Analyse de la qualité de l'eau via des organismes indicateurs
Vue d'ensemble
Source : Laboratoires du Dr Ian poivre et Dr Charles Gerba - Université de l’Arizona
Démonstration d’auteur : Luisa Ikner
Analyse de qualité de l’eau surveille les influences anthropiques tels que les polluants, les nutriments, pathogènes et autres éléments qui peuvent influer sur l’intégrité de l’eau comme une ressource. La contamination fécale contribue pathogènes microbiens qui menacent les plantes, animaux et la santé humaine avec ou à une maladie. La demande en eau croissante et strictes normes de qualité exigent que l’eau fournie pour les ressources humaines ou environnementales soit surveillé pour niveaux faiblement pathogène. Toutefois, suivi chaque pathogène lié à la pollution fécale n’est pas possible, car des techniques de laboratoire impliquent des coûts, temps et le vaste travail. Détection de micro-organismes indicateurs offre donc une technique simple, rapide et rentable pour surveiller les pathogènes associés à des conditions non hygiéniques.
Principles
Les indicateurs sont facilement détectables organismes dont la présence est corrélée directement à un ou plusieurs agents pathogènes, contamination de l’environnement. Pour être considéré comme un indicateur approprié, un organisme doit satisfaire les cinq suivant critère :
- L’organisme indicateur doit être présent quand l’agent pathogène est présent, et l’organisme indicateur doit être absent lorsque l’agent pathogène est absent.
- Concentration de l’organisme indicateur doit mettre en corrélation avec la concentration de l’agent pathogène. Toutefois, l’organisme indicateur devrait toujours être trouvé à un plus grand nombre.
- L’organisme indicateur devrait être capable de survivre plus facilement et plus longtemps dans l’environnement que l’agent pathogène.
- Détection de l’organisme indicateur devrait être facile, sûre et peu coûteuse.
- L’organisme indicateur devrait être efficace pour tous les types d’eau.
La plupart des indicateurs sont organismes entériques ou virus, qui sont généralement trouvés dans le sang mammifères et d’oiseaux gastro-intestinal systèmes chaud, donnant un accès direct à la contamination fécale. Cependant, de nombreux indicateurs peuvent manquer efficacité due à une mauvaise corrélation avec certains agents pathogènes. Deux des organismes bactériens indicateur plus largement acceptés sont Escherichia coli et les coliformes en raison de leurs liens fécales et aisance dans l’analyse en laboratoire.
Colilert est une approche de technologie (DST) de substrat défini pour la détection simultanée, l’identification spécifique et confirmation pour e. coli et coliformes totaux dans des échantillons d’eau. Cette technique de laboratoire utilise des nutriments de substrat spécifiques de voie métabolique des organismes de chaque indicateur, énumérer seulement les micro-organismes désirés, dégageant un signal lors de la bactérie modifie le composé. En présence d’un coliforme, nutriment (ONPG) ortho-nitrophényl-β-D-galactopyranoside est hydrolysé par l’enzyme β-galactosidase des coliformes. Le produit composé, ortho-nitrophényl, est un chromogène qui émet un signal de couleur, tournant l’eau jaune (Figure 1).
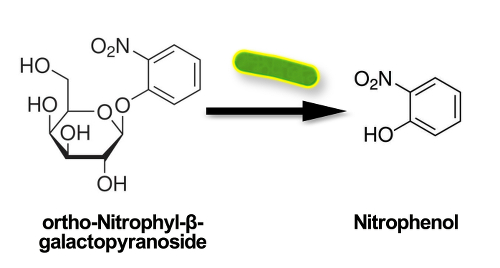
La figure 1. Schéma montrant les ortho-nitrophényl libérant un signal de couleur, tournant l’eau jaune.
En présence de e. coli, nutriment méthylumbelliféryl-β-D-glucuronide (MUG) est clivé par enzyme de la bactérie glucuronidase, la production d’un produit de méthylumbelliférone qui émet une fluorescence bleue-verte sous la lumière ultraviolette (Figure 2).
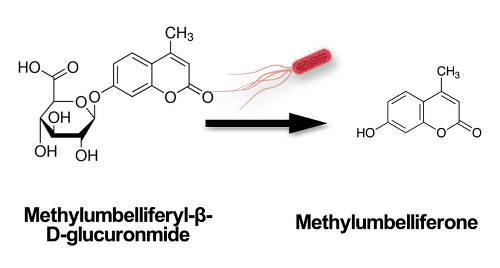
La figure 2. Schéma montrant le nutriment méthylumbelliféryl-β-D-glucuronide (MUG), clivé par l’enzyme glucuronidase de la bactérie, un produit de methylumberlliferone qui émet une fluorescence bleue-verte sous une lumière ultraviolette.
Colilert peut être effectuée comme test présence-absence (P-A) pour indiquer si oui ou non les organismes existent dans l’échantillon. Ce test est réalisé en dissolvant le substrat dans les échantillons d’eau de 100 mL, en incubation à 35 ± 0,5 ° C pendant 24 h et en observant les signaux de couleur. Présence des "indicateurs peut également être quantifié en utilisant un système qui détermine le nombre le plus probable (NPP) pour chaque organisme. Cette procédure consiste à dissoudre le substrat dans les échantillons d’eau de 100 mL qui sont scellés dans un bac contenant 49 grands puits et 48 petits puits. Le plateau est incubé à 35 ± 0,5 ° C pendant 24 h, et puis les puits contenant des changements de couleur positive sont comptés. Le ratio des grands aux petits puits contenant des signaux positifs est aligné sur le tableau NPP qui permet la quantification de la présence de chaque organisme indicateur présent. Règlement pour l’eau potable aux États-Unis exige que zéro coliformes sont présents dans 100 mL d’eau potable.
Procédure
1. Colilert présence-Absence (P – A) Test
- Ouvrez la bouteille Colilert en plastique de 100 mL. Le flacon contient une petite quantité de réactif en poudre qui est nécessaire pour les réactions appropriées, ne jetez pas cette poudre.
- Ajouter échantillon de 100 mL en bouteille Colilert.
- Ouvrir le tube d’oreiller contenant le substrat nutritif et versez le contenu dans l’échantillon d’eau à l’intérieur de la bouteille Colilert.
- Boucher et sceller la bouteille Colilert. Agiter le flacon énergiquement, à plusieurs reprises, inversant la bouteille jusqu'à ce que le substrat soit complètement dissout.
- Incuber le mélange témoin réactif/eau à l’intérieur de la bouteille à 35 ± 0,5 ° C pendant 24 h.
- Observez la couleur jaune changent dans le mélange réactif/eau de l’échantillon. La couleur jaune indique les coliformes est présent. L’eau claire ou aucun changement de couleur indique que les coliformes fécaux est absentes.
- Exposer l’échantillon/réactif à la lumière ultraviolette et observer la fluorescence bleue. Fluorescence bleue indique qu’e. coli est présente. Aucune fluorescence n’indique qu’e. coli est absent (Figure 3).

La figure 3. P-A test négatif (à gauche), coliforme positif (au milieu) et e. coli positif (à droite).
2. Colilert MPN : Quanti-tray 2000
- Ouvrir la bouteille Colilert et échantillon de 100 mL en bouteille Colilert.
- Ouvrir le tube d’oreiller contenant le substrat nutritif et versez le contenu dans l’échantillon d’eau à l’intérieur de la bouteille Colilert.
- Boucher et sceller la bouteille Colilert. Agiter le flacon énergiquement, à plusieurs reprises, inversant la bouteille jusqu'à ce que le substrat soit complètement dissout.
- Ouvrir soigneusement Quanti-tray 2000 en pressant les bords en haut de la barre d’État et en tirant vers l’arrière l’onglet papier garder pressant afin que le tiroir est ouvert.
- Verser le mélange réactif/eau de l’échantillon dans le bac et puis incuber l’échantillon à l’intérieur de la barre d’État à 35 ± 0,5 ° C pendant 24 h.
- Observez la couleur jaune changent dans le mélange réactif/eau de l’échantillon. Compter le nombre de petits et grands puits que le signal positif présence de coliformes fécaux. La couleur jaune indique les coliformes est présent. L’eau claire ou aucun changement de couleur indique que les coliformes fécaux est absentes.
- Exposer l’échantillon réactif/eau aux rayons ultraviolets et observer la fluorescence bleue. Compter le nombre de grands et petits puits qui signalent la présence positive pour e. coli. La fluorescence bleue indique qu’e. coli est présente. Aucune fluorescence n’indique qu’e. coli est absent.
- La fiche de Quanti-tray 2000 MPN (Figure 4) permet de quantifier la concentration pour chaque organisme indicateur présent dans 100 mL d’eau. Utilisez la feuille de calcul pour comparer grand : petit rapport bien positif pour énumérer la présence pour les deux organismes indicateurs.

La figure 4. Quanti-tray négatif (à gauche), coliforme positif (au milieu) et e. coli positif (à droite).
Applications et Résumé
Organismes indicateurs sont employés pour rapidement et à moindre coût déterminer la contamination de l’environnement. Colilert dosages sont utilisés pour analyser la qualité de l’eau pour boire, loisirs et les sources d’eaux usées. Qualité de l’eau doit respecter des normes juridiques fixées par l’Environmental Protection Agency (EPA) et les services réglementaires de l’État afin d’être accepté comme une ressource pour la consommation humaine et/ou environnementale.
Colilert dosages sont aussi stratégiquement utilisés comme marqueurs du bilan massique au sein de la recherche sur l’environnement, et ces données peuvent être analysées ainsi que d’autres tests environnementaux pour mesurer la corrélation entre les résultats. Effectuer un simple test Colilert p-a indique si un échantillon est contaminé, ce qui peut être analysé à côté des résultats de recherche. Si l’échantillon de P-A montre qu’il y a contamination dans l’eau, puis les échantillons d’eau utilisées dans la recherche peuvent aussi avoir de contamination qui mène à mal interprétés résultats, tandis que le NPP Quanti-tray fournit une quantification de base pour la contamination actuelle. Par exemple, les organismes indicateurs permet de corréler les quantifications de l’indicateur avec le nombre de pathogènes trouvés dans un échantillon d’eau. Si le quanti-tray énumère les chiffres de l’indicateur de faible, cela laisse supposer que l’échantillon d’eau devrait également rencontrer des tendances similaires avec des niveaux faiblement pathogène.
Tags
Passer à...
Vidéos de cette collection:

Now Playing
Analyse de la qualité de l'eau via des organismes indicateurs
Environmental Microbiology
29.6K Vues

Détermination de la teneur en humidité du sol
Environmental Microbiology
359.6K Vues

Technique aseptique en sciences de l'environnement
Environmental Microbiology
126.5K Vues

Coloration de Gram des bactéries provenant de sources environnementales
Environmental Microbiology
100.4K Vues

Visualisation des micro-organismes du sol grâce aux lames de contact et à la microscopie
Environmental Microbiology
42.4K Vues

Champignons filamenteux
Environmental Microbiology
57.4K Vues

Extraction d'ADN communautaire à partir de colonies bactériennes
Environmental Microbiology
28.9K Vues

Détection des micro-organismes environnementaux avec la réaction en chaîne par polymérase et l'électrophorèse sur gel
Environmental Microbiology
44.6K Vues

Analyse d'ARN d'échantillons environnementaux à l'aide de la RT-PCR
Environmental Microbiology
40.4K Vues

Quantification des micro-organismes et des virus environnementaux à l'aide de la qPCR
Environmental Microbiology
47.9K Vues

Isolement des bactéries fécales à partir des échantillons d'eau par filtration
Environmental Microbiology
39.4K Vues

Détection de bactériophages dans des échantillons environnementaux
Environmental Microbiology
40.8K Vues

Culture et dénombrement des bactéries dans un échantillon de sol
Environmental Microbiology
184.7K Vues

Analyse de la courbe de croissance bactérienne et ses applications environnementales
Environmental Microbiology
296.1K Vues

Dénombrement des algues via une méthodologie de culture
Environmental Microbiology
13.8K Vues