Method Article
Apikal Out İntestinal Organoidlerin Oluşumu ve EdU-Etiketleme Kullanılarak Organoid Proliferasyon Hızının Değerlendirilmesi
Bu Makalede
Özet
Burada, standart matris gömülü organoid kültürlerinden apikal bağırsak organoidleri oluşturmak için bir protokol açıklıyoruz. Ayrıca, EdU'nun daha sonra aktif olarak çoğalan hücrelere dahil edilmesini ve EdU-pozitif hücrelerin yarı otomatik olarak nicelleştirilmesini ana hatlarıyla belirtir.
Özet
Burada, hidrojel gömülü bağırsak organoid kültürlerinden apikal bağırsak organoidlerinin yüzen kültürlerinin oluşumunu açıklıyoruz. Aynı zamanda, apikal ve bazal çıkışlı organoidler arasında doğrudan karşılaştırma için yüzen bazal organoid kültürler oluşturulur. Apikal ve bazal çıkışlı organoidler daha sonra, hücre bölünmesinin S-fazı sırasında yeni sentezlenen DNA'ya entegre edilen timidin analoğu 5-etynil-2'-deoksiüridine (EdU) tabi tutulur. DNA'ya bu katılım, lazer taramalı konfokal mikroskopi kullanılarak morfolojik olarak bozulmamış organoidlerde görselleştirilebilir. Hoechst33342 ve EdU ile etiketlenmiş hücreler daha sonra görüntü analiz yazılımı kullanılarak yarı otomatik bir şekilde ölçülür. Toplam hücre sayısının EdU-pozitif hücrelerin yüzdesinin hesaplanması, üç boyutlu (3D) organoidlerde hücre proliferasyonunun analizine izin verir. Burada bağırsak organoidlerinde proliferasyonun analizi için kullanılmasına rağmen, protokol diğer organoidlerde veya iki boyutlu hücre kültürlerinde çeşitli türlerde çekirdeğe özgü boyamaların analizine de uygulanabilir.
Giriş
Bağırsak organoidleri, farklı hücre tiplerini içeren bağırsak epitelini özetleyen üç boyutlu in vitro modellerdir. Bu organoidler, bağırsak kriptlerinden izole edilen yetişkin kök hücrelerdenkolayca oluşturulabilir 1. Organoidler in vivo epitele çok daha yakın olduklarından, biyomedikal araştırmalarda giderek daha önemli hale gelmektedirler. Bağırsak organoidleri sadece fizyolojik mekanizmaların analizi için değil (örneğin, bağırsak niş sinyali 2,3 ve hücre farklılaşması 4,5) için değil, aynı zamanda bulaşıcı hastalıklar 6,7 üzerine araştırmalar için de kullanılır. Bununla birlikte, apikal hücre yüzeyine organoid lümen içinde erişilemez hale geldiğinden, merkezi bir lümeni çevreleyen 3D polarize hücrelerin büyümesi zordur. Apikal ve bazolateral hücre yüzeyleri arasındaki farklılıkların incelenmesi, yağ asidi alımındakifarklılıklar 8 ve bulaşıcı hastalık araştırmaları 9,10,11,12 ile örneklendiği gibi metabolik çalışmalarda önemli olabilir.
Apikal organoidlerin üretilmesi, bu sorunun üstesinden gelmek için kolay bir seçenektir. Hücre dışı matrisi standart organoid kültürlerden (yani, bazal çıkışlı, matrise gömülü organoidler) çıkararak ve bu organoidleri matris içermeyen bir ortamda tohumlayarak, bir polarite anahtarı indüklenebilir9.
Daha önce yayınladığımız gibi, organoidlerin çoğu polaritelerini 12 saat içinde tersine çevirir. Bununla birlikte,% 90'dan fazla apikal organoid içeren bir kültür elde etmek 48-72 saat sürer. Apikal hücre yüzeyine erişim sağlama avantajlarına rağmen, apikal organoidler, polaritenin tersine çevrilmesinden sonra önemli ölçüde azalmış proliferasyon gösterirken, hücre ölümü oranları artar13. Proliferatif aktivite faktörü, çeşitli analizlerde kafa karıştırıcı bir değişkeni temsil edebilir ve bir deney tasarlanırken akılda tutulmalıdır.
Burada, aşağı akış analizleri için bağırsak apikal çıkış organoid kültürleri ve yüzer bazal çıkış kontrol organoidleri oluşturmak için ayrıntılı bir protokol sunuyoruz. Ayrıca, yeni sentezlenen DNA'ya dahil edilen ve böylece aktif olarak çoğalan hücreleri işaretleyen 5-etinil-2'-deoksiüridin (EdU) ile etiketlemeyi tarif ediyoruz. EdU + hücrelerinin nicelleştirilmesi ile arivis Pro (Zeiss) yazılımını kullanarak organoidlerin çoğalma hızının yarı otomatik görüntü analizini daha ayrıntılı olarak açıklıyoruz. Sürecin bir şeması Şekil 1'de özetlenmiştir.
Protokol
Kramer ve ark., 202014'e göre kurulan köpeklerden elde edilen yetişkin kök hücre kaynaklı bağırsak organoidleri kullanıldı. Kurumsal etik kurul yönergelerine dayanarak, terapötik eksizyon veya otopsi sırasında toplanan doku materyalinin kullanımı, tüm hasta sahipleri tarafından imzalanmış olan üniversitenin 'tedavi için sahip onayı'na dahil edilmiştir.
1. Organoid kültürü
- Tercih edilen bazal membran özütü (BME) matrisine gömülü yetişkin kök hücre türevli bağırsak organoidlerini 24 oyuklu plakalarda kültürleyin ve bunları Pleguezuelos ve diğerleri, 202015'te ayrıntılı olarak açıklandığı gibi cam pipetler kullanarak mekanik olarak bölün.
NOT: Burada açıklanan protokol için BME olarak Geltrex kullanılmıştır. - Rafine edilmiş ortamı (Tablo 1) BME'ye gömülü organoidlerden dikkatlice çıkarın.
- Kuyucuk başına 500 μL %0,05 tripsin-EDTA ekleyin ve tekrar tekrar yukarı ve aşağı pipetleyerek tüm matris kubbelerini kuyudan ayırın. Organoidleri 15 mL'lik bir tüpe aktarın ve hidrojel matrisini tamamen ayırmak için iyice yeniden süspanse edin.
- Organoidleri% 0.05 tripsin-EDTA ile 37 ° C'de bir su banyosunda, tüm organoidler tek hücrelere veya küçük hücre kümelerine ayrışana kadar inkübe edin.
- Tripsin / hücre süspansiyonunu bazal ortam ile seyreltin (Tablo 1). Tripsin'den en az iki kat daha fazla bazal ortam kullanın.
- Hücreleri 8 °C'de 420 × g'da 5 dakika santrifüjleyin. Mümkün olduğu kadar çok süpernatanı çıkarın.
- Adım 1.3'te tripsinizasyon için kullanılan kadar çok oyukta BME'ye gömülü tohum hücreleri. ve onlara rafine ortam sağlayın (Tablo 1).
- Hücreleri bir hücre kültürü inkübatöründe 3 gün boyunca inkübe edin ve adım 2.1 ile devam edin.
2. Polaritenin tersine çevrilmesi ve EdU etiketlemesinin indüksiyonu
- Ortamı BME'ye gömülü organoidlerden dikkatlice çıkarın.
- Her kuyucuğa 500 μL organoid hasat çözeltisi ekleyin ve tekrar tekrar yukarı ve aşağı pipetleyerek tüm matris kubbelerini kuyudan ayırın. Organoidleri 15 mL'lik bir tüpe aktarın ve hidrojel matrisini tamamen ayırmak için iyice yeniden süspanse edin.
- 15 mL'lik tüpü buz üzerinde 1,5 saat inkübe edin. Organoidlerin topaklanmasını önlemek ve kalan hidrojel bileşenlerinin eşit şekilde ayrışmasını sağlamak için tüpü her 10 dakikada bir iyice çalkalayın.
- İnkübasyon sırasında, 96 oyuklu bir plakayı yapışma önleyici solüsyon ile kaplayın. Adım 1.3.'te tripsinizlenmiş 24 oyuklu bir plakanın her bir oyuğu için, 96 oyuklu bir plakanın 8 oyuğu kaplayın. Oda sıcaklığında (RT) en az 1 saat inkübe edin.
- 15 mL'lik tüpe organoid hasat çözeltisinin kullanıldığının en az iki katı kadar PBS ekleyin ve 8 ° C'de 150 × g'da 5 dakika boyunca santrifüjleyin.
- Süpernatanı çıkarın ve organoidleri 1 mL PBS'de yeniden süspanse edin.
- 500 μL organoid / PBS süspansiyonunu ayrı bir 15 mL tüpe aktarın ve her iki tüpü 5 dakika boyunca 150 × g'da 8 ° C'de tekrar santrifüjleyin.
- 96 oyuklu plakadan tüm yapışma önleyici solüsyonu çıkarın.
- Santrifüjlemeden sonra mümkün olduğunca fazla süpernatanı çıkarın.
- Yüzen bazal çıkışlı (BO) organoidlerin üretilmesi için tüplerden birini ve apikal çıkışlı (AO) organoidler için diğer tüpü kullanın.
- BO organoidleri için, bir tüpe 96 oyuklu plakanın oyuğu başına% 7.5 BME içeren 100 μL rafine ortam ekleyin. İyice karıştırın ve organoidleri önceden kaplanmış 96 oyuklu plakanın istenen sayıda oyuğuna eşit olarak dağıtın.
- AO organoidleri için, diğer tüpe 96 oyuklu plakanın oyuğu başına 100 μL düz rafine ortam (herhangi bir BME eklenmeden) ekleyin. İyice karıştırın ve organoidleri önceden kaplanmış 96 oyuklu plakanın istenen sayıda oyuğuna eşit olarak dağıtın.
- Organoidleri 37 ° C ve% 5 CO2'de 3 gün boyunca inkübe edin.
NOT: Morfolojik farklılıklar 1. günden sonra gözle görülür hale gelmeye başlayacaktır. Bununla birlikte, daha önce yayınlanan sonuçlar, organoidlerin büyük çoğunluğunun apikal polarite13 göstermesinin yaklaşık 3 gün sürdüğünü göstermektedir. - Tanımlanmış zaman noktalarında, örneğin, polaritenin tersine çevrilmesinin indüksiyonundan 24 saat / 48 saat / 72 saat, etiketlenecek tüm organoid oyuklarına rafine ortamda seyreltilmiş 50 μL 3 μM EdU ekleyin, her bir oyukta 1 μM EdU'luk bir nihai konsantrasyon elde etmek için.
- 37 ° C'de ve% 5 CO2'de 1,5 saat inkübe edin.
- Geniş delikli uçlar kullanarak EdU etiketli organoidleri toplayın ve bunları 15 mL'lik bir tüpe aktarın.
- Her tüpe eşit miktarda %4 PFA ekleyin (BO ve AO organoidleri; nihai PFA konsantrasyonu =% 2) ve dikkatlice karıştırın.
- RT'de 15 dakika inkübe edin.
- 15 mL'lik tüpte hacim olduğu için PBS miktarının en az iki katını ekleyin ve 8 °C'de 80 × g'da 5 dakika santrifüjleyin.
- Süpernatanı çıkarın ve organoidleri 1 mL PBS'de yeniden süspanse edin.
- 8 °C'de 80 × g'da 5 dakika boyunca tekrar santrifüjleyin.
- Süpernatanı çıkarın, organoidleri 1 mL PBS'de yeniden süspanse edin ve bunları 1.5 mL'lik bir tüpe aktarın. EdU boyama reaksiyonunu gerçekleştirene kadar organoidleri 4 °C'de saklayın (bkz. bölüm 3).
- Analiz edilecek her zaman noktası için 2.14-2.22 adımlarını tekrarlayın.
3. Click-it EdU boyama reaksiyonu ve Hoechst 33342 boyama
- Sabit organoidleri (adım 2.22'den itibaren) 1.5 mL'lik bir tüpte 4 ° C'de 50 × g'da 5 dakika boyunca santrifüjleyin.
- Süpernatanı çıkarın ve geniş delikli uçlar kullanılarak PBS'de seyreltilmiş 1 mL% 3 sığır serum albümininde (BSA) organoidleri yeniden süspanse edin.
- 3.1 adımlarını tekrarlayın. ve 3.2 (yıkama adımları).
- Süpernatanı çıkarın ve organoidleri PBS'de seyreltilmiş 1 mL% 0.5 Triton X-100'de yeniden süspanse edin.
- RT'de 20 dakika inkübe edin.
- Organoidleri RT'de 50 × g'da 5 dakika santrifüjleyin.
- Taze bir tüpte, 45 μL H2O ile 5 μL 10x Tampon Katkı Maddesini karıştırarak 1x Tampon Katkı Maddesi hazırlayın.
- Başka bir tüpte, aşağıdaki bileşenleri karıştırarak Reaksiyon Kokteylini hazırlayın: 385.8 μL H2O, 43 μL 10x Reaksiyon Tamponu, 20 μL CuSO4, 1.2 μL Alexa Fluor 647 azid ve 50 μL o 1x Tampon Katkı Maddesi (adım 3.7'den itibaren).
NOT: Bu karışım beş reaksiyon için yeterlidir ve gerekli boyama reaksiyonu sayısına göre yukarı ve aşağı ölçeklendirilebilir. - 3.1 adımlarını tekrarlayın. ve 3.2. iki kez (yıkama adımları).
- Süpernatanı çıkarın ve organoidlerle her tüpe 100 μL Reaksiyon Kokteyli (adım 3.8.) ekleyin.
- Karanlıkta 30 dakika boyunca RT'de kuluçkaya yatırın.
- 3.1 adımlarını tekrarlayın. ve 3.2 (yıkama adımları).
- Organoidleri RT'de 5 dakika boyunca 5 × g'da santrifüjleyin.
- PBS'de seyreltilmiş organoidleri 1 mL 10 μg / mL Hoechst33342'de yeniden süspanse edin.
- Karanlıkta 45 dakika boyunca RT'de kuluçkaya yatırın.
- 3.1 adımlarını tekrarlayın. ve 3.2 (yıkama adımları).
- Organoidleri 50 × g'da 4 ° C'de 5 dakika santrifüjleyin.
- Tercih edilen BME matrisindeki tohum organoidleri, konfokal mikroskopi ile uyumlu bir slayta dönüştürün (örneğin, μ-Slayt 18 kuyusu)
- Konfokal mikroskop altında görüntü organoidleri.
4. Yarı otomatik görüntü analizi
NOT: Bu analiz için arivis Pro sürüm 4.2.2 (görüntü analiz yazılımı) kullanılmıştır.
- Konfokal mikroskop görüntülerini görüntü analiz yazılımına aktarın ve analiz dosyasının kaydedileceği bir klasör tanımlayın. Birden fazla görüntüyü içe aktarmak için Zaman Noktaları Olarak Görüntüler seçeneğini kullanın (resimleri çoğaltın, farklı zaman noktaları, farklı tedaviler vb.). Daha sonra her görüntü tek bir zaman noktası olarak ele alınacak ve tek tek görüntüler arasında kolay geçiş sağlanacaktır.
- Analiz panelini açın ve Ek Dosya 1 (arivis_EdU_pipeline) olarak sağlanan analiz işlem hattını içe aktarın.
- İyi ayrılmış tüm organoidleri kolayca çevrelemek için Yeni Nesneler Yerleştir aracını ve Organoid etiketli Küre'yi kullanın.
- Bir sonraki görüntüye, yani bir sonraki zaman noktasına geçin ve tüm görüntüler için organoidleri işaretlemeye devam edin.
- Birbirine çok yakın olan ve bu nedenle Küre modu kullanılarak ayrılamayan organoidler için nesne listesini açın ve Organoid etiketini etkinleştirin.
- Organoid anahatları elle işaretlemek için Çokgen modunda Nesne Çiz aracını kullanmaya devam edin.
NOT: Nesne listesinde, tüm organoidler artık işaretlenmiş ve belirli bir zaman noktasına atanmıştır. Bu zaman noktası, adım 4.1'de içe aktarılan görüntülerin sırasına karşılık gelir. Bu zaman noktaları, tercih edilirse artık orijinal görüntü adıyla eşleşecek şekilde yeniden adlandırılabilir. - Nesne listesinde, tüm nesneleri (=organoidler) işaretleyin ve sağ tıklayın, ardından Manuel etiketini tüm nesnelerden kaldırmak için Etiketleri Kaldır'ı tıklayın.
- Nesne listesindeki Organoid etiketini devre dışı bırakın ve Çokgen modunda Nesne Çiz aracını kullanarak analizden çıkarılması gereken önceden tanımlanmış nesneler içindeki tüm alanları işaretleyin. Bu alanlar, organoid lümen içindeki ölü hücreleri veya analizi çarpıtabilecek bulanık alanları içerebilir.
- Nesne listesini açarken, tüm organoidlerin Organoid etiketiyle listelendiğinden ve hariç tutulması gereken tüm alanların Manuel etiketine sahip olduğundan emin olun.
- Sol üst paneldeki oka tıklayarak analiz işlem hattını başlatın.
NOT: Yazılım artık Hoechst33342 ve EdU kanallarındaki tüm çekirdekleri bölümlere ayırmaktadır. Bu analiz hattı, büyük olasılıkla ölü hücrelerden kaynaklanan küçük çekirdeklerin analizden çıkarılmasını sağlamak için yalnızca 15 μm2'den büyük segmentli Hoechst33342+ ve EdU+ çekirdeklerini (yani çekirdek segmentindeki alan) dikkate alır. - Özellik Sütunları etiketini tıklatarak nesne listesinde analizin sonuçlarını bulun.
- Ana Ayrıntı Görünümü'ne geçin ve üst paneldeki Organoidler etiketini ve İlk Zaman Noktası özelliğini seçin.
- Alt panelde, her organoid için görüntülenecek özellikleri seçin. Projeksiyon (x/y/z) Alanı (voksel), Ortalama yoğunluk # 1 (EdU kanalı) ve SD Yoğunlukları #1'i kullanın.
- Excel Dışa Aktarma işlevini kullanarak sonuçları (Ana Ayrıntı Raporu) dışa aktarın.
- Analiz dosyasını kaydedin ve yazılımı kapatın.
5. Organoid proliferasyon hızlarının belirlenmesi
- Adım 4.14'te dışa aktarılan Ana Ayrıntı Raporu dosyasını açın.
- Analiz edilen her görüntü için ayrı bir sekme vardır. Her görüntü için çekirdekler ve EdU boyası için alan/voksel toplamını hesaplayın. Ardından, elde edilen tüm verileri yeni bir toplu sekmeye kopyalayın ve aynı zaman noktasına başvuran tüm verileri gruplandırın.
- Ardından, her görüntü için hücre çekirdeğinin toplam alanını (yani, Hoechst33342+ alanı ve EdU+ alanının toplamı) hesaplayın.
- Daha sonra, toplam alanı kendisine (= %100) ve ortalama EdU+ alanını toplam alana (=EdU+ DNA yüzdesi) bölün.
- Y ekseninde BO ve AO organoidlerinin proliferatif DNA yüzdesini ve x ekseninde farklı zaman noktalarını çizin.
Sonuçlar
Tripsinizasyondan sonra 3 gün boyunca yetiştirilen organoidler, Şekil 2A'da gösterildiği gibi ideal olarak 50-250 μm arasında olmalıdır. Bundan önemli ölçüde daha büyük olan organoidler, polaritelerini verimli bir şekilde tersine çeviremeyebilir. Daha büyük organoidler de tomurcuklanmaya başlayabilir ve bu organoidlerin de verimli polaritenin tersine çevrilmesiyle ilgili sorunları olabileceğini fark ettik. Bazal ve apikal out organoidler, parlak alan görüntülemede zaten belirgin morfolojik farklılıklar göstermektedir. Bazal çıkışlı organoidler, 3 günlük süspansiyon kültüründen sonra büyük lümenlerini (Şekil 2B) korurken, apikal çıkışlı organoidler (Şekil 2C) daha kompakt görünmektedir. Apikal süspansiyon kültürlerinin çok spesifik bir özelliği, organoidlerin etrafında yüzen ölü hücrelerin sayısıdır. Bunun nedeni, apikal organoidlerin terminal olarak farklılaşmış ve ölü hücreleri çevreleyen ortama ekstrüde etmesi, bazal organoidlerin ise organoid lümende ölü hücreleri biriktirmesidir.
Hücre bölünmesinden önce EdU'yu yeni sentezlenen DNA'larına dahil eden bağırsak organoidleri, konfokal bir mikroskop kullanılarak görüntülenebilir. Bazal çıkışlı organoidler, zaman içinde apikal çıkışlı muadillerine göre çok daha yüksek EdU sinyalleri gösterir (Şekil 3). Boyut olarak büyümesine rağmen tüm organoidlerin EdU+ hücreleri göstermediğine dikkat etmek önemlidir. Bunun nedeni, spesifik görüntüleme katmanında hiçbir EdU+ hücresinin bulunmamasıdır.
Bu konfokal görüntüler, görüntü analiz yazılımı ve sağlanan analiz hattı kullanılarak kantitatif olarak analiz edilebilir (Ek Dosya 1). Analiz protokolü gerçekleştirilirken, organoidler önce çevrelenmelidir (Şekil 4A), daha sonra belirli alanları gerçek analizden hariç tutmalıdır (Şekil 4B). Bu dışlama alanları, EdU sinyallerinin nicelleştirilmesi için ilgi çekici olmayan organoid lümen içindeki ölü hücrelere atıfta bulunabilir. Otomatik analiz boru hattının müteakip yürütülmesi, Hoechst33342+ ve EdU+ çekirdekleri arasında ayrım yaparak tespit edilen tüm çekirdeklerin segmentasyonuna yol açar. Ek olarak, 15μm2'lik bir kesimin altındaki tüm çekirdekler, büyük olasılıkla ölü hücreler veya bu görüntü katmanında tam olarak gösterilmeyen çekirdekler olduğu için hariç tutulur (Şekil 4C).
Yazılım kullanılarak görüntü analizinden ve niceleme ölçümlerinin dışa aktarılmasından sonra, bu veriler, DNA'nın toplam kütlesinden EdU + sinyalinin yüzdesini analiz etmek için daha fazla hesaplanır (Şekil 5). Bu yazıda sunulan durumda, apikal bağırsak organoidleri, yüzen bazal organoidlere kıyasla büyük ölçüde azalmış proliferasyon seviyeleri göstermektedir.

Şekil 1: Açıklanan protokolün şematik genel bakışı. Şematik, organoidlerin yetiştirilmesini, polaritenin tersine çevrilmesinin indüksiyonunu, EdU etiketlemesini ve yarı otomatik görüntü analizini içerir. Biorender.com ile oluşturulan figür. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
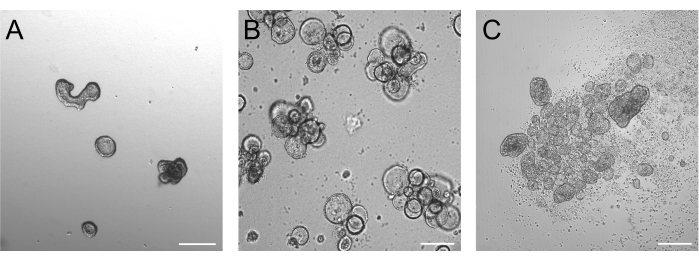
Şekil 2: Polaritenin tersine çevrilmesinin indüksiyonundan önce ve sonra organoidler. (A) Tripsinizlenmiş hücrelerin bir büyüme ortamında tohumlanmasından üç gün sonra matrise gömülü bağırsak organoidleri. (B) Süspansiyon kültüründe tohumlamadan üç gün sonra yüzen bazal organoidler. (C) Polaritenin tersine çevrilmesinin indüksiyonu için BME'siz süspansiyon kültüründe tohumlamadan 3 gün sonra apikal organoidler. Ölçek çubuğu = 200 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
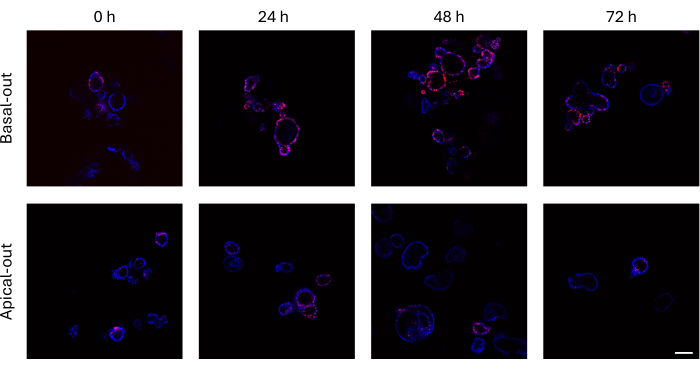
Şekil 3: EdU ile etiketlenmiş bazal ve apikal çıkış bağırsak organoidleri. Zaman içinde bazal organoidlerin konfokal görüntülerini gösteren üst panel, aynı zaman noktalarında apikal organoidlere (alt panel) kıyasla çok daha fazla EdU+ hücresi sunar. Ölçek çubuğu = 100 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4: EdU ile boyanmış bağırsak organoidlerinin kantitatif görüntü analizi. (A) Küre ve Çokgen modlarını kullanarak çevrelenmiş organoidler. (B) Analizden çıkarılacak alan beyaz renkle işaretlenmiştir (okla gösterilir). Bu alan, sonraki analizden çıkarılacak olan bir dizi ölü hücre içeren organoid lümeni işaretler. (C) Analizden sonraki görüntü, tüm segmentli çekirdekleri gösterir. Hoechst33342 + çekirdekleri camgöbeği, EdU+ çekirdekleri sarı ve 15μm2'ye ulaşmayan çekirdekler yeşil (Hoechst33342) ve turuncu (EdU) ile işaretlenmiştir. Ölçek çubuğu = 50 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 5: Organoid proliferasyon hızı. Apikal organoidlere kıyasla bazal organoidlerde daha yüksek proliferasyon gösteren organoid proliferasyon hızı için bir vekil görevi gören toplam DNA'nın EdU + DNA'sının yüzdesi. Veriler ortalama SEM olarak sunulur. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Bazal ortam | |
| Ortam bileşenleri | Son konsantrasyon |
| DMEM-F12 Serisi | |
| Medya için 100X Penisilin-Streptomisin takviyesi | 1 katı |
| GlutaMAX Takviyesi | 2 milyon |
| HEPES Tampon Çözeltisi 1 M, sıvı | 10 milyon |
| Rafine orta | |
| B27 SerumFree Takviye Edici Gıda (50x), sıvı | 1 katı |
| N-Asetil-L-sistein, hücre kültürü test edildi | 1 milyon |
| [Leu15]-Gastrin I insan | 10 nM |
| Bir 83-01 | 500 deniz mili |
| İnsan HGF | 50 ng/mL |
| İnsan NOGGIN (Memeli) | 100 ng/mL |
| İnsan IGF-I | 100 ng/mL |
| İnsan FGF-temel | 50 ng/mL |
| R-Spondin şartlandırılmış ortam | 10 % (h/h) |
| Wnt-3a şartlandırılmış ortam | 50 % (h/h) |
| Bazal ortam | Yukarıda belirtilen büyüme faktörlerinin / şartlandırılmış ortamın seyreltilmesi için kalan hacim |
Tablo 1: Bazal ve rafine ortam bileşimi.
Tartışmalar
Bu protokol, standart yetişkin kök hücre kaynaklı bağırsak organoid kültürlerinde polaritenin tersine çevrilmesinin nasıl indükleneceğini ayrıntılı olarak açıklamaktadır. Apikal organoidler, genellikle organoid lümene doğru yönlendirilen apikal hücre yüzeyine erişim sağlama amacına hizmet eder. Apikal yüzeyi inceleyebilmek, hücre zarının in vivo fizyolojik koşullar altında tüm sindirim sistemi içeriğine maruz kalan kısmı olduğu için bazı uygulamalar için çok önemli olabilir. Apikal yüzeyi spesifik olarak zorlamak için diğer yöntemler mikroenjeksiyon16, organoid türevli tek tabakaların17 kullanımı ve organoid parçalanması18'dir. Bununla birlikte, bu yöntemlerin her birinin, biz ve diğerleri daha önce daha ayrıntılı olarak incelediğimiz gibi, belirli dezavantajları ve dezavantajları vardır19,20.
Apikal organoidler üretme yönteminin çeşitli avantajları vardır: 1) Apikal organoidlerin üretilmesi, diğer yöntemlere kıyasla nispeten kolaydır ve herhangi bir özel enstrümantasyon veya ekipman gerektirmez. Bu nedenle, apikal organoidler, apikal hücre yüzeyine erişmenin uygun maliyetli bir yoludur; 2) yüzen bazal çıkışlı organoidler paralel olarak kültürlenebilir ve özellikle polariteye özgü etkileri analiz etmek için anlamlı kontrol organoidleri olarak kullanılabilir; 3) yüzen BO ve AO organoidleri, bu raporda EdU'nun dahil edilmesiyle örneklendiği gibi standart aşağı akış uygulamalarına tabi tutulabilir, aynı zamanda immüno(histo)kimyasal boyamanın yanı sıra daha önce bildirildiği gibi lüminesans ve floresan bazlı tahlillere tabi tutulabilir13 ve doğrudan canlı hücre görüntüleme12. EdU dahil etme veya immüno(histo)kimyasal boyamaların analizi gibi aşağı akış analizleri, organoidler daha fazla kullanıma kadar 4 °C'de saklanabildiğinden, zaman açısından bir miktar esneklik sağlar.
Polaritenin tersine çevrilmesinin kolaylığına rağmen, protokolümüzde bu yöntemi uygularken dikkate alınması gereken bazı kritik noktalar vardır. İlk olarak, adım 2.1'de kullanılan organoidler. belirli bir büyüklükte olmalıdır. Deneyimlerimize göre, tripsinizasyondan 3 gün sonra organoidlerin kullanılması iyi sonuç verir. Bununla birlikte, bu süre, hücre çoğalmasındaki farklılıklar nedeniyle veya tek hücreli kümelerin tohumlama yoğunluğuna bağlı olarak diğer hayvanların organoidlerine göre değişebilir. Ayrıca, organoid hasat çözeltisi kullanılarak BME'nin ayrışması artımlıdır. Co ve ark., 20199 tarafından tanımlandığı gibi, %2.5 kadar düşük BME konsantrasyonları, organoidleri süspansiyon kültüründe bazal bir morfolojide tutmak için yeterli olabilir. Bu nedenle, polaritenin verimli bir şekilde tersine çevrilmesini sağlamak için mümkün olduğunca fazla BME çıkarılmalıdır. Bir diğer önemli nokta ise süspansiyon kültürü sırasında organoid tutunmayı en aza indirmek için işlem görmemiş doku kültürü plaklarının doğru kullanılmasıdır. Deneyimlerimize göre, Yapışma Önleyici Solüsyon (adım 2.4.) ile ön kaplama plakaları, apikal organoidlerin kültürü için hemen hemen her plakanın kullanılmasını sağlar. Bununla birlikte, ön kaplama plakalarını gereksiz hale getiren diğer seçenekler araştırılabilir.
Polarize epitel hücrelerinin apikal hücre yüzeyinin yanı sıra bazolateral ve apikal hücre yüzeyi üzerindeki etkilerin değerlendirilmesinin önemi birçok durumda belirgin hale gelir. Örneğin, daha önce anaerobik bakteri Clostridioides difficile'nin toksinlerinin BO ve AO organoidleri üzerindeki etkilerini analiz etmiştik. Bu çalışmanın sonuçları, C. difficile toksin B'nin (TcdB) sadece ince bağırsağın BO organoidlerinde bağırsak epitel bariyeri bütünlüğüne zarar verdiğini, AO organoidlerinde zarar vermediğini göstermektedir. Çeşitli patojenik mikroorganizmaların alana özgü reaksiyonlarını gösteren diğer birkaç rapor, epitel hücrelerininher iki tarafının değerlendirilmesinin önemini vurgulamaktadır 9,16,21,22,23,24,25.
Apikal organoidlerin en büyük dezavantajı, hücre proliferasyonu ile ilgili değişen davranışlarıdır. Yukarıda tarif edildiği gibi, AO organoidleri, BO muadillerine kıyasla büyük ölçüde azaltılmış hücre proliferasyon oranları gösterir. Bu proliferasyon eksikliğinin, hücre ölümünün biraz artmasıyla el ele gittiğini daha önce bildirmiştik13. Sonuç olarak, bu, AO organoid ömrünü uzatmanın bir yolu bulunmadıkça, uzun vadeli bir AO organoid kültürüne izin vermez. Bununla birlikte, AO organoidlerinin, araştırmacıların azalmış hücre proliferasyonundan etkilenebilecek sonuçlara dikkat ettikleri sürece, apikal hücre yüzeyine kolayca erişmek için oldukça yararlı bir araç olduğunu düşünüyoruz.
Açıklamalar
Yazarlar herhangi bir çıkar çatışması beyan etmemektedir.
Teşekkürler
Bu araştırma, VetImaging Core Facility'nin (VetCore, Vetmeduni, Avusturya) kaynakları kullanılarak desteklenmiştir. Yarı kantitatif görüntü analizine verdiği destek için Ursula Reichart'a teşekkür etmek istiyoruz. GC, Avusturya Bilimler Akademisi'nin (ÖAW) Vetmeduni'deki Küçük Hayvan İç Hastalıkları Bölümü'nde DOC bursunun (hibe numarası 26349) bir alıcısıdır.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 24 well plates | Biologix | 07-6024 | |
| [Leu15]-Gastrin I human, ≥95% (HPLC) | Sigma-Aldrich | G-9145 | |
| µ-Slide 18 Well Glass Bottom | ibidi | 81817 | |
| 100X Penicillin-Streptomycin supplement for Media | Gibco/Thermo | 15140122 | |
| A 83-01 | Tocris Bioscience | 2939/10 | |
| Anti-Adherence Rinsing Solution | StemCell Technologies | 7010 | |
| arivis Pro | Zeiss | Version 4.2.2 | |
| B27 SerumFree Supplement (50X), liquid | Gibco/Thermo | 17504044 | |
| Bisbenzimide H 33342 (Hoechst 33342) | Abcam | ab145597 | |
| Bovine Serum Albumin | Sigma-Aldrich | A7906-100G | |
| Click-iT EdU Cell Proliferation Kit for Imaging, Alexa Fluor 647 dye | Thermo Scientific | C10340 | |
| DMEM-F12 | Gibco/Thermo | 11320033 | |
| Geltrex | Gibco/Thermo | A1413202 | |
| GlutaMAX Supplement | Gibco/Thermo | 35050061 | |
| HEPES Buffer Solution 1 M, liquid | Gibco/Thermo | 15630056 | |
| Human FGF-basic | PeproTech | 100-18B-100µG | |
| Human HGF | PeproTech | 100-39-100µG | |
| Human IGF-I | PeproTech | 100-11-100µG | |
| Human NOGGIN (Mammalian) | PeproTech | 120-10C-200µG | |
| N-Acetyl-L-cysteine,cell culture tested, BioReagent | Sigma-Aldrich | A9165-5G | |
| Organoid Harvesting Solution | Thermo | C10340 | |
| Triton(TM) X-100,for molecular biology | Sigma-Aldrich | T8787-250ML | |
| Trypsin-EDTA (0.05%), phenol red | Gibco/Thermo | 25300054 |
Referanslar
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459, 262-265 (2009).
- Li, Y., et al. BMP suppresses Wnt signaling via the Bcl11b-regulated NuRD complex to maintain intestinal stem cells. EMBO J. 43 (23), 6032-6051 (2024).
- Gaowa, A., Leangpanich, S., Park, E. J., Kawamoto, E., Shimaoka, M. Irisin promotes intestinal epithelial cell proliferation via Wnt/β-catenin and focal adhesion kinase signaling pathways. Sci Rep. 14, 25702 (2024).
- Basak, O., et al. Induced quiescence of Lgr5+ stem cells in intestinal organoids enables differentiation of hormone-producing enteroendocrine cells. Cell Stem Cell. 20 (2), 177-190 (2017).
- Ludikhuize, M. C., et al. Mitochondria define intestinal stem cell differentiation downstream of a FOXO/Notch axis. Cell Metab. 32 (5), 889-900.e7 (2020).
- Ettayebi, K., et al. Replication of human noroviruses in stem cell-derived human enteroids. Science (1979). 353 (6306), 1387-1393 (2016).
- Zhou, J., et al. Infection of bat and human intestinal organoids by SARS-CoV-2. Nat Med. 26 (7), 1077-1083 (2020).
- Joo, S. -. S., et al. Porcine intestinal apical-out organoid model for gut function study. Animals. 12 (3), 372 (2022).
- Co, J. Y., et al. Controlling epithelial polarity: A human enteroid model for host-pathogen interactions. Cell Rep. 26, 2509-2520.e4 (2019).
- Sasaki, N., et al. Development of a scalable coculture system for gut anaerobes and human colon epithelium. Gastroenterology. 159 (1), 388-390.e5 (2020).
- Mayorgas, A., et al. A novel strategy to study the invasive capability of adherent-invasive escherichia coli by using human primary organoid-derived epithelial monolayers. Front Immunol. 12, 646906 (2021).
- Csukovich, G., et al. Neutralising effects of different antibodies on clostridioides difficile toxins TcdA and TcdB in a translational approach. Int J Mol Sci. 24 (4), 3867 (2023).
- Csukovich, G., et al. Polarity reversal of canine intestinal organoids reduces proliferation and increases cell death. Cell Prolif. 57 (2), e13544 (2023).
- Kramer, N., et al. Generation of differentiating and long-living intestinal organoids reflecting the cellular diversity of canine intestine. Cells. 9 (4), 822 (2020).
- Pleguezuelos-Manzano, C., et al. Establishment and culture of human intestinal organoids derived from adult stem cells. Curr Protoc Immunol. 130 (1), e106 (2020).
- Dutta, D., Heo, I., O'Connor, R. Studying infection in 3D tissue-derived human organoid culture systems by microinjection. J Vis Exp. (151), e59610 (2019).
- Kumar, A., et al. Decreased SLC26A3 expression and function in intestinal epithelial cells in response to Cryptosporidium parvum infection. Am J Physiol Cell Physiol. 317 (6), C1205-C1212 (2019).
- Dutta, D., Clevers, H. Organoid culture systems to study host-pathogen interactions. Curr Opin Immunol. 48, 15-22 (2017).
- Csukovich, G., Pratscher, B., Burgener, I. A. The world of organoids: Gastrointestinal disease modelling in the age of 3R and one health with specific relevance to dogs and cats. Animals. 12 (18), 2461 (2022).
- Han, X., et al. Creating a more perfect union: Modeling intestinal bacteria-epithelial interactions using organoids. Cell Mol Gastroenterol Hepatol. 12 (2), 769-782 (2021).
- Li, Y., et al. Next-generation porcine intestinal organoids: an apical-out organoid model for swine enteric virus infection and immune response investigations. J Virol. 94 (21), e01006-e01020 (2020).
- Smith, D., et al. The development of ovine gastric and intestinal organoids for studying ruminant host-pathogen interactions. Front Cell Infect Microbiol. 11, 733811 (2021).
- Nash, T. J., Morris, K. M., Mabbott, N. A., Vervelde, L. Inside-out chicken enteroids with leukocyte component as a model to study host-pathogen interactions. Commun Biol. 4 (1), 377 (2021).
- Hanson, K. I., Weiss, A. A. Intestinal tissue response to Shiga toxin exposure. mBio. 15 (9), e0123224 (2024).
- Hovhannisyan, P., et al. Infection of human organoids supports an intestinal niche for Chlamydia trachomatis. PLoS Pathog. 20 (8), e1012144 (2024).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır