Method Article
Geração de organoides intestinais apicais e avaliação da taxa de proliferação de organoides usando marcação EdU
Neste Artigo
Resumo
Aqui, descrevemos um protocolo para gerar organoides intestinais apicais a partir de culturas organoides incorporadas à matriz padrão. Ele também descreve a incorporação subsequente de EdU em células de proliferação ativa e a quantificação semiautomática de células EdU-positivas.
Resumo
Aqui, descrevemos a geração de culturas flutuantes de organoides intestinais apicais a partir de culturas organoides intestinais embebidas em hidrogel. Ao mesmo tempo, culturas organoides basais flutuantes são estabelecidas para comparação direta entre organoides apicais e basais. Os organoides apicais e basais são subsequentemente submetidos ao análogo da timidina 5-etinil-2'-desoxiuridina (EdU), que é integrado ao DNA recém-sintetizado durante a fase S da divisão celular. Essa incorporação ao DNA pode ser visualizada em organoides morfologicamente intactos usando microscopia confocal de varredura a laser. As células marcadas com Hoechst33342 e EdU são então quantificadas de maneira semiautomática usando software de análise de imagem. O cálculo da porcentagem de células EdU-positivas do número total de células permite a análise da proliferação celular em organoides tridimensionais (3D). Apesar de ser usado aqui para a análise de proliferação em organoides intestinais, o protocolo é aplicável à análise de colorações específicas do núcleo de vários tipos em outros organoides ou culturas de células bidimensionais também.
Introdução
Os organoides intestinais são modelos tridimensionais in vitro que recapitulam o epitélio intestinal compreendendo diferentes tipos de células. Esses organoides podem ser facilmente estabelecidos a partir de células-tronco adultas isoladas de criptas intestinais1. Como os organoides estão muito mais próximos do epitélio in vivo, eles estão se tornando cada vez mais importantes na pesquisa biomédica. Os organoides do intestino não são usados apenas para a análise de mecanismos fisiológicos (por exemplo, sinalização do nicho intestinal 2,3 e diferenciação celular 4,5), mas também para pesquisas sobre doenças infecciosas 6,7. No entanto, o crescimento de células polarizadas em 3D envolvendo um lúmen central é um desafio, pois a superfície da célula apical acaba inacessível dentro do lúmen organoide. Examinar as diferenças entre as superfícies celulares apicais e basolaterais pode ser importante em estudos metabólicos, como exemplificado por diferenças na captação de ácidos graxos8 e pesquisa de doenças infecciosas 9,10,11,12.
A geração dos chamados organoides apical-out é uma opção fácil para superar esse problema. Ao remover a matriz extracelular de culturas organoides padrão (ou seja, organoides basais e embutidos na matriz) e semear esses organoides em um meio livre de matriz, uma mudança de polaridade pode ser induzida9.
Como publicamos anteriormente, a maioria dos organoides inverte sua polaridade em 12 h. No entanto, são necessárias 48-72 h para obter uma cultura com mais de 90% de organoides apicais. Apesar de sua vantagem de permitir o acesso à superfície celular apical, os organoides apicais apresentam proliferação significativamente diminuída após a inversão da polaridade, enquanto as taxas de morte celular aumentam13. O fator de atividade proliferativa pode representar uma variável de confusão em várias análises e deve ser mantido em mente ao projetar um experimento.
Aqui, apresentamos um protocolo detalhado para estabelecer culturas de organoides apicais intestinais e organoides de controle basais flutuantes para análises a jusante. Além disso, descrevemos a marcação com 5-etinil-2'-desoxiuridina (EdU), incorporada ao DNA recém-sintetizado e, portanto, marca as células em proliferação ativa. Descrevemos ainda a análise semiautomática de imagens da taxa de proliferação dos organoides usando o software arivis Pro (Zeiss) por quantificação de células EdU+ . Um esquema do processo é descrito na Figura 1.
Protocolo
Foram utilizados organoides intestinais derivados de células-tronco adultas de cães, estabelecidos de acordo com Kramer et al., 202014 . Com base nas diretrizes do comitê de ética institucional, o uso de material tecidual coletado durante a excisão terapêutica ou post-mortem está incluído no 'consentimento do proprietário para o tratamento' da universidade, que foi assinado por todos os proprietários dos pacientes.
1. Cultura organoide
- Cultive organoides intestinais derivados de células-tronco adultas incorporados na matriz de extrato de membrana basal (BME) de escolha em placas de 24 poços e divida-os mecanicamente usando pipetas de vidro, conforme descrito em detalhes em Pleguezuelos et al., 202015.
NOTA: Para o protocolo aqui descrito, o Geltrex foi utilizado como BME. - Remova cuidadosamente o meio refinado (Tabela 1) dos organoides incorporados ao BME.
- Adicione 500 μL de tripsina-EDTA a 0,05% por poço e retire todas as cúpulas da matriz do poço pipetando para cima e para baixo repetidamente. Transfira os organoides para um tubo de 15 mL e ressuspenda bem para dissociar totalmente a matriz de hidrogel.
- Incubar organoides com 0,05% de tripsina-EDTA a 37 °C em banho-maria até que todos os organoides estejam dissociados em células individuais ou pequenos aglomerados de células.
- Diluir a suspensão tripsina/célula com meio basal (Tabela 1). Use pelo menos duas vezes mais meio basal do que tripsina.
- Centrifugar as células a 8 °C a 420 × g durante 5 min. Remova o máximo de sobrenadante possível.
- Células-semente incorporadas em BME em tantos poços quanto foram usadas para tripsinização na etapa 1.3. e fornecê-los com meio refinado (Tabela 1).
- Incubar as células durante 3 dias numa incubadora de cultura de células e prosseguir com o passo 2.1.
2. Indução de inversão de polaridade e marcação EdU
- Remova cuidadosamente o meio dos organoides embutidos no BME.
- Adicione 500 μL de solução de coleta de organoides a cada poço e separe todas as cúpulas da matriz do poço pipetando para cima e para baixo repetidamente. Transfira os organoides para um tubo de 15 mL e ressuspenda bem para dissociar totalmente a matriz de hidrogel.
- Incube o tubo de 15 mL em gelo por 1,5 h. Agite bem o tubo a cada 10 minutos para evitar a aglomeração dos organoides e garantir a dissociação uniforme dos componentes restantes do hidrogel.
- Durante a incubação, cubra uma placa de 96 poços com solução antiaderente. Para cada poço de uma placa de 24 poços tripsinizada na etapa 1.3., reveste 8 poços de uma placa de 96 poços. Incubar durante pelo menos 1 h à temperatura ambiente (RT).
- Adicione pelo menos duas vezes mais PBS do que a solução de colheita de organoide foi usada ao tubo de 15 mL e centrifugue a 8 ° C a 150 × g por 5 min.
- Remova o sobrenadante e ressuspenda os organoides em 1 mL de PBS.
- Transferir 500 μl da suspensão organoide/PBS num tubo separado de 15 ml e centrifugar ambos os tubos novamente a 8 °C a 150 × g durante 5 min.
- Remova toda a solução antiaderente da placa de 96 poços.
- Remover o máximo de sobrenadante possível após centrifugação.
- Use um dos tubos para a geração de organoides basais flutuantes (BO) e o outro tubo para organoides apical-out (AO).
- Para organoides BO, adicione 100 μL de meio refinado contendo 7,5% de BME por poço da placa de 96 poços a um tubo. Misture bem e disperse os organoides uniformemente pelo número desejado de poços da placa pré-revestida de 96 poços.
- Para organoides AO, adicione 100 μL de meio refinado simples (sem adição de BME) por poço da placa de 96 poços ao outro tubo. Misture bem e disperse os organoides uniformemente pelo número desejado de poços da placa pré-revestida de 96 poços.
- Incubar os organoides a 37 °C e 5% de CO2 por 3 dias.
NOTA: As diferenças morfológicas começarão a ser visíveis após o dia 1. No entanto, resultados publicados anteriormente mostram que leva cerca de 3 dias para que a grande maioria dos organoides apresente polaridade apical-out13. - Em pontos de tempo definidos, por exemplo, 24 h / 48 h / 72 h após a indução da inversão de polaridade, adicione 50 μL de 3 μM EdU diluído em meio refinado a todos os poços de organoides a serem marcados, para receber uma concentração final de 1 μM EdU em cada poço.
- Incubar a 37 °C e 5% de CO2 por 1,5 h.
- Colete organoides marcados com EdU usando pontas de furo largo e transfira-os para um tubo de 15 mL.
- Adicione uma quantidade igual de 4% de PFA a cada tubo (organoides BO e AO; concentração final de PFA = 2%) e misture cuidadosamente.
- Incubar em RT por 15 min.
- Adicione pelo menos o dobro da quantidade de PBS conforme houver volume no tubo de 15 ml e centrifugue a 8 °C a 80 × g durante 5 min.
- Remova o sobrenadante e ressuspenda os organoides em 1 mL de PBS.
- Centrifugar novamente a 8 °C a 80 × g durante 5 min.
- Remova o sobrenadante, ressuspenda os organoides em 1 mL de PBS e transfira-os para um tubo de 1,5 mL. Conservar os organoides a 4 °C até realizar a reação de coloração EdU (ver secção 3).
- Repita as etapas 2.14-2.22 para cada ponto de tempo a ser analisado.
3. Reação de coloração Click-it EdU e coloração Hoechst 33342
- Centrifugar os organoides fixos (do passo 2.22.) num tubo de 1,5 ml a 4 °C a 50 × g durante 5 min.
- Remova o sobrenadante e ressuspenda os organoides em 1 mL de albumina de soro bovino a 3% (BSA) diluída em PBS usando pontas de calibre largo.
- Repita as etapas 3.1. e 3.2 (etapas de lavagem).
- Remova o sobrenadante e ressuspenda os organoides em 1 mL de Triton X-100 a 0,5% diluído em PBS.
- Incubar em RT por 20 min.
- Centrifugar organoides em RT a 50 × g por 5 min.
- Em um tubo novo, prepare 1x Buffer Additive misturando 45 μL de H2O com 5 μL de 10x Buffer Additive.
- Em outro tubo, prepare o Coquetel de Reação misturando os seguintes componentes: 385,8 μL de H2O, 43 μL de Tampão de Reação 10x, 20 μL de CuSO 4,1,2 μL de azida Alexa Fluor 647 e 50 μL o Aditivo Tampão 1x (da etapa 3.7.).
NOTA: Esta mistura é suficiente para cinco reações e pode ser ampliada e reduzida de acordo com o número necessário de reações de coloração. - Repita as etapas 3.1. e 3.2. duas vezes (etapas de lavagem).
- Remova o sobrenadante e adicione 100 μL de coquetel de reação (etapa 3.8.) em cada tubo com organoides.
- Incube em RT por 30 min no escuro.
- Repita as etapas 3.1. e 3.2 (etapas de lavagem).
- Centrifugar organoides a 50 × g durante 5 min a RT.
- Ressuspender organoides em 1 mL de 10 μg/mL Hoechst33342 diluído em PBS.
- Incubar em RT por 45 min no escuro.
- Repita as etapas 3.1. e 3.2 (etapas de lavagem).
- Centrifugar organoides a 50 × g durante 5 min a 4 °C.
- Semente de organoides na matriz BME de escolha em uma lâmina compatível com microscopia confocal (por exemplo, poço μ-Slide 18)
- Organoides de imagem sob um microscópio confocal.
4. Análise de imagem semiautomática
NOTA: Para esta análise, foi utilizado o arivis Pro versão 4.2.2 (software de análise de imagem).
- Importe as imagens do microscópio confocal para o software de análise de imagem e defina uma pasta na qual o arquivo de análise será salvo. Use a opção Imagens como pontos de tempo para importar várias imagens (replicar imagens, diferentes pontos de tempo, diferentes tratamentos etc.). Cada imagem será então tratada como um único ponto de tempo, permitindo uma fácil mudança entre as imagens individuais.
- Abra o painel de análise e importe o pipeline de análise fornecido como Arquivo Suplementar 1 (arivis_EdU_pipeline).
- Use a ferramenta Inserir novos objetos e Esfera com a tag Organoid para circundar facilmente todos os organoides bem separados.
- Mude para a próxima imagem, ou seja, o próximo ponto de tempo, e prossiga para marcar organoides para todas as imagens.
- Para organoides que estão muito próximos uns dos outros e, portanto, não podem ser separados usando o modo Sphere , abra a lista de objetos e ative a tag Organoid.
- Continue usando a ferramenta Desenhar objetos no modo Polígono para marcar contornos organoides manualmente.
NOTA: Na lista de objetos, todos os organoides agora são marcados e atribuídos a um ponto de tempo específico. Este ponto de tempo corresponde à ordem das imagens importadas na etapa 4.1. Esses pontos de tempo agora podem ser renomeados para corresponder ao nome da imagem original, se preferir. - Na lista de objetos, marque todos os objetos (=organoides) e clique com o botão direito do mouse e clique em Remover tags para remover a tag manual de todos os objetos.
- Desative a tag Organoid na lista de objetos e marque todas as áreas dentro de objetos previamente definidos que devem ser excluídas da análise usando a ferramenta Desenhar objetos no modo Polígono . Essas áreas podem incluir células mortas dentro do lúmen organoide ou áreas borradas, o que pode distorcer a análise.
- Ao abrir a lista de objetos, certifique-se de que todos os organoides estejam listados com a tag Organoid e que todas as áreas que devem ser excluídas tenham a tag Manual.
- Inicie o pipeline de análise clicando na seta no painel superior esquerdo.
NOTA: O software agora segmenta todos os núcleos nos canais Hoechst33342 e EdU. Este pipeline de análise considera apenas núcleos Hoechst33342+ e EdU+ segmentados maiores que 15 μm2 de tamanho (ou seja, área no segmento do núcleo) para garantir que pequenos núcleos, provavelmente originários de células mortas, sejam excluídos da análise. - Localize os resultados da análise na lista de objetos clicando na tag Colunas de Recursos .
- Alterne para a Visualização de detalhes mestre e selecione a tag Organoids no painel superior e o recurso Primeiro ponto de tempo.
- No painel inferior, selecione os recursos a serem exibidos por organoide. Use Projeção (x/y/z) Área (voxel), Intensidade média # 1 (canal EdU) e Intensidades SD #1.
- Exporte os resultados (Relatório de detalhes mestre) usando a função Exportar do Excel .
- Salve o arquivo de análise e feche o software.
5. Determinação das taxas de proliferação de organoides
- Abra o arquivo Relatório de detalhes mestre exportado na etapa 4.14.
- Há uma guia separada para cada imagem analisada. Calcule a soma da área/voxel para núcleos e coloração EdU para cada imagem. Em seguida, copie todos os dados resultantes em uma nova guia coletiva e agrupe todos os dados referentes ao mesmo ponto de tempo.
- Em seguida, calcule a área total dos núcleos celulares (ou seja, a soma da área de Hoechst33342+ e da área EdU+ ) para cada imagem.
- Em seguida, divida a área total por si mesma (= 100%) e a área média de EdU+ pela área total (= porcentagem de DNA de EdU+ ).
- Plote a porcentagem de DNA proliferativo dos organoides BO e AO no eixo y e os diferentes pontos de tempo no eixo x.
Resultados
Os organoides cultivados por 3 dias após a tripsinização devem estar idealmente entre 50-250 μm, conforme ilustrado na Figura 2A. Organoides consideravelmente maiores do que isso podem não reverter sua polaridade com eficiência. Organoides maiores também podem começar a brotar, e notamos que esses organoides também podem ter problemas com a inversão eficiente da polaridade. Os organoides basais e apicais-externos apresentam diferenças morfológicas óbvias já na imagem de campo claro. Enquanto os organoides basais retêm seu grande lúmen (Figura 2B) após 3 dias de cultura em suspensão, os organoides apicais (Figura 2C) parecem mais compactos. Uma característica muito específica das culturas em suspensão apical é o número de células mortas flutuando ao redor dos organoides. Isso se deve aos organoides apicais que expulsam células mortas e diferenciadas terminalmente para o meio circundante, enquanto os organoides basais acumulam células mortas no lúmen organoide.
Os organoides intestinais que incorporaram EdU em seu DNA recém-sintetizado antes da divisão celular podem ser visualizados usando um microscópio confocal. Os organoides basais mostram sinais EdU muito mais altos ao longo do tempo do que seus equivalentes apicais (Figura 3). É importante notar que nem todos os organoides apresentam células EdU+, apesar de crescerem em tamanho. Isso se deve ao fato de nenhuma célula EdU+ estar presente na camada de imagem específica.
Essas imagens confocais podem ser analisadas quantitativamente usando o software de análise de imagem e o pipeline de análise fornecido (Arquivo Suplementar 1). Ao realizar o protocolo de análise, os organoides devem primeiro ser circundados (Figura 4A) antes de excluir certas áreas da análise real (Figura 4B). Essas áreas de exclusão podem se referir a células mortas dentro do lúmen organoide, que não são de interesse para a quantificação de sinais de EdU. A execução subsequente do pipeline de análise automática leva à segmentação de todos os núcleos detectados, diferenciando entre os núcleos Hoechst33342+ e EdU+ . Além disso, todos os núcleos abaixo de um ponto de corte de 15 μm2 são excluídos, pois provavelmente são células mortas ou núcleos que não são mostrados na íntegra nesta camada de imagem (Figura 4C).
Após a análise da imagem usando o software e exportando as medições de quantificação, esses dados são calculados posteriormente para analisar a porcentagem do sinal EdU + da massa total de DNA (Figura 5). No caso apresentado neste manuscrito, os organoides intestinais apicais apresentam níveis drasticamente reduzidos de proliferação em comparação com os organoides basais flutuantes.

Figura 1: Visão geral esquemática do protocolo descrito. O esquema inclui o cultivo de organoides, a indução de inversão de polaridade, rotulagem EdU e análise semiautomática de imagens. Figura criada com Biorender.com. Clique aqui para ver uma versão maior desta figura.
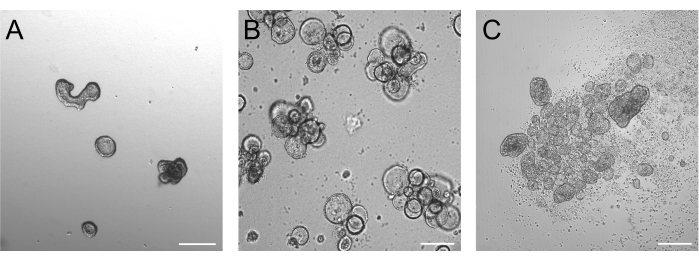
Figura 2: Organoides antes e depois da indução da inversão de polaridade. (A) Organoides intestinais incorporados na matriz três dias após as células tripsinizadas terem sido semeadas em um meio de crescimento. (B) Organoides basais flutuantes três dias após a semeadura em cultura em suspensão. (C) Organoides apicais 3 dias após a semeadura em cultura em suspensão sem BME para a indução de inversão de polaridade. Barra de escala = 200 μm. Clique aqui para ver uma versão ampliada desta figura.
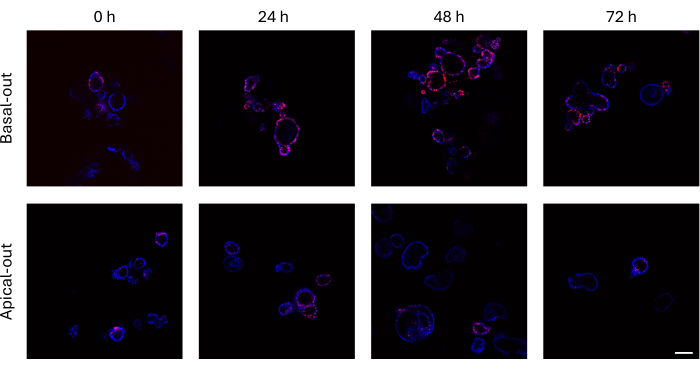
Figura 3: Organoides intestinais basais e apicais-externos marcados com EdU. O painel superior que representa imagens confocais de organoides basais ao longo do tempo apresenta muito mais células EdU+ em comparação com organoides apicais (painel inferior) nos mesmos pontos de tempo. Barra de escala = 100 μm. Clique aqui para ver uma versão ampliada desta figura.

Figura 4: Análise quantitativa de imagens de organoides intestinais corados com EdU. (A) Organoides circundados usando os modos Esfera e Polígono . (B) A área a ser excluída da análise é marcada em branco (indicada pela seta). Esta área marca o lúmen organoide, que contém um número de células mortas, que serão excluídas da análise subsequente. (C) A imagem após análise mostra todos os núcleos segmentados. Os núcleos Hoechst33342 + são marcados em ciano, os núcleos EdU+ são marcados em amarelo e os núcleos que não atingem 15 μm2 são marcados em verde (Hoechst33342) e laranja (EdU). Barra de escala = 50 μm. Clique aqui para ver uma versão ampliada desta figura.

Figura 5: Taxa de proliferação de organoides. A porcentagem de DNA EdU+ do DNA total servindo como um proxy para a taxa de proliferação de organoides mostrando maior proliferação em organoides basais em comparação com organoides apical-out. Os dados são apresentados como SEM médio. Clique aqui para ver uma versão maior desta figura.
| Meio basal | |
| Componentes de mídia | Concentração final |
| DMEM-F12 | |
| Suplemento de penicilina-estreptomicina 100X para mídia | 1x |
| Suplemento GlutaMAX | 2 mM |
| Solução tampão HEPES 1 M, líquido | 10 mM |
| Meio refinado | |
| Suplemento B27 SerumFree (50x), líquido | 1x |
| N-acetil-L-cisteína, cultura de células testada | 1 mM |
| [Leu15]-Gastrina I humano | 10 nM |
| UMA 83-01 | 500 nM |
| HGF Humano | 50 ng/mL |
| NOGGIN humano (mamífero) | 100 ng/mL |
| IGF-I humano | 100 ng/mL |
| FGF-básico humano | 50 ng/mL |
| Meio condicionado R-Spondin | 10 % (v/v) |
| Wnt-3a meio condicionado | 50 % (v/v) |
| Meio basal | volume restante para diluição dos fatores de crescimento/meio condicionado acima mencionados |
Tabela 1: Composição de mídia basal e refinada.
Discussão
Este protocolo descreve em detalhes como induzir a inversão de polaridade em culturas organoides intestinais derivadas de células-tronco adultas padrão. Os organoides apicais servem ao propósito de obter acesso à superfície da célula apical, que geralmente é orientada para o lúmen organoide. Ser capaz de sondar a superfície apical pode ser de grande importância para certas aplicações, pois esta é a porção da membrana celular que é exposta a todo o conteúdo do trato digestivo sob condições fisiológicas in vivo. Outros métodos para desafiar a superfície apical especificamente são a microinjeção16, o uso de monocamadas derivadas de organoides17 e a fragmentação de organoides18. No entanto, cada um desses métodos tem desvantagens e desvantagens específicas, como nós e outros revisamos com mais detalhes anteriormente 19,20.
O método de geração de organoides apical-out tem várias vantagens: 1) A geração de organoides apical-out é relativamente fácil em comparação com outros métodos e não requer nenhuma instrumentação ou equipamento especializado. Portanto, os organoides apicais são uma maneira econômica de acessar a superfície da célula apical; 2) organoides basais flutuantes podem ser cultivados em paralelo e usados como organoides de controle significativos, especialmente para analisar efeitos específicos da polaridade; 3) os organoides flutuantes BO e AO podem ser submetidos a aplicações padrão a jusante, como exemplificado pela incorporação de EdU neste relatório, mas também coloração imuno(histo)química, bem como ensaios baseados em luminescência e fluorescência, conforme relatado anteriormente13 e imagens diretas de células vivas12. As análises a jusante, como a análise da incorporação de EdU ou colorações imuno(histo)químicas, também permitem alguma flexibilidade em termos de tempo, pois os organoides podem ser armazenados a 4 °C até uso posterior.
Apesar da facilidade de inversão de polaridade, existem alguns pontos críticos em nosso protocolo que devem ser considerados ao aplicar este método. Primeiro, organoides usados na etapa 2.1. deve ser de um determinado tamanho. Em nossa experiência, o uso de organoides 3 dias após a tripsinização funciona bem. No entanto, esse tempo pode variar com organoides de outros animais devido a diferenças na proliferação celular ou dependendo da densidade de semeadura de aglomerados unicelulares. Além disso, a dissociação do BME usando a solução de colheita de organoides é incremental. Conforme descrito por Co et al., 20199, concentrações de BME tão baixas quanto 2,5% podem ser suficientes para manter os organoides em uma morfologia basal em cultura em suspensão. Portanto, o máximo de BME possível deve ser removido para garantir uma inversão de polaridade eficiente. Outro ponto importante é o uso correto de placas de cultura de tecidos não tratadas para minimizar a fixação de organoides durante a cultura em suspensão. Em nossa experiência, as placas de pré-revestimento com solução antiaderente (etapa 2.4) permitem o uso de praticamente qualquer placa para a cultura de organoides apical-out. No entanto, outras opções que tornam as placas de pré-revestimento redundantes podem ser exploradas.
A importância de avaliar os efeitos na superfície celular basolateral e apical das células epiteliais polarizadas torna-se óbvia em muitos casos. Por exemplo, analisamos anteriormente os efeitos das toxinas da bactéria anaeróbia Clostridioides difficile sobre os organoides BO e AO. Os resultados deste estudo mostram que a toxina B de C. difficile (TcdB) danifica apenas a integridade da barreira epitelial intestinal em organoides BO do intestino delgado, mas não em organoides AO. Vários outros relatórios mostrando reações específicas de domínio de vários microrganismos patogênicos destacam a importância de avaliar ambos os lados das células epiteliais 9,16,21,22,23,24,25.
Uma grande desvantagem dos organoides apicais é seu comportamento alterado em relação à proliferação celular. Conforme descrito acima, os organoides AO apresentam taxas drasticamente reduzidas de proliferação celular em comparação com seus equivalentes BO. Relatamos anteriormente que essa falta de proliferação anda de mãos dadas com níveis ligeiramente crescentes de morte celular13. Em última análise, isso não permite uma cultura de longo prazo de organoides AO, a menos que seja encontrada uma maneira de prolongar a vida útil do organoide AO. No entanto, consideramos os organoides AO uma ferramenta altamente útil para acessar facilmente a superfície celular apical, desde que os pesquisadores sejam cuidadosos com as conclusões que podem ser influenciadas pela diminuição da proliferação celular.
Divulgações
Os autores declaram não haver conflito de interesses.
Agradecimentos
Esta pesquisa foi apoiada com recursos do VetImaging Core Facility (VetCore, Vetmeduni, Áustria). Queremos agradecer a Ursula Reichart por seu apoio com a análise semiquantitativa de imagens. GC recebeu uma bolsa DOC (número de concessão 26349) da Academia Austríaca de Ciências (ÖAW) na Divisão de Medicina Interna de Pequenos Animais da Vetmeduni.
Materiais
| Name | Company | Catalog Number | Comments |
| 24 well plates | Biologix | 07-6024 | |
| [Leu15]-Gastrin I human, ≥95% (HPLC) | Sigma-Aldrich | G-9145 | |
| µ-Slide 18 Well Glass Bottom | ibidi | 81817 | |
| 100X Penicillin-Streptomycin supplement for Media | Gibco/Thermo | 15140122 | |
| A 83-01 | Tocris Bioscience | 2939/10 | |
| Anti-Adherence Rinsing Solution | StemCell Technologies | 7010 | |
| arivis Pro | Zeiss | Version 4.2.2 | |
| B27 SerumFree Supplement (50X), liquid | Gibco/Thermo | 17504044 | |
| Bisbenzimide H 33342 (Hoechst 33342) | Abcam | ab145597 | |
| Bovine Serum Albumin | Sigma-Aldrich | A7906-100G | |
| Click-iT EdU Cell Proliferation Kit for Imaging, Alexa Fluor 647 dye | Thermo Scientific | C10340 | |
| DMEM-F12 | Gibco/Thermo | 11320033 | |
| Geltrex | Gibco/Thermo | A1413202 | |
| GlutaMAX Supplement | Gibco/Thermo | 35050061 | |
| HEPES Buffer Solution 1 M, liquid | Gibco/Thermo | 15630056 | |
| Human FGF-basic | PeproTech | 100-18B-100µG | |
| Human HGF | PeproTech | 100-39-100µG | |
| Human IGF-I | PeproTech | 100-11-100µG | |
| Human NOGGIN (Mammalian) | PeproTech | 120-10C-200µG | |
| N-Acetyl-L-cysteine,cell culture tested, BioReagent | Sigma-Aldrich | A9165-5G | |
| Organoid Harvesting Solution | Thermo | C10340 | |
| Triton(TM) X-100,for molecular biology | Sigma-Aldrich | T8787-250ML | |
| Trypsin-EDTA (0.05%), phenol red | Gibco/Thermo | 25300054 |
Referências
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459, 262-265 (2009).
- Li, Y., et al. BMP suppresses Wnt signaling via the Bcl11b-regulated NuRD complex to maintain intestinal stem cells. EMBO J. 43 (23), 6032-6051 (2024).
- Gaowa, A., Leangpanich, S., Park, E. J., Kawamoto, E., Shimaoka, M. Irisin promotes intestinal epithelial cell proliferation via Wnt/β-catenin and focal adhesion kinase signaling pathways. Sci Rep. 14, 25702(2024).
- Basak, O., et al. Induced quiescence of Lgr5+ stem cells in intestinal organoids enables differentiation of hormone-producing enteroendocrine cells. Cell Stem Cell. 20 (2), 177-190 (2017).
- Ludikhuize, M. C., et al. Mitochondria define intestinal stem cell differentiation downstream of a FOXO/Notch axis. Cell Metab. 32 (5), 889-900.e7 (2020).
- Ettayebi, K., et al. Replication of human noroviruses in stem cell-derived human enteroids. Science (1979). 353 (6306), 1387-1393 (2016).
- Zhou, J., et al. Infection of bat and human intestinal organoids by SARS-CoV-2. Nat Med. 26 (7), 1077-1083 (2020).
- Joo, S. -S., et al. Porcine intestinal apical-out organoid model for gut function study. Animals. 12 (3), 372(2022).
- Co, J. Y., et al. Controlling epithelial polarity: A human enteroid model for host-pathogen interactions. Cell Rep. 26, 2509-2520.e4 (2019).
- Sasaki, N., et al. Development of a scalable coculture system for gut anaerobes and human colon epithelium. Gastroenterology. 159 (1), 388-390.e5 (2020).
- Mayorgas, A., et al. A novel strategy to study the invasive capability of adherent-invasive escherichia coli by using human primary organoid-derived epithelial monolayers. Front Immunol. 12, 646906(2021).
- Csukovich, G., et al. Neutralising effects of different antibodies on clostridioides difficile toxins TcdA and TcdB in a translational approach. Int J Mol Sci. 24 (4), 3867(2023).
- Csukovich, G., et al. Polarity reversal of canine intestinal organoids reduces proliferation and increases cell death. Cell Prolif. 57 (2), e13544(2023).
- Kramer, N., et al. Generation of differentiating and long-living intestinal organoids reflecting the cellular diversity of canine intestine. Cells. 9 (4), 822(2020).
- Pleguezuelos-Manzano, C., et al. Establishment and culture of human intestinal organoids derived from adult stem cells. Curr Protoc Immunol. 130 (1), e106(2020).
- Dutta, D., Heo, I., O'Connor, R. Studying infection in 3D tissue-derived human organoid culture systems by microinjection. J Vis Exp. (151), e59610(2019).
- Kumar, A., et al. Decreased SLC26A3 expression and function in intestinal epithelial cells in response to Cryptosporidium parvum infection. Am J Physiol Cell Physiol. 317 (6), C1205-C1212 (2019).
- Dutta, D., Clevers, H. Organoid culture systems to study host-pathogen interactions. Curr Opin Immunol. 48, 15-22 (2017).
- Csukovich, G., Pratscher, B., Burgener, I. A. The world of organoids: Gastrointestinal disease modelling in the age of 3R and one health with specific relevance to dogs and cats. Animals. 12 (18), 2461(2022).
- Han, X., et al. Creating a more perfect union: Modeling intestinal bacteria-epithelial interactions using organoids. Cell Mol Gastroenterol Hepatol. 12 (2), 769-782 (2021).
- Li, Y., et al. Next-generation porcine intestinal organoids: an apical-out organoid model for swine enteric virus infection and immune response investigations. J Virol. 94 (21), e01006-e01020 (2020).
- Smith, D., et al. The development of ovine gastric and intestinal organoids for studying ruminant host-pathogen interactions. Front Cell Infect Microbiol. 11, 733811(2021).
- Nash, T. J., Morris, K. M., Mabbott, N. A., Vervelde, L. Inside-out chicken enteroids with leukocyte component as a model to study host-pathogen interactions. Commun Biol. 4 (1), 377(2021).
- Hanson, K. I., Weiss, A. A. Intestinal tissue response to Shiga toxin exposure. mBio. 15 (9), e0123224(2024).
- Hovhannisyan, P., et al. Infection of human organoids supports an intestinal niche for Chlamydia trachomatis. PLoS Pathog. 20 (8), e1012144(2024).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados