Method Article
Генерация апикальных кишечных органоидов и оценка скорости пролиферации органоидов с помощью EdU-мечения
В этой статье
Резюме
Здесь мы описываем протокол генерации апикальных кишечных органоидов из стандартных органоидных культур, встроенных в матрицу. В ней также описывается последующее включение EdU в активно пролиферирующие клетки и полуавтоматическая количественная оценка EdU-положительных клеток.
Аннотация
Здесь мы описываем генерацию плавающих культур апикальных кишечных органоидов из интеграционных органоидных культур, встроенных в гидрогель. Одновременно с этим создаются плавающие базальные органоидные культуры для прямого сравнения между апикальными и базальными органоидами. Апикальные и базальные органоиды впоследствии подвергаются воздействию тимидинового аналога 5-этинил-2'-дезоксиуридина (EdU), который встраивается во вновь синтезированную ДНК во время S-фазы деления клеток. Это включение в ДНК может быть визуализировано в морфологически интактных органоидах с помощью лазерной сканирующей конфокальной микроскопии. Ячейки, помеченные с помощью Hoechst33342 и EdU, затем количественно оцениваются полуавтоматическим образом с помощью программного обеспечения для анализа изображений. Расчет процентного соотношения EdU-положительных клеток от общего числа клеток позволяет проводить анализ клеточной пролиферации в трехмерных (3D) органоидах. Несмотря на то, что протокол используется здесь для анализа пролиферации в кишечных органоидах, он применим и для анализа специфических для ядра окрашиваний различных видов в других органоидах или двумерных клеточных культурах.
Введение
Кишечные органоиды представляют собой трехмерные модели in vitro, воспроизводящие эпителий кишечника, состоящий из различных типов клеток. Эти органоиды могут быть легко установлены из взрослых стволовых клеток, выделенных из кишечных крипт1. Поскольку органоиды находятся гораздо ближе к эпителию in vivo, они приобретают все большее значение в биомедицинских исследованиях. Органоиды кишечника используются не только для анализа физиологических механизмов (например, передачи сигналов в кишечной нише 2,3 и дифференцировки клеток 4,5), но и для исследований инфекционных заболеваний 6,7. Тем не менее, выращивание поляризованных клеток в 3D, охватывающих центральный просвет, является сложной задачей, поскольку поверхность апикальной клетки оказывается недоступной в пределах органоидного просвета. Изучение различий между апикальными и базолатеральными поверхностями клеток может иметь важное значение в метаболических исследованиях, о чем свидетельствуют различияв поглощении жирных кислот 8 и исследованиях инфекционных заболеваний 9,10,11,12.
Генерация так называемых апикальных органоидов является простым вариантом решения этой проблемы. Путем удаления внеклеточного матрикса из стандартных органоидных культур (т.е. базально-исходных, встроенных в матрицу органоидов) и засеивания этих органоидов в среду, свободную от матрицы,можно индуцировать переключение полярности9.
Как мы уже писали ранее, большинство органоидов инвертируют свою полярность в течение 12 часов. Однако для получения культуры с более чем 90% апикальных органоидов требуется 48-72 ч. Несмотря на то, что они обеспечивают доступ к апикальной поверхности клетки, апикальные органоиды демонстрируют значительное снижение пролиферации после смены полярности, в то время как скорость гибели клеток увеличиваетсяв 13 раз. Фактор пролиферативной активности может представлять собой искажающую переменную в различных анализах, и его следует учитывать при планировании эксперимента.
Здесь мы представляем подробный протокол для создания кишечных апикальных органоидных культур и плавающих базальных контрольных органоидов для последующих анализов. Кроме того, мы описываем мечение 5-этинил-2'-дезоксиуридином (EdU), включенным в вновь синтезированную ДНК и таким образом маркирующим активно пролиферирующие клетки. Далее мы описываем полуавтоматический анализ скорости пролиферации органоидов с помощью программного обеспечения arivis Pro (Zeiss) путем количественного определения клеток EdU+ . Схема этого процесса представлена на рисунке 1.
протокол
Были использованы кишечные органоиды, полученные из взрослых стволовых клеток собак, полученные по данным Kramer et al., 202014 . В соответствии с руководящими принципами институционального комитета по этике, использование тканевого материала, собранного во время терапевтического иссечения или вскрытия, включено в университетское «Согласие владельца на лечение», которое было подписано всеми владельцами пациентов.
1. Органоидная культура
- Культивируйте кишечные органоиды, полученные из взрослых стволовых клеток, встраиваемые в выбранную матрицу экстракта базальной мембраны (BME) в 24-луночные планшеты и механически разделяйте их с помощью стеклянных пипеток, как подробно описано в Pleguezuelos et al., 2020,15.
ПРИМЕЧАНИЕ: Для описанного здесь протокола в качестве BME использовался Geltrex. - Осторожно удалите очищенную среду (Таблица 1) из органоидов, встроенных в БМЭ.
- Добавьте 500 мкл 0,05 % трипсина-ЭДТА в лунку и отсоедините все матричные купола от лунки путем многократного пипетирования вверх и вниз. Перенесите органоиды в пробирку объемом 15 мл и хорошо ресуспендируйте для полной диссоциации гидрогелевой матрицы.
- Инкубируйте органоиды с 0,05 % трипсин-ЭДТА при 37 °C на водяной бане до тех пор, пока все органоиды не диссоциируют на отдельные клетки или небольшие кластеры клеток.
- Разбавляют трипсин/клеточную суспензию базальной средой (табл. 1). Используйте как минимум в два раза больше базальной среды, чем трипсина.
- Центрифугируйте ячейки при 8 °C при 420 × г в течение 5 мин. Удалите как можно больше надосадочной жидкости.
- Затравочные клетки встраивали в БМЭ в столько лунок, сколько было использовано для трипсинизации на этапе 1.3. и снабжают их очищенной средой (табл. 1).
- Инкубируйте клетки в течение 3 дней в инкубаторе для клеточных культур и приступайте к шагу 2.1.
2. Индукция переполюсовки и маркировка EdU
- Осторожно удалите среду из органоидов, встроенных в BME.
- Добавьте 500 мкл раствора для сбора органоидов в каждую лунку и отсоедините все матричные купола от лунки путем многократного пипетирования вверх и вниз. Перенесите органоиды в пробирку объемом 15 мл и хорошо ресуспендируйте для полной диссоциации гидрогелевой матрицы.
- Инкубируйте пробирку объемом 15 мл на льду в течение 1,5 ч. Хорошо встряхивайте пробирку каждые 10 минут, чтобы предотвратить слипание органоидов и обеспечить равномерную диссоциацию оставшихся компонентов гидрогеля.
- Во время инкубации покройте 96-луночный планшет раствором, препятствующим прилипанию. Для каждой лунки 24-луночного планшета, трипсинизированного на шаге 1.3, покрыть 8 лунок 96-луночного планшета. Инкубировать не менее 1 ч при комнатной температуре (RT).
- Добавьте не менее чем в два раза больше PBS, чем использовался раствор для сбора органоидов, в пробирку объемом 15 мл и центрифугируйте при 8 °C при 150 × г в течение 5 минут.
- Удалите надосадочную жидкость и повторно суспендируйте органоиды в 1 мл PBS.
- Перенесите 500 мкл органоида/суспензии PBS в отдельную пробирку объемом 15 мл и снова центрифугируйте обе пробирки при 8 °C при 150 × г в течение 5 мин.
- Удалите весь антиадгезивный раствор с 96-луночного планшета.
- Удалите как можно больше надосадочной жидкости после центрифугирования.
- Используйте одну из трубок для генерации плавающих базальных органоидов (BO), а другую — для апикальных органоидов (AO).
- Для органоидов BO добавьте 100 мкл очищенной среды, содержащей 7,5% BME, на лунку 96-луночного планшета в одну пробирку. Хорошо перемешайте и равномерно распределите органоиды по желаемому количеству лунок предварительно покрытой 96-луночной пластины.
- Для органоидов АО добавьте 100 мкл простой очищенной среды (без добавления BME) на лунку 96-луночного планшета в другую пробирку. Хорошо перемешайте и равномерно распределите органоиды по желаемому количеству лунок предварительно покрытой 96-луночной пластины.
- Инкубируйте органоиды при 37 °C и 5%CO2 в течение 3 дней.
ПРИМЕЧАНИЕ: Морфологические различия начнут проявляться после 1-го дня. Тем не менее, ранее опубликованные результаты показывают, что подавляющему большинству органоидов требуется около 3 дней, чтобы проявить апикальную полярность13. - В определенные моменты времени, например, через 24 ч/48 ч/72 ч после индукции смены полярности, добавьте 50 мкл 3 мкМ EdU, разведенных в очищенной среде, во все лунки с органоидами, подлежащими маркировке, чтобы получить конечную концентрацию 1 мкМ EdU в каждой лунке.
- Инкубировать при 37 °C и 5%CO2 в течение 1,5 ч.
- Соберите органоиды, меченные EdU, с помощью наконечников с широким отверстием и перенесите их в пробирку объемом 15 мл.
- Добавьте равное количество 4% PFA в каждую пробирку (органоиды BO и AO; конечная концентрация PFA = 2%) и тщательно перемешайте.
- Инкубировать при RT в течение 15 минут.
- Добавьте не менее чем в два раза больше PBS, так как объем пробирки объемом 15 мл и центрифугируйте при 8 °C при 80 × г в течение 5 минут.
- Удалите надосадочную жидкость и повторно суспендируйте органоиды в 1 мл PBS.
- Снова центрифугируйте при 8 °C и 80 × г в течение 5 минут.
- Удалите надосадочную жидкость, повторно суспендируйте органоиды в 1 мл PBS и перенесите их в пробирку объемом 1,5 мл. Храните органоиды при температуре 4 °C до начала реакции окрашивания EdU (см. раздел 3).
- Повторите шаги 2.14-2.22 для каждой временной точки, которую необходимо проанализировать.
3. Реакция окрашивания Click-it EdU и окрашивание Hoechst 33342
- Центрифугируйте фиксированные органоиды (начиная с шага 2.22.) в пробирке объемом 1,5 мл при 4 °C при 50 × г в течение 5 мин.
- Удалите надосадочную жидкость и ресуспендируйте органоиды в 1 мл 3% бычьего сывороточного альбумина (БСА), разведенного в PBS, с помощью наконечников с широким отверстием.
- Повторите шаги 3.1. и 3.2 (этапы промывки).
- Удалите надосадочную жидкость и ресуспендируйте органоиды в 1 мл 0,5% Triton X-100, разведенного в PBS.
- Инкубировать при RT в течение 20 минут.
- Центрифугировать органоиды в RT при 50 × г в течение 5 мин.
- В свежей пробирке приготовьте 1x буферную добавку, смешав 45 мкл H2O с 5 мкл 10x буферной добавки.
- В другой пробирке приготовьте реакционный коктейль, смешав следующие компоненты: 385,8 мкл H2O, 43 мкл 10x реакционного буфера, 20 мкл CuSO, 4,1,2 мкл азида Alexa Fluor 647 и 50 мкл 1x буферной добавки (начиная с шага 3.7.).
ПРИМЕЧАНИЕ: Эта смесь достаточна для пяти реакций и может быть увеличена и уменьшена в соответствии с требуемым количеством реакций окрашивания. - Повторите шаги 3.1. и 3.2. два раза (этапы промывки).
- Удалите надосадочную жидкость и добавьте 100 μL Reaction Cocktail (шаг 3.8.) в каждую пробирку с органоидами.
- Инкубировать при RT в течение 30 минут в темноте.
- Повторите шаги 3.1. и 3.2 (этапы промывки).
- Центрифугировать органоиды при 50 × г в течение 5 мин при РТ.
- Ресуспендировать органоиды в 1 мл 10 мкг/мл Hoechst33342, разведенных в PBS.
- Инкубировать при RT в течение 45 минут в темноте.
- Повторите шаги 3.1. и 3.2 (этапы промывки).
- Центрифугируйте органоиды при 50 × г в течение 5 мин при 4 °C.
- Засейте органоиды из выбранной матрицы BME в предметное стекло, совместимое с конфокальной микроскопией (например, μ-Слайд 18)
- Изображение органоидов под конфокальным микроскопом.
4. Полуавтоматический анализ изображений
ПРИМЕЧАНИЕ: Для этого анализа использовался arivis Pro версии 4.2.2 (программное обеспечение для анализа изображений).
- Импортируйте изображения конфокального микроскопа в программное обеспечение для анализа изображений и определите папку, в которую будет сохранен файл анализа. Используйте опцию «Изображения как временные точки » для импорта нескольких изображений (дублирование изображений, разных временных точек, разных обработок и т. д.). Каждое изображение будет рассматриваться как отдельная временная точка, что позволит легко переключаться между отдельными изображениями.
- Откройте панель анализа и импортируйте конвейер анализа, предоставленный в виде дополнительного файла 1 (arivis_EdU_pipeline).
- Используйте инструмент «Разместить новые объекты » и «Сферу » с тегом «Органоид », чтобы легко обвести все хорошо разделенные органоиды.
- Переключитесь на следующее изображение, т.е. на следующую временную точку, и продолжайте отмечать органоиды для всех изображений.
- Для органоидов, которые находятся очень близко друг к другу и поэтому не могут быть разделены с помощью режима Сфера , откройте список объектов и активируйте тег Органоид.
- Продолжайте использовать инструмент «Рисовать объекты » в режиме «Многоугольник », чтобы отмечать контуры органоидов вручную.
ПРИМЕЧАНИЕ: В списке объектов все органоиды теперь помечены и назначены на определенный момент времени. Этот момент времени соответствует порядку импортируемых изображений на шаге 4.1. Эти временные точки теперь можно переименовать в соответствии с исходным именем изображения, если это необходимо. - В списке объектов отметьте все объекты (=органоиды) и щелкните правой кнопкой мыши, затем нажмите «Удалить теги », чтобы удалить тег «Вручную » со всех объектов.
- Деактивируйте тег Органоид в списке объектов и отметьте все области внутри ранее определенных объектов, которые должны быть исключены из анализа, с помощью инструмента Рисовать объекты в режиме Полигон . Эти области могут включать мертвые клетки в просвете органоида или размытые области, которые могут исказить анализ.
- При открытии списка объектов убедитесь, что все органоиды помечены тегом Organoid , а все области, которые должны быть исключены, имеют тег Manual.
- Запустите конвейер анализа, щелкнув стрелку на верхней левой панели.
ПРИМЕЧАНИЕ: Программное обеспечение теперь сегментирует все ядра в каналах Hoechst33342 и EdU. В этом конвейере анализа учитываются только сегментированные ядра Hoechst33342+ и EdU+ размером более 15мкм2 (т.е. площадь в сегменте ядра), чтобы гарантировать, что небольшие ядра, скорее всего, происходящие из мертвых клеток, исключены из анализа. - Результаты анализа можно найти в списке объектов, нажав на тег Feature Columns .
- Переключитесь в режим Master Detail View и выберите тег Organoids на верхней панели и функцию First Timepoint.
- На нижней панели выберите объекты для отображения для каждого органоида. Используйте Проекционную площадь (x/y/z) (воксель), Среднюю интенсивность # 1 (канал EdU) и Интенсивность SD #1.
- Экспортируйте результаты (основной подробный отчет) с помощью функции экспорта в Excel .
- Сохраните файл анализа и закройте программу.
5. Определение скоростей пролиферации органоидов
- Откройте файл основного подробного отчета , экспортированный на шаге 4.14.
- Для каждого анализируемого изображения предусмотрена отдельная вкладка. Рассчитайте сумму площадей/вокселей для ядер и окрашивания EdU для каждого изображения. Затем скопируйте все полученные данные в новую общую вкладку и сгруппируйте все данные, относящиеся к одному и тому же моменту времени.
- Затем вычислите общую площадь ядра клетки (т. е. сумму площади Hoechst33342+ и площади EdU+ ) для каждого изображения.
- Затем разделите общую площадь на саму (= 100%) и среднюю площадь EdU+ на общую площадь (= процент ДНК EdU+ ).
- Нанесите график процентного соотношения пролиферативной ДНК органоидов BO и AO по оси y и различных временных точек по оси x.
Результаты
Органоиды, выращенные в течение 3 дней после трипсинизации, в идеале должны иметь плотность 50-250 мкм, как показано на рисунке 2А. Органоиды, которые значительно больше этого, могут не эффективно менять свою полярность. Более крупные органоиды также могут начать почковаться, и мы заметили, что эти органоиды также могут иметь проблемы с эффективной сменой полярности. Базальные и апикальные органоиды демонстрируют очевидные морфологические различия уже при визуализации в светлом поле. В то время как базальные органоиды сохраняют свой большой просвет (рис. 2B) после 3 дней культивирования суспензии, апикальные органоиды (рис. 2C) кажутся более компактными. Очень специфической особенностью апикальных суспензионных культур является количество мертвых клеток, плавающих вокруг органоидов. Это связано с тем, что апикальные органоиды выдавливают терминально дифференцированные и мертвые клетки в окружающую среду, в то время как базальные органоиды накапливают мертвые клетки в просвете органоида.
Кишечные органоиды, которые включили EdU в свою вновь синтезированную ДНК до деления клеток, могут быть визуализированы с помощью конфокального микроскопа. Базальные органоиды демонстрируют гораздо более высокие сигналы EdU с течением времени, чем их апикальные аналоги (рис. 3). Важно отметить, что не все органоиды демонстрируют клетки EdU+, несмотря на растущие размеры. Это связано с тем, что в определенном слое визуализации отсутствуют клетки EdU+ .
Эти конфокальные изображения могут быть количественно проанализированы с помощью программного обеспечения для анализа изображений и предоставленного конвейера анализа (Дополнительный файл 1). При выполнении протокола анализа органоиды должны быть сначала окружены (рисунок 4А), а затем исключены определенные области из фактического анализа (рисунок 4В). Эти зоны исключения могут относиться к мертвым клеткам внутри просвета органоида, которые не представляют интереса для количественной оценки сигналов EdU. Последующее выполнение автоматического конвейера анализа приводит к сегментации всех обнаруженных ядер, дифференцируя ядра Hoechst33342+ и ядра EdU+ . Кроме того, исключаются все ядра ниже порогового значения 15мкм2, так как они, скорее всего, являются мертвыми клетками или ядрами, которые не полностью видны в этом слое изображения (рисунок 4C).
После анализа изображений с помощью программного обеспечения и экспорта количественных измерений эти данные рассчитываются далее для анализа процентного соотношения сигнала EdU+ от общей массы ДНК (рис. 5). В случае, представленном в данной рукописи, апикальные кишечные органоиды демонстрируют резко меньший уровень пролиферации по сравнению с плавающими базальными органоидами.

Рисунок 1: Схематический обзор описанного протокола. Схема включает в себя выращивание органоидов, индукцию смены полярности, маркировку EdU и полуавтоматический анализ изображений. Рисунок создан с помощью Biorender.com. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
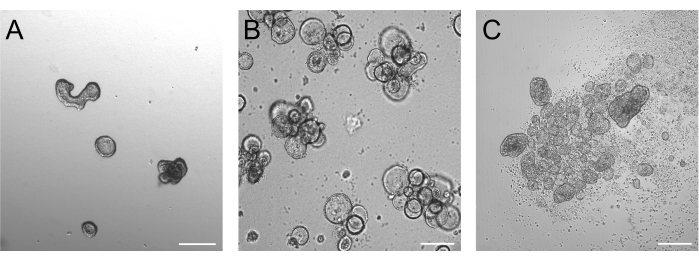
Рисунок 2: Органоиды до и после индукции смены полярности. (А) Встроенные в матрицу кишечные органоиды через три дня после посева трипсинизированных клеток в питательную среду. (B) Плавающие базальные органоиды через три дня после посева в суспензионной культуре. (C) Апикальные органоиды через 3 дня после посева в культуру суспензии без БМЭ для индукции смены полярности. Масштабная линейка = 200 μм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
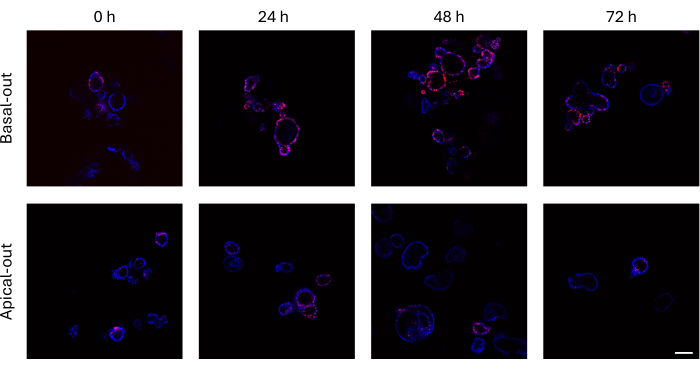
Рисунок 3: Базальные и апикальные кишечные органоиды, меченные EdU. Верхняя панель, изображающая конфокальные изображения базальных органоидов с течением времени, представляет гораздо больше клеток EdU+ по сравнению с апикальными органоидами (нижняя панель) в те же моменты времени. Масштабная линейка = 100 μм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 4: Количественный анализ изображений кишечных органоидов, окрашенных EdU. (A) Опоясанные органоиды в режимах Сфера и Полигон. (B) Область, подлежащая исключению из анализа, отмечена белым цветом (обозначена стрелкой). В этой области отмечен просвет органоида, в котором находится ряд мертвых клеток, которые будут исключены из последующего анализа. (C) На изображении после анализа видны все сегментированные ядра. Ядра Hoechst33342 + отмечены голубым цветом, ядра EdU+ — желтым, а ядра, не достигающие 15мкм2 , — зеленым (Hoechst33342) и оранжевым (EdU). Масштабная линейка = 50 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 5: Скорость пролиферации органоидов. Процент ДНК EdU+ от общей ДНК, служащий в качестве показателя скорости пролиферации органоидов, показывает более высокую пролиферацию в органоидах с базальным выходом по сравнению с органоидами с верхним расположением. Данные представлены в виде среднего значения SEM. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| Базальная среда | |
| Компоненты мультимедиа | Конечная концентрация |
| ДМЭМ-Ф12 | |
| 100X Пенициллин-стрептомицин добавка для СМИ | 1x |
| Добавка GlutaMAX | 2 мМ |
| HEPES Буферный раствор 1 м, жидкий | 10 мМ |
| Очищенная среда | |
| B27 Пищевая добавка без сыворотки (50x), жидкая | 1x |
| N-ацетил-L-цистеин, протестирована на клеточной культуре | 1 мМ |
| [Leu15]-Гастрин I человек | 10 нМ |
| А 83-01 | 500 нм |
| Человеческий HGF | 50 нг/мл |
| Человек НОГГИН (Млекопитающее) | 100 нг/мл |
| ИФР-I человека | 100 нг/мл |
| Человеческий FGF-базовый | 50 нг/мл |
| Кондиционированная среда R-Spondin | 10 % (v/v) |
| Wnt-3a кондиционированная среда | 50 % (v/v) |
| Базальная среда | оставшийся объем для разведения вышеупомянутых факторов роста/кондиционированной среды |
Таблица 1: Базальный и уточненный состав среды.
Обсуждение
В этом протоколе подробно описывается, как индуцировать смену полярности в стандартных культурах кишечных органоидов, полученных из взрослых стволовых клеток. Апикальные органоиды служат для получения доступа к апикальной поверхности клетки, которая обычно ориентирована на просвет органоида. Возможность зондирования апикальной поверхности может иметь большое значение для определенных областей применения, поскольку именно эта часть клеточной мембраны подвергается воздействию всего содержимого пищеварительного тракта в физиологических условиях in vivo. Другими способами воздействия на апикальную поверхность являются микроинъекция16, использование монослоев, полученных из органоидов17, и фрагментация органоидов18. Однако каждый из этих способов имеет свои недостатки и недостатки, о чем мы и другие подробно рассмотрели ранее19,20.
Метод генерации апикальных органоидов имеет ряд преимуществ: 1) Получение апикальных органоидов относительно прост по сравнению с другими методами и не требует каких-либо специализированных инструментов или оборудования. Таким образом, апикальные органоиды являются экономически эффективным способом доступа к поверхности апикальной клетки; 2) плавающие базальные органоиды могут культивироваться параллельно и использоваться в качестве значимых контрольных органоидов, особенно для анализа эффектов, специфичных для полярности; 3) плавающие органоиды BO и AO могут быть подвергнуты стандартному последующему применению, примером чего является включение EdU в настоящем отчете, а также иммунохимическое (гисто)химическое окрашивание, а также люминесцентные и флуоресцентные анализы, как сообщалосьранее13 , и прямая визуализация живых клеток12. Последующие анализы, такие как анализ включения EdU или иммунохимическое (гисто)окрашивание, также обеспечивают некоторую гибкость с точки зрения времени, поскольку органоиды могут храниться при температуре 4 °C до дальнейшего использования.
Несмотря на простоту смены полярности, в нашем протоколе есть некоторые критические моменты, которые следует учитывать при применении этого метода. Во-первых, органоиды, используемые на шаге 2.1. должен быть определенного размера. По нашему опыту, хорошо работает использование органоидов через 3 дня после трипсинизации. Однако это время может варьироваться у органоидов других животных из-за различий в пролиферации клеток или в зависимости от плотности посева одноклеточных кластеров. Кроме того, диссоциация БМЭ с помощью раствора для сбора органоидов является инкрементной. Как описано в Co et al., 20199, концентрации BME на уровне 2,5% могут быть достаточными для сохранения органоидов в базальной морфологии в культуре суспензии. Поэтому необходимо удалить как можно больше BME, чтобы обеспечить эффективную смену полярности. Еще одним важным моментом является правильное использование необработанных планшетов для культивирования тканей для минимизации присоединения органоидов во время культивирования суспензии. По нашему опыту, предварительное покрытие планшетов раствором Anti-Адгезии (шаг 2.4.) позволяет использовать практически любую пластину для культивирования апикальных органоидов. Тем не менее, можно рассмотреть другие варианты, делающие пластины предварительного покрытия излишними.
Важность оценки влияния на базолатеральную, а также апикальную клеточную поверхность поляризованных эпителиальных клеток становится очевидной во многих случаях. Например, ранее мы анализировали влияние токсинов анаэробной бактерии Clostridioides difficile на органоиды BO и AO. Результаты этого исследования показывают, что токсин B (TcdB) C. difficile повреждает целостность эпителиального барьера кишечника только в органоидах BO тонкой кишки, но не в органоидах AO. В нескольких других отчетах, показывающих домен-специфические реакции различных патогенных микроорганизмов, подчеркивается важность оценки обеих сторон эпителиальных клеток 9,16,21,22,23,24,25.
Одним из основных недостатков апикальных органоидов является их измененное поведение в отношении пролиферации клеток. Как описано выше, органоиды АО демонстрируют значительно более низкие темпы пролиферации клеток по сравнению с их аналогами BO. Ранее мы сообщали, что это отсутствие пролиферации идет рука об руку с несколько возрастающим уровнем клеточнойсмерти13. В конечном счете, это не позволяет проводить долгосрочное культивирование AO-органоидов, если не будет найден способ продлить жизнь AO-органоидов. Тем не менее, мы считаем органоиды АО очень полезным инструментом для легкого доступа к апикальной поверхности клетки, если исследователи осторожны с выводами, на которые может повлиять снижение пролиферации клеток.
Раскрытие информации
Авторы заявляют об отсутствии конфликта интересов.
Благодарности
Данное исследование было поддержано с использованием ресурсов VetImaging Core Facility (VetCore, Vetmeduni, Австрия). Мы хотим поблагодарить Урсулу Райхарт за ее поддержку в проведении полуколичественного анализа изображений. GC является получателем стипендии DOC (грант No 26349) Австрийской академии наук (ÖAW) в отделении внутренней медицины мелких животных в Vetmeduni.
Материалы
| Name | Company | Catalog Number | Comments |
| 24 well plates | Biologix | 07-6024 | |
| [Leu15]-Gastrin I human, ≥95% (HPLC) | Sigma-Aldrich | G-9145 | |
| µ-Slide 18 Well Glass Bottom | ibidi | 81817 | |
| 100X Penicillin-Streptomycin supplement for Media | Gibco/Thermo | 15140122 | |
| A 83-01 | Tocris Bioscience | 2939/10 | |
| Anti-Adherence Rinsing Solution | StemCell Technologies | 7010 | |
| arivis Pro | Zeiss | Version 4.2.2 | |
| B27 SerumFree Supplement (50X), liquid | Gibco/Thermo | 17504044 | |
| Bisbenzimide H 33342 (Hoechst 33342) | Abcam | ab145597 | |
| Bovine Serum Albumin | Sigma-Aldrich | A7906-100G | |
| Click-iT EdU Cell Proliferation Kit for Imaging, Alexa Fluor 647 dye | Thermo Scientific | C10340 | |
| DMEM-F12 | Gibco/Thermo | 11320033 | |
| Geltrex | Gibco/Thermo | A1413202 | |
| GlutaMAX Supplement | Gibco/Thermo | 35050061 | |
| HEPES Buffer Solution 1 M, liquid | Gibco/Thermo | 15630056 | |
| Human FGF-basic | PeproTech | 100-18B-100µG | |
| Human HGF | PeproTech | 100-39-100µG | |
| Human IGF-I | PeproTech | 100-11-100µG | |
| Human NOGGIN (Mammalian) | PeproTech | 120-10C-200µG | |
| N-Acetyl-L-cysteine,cell culture tested, BioReagent | Sigma-Aldrich | A9165-5G | |
| Organoid Harvesting Solution | Thermo | C10340 | |
| Triton(TM) X-100,for molecular biology | Sigma-Aldrich | T8787-250ML | |
| Trypsin-EDTA (0.05%), phenol red | Gibco/Thermo | 25300054 |
Ссылки
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459, 262-265 (2009).
- Li, Y., et al. BMP suppresses Wnt signaling via the Bcl11b-regulated NuRD complex to maintain intestinal stem cells. EMBO J. 43 (23), 6032-6051 (2024).
- Gaowa, A., Leangpanich, S., Park, E. J., Kawamoto, E., Shimaoka, M. Irisin promotes intestinal epithelial cell proliferation via Wnt/β-catenin and focal adhesion kinase signaling pathways. Sci Rep. 14, 25702(2024).
- Basak, O., et al. Induced quiescence of Lgr5+ stem cells in intestinal organoids enables differentiation of hormone-producing enteroendocrine cells. Cell Stem Cell. 20 (2), 177-190 (2017).
- Ludikhuize, M. C., et al. Mitochondria define intestinal stem cell differentiation downstream of a FOXO/Notch axis. Cell Metab. 32 (5), 889-900.e7 (2020).
- Ettayebi, K., et al. Replication of human noroviruses in stem cell-derived human enteroids. Science (1979). 353 (6306), 1387-1393 (2016).
- Zhou, J., et al. Infection of bat and human intestinal organoids by SARS-CoV-2. Nat Med. 26 (7), 1077-1083 (2020).
- Joo, S. -S., et al. Porcine intestinal apical-out organoid model for gut function study. Animals. 12 (3), 372(2022).
- Co, J. Y., et al. Controlling epithelial polarity: A human enteroid model for host-pathogen interactions. Cell Rep. 26, 2509-2520.e4 (2019).
- Sasaki, N., et al. Development of a scalable coculture system for gut anaerobes and human colon epithelium. Gastroenterology. 159 (1), 388-390.e5 (2020).
- Mayorgas, A., et al. A novel strategy to study the invasive capability of adherent-invasive escherichia coli by using human primary organoid-derived epithelial monolayers. Front Immunol. 12, 646906(2021).
- Csukovich, G., et al. Neutralising effects of different antibodies on clostridioides difficile toxins TcdA and TcdB in a translational approach. Int J Mol Sci. 24 (4), 3867(2023).
- Csukovich, G., et al. Polarity reversal of canine intestinal organoids reduces proliferation and increases cell death. Cell Prolif. 57 (2), e13544(2023).
- Kramer, N., et al. Generation of differentiating and long-living intestinal organoids reflecting the cellular diversity of canine intestine. Cells. 9 (4), 822(2020).
- Pleguezuelos-Manzano, C., et al. Establishment and culture of human intestinal organoids derived from adult stem cells. Curr Protoc Immunol. 130 (1), e106(2020).
- Dutta, D., Heo, I., O'Connor, R. Studying infection in 3D tissue-derived human organoid culture systems by microinjection. J Vis Exp. (151), e59610(2019).
- Kumar, A., et al. Decreased SLC26A3 expression and function in intestinal epithelial cells in response to Cryptosporidium parvum infection. Am J Physiol Cell Physiol. 317 (6), C1205-C1212 (2019).
- Dutta, D., Clevers, H. Organoid culture systems to study host-pathogen interactions. Curr Opin Immunol. 48, 15-22 (2017).
- Csukovich, G., Pratscher, B., Burgener, I. A. The world of organoids: Gastrointestinal disease modelling in the age of 3R and one health with specific relevance to dogs and cats. Animals. 12 (18), 2461(2022).
- Han, X., et al. Creating a more perfect union: Modeling intestinal bacteria-epithelial interactions using organoids. Cell Mol Gastroenterol Hepatol. 12 (2), 769-782 (2021).
- Li, Y., et al. Next-generation porcine intestinal organoids: an apical-out organoid model for swine enteric virus infection and immune response investigations. J Virol. 94 (21), e01006-e01020 (2020).
- Smith, D., et al. The development of ovine gastric and intestinal organoids for studying ruminant host-pathogen interactions. Front Cell Infect Microbiol. 11, 733811(2021).
- Nash, T. J., Morris, K. M., Mabbott, N. A., Vervelde, L. Inside-out chicken enteroids with leukocyte component as a model to study host-pathogen interactions. Commun Biol. 4 (1), 377(2021).
- Hanson, K. I., Weiss, A. A. Intestinal tissue response to Shiga toxin exposure. mBio. 15 (9), e0123224(2024).
- Hovhannisyan, P., et al. Infection of human organoids supports an intestinal niche for Chlamydia trachomatis. PLoS Pathog. 20 (8), e1012144(2024).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены