Method Article
توليد العضيات المعوية القمية وتقييم معدل التكاثر العضلي باستخدام وضع العلامات على EdU
In This Article
Summary
هنا ، نصف بروتوكولا لتوليد عضيات معوية قمية من الثقافات العضوية القياسية المضمنة في المصفوفة. كما يحدد الدمج اللاحق ل EdU في الخلايا التي تتكاثر بنشاط والقياس الكمي شبه التلقائي للخلايا الإيجابية ل EdU.
Abstract
هنا ، نصف توليد الثقافات العائمة للعضيات المعوية القمية من الثقافات العضوية المعوية المضمنة في الهيدروجيل. في الوقت نفسه ، يتم إنشاء الثقافات العضوية القاعدية العائمة للمقارنة المباشرة بين العضيات القمية للخارج والقاعدية. تخضع العضيات القمية والقاعدية لاحقا لنظير الثايميدين 5-ethynyl-2'-deoxyuridine (EdU) ، والذي يتم دمجه في الحمض النووي المركب حديثا خلال المرحلة S من انقسام الخلية. يمكن تصور هذا الدمج في الحمض النووي في العضيات السليمة شكليا باستخدام الفحص المجهري متحد البؤر بالمسح بالليزر. ثم يتم قياس الخلايا المسماة ب Hoechst33342 و EdU بطريقة شبه تلقائية باستخدام برنامج تحليل الصور. يسمح حساب النسبة المئوية للخلايا الإيجابية ل EdU من إجمالي عدد الخلايا بتحليل تكاثر الخلايا في العضيات ثلاثية الأبعاد (3D). على الرغم من استخدامه هنا لتحليل التكاثر في العضيات المعوية ، إلا أن البروتوكول قابل للتطبيق على تحليل البقع الخاصة بالنواة من أنواع مختلفة في العضيات الأخرى أو مزارع الخلايا ثنائية الأبعاد أيضا.
Introduction
العضيات المعوية هي نماذج ثلاثية الأبعاد في المختبر تلخص ظهارة الأمعاء التي تشتمل على أنواع مختلفة من الخلايا. يمكن إنشاء هذه العضيات بسهولة من الخلايا الجذعية البالغة المعزولة من الخبايا المعوية1. نظرا لأن العضيات أقرب بكثير إلى ظهارة الجسم الحي ، فقد أصبحت ذات أهمية متزايدة في البحوث الطبية الحيوية. لا تستخدم عضيات الأمعاء فقط لتحليل الآليات الفسيولوجية (على سبيل المثال ، إشارات المعويةالمتخصصة 2،3 وتمايز الخلايا4،5) ولكن أيضا للبحث عن الأمراض المعدية6،7. ومع ذلك ، فإن زراعة الخلايا المستقطبة في 3D التي تحيط بالتجويف المركزي يمثل تحديا ، حيث ينتهي الأمر بسطح الخلية القمية بحيث لا يمكن الوصول إليه داخل التجويف العضوي. يمكن أن يكون فحص الاختلافات بين أسطح الخلايا القمية والقاعدية الجانبية مهما في دراسات التمثيل الغذائي ، كما يتضح من الاختلافات في امتصاص الأحماضالدهنية 8 وأبحاث الأمراض المعدية9،10،11،12.
يعد توليد ما يسمى بالعضيات القمية خيارا سهلا للتغلب على هذه المشكلة. عن طريق إزالة المصفوفة خارج الخلية من الثقافات العضوية القياسية (أي العضيات القاعدية المضمنة في المصفوفة) وبذر هذه العضيات في وسط خال من المصفوفة ، يمكن إحداث مفتاح قطبية9.
كما نشرنا سابقا ، فإن معظم العضيات تعكس قطبيتها في غضون 12 ساعة. ومع ذلك ، يستغرق الأمر 48-72 ساعة للحصول على ثقافة تحتوي على أكثر من 90٪ من العضوية القمية. على الرغم من ميزتها المتمثلة في تمكين الوصول إلى سطح الخلية القمية ، إلا أن العضيات القمية تظهر انخفاضا كبيرا في الانتشار بعد انعكاس القطبية بينما تزداد معدلات موت الخلايابمقدار 13. يمكن أن يمثل عامل النشاط التكاثري متغيرا مربكا في التحليلات المختلفة ويجب أن يؤخذ في الاعتبار عند تصميم التجربة.
هنا ، نقدم بروتوكولا مفصلا لإنشاء الثقافات العضوية القمية المعوية وعضويات التحكم القاعدية العائمة لتحليلات المصب. علاوة على ذلك ، نصف وضع العلامات باستخدام 5-ethynyl-2'-deoxyuridine (EdU) ، المدمج في الحمض النووي المركب حديثا وبالتالي يشير إلى الخلايا المتكاثرة بنشاط. نصف أيضا تحليل الصور شبه التلقائي لمعدل تكاثر العضيات باستخدام برنامج arivis Pro (Zeiss) عن طريق القياس الكمي لخلايا EdU + . تم توضيح مخطط العملية في الشكل 1.
Protocol
تم استخدام العضيات المعوية المشتقة من الخلايا الجذعية البالغة من ، والتي تم إنشاؤها وفقا ل Kramer et al. ، 202014 . بناء على إرشادات لجنة الأخلاقيات المؤسسية ، يتم تضمين استخدام مواد الأنسجة التي تم جمعها أثناء الاستئصال العلاجي أو ما بعد الوفاة في "موافقة المالك على العلاج" للجامعة ، والتي تم توقيعها من قبل جميع مالكي المرضى.
1. الثقافة العضوية
- استزراع العضيات المعوية المشتقة من الخلايا الجذعية البالغة المضمنة في مصفوفة مستخلص الغشاء القاعدي (BME) المفضلة في ألواح مكونة من 24 بئرا وتقسيمها ميكانيكيا باستخدام ماصات زجاجية كما هو موضح بالتفصيل في Pleguezuelos et al. ، 202015.
ملاحظة: بالنسبة للبروتوكول الموضح هنا ، تم استخدام Geltrex كBME. - قم بإزالة الوسط المكرر بعناية (الجدول 1) من العضيات المضمنة في BME.
- أضف 500 ميكرولتر من 0.05٪ تريبسين-EDTA لكل بئر وافصل جميع قباب المصفوفة عن البئر عن طريق سحب العينات لأعلى ولأسفل بشكل متكرر. انقل العضيات إلى أنبوب سعة 15 مل وأعد تعليقها جيدا لفصل مصفوفة الهيدروجيل تماما.
- احتضان العضيات بنسبة 0.05٪ تريبسين-EDTA عند 37 درجة مئوية في حمام مائي حتى يتم تفكك جميع العضيات إلى خلايا مفردة أو مجموعات صغيرة من الخلايا.
- تمييع معلق التربسين / الخلية بالوسط القاعدي (الجدول 1). استخدم ما لا يقل عن ضعف الوسط القاعدي من التربسين.
- خلايا الطرد المركزي عند 8 درجات مئوية عند 420 × جم لمدة 5 دقائق. قم بإزالة أكبر قدر ممكن من المواد الطافية.
- خلايا البذور المضمنة في BME في العديد من الآبار التي تم استخدامها في التربسين في الخطوة 1.3. وتزويدهم بوسط مكرر (الجدول 1).
- احتضان الخلايا لمدة 3 أيام في حاضنة زراعة الخلايا والمضي قدما في الخطوة 2.1.
2. تحريض انعكاس القطبية ووضع العلامات على EdU
- قم بإزالة الوسيط بعناية من العضيات المضمنة في BME.
- أضف 500 ميكرولتر من محلول الحصاد العضوي إلى كل بئر وافصل جميع قباب المصفوفة عن البئر عن طريق سحب العينات لأعلى ولأسفل بشكل متكرر. انقل العضيات إلى أنبوب سعة 15 مل وأعد تعليقها جيدا لفصل مصفوفة الهيدروجيل تماما.
- احتضان الأنبوب سعة 15 مل على الجليد لمدة 1.5 ساعة. رج الأنبوب جيدا كل 10 دقائق لمنع تكتل العضيات وضمان تفكك متساو لمكونات الهيدروجيل المتبقية.
- أثناء الحضانة ، قم بتغطية لوح 96 بئرا بمحلول مضاد للالتصاق. لكل بئر من صفيحة 24 بئرا مدرجة في الخطوة 1.3 ، قم بتغطية 8 آبار من صفيحة 96 بئرا. احتضان لمدة 1 ساعة على الأقل في درجة حرارة الغرفة (RT).
- أضف ما لا يقل عن ضعف كمية PBS التي تم استخدامها في محلول الحصاد العضوي إلى أنبوب 15 مل وجهاز الطرد المركزي عند 8 درجات مئوية عند 150 × جم لمدة 5 دقائق.
- قم بإزالة المادة الطافية وإعادة تعليق العضيات في 1 مل من PBS.
- انقل 500 ميكرولتر من التعليق العضوي / PBS في أنبوب منفصل سعة 15 مل وقم بالطرد المركزي كلا الأنبوبين مرة أخرى عند 8 درجات مئوية عند 150 × جم لمدة 5 دقائق.
- قم بإزالة جميع المحلول المضاد للالتصاق من اللوحة المكونة من 96 بئرا.
- قم بإزالة أكبر قدر ممكن من المواد الطاففية بعد الطرد المركزي.
- استخدم أحد الأنابيب لتوليد العضيات القاعدية العائمة (BO) والأنبوب الآخر للعضيات القمية (AO).
- بالنسبة للعضيات BO ، أضف 100 ميكرولتر من الوسط المكرر الذي يحتوي على 7.5٪ BME لكل بئر من اللوحة المكونة من 96 بئرا إلى أنبوب واحد. تخلط جيدا وتفريق العضيات بالتساوي عبر العدد المطلوب من الآبار في الصفيحة المطلية مسبقا 96 بئرا.
- بالنسبة للعضيات AO ، أضف 100 ميكرولتر من الوسط المكرر العادي (دون إضافة أي BME) لكل بئر من اللوحة المكونة من 96 بئرا إلى الأنبوب الآخر. تخلط جيدا وتفريق العضيات بالتساوي عبر العدد المطلوب من الآبار في الصفيحة المطلية مسبقا 96 بئرا.
- احتضان العضيات عند 37 درجة مئوية و 5٪ ثاني أكسيد الكربون2 لمدة 3 أيام.
ملاحظة: ستبدأ الاختلافات المورفولوجية في الظهور بعد اليوم الأول. ومع ذلك ، تظهر النتائج المنشورة سابقا أن الغالبية العظمى من العضيات تستغرق حوالي 3 أيام لتقديم قطبية قمية13. - في نقاط زمنية محددة ، على سبيل المثال ، 24 ساعة / 48 ساعة / 72 ساعة بعد تحريض انعكاس القطبية ، أضف 50 ميكرولتر من 3 ميكرومتر EdU مخفف في وسط مكرر إلى جميع آبار العضيات المراد تصنيفها ، لتلقي تركيز نهائي قدره 1 ميكرومتر EdU في كل بئر.
- احتضان عند 37 درجة مئوية و 5٪ ثاني أكسيد الكربون2 لمدة 1.5 ساعة.
- اجمع العضيات التي تحمل علامة EdU باستخدام أطراف واسعة التجويف وانقلها إلى أنبوب سعة 15 مل.
- أضف كمية متساوية من 4٪ PFA إلى كل أنبوب (عضيات BO و AO ؛ التركيز النهائي ل PFA = 2٪) واخلطها بعناية.
- احتضن في RT لمدة 15 دقيقة.
- أضف ما لا يقل عن ضعف كمية PBS حيث يوجد حجم في أنبوب 15 مل وجهاز طرد مركزي عند 8 درجات مئوية عند 80 × جم لمدة 5 دقائق.
- قم بإزالة المادة الطافية وإعادة تعليق العضيات في 1 مل من PBS.
- جهاز الطرد المركزي مرة أخرى عند 8 درجات مئوية عند 80 × جم لمدة 5 دقائق.
- قم بإزالة المادة الطافية ، وأعد تعليق العضيات في 1 مل من PBS ، وانقلها إلى أنبوب سعة 1.5 مل. قم بتخزين العضيات في درجة حرارة 4 درجات مئوية حتى إجراء تفاعل تلطيخ EdU (انظر القسم 3).
- كرر الخطوات 2.14-2.22 لكل نقطة زمنية ليتم تحليلها.
3. انقر فوق تفاعل تلطيخ EdU وتلوين Hoechst 33342
- الطرد المركزي للعضيات الثابتة (من الخطوة 2.22.) في أنبوب 1.5 مل عند 4 درجات مئوية عند 50 × جم لمدة 5 دقائق.
- قم بإزالة المادة الطافية وإعادة تعليق العضيات في 1 مل من ألبومين مصل الأبقار 3٪ (BSA) المخفف في PBS باستخدام أطراف التجويف العريض.
- كرر الخطوات 3.1. و 3.2 (خطوات الغسيل).
- قم بإزالة المادة الطافية وإعادة تعليق العضيات في 1 مل من 0.5٪ Triton X-100 المخفف في PBS.
- احتضن في RT لمدة 20 دقيقة.
- عضيات الطرد المركزي عند RT عند 50 × جم لمدة 5 دقائق.
- في أنبوب جديد ، قم بإعداد 1x Buffer Addition عن طريق خلط 45 ميكرولتر من H2O مع 5 ميكرولتر من 10x Buffer Additive.
- في أنبوب آخر ، قم بإعداد كوكتيل التفاعل عن طريق خلط المكونات التالية: 385.8 ميكرولتر من H2O ، 43 ميكرولتر من 10x Reaction Buffer ، 20 ميكرولتر من CuSO4،1.2 ميكرولتر من Alexa Fluor 647 azide ، و 50 ميكرولتر o 1x Buffer Additive (من الخطوة 3.7.).
ملاحظة: هذا المزيج كاف لخمسة تفاعلات ويمكن توسيع نطاقه لأعلى ولأسفل وفقا للعدد المطلوب من تفاعلات التلوين. - كرر الخطوات 3.1. و 3.2. مرتين (خطوات الغسيل).
- قم بإزالة المادة الطافية وأضف 100 ميكرولتر من كوكتيل التفاعل (الخطوة 3.8.) في كل أنبوب به عضويات.
- احتضن في RT لمدة 30 دقيقة في الظلام.
- كرر الخطوات 3.1. و 3.2 (خطوات الغسيل).
- عضويات الطرد المركزي عند 50 × جم لمدة 5 دقائق في RT.
- أعد تعليق العضيات في 1 مل من 10 ميكروغرام / مل Hoechst33342 المخفف في PBS.
- احتضن في RT لمدة 45 دقيقة في الظلام.
- كرر الخطوات 3.1. و 3.2 (خطوات الغسيل).
- عضيات الطرد المركزي عند 50 × جم لمدة 5 دقائق عند 4 درجات مئوية.
- عضيات البذور في مصفوفة BME المختارة في شريحة متوافقة مع الفحص المجهري متحد البؤر (على سبيل المثال ، μ-Slide 18 جيدا)
- صورة العضيات تحت المجهر متحد البؤر.
4. تحليل الصور شبه التلقائي
ملاحظة: في هذا التحليل ، تم استخدام الإصدار 4.2.2 من arivis Pro (برنامج تحليل الصور).
- قم باستيراد صور المجهر متحد البؤر إلى برنامج تحليل الصور وحدد مجلدا سيتم حفظ ملف التحليل فيه. استخدم الخيار الصور كنقاط زمنية لاستيراد صور متعددة (نسخ الصور ، ونقاط زمنية مختلفة ، ومعالجات مختلفة ، وما إلى ذلك). سيتم بعد ذلك التعامل مع كل صورة كنقطة زمنية واحدة ، مما يتيح سهولة التبديل بين الصور الفردية.
- افتح لوحة التحليل واستورد مسار التحليل المتوفر كملف تكميلي 1 (arivis_EdU_pipeline).
- استخدم أداة Place New Objects وSphere مع العلامة Organoid لتطويق جميع العضويات المنفصلة جيدا بسهولة.
- قم بالتبديل إلى الصورة التالية ، أي النقطة الزمنية التالية ، وتابع وضع علامة على العضيات لجميع الصور.
- بالنسبة للعضيات القريبة جدا من بعضها البعض وبالتالي لا يمكن فصلها باستخدام وضع Sphere ، افتح قائمة الكائنات وقم بتنشيط العلامة Organoid.
- استمر في استخدام أداة رسم الكائنات في وضع المضلع لتمييز المخططات العضوية يدويا.
ملاحظة: في قائمة الكائنات، يتم الآن تمييز جميع العضويات وتعيينها إلى نقطة زمنية محددة. تتوافق هذه النقطة الزمنية مع ترتيب الصور المستوردة في الخطوة 4.1. يمكن الآن إعادة تسمية هذه النقاط الزمنية لمطابقة اسم الصورة الأصلي إذا كنت تفضل ذلك. - في قائمة الكائنات، ضع علامة على كل الكائنات (=العضيات) وانقر بزر الماوس الأيمن، ثم انقر على إزالة العلامات لإزالة العلامة يدوية من جميع الكائنات.
- قم بإلغاء تنشيط علامة Organoid في قائمة الكائنات وقم بتمييز جميع المناطق داخل الكائنات المحددة مسبقا والتي يجب استبعادها من التحليل باستخدام أداة رسم الكائنات في وضع المضلع . قد تشمل هذه المناطق خلايا ميتة داخل التجويف العضوي أو المناطق الضبابية ، مما قد يؤدي إلى انحراف التحليل.
- عند فتح قائمة الكائنات، تأكد من إدراج جميع المواد العضوية بعلامة Organoid وأن جميع المناطق التي يجب استبعادها تحتوي على العلامة Manual.
- ابدأ مسار التحليل بالنقر فوق السهم الموجود في اللوحة العلوية اليمنى.
ملاحظة: يقوم البرنامج الآن بتقسيم جميع النوى في قنوات Hoechst33342 و EdU. يأخذ خط أنابيب التحليل هذا في الاعتبار فقط نوى Hoechst33342+ و EdU + المجزأة التي يزيد حجمها عن 15 ميكرومترمربع (أي المساحة الموجودة في جزء النواة) لضمان استبعاد النوى الصغيرة ، التي تنشأ على الأرجح من الخلايا الميتة ، من التحليل. - ابحث عن نتائج التحليل في قائمة الكائنات بالنقر فوق علامة أعمدة المعالم .
- قم بالتبديل إلى طريقة عرض التفاصيل الرئيسية وحدد علامة Organoids في اللوحة العلوية والميزة النقطة الزمنية الأولى.
- في اللوحة السفلية، حدد الميزات المراد عرضها لكل مادة عضوية. استخدم منطقة الإسقاط (x / y / z) (voxel) ، ومتوسط الكثافة # 1 (قناة EdU) ، وشدة SD # 1.
- تصدير النتائج (تقرير التفاصيل الرئيسية) باستخدام وظيفة Excel Export .
- احفظ ملف التحليل وأغلق البرنامج.
5. تحديد معدلات الانتشار العضوي
- افتح ملف تقرير التفاصيل الرئيسية الذي تم تصديره في الخطوة 4.14.
- هناك علامة تبويب واحدة منفصلة لكل صورة تم تحليلها. احسب مجموع المساحة / فوكسل للنوى وصمة عار EdU لكل صورة. بعد ذلك ، انسخ جميع البيانات الناتجة في علامة تبويب جماعية جديدة وقم بتجميع جميع البيانات التي تشير إلى نفس النقطة الزمنية.
- بعد ذلك ، احسب المساحة الإجمالية لنوى الخلية (أي مجموع منطقة Hoechst33342+ ومنطقة EdU + ) لكل صورة.
- بعد ذلك ، قسم المساحة الإجمالية على نفسها (= 100٪) ومتوسط مساحة EdU + على المساحة الإجمالية (= النسبة المئوية ل EdU + DNA).
- ارسم النسبة المئوية للحمض النووي التكاثري للعضيات BO و AO على المحور y والنقاط الزمنية المختلفة على المحور x.
النتائج
يجب أن تكون العضيات المزروعة لمدة 3 أيام بعد التربسين بين 50-250 ميكرومتر ، كما هو موضح في الشكل 2أ. قد لا تعكس العضيات الأكبر بكثير من ذلك قطبيتها بكفاءة. قد تبدأ العضيات الأكبر حجما أيضا في التبرعم ، وقد لاحظنا أن هذه العضيات يمكن أن تواجه مشاكل في انعكاس القطبية الفعال أيضا. تقدم العضيات القاعدية والقمية اختلافات مورفولوجية واضحة بالفعل في تصوير المجال الساطع. بينما تحتفظ العضيات القاعدية بالتجويف الكبير (الشكل 2ب) بعد 3 أيام من ثقافة التعليق ، تبدو العضيات القمية (الشكل 2ج) أكثر إحكاما. ميزة محددة للغاية لثقافات التعليق القمي هي عدد الخلايا الميتة التي تطفو حول العضيات. ويرجع ذلك إلى بثق الخلايا العضوية القمية للخارج الخلايا المتمايزة والميتة في الوسط المحيط ، بينما تتراكم العضيات القاعدية الخلايا الميتة في التجويف العضوي.
يمكن تصوير العضيات المعوية التي أدرجت EdU في الحمض النووي المركب حديثا قبل انقسام الخلية باستخدام مجهر متحد البؤر. تظهر العضيات القاعدية إشارات EdU أعلى بكثير بمرور الوقت من نظيراتها القمية (الشكل 3). من المهم ملاحظة أنه لا تظهر جميع العضيات خلايا EdU + على الرغم من نموها في الحجم. ويرجع ذلك إلى عدم وجود خلايا EdU + في طبقة التصوير المحددة.
يمكن تحليل هذه الصور متحدة البؤر كميا باستخدام برنامج تحليل الصور وخط أنابيب التحليل المقدم (الملف التكميلي 1). أثناء تنفيذ بروتوكول التحليل ، يجب أولا تطويق العضيات (الشكل 4أ) قبل استبعاد مناطق معينة من التحليل الفعلي (الشكل 4ب). قد تشير مناطق الاستبعاد هذه إلى الخلايا الميتة داخل التجويف العضوي ، والتي لا تهم القياس الكمي لإشارات EdU. يؤدي التنفيذ اللاحق لخط أنابيب التحليل التلقائي إلى تجزئة جميع النوى المكتشفة ، والتمييز بين نوى Hoechst33342+ و EdU + . بالإضافة إلى ذلك ، يتم استبعاد جميع النوى التي تقل عن قطع 15 ميكرومتر2 لأنها على الأرجح خلايا ميتة أو نوى لا تظهر بالكامل في طبقة الصورة هذه (الشكل 4ج).
بعد تحليل الصور باستخدام البرنامج وتصدير قياسات القياس الكمي ، يتم حساب هذه البيانات بشكل أكبر لتحليل النسبة المئوية لإشارة EdU + من الكتلة الكلية للحمض النووي (الشكل 5). في الحالة المعروضة في هذه المخطوطة ، تظهر العضيات المعوية القمية مستويات منخفضة بشكل كبير من التكاثر مقارنة بالعضيات القاعدية العائمة.

الشكل 1: نظرة عامة تخطيطية على البروتوكول الموصوف. يتضمن التخطيطي زراعة العضيات ، وتحريض انعكاس القطبية ، ووضع العلامات على EdU ، وتحليل الصور شبه التلقائي. الشكل الذي تم إنشاؤه باستخدام Biorender.com. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
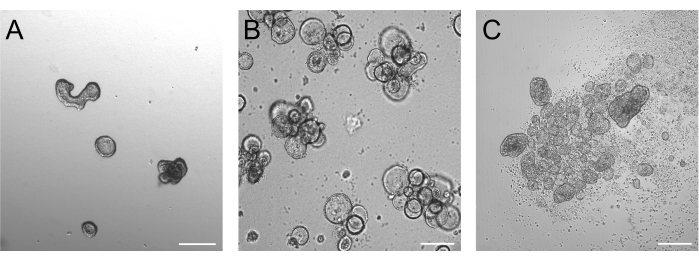
الشكل 2: العضيات قبل وبعد تحريض انعكاس القطبية. (أ) العضيات المعوية المضمنة في المصفوفة بعد ثلاثة أيام من زرع الخلايا المكرونة بالتربسين في وسط النمو. (ب) العضيات القاعدية العائمة بعد ثلاثة أيام من البذر في ثقافة المعلقة. (ج) العضيات القمية بعد 3 أيام من البذر في ثقافة التعليق بدون BME لتحريض انعكاس القطبية. شريط المقياس = 200 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
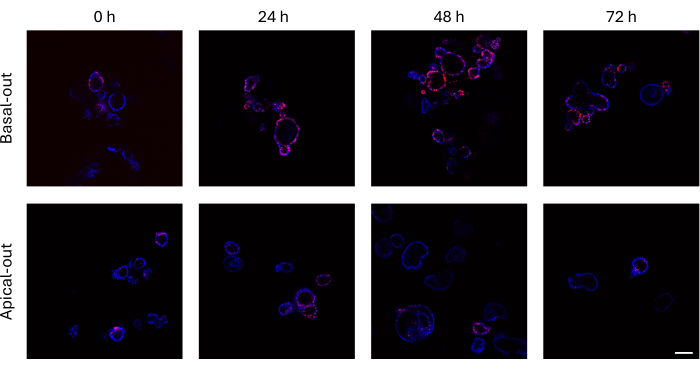
الشكل 3: العضيات المعوية القاعدية والقمية المسماة ب EdU. تقدم اللوحة العلوية التي تصور صورا متحدة البؤر للعضيات القاعدية بمرور الوقت العديد من خلايا EdU + مقارنة بالعضيات القمية (اللوحة السفلية) في نفس النقاط الزمنية. شريط المقياس = 100 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: تحليل الصور الكمي للعضيات المعوية الملطخة ب EdU. (أ) العضيات المحيطة باستخدام الوضعين Sphere و Polygon . (ب) تم تمييز المنطقة المراد استبعادها من التحليل باللون الأبيض (يشار إليها بالسهم). تشير هذه المنطقة إلى التجويف العضوي ، الذي يحتوي على عدد من الخلايا الميتة ، والتي سيتم استبعادها من التحليل اللاحق. (ج) تظهر الصورة بعد التحليل جميع النوى المجزأة. يتم تمييز Hoechst33342 + النوى باللون السماوي ، ويتم تمييز نوى EdU + باللون الأصفر ، ويتم تمييز النوى التي لا تصل إلى 15 ميكرومتر2 باللون الأخضر (Hoechst33342) والبرتقالي (EdU). شريط المقياس = 50 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 5: معدل الانتشار العضوي. النسبة المئوية للحمض النووي EdU + من إجمالي الحمض النووي التي تعمل كوكيل لمعدل التكاثر العضوي التي تظهر انتشارا أعلى في العضيات القاعدية مقارنة بالعضيات القمية. يتم تقديم البيانات على أنها متوسط التسويق عبر محرك البحث. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
| متوسطة قاعدية | |
| مكونات الوسائط | التركيز النهائي |
| DMEM-F12 | |
| مكمل بنسلين ستربتومايسين 100X للوسائط | 1x |
| مكمل GlutaMAX | 2 مللي |
| محلول عازلة HEPES 1 متر ، سائل | 10 ملم |
| متوسط مكرر | |
| مكمل B27 SerumFree (50x) ، سائل | 1x |
| N-Acetyl-L-cysteine ، تم اختبار زراعة الخلايا | 1 ملي متر |
| [Leu15] - Gastrin I الإنسان | 10 نانومتر |
| أ 83-01 | 500 نانومتر |
| HGF البشري | 50 نانوغرام / مل |
| نوجين البشري (الثدييات) | 100 نانوغرام / مل |
| منتدى إدارة الإنترنت البشري | 100 نانوغرام / مل |
| FGF البشري الأساسي | 50 نانوغرام / مل |
| R-Spondin وسط مكيف | 10 ٪ (حجم حجمي) |
| Wnt-3a وسط مكيف | 50 ٪ (حجم حجمي) |
| متوسطة قاعدية | الحجم المتبقي لتخفيف عوامل النمو المذكورة أعلاه / الوسط المكيف |
الجدول 1: تكوين الوسائط القاعدية والمكررة.
Discussion
يصف هذا البروتوكول بالتفصيل كيفية إحداث انعكاس القطبية في المزارع العضوية المعوية القياسية المشتقة من الخلايا الجذعية البالغة. تخدم العضيات القمية الغرض من الوصول إلى سطح الخلية القمية ، والتي عادة ما تكون موجهة نحو التجويف العضوي. يمكن أن تكون القدرة على فحص السطح القمي ذات أهمية كبيرة لتطبيقات معينة لأن هذا هو جزء غشاء الخلية الذي يتعرض لجميع محتويات الجهاز الهضمي في ظل الظروف الفسيولوجية في الجسم الحي. الطرق الأخرى لتحدي السطح القمي على وجه التحديد هي الحقنالمجهري 16 ، واستخدام الطبقات الأحادية المشتقة من العضوية17 ، والتجزئة العضوية18. ومع ذلك ، فإن كل طريقة من هذه الطرق لها عيوب وعيوب محددة ، حيث قمنا نحن وآخرون بمراجعة أكثر تفصيلا سابقا19,20.
تتميز طريقة توليد العضيات القمية بالعديد من المزايا: 1) يعد توليد العضيات القمية أمرا سهلا نسبيا مقارنة بالطرق الأخرى ولا يتطلب أي أجهزة أو معدات متخصصة. لذلك ، فإن العضيات القمية هي طريقة فعالة من حيث التكلفة للوصول إلى سطح الخلية القمية. 2) يمكن استزراع العضيات القاعدية العائمة بالتوازي واستخدامها كعضيات تحكم ذات مغزى ، خاصة لتحليل التأثيرات الخاصة بالقطبية ؛ 3) يمكن أن تخضع عضيات BO و AO العائمة لتطبيقات المصب القياسية كما يتضح من دمج EdU في هذا التقرير ولكن أيضا التلوين الكيميائي المناعي (النسيجي) بالإضافة إلى المقايسات القائمة على اللمعان والفلورة كما تم الإبلاغ عنه سابقا13 والتصوير المباشر للخلاياالحية 12. تسمح التحليلات النهائية ، مثل تحليل دمج EdU أو البقع الكيميائية المناعية (النسيجية) ، أيضا ببعض المرونة من حيث الوقت ، حيث يمكن تخزين العضيات عند 4 درجات مئوية حتى الاستخدام الآخر.
على الرغم من سهولة انعكاس القطبية ، إلا أن هناك بعض النقاط الحرجة في بروتوكولنا التي يجب مراعاتها عند تطبيق هذه الطريقة. أولا ، العضيات المستخدمة في الخطوة 2.1. يجب أن يكون بحجم معين. في تجربتنا ، فإن استخدام العضيات بعد 3 أيام من التربسين يعمل بشكل جيد. ومع ذلك ، قد تختلف هذه المرة باختلاف عضويات الأخرى بسبب الاختلافات في تكاثر الخلايا أو اعتمادا على كثافة البذر لمجموعات الخلية الواحدة. علاوة على ذلك ، فإن تفكك BME باستخدام محلول الحصاد العضوي تدريجي. كما وصفه Co et al. ، 20199 ، قد تكون تركيزات BME المنخفضة التي تصل إلى 2.5٪ كافية للحفاظ على العضيات في مورفولوجيا قاعدية في ثقافة التعليق. لذلك ، يجب إزالة أكبر قدر ممكن من BME لضمان انعكاس القطبية بكفاءة. نقطة أخرى مهمة هي الاستخدام الصحيح لألواح زراعة الأنسجة غير المعالجة لتقليل الارتباط العضوي أثناء ثقافة التعليق. في تجربتنا ، تتيح الألواح المسبقة المصنوعة من محلول مضاد للالتصاق (الخطوة 2.4) استخدام أي لوحة تقريبا لثقافة العضيات القمية. ومع ذلك ، يمكن استكشاف خيارات أخرى تجعل ألواح الطلاء المسبق زائدة عن الحاجة.
تصبح أهمية تقييم التأثيرات على سطح الخلية القاعدية والقمية للخلايا الظهارية المستقطبة واضحة في كثير من الحالات. على سبيل المثال ، قمنا سابقا بتحليل تأثيرات سموم البكتيريا اللاهوائية Clostridioides difficile على عضويات BO و AO. تظهر نتائج هذه الدراسة أن المطثية العسيرة السم B (TcdB) تلحق الضرر فقط بسلامة الحاجز الظهاري المعوي في عضيات BO في الأمعاء الدقيقة ولكن ليس في عضيات AO. تسلط العديد من التقارير الأخرى التي تظهر تفاعلات خاصة بالمجال لمختلف الكائنات الحية الدقيقة المسببة للأمراض الضوء على أهمية تقييم جانبي الخلايا الظهارية9،16،21،22،23،24،25.
أحد العوائق الرئيسية للعضيات القمية هو سلوكها المتغير فيما يتعلق بتكاثر الخلايا. كما هو موضح أعلاه ، تظهر عضيات AO معدلات انخفاضا كبيرا في تكاثر الخلايا مقارنة بنظيراتها من BO. لقد أبلغنا سابقا أن هذا النقص في الانتشار يسير جنبا إلى جنب مع زيادة طفيفة في مستويات موت الخلايا13. في النهاية ، هذا لا يسمح بثقافة طويلة الأمد للعضيات AO ما لم يتم العثور على طريقة لإطالة عمر عضيات AO ومع ذلك ، فإننا نعتبر أن عضيات AO أداة مفيدة للغاية للوصول بسهولة إلى سطح الخلية القمية طالما أن الباحثين حريصون على الاستنتاجات التي قد تتأثر بانخفاض تكاثر الخلايا.
Disclosures
ويعلن أصحاب البلاغ عدم وجود تضارب في المصالح.
Acknowledgements
تم دعم هذا البحث باستخدام موارد مرفق VetImaging الأساسي (VetCore ، Vetmeduni ، النمسا). نود أن نشكر أورسولا ريشارت على دعمها في تحليل الصور شبه الكمي. حصلت GC على زمالة DOC (رقم المنحة 26349) من الأكاديمية النمساوية للعلوم (ÖAW) في قسم الطب الباطني للحيوانات الصغيرة في Vetmeduni.
Materials
| Name | Company | Catalog Number | Comments |
| 24 well plates | Biologix | 07-6024 | |
| [Leu15]-Gastrin I human, ≥95% (HPLC) | Sigma-Aldrich | G-9145 | |
| µ-Slide 18 Well Glass Bottom | ibidi | 81817 | |
| 100X Penicillin-Streptomycin supplement for Media | Gibco/Thermo | 15140122 | |
| A 83-01 | Tocris Bioscience | 2939/10 | |
| Anti-Adherence Rinsing Solution | StemCell Technologies | 7010 | |
| arivis Pro | Zeiss | Version 4.2.2 | |
| B27 SerumFree Supplement (50X), liquid | Gibco/Thermo | 17504044 | |
| Bisbenzimide H 33342 (Hoechst 33342) | Abcam | ab145597 | |
| Bovine Serum Albumin | Sigma-Aldrich | A7906-100G | |
| Click-iT EdU Cell Proliferation Kit for Imaging, Alexa Fluor 647 dye | Thermo Scientific | C10340 | |
| DMEM-F12 | Gibco/Thermo | 11320033 | |
| Geltrex | Gibco/Thermo | A1413202 | |
| GlutaMAX Supplement | Gibco/Thermo | 35050061 | |
| HEPES Buffer Solution 1 M, liquid | Gibco/Thermo | 15630056 | |
| Human FGF-basic | PeproTech | 100-18B-100µG | |
| Human HGF | PeproTech | 100-39-100µG | |
| Human IGF-I | PeproTech | 100-11-100µG | |
| Human NOGGIN (Mammalian) | PeproTech | 120-10C-200µG | |
| N-Acetyl-L-cysteine,cell culture tested, BioReagent | Sigma-Aldrich | A9165-5G | |
| Organoid Harvesting Solution | Thermo | C10340 | |
| Triton(TM) X-100,for molecular biology | Sigma-Aldrich | T8787-250ML | |
| Trypsin-EDTA (0.05%), phenol red | Gibco/Thermo | 25300054 |
References
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459, 262-265 (2009).
- Li, Y., et al. BMP suppresses Wnt signaling via the Bcl11b-regulated NuRD complex to maintain intestinal stem cells. EMBO J. 43 (23), 6032-6051 (2024).
- Gaowa, A., Leangpanich, S., Park, E. J., Kawamoto, E., Shimaoka, M. Irisin promotes intestinal epithelial cell proliferation via Wnt/β-catenin and focal adhesion kinase signaling pathways. Sci Rep. 14, 25702(2024).
- Basak, O., et al. Induced quiescence of Lgr5+ stem cells in intestinal organoids enables differentiation of hormone-producing enteroendocrine cells. Cell Stem Cell. 20 (2), 177-190 (2017).
- Ludikhuize, M. C., et al. Mitochondria define intestinal stem cell differentiation downstream of a FOXO/Notch axis. Cell Metab. 32 (5), 889-900.e7 (2020).
- Ettayebi, K., et al. Replication of human noroviruses in stem cell-derived human enteroids. Science (1979). 353 (6306), 1387-1393 (2016).
- Zhou, J., et al. Infection of bat and human intestinal organoids by SARS-CoV-2. Nat Med. 26 (7), 1077-1083 (2020).
- Joo, S. -S., et al. Porcine intestinal apical-out organoid model for gut function study. Animals. 12 (3), 372(2022).
- Co, J. Y., et al. Controlling epithelial polarity: A human enteroid model for host-pathogen interactions. Cell Rep. 26, 2509-2520.e4 (2019).
- Sasaki, N., et al. Development of a scalable coculture system for gut anaerobes and human colon epithelium. Gastroenterology. 159 (1), 388-390.e5 (2020).
- Mayorgas, A., et al. A novel strategy to study the invasive capability of adherent-invasive escherichia coli by using human primary organoid-derived epithelial monolayers. Front Immunol. 12, 646906(2021).
- Csukovich, G., et al. Neutralising effects of different antibodies on clostridioides difficile toxins TcdA and TcdB in a translational approach. Int J Mol Sci. 24 (4), 3867(2023).
- Csukovich, G., et al. Polarity reversal of canine intestinal organoids reduces proliferation and increases cell death. Cell Prolif. 57 (2), e13544(2023).
- Kramer, N., et al. Generation of differentiating and long-living intestinal organoids reflecting the cellular diversity of canine intestine. Cells. 9 (4), 822(2020).
- Pleguezuelos-Manzano, C., et al. Establishment and culture of human intestinal organoids derived from adult stem cells. Curr Protoc Immunol. 130 (1), e106(2020).
- Dutta, D., Heo, I., O'Connor, R. Studying infection in 3D tissue-derived human organoid culture systems by microinjection. J Vis Exp. (151), e59610(2019).
- Kumar, A., et al. Decreased SLC26A3 expression and function in intestinal epithelial cells in response to Cryptosporidium parvum infection. Am J Physiol Cell Physiol. 317 (6), C1205-C1212 (2019).
- Dutta, D., Clevers, H. Organoid culture systems to study host-pathogen interactions. Curr Opin Immunol. 48, 15-22 (2017).
- Csukovich, G., Pratscher, B., Burgener, I. A. The world of organoids: Gastrointestinal disease modelling in the age of 3R and one health with specific relevance to dogs and cats. Animals. 12 (18), 2461(2022).
- Han, X., et al. Creating a more perfect union: Modeling intestinal bacteria-epithelial interactions using organoids. Cell Mol Gastroenterol Hepatol. 12 (2), 769-782 (2021).
- Li, Y., et al. Next-generation porcine intestinal organoids: an apical-out organoid model for swine enteric virus infection and immune response investigations. J Virol. 94 (21), e01006-e01020 (2020).
- Smith, D., et al. The development of ovine gastric and intestinal organoids for studying ruminant host-pathogen interactions. Front Cell Infect Microbiol. 11, 733811(2021).
- Nash, T. J., Morris, K. M., Mabbott, N. A., Vervelde, L. Inside-out chicken enteroids with leukocyte component as a model to study host-pathogen interactions. Commun Biol. 4 (1), 377(2021).
- Hanson, K. I., Weiss, A. A. Intestinal tissue response to Shiga toxin exposure. mBio. 15 (9), e0123224(2024).
- Hovhannisyan, P., et al. Infection of human organoids supports an intestinal niche for Chlamydia trachomatis. PLoS Pathog. 20 (8), e1012144(2024).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved