Method Article
使用 EdU 标记生成顶端外肠类器官并评估类器官增殖率
摘要
在这里,我们描述了一种从标准基质包埋的类器官培养物中生成顶端肠类器官的方案。它还概述了随后将 EdU 掺入活跃增殖的细胞中以及 EdU 阳性细胞的半自动定量。
摘要
在这里,我们描述了从水凝胶包埋的肠道类器官培养物中产生顶端肠类器官的漂浮培养物。同时,建立漂浮的基底类器官培养物,用于根尖和基底类器官之间的直接比较。随后,顶端和基底外类器官经受胸苷类似物 5-乙炔基-2'-脱氧尿嘧啶 (EdU) 的影响,该类似物在细胞分裂的 S 期整合到新合成的 DNA 中。这种掺入 DNA 的过程可以使用激光扫描共聚焦显微镜在形态完整的类器官中进行可视化。然后使用图像分析软件以半自动方式定量用 Hoechst33342 和 EdU 标记的细胞。计算 EdU 阳性细胞占细胞总数的百分比,可以分析三维 (3D) 类器官中的细胞增殖。尽管此处用于分析肠道类器官中的增殖,但该方案也适用于分析其他类器官或二维细胞培养物中各种细胞核特异性染色。
引言
肠道类器官是三维体外模型,概括了包含不同细胞类型的肠上皮细胞。这些类器官可以很容易地从从肠隐窝分离的成体干细胞中建立1。由于类器官更接近体内上皮,因此它们在生物医学研究中变得越来越重要。肠道类器官不仅用于分析生理机制(例如,肠道生态位信号传导 2,3 和细胞分化 4,5),还用于传染病研究 6,7。然而,在包围中央腔的 3D 极化细胞中生长是具有挑战性的,因为顶端细胞表面最终无法进入类器官腔。检查顶端和基底外侧细胞表面之间的差异在代谢研究中可能很重要,脂肪酸摄取 8 和传染病研究的差异 9,10,11,12 就是例证。
产生所谓的顶端类器官是克服这个问题的简单选择。通过从标准类器官培养物(即基底、基质包埋的类器官)中去除细胞外基质,并将这些类器官接种在无基质培养基中,可以诱导极性转换9。
正如我们之前发表的,大多数类器官在 12 小时内反转了它们的极性。然而,需要 48-72 小时才能获得超过 90% 顶端类器官的培养物。尽管它们具有能够进入顶端细胞表面的优势,但顶端外的类器官在极性反转后增殖显著减少,而细胞死亡率增加13。增殖活性因子在各种分析中可能代表一个混杂变量,在设计实验时应牢记这一点。
在这里,我们提出了一个详细的方案,用于建立肠道顶端外类器官培养物和浮动基底外对照类器官用于下游分析。此外,我们描述了用 5-乙炔基-2'-脱氧尿嘧啶 (EdU) 进行标记,掺入新合成的 DNA 中,从而标记活跃增殖的细胞。我们进一步描述了使用软件 arivis Pro (Zeiss) 通过定量 EdU + 细胞对类器官增殖速率进行半自动图像分析。 图 1 概述了该过程的示意图。
研究方案
使用根据 Kramer 等人,202014 建立的来自狗的成体干细胞衍生的肠道类器官。根据机构伦理委员会的指导方针,使用在治疗性切除或尸检期间收集的组织材料包含在大学的“所有者治疗同意书”中,该同意书由所有患者所有者签署。
1. 类器官培养
- 在 24 孔板中选择的基底膜提取物 (BME) 基质中培养成体干细胞衍生的肠道类器官,并使用玻璃移液器机械分离它们,如 Pleguezuelos等人,2020 年15 月详细描述。
注:对于此处描述的方案,使用 Geltrex 作为 BME。 - 小心地从 BME 包埋的类器官中取出精制培养基(表 1)。
- 每孔加入 500 μL 0.05% 胰蛋白酶-EDTA,并通过反复上下吹打从孔中分离所有基质圆顶。将类器官转移到 15 mL 试管中并充分重悬以完全解离水凝胶基质。
- 将类器官与 0.05% 胰蛋白酶-EDTA 在 37 °C 下在水浴中孵育,直到所有类器官解离成单个细胞或小细胞簇。
- 用基础培养基稀释胰蛋白酶/细胞悬液(表 1)。使用至少两倍于胰蛋白酶的基础培养基。
- 将细胞在 8 °C 下以 420 × g 离心 5 分钟。去除尽可能多的上清液。
- 种子细胞包埋在 BME 中的孔中,与步骤 1.3 中用于胰蛋白酶消化的孔一样多。并为它们提供精制培养基(表 1)。
- 在细胞培养箱中孵育细胞 3 天,然后继续执行步骤 2.1。
2. 诱导极性反转和 EdU 标记
- 小心地从 BME 包埋的类器官中取出培养基。
- 向每个孔中加入 500 μL 类器官收获溶液,并通过反复上下吹打从孔中分离所有基质圆顶。将类器官转移到 15 mL 试管中并充分重悬以完全解离水凝胶基质。
- 将 15 mL 试管在冰上孵育 1.5 小时。每 10 分钟摇匀试管,以防止类器官结块并确保剩余水凝胶成分均匀解离。
- 在孵育过程中,用抗粘附溶液包被 96 孔板。对于在步骤 1.3 中胰蛋白酶消化的 24 孔板的每个孔,包被 96 孔板的 8 个孔。在室温 (RT) 下孵育至少 1 小时。
- 向 15 mL 试管中加入至少两倍于类器官收获溶液的 PBS,并在 8 °C 下以 150 × g 离心 5 分钟。
- 去除上清液并将类器官重悬于 1 mL PBS 中。
- 将 500 μL 类器官/PBS 悬浮液转移到单独的 15 mL 试管中,并在 8 °C 下以 150 × g 再次离心两支试管 5 分钟。
- 从 96 孔板中取出所有抗粘附溶液。
- 离心后尽可能多地去除上清液。
- 使用其中一根管子生成浮动基底 (BO) 类器官,使用另一根管子生成顶端输出 (AO) 类器官。
- 对于 BO 类器官,将 100 μL 每 96 孔板含有 7.5% BME 的精制培养基添加到一个试管中。充分混合并将类器官均匀分散在预包被的 96 孔板的所需孔数中。
- 对于 AO 类器官,将 96 孔板的每孔添加 100 μL 普通精制培养基(未添加任何 BME)到另一根试管中。充分混合并将类器官均匀分散在预包被的 96 孔板的所需孔数中。
- 将类器官在 37 °C 和 5% CO2 下孵育 3 天。
注意:第 1 天后,形态差异将开始可见。然而,之前发表的结果表明,绝大多数类器官大约需要 3 天才能呈现顶端输出极性13。 - 在确定的时间点,例如,诱导极性反转后 24 小时/48 小时/72 小时,将 50 μL 在精制培养基中稀释的 3 μM EdU 添加到待标记的类器官的所有孔中,在每个孔中获得 1 μM EdU 的最终浓度。
- 在 37 °C 和 5% CO2 下孵育 1.5 小时。
- 使用宽口径吸头收集 EdU 标记的类器官,并将其转移到 15 mL 试管中。
- 向每个试管中加入等量的 4% PFA(BO 和 AO 类器官;PFA 的最终浓度 = 2%)并小心混合。
- 在 RT 孵育 15 分钟。
- 添加至少两倍于 15 mL 试管体积的 PBS,并在 8 °C 下以 80 × g 离心 5 分钟。
- 去除上清液并将类器官重悬于 1 mL PBS 中。
- 在 8 °C 下以 80 × g 再次离心 5 分钟。
- 去除上清液,将类器官重悬于 1 mL PBS 中,然后转移到 1.5 mL 试管中。将类器官储存在4°C,直到进行EdU染色反应(参见第3节)。
- 对要分析的每个时间点重复步骤 2.14-2.22。
3. Click-it EdU 染色反应和 Hoechst 33342 染色
- 将固定的类器官(来自步骤 2.22.)在 1.5 mL 管中于 4 °C 以 50 × g 离心 5 分钟。
- 去除上清液,并使用大口径吸头将类器官重悬于 1 mL 用 PBS 稀释的 3% 牛血清白蛋白 (BSA) 中。
- 重复步骤 3.1。和 3.2(洗涤步骤)。
- 去除上清液,将类器官重悬于 1 mL 用 PBS 稀释的 0.5% Triton X-100 中。
- 在 RT 孵育 20 分钟。
- 在 RT 下以 50 × g 离心类器官 5 分钟。
- 在新鲜试管中,通过将 45 μL H2O 与 5 μL 10x 缓冲液添加剂混合来制备 1x 缓冲液添加剂。
- 在另一个试管中,通过混合以下组分来制备反应混合物:385.8 μL H2O、43 μL 10x 反应缓冲液、20 μL CuSO、4.1.2 μL Alexa Fluor 647 叠氮化物和 50 μL o 1x 缓冲液添加剂(来自步骤 3.7)。
注:该混合物足以进行 5 次反应,并且可以根据所需的染色反应次数按比例放大和缩小。 - 重复步骤 3.1。和 3.2.两次(洗涤步骤)。
- 去除上清液,将 100 μL 反应混合物(步骤 3.8)加入每个装有类器官的试管中。
- 在 RT 下避光孵育 30 分钟。
- 重复步骤 3.1。和 3.2(洗涤步骤)。
- 在 RT 下以 50 × g 离心类器官 5 分钟。
- 将类器官重悬于 1 mL 用 PBS 稀释的 10 μg/mL Hoechst33342 中。
- 在 RT 下在黑暗中孵育 45 分钟。
- 重复步骤 3.1。和 3.2(洗涤步骤)。
- 在 4 °C 下以 50 × g 离心类器官 5 分钟。
- 将所选 BME 基质中的类器官接种到与共聚焦显微镜兼容的载玻片中(例如,μ-Slide 18 孔)
- 在共聚焦显微镜下对类器官进行成像。
4. 半自动图像分析
注意:对于此分析,使用了 arivis Pro 版本 4.2.2(图像分析软件)。
- 将共聚焦显微镜图像导入图像分析软件,并定义一个文件夹,分析文件将保存到该文件夹中。使用选项 图像作为时间点 导入多个图像(复制图片、不同的时间点、不同的处理等)。然后,每张图像将被视为一个时间点,从而可以在各个图像之间轻松切换。
- 打开分析面板并导入作为 补充文件 1 (arivis_EdU_pipeline) 提供的分析管道。
- 使用 Place New Objects 工具和带有标签 Organoid 的 Sphere 轻松包围所有分离良好的类器官。
- 切换到下一个图像,即下一个时间点,然后继续标记所有图像的类器官。
- 对于彼此非常接近且因此无法使用 Sphere 模式分离的类器官,请打开对象列表并激活标签 Organoid。
- 在 Polygon 模式下继续使用 Draw Objects 工具手动标记类器官轮廓。
注意:在对象列表中,所有类器官现在都被标记并分配到特定时间点。该时间点与步骤 4.1 中导入的图片顺序相对应。现在,如果愿意,可以重命名这些时间点以匹配原始映像名称。 - 在对象列表中,标记所有对象 (=organoids) 并右键单击,然后单击 Remove Tags 以从所有对象中删除 Manual 标签。
- 停用对象列表中的 Organoid 标签,并在多边形模式下使用 Draw Objects 工具标记先前定义的对象中应从分析中排除的所有区域。这些区域可能包括类器官腔内的死细胞或模糊区域,这可能会使分析产生偏差。
- 打开对象列表时,确保所有类器官都带有 Organoid 标签,并且所有应排除的区域都带有 Manual 标签。
- 通过单击左上方面板中的箭头启动分析管道。
注意:该软件现在可以分割 Hoechst33342 和 EdU 通道中的所有细胞核。该分析流程仅考虑大于 15 μm2 的分段 Hoechst33342+ 和 EdU + 细胞核(即细胞核段中的面积),以确保从分析中排除最可能来自死细胞的小细胞核。 - 通过单击 Feature Columns 标签,在对象列表中查找分析结果。
- 切换到 Master Detail View 并选择上部面板中的 Organoids 标签和功能 First Timepoint。
- 在下部面板中,选择要按类器官显示的特征。使用 投影 (x/y/z)、面积(体素)、平均强度 # 1(EdU 通道)和 SD 强度 #1。
- 使用 Excel Export 功能导出结果(主从报告)。
- 保存分析文件并关闭软件。
5. 类器官增殖率的测定
- 打开在步骤 4.14 中导出的 Master Detail Report 文件。
- 每个分析的图像都有一个单独的选项卡。计算每个图像的细胞核和 EdU 染色的面积/体素和。然后,将所有结果数据复制到新的集体选项卡中,并将引用同一时间点的所有数据分组。
- 然后,计算每个图像的细胞核总面积(即 Hoechst33342 + 面积和 EdU + 面积之和)。
- 随后,将总面积除以自身 (= 100%),将平均 EdU + 面积除以总面积 (= EdU + DNA 的百分比)。
- 在 y 轴上绘制 BO 和 AO 类器官的增殖 DNA 的百分比,在 x 轴上绘制不同的时间点。
结果
胰蛋白酶消化后生长 3 天的类器官理想情况下应在 50-250 μm 之间,如图 2A 所示。比这大得多的类器官可能无法有效地反转它们的极性。较大的类器官也可能开始出芽,我们注意到这些类器官也可能存在有效极性反转的问题。基底和顶端外类器官在明场成像中已经呈现出明显的形态差异。虽然基础类器官在悬浮培养 3 天后仍保留其大腔(图 2B),但顶端类器官(图 2C)似乎更紧凑。顶端分离悬浮培养物的一个非常具体的特征是漂浮在类器官周围的死细胞数量。这是由于顶端外的类器官将终末分化的死细胞挤出到周围的培养基中,而基底外胚层的类器官将死细胞积累在类器官腔中。
在细胞分裂之前将 EdU 掺入新合成的 DNA 中的肠道类器官可以使用共聚焦显微镜进行成像。随着时间的推移,基础输出的类器官显示出比其顶端输出的类器官高得多的 EdU 信号(图 3)。需要注意的是,尽管大小不断增长,但并非所有类器官都显示 EdU+ 细胞。这是因为特定成像层上不存在 EdU+ 细胞。
这些共聚焦图像可以使用图像分析软件和提供的分析管道(补充文件 1)进行定量分析。在执行分析方案时,必须首先包围类器官(图 4A),然后从实际分析中排除某些区域(图 4B)。这些排除区域可能是指类器官腔内的死细胞,这些死细胞对 EdU 信号的定量无关。随后执行自动分析管道导致对所有检测到的细胞核进行分割,区分 Hoechst33342+ 和 EdU+ 细胞核。此外,所有低于 15 μm2 截止值的细胞核都被排除在外,因为这些很可能是死细胞或细胞核未在此图像层中完整显示(图 4C)。
使用软件进行图像分析并导出定量测量值后,进一步计算这些数据以分析 EdU+ 信号占 DNA 总质量的百分比(图 5)。在本手稿中介绍的案例中,与漂浮的基底类器官相比,顶端出肠类器官的增殖水平急剧降低。

图 1:所述协议的示意图概述。 该示意图包括类器官的培养、极性反转的诱导、EdU 标记和半自动图像分析。使用 Biorender.com 创建的图窗。 请单击此处查看此图的较大版本。
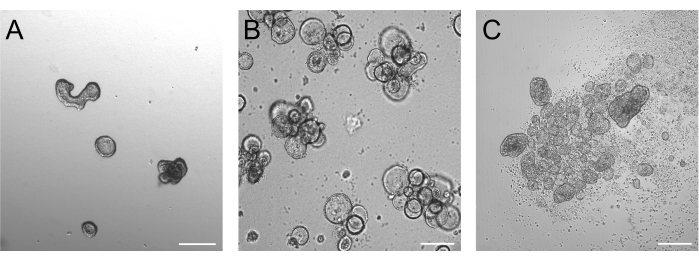
图 2:诱导极性反转前后的类器官。(A) 将胰蛋白酶化细胞接种到生长培养基中 3 天后,基质包埋的肠道类器官。(B) 在悬浮培养物中接种 3 天后漂浮的基底类器官。(C) 在无 BME 的悬浮培养物中接种 3 天后,顶端输出的类器官用于诱导极性反转。比例尺 = 200 μm。 请点击此处查看此图的较大版本。
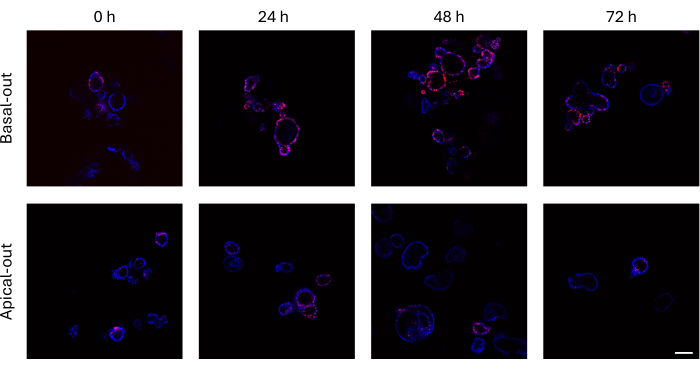
图 3:用 EdU 标记的基底和顶端肠类器官。顶部面板描绘了基底输出类器官随时间变化的共聚焦图像,与顶端输出类器官(下图)相比,在同一时间点呈现了更多的 EdU + 细胞。比例尺 = 100 μm。 请点击此处查看此图的较大版本。

图 4:EdU 染色的肠道类器官的定量图像分析。(A) 使用 Sphere 和 Polygon 模式的环绕类器官。(B) 要从分析中排除的区域标记为白色(由箭头指示)。该区域标记类器官腔,其中包含许多死细胞,这些死细胞将被排除在后续分析之外。(C) 分析后的图像显示了所有分割的细胞核。Hoechst33342 + 细胞核标记为青色,EdU + 细胞核标记为黄色,未达到 15 μm2 的细胞核标记为绿色 (Hoechst33342) 和橙色 (EdU)。比例尺 = 50 μm。 请点击此处查看此图的较大版本。

图 5:类器官增殖率。EdU + DNA 占总 DNA 的百分比作为类器官增殖速率的代表,与根尖类器官相比,基底类器官的增殖更高。数据以平均 SEM 表示。 请单击此处查看此图的较大版本。
| 基础培养基 | |
| 媒体组件 | 最终浓度 |
| DMEM-F12 系列 | |
| 100X 青霉素-链霉素培养基补充剂 | 1 倍 |
| GlutaMAX 添加剂 | 2 毫米 |
| HEPES 缓冲溶液 1 M,液体 | 10 毫米 |
| 精制培养基 | |
| B27 SerumFree 添加剂 (50x),液体 | 1 倍 |
| N-乙酰-L-半胱氨酸,细胞培养测试 | 1 毫米 |
| [Leu15]-胃泌素 I 人 | 10 纳米 |
| A 83-01 | 500 纳米 |
| 人HGF | 50 纳克/毫升 |
| 人 NOGGIN (哺乳动物) | 100 纳克/毫升 |
| 人 IGF-I | 100 纳克/毫升 |
| 人 FGF 碱性 | 50 纳克/毫升 |
| R-Spondin 条件培养基 | 10 % (v/v) |
| Wnt-3a 条件培养基 | 50 % (v/v) |
| 基础培养基 | 用于稀释上述生长因子/条件培养基的剩余体积 |
表 1:基础和精制培养基组成。
讨论
该方案详细描述了如何在标准成人干细胞衍生的肠道类器官培养物中诱导极性反转。顶端外类器官的目的是进入顶端细胞表面,该表面通常朝向类器官腔。能够探测顶端表面对于某些应用可能非常重要,因为这是细胞膜在体内生理条件下暴露于所有消化道内容物的部分。其他专门挑战顶端表面的方法是显微注射16、使用类器官衍生的单层17 和类器官碎裂18。但是,这些方法中的每一种都有特定的缺点和缺点,正如我们和其他人之前更详细地回顾过19,20 一样。
生成顶端外类器官的方法有几个优点:1) 与其他方法相比,生成顶端外类器官相对容易,并且不需要任何专门的仪器或设备。因此,顶端外类器官是进入顶端细胞表面的一种经济高效的方式;2) 漂浮的基础类器官可以平行培养并用作有意义的对照类器官,特别是用于分析极性特异性效应;3) 漂浮的 BO 和 AO 类器官可以进行标准的下游应用,如本报告中的 EdU 掺入所示,也可以进行免疫(组织)化学染色以及以前报道的基于发光和荧光的测定13 和直接活细胞成像12。下游分析,例如 EdU 掺入或免疫(组织)化学染色的分析,在时间方面也允许一定的灵活性,因为类器官可以在 4 °C 下储存直至进一步使用。
尽管极性反转很容易,但在应用此方法时,我们的协议中存在一些关键点。首先,步骤 2.1 中使用的类器官。应具有一定大小。根据我们的经验,胰蛋白酶消化后 3 天使用类器官效果很好。然而,由于细胞增殖的差异或取决于单细胞簇的接种密度,这个时间可能会因其他动物的类器官而异。此外,使用类器官收获溶液的 BME 解离是增量的。如 Co 等人,2019年 9 月所述,低至 2.5% 的 BME 浓度可能足以使类器官在悬浮培养中保持基底形态。因此,必须去除尽可能多的 BME 以确保有效的极性反转。另一个重要的一点是正确使用未经处理的组织培养板,以最大限度地减少悬浮培养过程中的类器官附着。根据我们的经验,使用抗粘附解决方案(步骤 2.4.)预涂板几乎可以使用任何板来培养根尖类器官。但是,可以探索其他使预涂板变得多余的选项。
在许多情况下,评估对极化上皮细胞的基底外侧和顶端细胞表面的影响的重要性变得很明显。例如,我们之前已经分析了厌氧菌 艰难梭菌 毒素对 BO 和 AO 类器官的影响。本研究的结果表明, 艰难梭菌 毒素 B (TcdB) 仅破坏小肠 BO 类器官的肠上皮屏障完整性,而不损害 AO 类器官的肠道上皮屏障完整性。其他几份显示各种病原微生物的结构域特异性反应的报告强调了评估上皮细胞两侧的重要性9、16、21、22、23、24、25。
顶端类器官的一个主要缺点是它们改变了细胞增殖的行为。如上所述,与 BO 类器官相比,AO 类器官的细胞增殖速率急剧降低。我们之前曾报道过,这种增殖的缺乏与细胞死亡水平的略微增加密切相关13。最终,除非找到延长 AO 类器官寿命的方法,否则不允许长期培养 AO 类器官。然而,我们认为 AO 类器官是一种非常有用的工具,可以轻松访问顶端细胞表面,只要研究人员小心处理可能受细胞增殖减少影响的结论。
披露声明
作者声明没有利益冲突。
致谢
这项研究得到了 VetImaging 核心设施(VetCore,Vetmeduni,奥地利)的资源支持。我们要感谢 Ursula Reichart 对半定量图像分析的支持。GC 是奥地利科学院 (ÖAW) 在 Vetmeduni 小动物内科系的 DOC 奖学金(资助号 26349)的获得者。
材料
| Name | Company | Catalog Number | Comments |
| 24 well plates | Biologix | 07-6024 | |
| [Leu15]-Gastrin I human, ≥95% (HPLC) | Sigma-Aldrich | G-9145 | |
| µ-Slide 18 Well Glass Bottom | ibidi | 81817 | |
| 100X Penicillin-Streptomycin supplement for Media | Gibco/Thermo | 15140122 | |
| A 83-01 | Tocris Bioscience | 2939/10 | |
| Anti-Adherence Rinsing Solution | StemCell Technologies | 7010 | |
| arivis Pro | Zeiss | Version 4.2.2 | |
| B27 SerumFree Supplement (50X), liquid | Gibco/Thermo | 17504044 | |
| Bisbenzimide H 33342 (Hoechst 33342) | Abcam | ab145597 | |
| Bovine Serum Albumin | Sigma-Aldrich | A7906-100G | |
| Click-iT EdU Cell Proliferation Kit for Imaging, Alexa Fluor 647 dye | Thermo Scientific | C10340 | |
| DMEM-F12 | Gibco/Thermo | 11320033 | |
| Geltrex | Gibco/Thermo | A1413202 | |
| GlutaMAX Supplement | Gibco/Thermo | 35050061 | |
| HEPES Buffer Solution 1 M, liquid | Gibco/Thermo | 15630056 | |
| Human FGF-basic | PeproTech | 100-18B-100µG | |
| Human HGF | PeproTech | 100-39-100µG | |
| Human IGF-I | PeproTech | 100-11-100µG | |
| Human NOGGIN (Mammalian) | PeproTech | 120-10C-200µG | |
| N-Acetyl-L-cysteine,cell culture tested, BioReagent | Sigma-Aldrich | A9165-5G | |
| Organoid Harvesting Solution | Thermo | C10340 | |
| Triton(TM) X-100,for molecular biology | Sigma-Aldrich | T8787-250ML | |
| Trypsin-EDTA (0.05%), phenol red | Gibco/Thermo | 25300054 |
参考文献
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459, 262-265 (2009).
- Li, Y., et al. BMP suppresses Wnt signaling via the Bcl11b-regulated NuRD complex to maintain intestinal stem cells. EMBO J. 43 (23), 6032-6051 (2024).
- Gaowa, A., Leangpanich, S., Park, E. J., Kawamoto, E., Shimaoka, M. Irisin promotes intestinal epithelial cell proliferation via Wnt/β-catenin and focal adhesion kinase signaling pathways. Sci Rep. 14, 25702 (2024).
- Basak, O., et al. Induced quiescence of Lgr5+ stem cells in intestinal organoids enables differentiation of hormone-producing enteroendocrine cells. Cell Stem Cell. 20 (2), 177-190 (2017).
- Ludikhuize, M. C., et al. Mitochondria define intestinal stem cell differentiation downstream of a FOXO/Notch axis. Cell Metab. 32 (5), 889-900.e7 (2020).
- Ettayebi, K., et al. Replication of human noroviruses in stem cell-derived human enteroids. Science (1979). 353 (6306), 1387-1393 (2016).
- Zhou, J., et al. Infection of bat and human intestinal organoids by SARS-CoV-2. Nat Med. 26 (7), 1077-1083 (2020).
- Joo, S. -. S., et al. Porcine intestinal apical-out organoid model for gut function study. Animals. 12 (3), 372 (2022).
- Co, J. Y., et al. Controlling epithelial polarity: A human enteroid model for host-pathogen interactions. Cell Rep. 26, 2509-2520.e4 (2019).
- Sasaki, N., et al. Development of a scalable coculture system for gut anaerobes and human colon epithelium. Gastroenterology. 159 (1), 388-390.e5 (2020).
- Mayorgas, A., et al. A novel strategy to study the invasive capability of adherent-invasive escherichia coli by using human primary organoid-derived epithelial monolayers. Front Immunol. 12, 646906 (2021).
- Csukovich, G., et al. Neutralising effects of different antibodies on clostridioides difficile toxins TcdA and TcdB in a translational approach. Int J Mol Sci. 24 (4), 3867 (2023).
- Csukovich, G., et al. Polarity reversal of canine intestinal organoids reduces proliferation and increases cell death. Cell Prolif. 57 (2), e13544 (2023).
- Kramer, N., et al. Generation of differentiating and long-living intestinal organoids reflecting the cellular diversity of canine intestine. Cells. 9 (4), 822 (2020).
- Pleguezuelos-Manzano, C., et al. Establishment and culture of human intestinal organoids derived from adult stem cells. Curr Protoc Immunol. 130 (1), e106 (2020).
- Dutta, D., Heo, I., O'Connor, R. Studying infection in 3D tissue-derived human organoid culture systems by microinjection. J Vis Exp. (151), e59610 (2019).
- Kumar, A., et al. Decreased SLC26A3 expression and function in intestinal epithelial cells in response to Cryptosporidium parvum infection. Am J Physiol Cell Physiol. 317 (6), C1205-C1212 (2019).
- Dutta, D., Clevers, H. Organoid culture systems to study host-pathogen interactions. Curr Opin Immunol. 48, 15-22 (2017).
- Csukovich, G., Pratscher, B., Burgener, I. A. The world of organoids: Gastrointestinal disease modelling in the age of 3R and one health with specific relevance to dogs and cats. Animals. 12 (18), 2461 (2022).
- Han, X., et al. Creating a more perfect union: Modeling intestinal bacteria-epithelial interactions using organoids. Cell Mol Gastroenterol Hepatol. 12 (2), 769-782 (2021).
- Li, Y., et al. Next-generation porcine intestinal organoids: an apical-out organoid model for swine enteric virus infection and immune response investigations. J Virol. 94 (21), e01006-e01020 (2020).
- Smith, D., et al. The development of ovine gastric and intestinal organoids for studying ruminant host-pathogen interactions. Front Cell Infect Microbiol. 11, 733811 (2021).
- Nash, T. J., Morris, K. M., Mabbott, N. A., Vervelde, L. Inside-out chicken enteroids with leukocyte component as a model to study host-pathogen interactions. Commun Biol. 4 (1), 377 (2021).
- Hanson, K. I., Weiss, A. A. Intestinal tissue response to Shiga toxin exposure. mBio. 15 (9), e0123224 (2024).
- Hovhannisyan, P., et al. Infection of human organoids supports an intestinal niche for Chlamydia trachomatis. PLoS Pathog. 20 (8), e1012144 (2024).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。