Method Article
יצירת אורגנואידים במעי אפיקלי החוצה והערכת קצב התפשטות האורגנואידים באמצעות תיוג EdU
In This Article
Summary
כאן, אנו מתארים פרוטוקול ליצירת אורגנואידים במעי אפיקליים מתרביות אורגנואידים סטנדרטיות משובצות מטריצה. הוא גם מתאר את השילוב הבא של EdU בתאים המתרבים באופן פעיל ואת הכימות האוטומטי למחצה של תאים חיוביים ל-EdU.
Abstract
כאן, אנו מתארים את הדור של תרביות צפות של אורגנואידים במעי הקודקודים מתרביות אורגנואידים במעי משובצות הידרוג'ל. במקביל, תרביות אורגנואידים צפות בבסיס החוצה נקבעות להשוואה ישירה בין אורגנואידים קודקודיים ובזאליים החוצה. אורגנואידים אפיקליים ובסיסיים כפופים לאחר מכן לאנלוגי התימידין 5-ethynyl-2'-deoxyuridine (EdU), המשולב ב-DNA החדש שסונתז במהלך שלב ה-S של חלוקת התא. ניתן לדמיין שילוב זה ב-DNA באורגנואידים שלמים מבחינה מורפולוגית באמצעות מיקרוסקופיה קונפוקלית של סריקת לייזר. תאים המסומנים ב-Hoechst33342 ו-EdU מכומתים לאחר מכן בצורה חצי אוטומטית באמצעות תוכנת ניתוח תמונה. חישוב אחוז התאים החיוביים ל-EdU ממספר התאים הכולל מאפשר ניתוח של התפשטות תאים באורגנואידים תלת מימדיים (3D). למרות שהוא משמש כאן לניתוח התפשטות באורגנואידים במעי, הפרוטוקול ישים לניתוח של כתמים ספציפיים לגרעין מסוגים שונים גם באורגנואידים אחרים או בתרביות תאים דו-ממדיות.
Introduction
אורגנואידים במעי הם מודלים תלת מימדיים במבחנה המסכמים את אפיתל המעי המורכב מסוגי תאים שונים. ניתן ליצור אורגנואידים אלה בקלות מתאי גזע בוגרים המבודדים מקריפטות מעיים1. מכיוון שאורגנואידים קרובים הרבה יותר לאפיתל in vivo, הם הופכים חשובים יותר ויותר במחקר ביו-רפואי. אורגנואידים של המעי משמשים לא רק לניתוח מנגנונים פיזיולוגיים (למשל, איתות נישת מעיים 2,3 והתמיינות תאים 4,5) אלא גם למחקר על מחלות זיהומיות 6,7. עם זאת, גידול תאים מקוטבים בתלת מימד הסוגר לומן מרכזי הוא מאתגר, מכיוון שמשטח התא האפיקלי בסופו של דבר אינו נגיש בתוך לומן האורגנואיד. בחינת ההבדלים בין משטחי תאים אפיקליים ובסיסיים יכולה להיות חשובה במחקרים מטבוליים, כפי שמודגם על ידי הבדלים בספיגת חומצות שומן8 ומחקר מחלות זיהומיות 9,10,11,12.
יצירת מה שנקרא אורגנואידים אפיקליים היא אפשרות קלה להתגבר על בעיה זו. על ידי הסרת המטריצה החוץ-תאית מתרביות אורגנואידים סטנדרטיות (כלומר, אורגנואידים בסיסיים, משובצים במטריצה) וזריעת אורגנואידים אלה בתווך נטול מטריצה, ניתן לגרום למתג קוטביות9.
כפי שפרסמנו בעבר, רוב האורגנואידים הופכים את הקוטביות שלהם תוך 12 שעות. עם זאת, לוקח 48-72 שעות להשיג תרבית עם יותר מ-90% אורגנואידים אפיקליים. למרות יתרונם בכך שהם מאפשרים גישה למשטח התא האפיקלי, אורגנואידים אפיקליים מראים ירידה משמעותית בהתפשטות לאחר היפוך הקוטביות בעוד ששיעורי מוות התאים עולים13. גורם הפעילות הפרוליפרטיבית יכול לייצג משתנה מבלבל בניתוחים שונים ויש לזכור אותו בעת תכנון ניסוי.
כאן, אנו מציגים פרוטוקול מפורט להקמת תרביות אורגנואידים אפיקליים במעי ואורגנואידים בקרה בזאליים צפים לניתוחים במורד הזרם. יתר על כן, אנו מתארים תיוג עם 5-ethynyl-2'-deoxyuridine (EdU), המשולב ב-DNA שסונתז לאחרונה ובכך מסמן תאים מתרבים באופן פעיל. אנו מתארים עוד את ניתוח התמונה החצי אוטומטי של קצב התפשטות האורגנואידים באמצעות התוכנה arivis Pro (Zeiss) על ידי כימות של תאי EdU+ . סכימה של התהליך מתוארת באיור 1.
Protocol
נעשה שימוש באורגנואידים במעי שמקורם בתאי גזע בוגרים מכלבים, שהוקמו על פי Kramer et al., 202014 . בהתבסס על הנחיות ועדת האתיקה המוסדית, השימוש בחומר רקמה שנאסף במהלך כריתה טיפולית או לאחר המוות נכלל ב"הסכמת הבעלים לטיפול" של האוניברסיטה, שנחתמה על ידי כל בעלי המטופלים.
1. תרבות אורגנואידים
- תרבית אורגנואידים במעי שמקורם בתאי גזע בוגרים המוטבעים במטריצת תמצית קרום הבסיס (BME) לבחירה בצלחות של 24 בארות ופיצול אותם באופן מכני באמצעות פיפטות זכוכית כמתואר בפירוט ב- Pleguezuelos et al., 202015.
הערה: עבור הפרוטוקול המתואר כאן, Geltrex שימש כ-BME. - הסר בזהירות את המדיום המזוקק (טבלה 1) מהאורגנואידים המוטבעים ב-BME.
- הוסף 500 מיקרוליטר של 0.05% טריפסין-EDTA לבאר ונתק את כל כיפות המטריצה מהבאר על ידי פיפטינג למעלה ולמטה שוב ושוב. העבירו את האורגנואידים לצינור של 15 מ"ל והשעו היטב כדי לנתק לחלוטין את מטריצת ההידרוג'ל.
- דגירה של אורגנואידים עם 0.05% טריפסין-EDTA ב-37 מעלות צלזיוס באמבט מים עד שכל האורגנואידים מתפרקים לתאים בודדים או לאשכולות קטנים של תאים.
- לדלל את תרחיף הטריפסין/תא במדיום בסיסי (טבלה 1). השתמש לפחות פי שניים במדיום בסיסי מאשר טריפסין.
- תאי צנטריפוגה בטמפרטורה של 8 מעלות צלזיוס בטמפרטורה של 420 × גרם למשך 5 דקות. הסר כמה שיותר סופרנטנט.
- תאי זרע משובצים ב-BME בכמה בארות ששימשו לטריפסיניזציה בשלב 1.3. ולספק להם מדיום מזוקק (טבלה 1).
- דגרו תאים למשך 3 ימים בחממת תרבית תאים והמשיכו לשלב 2.1.
2. אינדוקציה של היפוך קוטביות ותיוג EdU
- הסר בזהירות את המדיום מהאורגנואידים המוטבעים ב-BME.
- הוסף 500 מיקרוליטר של תמיסת קציר אורגנואידים לכל באר ונתק את כל כיפות המטריצה מהבאר על ידי פיפטינג למעלה ולמטה שוב ושוב. העבירו את האורגנואידים לצינור של 15 מ"ל והשעו היטב כדי לנתק לחלוטין את מטריצת ההידרוג'ל.
- דגרו את צינור ה-15 מ"ל על קרח למשך שעה וחצי. יש לנער היטב את הצינור כל 10 דקות כדי למנוע התגבשות של האורגנואידים ולהבטיח דיסוציאציה אחידה של רכיבי ההידרוג'ל הנותרים.
- במהלך הדגירה, מצפים צלחת של 96 בארות בתמיסה נגד הידבקות. עבור כל באר של צלחת של 24 בארות שעברו טריפסין בשלב 1.3., מצפים 8 בארות של צלחת של 96 בארות. דגירה למשך שעה לפחות בטמפרטורת החדר (RT).
- הוסף לפחות פי שניים PBS מאשר תמיסת קצירת אורגנואידים ששימשה לצינור של 15 מ"ל וצנטריפוגה ב-8 מעלות צלזיוס ב-150 × גרם למשך 5 דקות.
- הסר את הסופרנטנט והשהה מחדש את האורגנואידים ב-1 מ"ל של PBS.
- העבירו 500 מיקרוליטר של מתלה האורגנואיד/PBS בצינור נפרד של 15 מ"ל וצנטריפוגה את שני הצינורות שוב ב-8 מעלות צלזיוס ב-150 × גרם למשך 5 דקות.
- הסר את כל התמיסה נגד הידבקות מצלחת 96 הבארות.
- הסר כמה שיותר סופרנטנט לאחר הצנטריפוגה.
- השתמש באחד הצינורות ליצירת אורגנואידים בזליים צפים (BO) ובצינור השני לאורגנואידים אפיקליים (AO).
- עבור אורגנואידים של BO, הוסף 100 מיקרוליטר של מדיום מזוקק המכיל 7.5% BME לבאר של צלחת 96 הבארות לצינור אחד. מערבבים היטב ומפזרים את האורגנואידים באופן שווה על פני מספר הבארות הרצוי של צלחת 96 הבארות המצופה מראש.
- עבור אורגנואידים של AO, הוסף 100 מיקרוליטר מדיום מזוקק רגיל (ללא תוספת BME) לכל באר של צלחת 96 הבארות לצינור השני. מערבבים היטב ומפזרים את האורגנואידים באופן שווה על פני מספר הבארות הרצוי של צלחת 96 הבארות המצופה מראש.
- דגרו על האורגנואידים בטמפרטורה של 37 מעלות צלזיוס ו-5% CO2 למשך 3 ימים.
הערה: הבדלים מורפולוגיים יתחילו להופיע לאחר היום הראשון. עם זאת, תוצאות שפורסמו בעבר מראות כי לוקח לרוב המכריע של האורגנואידים כ-3 ימים להציג קוטביות אפיקלית13. - בנקודות זמן מוגדרות, למשל, 24 שעות/48 שעות/72 שעות לאחר אינדוקציה של היפוך קוטביות, הוסף 50 מיקרוליטר של 3 מיקרומטר EdU מדולל במדיום מזוקק לכל בארות האורגנואידים שיש לסמן, כדי לקבל ריכוז סופי של 1 מיקרומטר EdU בכל באר.
- דגירה בטמפרטורה של 37 מעלות צלזיוס ו-5% CO2 למשך 1.5 שעות.
- אסוף אורגנואידים עם תווית EdU באמצעות קצות רחבים והעביר אותם לצינור של 15 מ"ל.
- הוסף כמות שווה של 4% PFA לכל שפופרת (אורגנואידים BO ו-AO; ריכוז סופי של PFA = 2%) וערבב בזהירות.
- דגירה ב- RT למשך 15 דקות.
- הוסף לפחות פי שניים מכמות ה-PBS מכיוון שיש נפח בצינור 15 מ"ל וצנטריפוגה ב-8 מעלות צלזיוס ב-80 × גרם למשך 5 דקות.
- הסר את הסופרנטנט והשהה מחדש את האורגנואידים ב-1 מ"ל של PBS.
- שוב צנטריפוגה ב-8 מעלות צלזיוס ב-80 × גרם למשך 5 דקות.
- הסר את הסופרנטנט, השהה מחדש את האורגנואידים ב-1 מ"ל PBS והעביר אותם לצינור של 1.5 מ"ל. אחסן את האורגנואידים בטמפרטורה של 4 מעלות צלזיוס עד לביצוע תגובת הצביעה של EdU (ראה סעיף 3).
- חזור על שלבים 2.14-2.22 עבור כל נקודת זמן שיש לנתח.
3. תגובת צביעה של Click-it EdU וצביעה של Hoechst 33342
- צנטריפוגה את האורגנואידים הקבועים (משלב 2.22.) בצינור של 1.5 מ"ל ב-4 מעלות צלזיוס ב-50 × גרם למשך 5 דקות.
- הסר את ה-supernatant והשהה מחדש את האורגנואידים ב-1 מ"ל של אלבומין סרום בקר 3% (BSA) מדולל ב-PBS באמצעות קצות קדח רחבים.
- חזור על שלבים 3.1. ו -3.2 (שלבי כביסה).
- הסר את הסופרנטנט והשהה מחדש את האורגנואידים ב-1 מ"ל של 0.5% טריטון X-100 מדולל ב-PBS.
- דגירה ב- RT למשך 20 דקות.
- אורגנואידים צנטריפוגות ב-RT ב-50 × גרם למשך 5 דקות.
- בשפופרת טרייה, הכינו תוסף חיץ 1x על ידי ערבוב של 45 מיקרוליטר של H2O עם 5 מיקרוליטר של תוסף מאגר 10x.
- בשפופרת אחרת, הכינו את קוקטייל התגובה על ידי ערבוב הרכיבים הבאים: 385.8 מיקרוליטר של H2O, 43 מיקרוליטר של מאגר תגובה 10x, 20 מיקרוליטר של CuSO 4,1.2 מיקרוליטר של Alexa Fluor 647 אזיד, ו-50 מיקרוליטר o 1x תוסף מאגר (משלב 3.7).
הערה: תערובת זו מספיקה לחמש תגובות וניתן להגדיל ולהקטין אותה בהתאם למספר הנדרש של תגובות צביעה. - חזור על שלבים 3.1. ו-3.2. פעמיים (שלבי כביסה).
- הסר את הסופרנטנט והוסף 100 מיקרוליטר קוקטייל תגובה (שלב 3.8.) לכל צינור עם אורגנואידים.
- דגירה ב-RT למשך 30 דקות בחושך.
- חזור על שלבים 3.1. ו -3.2 (שלבי כביסה).
- אורגנואידים צנטריפוגות במשקל 50 × גרם למשך 5 דקות ב-RT.
- השעו אורגנואידים ב-1 מ"ל של 10 מיקרוגרם/מ"ל Hoechst33342 מדולל ב-PBS.
- דגירה ב-RT למשך 45 דקות בחושך.
- חזור על שלבים 3.1. ו -3.2 (שלבי כביסה).
- אורגנואידים צנטריפוגה במשקל 50 × גרם למשך 5 דקות בטמפרטורה של 4 מעלות צלזיוס.
- זרעי אורגנואידים במטריצת BME לבחירה בשקופית התואמת למיקרוסקופיה קונפוקלית (למשל, באר μ-שקופית 18)
- דמיין אורגנואידים תחת מיקרוסקופ קונפוקלי.
4. ניתוח תמונה חצי אוטומטי
הערה: לצורך ניתוח זה, נעשה שימוש ב-arivis Pro גרסה 4.2.2 (תוכנת ניתוח תמונות).
- ייבא את תמונות המיקרוסקופ הקונפוקלי לתוכנת ניתוח התמונות והגדר תיקיה בה יישמר קובץ הניתוח. השתמש באפשרות תמונות כנקודות זמן כדי לייבא תמונות מרובות (שכפול תמונות, נקודות זמן שונות, טיפולים שונים וכו'). לאחר מכן כל תמונה תטופל כנקודת זמן אחת, מה שיאפשר מעבר קל בין התמונות הבודדות.
- פתח את לוח הניתוח וייבא את צינור הניתוח שסופק כקובץ משלים 1 (arivis_EdU_pipeline).
- השתמשו בכלי Place New Objects וב-Sphere עם התג Organoid כדי להקיף בקלות את כל האורגנואידים המופרדים היטב.
- עבור לתמונה הבאה, כלומר לנקודת הזמן הבאה, והמשך לסמן אורגנואידים עבור כל התמונות.
- עבור אורגנואידים הקרובים מאוד זה לזה ולכן לא ניתן להפריד אותם באמצעות מצב Sphere , פתח את רשימת האובייקטים והפעל את התג Organoid.
- המשך להשתמש בכלי Draw Objects במצב מצולע כדי לסמן קווי מתאר אורגנואידים באופן ידני.
הערה: ברשימת האובייקטים, כל האורגנואידים מסומנים כעת ומוקצים לנקודת זמן מסוימת. נקודת זמן זו תואמת לסדר התמונות שיובאו בשלב 4.1. כעת ניתן לשנות את שמות נקודות הזמן הללו כך שיתאימו לשם התמונה המקורי אם אתה מעדיף. - ברשימת האובייקטים, סמן את כל האובייקטים (=אורגנואידים) ולחץ באמצעות לחצן העכבר הימני ולאחר מכן לחץ על הסר תגים כדי להסיר את התג Manual מכל האובייקטים.
- השבת את התג Organoid ברשימת האובייקטים וסמן את כל האזורים בתוך אובייקטים שהוגדרו קודם לכן שיש לא לכלול בניתוח באמצעות הכלי Draw Objects במצב מצולע . אזורים אלה עשויים לכלול תאים מתים בתוך לומן האורגנואיד או אזורים מטושטשים, מה שעלול להטות את הניתוח.
- בעת פתיחת רשימת האובייקטים, ודא שכל האורגנואידים מופיעים עם התג Organoid וכל האזורים שיש לא לכלול כוללים את התג Manual.
- התחל את צינור הניתוח על ידי לחיצה על החץ בחלונית השמאלית העליונה.
הערה: התוכנה מפלחת כעת את כל הגרעינים בערוצי Hoechst33342 ו-EdU. צינור ניתוח זה מתייחס רק לגרעיני Hoechst33342+ ו-EdU+ מפולחים בגודל של יותר מ-15 מיקרומטר2 (כלומר, שטח במקטע הגרעין) כדי להבטיח שגרעינים קטנים, שמקורם ככל הנראה בתאים מתים, אינם נכללים בניתוח. - חפש את תוצאות הניתוח ברשימת האובייקטים על-ידי לחיצה על התגית עמודות תכונה .
- עבור לתצוגת פרטי מאסטר ובחר את התג Organoids בחלונית העליונה ואת התכונה First Timepoint.
- בחלונית התחתונה, בחר את התכונות שיוצגו לכל אורגנואיד. השתמש בשטח הקרנה (x/y/z) (ווקסל), עוצמה ממוצעת # 1 (ערוץ EdU) ועוצמות SD #1.
- ייצא את התוצאות (דוח פירוט ראשי) באמצעות הפונקציה ייצוא של Excel .
- שמור את קובץ הניתוח וסגור את התוכנה.
5. קביעת שיעורי התפשטות אורגנואידים
- פתח את קובץ דוח פרטי האב המיוצא בשלב 4.14.
- יש כרטיסייה נפרדת אחת לכל תמונה מנותחת. חשב את סכום השטח/ווקסל עבור גרעינים וכתם EdU עבור כל תמונה. לאחר מכן, העתק את כל הנתונים המתקבלים לכרטיסייה קולקטיבית חדשה וקבץ את כל הנתונים המתייחסים לאותה נקודת זמן.
- לאחר מכן, חשב את השטח הכולל של גרעיני התא (כלומר, הסכום של שטח Hoechst33342+ ושטח EdU+ ) עבור כל תמונה.
- לאחר מכן, חלקו את השטח הכולל בפני עצמו (= 100%) ואת שטח ה-EdU+ הממוצע בשטח הכולל (=אחוז ה-DNA של EdU+ ).
- שרטט את אחוז ה-DNA המתפשט של אורגנואידים BO ו-AO על ציר ה-y ואת נקודות הזמן השונות על ציר ה-x.
תוצאות
אורגנואידים שגדלו במשך 3 ימים לאחר טריפסיניזציה צריכים להיות באופן אידיאלי בין 50-250 מיקרומטר, כפי שמתואר באיור 2A. אורגנואידים גדולים בהרבה מזה עשויים שלא להפוך את הקוטביות שלהם ביעילות. אורגנואידים גדולים יותר עשויים גם להתחיל לנבוט, ושמנו לב שלאורגנואידים אלה יכולות להיות בעיות גם בהיפוך קוטביות יעיל. אורגנואידים בסיסיים וקודקודיים מציגים הבדלים מורפולוגיים ברורים כבר בהדמיית שדה בהיר. בעוד שאורגנואידים בסיסיים שומרים על לומן גדול (איור 2B) לאחר 3 ימים של תרבית תרחיף, אורגנואידים קודקודיים (איור 2C) נראים קומפקטיים יותר. מאפיין ספציפי מאוד של תרביות תרחיף אפיקליות הוא מספר התאים המתים הצפים סביב האורגנואידים. הסיבה לכך היא אורגנואידים אפיקליים החוצה המוציאים תאים מובחנים ומתים סופניים לתווך שמסביב, בעוד שאורגנואידים בסיסיים צוברים תאים מתים בלומן האורגנואיד.
ניתן לדמות אורגנואידים במעי ששילבו EdU ב-DNA החדש שלהם לפני חלוקת התא באמצעות מיקרוסקופ קונפוקלי. אורגנואידים בזאליים מראים אותות EdU גבוהים בהרבה לאורך זמן מאשר עמיתיהם הקודקודיים (איור 3). חשוב לציין שלא כל האורגנואידים מראים תאי EdU+ למרות הגידול בגודלם. הסיבה לכך היא שאין תאי EdU+ בשכבת ההדמיה הספציפית.
ניתן לנתח את התמונות הקונפוקליות הללו באופן כמותי באמצעות תוכנת ניתוח תמונות וצינור הניתוח המסופק (קובץ משלים 1). בזמן ביצוע פרוטוקול הניתוח, תחילה יש להקיף אורגנואידים (איור 4A) לפני הוצאת אזורים מסוימים מהניתוח בפועל (איור 4B). אזורי אי הכללה אלה עשויים להתייחס לתאים מתים בתוך לומן האורגנואיד, שאינם מעניינים לכימות אותות EdU. ביצוע לאחר מכן של צינור הניתוח האוטומטי מוביל לפילוח של כל הגרעינים שזוהו, תוך הבחנה בין גרעיני Hoechst33342+ ו-EdU+ . בנוסף, כל הגרעינים מתחת לחתך של 15 מיקרומטר2 אינם נכללים מכיוון שסביר להניח שאלו תאים מתים או גרעינים שאינם מוצגים במלואם בשכבת תמונה זו (איור 4C).
לאחר ניתוח תמונה באמצעות התוכנה וייצוא מדידות הכמות, נתונים אלה מחושבים עוד יותר כדי לנתח את אחוז אות EdU+ מהמסה הכוללת של ה-DNA (איור 5). במקרה המוצג בכתב יד זה, אורגנואידים במעי הקודקודים מראים רמות מופחתות באופן דרסטי של התפשטות בהשוואה לאורגנואידים בסיסיים צפים.

איור 1: סקירה סכמטית של הפרוטוקול המתואר. הסכימה כוללת גידול אורגנואידים, אינדוקציה של היפוך קוטביות, תיוג EdU וניתוח תמונה חצי אוטומטי. דמות שנוצרה באמצעות Biorender.com. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
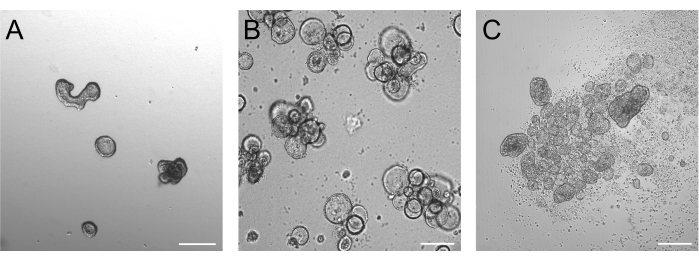
איור 2: אורגנואידים לפני ואחרי אינדוקציה של היפוך קוטביות. (A) אורגנואידים במעי משובצים במטריקס שלושה ימים אחרי שתאים טריפסינים נזרעו במצע גידול. (B) אורגנואידים בסיסיים צפים שלושה ימים לאחר הזריעה בתרבית תרחיף. (C) אורגנואידים אפיקליים 3 ימים לאחר הזריעה בתרבית תרחיף ללא BME לאינדוקציה של היפוך קוטביות. סרגל קנה מידה = 200 מיקרומטר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
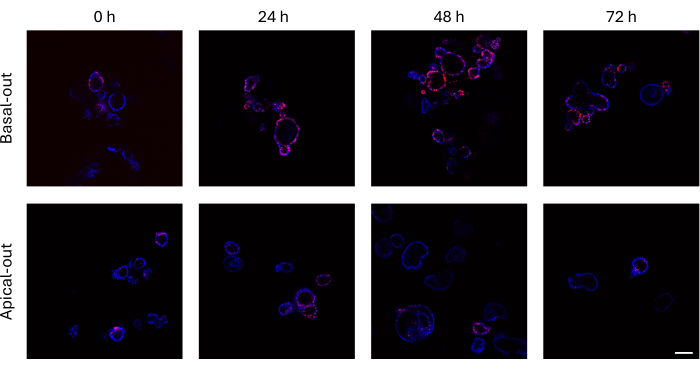
איור 3: אורגנואידים במעי עם בסיס החוצה והחוצה האפיקלי מסומנים ב-EdU. הפאנל העליון המתאר תמונות קונפוקליות של אורגנואידים בזאליים לאורך זמן מציג הרבה יותר תאי EdU+ בהשוואה לאורגנואידים אפיקליים (פאנל תחתון) באותן נקודות זמן. סרגל קנה מידה = 100 מיקרומטר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 4: ניתוח תמונה כמותי של אורגנואידים במעי מוכתמים ב-EdU. (A) אורגנואידים מוקפים באמצעות מצבי Sphere ו-Polygon . (B) האזור שלא ייכלל בניתוח מסומן בלבן (מסומן על ידי החץ). אזור זה מסמן את לומן האורגנואיד, המכיל מספר תאים מתים, אשר לא ייכללו בניתוח שלאחר מכן. (C) התמונה לאחר הניתוח מציגה את כל הגרעינים המפולחים. גרעיני Hoechst33342 + מסומנים בציאן, גרעיני EdU+ מסומנים בצהוב, וגרעינים שאינם מגיעים ל -15 מיקרומטר2 מסומנים בירוק (Hoechst33342) וכתום (EdU). סרגל קנה מידה = 50 מיקרומטר. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 5: קצב התפשטות האורגנואידים. אחוז ה-DNA של EdU+ מכלל ה-DNA המשמש כפרוקסי לקצב התפשטות האורגנואידים מראה התפשטות גבוהה יותר באורגנואידים בסיסיים בהשוואה לאורגנואידים אפיקליים. הנתונים מוצגים כ-SEM ממוצע. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
| מדיום בזאלי | |
| רכיבי מדיה | ריכוז סופי |
| DMEM-F12 | |
| תוסף פניצילין-סטרפטומיצין 100X למדיה | 1x |
| תוסף GlutaMAX | 2 מ"מ |
| תמיסת חיץ HEPES 1 מ', נוזל | 10 מ"מ |
| מדיום מעודן | |
| תוסף תזונה ללא סרום B27 (פי 50), נוזלי | 1x |
| N-אצטיל-L-ציסטאין, נבדק בתרבית תאים | 1 מ"מ |
| [Leu15]-גסטרין הראשון אנושי | 10 ננומטר |
| א 83-01 | 500 ננומטר |
| HGF אנושי | 50 ננוגרם/מ"ל |
| נוגין אנושי (יונקים) | 100 ננוגרם/מ"ל |
| IGF-I אנושי | 100 ננוגרם/מ"ל |
| FGF אנושי בסיסי | 50 ננוגרם/מ"ל |
| מדיום מותנה R-Spondin | 10% (אנכי/אנכי) |
| מדיום מותנה Wnt-3a | 50% (אנכי/אנכי) |
| מדיום בזאלי | נפח שנותר לדילול גורמי הגדילה שהוזכרו לעיל / מדיום מותנה |
טבלה 1: הרכב המדיה הבסיסית והמעודנת.
Discussion
פרוטוקול זה מתאר בפירוט כיצד לגרום להיפוך קוטביות בתרביות אורגנואידים סטנדרטיות שמקורן בתאי גזע בוגרים. אורגנואידים אפיקליים משרתים את המטרה של קבלת גישה למשטח התא האפיקלי, המכוון בדרך כלל לכיוון לומן האורגנואיד. היכולת לחקור את המשטח האפיקלי יכולה להיות בעלת חשיבות גבוהה עבור יישומים מסוימים מכיוון שזהו החלק של קרום התא החשוף לכל תכולת מערכת העיכול בתנאים פיזיולוגיים in vivo. שיטות אחרות לאתגר את המשטח האפיקלי באופן ספציפי הן מיקרו-הזרקה16, שימוש בחד-שכבות שמקורן באורגנואיד17 ופיצול אורגנואיד18. עם זאת, לכל אחת מהשיטות הללו חסרונות וחסרונות ספציפיים, כפי שסקרנו ביתר פירוט בעבר 19,20.
לשיטה ליצירת אורגנואידים אפיקליים יש מספר יתרונות: 1) יצירת אורגנואידים אפיקליים היא קלה יחסית בהשוואה לשיטות אחרות ואינה דורשת מכשור או ציוד מיוחד. לכן, אורגנואידים אפיקליים הם דרך חסכונית לגשת למשטח התא האפיקלי; 2) ניתן לגדל אורגנואידים בזאליים צפים במקביל ולהשתמש בהם כאורגנואידים בקרה משמעותיים, במיוחד לניתוח השפעות ספציפיות לקוטביות; 3) אורגנואידים צפים של BO ו-AO יכולים להיות נתונים ליישומים סטנדרטיים במורד הזרם כפי שמודגם על ידי שילוב EdU בדוח זה, אך גם צביעה אימונולוגית (היסטו) כימית כמו גם בדיקות מבוססות זוהר ופלואורסצנטי כפי שדווח בעבר13 והדמיה ישירה של תאים חיים12. ניתוחים במורד הזרם, כגון ניתוח שילוב EdU או צביעה אימונולוגית (היסטו) כימית, מאפשרים גם גמישות מסוימת מבחינת זמן, שכן ניתן לאחסן אורגנואידים בטמפרטורה של 4 מעלות צלזיוס עד לשימוש נוסף.
למרות הקלות של היפוך הקוטביות, קיימות כמה נקודות קריטיות בפרוטוקול שלנו שיש לקחת בחשבון בעת יישום שיטה זו. ראשית, אורגנואידים ששימשו בשלב 2.1. צריך להיות בגודל מסוים. מניסיוננו, שימוש באורגנואידים 3 ימים לאחר הטריפסיניזציה עובד היטב. עם זאת, זמן זה עשוי להשתנות עם אורגנואידים של בעלי חיים אחרים עקב הבדלים בריבוי התאים או בהתאם לצפיפות הזריעה של אשכולות תאים בודדים. יתר על כן, הדיסוציאציה של BME באמצעות תמיסת קצירת האורגנואידים היא הדרגתית. כפי שתואר על ידי Co et al., 20199, ריכוזי BME נמוכים עד 2.5% עשויים להספיק כדי לשמור על אורגנואידים במורפולוגיה בסיסית בתרבית תרחיף. לכן, יש להסיר כמה שיותר BME כדי להבטיח היפוך קוטביות יעיל. נקודה חשובה נוספת היא שימוש נכון בלוחות תרבית רקמה לא מטופלים כדי למזער את ההתקשרות האורגנואידית במהלך תרבית השעיה. מניסיוננו, ציפוי מראש של צלחות בתמיסה נגד היצמדות (שלב 2.4.) מאפשר שימוש כמעט בכל צלחת לתרבית של אורגנואידים אפיקליים. עם זאת, ניתן לבחון אפשרויות אחרות ההופכות את לוחות הציפוי מראש למיותרים.
החשיבות של הערכת ההשפעות על פני התא הבסיסי כמו גם על פני התא האפיקלי של תאי אפיתל מקוטבים מתבררת במקרים רבים. לדוגמה, ניתחנו בעבר את ההשפעות של רעלנים של החיידק האנאירובי Clostridioides difficile על אורגנואידים BO ו-AO. תוצאות מחקר זה מראות כי רעלן C. difficile B (TcdB) פוגע רק בשלמות מחסום האפיתל של המעי באורגנואידים BO של המעי הדק אך לא באורגנואידים של AO. מספר דיווחים אחרים המציגים תגובות ספציפיות לתחום של מיקרואורגניזמים פתוגניים שונים מדגישים את החשיבות של הערכת שני הצדדים של תאי אפיתל 9,16,21,22,23,24,25.
חיסרון מרכזי אחד של אורגנואידים אפיקליים הוא ההתנהגות המשתנה שלהם לגבי התפשטות התאים. כפי שתואר לעיל, אורגנואידים של AO מראים שיעורי התפשטות תאים מופחתים באופן דרסטי בהשוואה לעמיתיהם ב-BO. דיווחנו בעבר כי חוסר התפשטות זה הולך יד ביד עם רמות מוגברות מעט של מוות תאי13. בסופו של דבר, זה לא מאפשר תרבית ארוכת טווח של אורגנואידים AO אלא אם כן נמצאה דרך להאריך את חיי האורגנואידים של AO עם זאת, אנו רואים באורגנואידים של AO כלי שימושי ביותר לגישה קלה למשטח התא האפיקלי כל עוד החוקרים נזהרים עם מסקנות שעלולות להיות מושפעות מירידה בהתפשטות התאים.
Disclosures
המחברים מצהירים שאין ניגוד עניינים.
Acknowledgements
מחקר זה נתמך באמצעות משאבים של מתקן הליבה של VetImaging (VetCore, Vetmeduni, אוסטריה). אנו רוצים להודות לאורסולה רייכרט על תמיכתה בניתוח תמונה כמותי למחצה. GC הוא זוכה מלגת DOC (מענק מספר 26349) של האקדמיה האוסטרית למדעים (ÖAW) במחלקה לרפואה פנימית של בעלי חיים קטנים ב-Vetmeduni.
Materials
| Name | Company | Catalog Number | Comments |
| 24 well plates | Biologix | 07-6024 | |
| [Leu15]-Gastrin I human, ≥95% (HPLC) | Sigma-Aldrich | G-9145 | |
| µ-Slide 18 Well Glass Bottom | ibidi | 81817 | |
| 100X Penicillin-Streptomycin supplement for Media | Gibco/Thermo | 15140122 | |
| A 83-01 | Tocris Bioscience | 2939/10 | |
| Anti-Adherence Rinsing Solution | StemCell Technologies | 7010 | |
| arivis Pro | Zeiss | Version 4.2.2 | |
| B27 SerumFree Supplement (50X), liquid | Gibco/Thermo | 17504044 | |
| Bisbenzimide H 33342 (Hoechst 33342) | Abcam | ab145597 | |
| Bovine Serum Albumin | Sigma-Aldrich | A7906-100G | |
| Click-iT EdU Cell Proliferation Kit for Imaging, Alexa Fluor 647 dye | Thermo Scientific | C10340 | |
| DMEM-F12 | Gibco/Thermo | 11320033 | |
| Geltrex | Gibco/Thermo | A1413202 | |
| GlutaMAX Supplement | Gibco/Thermo | 35050061 | |
| HEPES Buffer Solution 1 M, liquid | Gibco/Thermo | 15630056 | |
| Human FGF-basic | PeproTech | 100-18B-100µG | |
| Human HGF | PeproTech | 100-39-100µG | |
| Human IGF-I | PeproTech | 100-11-100µG | |
| Human NOGGIN (Mammalian) | PeproTech | 120-10C-200µG | |
| N-Acetyl-L-cysteine,cell culture tested, BioReagent | Sigma-Aldrich | A9165-5G | |
| Organoid Harvesting Solution | Thermo | C10340 | |
| Triton(TM) X-100,for molecular biology | Sigma-Aldrich | T8787-250ML | |
| Trypsin-EDTA (0.05%), phenol red | Gibco/Thermo | 25300054 |
References
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459, 262-265 (2009).
- Li, Y., et al. BMP suppresses Wnt signaling via the Bcl11b-regulated NuRD complex to maintain intestinal stem cells. EMBO J. 43 (23), 6032-6051 (2024).
- Gaowa, A., Leangpanich, S., Park, E. J., Kawamoto, E., Shimaoka, M. Irisin promotes intestinal epithelial cell proliferation via Wnt/β-catenin and focal adhesion kinase signaling pathways. Sci Rep. 14, 25702(2024).
- Basak, O., et al. Induced quiescence of Lgr5+ stem cells in intestinal organoids enables differentiation of hormone-producing enteroendocrine cells. Cell Stem Cell. 20 (2), 177-190 (2017).
- Ludikhuize, M. C., et al. Mitochondria define intestinal stem cell differentiation downstream of a FOXO/Notch axis. Cell Metab. 32 (5), 889-900.e7 (2020).
- Ettayebi, K., et al. Replication of human noroviruses in stem cell-derived human enteroids. Science (1979). 353 (6306), 1387-1393 (2016).
- Zhou, J., et al. Infection of bat and human intestinal organoids by SARS-CoV-2. Nat Med. 26 (7), 1077-1083 (2020).
- Joo, S. -S., et al. Porcine intestinal apical-out organoid model for gut function study. Animals. 12 (3), 372(2022).
- Co, J. Y., et al. Controlling epithelial polarity: A human enteroid model for host-pathogen interactions. Cell Rep. 26, 2509-2520.e4 (2019).
- Sasaki, N., et al. Development of a scalable coculture system for gut anaerobes and human colon epithelium. Gastroenterology. 159 (1), 388-390.e5 (2020).
- Mayorgas, A., et al. A novel strategy to study the invasive capability of adherent-invasive escherichia coli by using human primary organoid-derived epithelial monolayers. Front Immunol. 12, 646906(2021).
- Csukovich, G., et al. Neutralising effects of different antibodies on clostridioides difficile toxins TcdA and TcdB in a translational approach. Int J Mol Sci. 24 (4), 3867(2023).
- Csukovich, G., et al. Polarity reversal of canine intestinal organoids reduces proliferation and increases cell death. Cell Prolif. 57 (2), e13544(2023).
- Kramer, N., et al. Generation of differentiating and long-living intestinal organoids reflecting the cellular diversity of canine intestine. Cells. 9 (4), 822(2020).
- Pleguezuelos-Manzano, C., et al. Establishment and culture of human intestinal organoids derived from adult stem cells. Curr Protoc Immunol. 130 (1), e106(2020).
- Dutta, D., Heo, I., O'Connor, R. Studying infection in 3D tissue-derived human organoid culture systems by microinjection. J Vis Exp. (151), e59610(2019).
- Kumar, A., et al. Decreased SLC26A3 expression and function in intestinal epithelial cells in response to Cryptosporidium parvum infection. Am J Physiol Cell Physiol. 317 (6), C1205-C1212 (2019).
- Dutta, D., Clevers, H. Organoid culture systems to study host-pathogen interactions. Curr Opin Immunol. 48, 15-22 (2017).
- Csukovich, G., Pratscher, B., Burgener, I. A. The world of organoids: Gastrointestinal disease modelling in the age of 3R and one health with specific relevance to dogs and cats. Animals. 12 (18), 2461(2022).
- Han, X., et al. Creating a more perfect union: Modeling intestinal bacteria-epithelial interactions using organoids. Cell Mol Gastroenterol Hepatol. 12 (2), 769-782 (2021).
- Li, Y., et al. Next-generation porcine intestinal organoids: an apical-out organoid model for swine enteric virus infection and immune response investigations. J Virol. 94 (21), e01006-e01020 (2020).
- Smith, D., et al. The development of ovine gastric and intestinal organoids for studying ruminant host-pathogen interactions. Front Cell Infect Microbiol. 11, 733811(2021).
- Nash, T. J., Morris, K. M., Mabbott, N. A., Vervelde, L. Inside-out chicken enteroids with leukocyte component as a model to study host-pathogen interactions. Commun Biol. 4 (1), 377(2021).
- Hanson, K. I., Weiss, A. A. Intestinal tissue response to Shiga toxin exposure. mBio. 15 (9), e0123224(2024).
- Hovhannisyan, P., et al. Infection of human organoids supports an intestinal niche for Chlamydia trachomatis. PLoS Pathog. 20 (8), e1012144(2024).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved