Method Article
Mekansal transkriptomik analiz için larva zebra balığı bölümlerinin mekansal olarak kompakt düzenlenmesi
Bu Makalede
Özet
Burada, birden fazla Zebra Balığı (Danio rerio) larva örneğini hizalamak ve kriyoseksiyona tabi tutmak ve bunları mekansal transkriptomik analiz için tek bir slaytta toplamak için bir yöntem sunuyoruz.
Özet
Mekansal transkriptomik teknikler, biyomedikal araştırmalarda mekansal olarak kaydedilmiş gen ekspresyon modellerini görselleştirmek için gelişmiş bir araçtır. Mekansal görüntüleme platformları ile birden fazla numunenin görüntülenmesi ve analizi maliyetli olabilir. Bu testlerin gelişimsel çalışmalarda da görüldüğü gibi birden fazla deney koşulu üzerinden yapılması maliyetleri daha da artırmaktadır. Maliyetleri azaltmak için bu çalışma, gelişimsel çalışmalar için uzamsal transkriptomik örnek düzenleme tekniklerini ve stratejilerini optimize etmeye çalıştı. Burada, çalışma, gelişim sırasında şeffaf olan, insanlara ~% 70 genetik homolojiye sahip olan ve transkriptomik analiz için ideal olan yüksek açıklamalı bir genoma sahip, köklü bir gelişimsel omurgalı modeli olan zebra balıklarını kullandı. Küçük boyutları nedeniyle, zebra balığı geliştirmek, seri bölümlerin birkaç biyolojik kopya boyunca kompakt bir şekilde yerleştirilmesine de izin verir. Burada, bir multipleks in situ hibridizasyon mekansal görüntüleme platformunun görüntüleme alanı içinde birden fazla balık örneğinin optimize edilmiş fiksasyonunu, kriyoseksiyonunu ve güvenilir hizalamasını rapor ediyoruz. Bu yöntemle, en az 4 farklı küften ve 174 bölüme kadar zebra balığı döllenmeden 15 gün sonra (dpf) başarılı bir şekilde kriyoseksiyone alınabilir, 22 mm 10,5 mm'lik görüntüleme alanı içinde toplanabilir ( yerinde mekansal transkriptomik slayt için) ve aynı anda işlenebilir. Bölüm kalitesine, numune hizalamasına ve slayt başına numune boyutuna bağlı olarak, zebrafish'teki bu yöntem, uzamsal transkriptomik tekniklerin çıktısını ve numune başına maliyetini optimize eder.
Giriş
Dokudaki uzamsal olarak farklı ekspresyon modellerinin değerlendirilmesi, gelişim, kanser ve hastalıktaki genomik etkileri anlamamız için kritik öneme sahiptir 1,2,3. Uzamsal transkriptomik, çoğullanmış ekspresyon tekniklerini dokulardaki ekspresyonun uzamsal kaydı ile birleştirir. "Mekansal transkriptomik" ilk olarak Ståhl ve meslektaşları4 tarafından icat edildi ve burada monte edilmiş kanser örnekleri yerinde yeni nesil dizileme kullanılarak incelendi. O zamandan beri, "uzamsal transkriptomik", uzamsal kayıt ile birlikte yüksek verimli ifade çalışmaları için her şeyi kapsayan bir yöntem olarak kullanılmıştır. Bunlar güçlü araçlar olmakla birlikte, aynı zamanda verilerin oluşturulabilmesi için genellikle büyük kurumsal yatırım ve laboratuvar maliyetleri gerektiren pahalı girişimlerdir5. Yüksek kaliteli verileri korurken maliyeti en aza indirmeye yönelik stratejiler yüksek talep görmektedir.
Zebra balığı, Danio rerio, gelişim biyolojisi çalışmaları için önemli bir model sistem haline gelmiştir ve omurgalı tüm organ (ve organizma) analizlerini sınırlı bir alanda çoğaltmanın bir yolunu sunmaktadır. Zebra balığı küçüktür (larva olarak 4-6 mm ve yetişkin olarak 2-3 cm) ve bir seferde yüzlerce şeffaf yumurta bırakabilir6. Zebra balığı embriyoları dışarıdan döllenir ve hızla gelişir, bu da araştırmacıların gelişimin erken aşamalarında kolayca fonksiyon kazancı ve kaybı alelleri oluşturmak için transgenleri tanıtmalarına olanak tanır7. Tek bir slayta birden fazla numune sığdırmak, maliyetleri azaltmak için çekici bir stratejidir. Yüksek doğurganlıkları ve küçük boyutları, zebra balıklarını, örnekler için kısıtlı alana sahip olan uzamsal transkriptomik tahlilleri çoğullamak için ideal bir aday yapar8.
Zebra balığı larvalarının kriyoseksiyonu zorlu bir tekniktir. Birçok uzamsal transkriptomik platform, zebra balığı parafin kesitleri için optimize edilmemiştir ve doku yapısını korumak ve RNA transkriptlerini korumak için model organizma olarak zebra balığı ile çalışırken kriyoseksiyonlar gerektirir. Ek olarak, zebra balığının küçük boyutu, kaliteli kriyoseksiyonlar elde etmeyi ve birden fazla numuneyi etkili bir şekilde analiz etmeyi zorlaştırır. Yetişkin muadillerinden daha küçük ve daha kırılgan olan zebra balığı larvaları ile çalışırken bu görev daha zor hale gelir. Bu zorlukların üstesinden gelmek için, birden fazla numuneyi güvenilir bir şekilde hizalayan ve daha sonra uzamsal görüntüleme platformları tarafından görüntülenebilen ve analiz edilebilen tek bir slayt üzerinde birçok yüksek kaliteli bölüm elde etmek için uzamsal görüntüleme platformlarının görüntüleme alanını verimli bir şekilde kullanan bir yöntem açıklıyoruz (Şekil 1). Bu durumda, bu yöntem uzamsal bir transkriptomik görüntüleme platformuna uygulanır.
Protokol
Bu protokol, Dartmouth College'ın kurumsal hayvan bakımı ve kullanımı komitesinin yönergelerini takip eder.
1. Kriyostatın hazırlanması
- Kriyostatı -22 °C'ye soğutun ve kriyostatın iç yüzeylerini, kalıntıları hazneye fırçalayarak temizleyin. Gerekli tüm fırçaları ve aletleri haznenin içine yerleştirin.
2. Tek kullanımlık taban kalıbının hazırlanması
- Numune hizalaması için bir referans noktası olarak kullanmak üzere kalıcı bir işaretleyici ile bir temel kalıbın içi boyunca düz bir çizgi çizerek numune hizalaması için bir taban kalıbı (37 mm 24 mm 5 mm tek kullanımlık plastik kalıp) hazırlayın. En iyi sonuçlar için bir çizgi çizmeden önce düz çizginin olması gereken taban kalıbının içine bir parça laboratuvar bandı yerleştirin (Şekil 2A).
- Kriyoseksiyon sırasında uygun numune oryantasyonunu sağlamak için taban kalıbının iç kısmına sol veya sağ duvara yakın bir nokta çizin (Şekil 2B).
- İstenen kesme açısını bir iletki ile ölçün ve bunu her numune için taban kalıbının iç kısmında işaretleyin (Şekil 2C).
- Hazırlanan taban kalıbına sığ bir dondurma tabakası (optik koherens tomografi [OCT]) ortamı uygulayın. Numuneleri kaplamaya yetecek kadar dondurma ortamı olduğundan emin olun.
- Orta şişenin ağzını astarlayarak ve taban kalıbının yatay düzlemini kaydırmadan önce taban kalıbının bir köşesine gerekli miktarda ortam ekleyerek dondurma ortamını uygularken hava kabarcıklarından kaçının, böylece ortam tüm yüzeye eşit olarak dağıtılır.
- Dondurma ortamını dağıtırken şişeyi yavaşça sıkın.
- 1 L'lik bir behere buz ekleyin, dondurma ortamlı taban kalıbını buz banyosuna yerleştirin ve ortamı soğutmak için en az 10 dakika inkübe edin.
3. Kuru buz hazırlama:% 100 etanol banyosu
- Bir buz kovasındaki bir kısım kuru buza bir kısım %100 etanol ekleyerek çeker ocakta kuru buz ve %100 etanol banyosu hazırlayın.
- Tek kullanımlık bir alüminyum tabak kullanın veya alüminyum folyoyu tek kullanımlık bir taban kalıbına sığacak kadar büyük bir tekneye katlayın. Çanak veya teknenin, taban kalıbının tamamen düz durması için yeterince büyük olduğundan emin olun.
- Çanağı veya tekneyi banyoya yerleştirin ve kovayı kapatın. Numuneleri dondurmadan önce kovanın soğuması için 5-10 dakika bekleyin.
4. Ötenazi örnekleri
- Bölümlere ayırmak için rastgele zebra balığı seçin. Örneklerin boyutları değişiyorsa, doğru hizalamayı kolaylaştırmak için bunları göreceli boyuta göre gruplara ayırın (ayrıntılar için tartışmaya bakın). Büyük balıkları ve küçük balıkları ayrı tabaklara koyun.
- Bir beheri balık sistemi suyuyla doldurun ve kabı bir buz kovasına koyun. Beheri buzla çevreleyin.
- Suyun sıcaklığını bir termometre ile izleyin. Sıcaklığın 2-4 °C arasında sabitlenmesine izin verin.
- Bir grup balığı 4 °C suya koymak için bir ağ veya süzgeç kullanın. Balıklar tamamen suya batırılmalı ve buzla temas ettirilmemelidir. Operküler hareket durduğunda, 4 °C'nin altında kalmasını sağlamak için suya buz ekleyin. Balıkları 4 °C suda 10 dakika bekletin.
NOT: Bir sonraki gruba ötenazi yapmadan önce her bir ötenazi örneği grubunun gömülmesi, hizalanması ve hızlı dondurulması ile devam edin. Her seferinde suyu değiştirin.
5. Gömme ve hizalama
- Ötenazi yapılmış balıkları 10 dakika boyunca 4 °C suya batırıldıktan sonra toplayın. Balıkları ince uçlu forseps ile kuyruk yüzgecinden tutarak sudan çıkarın ve emici, tüy bırakmayan bir mendile hafifçe bastırarak kurulayın.
NOT: Yüksek kaliteli bölümler için, balıkların 4 °C sudan çıkarılması ile hızlı dondurma arasındaki süreyi sınırlamak çok önemlidir - Hazırlanan taban kalıbı ile bir buz banyosunda stereomikroskop altında (10x büyütme) çalışarak, her bir numuneyi referans noktaları boyunca doğru yönde temel kalıba yerleştirin ve numuneleri başka bir ince dondurma ortamı tabakası ile nazikçe kaplayın.
NOT: Tüm kalıbı donma ortamı ile doldurmayın. Bunun yerine, yalnızca tüm numuneleri kaplayacak kadar ince bir tabaka kullanın. - Balıkları taban kalıbının iç kısmında işaretlenmiş çizgilere hassas bir şekilde hizalamak için anatomik bir referans noktası kullanın. Her balığın yönünü aynı hizada ve aynı yönde olacak şekilde ayarlamak için ince uçlu forseps kullanın. Yavaş hareket ederek donma ortamında kabarcıklar oluşturmaktan kaçının.
- Numunelerin altındaki taban kalıbının altına, yerel olarak dondurulana kadar bir parça kuru buz uygulayın. Kuru buzla donmadan önce numunelerin referans noktalarından kaymasını önlemek için temel kalıp seviyesinin yatay düzlemini koruyun.
- Numunelerle birlikte taban kalıbını kuru buz:% 100 etanol banyosunda alüminyum tekne veya tabağa yerleştirin. Teknenin banyo yüzeyinde yüzdüğünden ve taban kalıbının kuru kaldığından emin olun. Banyoyu örtün ve numunelerin 10 dakika yüzmesine izin verin.
- Donmuş taban kalıbını folyoya sarın ve bölümlere ayrılmaya hazır olana kadar -80 °C dondurucuda saklayın. Kalan gruplar için 4.2-5.6 adımlarını tekrarlayın.
6. Kriyoseksiyon
- Donmuş baz kalıplarını kriyoseksiyon için önceden soğutulmuş kriyostata getirin ve kriyostat odasına yerleştirin. Çözülmeyi önlemek için donmuş blokları kuru buzlu bir kutuda taşıyın.
- Yerinde uzamsal görüntüleme slaytını depodan çıkarın ve önceden soğutulmuş bir slayt tutucusuna yerleştirin. Uzamsal görüntüleme slaytlı sürgü tutucuyu, ilgilenilen bölgeden kesitleri toplamaya hazır olana kadar -22 °C kriyostat odasında saklayın.
- Dondurulmuş numuneleri taban kalıbından çıkarın ve ardından taze bir dondurma ortamı olan bir aynada dondurun. Kesme yüzeyi bıçağa bakacak şekilde aynanın üzerine dondurun.
- Kriyostata yeni, ince bir mikrotom bıçağı yerleştirin.
- Kalıbı bıçağa hizalayın ve ilgilenilen bölgeyi kesin (önerilen trim kalınlığı 20-50 μm). Numuneler içindeki konumu tanımlamaya yardımcı olmak için kalıbın içinde yapılan işaretlerin donmuş numune bloğuna aktarıldığından emin olun.
- Düzeltme aşamasında kalıbı, kesme yüzeyi dondurma ortamındaki referans işaretlerine paralel olacak şekilde ayarlayın.
- Kesitleri standart pozitif yüklü bir mikroskop lamı üzerine toplayın ve kırpmanın artık gerekli olmadığını doğrulamak için parlak alan ile kontrol edin.
- Uzamsal görüntüleme slaytını kriyostat odasından çıkarın ve 4 °C'lik bir buz banyosuna yerleştirin. Slaytı sürgü tutucusunda tutun. Kaydırağın ıslanmadığından emin olun.
- Kriyoseksiyona başlayın (önerilen 10-14 μm; Şekil 3) ve numunelerdeki ilgilenilen bölgeye ulaşılana kadar bölümleri pozitif yüklü slaytlar üzerinde toplayın. İlgilenilen bölgenin kalıptan bir sonraki bölüm olacağını onaylamak için brightfield'a göre bölümleri kontrol edin.
- Tek hücreli uzamsal görüntüleme slaytını kriyostat odasına geri getirin. Slaytı slayt tutucusundan çıkarın ve bölümlerin yuvarlanmasını önlemek için ince uçlu bir boya fırçası kullanarak tam ilgi alanındaki bölümleri uzamsal görüntüleme slaydına satır satır toplayın.
- Boş, dondurucu ortamın bir köşesini boya fırçasının arka tarafıyla bıçak aşamasına bastırın, böylece slaytı toplamak için tutarken bölüm düz kalır.
- Sürgünün üst kısmını pivot noktası olarak kullanın, sürgüyü yavaşça bölümün üzerine indirin ve sürgüyü bıçak aşamasından kaldırmadan önce bölümlerin 3 saniye boyunca sürgüne yapışmasına izin verin.
- Slaytın görüntüleme alanındaki bölümleri toplarken soldan sağa doğru çalışın ve mümkün olduğunda boş, donma ortamının katmanlarını üst üste getirin.
- Dokunun görülmesi zorsa, slaytın görüntüleme alanı içindeki bölümleri yerleştirmek için referans olarak renkli kağıt kenarlıkları kullanın.
- İlgilenilen bölgeden bölümleri topladıktan sonra, sürgüyü tekrar sürgü tutucusuna yerleştirin. Uzamsal görüntüleme slaytı üzerinde toplanacak başka numune yoksa, slaytı yerinde uzamsal görüntüleme platformuyla cihaz analizine hazır olana kadar -80 °C'de 2 haftaya kadar saklayın. Bölümlerin birden fazla kalıptan toplanması gerekiyorsa, uzamsal görüntüleme slaytını 4 °C buz banyosuna geri koyun ve bir sonraki kalıpla 6.3-6.11 adımlarını tekrarlayın.
- Analize devam etmeden önce numune hizalamasının ve kesit kalitesinin yeterli olup olmadığını kontrol etmek için hematoksilen ve eozin (HE) boyama için standart bir pozitif yüklü mikroskop lamı üzerinde her kalıptan ilgilenilen bölge bölümlerinden önce ve sonra bölümleri toplayın.
7. Numunenin sabitlenmesi
- Referans slaytları kriyostattan çıkarın ve bölümleri slayta yapıştırmak için RT'de 30 dakika havayla kurutun.
- Bölümleri 20 dakika boyunca %4 paraformaldehit içeren bir slayt kabına (Tablo 1) yerleştirerek sabitleyin.
- Bölümleri 3 dakika boyunca damıtılmış su ile sürgülü bir kaba koyarak yıkayın.
- HE boyamaya devam edin veya kurutun ve gelecekteki boyama için slaytları -80 °C'de saklayın.
8. Bölümlerin boyanması
- Slaytları 2 dakika% 100 etanol, % 95 (Tablo 2) etanol içinde 2 dakika ve ardından 1 dakika musluk suyunda inkübe ederek bölümleri kurutun ve temizleyin. Slaytları banyodan banyoya aktarmak için bir mikroskop slayt boyama rafı kullanın.
- Slaytları Hematoksilen içinde 2 dakika 45 s, musluk suyunda 1 dakika, %0.3 asitlenmiş alkolde (Tablo 3) 1 dakika ve ardından 1 dakika musluk suyu akıtarak çekirdekleri boyayın ve farklılaştırın. Slaytları banyodan banyoya aktarmak için bir mikroskop slayt boyama rafı kullanın.
- Sitoplazmik bileşenleri boyayın ve slaytları Eozin Y% 1'de 45 s, %50 etanolde (Tablo 4) 1 dakika, %95 etanolde 1 dakika ve %100 etanolde 1 dakika inkübe ederek dehidrat edin. Slaytları banyodan banyoya aktarmak için bir mikroskop slayt boyama rafı kullanın.
- Slaytları Ksilen içinde 1 dakika inkübe ederek bölümleri temizleyin. Bir transfer pipeti ile sürgünün üst üçte birlik kısmına bir damla montaj ortamı uygulayarak ve forseps ile montaj ortamının üzerine bir lamel yavaşça indirerek kızakları monte edin ve örtün.
9. Mekansal transkriptomik görüntüleme ve kesitlerin analizi
- Görüntüleme slaytlarını -80 °C depolama alanından çıkarın ve uzamsal transkriptomik analiz için yerinde uzamsal görüntüleme platformuyla görüntü alın.
NOT: Görüntülemede yer alan kesin adımlar, uzamsal görüntüleme platformu tarafından belirlenecektir. - Mekansal transkriptomik platformun kalite kontrol metriklerini gözden geçirin. Kontrol edilmesi gereken önemli metrikler, tespit edilen hücre sayısı, hücre başına medyan transkriptler, 100μm2 başına nükleer transkriptler ve prob setindeki her bir genin toplam yüksek kaliteli kodu çözülmüş transkriptleridir.
NOT: Bu kalite kontrol metriklerinin evrensel eşikleri yoktur ve bu eşiklere ilişkin beklentiler, kullanılan örneğe ve gen paneline bağlı olarak değişecektir. - Tespit edilebilir RNA transkriptlerinin veri çıktısını okuyun, deneyin kalite kontrol metriklerine göre hangi transkriptlerin düşük kaliteli olduğunu belirleyin ve düşük kaliteli transkriptleri filtreleyin. Kalan yüksek kaliteli transkriptleri, bölüm içindeki mekansal düzenlemeleriyle ilişkili olarak analiz edin.
- Deneysel ilgi alanlarına dayalı olarak bölümlerin ve küme hücrelerinin hücresel segmentasyonunu görüntüleyin. Aynı slaytta farklı yaşlardaki zebra balığı gruplarındaki ilgilenilen bölgenin hücre kümeleri içindeki RNA transkriptlerini karşılaştırın.
Sonuçlar
Bu yöntemde (Şekil 1), zebra balığı, uzamsal olarak çözülmüş gen ekspresyon modellerini araştırmak için bir hayvan modeli olarak kullanılır. Uzamsal görüntüleme için larva zebra balıklarını verimli bir şekilde kriyoseksiyon yapmak zordur. Doku yapısını ve saptanabilir genleri korumak için kesitler yüksek kalitede olmalıdır (Şekil 4). Mekansal olarak verimli görüntüleme için birden fazla numune içeren bölümler, tüm numunelerdeki ilgi alanlarını analiz etmek için hassas bir şekilde hizalanmalıdır (Şekil 2 ve Şekil 5). Son olarak, uzamsal bir transkriptomik slaytın görüntüleme alanı içindeki potansiyel veri noktalarının sayısını en üst düzeye çıkarmak için bölümler verimli bir şekilde toplanmalı ve aralıklandırılmalıdır (Şekil 3 ve Şekil 6). Deneyler, başarılı olup olmadıklarını belirlemek için bu üç parametre kullanılarak ölçüldü.
Birçok protokol değişikliği, uzamsal transkriptomik görüntüleme için iyi adaylar olan yüksek kaliteli bölümleri toplama yeteneğimize katkıda bulundu. Ötenazi, fiksasyon ve gömme protokollerinin ayarlanması, bölüm kalitesinde iyileştirmelere yol açmıştır (Şekil 4). İlk protokolde (Şekil 4, protokol 1), kesit kalitesi optimalin altındaydı ve dokular yapılarını koruyamadı. Bunu düzeltmek için, ikinci protokolde (Şekil 4, protokol 2), kesitler slaytlar üzerine toplandıktan sonra numuneler ve sabit doku gömüldükten sonra bir flaş dondurma adımı tanıtıldı. Bu, bölümlerin genel doku yapısını iyileştirdi, ancak mekansal transkriptomik için kabul edilebilir olduğu düşünülen kaliteye ulaşamadı. Son olarak, üçüncü protokolde (Şekil 4, protokol 3), ötenazi teknikleri, balıkları ötenazi yapmak için geçen sürenin kısaltılması ve balıkların ani dondurmadan önce buz üzerine gömülmesi ve ardından toplama sonrası kesitleme ve fiksasyon ile rafine edildi. Bu, uzamsal transkriptomik görüntüleme için iyi adaylar olan en yüksek kaliteli örneklerle sonuçlandı.
Birden fazla örneği ilgilenilen bir bölgeye hizalamak, protokolde de bazı değişiklikler yapılmasını gerektirdi. Numuneler arasında hizalamayı en çok iyileştiren modifikasyonlardan biri, zebra balığının gömülü olduğu temel kalıplara referans noktaları eklemekti (Şekil 2). Bu çalışmada yapılan deneylerde, numuneler aynı kesimdeki birden fazla bölümdeki yapılar karşılaştırılarak hizalanmıştır (Şekil 5).
Verimli uzamsal transkriptomik için yöntemin geliştirilmesindeki son önemli adım, farklı yaşlardaki bu yüksek kaliteli, hizalanmış örneklerin çoğunu görüntüleme için aynı slayta sığdırmaktı. Deneyim kazanmak ve teknik becerilerin geliştirilmesi, toplanan numune sayısının artmasına katkıda bulunur. Bu iyileştirmeler aynı zamanda büyük ölçüde protokoldeki gömme ve toplama adımlarında yapılan küçük ayarlamalardan da kaynaklanıyordu. Şekil 6'daki bu paneller, zaman içinde her bir slaytın görüntüleme alanında toplanan kesit sayısını vurgulamaktadır. Şekil 6A (15 dpf balığın 40 bölümü), kesitleme sırasında bir kalıp kullanan erken bir çalışmadır. Şekil 6B (15 dpf balığının 90 bölümü ve 26 dpf balığının 47 bölümü) ikinci bir kalıbı tanıtır ve gömme sırasında numuneler arasındaki boşluk miktarını azaltarak uzamsal düzenlemedeki iyileşmeyi gösterir. Şekil 6C (15 dpf balığının 54 bölümü, 19 dpf balığının 80 bölümü, 23 dpf balığının 24 bölümü ve 26 dpf balığının 21 bölümü) üçüncü ve dördüncü bir kalıbı tanıtır ve numunelerin etrafındaki bloğun kesme yüzeyini kırparak ve boş, donma ortamının üst üste binmesiyle uzamsal bir düzenlemede sürekli iyileştirmeyi gösterir. Bu iyileştirmeler, mekansal transkriptomik slaytımızın görüntüleme alanına 179 kesit yerleştirme ve 4 farklı yaştaki balıkları test etme fırsatı verdi.
Protokolün tamamlanmasının ardından, hem kullanıma hazır çoğullanmış yerinde yazılımla hem de özel yöntemlerle kolayca analiz edilebilen numunelerimiz vardı. Burada kullanılan multipleks yazılımı, sıralama verileri9'daki phred kalite puanlarına gevşek bir şekilde dayanan bir sahte phred puanı kullandı. Puanlar %59 ile %70 arasında değişiyordu ve %60, daha düşük kaliteli okuma uyarısı için son sınırdı. İnceleme üzerine, düşük sözde phred puanı, bölümler arasındaki boş alandaki düşük sinyal karmaşıklığından kaynaklanıyordu. Kaydırak alanı verimli bir şekilde kullanılmasına rağmen, kaydırak alanı hala %>50 boştu. Sinyalin yeterince karmaşık olduğu doku tarafından işgal edilen kayma alanının oranı hesaba katıldığında, sinyal kalitesi mükemmeldi.
Düşük yoğunluklu, spesifik olmayan sinyaller slayttaki iki genel bölgede de görülmüştür: örneklerin dışında ve boş notokord içinde (Şekil 7A). Kesitlerin dışında, numunelerden uzaklaşmayı azaltacak bir yıkama artefaktı ile tutarlı bir model vardı (Şekil 7B). Notokord tarafından işgal edilen örneklerin boş bölgelerinde spesifik olmayan bir sinyal de görüldü. Bu, amplifikasyon reaktiflerinin sıkışabileceği olası bir yıkama artefaktı olarak kabul edildi. Her iki bölgedeki transkriptler büyük ölçüde sitoplazmik (yani ribozomal proteinler L3 ve L4) veya mitokondriyal (aspartat transferaz ve izositrat dehidrojenaz) idi. Bu bölgeler, çekirdek10 etrafındaki transkriptlerin lokalizasyonuna ve kümelenmesine dayalı olarak hücreleri tanımlayan Baysor segmentasyonuna dahil edildiğinde, segmentasyon analizi, bazen bunları içeren hücre sınırlarını içeriyordu. Bu sinyal, numuneden kolayca ayırt edilebilecek kadar düşüktü.
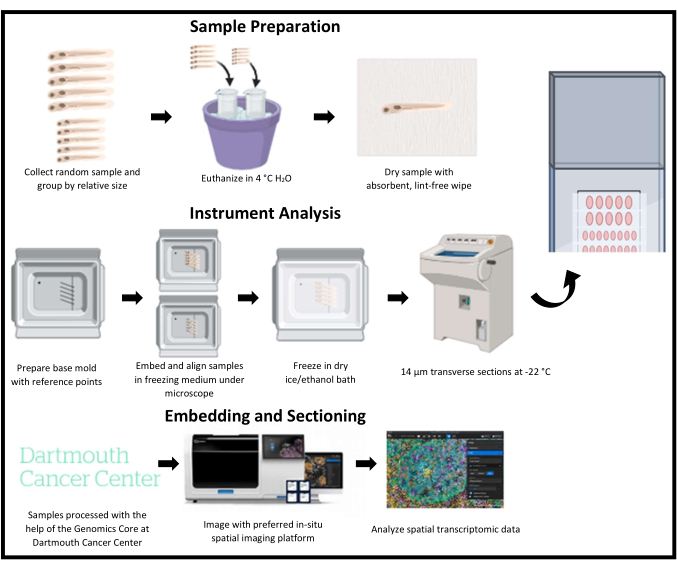
Şekil 1: Zebra balıklarında uzamsal transkriptomik için kriyoseksiyonun şematik taslağı. Yavru zebra balığı rastgele toplanır ve daha sonra göreceli boyuta göre gruplandırılır. Numuneler daha sonra bir dondurma ortamına gömülür ve ilgilenilen bir bölgeye karşılık gelen temel kalıp üzerindeki referans noktaları ile hizalanır. Her kalıp flaşla dondurulur, kriyoseksiyona alınır ve aynı slaytta her seferinde bir sıra toplanır. Slaytlar, kesitlere ayrıldıktan sonra -80 °C'de saklanır ve uzamsal bir transkriptomik görüntüleme platformu kullanılarak görüntülenir ve analiz edilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: Hassas kesit alma için referans noktalarının oluşturulması. Bir dizi görüntü, kriyoseksiyon için birden fazla numuneyi hizalamak için tek kullanımlık bir temel kalıba referans noktaları ekleme sürecini göstermektedir. İlk adım (A), kalıbın iç kısmında tüm numunelerin hizalama için referans olarak kullanacağı bir çizgiyi işaretlemek için laboratuvar bandı kullanmaktır. (B) Kriyoseksiyon sırasında uygun numune oryantasyonunu bildirmek için kalıbın iç kısmına sol veya sağ duvarın yanına bir nokta yerleştirin ve ardından (C) her numune için istenen açıda çizgiler işaretleyin. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
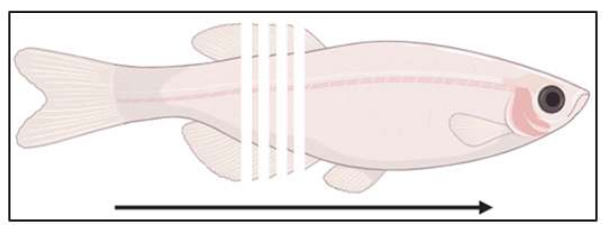
Şekil 3: Kesit konumunun şeması. Balıklar 14 μm aralıklarla kaudalden rostral'a koronal olarak ayrılır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
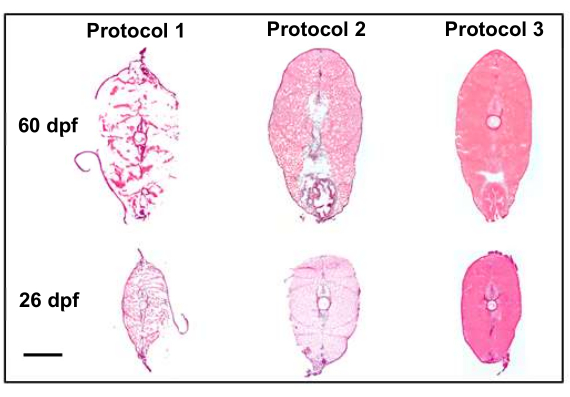
Şekil 4: Protokol değişiklikleri ile bölüm kalitesinin iyileştirilmesi (10x). Şekil, optimal olmayan doku kalitesiyle sonuçlanan ilk iki protokolü, mekansal transkriptomik için iyi adaylar olan yüksek kaliteli kesitlerle (morfolojiyi koruyan) sonuçlanan son protokolle karşılaştırır. Protokol 1, kesitlemeden önce %8 paraformaldehit fiksasyonu ile vurgulanan Penn State bio-atlas'ın karşılaştırmalı analizi4'i kullanır. Protokol 2, ötenaziden sonra kuru buz/etanol flaş dondurma ve kesit sonrası fiksasyonu tanıtır, bu da kesit boyunca donma artefaktları uyarısı ile doku yapısını çok daha iyi korur. Protokol 3, ötenazi tekniklerini ve flaş dondurmadan önce buz üzerine gömmeyi ve ardından toplama sonrası kesit ve fiksasyonu rafine etti, bu da en yüksek kalitede numunelerle sonuçlandı. Ölçek çubuğu 500 μm'dir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 5: Çoklu kesit hizalamasının doğrulanması (20x). Tek bir kesimde birden fazla numune arasındaki hizalamayı vurgulayan 26 dpf bölümünün temsili HE görüntüleri. Ölçek çubuğu 500 μm'dir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 6: Örneklerin geliştirilmiş uzamsal düzenlemesi. Bu paneller, zaman içinde her slaytın görüntüleme alanında toplanan bölümlerin sayısını vurgular. Deneyim kazanmak ve teknik becerilerin geliştirilmesi, toplanan numune sayısının artmasına katkıda bulunur. Bu iyileştirmeler aynı zamanda büyük ölçüde protokoldeki gömme ve toplama adımlarında yapılan küçük ayarlamalardan da kaynaklanıyordu. Panel A (15 dpf balığın 40 bölümü), kesitleme sırasında bir kalıp kullanan erken bir çalışmadır. Panel B (15 dpf balığın 90 bölümü ve 26 dpf balığının 47 bölümü) ikinci bir kalıp sunar ve gömme sırasında numuneler arasındaki boşluk miktarını azaltarak uzamsal bir düzenlemede iyileşme gösterir. Panel C (15 dpf balığın 54 bölümü, 19 dpf balığının 80 bölümü, 23 dpf balığının 24 bölümü ve 26 dpf balığının 21 bölümü) üçüncü ve dördüncü bir kalıbı tanıtır ve numunelerin etrafındaki bloğun kesme yüzeyini kırparak ve boş, dondurucu ortamın üst üste binmesiyle uzamsal bir düzenlemede sürekli iyileştirme gösterir. Her paneldeki braketler, kesit alma sırasında kullanılan farklı kalıpları temsil eder. Kesitler 10,5 mm 22 mm alan üzerindedir. Ölçek çubuğu 4 mm'dir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 7: Uzamsal transkriptomik deneyimizin temsili sonuçları. (A) Şekil 6C'de görüldüğü gibi protokolle işlenen bir slaydın tek bir görüntüsü. (B) Uzamsal transkriptomik görüntülemeden sonra 15 dpf'de bir zebra balığının 14 μm kesitleri, bölümlere bitişik ve notokord içinde spesifik olmayan sinyal gösterir. Ölçek çubuğu panel A'da 4 mm'dir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| % 4 paraformaldehit | Stok Konsantrasyonu | Miktar | Son Konsantrasyon |
| Paraformaldehit (toz) | 95 % w/w | 40 gr | 4 % w/v |
| NaOH (NanoOH) | 1 N | Damla damla (toz eriyene kadar) | |
| Hcl | 1 N | Damla damla (6.9 pH'a kadar) | |
| PBS 1x Hisse Senedi | 1 katı | ~1000 mL (1000 mL toplam hacme ulaşın) | 1 katı |
| Toplam | 1000 mL |
Tablo 1: %4 Paraformaldehit formülü. Numuneleri sabitlemek için% 4 paraformaldehit çözeltisinin bileşimi.
| % 95 Etanol | Stok Konsantrasyonu | Miktar | Son Konsantrasyon |
| 200 geçirmez etanol | %100 V/V | 190 mL | %95 V/V |
| RO suyu | %100 V/V | 10 mL | %5 V/V |
| Toplam | 200 mL |
Tablo 2: %95 Etanol formülü. H & E boyama sırasında bölümleri kurutmak için% 95 etanol çözeltisinin bileşimi.
| % 0.3 Asitlenmiş alkol | Stok Konsantrasyonu | Miktar | Son Konsantrasyon |
| Buzlu asetik asit | %100 V/V | 300 μL | % 0.3 v / v |
| RO suyu | %100 V/V | 99,7 mL | %99,7 V/V |
| Toplam | 100 mL |
Tablo 3: %0.3 Asitlenmiş alkol formülü. HE boyama sırasında ayırt etmek için% 0.3 asitleştirilmiş alkol bileşimi.
| % 50 Etanol | Stok Konsantrasyonu | Miktar | Son Konsantrasyon |
| 200 geçirmez etanol | %100 V/V | 100 mL | %50 V/V |
| RO suyu | %100 V/V | 100 mL | %50 V/V |
| Toplam | 200 mL |
Tablo 4: %50 Etanol formülü. HE boyama sırasında bölümleri kurutmak için% 50 etanol bileşimi.
Tartışmalar
Bu rapor, geliştirme sırasında mekansal transkriptomik analizde model organizma olarak zebra balığı ile ilgili teknik zorlukların çoğuna ayrıntılı çözümler sunmaktadır. Bu zorlukların üstesinden gelirken, kompakt numune düzenlememiz, ortaya çıkan mekansal transkriptomik platformlardaki maliyetleri optimize eder1. Uzamsal görüntüleme için larva zebra balığının kriyoseksiyonu zordur. Bölümler, tatmin edici deneysel yürütme ve aşağı akış uzamsal analizi için yeterli doku yapısını ve transkript kalitesini korumalıdır8. Uzamsal olarak verimli görüntüleme için birden fazla örnek içeren dilimler, tüm örneklerdeki ortak ilgi alanlarını analiz etmek için hassas bir şekilde hizalanmalıdır. Son olarak, bir görüntüleme slaytının belirlenen alanı içindeki potansiyel veri noktalarının sayısını en üst düzeye çıkarmak için bölümler verimli bir şekilde toplanmalı ve aralıklarla yerleştirilmelidir.
Protokol, tek hücreli uzamsal görüntüleme platformları için mükemmel adaylar olan yüksek kaliteli bölümlerin toplanmasına izin verir. İlk değişiklik, zebra balıklarını hızlı dondurmak ve daha sonra bölümleri bir slayt üzerine topladıktan sonra% 4 paraformaldehit içinde sabitlemekti. Başlangıçta, zebra balığı gece boyunca 4 °C'de% 4 paraformaldehit ile sabitlendi ve daha sonra gömüldü ve bölümlere ayrıldı11. Numunelerin bölümlere ayrıldıktan sonra sabitlenmesinin seçilmesi, bütün bir numuneyi sabitlerken etkili bir şekilde korunmayan iç dokuların korunmasına yardımcı oldu (Şekil 4).
İkinci kritik değişiklik, doku bütünlüğünü korumak için ötenazi yönteminin rafine edilmesiydi. Zebra balığı, yeterince ötenazi yapıldıklarından emin olmak için başlangıçta 20 dakika boyunca 4 ° C suya yerleştirildi. Bu, IACUC yönergeleri için minimum gereksinimlerin 10 dakika ötesindedir. 4 °C'lik suda geçen bu ekstra süre, numunelere ayrışmaları için daha fazla zaman verdi ve çok ince veya hassas iç yapıların ideal olmayan kesit kalitesine katkıda bulundu. 4 °C'deki suda geçirilen sürenin minimum 10 dakikaya düşürülmesi, önceki kesit alma girişimlerinde eksik olan hassas iç yapıların korunmasına yardımcı oldu. Şekil 4'te gösterilmeyen diğer modifikasyonlar arasında ötenazi ile aynı gün bölümlere ayırma, ötenazi ile flaş dondurma arasındaki sürenin 15 dakikadan 5 dakikanın altına düşürülmesi ve gömme sırasında önceden soğutulmuş bir dondurma ortamı ile çalışılması yer alır. Numuneler kesit alınmadan önce -80 °C'de ne kadar uzun süre saklanırsa, kesitin doku kalitesi o kadar kötü olur. Farklılıklar inceydi, ancak ötenazi ve blok oluşturma ile aynı gün bölümlere ayırmak için idealdir. Ötenaziden sonra ve flaş dondurmadan önce numuneleri hizalamak için gereken süreyi 5 dakikadan fazla olmayacak şekilde kısaltmak, kesit kalitesi için kritik öneme sahiptir.
Birden fazla örneği ilgilenilen bir bölgeye hizalamak, protokolde de bazı değişiklikler yapılmasını gerektirdi. Elde edilen hizalama hassasiyeti (Şekil 5), numuneleri göreceli boyuta göre gruplandırdı ve verimli bir mekansal düzenlemeye en büyük katkıyı sağladı. Numuneleri hizalamak için birincil strateji, zebra balığını, içine yerleştirildikleri temel kalıplara çizilen referans noktaları üzerine yerleştirmektir. Örnekler, zebra balığının örnekleri içindeki istenen ilgi alanına bağlı olarak değişebilen anatomik yapılarla bu referans noktalarına hizalanır. Aynı yaştaki gelişmekte olan balıkların büyüklüğü %50'ye kadar değişebilir12. Büyük ölçüde farklı boyutlara sahip numuneler, anatomik referans noktası ile ilgilenilen bölge arasındaki değişen mesafeler nedeniyle yanlış hizalanabilir. Aynı yaştaki numuneleri göreceli boyuta göre gruplandırmak ve her boyutu kalıplarına gömmek, kalıpları içinde birden fazla numuneyi hizalama yeteneğini geliştirdi. Bu yöntem, ilgilenilen bölgenin izin verdiği pencereye ve anatomik referans noktası seçimine bağlı olarak numunelerin yaklaşık 2/3'ünü güvenilir bir şekilde hizalayabilir.
Gömme ve hizalama sırasında örnekler arasındaki boşluğun azaltılması, slayt başına daha fazla örnek sayısına yol açar. Bununla birlikte, bu sıkı konfigürasyon, görüntüleme alanındaki referans sınırları tarafından daha da kısıtlanır. Kriyostattaki deneyime ek olarak, bunları uzlaştırmak için çeşitli stratejiler açıklanmaktadır. İlk olarak, bölümler arasında üst üste binen gömme ortamının hassas bir şekilde yerleştirilmesi ve donmuş kalıbın kırpılması, belirli bir görüntüleme alanına sığabilecek bölümlerin sayısı üzerinde derin etkilere sahip olabilir. Şekil 6 , gömme düzenlemesini optimize etmeden önce ve sonra elde edilen bölümlerin sayısını vurgulamaktadır. İkinci olarak, görüntüleme slaytına uygun şekilde yerleştirilmesine yardımcı olmak için gömme sırasında ve dondurmadan önce en dıştaki numunelerin dışına bir sınır yerleştirildi. Üçüncüsü, larva zebra balığının boyutu ve şeffaf doğası, numunelerin bir slayt içinde nerede bulunduğunu bilmeyi zorlaştırabilir, böylece bir slayt üzerinde hassas bir şekilde toplanabilirler. En dıştaki numunelerin dışında bir sınır oluşturmak için beyaz dondurma ortamını kontrast oluşturmak için renkli kağıt kullanmanın, bölümlerin slaytlara çok daha hassas bir şekilde yerleştirilmesine yol açtığını bulduk.
Yerel sıcaklığın nüansları, kesme işlemi sırasında numunenin korunmasına yardımcı olur. Birden fazla kalıptan alınan numuneler tek bir slaytta toplandıktan sonra, görüntüleme lamı 4 °C'de saklanır, bir sonraki kalıp tekrar toplanmadan önce istenen ilgi alanına göre kesilir. Görüntüleme slaytının, slaytın yüzeyine düzgün bir şekilde yapışması için bölümlerden biraz daha sıcak olması gerekir. Bu nedenle, görüntüleme slaytını -80 °C'de veya kriyostatta -20 °C'de farklı kalıplardan numune toplama arasında saklamak ideal değildir. Görüntüleme slaytında toplanan numunelerin birden fazla donma/çözülme döngüsüne tabi tutulmaması da çok önemlidir, çünkü bu, her bir numune içindeki RNA transkriptlerinin kalitesini olumsuz etkileyebilir. Görüntüleme slaytını daha önce toplanan bölümlerle 4 °C'de tutmak, donma/çözülme döngüleri ile ilişkili olumsuz yan etkiler olmaksızın uygun yapışma için daha düşük bir sıcaklığı korurken RNA transkriptlerini yeterince korur13.
Tatmin edici sonuçlar elde edilmesine rağmen, bu yöntemin tasarımı olası sınırlamalarla birlikte gelir. İlk sınırlama, aynı slaytta görüntülenebilecek toplam bölüm sayısına bir tavan koyan uzamsal bir transkriptomik slaytın görüntüleme alanıyla sınırlı olmamızdır. Bölümler arasında hala boş alanımız olduğu göz önüne alındığında, bu yöntem için mümkün olanın sınırlarına henüz ulaşmamış olmamız muhtemeldir, ancak görüntüleme slaytına daha fazla bölüm sığdırmanın artık mümkün olmadığı bir nokta olduğunun farkındayız. Daha büyük yaşlarda daha büyük balıklarla çalışmak da toplam numune boyutunu sınırlayacaktır, ancak bir slaydın görüntüleme alanına sığabilecek toplam doku miktarını etkilememelidir. Uzamsal görüntüleme platformları tarafından yapılan teknik iyileştirmeler, görüntüleme slaytlarındaki görüntüleme alanını genişleterek görüntülenebilecek toplam doku miktarını artırabilir. Bu yöntemin bir başka sınırlaması, protokolün 15 dpf'den küçük balıklar için optimize edilmemiş olmasıdır. Balıkların genççe giderek daha kırılgan hale geldiği ve 15 dpf'den küçük balıkların idare edilmesinin son derece zor olduğu ve gömme işlemi sırasında kolayca zarar gördüğü bulundu. Bu, ötenazi ile flaş dondurma arasındaki sürenin artmasına neden oldu ve bu da doku kalitesine zarar verdi. Bu aynı zamanda kriyoseksiyon için kalan canlı numunelerin yüzdesini de azalttı ve kesitleme için kalan birkaç canlı balık, kalite analizi için doku yapısını koruyacak kadar sert değildi. Daha kırılgan balıkların işlenmesi için daha uygun aletlerin bulunması ve kesitleme sırasında numunelerin sertliğini de artıran daha az yoğun bir dondurma ortamıyla çalışmak, bu yöntemin 15 dpf'den daha genç balıklara uygulanmasına izin verebilir. Bu yöntemin son büyük sınırlaması, çok küçük ilgi alanları için numune hizalamasıdır. Örneklemdeki ilgi alanı ne kadar küçükse, onları düzgün bir şekilde hizalama olasılığımızın o kadar düşük olduğunu gördük. Yaklaşık 50 μm boyutunda bir ilgi alanıyla çalıştık ve bu, bölümlerin yaklaşık 2 / 3'ünün düzgün bir şekilde hizalanmasıyla sonuçlandı. 50 μm'den daha küçük bir ilgi alanına sahip numuneler, bölümlerin 2/3'ünden daha azının hizalanmasına neden olabilir. Yanlış hizalanmış örneklerin çoğu, protokoldeki gömme adımından gelir. Dondurma ortamındaki bir numuneyi, önceden hizalanmış olan diğer numuneleri hareket ettirmeden ayarlamak zordur. Ayrıca, araştırmacının doku kalitesini olumsuz etkilemeden önce bu örnekleri hizalaması için sınırlı bir süre vardır. Son olarak, kalıplar stereomikroskoptan flaş dondurma banyosuna taşınır ve numunelerin tamamen donmadan önce kalıp içinde kayması mümkündür. Daha soğuk bir dondurma ortamı ile çalışmanın, araştırmacının zaten hizalanmış diğer numuneleri etkilemeden bir numuneyi daha kolay hareket ettirmesine izin vermesi mümkündür. Hizalamadan sonra kalıbı hareket ettirmek zorunda kalmadan hızlı dondurma, yerinde tamamen donmadan önce numune kaymasını ortadan kaldırabilir. Örneklerin dışında spesifik olmayan sinyaller belirledik.
Nihai ürün ve ilk analiz sonrası ek dersler sundu. Dikkate alınması gereken spesifik olmayan sinyaller mevcuttu. Üreticiye göre, bazı düşük sinyal transkriptleri bilinen bir artefakttır ve ortam RNA'sı, analiz sonrası yönetilebilen tek hücreli RNA-seq'de görülebilir14. Burada kullanılan protokol, numunelerin yerleştirilmesinden sonra fiksasyon meydana geldiğinden, ortam transkriptlerine katkıda bulunmuş olabilir. Bununla birlikte, erken fiksasyonun bu genç yaşlar için zayıf ve tutarsız morfolojiye yol açtığı bulundu. Alternatif olarak, bir araya getirilen amplifikasyon reaktifleri böyle bir etki yaratabilir. Niteliksel olarak, notokordda görülen spesifik olmayan sinyal en belirgindi. İşleme sırasında, notokord, bitişik notokord astar dokularının sitoplazmik ve mitokondriyal profillerine benzeyen montaj ortamı ve transkript sinyalleri içermediği için gerçekten boş olan tek bölgeydi. Bu, fiziksel "desteğin" (doku veya montaj ortamı ile) bu sinyali azaltmada yardımcı olduğunu göstermektedir. Sonuç olarak, son işlemde sinyalin hariç tutulmasının tatmin edici bir strateji olduğunu düşünüyoruz. Spesifik olmayan sinyal özellikleri, deneylerden sonra kolayca tanımlanabilirdi ve aşağı akış analizi sırasında, örneğin, numunenin dışındaki bölgelerin spesifik olmayan sinyallerinin manuel olarak hariç tutulması yoluyla hafifletilebilir.
En az 4 farklı kalıptan (ve yaştan) 15 dpf kadar genç zebra balığı, mekansal transkriptomik görüntüleme alanı içinde başarılı bir şekilde kriyoseksiyon ve toplanabilir ve aynı anda 179'a kadar kesit işlenebilir. Görüntüleme sırasında kesit kalitesine, numune hizalamasına, numune boyutuna ve RNA transkriptlerinin kalitesine dayanarak, bu yöntemin verimli uzamsal transkriptomik testler yürütmek için etkili bir protokol olduğu sonucuna vardık. Araştırmacılar bu yöntemi, uzamsal görüntüleme ile ilişkili maliyetleri azaltmak, uzamsal transkriptomik tahliller sırasında örneklem boyutunu artırmak ve hatta tek bir çalışmada büyük deneyler yapmak için kullanabilirler.
Açıklamalar
Yazarların bu raporla ilgili herhangi bir açıklaması veya çıkar çatışması yoktur.
Teşekkürler
Kesit alma ve görüntüleme, NCI Kanser Merkezi Destek Hibesi 5P30CA023108 tarafından finanse edilen Dartmouth Kanser Merkezi'nde ve Dartmouth College'daki Kantitatif Biyoloji Merkezi'nde (NIGMS COBRE) paylaşılan kaynaklar tarafından sağlanan araçlarla gerçekleştirildi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1 L Beaker | Pyrex | 1003 | |
| 200 proof pure ethanol | Koptec | V1001 | |
| Acetic acid, glacial | VWR | 0714 | acidified alcohol |
| Aluminum foil | |||
| Cover slips | Epredia | 24X50-1.5-001G | |
| Disposable base mold | Fisher HealthCare | 22-363-556 | |
| Distilled water | |||
| DPX mountant | Sigma-Aldrich | 06522 | mountant for histology |
| Dry ice pellets | |||
| Dumont #5SF Forceps | Fine Science Tools | 11252-00 | |
| Eosin-Y Alcoholic | Epredia | 71204 | Eosin Y 1% |
| Gill 1 Hematoxylin | Epredia | 72411 | Hematoxylin |
| Kimwipe | Kimberly-Clark Professional | 34120 | absorbent, lint-free wipe |
| Lab labelling tape | VWR | 89097-934 | |
| Microtome blade MX35 Ultra | Epredia | 3053835 | |
| Microtome Cryostat | Thermo Scientific | Microme HM 525 | |
| O.C.T. Compound | Fisher HealthCare | 23-730-571 | freezing medium |
| Paraformaldehyde | Sigma-Aldrich | 158127 | PFA |
| Permanent Marker | VWR | 52877-886 | |
| Protractor | |||
| SafeClear Xylene Substitute | Fisherbrand | 68551-16-6 | Xylene substitute |
| Single Edge Blades | American Line | 66-0407 | |
| Steriomicroscope | Zeiss | 4350639000 | Stemi 305 w/ double spot LED (4355259020) and Stand K lab (4354259010) |
| Superfrost Plus Micro Slides | VWR | 48311-703 | |
| Transfer pipet | |||
| Xenium V1 slide | 10X/Xenium | 3000941 | spatial transcriptomic imaging slide |
Referanslar
- Rao, A., Barkley, D., França, G. S., Yanai, I. Exploring tissue architecture using spatial transcriptomics. Nature. 596 (7871), 211-220 (2021).
- Longo, S. K., Guo, M. G., Ji, A. L., Khavari, P. A. Integrating single-cell and spatial transcriptomics to elucidate intercellular tissue dynamics. Nat Rev Genet. 22, 627-644 (2021).
- Duhan, L., et al. Single-cell transcriptomics: background, technologies, applications, and challenges. Mol Biol Rep. 51, 600 (2024).
- Ståhl, P. L., et al. Visualization and analysis of gene expression in tissue sections by spatial transcriptomics. Science. 353 (6294), 78-82 (2016).
- Colman, R. E., et al. Whole-genome and targeted sequencing of drug-resistant Mycobacterium tuberculosis on the iSeq100 and MiSeq: A performance, ease-of-use, and cost evaluation. PLOS Med. 16 (4), e1002194 (2019).
- Marques, I. J., Lupi, E., Mercader, N. Model systems for regeneration: zebrafish. Development. 146 (18), dev167692 (2019).
- Mohideen, M. P. K., et al. Histology-based screen for zebrafish mutants with abnormal cell differentiation. Dev Dyn. 228 (3), 414-423 (2003).
- Copper, J. E., et al. Comparative analysis of fixation and embedding techniques for optimized histological preparation of zebrafish. Comp Biochem Physiol C Toxicol Pharmacol. 208, 38-46 (2018).
- Stock, R. J., Labudovich, M., Ducatman, B. Asymptomatic first-trimester liver cell adenoma: diagnosis by fine-needle aspiration cytology with cytochemical and ultrastructural study. Obstet Gynecol. 66 (2), 287-290 (1985).
- Petukhov, V., et al. Cell segmentation in imaging-based spatial transcriptomics. Nat Biotechnol. 40 (3), 345-354 (2022).
- Meyer, T., Tiburcy, M., Zimmermann, W. H. Cardiac macrotissues-on-a-plate models for phenotypic drug screens. Adv Drug Deliv Rev. 140, 93-100 (2019).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Dev Dyn. 203 (3), 253-310 (1995).
- Yu, K., Xing, J., Zhang, J., Zhao, R., Zhang, Y., Zhao, L. Effect of multiple cycles of freeze-thawing on the RNA quality of lung cancer tissues. Cell Tissue Bank. 18 (3), 433-440 (2017).
- Yang, S., et al. Decontamination of ambient RNA in single-cell RNA-seq with DecontX. Genome Biol. 21 (1), 57 (2020).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır