Method Article
סידור קומפקטי מרחבית של קטעי דג זברה זחלים לניתוח טרנסקריפטומי מרחבי
In This Article
Summary
כאן, אנו מציגים שיטה ליישור והקפאה של דגימות זחלי דג זברה מרובות (Danio rerio) ואיסוףן בשקופית אחת לניתוח טרנסקריפטומי מרחבי.
Abstract
טכניקות טרנסקריפטומיות מרחביות הן כלי מתוחכם במחקר ביו-רפואי להמחשת דפוסי ביטוי גנים רשומים מרחבית. הדמיה וניתוח של דגימות מרובות עם פלטפורמות הדמיה מרחבית עלולות להיות יקרות. ביצוע בדיקות אלה בתנאי ניסוי מרובים, כפי שניתן לראות במחקרים התפתחותיים, מגדיל עוד יותר את העלויות. כדי להפחית עלויות, מחקר זה ביקש לייעל את הטכניקות והאסטרטגיות של סידור דגימות טרנסקריפטומיות מרחביות למחקרים התפתחותיים. כאן, המחקר השתמש בדגי זברה, שהם מודל בעל חוליות התפתחותי מבוסס היטב שהוא שקוף במהלך ההתפתחות, יש להם ~70% הומולוגיה גנטית לבני אדם, וגנום מבואר מאוד אידיאלי לניתוח טרנסקריפטומי. בגלל גודלם הקטן, פיתוח דגי הזברה מאפשר גם מיקום קומפקטי של חלקים סדרתיים על פני מספר שכפולים ביולוגיים. כאן, אנו מדווחים על קיבוע אופטימלי, הקפאה ויישור אמין של דגימות דגים מרובות באזור ההדמיה של פלטפורמת הדמיה מרחבית היברידית מולטיפלקס באתר. בשיטה זו, ניתן להקפיא בהצלחה דגי זברה צעירים עד 15 יום לאחר ההפריה (dpf) מלפחות 4 תבניות שונות ועד 174 חלקים, לאסוף אותם באזור ההדמיה של 22 מ"מ 10.5 מ"מ (עבור שקופית טרנסקריפטומית מרחבית באתר ), ולעבד אותם בו זמנית. בהתבסס על איכות החתך, יישור הדגימה וגודל המדגם לכל שקופית, שיטה זו בדגי הזברה מייעלת את התפוקה ואת העלות לדגימה של טכניקות תעתיק מרחביות.
Introduction
הערכת דפוסי ביטוי מובחנים מרחבית ברקמה נותרה קריטית להבנתנו את ההשפעות הגנומיות בהתפתחות, סרטן ומחלות 1,2,3. טרנסקריפטומיקה מרחבית משלבת טכניקות ביטוי מרובות עם רישום מרחבי של ביטוי ברקמות. "טרנסקריפטומיקה מרחבית" נטבעה לראשונה על ידי Ståhl ועמיתיו4, שם נבדקו דגימות סרטן רכובות באמצעות ריצוף הדור הבא באתרו. מאז, "טרנסקריפטומיקה מרחבית" שימשה כתפיסה למחקרי ביטוי בתפוקה גבוהה בשילוב עם רישום מרחבי. אמנם מדובר בכלים רבי עוצמה, אך הם גם התחייבויות יקרות שלעתים קרובות דורשות השקעה מוסדית גדולה ועלויות מעבדה לפני שניתן יהיה לייצר נתונים5. אסטרטגיות למזעור עלויות תוך שמירה על נתונים באיכות גבוהה מבוקשות מאוד.
דג הזברה, Danio rerio, הפך למערכת מודל חשובה לחקר ביולוגיה התפתחותית ומציע אמצעי להכפלת ניתוחי איברים שלמים (ואורגניזמים) של בעלי חוליות במרחב מוגבל. דגי הזברה קטנים (4-6 מ"מ כזחלים ו-2-3 ס"מ כבוגרים) ויכולים להטיל מאות ביצים שקופות בכל פעם6. עוברי דג הזברה מופרים חיצונית ומתפתחים במהירות, מה שמאפשר לחוקרים להכניס טרנסגנים בשלבי התפתחות מוקדמים כדי לייצר בקלות אללים של רווח ואובדן תפקוד7. התאמת מספר דגימות בשקופית אחת היא אסטרטגיה מושכת להפחתת עלויות. פוריותם הגבוהה וגודלם הקטן הופכים את דג הזברה למועמד אידיאלי לריבוי מבחני טרנסקריפטומיה מרחביים שיש להם מקום מוגבל לדגימות8.
הקפאה של זחלי דג הזברה היא טכניקה מאתגרת. פלטפורמות טרנסקריפטומיות מרחביות רבות לא עברו אופטימיזציה עבור קטעי פרפין של דג הזברה ודורשות חתכים בהקפאה בעת עבודה עם דג הזברה כאורגניזם מודל לשימור מבנה הרקמה ושמירה על תעתיקי RNA. בנוסף, הגודל הקטן של דג הזברה מקשה על השגת חתכים איכותיים וניתוח דגימות מרובות ביעילות. משימה זו הופכת לקשה יותר כאשר עובדים עם זחלי דג זברה קטנים ושבריריים יותר מעמיתיהם הבוגרים. כדי להתגבר על אתגרים אלה, אנו מתארים שיטה המיישרת באופן אמין מספר דגימות ומנצלת ביעילות את אזור ההדמיה של פלטפורמות הדמיה מרחבית כדי להשיג מקטעים רבים באיכות גבוהה על שקופית אחת שניתן לאחר מכן לצלם ולנתח על ידי פלטפורמות הדמיה מרחבית (איור 1). במקרה זה, שיטה זו מיושמת על פלטפורמת הדמיה טרנסקריפטומית מרחבית.
Protocol
פרוטוקול זה עוקב אחר ההנחיות של הוועדה המוסדית לטיפול ושימוש בבעלי חיים של מכללת דארטמות'.
1. הכנת קריוסטט
- יש לקרר את הקריוסטט לטמפרטורה של -22 מעלות צלזיוס ולנקות את המשטחים הפנימיים של הקריוסטט על ידי הברשה של פסולת לתוך כלי הקיבול. הנח את כל המברשות והכלים הדרושים בתוך החדר.
2. הכנת תבנית הבסיס החד פעמית
- הכן תבנית בסיס (תבנית פלסטיק חד פעמית 37 מ"מ 24 מ"מ 5 מ"מ) ליישור דגימה על ידי ציור קו ישר על פני החלק הפנימי של תבנית בסיס עם טוש קבוע לשימוש כנקודת ייחוס ליישור הדגימה. הניחו פיסת סרט מעבדה בחלק הפנימי של תבנית הבסיס היכן שהקו הישר צריך להיות לפני שרטוט קו לקבלת התוצאות הטובות ביותר (איור 2A).
- צייר נקודה בחלק הפנימי של תבנית הבסיס ליד הקיר השמאלי או הימני כדי להבטיח כיוון דגימה נכון במהלך הקפאה (איור 2B).
- מדוד את זווית החיתוך הרצויה בעזרת מד זווית וסמן זאת בחלק הפנימי של תבנית הבסיס עבור כל דגימה (איור 2C).
- מרחו שכבה רדודה של מדיום הקפאה (טומוגרפיה קוהרנטית אופטית [OCT]) על תבנית הבסיס המוכנה. ודא שיש מספיק אמצעי הקפאה כדי לכסות את הדגימות.
- הימנע מבועות אוויר בעת מריחת מדיום ההקפאה על ידי תחול הזרבובית של בקבוק המדיום והוספת הכמות הדרושה של מדיום לפינה אחת של תבנית הבסיס לפני הזזת המישור האופקי של תבנית הבסיס כך שהמדיום יתפזר באופן שווה על פני כל המשטח.
- סחטו את הבקבוק לאט בעת חלוקת אמצעי ההקפאה.
- מוסיפים קרח לכוס של 1 ליטר, מניחים את תבנית הבסיס עם מדיום מקפיא באמבט הקרח, ומדגרים לפחות 10 דקות כדי לקרר את המדיום.
3. הכנת קרח יבש: אמבט 100% אתנול
- הכינו אמבט קרח יבש ואתנול 100% במכסה אדים על ידי הוספת חלק אחד של 100% אתנול לחלק אחד של קרח יבש בדלי קרח.
- השתמש בכלי אלומיניום חד פעמי או קפל נייר אלומיניום לסירה גדולה מספיק כדי להתאים לתבנית בסיס חד פעמית. ודא שהצלחת או הסירה גדולות מספיק כדי שתבנית הבסיס תשכב שטוחה לחלוטין.
- מניחים את המנה או הסירה באמבטיה ומכסים את הדלי. אפשר 5-10 דקות עד שהדלי יתקרר לפני הקפאת הדגימות.
4. המתת חסד של דגימות
- בחר באופן אקראי דג זברה לחתך. אם הדגימות משתנות בגודלן, הפרד אותן לקבוצות לפי גודל יחסי כדי להקל על היישור המדויק (ראה דיון לפרטים). מניחים דגים גדולים יותר ודגים קטנים יותר בכלים נפרדים.
- ממלאים במי מערכת דגים ומניחים את הכוס בדלי קרח. הקיפו את הכוס בקרח.
- עקוב אחר טמפרטורת המים בעזרת מדחום. תנו לטמפרטורה להתייצב בין 2-4 מעלות צלזיוס.
- השתמש ברשת או במסננת כדי להכניס קבוצת דגים אחת למים של 4 מעלות צלזיוס. דגים צריכים להיות שקועים לחלוטין במים ולא במגע עם קרח. לאחר הפסקת התנועה האופרקולרית, הוסיפו קרח למים כדי להבטיח שהם יישארו מתחת ל-4 מעלות צלזיוס. השאירו את הדגים במים בטמפרטורה של 4 מעלות צלזיוס למשך 10 דקות.
הערה: המשך עם ההטמעה, היישור והקפאת הבזק של כל קבוצה של דגימות מורדמות לפני המתת חסד של הקבוצה הבאה. החלף את המים בכל פעם.
5. הטבעה ויישור
- אוספים את הדגים המומתים לאחר שהושקעו במים של 4 מעלות צלזיוס למשך 10 דקות. הוציאו את הדגים מהמים בעזרת מלקחיים עדינים על ידי אחיזתם בסנפיר הזנב וייבשו אותם על ידי לחיצה עדינה על מגבון סופג ונטול מוך.
הערה: עבור קטעים באיכות גבוהה, חשוב להגביל את הזמן בין הוצאת דגים מהמים בטמפרטורה של 4 מעלות צלזיוס לבין הקפאת הבזק - בעבודה עם תבנית הבסיס המוכנה באמבט קרח תחת סטריאומיקרוסקופ (הגדלה פי 10), הנח כל דגימה בתבנית הבסיס לאורך נקודות הייחוס בכיוון הנכון וכסה בעדינות את הדגימות בשכבה דקה נוספת של מדיום הקפאה.
הערה: אין למלא את כל התבנית במדיום הקפאה. במקום זאת, השתמש רק בשכבה דקה, מספיק כדי לכסות את כל הדגימות. - השתמש בנקודת ייחוס אנטומית כדי ליישר במדויק את הדג לקווים המסומנים בחלק הפנימי של תבנית הבסיס. השתמש במלקחיים עדינים כדי להתאים את הכיוון של כל דג כך שיהיו מיושרים ובאותו כיוון. הימנע מיצירת בועות במדיום ההקפאה על ידי תנועה איטית.
- מרחו חתיכת קרח יבש על תחתית תבנית הבסיס מתחת לדגימות עד שהן קפואות מקומית למקומן. שמור על המישור האופקי של תבנית הבסיס בגובה כדי למנוע הזזת הדגימות מנקודות הייחוס שלהן לפני הקפאה למקומן עם קרח יבש.
- מניחים את תבנית הבסיס עם הדגימות על סירת האלומיניום או צלחת האלומיניום בקרח היבש: אמבט אתנול 100%. ודא שהסירה צפה על פני האמבטיה ותבנית הבסיס נשארת יבשה. מכסים את האמבטיה ומאפשרים לדגימות לצוף למשך 10 דקות.
- עוטפים את תבנית הבסיס הקפואה בנייר כסף ושומרים במקפיא של -80 מעלות צלזיוס עד שמוכן לחתך. חזור על שלבים 4.2-5.6 עבור כל הקבוצות הנותרות.
6. הקפאה
- הביאו תבניות בסיס קפואות לקריוסטט שהתקרר מראש לצורך הקפאה והניחו אותן בתא הקריוסטט. הובלת בלוקים קפואים בקופסה עם קרח יבש למניעת הפשרה.
- הסר שקופית הדמיה מרחבית באתרה מהאחסון והנח אותה במחזיק שקופיות מקורר מראש. אחסן את מחזיק השקופיות עם שקופית הדמיה מרחבית בתא הקריוסטט של -22 מעלות צלזיוס עד שמוכן לאסוף חלקים מאזור העניין.
- מוציאים את הדגימות הקפואות מתבנית הבסיס ולאחר מכן מקפיאים אותן בצ'אק עם מדיום הקפאה טרי. הקפיאו אותם על הצ'אק כך שמשטח החיתוך יפנה ללהב.
- הניחו להב מיקרוטום טרי ועדין בקריוסטט.
- יישר את התבנית ללהב וחתוך את אזור העניין (עובי גימור מומלץ 20-50 מיקרומטר). ודא שהסימונים שנעשו בתוך התבנית מועברים לבלוק הדגימה הקפוא כדי לסייע בזיהוי המיקום בתוך הדגימות.
- כוונן את התבנית בשלב החיתוך כך שמשטח החיתוך יהיה מקביל לסימוני הייחוס במדיום ההקפאה.
- אסוף קטעים על שקופית מיקרוסקופ רגילה טעונה חיובית ובדוק אותם לפי שדה בהיר כדי לוודא מתי אין עוד צורך בחיתוך.
- הסר את שקופית ההדמיה המרחבית מתא הקריוסטט והנח אותה באמבט קרח של 4 מעלות צלזיוס. שמור את השקופית במחזיק השקופיות. ודא שהמגלשה לא נרטבת.
- התחל בהקפאה (מומלץ 10-14 מיקרומטר; איור 3) ולאסוף קטעים על שקופיות טעונות חיובית עד שמגיעים לאזור העניין בדגימות. בדוק קטעים לפי שדה בהיר כדי לאשר שאזור העניין יהיה החלק הבא מהתבנית.
- החזר את שקופית ההדמיה המרחבית של תא יחיד לתא הקריוסטט. הסר את השקופית ממחזיק השקופית ואסוף מקטעים מאזור העניין המדויק אל השקופית של ההדמיה המרחבית שורה אחר שורה באמצעות מברשת צבע עדינה כדי למנוע גלגול של מקטעים.
- לחץ על פינה של המדיום הריק והקפוא לתוך שלב הסכין עם הצד האחורי של המברשת כך שהחלק יישאר שטוח בעת תפיסת השקופית לאיסוף.
- השתמש בחלק העליון של המגלשה כנקודת ציר, הורד לאט את השקופית על הקטע, ואפשר לחלקים להיצמד למגלשה למשך 3 שניות לפני הרמת המגלשה מהסכין tage.
- עבדו משמאל לימין בעת איסוף מקטעים באזור ההדמיה של השקופית וחפפו שכבות של מדיום ריק ומקפיא במידת האפשר.
- השתמש בגבולות נייר צבעוניים כהתייחסות למיקום מקטעים בתוך אזור ההדמיה של השקופית אם קשה לראות רקמה.
- לאחר איסוף קטעים מאזור העניין, הנח את השקופית בחזרה למחזיק השקופיות. אם אין עוד דגימות לאיסוף על שקופית ההדמיה המרחבית, אחסן את השקופית בטמפרטורה של -80 מעלות צלזיוס עד שבועיים עד שהיא מוכנה לניתוח מכשירים עם פלטפורמת ההדמיה המרחבית באתרה . אם יש צורך לאסוף חלקים ממספר תבניות, החזר את שקופית ההדמיה המרחבית לאמבטיית הקרח של 4 מעלות צלזיוס וחזור על שלבים 6.3-6.11 עם התבנית הבאה.
- אסוף קטעים לפני ואחרי קטעי אזור העניין מכל תבנית בשקופית מיקרוסקופ סטנדרטית טעונה חיובית לצביעה של המטוקסילין ואאוזין (HE) כדי לבדוק שיישור הדגימה ואיכות החתך מספיקים לפני שתמשיך בניתוח.
7. תיקון המדגם
- הסר את שקופיות הייחוס מהקריוסטט וייבש באוויר ב-RT למשך 30 דקות כדי להדביק חלקים למגלשה.
- תקן מקטעים על-ידי הנחתם במכל שקופיות עם 4% פרפורמלדהיד (טבלה 1) למשך 20 דקות.
- שטפו חלקים על ידי הנחתם במיכל שקופיות עם מים מזוקקים למשך 3 דקות.
- המשך עם צביעת HE או יבש ואחסן שקופיות ב-80 מעלות צלזיוס לצביעה עתידית.
8. הכתמת הקטעים
- ייבשו ונקו את החלקים על ידי דגירה של המגלשות ב-100% אתנול למשך 2 דקות, 95% (טבלה 2) אתנול למשך 2 דקות, ולאחר מכן מי ברז למשך דקה. השתמש במתלה לצביעה שקופיות במיקרוסקופ כדי להעביר שקופיות מאמבטיה לאמבטיה.
- צבעו את הגרעינים והתמיינו על ידי דגירה של המגלשות בהמטוקסילין למשך 2 דקות ו-45 שניות, מי ברז למשך דקה, 0.3% אלכוהול מחומצן (טבלה 3) למשך דקה אחת, ולאחר מכן מי ברז זורמים למשך דקה אחת. השתמש במתלה לצביעה שקופיות במיקרוסקופ כדי להעביר שקופיות מאמבטיה לאמבטיה.
- לצבוע את הרכיבים הציטופלזמיים ולייבש על ידי דגירה של השקופיות באאוזין Y 1% למשך 45 שניות, 50% אתנול (טבלה 4) למשך דקה אחת, 95% אתנול למשך דקה אחת ו-100% אתנול למשך דקה אחת. השתמש במתלה לצביעה שקופיות במיקרוסקופ כדי להעביר שקופיות מאמבטיה לאמבטיה.
- נקה את החלקים על ידי דגירה של שקופיות בקסילן למשך דקה. הרכיבו וכסו את המגלשות על ידי מריחת טיפה של אמצעי הרכבה על השליש העליון של השקופית בעזרת צינור העברה והורדה איטית של כיסוי על גבי אמצעי ההרכבה בעזרת מלקחיים.
9. הדמיה טרנסקריפטומית מרחבית וניתוח חתכים
- הסר את שקופיות ההדמיה מאחסון ותמונה של -80 מעלות צלזיוס עם פלטפורמת הדמיה מרחבית באתרה לניתוח טרנסקריפטומי מרחבי.
הערה: השלבים המדויקים הכרוכים בהדמיה ייקבעו על ידי פלטפורמת ההדמיה המרחבית. - סקור את מדדי בקרת האיכות של פלטפורמת התעתיק המרחבית. מדדים חשובים שיש לבדוק הם מספר התאים שזוהו, תעתיקים חציוניים לתא, תעתיקים גרעיניים לכל 100 מיקרומטר2, וסך כל התעתיקים המפוענחים באיכות גבוהה של כל גן בערכת הבדיקה.
הערה: למדדי בקרת איכות אלה אין ספים אוניברסליים, והציפיות לספים אלה ישתנו בהתאם לדגימה ולפאנל הגנים שבהם נעשה שימוש. - קרא את פלט הנתונים של תמלילי RNA הניתנים לזיהוי, קבע אילו תמלילים באיכות נמוכה על סמך מדדי בקרת האיכות של הניסוי, וסנן תמלילים באיכות נמוכה. נתח את התמלילים האיכותיים הנותרים ביחס לסידורם המרחבי בתוך הקטע.
- הצג את הפילוח הסלולרי של החתכים ותאי האשכול על סמך תחומי עניין ניסיוניים. השווה את תעתיקי ה-RNA בתוך אשכולות תאים של אזור העניין על פני קבוצות בגילאים שונים של דג זברה באותה שקופית.
תוצאות
בשיטה זו (איור 1), דג הזברה משמש כמודל של חיות כדי לחקור דפוסי ביטוי גנים שנפתרו מרחבית. חיתוך הקפאה של דג זברה זחל ביעילות להדמיה מרחבית הוא מאתגר. המקטעים חייבים להיות באיכות גבוהה כדי לשמור על מבנה הרקמה והגנים הניתנים לזיהוי (איור 4). קטעים המכילים דגימות מרובות להדמיה יעילה מרחבית חייבים להיות מיושרים במדויק כדי לנתח אזורי עניין על פני כל הדגימות (איור 2 ואיור 5). לבסוף, יש לאסוף קטעים ולרווח אותם ביעילות כדי למקסם את מספר נקודות הנתונים הפוטנציאליות בתוך אזור ההדמיה של שקופית טרנסקריפטומיקה מרחבית (איור 3 ואיור 6). הניסויים נמדדו באמצעות שלושת הפרמטרים הללו כדי לקבוע אם הם היו מוצלחים או לא אופטימליים.
שינויים רבים בפרוטוקול תרמו ליכולתנו לאסוף קטעים באיכות גבוהה שהם מועמדים טובים להדמיה טרנסקריפטומית מרחבית. התאמת הפרוטוקולים עבור המתת חסד, קיבוע והטמעה לשיפורים באיכות המקטע (איור 4). בפרוטוקול הראשון (איור 4, פרוטוקול 1), איכות החתך הייתה תת-אופטימלית, והרקמות לא שמרו על המבנה שלהן. כדי לתקן זאת, בפרוטוקול השני (איור 4, פרוטוקול 2), הוצג שלב הקפאת הבזק לאחר הטמעת דגימות ורקמות קבועות לאחר איסוף חלקים על שקופיות. זה שיפר את מבנה הרקמה הכללי של הקטעים אך לא הצליח להגיע למה שנחשב לאיכות מקובלת עבור טרנסקריפטומיקה מרחבית. לבסוף, בפרוטוקול השלישי (איור 4, פרוטוקול 3), טכניקות המתת החסד שוכללו על ידי קיצור משך הזמן שנדרש להמתת חסד של דגים והטמעת דגים על קרח לפני הקפאת הבזק ולאחר מכן חתך וקיבוע לאחר האיסוף. זה הביא לדגימות האיכותיות ביותר שהיו מועמדות טובות להדמיה טרנסקריפטומית מרחבית.
התאמת דגימות מרובות לאזור עניין דרשה גם כמה שינויים בפרוטוקול. אחד השינויים ששיפרו את היישור בין הדגימות הכי הרבה היה הכנסת נקודות ייחוס לתבניות הבסיס שבהן מוטבעים דגי הזברה (איור 2). בניסויים שנערכו במחקר זה, הדגימות היו מיושרות על ידי השוואת מבנים על פני מספר חלקים באותו חתך (איור 5).
הצעד החשוב האחרון בפיתוח השיטה לתעתיק מרחבי יעיל היה להתאים כמה שיותר מהדגימות האיכותיות והמיושרות הללו בגילאים שונים לאותה שקופית להדמיה. צבירת ניסיון ושיפור מיומנויות טכניות תורמים לשיפור מספר הדגימות הנאספות. שיפורים אלה נבעו בעיקר מהתאמות קלות בשלבי ההטמעה והאיסוף בפרוטוקול. לוחות אלה באיור 6 מדגישים את מספר החלקים שנאספו באזור ההדמיה של כל שקופית לאורך זמן. איור 6A (40 קטעים של 15 דגים dpf) הוא ריצה מוקדמת המשתמשת בתבנית אחת במהלך החיתוך. איור 6B (90 קטעים של דגי 15 dpf ו-47 קטעים של דגי 26 dpf) מציג תבנית שנייה ומראה שיפור בסידור המרחבי על ידי הפחתת כמות הרווח בין הדגימות במהלך ההטמעה. איור 6C (54 קטעים של 15 דגים dpf, 80 חלקים של 19 דגי dpf, 24 חלקים של 23 דגים dpf ו-21 חלקים של דגים 26 dpf) מציג תבנית שלישית ורביעית ומראה שיפור מתמשך בסידור מרחבי על ידי חיתוך משטח החיתוך של הבלוק סביב הדגימות וחפיפה של מדיום ריק ומקפיא. שיפורים אלה אפשרו לנו את ההזדמנות למקם 179 קטעים באזור ההדמיה של שקופית הטרנסקריפטום המרחבית שלנו ולבדוק דגים ב-4 גילאים שונים.
בסיום הפרוטוקול, היו לנו דגימות שהיו ניתנות לניתוח בקלות הן עם תוכנת המדף המרובבת באתרה והן בשיטות מותאמות אישית. תוכנת המולטיפלקס המשמשת כאן השתמשה בציון פסאודו-פרד, המבוסס באופן רופף על ציוני איכות פרד ברצף נתונים9. הציונים נעו בין 59%-70%, כאשר 60% היו הגבול לאזהרה מפני קריאות באיכות נמוכה יותר. בבדיקה, הציון הפסאודו-פרד הנמוך נבע ממורכבות האות הנמוכה בחלל הריק בין המקטעים. למרות שאזור המגלשה נוצל ביעילות, אזור המגלשה עדיין היה ריק >50%. כאשר לוקחים בחשבון את שיעור שטח ההחלקה שתופסת רקמה, שם האות היה מורכב מספיק, איכות האות הייתה מצוינת.
אותות לא ספציפיים בעוצמה נמוכה נראו גם בשני אזורים כלליים בשקופית: מחוץ לדגימות ובתוך הנוטוכורד הריק (איור 7A). מחוץ לקטעים, היה דפוס התואם לחפץ שטיפה, שיפחית את ההתרחקות מהדגימות (איור 7B). אות לא ספציפי נראה גם באזורים הריקים של הדגימות שנכבשו על ידי הנוטוכורד. זה נחשב לחפץ שטיפה סביר שבו ריאגנטים להגברה יכולים להילכד. התעתיקים בשני האזורים היו בעיקר ציטופלזמיים (כלומר, חלבונים ריבוזומליים L3 ו-L4) או מיטוכונדריאלים (אספרטט טרנספראז ואיזוציטראט דהידרוגנאז). כאשר אזורים אלה נכללו בסגמנטציה של בייסור, המזהה תאים על סמך לוקליזציה ואשכולות של תעתיקים סביב גרעין10, ניתוח הפילוח כלל את גבולות התא, שלעתים כללו אותם. אות זה היה נמוך מספיק כדי שניתן היה להבחין בו בקלות מהדגימה.
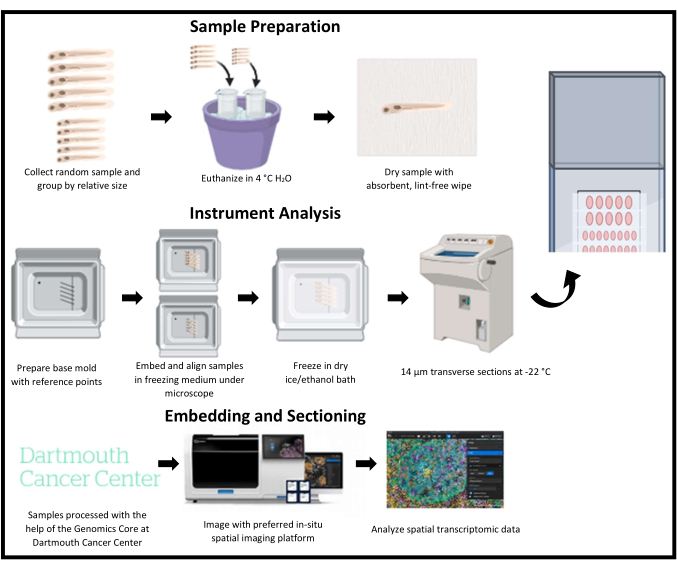
איור 1: מתאר סכמטי של הקפאה עבור טרנסקריפטומיקה מרחבית בדג זברה. דגי זברה צעירים נאספים באופן אקראי ולאחר מכן מקובצים לפי גודל יחסי. לאחר מכן הדגימות מוטמעות במדיום הקפאה ומיושרות על ידי נקודות ייחוס על תבנית הבסיס המתאימות לאזור עניין. כל תבנית מוקפאת, מוקפאת ונאספת שורה אחת בכל פעם באותה שקופית. השקופיות מאוחסנות בטמפרטורה של -80 מעלות צלזיוס לאחר החיתוך ומצולמות ומנותחות באמצעות פלטפורמת הדמיה טרנסקריפטומית מרחבית. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 2: קביעת נקודות ייחוס עבור חתך מדויק. סדרת תמונות מדגימה את התהליך של הוספת נקודות ייחוס לתבנית בסיס חד פעמית כדי ליישר מספר דגימות להקפאה. השלב הראשון (A) הוא להשתמש בסרט מעבדה כדי לסמן קו בחלק הפנימי של התבנית שכל הדגימות ישתמשו בו כהתייחסות ליישור. (ב) הנח נקודה בחלק הפנימי של התבנית ליד הקיר השמאלי או הימני כדי להודיע על כיוון הדגימה הנכון במהלך ההקפאה, ולאחר מכן (ג) סמן קווים עבור כל דגימה בזווית הרצויה. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
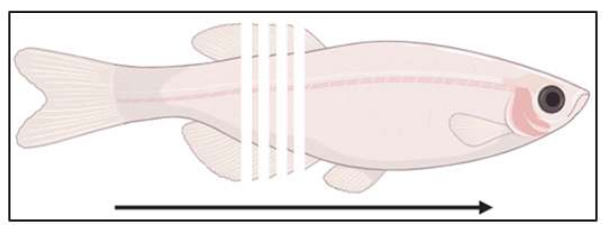
איור 3: סכמטי של מיקום החיתוך. הדגים מחולקים באופן עטרתי, מזנב לרוסטרל, במרווחים של 14 מיקרומטר. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
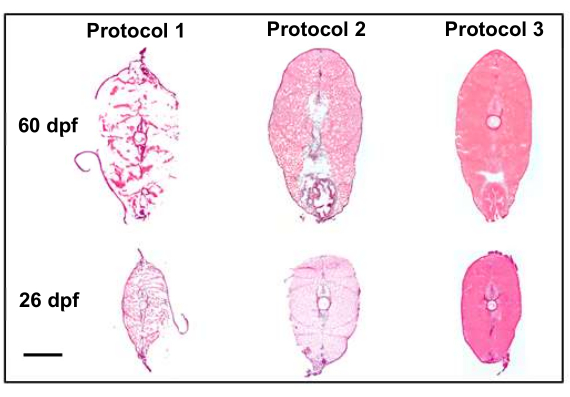
איור 4: שיפור איכות המקטע עם שינויי פרוטוקול (פי 10). האיור משווה את שני הפרוטוקולים הראשונים, שהביאו לאיכות רקמה לא אופטימלית, עם הפרוטוקול הסופי, שהביא לקטעים איכותיים (ששמרו על מורפולוגיה) שהם מועמדים טובים לתעתיק מרחבי. פרוטוקול 1 משתמשבניתוח השוואתי 8 של הביו-אטלס של Penn State, המודגש על ידי קיבוע פרפורמלדהיד של 4% לפני החיתוך. פרוטוקול 2 מציג הקפאת הבזק של קרח יבש/אתנול לאחר המתת חסד וקיבוע לאחר חתך, מה שמשמר את מבנה הרקמה הרבה יותר טוב עם האזהרה של הקפאת חפצים לאורך הקטע. פרוטוקול 3 שיכלל את טכניקות המתת החסד וההטמעה על קרח לפני הקפאת הבזק ולאחר מכן חתך וקיבוע לאחר האיסוף, מה שהביא לדגימות האיכותיות ביותר. סרגל קנה המידה הוא 500 מיקרומטר. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 5: אימות יישור מקטעים מרובים (פי 20). תמונות HE מייצגות של 26 קטעי dpf המדגישים את היישור בין מספר דגימות בחיתוך אחד. סרגל קנה המידה הוא 500 מיקרומטר. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 6: סידור מרחבי משופר של דגימות. לוחות אלה מדגישים את מספר החלקים שנאספו באזור ההדמיה של כל שקופית לאורך זמן. צבירת ניסיון ושיפור מיומנויות טכניות תורמים לשיפור מספר הדגימות הנאספות. שיפורים אלה נבעו בעיקר מהתאמות קלות בשלבי ההטמעה והאיסוף בפרוטוקול. פאנל A (40 קטעים של 15 דגים dpf) הוא ריצה מוקדמת המשתמשת בתבנית אחת במהלך החיתוך. פאנל B (90 קטעים של 15 דגי dpf ו-47 קטעים של דגים 26 dpf) מציג תבנית שנייה ומראה שיפור בסידור מרחבי על ידי צמצום כמות הרווח בין הדגימות במהלך ההטמעה. פאנל C (54 קטעים של דגים של 15 dpf, 80 קטעים של 19 דגים dpf, 24 קטעים של 23 דגים dpf ו-21 חלקים של דגים 26 dpf) מציג תבנית שלישית ורביעית ומראה שיפור מתמשך בסידור מרחבי על ידי חיתוך משטח החיתוך של הגוש סביב הדגימות וחפיפה של מדיום ריק ומקפיא. הסוגריים בכל לוח מייצגים תבניות שונות המשמשות במהלך החיתוך. החלקים נמצאים על שטח של 10.5 מ"מ 22 מ"מ. סרגל קנה המידה הוא 4 מ"מ. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 7: תוצאות מייצגות של ניסוי הטרנסקריפטום המרחבי שלנו. (A) תמונה בודדת של שקופית שעובדה עם הפרוטוקול כפי שניתן לראות באיור 6C. (B) מקטעים של 14 מיקרומטר של דג זברה ב-15 dpf לאחר הדמיה טרנסקריפטומית מרחבית המציגים אות לא ספציפי בסמוך למקטעים ובתוך הנוטוכורד. סרגל קנה המידה הוא 4 מ"מ בפאנל A. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
| 4% פרפורמלדהיד | ריכוז מלאי | כמות | ריכוז סופי |
| פרפורמלדהיד (אבקה) | 95% w/w | 40 גרם | 4% משקל/נפח |
| נאוה | 1 נ | טיפה (עד להמסת האבקה) | |
| HCl | 1 נ | טיפה (עד 6.9 pH) | |
| מלאי PBS 1x | 1x | ~1000 מ"ל (להגיע לנפח כולל של 1000 מ"ל) | 1x |
| סך | 1000 מ"ל |
טבלה 1: פורמולה של 4% פרפורמלדהיד. הרכב של תמיסת פרפורמלדהיד 4% לתיקון דגימות.
| 95% אתנול | ריכוז מלאי | כמות | ריכוז סופי |
| 200 הוכחת אתנול | 100% v/v | 190 מ"ל | 95% v/v |
| מי RO | 100% v/v | 10 מ"ל | 5% v/v |
| סך | 200 מ"ל |
טבלה 2: נוסחת אתנול 95%. הרכב של תמיסת אתנול 95% לייבוש חלקים במהלך צביעת H&E.
| 0.3% אלכוהול מחומצן | ריכוז מלאי | כמות | ריכוז סופי |
| חומצה אצטית קרחונית | 100% v/v | 300 מיקרוליטר | 0.3% וולט/נפט |
| מי RO | 100% v/v | 99.7 מ"ל | 99.7% v/v |
| סך | 100 מ"ל |
טבלה 3: 0.3% פורמולת אלכוהול מחומצת. הרכב של 0.3% אלכוהול מחומצן להבדיל במהלך צביעת HE.
| 50% אתנול | ריכוז מלאי | כמות | ריכוז סופי |
| 200 הוכחת אתנול | 100% v/v | 100 מ"ל | 50% v/v |
| מי RO | 100% v/v | 100 מ"ל | 50% v/v |
| סך | 200 מ"ל |
טבלה 4: נוסחת אתנול 50%. הרכב של 50% אתנול לייבוש חלקים במהלך צביעת HE.
Discussion
דוח זה מספק פתרונות מפורטים לרבים מהאתגרים הטכניים הקשורים לדגי הזברה כאורגניזם מודל בניתוח טרנסקריפטומי מרחבי במהלך ההתפתחות. בהתמודדות עם אתגרים אלה, סידור הדגימות הקומפקטי שלנו מייעל את העלויות בפלטפורמות התעתיק המרחביות המתפתחות1. הקפאה של דג זברה זחל להדמיה מרחבית היא מאתגרת. החלקים צריכים לשמור על מבנה רקמה ואיכות תעתיק מספיקים לביצוע ניסוי משביע רצון וניתוח מרחבי במורד הזרם8. פרוסות המכילות מספר דגימות להדמיה יעילה מרחבית חייבות להיות מיושרות במדויק כדי לנתח אזורי עניין משותפים בכל הדגימות. לבסוף, יש לאסוף קטעים ולרווח אותם ביעילות כדי למקסם את מספר נקודות הנתונים הפוטנציאליות באזור המיועד של שקופית הדמיה.
הפרוטוקול מאפשר איסוף של קטעים באיכות גבוהה שהם מועמדים מצוינים לפלטפורמות הדמיה מרחבית של תא בודד. השינוי הראשון היה להקפיא דג זברה ואז לתקן חלקים ב-4% פרפורמלדהיד לאחר שאספו אותם על מגלשה. במקור, דגי הזברה קובעו עם 4% פרפורמלדהיד ב-4 מעלות צלזיוס למשך הלילה והוטמעו ונחתכו לאחר מכן11. הבחירה לתקן דגימות אחרי שהן נחתכו סייעה לשמר רקמות פנימיות שלא נשמרו ביעילות בעת קיבוע דגימה שלמה (איור 4).
השינוי הקריטי השני היה חידוד שיטת המתת החסד כדי לשמור על שלמות הרקמות. דגי הזברה הונחו במקור במים של 4 מעלות צלזיוס למשך 20 דקות כדי להבטיח שהם מורדמים מספיק. זה 10 דקות מעבר לדרישות המינימום של הנחיות IACUC. זמן נוסף זה במים של 4 מעלות צלזיוס נתן לדגימות זמן רב יותר להתפרק ותרם לאיכות חתך פחות מאידיאלית של מבנים פנימיים עדינים או עדינים מאוד. הפחתת משך הזמן במים של 4 מעלות צלזיוס לדרישה המינימלית של 10 דקות סייעה בשימור מבנים פנימיים עדינים שהיו חסרים בניסיונות חיתוך קודמים. שינויים אחרים שאינם מוצגים באיור 4 כוללים חתך באותו יום של המתת חסד, הפחתת משך הזמן בין המתת חסד להקפאת בזק מ-15 דקות לפחות מ-5 דקות, ועבודה עם מדיום הקפאה מקורר מראש בעת ההטמעה. ככל שהדגימות אוחסנו זמן רב יותר ב-80 מעלות צלזיוס לפני החיתוך, כך איכות הרקמה של החתך הייתה גרועה יותר. ההבדלים היו עדינים, אבל זה אידיאלי לחלוקה באותו יום של המתת חסד ויצירת בלוקים. קיצור משך הזמן שלוקח ליישר דגימות לאחר המתת חסד ולפני הקפאת בזק ללא יותר מ-5 דקות הוא קריטי לאיכות החתך.
התאמת דגימות מרובות לאזור עניין דרשה גם כמה שינויים בפרוטוקול. דיוק היישור שהושג (איור 5) קיבץ דגימות לפי גודל יחסי וסיפק את התרומה הגדולה ביותר לסידור מרחבי יעיל. האסטרטגיה העיקרית ליישור הדגימות היא כיסוי דג הזברה על נקודות ייחוס המצוירות על תבניות הבסיס שבהן הן מוטמעות. דגימות מיושרות לנקודות ייחוס אלו על ידי מבנים אנטומיים בתוך הדגימות של דג הזברה שיכולים להשתנות בהתאם לאזור העניין הרצוי. דגים מתפתחים באותו גיל יכולים להשתנות בגודלם עד 50%12. דגימות בגדלים שונים באופן דרסטי עלולות להיות לא מיושרות עקב מרחקים משתנים בין נקודת הייחוס האנטומית לאזור העניין. קיבוץ דגימות מאותו גיל לפי גודל יחסי והטמעת כל גודל בתבניות שלהם שיפרו את היכולת ליישר דגימות מרובות בתוך התבנית שלהם. שיטה זו יכולה ליישר באופן אמין כ-2/3 מהדגימות בהתאם לחלון המותר על ידי אזור העניין ובחירת נקודת הייחוס האנטומית.
צמצום הרווח בין דגימות בעת הטבעה ויישור מוביל למספר גדול יותר של דגימות לכל שקופית. עם זאת, תצורה הדוקה זו מוגבלת עוד יותר על ידי המגבלות הנאמנות על אזור ההדמיה. בנוסף לניסיון בקריוסטט, מתוארות מספר אסטרטגיות ליישוב אלה. ראשית, למיקום המדויק של מדיום הטבעה חופף בין חלקים וחיתוך התבנית הקפואה יכולות להיות השפעות עמוקות על מספר החלקים שיכולים להתאים לאזור הדמיה ספציפי. איור 6 מדגיש את מספר החלקים המתקבלים לפני ואחרי אופטימיזציה של סידור ההטמעה. שנית, הוצב גבול בצד החיצוני של הדגימות החיצוניות ביותר במהלך ההטבעה ולפני ההקפאה כדי לסייע במיקום נכון על שקופית ההדמיה. שלישית, הגודל והאופי השקוף של דג הזברה יכולים להקשות על הידיעה היכן ממוקמות הדגימות בתוך מגלשה, כך שניתן יהיה לאסוף אותן במדויק על מגלשה. מצאנו ששימוש בנייר צבעוני כדי ליצור ניגוד למדיום ההקפאה הלבן כדי ליצור גבול בצד החיצוני של הדגימות החיצוניות ביותר הוביל למיקום מדויק הרבה יותר של החלקים על השקופיות.
הניואנסים של הטמפרטורה המקומית מסייעים בשימור הדגימה בתהליך החיתוך. לאחר איסוף דגימות ממספר תבניות על שקופית אחת, שקופית ההדמיה מאוחסנת ב-4 מעלות צלזיוס, התבנית הבאה נחתכת לאזור העניין הרצוי לפני איסוף שוב. שקופית ההדמיה חייבת להיות מעט חמה יותר מהחלקים כדי שהיא תידבק כראוי לפני השטח של השקופית. לכן, אחסון שקופית ההדמיה ב-80 מעלות צלזיוס או בקריוסטט ב-20 מעלות צלזיוס בין איסוף דגימות מתבניות שונות אינו אידיאלי. זה גם קריטי שהדגימות שנאספו בשקופית ההדמיה לא יעברו מחזורי הקפאה/הפשרה מרובים, מכיוון שהדבר יכול להשפיע לרעה על איכות תעתיקי ה-RNA בתוך כל דגימה. שמירה על שקופית ההדמיה עם קטעים שנאספו בעבר ב-4 מעלות צלזיוס שומרת כראוי על תעתיקי RNA תוך שמירה על טמפרטורה נמוכה יותר להיצמדות נכונה ללא תופעות לוואי שליליות הקשורות למחזורי הקפאה/הפשרה13.
למרות שהושגו תוצאות משביעות רצון, העיצוב של שיטה זו מגיע עם מגבלות אפשריות. המגבלה הראשונה היא שאנו מוגבלים לאזור ההדמיה של שקופית טרנסקריפטומית מרחבית, מה שמציב תקרה למספר הכולל של הקטעים שניתן לצלם באותה שקופית. בהתחשב בכך שעדיין יש לנו מקום ריק בין הסעיפים, סביר להניח שעדיין לא הגענו לגבולות האפשרי עבור שיטה זו, אך אנו מכירים בכך שיש נקודה שבה כבר לא ניתן להכניס קטעים נוספים לשקופית ההדמיה. עבודה עם דגים גדולים יותר בגילאים מבוגרים יותר תגביל גם את גודל המדגם הכולל אך לא אמורה להשפיע על כמות הרקמה הכוללת שיכולה להתאים לאזור ההדמיה של מגלשה. שיפורים טכניים על ידי פלטפורמות הדמיה מרחבית יכולים אולי להגדיל את הכמות הכוללת של רקמה שניתן לצלם על ידי הגדלת אזור ההדמיה בשקופיות ההדמיה. מגבלה נוספת של שיטה זו היא שהפרוטוקול לא עבר אופטימיזציה לדגים מתחת ל-15 dpf. נמצא כי דגים נעשים שבירים יותר ויותר ככל שהם צעירים יותר וכי דגים מתחת ל-15 dpf היו קשים מאוד לטיפול ונפגעו בקלות במהלך תהליך ההטמעה. זה הביא להגדלת משך הזמן בין המתת חסד להקפאת בזק, מה שפגע באיכות הרקמות. זה גם הפחית את אחוז הדגימות הקיימות שנותרו להקפאה, והדגים המעטים שנותרו לחיתוך לא היו קשיחים מספיק כדי לשמור על מבנה הרקמה לניתוח איכותי. מציאת כלים המתאימים יותר לטיפול בדגים שבירים יותר ועבודה עם מדיום הקפאה פחות צפוף שגם מגביר את קשיחות הדגימות במהלך החיתוך יכולה לאפשר ליישם שיטה זו על דגים מתחת ל-15 dpf. המגבלה העיקרית האחרונה של שיטה זו היא יישור מדגם עבור אזורי עניין קטנים מאוד. מצאנו שככל שאזור העניין במדגם קטן יותר, כך קטן הסיכוי שהצלחנו ליישר אותם כראוי. עבדנו עם אזור מעניין בגודל של כ-50 מיקרומטר, וזה הביא לכך שכ-2/3 מהחלקים היו מיושרים כראוי. דגימות עם אזור עניין קטן יותר מ-50 מיקרומטר עלולות לגרום ליישור של פחות מ-2/3 מהקטעים. רוב הדגימות הלא מיושרות מגיעות משלב ההטמעה בפרוטוקול. קשה להתאים דגימה אחת במדיום ההקפאה מבלי להזיז דגימות אחרות שכבר יושרו. יש גם כמות מוגבלת של זמן שיש לחוקר ליישר את הדגימות הללו לפני שישפיע לרעה על איכות הרקמות. לבסוף, תבניות מועברות מהסטריאומיקרוסקופ לאמבט הקפאת הבזק, וייתכן שדגימות יזוזו בתבנית לפני שהן קפואות לחלוטין. ייתכן שעבודה עם מדיום הקפאה קר יותר יכולה לאפשר לחוקר להעביר דגימה אחת ביתר קלות מבלי להשפיע על דגימות אחרות שכבר מיושרות. הקפאת הבזק של התבנית ללא צורך להזיז אותה לאחר היישור עלולה למנוע הזזת דגימה לפני שהם קפואים לחלוטין במקומם. זיהינו אותות לא ספציפיים מחוץ לדגימות.
התוצר הסופי והניתוח הראשוני לאחר הניתוח הציגו לקחים נוספים. היו אותות לא ספציפיים, שדרשו התייחסות. לדברי היצרן, כמה תעתיקי אותות נמוכים הם חפץ ידוע וניתן לראות RNA סביבתי ב-RNA-seq של תא יחיד שניתן לנהל לאחר ניתוח14. ייתכן שהפרוטוקול ששימש כאן תרם לתעתיקי הסביבה שכן הקיבוע התרחש לאחר מיקום הדגימות. עם זאת, נמצא כי קיבוע מוקדם הוביל למורפולוגיה ירודה ולא עקבית בגילאים צעירים אלה. לחלופין, ריאגנטים להגברה שהצטברו יכולים ליצור אפקט כזה. מבחינה איכותית, האות הלא ספציפי שנראה בנוטוכורד היה הבולט ביותר. במהלך העיבוד, הנוטוכורד היה האזור הריק היחיד באמת מכיוון שהוא לא הכיל אמצעי התגברות ואותות תעתיק, שדמו לפרופילים הציטופלזמיים והמיטוכונדריאלים של רקמות רירית נוטוקורד סמוכות. זה מצביע על כך ש"גיבוי" פיזי (על ידי רקמה או אמצעי הרכבה) מועיל בהפחתת אות זה. בסופו של דבר, אנו מסיקים כי אי הכללת האות לאחר העיבוד היא אסטרטגיה מספקת. מאפייני האות הלא ספציפיים היו ניתנים לזיהוי בקלות לאחר ניסויים וניתן היה להפחית אותם במהלך ניתוח במורד הזרם, למשל, באמצעות הרחקה ידנית של אותות לא ספציפיים של אזורים מחוץ לדגימה.
דגי זברה צעירים עד 15 dpf מלפחות 4 תבניות (וגילאים) שונים ניתנים להקפאה ולאסוף בהצלחה באזור ההדמיה הטרנסקריפטומית המרחבית, וניתן לעבד עד 179 חלקים בו זמנית. בהתבסס על איכות החתך, יישור הדגימה, גודל המדגם ואיכות תעתיקי ה-RNA במהלך ההדמיה, אנו מסיקים כי שיטה זו היא פרוטוקול יעיל לביצוע בדיקות טרנסקריפטומיות מרחביות יעילות. חוקרים יכולים להשתמש בשיטה זו כדי להפחית את העלויות הכרוכות בהדמיה מרחבית, להגדיל את גודל המדגם במהלך בדיקות טרנסקריפטומיות מרחביות, ואפילו להשיג ניסויים גדולים בריצה אחת.
Disclosures
למחברים אין גילויים או ניגודי אינטרסים בנוגע לדו"ח זה.
Acknowledgements
החיתוך וההדמיה בוצעו באמצעות מכשירים שסופקו על ידי משאבים משותפים במרכז הסרטן של דארטמות', במימון מענק התמיכה של מרכז הסרטן NCI 5P30CA023108, והמרכז לביולוגיה כמותית במכללת דארטמות' (NIGMS COBRE).
Materials
| Name | Company | Catalog Number | Comments |
| 1 L Beaker | Pyrex | 1003 | |
| 200 proof pure ethanol | Koptec | V1001 | |
| Acetic acid, glacial | VWR | 0714 | acidified alcohol |
| Aluminum foil | |||
| Cover slips | Epredia | 24X50-1.5-001G | |
| Disposable base mold | Fisher HealthCare | 22-363-556 | |
| Distilled water | |||
| DPX mountant | Sigma-Aldrich | 06522 | mountant for histology |
| Dry ice pellets | |||
| Dumont #5SF Forceps | Fine Science Tools | 11252-00 | |
| Eosin-Y Alcoholic | Epredia | 71204 | Eosin Y 1% |
| Gill 1 Hematoxylin | Epredia | 72411 | Hematoxylin |
| Kimwipe | Kimberly-Clark Professional | 34120 | absorbent, lint-free wipe |
| Lab labelling tape | VWR | 89097-934 | |
| Microtome blade MX35 Ultra | Epredia | 3053835 | |
| Microtome Cryostat | Thermo Scientific | Microme HM 525 | |
| O.C.T. Compound | Fisher HealthCare | 23-730-571 | freezing medium |
| Paraformaldehyde | Sigma-Aldrich | 158127 | PFA |
| Permanent Marker | VWR | 52877-886 | |
| Protractor | |||
| SafeClear Xylene Substitute | Fisherbrand | 68551-16-6 | Xylene substitute |
| Single Edge Blades | American Line | 66-0407 | |
| Steriomicroscope | Zeiss | 4350639000 | Stemi 305 w/ double spot LED (4355259020) and Stand K lab (4354259010) |
| Superfrost Plus Micro Slides | VWR | 48311-703 | |
| Transfer pipet | |||
| Xenium V1 slide | 10X/Xenium | 3000941 | spatial transcriptomic imaging slide |
References
- Rao, A., Barkley, D., França, G. S., Yanai, I. Exploring tissue architecture using spatial transcriptomics. Nature. 596 (7871), 211-220 (2021).
- Longo, S. K., Guo, M. G., Ji, A. L., Khavari, P. A. Integrating single-cell and spatial transcriptomics to elucidate intercellular tissue dynamics. Nat Rev Genet. 22, 627-644 (2021).
- Duhan, L., et al. Single-cell transcriptomics: background, technologies, applications, and challenges. Mol Biol Rep. 51, 600 (2024).
- Ståhl, P. L., et al. Visualization and analysis of gene expression in tissue sections by spatial transcriptomics. Science. 353 (6294), 78-82 (2016).
- Colman, R. E., et al. Whole-genome and targeted sequencing of drug-resistant Mycobacterium tuberculosis on the iSeq100 and MiSeq: A performance, ease-of-use, and cost evaluation. PLOS Med. 16 (4), e1002194 (2019).
- Marques, I. J., Lupi, E., Mercader, N. Model systems for regeneration: zebrafish. Development. 146 (18), dev167692 (2019).
- Mohideen, M. P. K., et al. Histology-based screen for zebrafish mutants with abnormal cell differentiation. Dev Dyn. 228 (3), 414-423 (2003).
- Copper, J. E., et al. Comparative analysis of fixation and embedding techniques for optimized histological preparation of zebrafish. Comp Biochem Physiol C Toxicol Pharmacol. 208, 38-46 (2018).
- Stock, R. J., Labudovich, M., Ducatman, B. Asymptomatic first-trimester liver cell adenoma: diagnosis by fine-needle aspiration cytology with cytochemical and ultrastructural study. Obstet Gynecol. 66 (2), 287-290 (1985).
- Petukhov, V., et al. Cell segmentation in imaging-based spatial transcriptomics. Nat Biotechnol. 40 (3), 345-354 (2022).
- Meyer, T., Tiburcy, M., Zimmermann, W. H. Cardiac macrotissues-on-a-plate models for phenotypic drug screens. Adv Drug Deliv Rev. 140, 93-100 (2019).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Dev Dyn. 203 (3), 253-310 (1995).
- Yu, K., Xing, J., Zhang, J., Zhao, R., Zhang, Y., Zhao, L. Effect of multiple cycles of freeze-thawing on the RNA quality of lung cancer tissues. Cell Tissue Bank. 18 (3), 433-440 (2017).
- Yang, S., et al. Decontamination of ambient RNA in single-cell RNA-seq with DecontX. Genome Biol. 21 (1), 57 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved