Method Article
الترتيب المضغوط مكانيا لأقسام اليرقات الزرد لتحليل النسخ المكاني
In This Article
Summary
هنا ، نقدم طريقة لمحاذاة وتقطيع عينات يرقات متعددة من الزرد (Danio rerio) وجمعها على شريحة واحدة لتحليل النسخ المكاني.
Abstract
تقنيات النسخ المكاني هي أداة متطورة في البحوث الطبية الحيوية لتصور أنماط التعبير الجيني المسجلة مكانيا. يمكن أن يكون تصوير وتحليل عينات متعددة باستخدام منصات التصوير المكاني مكلفا. يؤدي إجراء هذه الاختبارات على ظروف تجريبية متعددة ، كما هو موضح في الدراسات التنموية ، إلى زيادة التكاليف. لتقليل التكاليف ، سعت هذه الدراسة إلى تحسين تقنيات واستراتيجيات ترتيب عينات النسخ المكاني للدراسات التنموية. هنا ، استخدمت الدراسة أسماك الزرد ، وهي نموذج فقاريات تنموي راسخ وشفاف أثناء التطور ، وله ~ 70٪ تماثل جيني للبشر ، وجينوم مشروح للغاية مثالي لتحليل النسخ. نظرا لصغر حجمها ، يسمح تطوير أسماك الزرد أيضا بوضع مضغوط للأقسام التسلسلية عبر العديد من التكرارات البيولوجية. هنا ، نبلغ عن التثبيت الأمثل والتقطيع بالتبريد والمحاذاة الموثوقة لعينات الأسماك المتعددة داخل منطقة التصوير لمنصة التصوير المكاني للتهجين المتعدد في الموقع. باستخدام هذه الطريقة ، يمكن بنجاح قطع أسماك الزرد التي يصل وزنها إلى 15 يوما بعد الإخصاب (dpf) من 4 قوالب مختلفة على الأقل وما يصل إلى 174 قسما ، وجمعها في منطقة التصوير 22 مم 10.5 مم (لشريحة النسخ المكاني في الموقع ) ، ومعالجتها في وقت واحد. استنادا إلى جودة القسم ومحاذاة العينة وحجم العينة لكل شريحة ، تعمل هذه الطريقة في أسماك الزرد على تحسين الإخراج وتكلفة العينة لتقنيات النسخ المكاني.
Introduction
يظل تقييم أنماط التعبير المميزة مكانيا في الأنسجة أمرا بالغ الأهمية لفهمنا للتأثيرات الجينومية في التطور والسرطان والمرض1،2،3. يجمع النسخ المكاني بين تقنيات التعبير المتعدد مع التسجيل المكاني للتعبير في الأنسجة. صاغ Ståhl وزملاؤه "النسخ المكانية" لأولمرة ، حيث تم فحص عينات السرطان المركبة باستخدام تسلسل الجيل التالي في الموقع . منذ ذلك الوقت ، تم استخدام "النسخ المكانية" كصيد شامل لدراسات التعبير عالية الإنتاجية جنبا إلى جنب مع التسجيل المكاني. في حين أن هذه أدوات قوية ، إلا أنها أيضا مشاريع باهظة الثمن تتطلب استثمارات مؤسسية كبيرة وتكاليف معملية قبل إنشاء البيانات5. هناك طلب كبير على استراتيجيات تقليل التكلفة مع الحفاظ على البيانات عالية الجودة.
أصبحت أسماك الزرد ، Danio rerio ، نظاما نموذجيا مهما لدراسة علم الأحياء التنموي وتوفر وسيلة لمضاعفة تحليلات الأعضاء (والكائن الحي) للفقاريات بالكامل في مساحة محدودة. أسماك الزرد صغيرة (4-6 مم على شكل يرقات و 2-3 سم كبالغين) ويمكنها وضع مئات البيض الشفاف في وقتواحد 6. يتم تخصيب أجنة الزرد خارجيا وتتطور بسرعة ، مما يسمح للباحثين بإدخال الجينات المعدلة وراثيا في المراحل المبكرة من التطور لتوليد أليلات كسب وفقدان الوظيفةبسهولة. يعد تركيب عينات متعددة على شريحة واحدة استراتيجية جذابة لتقليل التكاليف. تجعل خصوبتها العالية وصغر حجمها من سمك الزرد مرشحا مثاليا لمضاعفة فحوصات النسخ المكانية التي قيدت مساحة العينات8.
يعد التقطيع بالتبريد ليرقات الزرد تقنية صعبة. لم يتم تحسين العديد من منصات النسخ المكانية لأقسام بارافين الزرد وتتطلب عمليات القطع بالتبريد عند العمل مع أسماك الزرد ككائن حي نموذجي للحفاظ على بنية الأنسجة والاحتفاظ بنصوص الحمض النووي الريبي. بالإضافة إلى ذلك ، فإن الحجم الصغير لأسماك الزرد يجعل من الصعب الحصول على عمليات القطع بالتبريد عالية الجودة وتحليل عينات متعددة بشكل فعال. تصبح هذه المهمة أكثر صعوبة عند العمل مع يرقات الزرد الأصغر حجما والأكثر هشاشة من نظيراتها البالغة. للتغلب على هذه التحديات ، نصف طريقة تقوم بمحاذاة عينات متعددة بشكل موثوق وتستخدم منطقة التصوير لمنصات التصوير المكاني بكفاءة للحصول على العديد من الأقسام عالية الجودة على شريحة واحدة يمكن بعد ذلك تصويرها وتحليلها بواسطة منصات التصوير المكاني (الشكل 1). في هذه الحالة ، يتم تطبيق هذه الطريقة على منصة تصوير النسخ المكاني.
Protocol
يتبع هذا البروتوكول إرشادات لجنة رعاية واستخدامها المؤسسية في كلية دارتموث.
1. تحضير ناظم البرد
- قم بتبريد ناظم البرد إلى -22 درجة مئوية وتنظيف الأسطح الداخلية لناظم التبريد عن طريق تنظيف الحطام بالفرشاة في الوعاء. ضع جميع الفرش والأدوات اللازمة داخل الغرفة.
2. تحضير قالب القاعدة القابل للتصرف
- قم بإعداد قالب أساسي (قالب بلاستيكي يمكن التخلص منه 37 مم 24 مم 5 مم) لمحاذاة العينة عن طريق رسم خط مستقيم عبر الجزء الداخلي من قالب القاعدة بعلامة دائمة لاستخدامه كنقطة مرجعية لمحاذاة العينة. ضع قطعة من شريط المختبر داخل قالب القاعدة حيث يجب أن يكون الخط المستقيم قبل رسم خط للحصول على أفضل النتائج (الشكل 2 أ).
- ارسم نقطة داخل قالب القاعدة بالقرب من الجدار الأيسر أو الأيمن لضمان اتجاه العينة المناسب أثناء القطع بالتبريد (الشكل 2 ب).
- قم بقياس زاوية القطع المطلوبة بمنقلة وقم بتمييزها داخل القالب الأساسي لكل عينة (الشكل 2C).
- ضع طبقة ضحلة من وسط التجميد (التصوير المقطعي للتماسك البصري [OCT]) على قالب القاعدة المعد. تأكد من وجود وسيط تجميد كاف لتغطية العينات.
- تجنب فقاعات الهواء عند تطبيق وسط التجميد عن طريق تحضير فوهة الزجاجة المتوسطة وإضافة الكمية اللازمة من الوسط إلى أحد أركان القالب الأساسي قبل إزاحة المستوى الأفقي للقالب الأساسي بحيث يتم توزيع الوسيط بالتساوي عبر السطح بأكمله.
- اضغط على الزجاجة ببطء عند توزيع وسط التجميد.
- أضف الثلج إلى دورق سعة 1 لتر ، ضع القالب الأساسي بوسط تجميد في الحمام الجليدي ، واحتضنه لمدة 10 دقائق على الأقل لتبريد الوسط.
3. تحضير الثلج الجاف: حمام الإيثانول 100٪
- قم بإعداد حمام ثلج جاف وإيثانول بنسبة 100٪ في غطاء دخان عن طريق إضافة جزء واحد من الإيثانول بنسبة 100٪ إلى جزء واحد من الثلج الجاف في دلو ثلج.
- استخدم طبقا من الألومنيوم يمكن التخلص منه أو قم بطي رقائق الألومنيوم في قارب كبير بما يكفي ليناسب قالب قاعدة يمكن التخلص منه. تأكد من أن الطبق أو القارب كبير بما يكفي لوضع القالب الأساسي بشكل مسطح تماما.
- ضع الطبق أو القارب في الحمام وقم بتغطية الدلو. اترك 5-10 دقائق حتى يبرد الدلو قبل تجميد العينات.
4. القتل الرحيم للعينات
- حدد سمك الزرد بشكل عشوائي للتقسيم. إذا اختلفت العينات في الحجم ، فقم بفصلها إلى مجموعات حسب الحجم النسبي لتسهيل المحاذاة الدقيقة (انظر المناقشة للحصول على التفاصيل). ضع الأسماك الكبيرة والأسماك الصغيرة في أطباق منفصلة.
- املأ دورق بماء نظام السمك وضع الدورق في دلو ثلج. أحط الدورق بالثلج.
- راقب درجة حرارة الماء باستخدام مقياس حرارة. دع درجة الحرارة تستقر بين 2-4 درجة مئوية.
- استخدم شبكة أو مصفاة لوضع مجموعة واحدة من الأسماك في الماء 4 درجات مئوية. يجب أن تكون الأسماك مغمورة بالكامل في الماء وعدم ملامسة الجليد. بمجرد توقف الحركة التشغيلية ، أضف الثلج إلى الماء للتأكد من بقائه أقل من 4 درجات مئوية. اترك السمك في ماء 4 درجات مئوية لمدة 10 دقائق.
ملاحظة: استمر في التضمين والمحاذاة والتجميد السريع لكل مجموعة من العينات التي تم القتل الرحيم قبل القتل الرحيم للمجموعة التالية. استبدل الماء في كل مرة.
5. التضمين والمحاذاة
- اجمع الأسماك التي تم قتلها رحيما بعد غمرها في ماء 4 درجات مئوية لمدة 10 دقائق. أخرج السمك من الماء باستخدام ملقط ناعم عن طريق الإمساك به من الزعنفة الذيلية وجففه بالضغط عليه برفق على منديل ماص وخالي من النسالة.
ملاحظة: بالنسبة للأقسام عالية الجودة ، من الأهمية بمكان تحديد الوقت بين إزالة الأسماك من الماء 4 درجات مئوية والتجميد السريع - العمل مع قالب القاعدة المحضر في حمام جليدي تحت مجهر مجسم (تكبير 10x) ، ضع كل عينة في القالب الأساسي على طول النقاط المرجعية في الاتجاه الصحيح وقم بتغطية العينات برفق بطبقة رقيقة أخرى من وسط التجميد.
ملاحظة: لا تملأ القالب بالكامل بوسط التجميد. بدلا من ذلك ، استخدم طبقة رقيقة فقط ، تكفي فقط لتغطية جميع العينات. - استخدم نقطة مرجعية تشريحية لمحاذاة السمكة بدقة مع الخطوط المحددة داخل قالب القاعدة. استخدم ملقطا دقيقا لضبط اتجاه كل سمكة بحيث تكون محاذاة وفي نفس الاتجاه. تجنب تكوين فقاعات في وسط التجميد عن طريق التحرك ببطء.
- ضع قطعة من الثلج الجاف في قاع قالب القاعدة أسفل العينات حتى يتم تجميدها محليا في موضعها. حافظ على المستوى الأفقي لمستوى القالب الأساسي لتجنب إزاحة العينات من نقاطها المرجعية قبل التجميد إلى موضعها مع الثلج الجاف.
- ضع القالب الأساسي مع العينات على قارب أو طبق من الألومنيوم في الثلج الجاف: حمام الإيثانول بنسبة 100٪. تأكد من أن القارب يطفو على سطح الحمام وأن القالب الأساسي يظل جافا. قم بتغطية الحمام واترك العينات تطفو لمدة 10 دقائق.
- لف قالب القاعدة المجمد بورق القصدير واحفظه في فريزر -80 درجة مئوية حتى يصبح جاهزا للتقسيم. كرر الخطوات 4.2-5.6 لأي مجموعات متبقية.
6. التقطيع بالتبريد
- أحضر قوالب القاعدة المجمدة إلى ناظم البرد المبرد مسبقا للتقطيع بالتبريد وضعها في حجرة ناظم البرد. انقل الكتل المجمدة في صندوق به ثلج جاف لمنع الذوبان.
- قم بإزالة شريحة التصوير المكاني في الموقع من التخزين وضعها في حامل شرائح مبرد مسبقا. قم بتخزين حامل الشريحة مع شريحة التصوير المكاني في غرفة ناظم التبريد -22 درجة مئوية حتى يصبح جاهزا لجمع الأقسام من المنطقة المعنية.
- قم بإزالة العينات المجمدة من القالب الأساسي ثم قم بتجميدها في ظرف بوسط تجميد جديد. قم بتجميدها على ظرف بحيث يواجه سطح القطع الشفرة.
- ضع شفرة ميكروتوم جديدة ودقيقة في الثلاجة.
- قم بمحاذاة القالب مع الشفرة وقم بقص منطقة الاهتمام (سمك القطع الموصى به 20-50 ميكرومتر). تأكد من نقل العلامات التي تم إجراؤها داخل القالب إلى كتلة العينة المجمدة للمساعدة في تحديد الموقع داخل العينات.
- اضبط القالب أثناء مرحلة التشذيب بحيث يكون سطح القطع موازيا للعلامات المرجعية في وسط التجميد.
- اجمع الأقسام على شريحة مجهر قياسية موجبة الشحنة وتحقق منها عن طريق الحقل الساطع للتأكد من عدم الحاجة إلى التشذيب.
- قم بإزالة شريحة التصوير المكاني من غرفة التبريد وضعها في حمام جليدي 4 درجات مئوية. احتفظ بالشريحة في حامل الشريحة. تأكد من أن الشريحة لا تبلل.
- ابدأ التشريح بالتبريد (يوصى به 10-14 ميكرومتر ؛ الشكل 3) وجمع الأقسام على شرائح موجبة الشحنة حتى يتم الوصول إلى منطقة الاهتمام في العينات. تحقق من الأقسام حسب الحقل الساطع لتأكيد أن منطقة الاهتمام ستكون القسم التالي من القالب.
- أعد شريحة التصوير المكاني أحادية الخلية إلى غرفة ناظم البرد. قم بإزالة الشريحة من حامل الشريحة وقم بتجميع الأقسام من منطقة الاهتمام الدقيقة إلى شريحة التصوير المكاني صفا تلو الآخر باستخدام فرشاة رسم ذات رؤوس دقيقة لمنع المقاطع من التدحرج.
- اضغط على زاوية من الوسط الفارغ المتجمد في مرحلة السكين مع الجانب الخلفي من فرشاة الرسم حتى يظل القسم مسطحا عند الإمساك بالشريحة للتجميع.
- استخدم الجزء العلوي من الشريحة كنقطة محورية ، وقم بخفض الشريحة ببطء على القسم ، واترك الأقسام تلتصق بالشريحة لمدة 3 ثوان قبل رفع الشريحة عن مرحلة السكين.
- اعمل من اليسار إلى اليمين عند تجميع الأقسام في منطقة التصوير للشريحة وتداخل طبقات الوسط الفارغ المتجمد عندما يكون ذلك ممكنا.
- استخدم حدود الورق الملونة كمرجع لوضع الأقسام داخل منطقة التصوير في الشريحة إذا كان من الصعب رؤية الأنسجة.
- بعد جمع الأقسام من منطقة الاهتمام ، ضع الشريحة مرة أخرى في حامل الشريحة. إذا لم يكن هناك المزيد من العينات التي سيتم جمعها على شريحة التصوير المكاني ، فقم بتخزين الشريحة عند -80 درجة مئوية لمدة تصل إلى أسبوعين حتى تصبح جاهزة لتحليل الأداة باستخدام منصة التصوير المكاني في الموقع . إذا كانت هناك حاجة إلى جمع الأقسام من قوالب متعددة ، فضع شريحة التصوير المكاني مرة أخرى في الحمام الجليدي 4 درجات مئوية وكرر الخطوات 6.3-6.11 مع القالب التالي.
- اجمع الأقسام قبل وبعد أقسام منطقة الاهتمام من كل قالب على شريحة مجهرية قياسية موجبة الشحنة لتلوين الهيماتوكسيلين والأيوزين (HE) للتحقق من أن محاذاة العينة وجودة القسم كافية قبل متابعة التحليل.
7. إصلاح العينة
- قم بإزالة الشرائح المرجعية من ناظم البرد وجففها في الهواء عند RT لمدة 30 دقيقة لتلتصق الأقسام بالشريحة.
- قم بإصلاح الأقسام عن طريق وضعها في حاوية منزلقة تحتوي على 4٪ بارافورمالدهيد (الجدول 1) لمدة 20 دقيقة.
- اغسل الأقسام عن طريق وضعها في وعاء منزلق بالماء المقطر لمدة 3 دقائق.
- استمر في تلطيخ HED أو تجفيفه وقم بتخزين الشرائح عند -80 درجة مئوية للتلطيخ في المستقبل.
8. تلطيخ الأقسام
- قم بتجفيف وتنظيف الأقسام عن طريق احتضان الشرائح في الإيثانول بنسبة 100٪ لمدة دقيقتين ، و 95٪ (الجدول 2) الإيثانول لمدة دقيقتين ، ثم ماء الصنبور لمدة 1 دقيقة. استخدم رف تلطيخ منزلق مجهر لنقل الشرائح من الحمام إلى الحمام.
- قم بتلطيخ النوى وتمييزها عن طريق احتضان الشرائح في الهيماتوكسيلين لمدة دقيقتين و 45 ثانية ، وماء الصنبور لمدة دقيقة واحدة ، والكحول المحمض بنسبة 0.3٪ (الجدول 3) لمدة دقيقة واحدة ، ثم تشغيل ماء الصنبور لمدة دقيقة واحدة. استخدم رف تلطيخ منزلق مجهر لنقل الشرائح من الحمام إلى الحمام.
- تلطيخ المكونات السيتوبلازمية وتجفيفها عن طريق احتضان الشرائح في Eosin Y 1٪ لمدة 45 ثانية ، و 50٪ إيثانول (الجدول 4) لمدة دقيقة واحدة ، و 95٪ إيثانول لمدة دقيقة واحدة ، و 100٪ إيثانول لمدة دقيقة واحدة. استخدم رف تلطيخ منزلق مجهر لنقل الشرائح من الحمام إلى الحمام.
- امسح الأقسام عن طريق احتضان الشرائح في الزيلين لمدة 1 دقيقة. قم بتركيب الشرائح وتغطيتها عن طريق تطبيق قطرة من وسط التثبيت على الثلث العلوي من الشريحة باستخدام ماصة نقل وخفض الغطاء ببطء أعلى وسط التثبيت باستخدام ملقط.
9. التصوير النسخي المكاني وتحليل الأقسام
- قم بإزالة شرائح التصوير من التخزين والصورة -80 درجة مئوية باستخدام منصة التصوير المكاني في الموقع لتحليل النسخ المكاني.
ملاحظة: سيتم تحديد الخطوات الدقيقة المتضمنة في التصوير بواسطة منصة التصوير المكاني. - مراجعة مقاييس مراقبة الجودة لمنصة النسخ المكاني. المقاييس المهمة التي يجب التحقق منها هي عدد الخلايا المكتشفة ، ومتوسط النصوص لكل خلية ، والنصوص النووية لكل 100 ميكرومتر2 ، وإجمالي النصوص عالية الجودة التي تم فك تشفيرها لكل جين في مجموعة المسبار.
ملاحظة: لا تحتوي مقاييس مراقبة الجودة هذه على عتبات عالمية ، وستختلف التوقعات لهذه العتبات اعتمادا على العينة ولوحة الجينات المستخدمة. - اقرأ إخراج البيانات لنصوص الحمض النووي الريبي التي يمكن اكتشافها ، وحدد النصوص ذات الجودة المنخفضة بناء على مقاييس مراقبة الجودة للتجربة ، وقم بتصفية النصوص منخفضة الجودة. تحليل النصوص المتبقية عالية الجودة فيما يتعلق بترتيبها المكاني داخل القسم.
- عرض التجزئة الخلوية للأقسام وخلايا نظام المجموعة استنادا إلى الاهتمامات التجريبية. قارن نصوص الحمض النووي الريبي داخل مجموعات الخلايا في المنطقة ذات الاهتمام عبر مجموعات من أعمار مختلفة من أسماك الزرد على نفس الشريحة.
النتائج
في هذه الطريقة (الشكل 1) ، يتم استخدام سمك الزرد كنموذج حيواني للتحقيق في أنماط التعبير الجيني التي تم حلها مكانيا. يعد التقطيع بالتبريد ليرقات الزرد بكفاءة للتصوير المكاني أمرا صعبا. يجب أن تكون الأقسام عالية الجودة للاحتفاظ ببنية الأنسجة والجينات التي يمكن اكتشافها (الشكل 4). يجب محاذاة الأقسام التي تحتوي على عينات متعددة للتصوير الفعال مكانيا بدقة لتحليل مناطق الاهتمام عبر جميع العينات (الشكل 2 والشكل 5). أخيرا ، يجب جمع الأقسام وتباعدها بكفاءة لزيادة عدد نقاط البيانات المحتملة داخل منطقة التصوير لشريحة النسخ المكانية (الشكل 3 والشكل 6). تم قياس التجارب باستخدام هذه المعلمات الثلاث لتحديد ما إذا كانت ناجحة أو دون المستوى الأمثل.
ساهمت العديد من تعديلات البروتوكول في قدرتنا على جمع أقسام عالية الجودة مرشحة جيدة للتصوير النسخي المكاني. أدى تعديل بروتوكولات القتل الرحيم والتثبيت والتضمين إلى تحسينات في جودة القسم (الشكل 4). في البروتوكول الأول (الشكل 4 ، البروتوكول 1) ، كانت جودة القسم دون المستوى الأمثل ، ولم تحتفظ الأنسجة بهيكلها. لتصحيح ذلك ، في البروتوكول الثاني (الشكل 4 ، البروتوكول 2) ، تم إدخال خطوة التجميد السريع بعد تضمين العينات والأنسجة الثابتة بعد جمع الأقسام على الشرائح. أدى هذا إلى تحسين بنية الأنسجة العامة للأقسام لكنه فشل في الوصول إلى ما كان يعتقد أنه جودة مقبولة لعلم النسخ المكاني. أخيرا ، في البروتوكول الثالث (الشكل 4 ، البروتوكول 3) ، تم تحسين تقنيات القتل الرحيم عن طريق تقصير مقدار الوقت المستغرق للقتل الرحيم للأسماك وتضمين الأسماك على الجليد قبل التجميد السريع والتقسيم اللاحق والتثبيت بعد التجميع. نتج عن ذلك عينات عالية الجودة كانت مرشحة جيدة للتصوير النسخي المكاني.
تطلبت محاذاة عينات متعددة مع منطقة الاهتمام بعض التعديلات على البروتوكول أيضا. كان أحد التعديلات التي حسنت المحاذاة عبر العينات هو إدخال نقاط مرجعية للقوالب الأساسية التي يتم تضمين أسماك الزرد فيها (الشكل 2). في التجارب التي أجريت في هذه الدراسة ، تمت محاذاة العينات من خلال مقارنة الهياكل عبر أقسام متعددة في نفس القطع (الشكل 5).
كانت الخطوة الأخيرة المهمة في تطوير طريقة النسخ المكاني الفعالة هي احتواء أكبر عدد ممكن من هذه العينات عالية الجودة والمحاذاة من مختلف الأعمار على نفس الشريحة للتصوير. يساهم اكتساب الخبرة وتحسين المهارات التقنية في تحسين عدد العينات التي يتم جمعها. ترجع هذه التحسينات أيضا إلى حد كبير إلى تعديلات طفيفة على خطوات التضمين والتجميع في البروتوكول. تسلط هذه اللوحات في الشكل 6 الضوء على عدد الأقسام التي تم جمعها في منطقة التصوير لكل شريحة بمرور الوقت. الشكل 6 أ (40 قسما من 15 سمكة dpf) هو تشغيل مبكر يستخدم قالبا واحدا أثناء التقسيم. يقدم الشكل 6 ب (90 قسما من 15 سمكة dpf و 47 قسما من 26 dpf سمكة) قالبا ثانيا ويظهر تحسنا في الترتيب المكاني عن طريق تقليل مقدار المسافة بين العينات أثناء التضمين. يقدم الشكل 6 ج (54 قسما من 15 سمكة dpf ، و 80 قسما من 19 سمكة dpf ، و 24 قسما من 23 dpf من الأسماك ، و 21 قسما من 26 dpf سمكة) قالبا ثالثا ورابعا ويظهر تحسنا مستمرا في الترتيب المكاني عن طريق تقليم سطح القطع للكتلة حول العينات وتداخل وسط التجمد الفارغ. أتاحت لنا هذه التحسينات الفرصة لوضع 179 قسما في منطقة التصوير لشريحة النسخ المكانية وأسماك الاختبار من 4 أعمار مختلفة.
عند الانتهاء من البروتوكول ، كان لدينا عينات يمكن تحليلها بسهولة باستخدام كل من البرامج الجاهزة الجاهزة في الموقع ومع الطرق المخصصة. استخدم برنامج تعدد الإرسال المستخدم هنا درجة زائفة ، تستند بشكل فضفاض إلى درجات جودة الفراد في بيانات التسلسل9. تراوحت الدرجات بين 59٪ -70٪ ، مع 60٪ هي الحد الأقصى للتحذير من قراءات منخفضة الجودة. عند الفحص ، كانت الدرجة المنخفضة للفريد الزائف بسبب انخفاض تعقيد الإشارة في المساحة الفارغة بين الأقسام. على الرغم من استخدام منطقة الشريحة بكفاءة ، إلا أن منطقة الشريحة كانت لا تزال فارغة بنسبة >50٪. عند حساب نسبة مساحة الانزلاق التي تشغلها الأنسجة ، حيث كانت الإشارة معقدة بما فيه الكفاية ، كانت جودة الإشارة ممتازة.
شوهدت أيضا إشارات منخفضة الكثافة وغير محددة في منطقتين عامتين على الشريحة: خارج العينات وداخل الحبل الظهري الفارغ (الشكل 7 أ). خارج الأقسام ، كان هناك نمط يتوافق مع قطعة أثرية للغسيل ، والتي من شأنها أن تقلل من الابتعاد عن العينات (الشكل 7 ب). كما شوهدت إشارة غير محددة داخل المناطق الفارغة من العينات التي يشغلها الحبل الظهري. كان هذا يعتبر قطعة أثرية محتملة للغسيل حيث يمكن أن تحبس كواشف التضخيم. كانت النصوص في كلتا المنطقتين سيتوبلازمية إلى حد كبير (أي البروتينات الريبوزومية L3 و L4) أو الميتوكوندريا (ترانسفيراز الأسبارتات ونازعة هيدروجين الايزوسيترات). عندما تم تضمين هذه المناطق في تجزئة Baysor ، والتي تحدد الخلايا بناء على توطين وتجميع النصوص حول النوى10 ، تضمن تحليل التجزئة حدود الخلية ، والتي تضمنت أحيانا هذه. كانت هذه الإشارة منخفضة بما يكفي بحيث يمكن تمييزها بسهولة عن العينة.
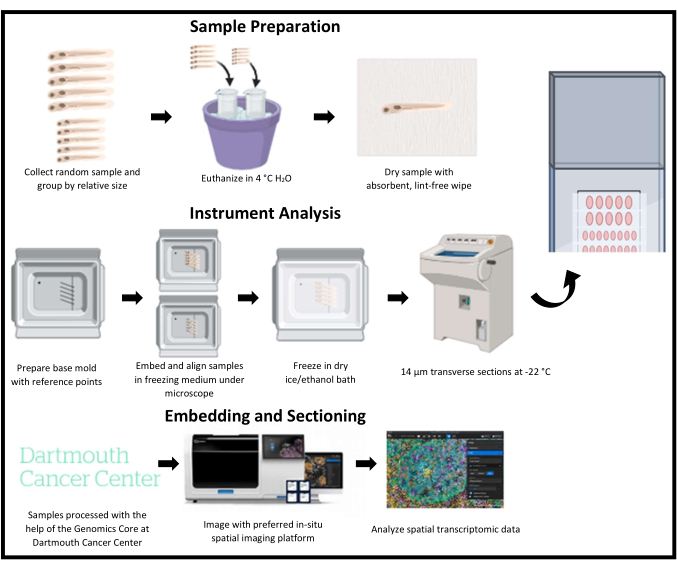
الشكل 1: مخطط تخطيطي للتقطيع بالتبريد للنسخ المكانية في أسماك الزرد. يتم جمع أسماك الزرد الصغيرة بشكل عشوائي ثم يتم تجميعها حسب الحجم النسبي. ثم يتم تضمين العينات في وسط تجميد ومحاذاة النقاط المرجعية على القالب الأساسي المقابلة لمنطقة الاهتمام. يتم تجميد كل قالب بالفلاش ، وتقطيعه بالتبريد ، وجمعه صفا واحدا في كل مرة على نفس الشريحة. يتم تخزين الشرائح عند -80 درجة مئوية بعد التقسيم وتصويرها وتحليلها باستخدام منصة تصوير النسخ المكاني. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: إنشاء نقاط مرجعية للتقسيم الدقيق. توضح سلسلة من الصور عملية إضافة نقاط مرجعية إلى قالب قاعدة يمكن التخلص منه لمحاذاة عينات متعددة للتقطيع بالتبريد. تتمثل الخطوة الأولى (أ) في استخدام شريط المختبر لتمييز خط داخل القالب ستستخدمه جميع العينات كمرجع للمحاذاة. (ب) ضع نقطة داخل القالب بالقرب من الجدار الأيسر أو الأيمن لإبلاغ الاتجاه المناسب للعينة أثناء القطع بالتبريد ، ثم (ج) ضع علامة على الخطوط لكل عينة بالزاوية المرغوبة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
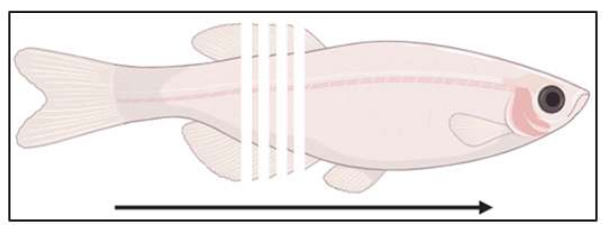
الشكل 3: تخطيطي لموقع التقسيم. يتم تقسيم الأسماك بشكل إكليلي ، من الذيلية إلى الأدوار ، على فترات 14 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
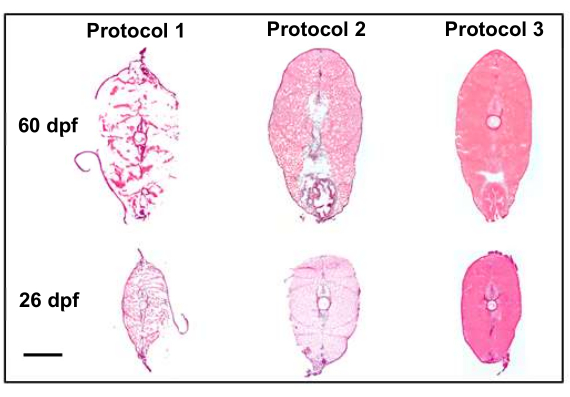
الشكل 4: تحسين جودة القسم مع تعديلات البروتوكول (10x). يقارن الشكل البروتوكولين الأولين ، اللذين أديا إلى جودة الأنسجة دون المستوى الأمثل ، مع البروتوكول النهائي ، مما أدى إلى أقسام عالية الجودة (احتفظت بالتشكل) وهي مرشحة جيدة لعلم النسخ المكاني. يستخدم البروتوكول 1 التحليل المقارن للأطلس الحيويلولاية بنسلفانيا 8 ، والذي تم تسليط الضوء عليه من خلال تثبيت بارافورمالدهيد بنسبة 4٪ قبل التقسيم. يقدم البروتوكول 2 تجميدا سريعا للثلج الجاف / الإيثانول بعد القتل الرحيم والتثبيت بعد التقسيم ، مما يحافظ على بنية الأنسجة بشكل أفضل مع التحذير من تجميد القطع الأثرية في جميع أنحاء القسم. وقام البروتوكول 3 بتنقيح تقنيات القتل الرحيم والتضمين على الجليد قبل التجميد السريع وما تلاه من تقطيع التقطيع والتثبيت بعد جمعه، مما أدى إلى الحصول على عينات عالية الجودة. شريط المقياس 500 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.

الشكل 5: التحقق من محاذاة الأقسام المتعددة (20x). صور ممثلة لدرجة حرارة المهنيين ل 26 قسما DPF تسلط الضوء على المحاذاة بين عينات متعددة في قص واحد. شريط المقياس 500 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.

الشكل 6: تحسين الترتيب المكاني للعينات. تسلط هذه اللوحات الضوء على عدد الأقسام التي تم جمعها في منطقة التصوير لكل شريحة بمرور الوقت. يساهم اكتساب الخبرة وتحسين المهارات التقنية في تحسين عدد العينات التي يتم جمعها. ترجع هذه التحسينات أيضا إلى حد كبير إلى تعديلات طفيفة على خطوات التضمين والتجميع في البروتوكول. اللوحة أ (40 قسما من 15 سمكة dpf) هي تشغيل مبكر يستخدم قالبا واحدا أثناء التقسيم. تقدم اللوحة B (90 قسما من 15 سمكة dpf و 47 قسما من 26 dpf سمكة) قالبا ثانيا وتظهر تحسنا في الترتيب المكاني عن طريق تقليل مقدار المسافة بين العينات أثناء التضمين. تقدم اللوحة C (54 قسما من 15 سمكة dpf ، و 80 قسما من 19 سمكة dpf ، و 24 قسما من 23 سمكة dpf ، و 21 قسما من 26 سمكة dpf) قالبا ثالثا ورابعا وتظهر تحسنا مستمرا في الترتيب المكاني عن طريق تقليم سطح القطع للكتلة حول العينات وتداخل وسط التجمد الفارغ. تمثل الأقواس الموجودة في كل لوحة قوالب مختلفة مستخدمة أثناء التقسيم. الأقسام على مساحة 10.5 مم 22 مم. شريط المقياس 4 مم. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.

الشكل 7: النتائج التمثيلية لتجربتنا النسخية المكانية. (أ) صورة واحدة لشريحة تمت معالجتها باستخدام البروتوكول كما هو موضح في الشكل 6C. (ب) أقسام 14 ميكرومتر من سمكة الزرد عند 15 نقطة في الدقيقة بعد التصوير النسخي المكاني الذي يعرض إشارة غير محددة بجوار الأقسام وداخل الحبل الظهري. شريط المقياس هو 4 مم في اللوحة A. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
| 4٪ بارافورمالديهايد | تركيز المخزون | مبلغ | التركيز النهائي |
| بارافورمالدهيد (مسحوق) | 95 ٪ وزن/وزن | 40 جرام | 4 ٪ وزن / حجم |
| هيدروكسيد الصوديوميوم | 1 نيوتن | بالتنقيط (حتى يذوب المسحوق) | |
| حمض الهيدروكلوريك | 1 نيوتن | Dropwise (حتى 6.9 درجة حموضة) | |
| PBS 1x الأسهم | 1x | ~ 1000 مل (يصل إلى الحجم الكلي 1000 مل) | 1x |
| مجموع | 1000 مل |
الجدول 1: 4٪ صيغة بارافورمالدهايد. تكوين محلول بارافورمالدهيد 4٪ لإصلاح العينات.
| 95٪ إيثانول | تركيز المخزون | مبلغ | التركيز النهائي |
| 200 دليل على الإيثانول | 100٪ حجم الصورة / الصورة | 190 مل | 95٪ حجم الصورة / الصورة |
| ماء RO | 100٪ حجم الصورة / الصورة | 10 مل | 5٪ حجم / حجم |
| مجموع | 200 مل |
الجدول 2: 95٪ صيغة الإيثانول. تكوين محلول الإيثانول بنسبة 95٪ لتجفيف الأقسام أثناء تلطيخ H & E.
| 0.3٪ كحول محمض | تركيز المخزون | مبلغ | التركيز النهائي |
| حمض الخليك الجليدي | 100٪ حجم الصورة / الصورة | 300 ميكرولتر | 0.3٪ من القيمة الرأسمالية |
| ماء RO | 100٪ حجم الصورة / الصورة | 99.7 مل | 99.7٪ من القيمة الحجمية |
| مجموع | 100 مل |
الجدول 3: 0.3٪ تركيبة كحول محمضة. تكوين 0.3٪ كحول محمض للتمييز أثناء تلطيخ HE.
| 50٪ إيثانول | تركيز المخزون | مبلغ | التركيز النهائي |
| 200 دليل على الإيثانول | 100٪ حجم الصورة / الصورة | 100 مل | 50٪ حجم الصورة |
| ماء RO | 100٪ حجم الصورة / الصورة | 100 مل | 50٪ حجم الصورة |
| مجموع | 200 مل |
الجدول 4: 50٪ صيغة الإيثانول. تكوين 50٪ إيثانول لتجفيف الأقسام أثناء تلطيخ HE.
Discussion
يقدم هذا التقرير حلولا مفصلة للعديد من التحديات التقنية المرتبطة بأسماك الزرد ككائن حي نموذجي في تحليل النسخ المكاني أثناء التطوير. في مواجهة هذه التحديات ، يعمل ترتيب العينات المدمجة لدينا على تحسين التكاليف على منصات النسخ المكانية الناشئة1. يعد استئصال يرقات الزرد بالتبريد للتصوير المكاني أمرا صعبا. يجب أن تحتفظ الأقسام ببنية الأنسجة الكافية وجودة النسخ للتنفيذ التجريبي المرضي والتحليل المكاني في اتجاه مجرىالنهر 8. يجب محاذاة الشرائح التي تحتوي على عينات متعددة للتصوير الفعال مكانيا بدقة لتحليل المناطق المشتركة ذات الأهمية عبر جميع العينات. أخيرا ، يجب جمع الأقسام وتباعدها بكفاءة لزيادة عدد نقاط البيانات المحتملة داخل المنطقة المخصصة لشريحة التصوير.
يسمح البروتوكول بجمع أقسام عالية الجودة تعد مرشحة ممتازة لمنصات التصوير المكاني أحادية الخلية. كان التعديل الأول هو تجميد سمك الزرد بسرعة ثم إصلاح الأقسام في 4٪ بارافورمالدهيد بعد جمعها على شريحة. في الأصل ، تم تثبيت أسماك الزرد بنسبة 4٪ بارافورمالدهيد عند 4 درجات مئوية بين عشية وضحاها وتم تضمينها وتقسيمها بعد ذلك11. ساعد اختيار إصلاح العينات بعد تقسيمها في الحفاظ على الأنسجة الداخلية التي لم يتم الحفاظ عليها بشكل فعال عند إصلاح عينة كاملة (الشكل 4).
كان التعديل الحاسم الثاني هو تحسين طريقة القتل الرحيم للحفاظ على سلامة الأنسجة. تم وضع أسماك الزرد في الأصل في ماء 4 درجات مئوية لمدة 20 دقيقة لضمان القتل الرحيم بشكل كاف. هذا يتجاوز 10 دقائق الحد الأدنى من متطلبات إرشادات IACUC. أعطى هذا الوقت الإضافي في الماء 4 درجات مئوية العينات مزيدا من الوقت للتحلل وساهم في جودة القسم الأقل من المثالية للهياكل الداخلية الدقيقة جدا أو الحساسة. ساعد تقليل مقدار الوقت في الماء 4 درجات مئوية إلى الحد الأدنى المطلوب البالغ 10 دقائق في الحفاظ على الهياكل الداخلية الدقيقة التي كانت مفقودة من محاولات التقسيم السابقة. تشمل التعديلات الأخرى غير الموضحة في الشكل 4 التقسيم في نفس يوم القتل الرحيم ، وتقليل مقدار الوقت بين القتل الرحيم والتجميد السريع من 15 دقيقة إلى أقل من 5 دقائق ، والعمل مع وسط تجميد مبرد مسبقا عند التضمين. كلما طالت مدة تخزين العينات عند -80 درجة مئوية قبل التقسيم ، كلما كانت جودة أنسجة القسم أسوأ. كانت الاختلافات دقيقة ، لكنها مثالية للتقسيم في نفس يوم القتل الرحيم وإنشاء الكتلة. يعد تقصير مقدار الوقت الذي تستغرقه محاذاة العينات بعد القتل الرحيم وقبل التجميد السريع إلى ما لا يزيد عن 5 دقائق أمرا بالغ الأهمية لجودة القسم.
تطلبت محاذاة عينات متعددة مع منطقة الاهتمام بعض التعديلات على البروتوكول أيضا. دقة المحاذاة التي تم تحقيقها (الشكل 5) مجمعة العينات حسب الحجم النسبي وقدمت أكبر مساهمة في ترتيب مكاني فعال. تتمثل الإستراتيجية الأساسية لمحاذاة العينات في تراكب سمك الزرد على نقاط مرجعية يتم رسمها على القوالب الأساسية التي يتم تضمينها فيها. تتم محاذاة العينات مع هذه النقاط المرجعية من خلال الهياكل التشريحية داخل عينات الزرد التي يمكن أن تختلف اعتمادا على منطقة الاهتمام المطلوبة. يمكن أن يختلف حجم الأسماك النامية من نفس العمر حتى 50٪ 12. يمكن أن تتغير العينات ذات الأحجام المختلفة بشكل كبير بسبب المسافات المتفاوتة بين النقطة المرجعية التشريحية ومنطقة الاهتمام. أدى تجميع العينات من نفس العمر حسب الحجم النسبي وتضمين كل حجم في قوالبها إلى تحسين القدرة على محاذاة عينات متعددة داخل قالبها. يمكن لهذه الطريقة محاذاة ما يقرب من 2/3 من العينات بشكل موثوق اعتمادا على النافذة المسموح بها من قبل منطقة الاهتمام واختيار النقطة المرجعية التشريحية.
يؤدي تقليل المسافة بين العينات عند التضمين والمحاذاة إلى زيادة عدد العينات لكل شريحة. ومع ذلك ، فإن هذا التكوين الضيق مقيد بشكل أكبر بالحدود الائتمانية في منطقة التصوير. بالإضافة إلى الخبرة في cryostat ، تم وصف العديد من الاستراتيجيات للتوفيق بين هذه الاستراتيجيات. أولا ، يمكن أن يكون للوضع الدقيق لوسط التضمين المتداخل بين الأقسام وتقليم القالب المجمد تأثيرات عميقة على عدد الأقسام التي يمكن أن تتناسب مع منطقة تصوير معينة. يسلط الشكل 6 الضوء على عدد الأقسام التي تم الحصول عليها قبل وبعد تحسين ترتيب التضمين. ثانيا ، تم وضع حد على السطح الخارجي للعينات الخارجية أثناء التضمين وقبل التجميد للمساعدة في وضعه بشكل صحيح على شريحة التصوير. ثالثا ، يمكن أن يجعل حجم الزرد اليرقي وطبيعته الشفافة من الصعب معرفة مكان وجود العينات داخل شريحة بحيث يمكن جمعها بدقة على شريحة. وجدنا أن استخدام الورق الملون لتباين وسط التجميد الأبيض لإنشاء حد على السطح الخارجي للعينات الخارجية أدى إلى وضع أكثر دقة للأقسام على الشرائح.
تساعد الفروق الدقيقة في درجة الحرارة المحلية في الحفاظ على العينة أثناء عملية القطع. بمجرد جمع عينات من قوالب متعددة على شريحة واحدة ، يتم تخزين شريحة التصوير عند 4 درجات مئوية ، ويتم قطع القالب التالي إلى منطقة الاهتمام المطلوبة قبل جمعها مرة أخرى. يجب أن تكون شريحة التصوير أكثر دفئا قليلا من الأقسام حتى تلتصق بشكل صحيح بسطح الشريحة. لذا ، فإن تخزين شريحة التصوير عند -80 درجة مئوية أو في ناظم البرد عند -20 درجة مئوية بين جمع العينات من قوالب مختلفة ليس مثاليا. من الأهمية بمكان أيضا ألا تخضع العينات التي تم جمعها على شريحة التصوير لدورات تجميد / ذوبان متعددة ، حيث يمكن أن يؤثر ذلك سلبا على جودة نصوص الحمض النووي الريبي داخل كل عينة. الحفاظ على شريحة التصوير مع الأقسام التي تم جمعها مسبقا عند 4 درجات مئوية يحافظ بشكل كاف على نصوص الحمض النووي الريبي مع الحفاظ على درجة حرارة منخفضة للالتصاق المناسب دون آثار جانبية سلبية مرتبطة بدورات التجميد / الذوبان13.
على الرغم من الحصول على نتائج مرضية ، إلا أن تصميم هذه الطريقة يأتي مع قيود محتملة. القيد الأول هو أننا مقيدون بمنطقة التصوير لشريحة النسخ المكانية ، والتي تضع سقفا للعدد الإجمالي للأقسام التي يمكن تصويرها على نفس الشريحة. بالنظر إلى أنه لا يزال لدينا مساحة فارغة بين الأقسام ، فمن المحتمل أننا لم نصل بعد إلى حدود ما هو ممكن لهذه الطريقة ، لكننا ندرك أن هناك نقطة لم يعد من الممكن فيها احتواء المزيد من الأقسام على شريحة التصوير. سيؤدي العمل مع الأسماك الكبيرة في الأعمار الأكبر حجما أيضا إلى الحد من الحجم الإجمالي للعينة ولكن لا ينبغي أن يؤثر على الكمية الإجمالية للأنسجة التي يمكن أن تتناسب مع منطقة التصوير في الشريحة. يمكن أن تؤدي التحسينات التقنية بواسطة منصات التصوير المكاني إلى زيادة الكمية الإجمالية للأنسجة التي يمكن تصويرها عن طريق توسيع منطقة التصوير على شرائح التصوير. قيد آخر لهذه الطريقة هو أن البروتوكول لم يتم تحسينه للأسماك التي يقل عمرها عن 15 نقطة في الدقيقة. وجد أن الأسماك أصبحت أكثر هشاشة بشكل متزايد كلما كانت أصغر سنا وأن الأسماك التي يقل عمرها عن 15 نقطة في الدقيقة كان من الصعب للغاية التعامل معها وتضررت بسهولة أثناء عملية التضمين. أدى ذلك إلى زيادة مقدار الوقت بين القتل الرحيم والتجميد السريع ، مما كان ضارا بجودة الأنسجة. أدى هذا أيضا إلى تقليل النسبة المئوية للعينات القابلة للحياة المتبقية للتقطيع بالتبريد ، ولم تكن الأسماك القليلة القابلة للحياة المتبقية للتقسيم صلبة بما يكفي للاحتفاظ ببنية الأنسجة لتحليل الجودة. إن العثور على أدوات أكثر ملاءمة للتعامل مع الأسماك الأكثر هشاشة والعمل مع وسط تجميد أقل كثافة يزيد أيضا من صلابة العينات أثناء التقسيم يمكن أن يسمح بتطبيق هذه الطريقة على الأسماك التي يقل عمرها عن 15 dpf. آخر قيد رئيسي لهذه الطريقة هو محاذاة العينة لمناطق صغيرة جدا ذات أهمية. وجدنا أنه كلما كانت منطقة الاهتمام في العينة أصغر ، قل احتمال قدرتنا على محاذاتها بشكل صحيح. لقد عملنا مع منطقة ذات أهمية يبلغ حجمها حوالي 50 ميكرومتر ، مما أدى إلى محاذاة حوالي 2/3 من الأقسام بشكل صحيح. يمكن أن تؤدي العينات ذات المنطقة ذات الأهمية الأصغر من 50 ميكرومتر إلى محاذاة أقل من 2/3 من المقاطع. تأتي غالبية العينات المنحرفة من خطوة التضمين في البروتوكول. من الصعب ضبط عينة واحدة في وسط التجميد دون نقل عينات أخرى تمت محاذاتها بالفعل. هناك أيضا فترة محدودة من الوقت الذي يتعين على الباحث فيه محاذاة هذه العينات قبل التأثير سلبا على جودة الأنسجة. أخيرا ، يتم نقل القوالب من المجهر المجسم إلى حمام التجميد السريع ، ومن الممكن أن تتحول العينات في القالب قبل تجميدها تماما. من الممكن أن يسمح العمل باستخدام وسط تجميد أكثر برودة للباحث بنقل عينة واحدة بسهولة أكبر دون التأثير على العينات الأخرى المحاذاة بالفعل. يمكن أن يؤدي تجميد القالب بالفلاش دون الحاجة إلى تحريكه بعد المحاذاة إلى القضاء على نقل العينة قبل تجميدها تماما في مكانها. لقد حددنا إشارات غير محددة خارج العينات.
قدم المنتج النهائي والتحليل اللاحق الأولي دروسا إضافية. كانت هناك إشارات غير محددة تتطلب النظر فيها. وفقا للشركة المصنعة ، تعد بعض نصوص الإشارة المنخفضة قطعة أثرية معروفة ويمكن رؤية الحمض النووي الريبي المحيط في تسلسل الحمض النووي الريبي أحادي الخلية الذي يمكن إدارته بعد التحليل14. قد يكون البروتوكول المستخدم هنا قد ساهم في النصوص المحيطة حيث حدث التثبيت بعد وضع العينات. ومع ذلك ، وجد أن التثبيت المبكر أدى إلى مورفولوجيا ضعيفة وغير متسقة لهذه الأعمار الصغيرة. بدلا من ذلك ، يمكن أن تخلق كواشف التضخيم التي تم تجميعها مثل هذا التأثير. من الناحية النوعية ، كانت الإشارة غير المحددة التي شوهدت في الحبل الظهري أكثر وضوحا. أثناء المعالجة ، كانت الحبل الظهري هي المنطقة الفارغة الوحيدة حقا لأنها لم تحتوي على وسائط متصاعدة وإشارات نسخ ، والتي تشبه الملامح السيتوبلازمية والميتوكوندريا لأنسجة بطانة الحبل الظهري المجاورة. يشير هذا إلى أن "الدعم" المادي (عن طريق الأنسجة أو وسائط التثبيت) مفيد في تقليل هذه الإشارة. في النهاية ، نعتقد أن استبعاد الإشارة في المعالجة اللاحقة هو استراتيجية مرضية. يمكن التعرف بسهولة على ميزات الإشارة غير المحددة بعد التجارب ويمكن تخفيفها أثناء التحليل النهائي ، على سبيل المثال ، من خلال الاستبعاد اليدوي للإشارات غير المحددة للمناطق خارج العينة.
يمكن بنجاح قطع أسماك الزرد التي يصل وزنها إلى 15 نقطة في الدقيقة من 4 قوالب مختلفة على الأقل (والأعمار) وجمعها داخل منطقة التصوير النسخي المكاني ، ويمكن معالجة ما يصل إلى 179 قسما في وقت واحد. استنادا إلى جودة القسم ومحاذاة العينة وحجم العينة وجودة نصوص الحمض النووي الريبي أثناء التصوير ، نستنتج أن هذه الطريقة هي بروتوكول فعال لإجراء فحوصات النسخ المكاني الفعالة. يمكن للباحثين استخدام هذه الطريقة لتقليل التكاليف المرتبطة بالتصوير المكاني ، وزيادة حجم العينة أثناء فحوصات النسخ المكاني ، وحتى تحقيق تجارب كبيرة في جولة واحدة.
Disclosures
ليس لدى المؤلفين أي إفصاحات أو تضارب في المصالح فيما يتعلق بهذا التقرير.
Acknowledgements
تم إجراء التقسيم والتصوير باستخدام الأدوات التي توفرها الموارد المشتركة في مركز دارتموث للسرطان ، بتمويل من منحة دعم مركز السرطان NCI 5P30CA023108 ، ومركز البيولوجيا الكمي في كلية دارتموث (NIGMS COBRE).
Materials
| Name | Company | Catalog Number | Comments |
| 1 L Beaker | Pyrex | 1003 | |
| 200 proof pure ethanol | Koptec | V1001 | |
| Acetic acid, glacial | VWR | 0714 | acidified alcohol |
| Aluminum foil | |||
| Cover slips | Epredia | 24X50-1.5-001G | |
| Disposable base mold | Fisher HealthCare | 22-363-556 | |
| Distilled water | |||
| DPX mountant | Sigma-Aldrich | 06522 | mountant for histology |
| Dry ice pellets | |||
| Dumont #5SF Forceps | Fine Science Tools | 11252-00 | |
| Eosin-Y Alcoholic | Epredia | 71204 | Eosin Y 1% |
| Gill 1 Hematoxylin | Epredia | 72411 | Hematoxylin |
| Kimwipe | Kimberly-Clark Professional | 34120 | absorbent, lint-free wipe |
| Lab labelling tape | VWR | 89097-934 | |
| Microtome blade MX35 Ultra | Epredia | 3053835 | |
| Microtome Cryostat | Thermo Scientific | Microme HM 525 | |
| O.C.T. Compound | Fisher HealthCare | 23-730-571 | freezing medium |
| Paraformaldehyde | Sigma-Aldrich | 158127 | PFA |
| Permanent Marker | VWR | 52877-886 | |
| Protractor | |||
| SafeClear Xylene Substitute | Fisherbrand | 68551-16-6 | Xylene substitute |
| Single Edge Blades | American Line | 66-0407 | |
| Steriomicroscope | Zeiss | 4350639000 | Stemi 305 w/ double spot LED (4355259020) and Stand K lab (4354259010) |
| Superfrost Plus Micro Slides | VWR | 48311-703 | |
| Transfer pipet | |||
| Xenium V1 slide | 10X/Xenium | 3000941 | spatial transcriptomic imaging slide |
References
- Rao, A., Barkley, D., França, G. S., Yanai, I. Exploring tissue architecture using spatial transcriptomics. Nature. 596 (7871), 211-220 (2021).
- Longo, S. K., Guo, M. G., Ji, A. L., Khavari, P. A. Integrating single-cell and spatial transcriptomics to elucidate intercellular tissue dynamics. Nat Rev Genet. 22, 627-644 (2021).
- Duhan, L., et al. Single-cell transcriptomics: background, technologies, applications, and challenges. Mol Biol Rep. 51, 600 (2024).
- Ståhl, P. L., et al. Visualization and analysis of gene expression in tissue sections by spatial transcriptomics. Science. 353 (6294), 78-82 (2016).
- Colman, R. E., et al. Whole-genome and targeted sequencing of drug-resistant Mycobacterium tuberculosis on the iSeq100 and MiSeq: A performance, ease-of-use, and cost evaluation. PLOS Med. 16 (4), e1002194 (2019).
- Marques, I. J., Lupi, E., Mercader, N. Model systems for regeneration: zebrafish. Development. 146 (18), dev167692 (2019).
- Mohideen, M. P. K., et al. Histology-based screen for zebrafish mutants with abnormal cell differentiation. Dev Dyn. 228 (3), 414-423 (2003).
- Copper, J. E., et al. Comparative analysis of fixation and embedding techniques for optimized histological preparation of zebrafish. Comp Biochem Physiol C Toxicol Pharmacol. 208, 38-46 (2018).
- Stock, R. J., Labudovich, M., Ducatman, B. Asymptomatic first-trimester liver cell adenoma: diagnosis by fine-needle aspiration cytology with cytochemical and ultrastructural study. Obstet Gynecol. 66 (2), 287-290 (1985).
- Petukhov, V., et al. Cell segmentation in imaging-based spatial transcriptomics. Nat Biotechnol. 40 (3), 345-354 (2022).
- Meyer, T., Tiburcy, M., Zimmermann, W. H. Cardiac macrotissues-on-a-plate models for phenotypic drug screens. Adv Drug Deliv Rev. 140, 93-100 (2019).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Dev Dyn. 203 (3), 253-310 (1995).
- Yu, K., Xing, J., Zhang, J., Zhao, R., Zhang, Y., Zhao, L. Effect of multiple cycles of freeze-thawing on the RNA quality of lung cancer tissues. Cell Tissue Bank. 18 (3), 433-440 (2017).
- Yang, S., et al. Decontamination of ambient RNA in single-cell RNA-seq with DecontX. Genome Biol. 21 (1), 57 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved