Method Article
用于空间转录组学分析的斑马鱼幼鱼切片空间紧凑排列
摘要
在这里,我们提出了一种对齐和冷冻切片多个斑马鱼 (Danio rerio) 幼虫样本并将它们收集在单个载玻片上以进行空间转录组学分析的方法。
摘要
空间转录组学技术是生物医学研究中的一种复杂工具,用于可视化空间注册的基因表达模式。使用空间成像平台对多个样品进行成像和分析可能成本高昂。如开发研究中所见,在多个实验条件下执行这些测试会进一步增加成本。为了降低成本,本研究试图优化用于发育研究的空间转录组标本排列的技术和策略。在这里,该研究利用了斑马鱼,斑马鱼是一种成熟的发育脊椎动物模型,在发育过程中是透明的,与人类具有 ~70% 的遗传同源性,并且具有高度注释的基因组,非常适合转录组学分析。由于斑马鱼体积小,发育中的斑马鱼还允许在多个生物重复中紧凑地放置连续切片。在此,我们报告了多重 原 位杂交空间成像平台成像区域内多个鱼样本的优化固定、冷冻切片和可靠对齐。使用这种方法,可以从至少 4 个不同的模具和多达 174 个切片中冷冻切片来自受精后 15 天 (dpf) 的斑马鱼,在 22 毫米 10.5 毫米的成像区域内收集(对于 原位 空间转录组载玻片),并同时处理。根据切片质量、样本对齐和每张载玻片的样本量,斑马鱼中的这种方法优化了空间转录组学技术的输出和每个样本的成本。
引言
评估组织中空间不同的表达模式对于我们理解基因组对发育、癌症和疾病的影响仍然至关重要 1,2,3。空间转录组学将多重表达技术与组织中表达的空间配准相结合。“空间转录组学”最早是由 Ståhl 及其同事4 创造的,其中使用原位下一代测序探测安装的癌症标本。从那时起,“空间转录组学”就被用作高通量表达研究与空间配准相结合的统称。虽然这些工具很强大,但它们也是昂贵的工作,通常需要大量的机构投资和实验室成本才能生成数据5。在保留高质量数据的同时最大限度地降低成本的策略需求量很大。
斑马鱼 Danio rerio 已成为研究发育生物学的重要模型系统,并提供了一种在有限空间内增加脊椎动物整个器官(和生物体)分析的方法。斑马鱼很小(幼鱼 4-6 毫米,成虫 2-3 厘米),一次可以产下数百个透明卵6.斑马鱼胚胎在外部受精并迅速发育,使研究人员能够在发育的早期阶段引入转基因,以容易产生功能获得性和丧失性的等位基因7。在单个玻片上安装多个试样是一种降低成本的有吸引力的策略。它们的高繁殖力和小尺寸使斑马鱼成为多重空间转录组学测定的理想选择,这些分析对标本空间有限8。
斑马鱼幼虫冷冻切片是一项具有挑战性的技术。许多空间转录组学平台尚未针对斑马鱼石蜡切片进行优化,并且在将斑马鱼作为模式生物使用时需要冷冻切片,以保存组织结构和保留 RNA 转录本。此外,斑马鱼的小尺寸使得难以获得高质量的冷冻切片和有效分析多个样品。当处理斑马鱼幼虫时,这项任务变得更加困难,因为斑马鱼幼虫比成年斑马鱼幼虫更小、更脆弱。为了克服这些挑战,我们描述了一种方法,该方法可靠地对齐多个样品并有效地利用空间成像平台的成像区域,在单个载玻片上获得许多高质量的切片,然后可以通过空间成像平台进行成像和分析(图 1)。在这种情况下,该方法应用于空间转录组成像平台。
研究方案
该协议遵循达特茅斯学院机构动物护理和使用委员会的指导方针。
1. 准备低温恒温器
- 将低温恒温器冷却至 -22 °C,并将碎屑刷入容器中,清洁低温恒温器的内表面。将所有必要的刷子和工具放入腔室内。
2. 准备一次性底模
- 通过在基模内部画一条直线,准备一个用于样品对齐的基模(37 mm 24 mm 5 mm 一次性塑料模具),用永久记号笔作为样品对齐的参考点。在画线之前,在基模内侧的直线位置上放一块实验室胶带以获得最佳效果(图 2A)。
- 在靠近左壁或右壁的基模内侧画一个点,以确保在冷冻切片过程中样品方向正确(图 2B)。
- 用量角器测量所需的切割角度,并在每个样品的基模内侧标记(图 2C)。
- 将一层浅层冷冻(光学相干断层扫描 [OCT])培养基涂在准备好的基模上。确保有足够的冷冻培养基覆盖样品。
- 在涂抹冷冻介质时,通过灌注培养基瓶的喷嘴并在基模的一个角上添加必要量的介质,然后移动基模的水平面,使介质均匀分布在整个表面上,从而避免出现气泡。
- 分配冷冻培养基时,请缓慢挤压瓶子。
- 将冰块加入 1 L 烧杯中,将装有冷冻培养基的基模放入冰浴中,孵育至少 10 分钟以冷却培养基。
3. 制备干冰:100% 乙醇浴
- 在通风橱中将一份 100% 乙醇加入冰桶中的一份干冰中,在通风橱中制备干冰和 100% 乙醇浴。
- 使用一次性铝盘或将铝箔折叠到足够大的船中,以容纳一次性底座模具。确保盘子或船足够大,以便底模完全平放。
- 将盘子或船放入浴缸中,盖上桶盖。冷冻样品前,让桶冷却 5-10 分钟。
4. 对样本实施安乐死
- 随机选择斑马鱼进行切片。如果样品大小不同,请按相对大小将它们分成几组,以便于准确对齐(有关详细信息,请参阅讨论)。将较大的鱼和较小的鱼放在不同的盘子中。
- 在烧杯中装满鱼系水,然后将烧杯放入冰桶中。用冰块包围烧杯。
- 用温度计监测水温。让温度稳定在 2-4 °C 之间。
- 使用网或过滤器将一组鱼放入 4 °C 的水中。鱼应完全浸入水中,不要与冰接触。一旦鳃盖运动停止,向水中加入冰块以确保其保持在 4 °C 以下。 将鱼在 4 °C 水中放置 10 分钟。
注:在对下一组安乐死样品实施安乐死之前,继续对每组安乐死样品进行包埋、对齐和快速冷冻。每次都要换水。
5. 嵌入和对齐
- 将安乐死的鱼浸入 4 °C 水中 10 分钟后收集。用细尖镊子抓住尾鳍将鱼从水中捞出,然后用吸水、不起毛的湿巾轻轻按压擦干。
注:对于高质量的切片,限制从 4 °C 水中去除鱼和快速冷冻之间的时间至关重要 - 在立体显微镜(10 倍放大倍率)下,在冰浴中使用准备好的基模,沿参考点以正确的方向将每个样品放入基模中,然后用另一层薄薄的冷冻介质轻轻覆盖样品。
注意:不要用冷冻介质填充整个模具。相反,只使用薄层,刚好足以覆盖所有样品。 - 使用解剖参考点将鱼与基模内侧标记的线条精确对齐。使用细尖镊子调整每条鱼的方向,使它们对齐并处于相同的方向。缓慢移动,避免在冷冻介质中产生气泡。
- 在样品下方的基模底部涂上一块干冰,直到它们局部冻结到位。保持基模的水平面,以避免样品在用干冰冻结到位之前从参考点移开。
- 将装有样品的基模放在干冰:100% 乙醇浴中的铝舟或盘子上。确保船漂浮在浴槽表面,并且基模保持干燥。盖上浴槽,让样品漂浮 10 分钟。
- 用箔纸包裹冷冻的底模并储存在 -80 °C 冰箱中,直到准备好切片。对任何剩余组重复步骤 4.2-5.6。
6. 冷冻切片
- 将冷冻的基模带到预冷的低温恒温器中进行冷冻切片,然后将它们放入低温恒温器室中。将冷冻块放在装有干冰的盒子中运输,以防止解冻。
- 从储存中取出 原位 空间成像载玻片,并将其放入预冷的载玻片架中。将带有空间成像载玻片的载玻片架存放在 -22 °C 低温恒温器室中,直到准备好从感兴趣区域收集切片。
- 从基模中取出冷冻样品,然后在装有新鲜冷冻介质的卡盘中冷冻。将它们冷冻到卡盘上,使切割表面面向刀片。
- 将新鲜、精细的切片机刀片放入低温恒温器中。
- 将模具与刀片对齐并修剪感兴趣的区域(建议的修剪厚度 20-50 μm)。确保在模具内所做的标记转移到冷冻的样品块上,以帮助识别样品内的位置。
- 在修整阶段调整模具,使切割表面与冷冻介质中的参考标记平行。
- 将切片收集到带正电的标准显微镜载玻片上,并通过明场检查,以确认何时不再需要修剪。
- 从低温恒温器室中取出空间成像载玻片,并将其置于 4 °C 冰浴中。将载玻片放在载玻片支架中。确保载玻片不会弄湿。
- 开始冷冻切片(推荐 10-14 μm; 图 3)并将切片收集到带正电的载玻片上,直到达到样品中的感兴趣区域。按明场检查截面,以确认感兴趣区域将是模具的下一个截面。
- 将单细胞空间成像载玻片带回低温恒温器室。从载玻片架上取下载玻片,并使用细尖画笔逐行将确切感兴趣区域的切片收集到空间成像载玻片上,以防止切片卷起。
- 用画笔的背面将空的冷冻介质的一角压入切刀台,以便在抓取载玻片进行收集时,该部分保持平坦。
- 以载玻片顶部为枢轴点,慢慢将载玻片降低到切片上,让切片粘附在载玻片上 3 秒,然后将载玻片从载刀台上提起。
- 在载玻片的成像区域收集切片时,从左到右工作,并尽可能重叠空的冷冻介质层。
- 如果组织难以看清,请使用彩色纸张边框作为参考,将切片放置在载玻片的成像区域内。
- 从感兴趣区域收集切片后,将玻片放回玻片支架中。如果没有更多样品需要收集到空间成像载玻片上,请将载玻片在 -80 °C 下储存长达 2 周,直到它准备好使用 原位 空间成像平台进行仪器分析。如果需要从多个模具中收集切片,请将空间成像载玻片放回 4 °C 冰浴中,然后对下一个模具重复步骤 6.3-6.11。
- 在标准带正电荷的显微镜载玻片上从每个模具收集感兴趣区域的切片之前和之后,进行苏木精和伊红 (HE) 染色,以检查样品对齐和切片质量是否足够,然后再进行分析。
7. 固定样品
- 从低温恒温器中取出参比载玻片,并在室温下风干 30 分钟,以将切片粘附在载玻片上。
- 通过将切片放入含有 4% 多聚甲醛(表 1)的载玻片容器中 20 分钟来固定切片。
- 将切片放入装有蒸馏水的载玻片容器中 3 分钟,洗涤切片。
- 继续进行 HE 染色或干燥,并将载玻片储存在 -80 °C 以备将来染色。
8. 切片的 HE 染色
- 通过将载玻片在 100% 乙醇中孵育 2 分钟,在 95%(表 2)乙醇中孵育 2 分钟,然后用自来水孵育 1 分钟来脱水和清洁切片。使用显微镜载玻片染色架将载玻片从一个浴转移到另一个浴。
- 通过将载玻片在苏木精中孵育 2 分钟 45 秒、自来水 1 分钟、0.3% 酸化酒精(表 3)1 分钟,然后用自来水运行 1 分钟来染色和区分。使用显微镜载玻片染色架将载玻片从一个浴转移到另一个浴。
- 将载玻片在 1% 曙红 Y 中孵育 45 秒,50% 乙醇(表 4)孵育 1 分钟,95% 乙醇 1 分钟,100% 乙醇 1 分钟,将载玻片细胞质成分染色并脱水。使用显微镜载玻片染色架将载玻片从一个浴转移到另一个浴。
- 通过将载玻片在二甲苯中孵育 1 分钟来清除切片。用移液管将一滴封固剂滴在载玻片的顶部三分之一处,然后用镊子慢慢降低封固剂顶部的盖玻片,以安装并覆盖载玻片。
9. 切片的空间转录组成像和分析
- 从 -80 °C 储存中取出成像载玻片,并使用 原位 空间成像平台进行空间转录组学分析。
注意:成像中涉及的确切步骤将由空间成像平台决定。 - 查看空间转录组学平台的质量控制指标。需要检查的重要指标是检测到的细胞数量、每个细胞的中位转录本、每 100 μm2 的核转录本以及探针集中每个基因的高质量解码转录本总数。
注意:这些质量控制指标没有通用阈值,对这些阈值的期望会因所使用的样本和基因面板而异。 - 读取可检测 RNA 转录本的数据输出,根据实验的质量控制指标确定哪些转录本质量低,并过滤掉低质量转录本。分析与本节中的空间排列相关的其余高质量转录本。
- 根据实验兴趣查看切片和聚类细胞的细胞分割。在同一张载玻片上比较不同年龄斑马鱼组感兴趣区域细胞簇内的 RNA 转录物。
结果
在这种方法中(图 1),斑马鱼被用作动物模型来探测空间分辨的基因表达模式。有效地冷冻切片斑马鱼幼虫以进行空间成像具有挑战性。切片必须具有高质量,以保留组织结构和可检测基因(图 4)。包含多个样品的切片必须精确对齐以实现空间高效成像,以分析所有样品中的感兴趣区域(图 2 和图 5)。最后,必须有效地收集切片并间隔,以最大限度地提高空间转录组学载玻片成像区域内潜在数据点的数量(图 3 和图 6)。使用这三个参数对实验进行测量,以确定它们是成功的还是次优的。
许多协议修改有助于我们收集高质量的切片,这些切片是空间转录组成像的良好候选者。调整安乐死、固定和嵌入的方案以提高切片质量(图 4)。在第一个方案(图 4,方案 1)中,切片质量次优,组织没有保留其结构。为了纠正这个问题,在第二个方案(图 4, 方案 2)中,在将切片收集到载玻片上后,在包埋样品和固定组织后引入快速冷冻步骤。这改善了切片的整体组织结构,但未能达到空间转录组学可接受的质量。最后,在第三个方案(图 4, 方案 3)中,通过缩短对鱼实施安乐死所需的时间,并在快速冷冻之前将鱼包埋在冰上以及随后的切片和固定后,对安乐死技术进行了改进。这产生了最高质量的样品,非常适合空间转录组成像。
将多个样品与感兴趣区域对齐也需要对方案进行一些修改。最能改善样品对齐的修改之一是在嵌入斑马鱼的基模中引入参考点(图 2)。在本研究进行的实验中,通过比较同一切割中多个切片的结构来对齐样品(图 5)。
开发高效空间转录组学方法的最后一个重要步骤是将尽可能多的这些不同年龄的高质量、对齐的样本放在同一张载玻片上进行成像。获得经验和提高技术技能有助于增加采集的样本数量。这些改进在很大程度上也是由于对方案中嵌入和收集步骤的轻微调整。 图 6 中的这些面板突出显示了随时间在每张玻片的成像区域中收集的切片数量。 图 6A (40 段 15 dpf 鱼)是在切片过程中使用一个模具的早期运行。 图 6B (90 节 15 dpf 鱼和 47 节 26 dpf 鱼)引入了第二个模具,并通过减少包埋过程中样品之间的空间量来显示空间排列的改进。 图 6C (54 段 15 dpf 鱼、80 段 19 dpf 鱼、24 段 23 dpf 鱼和 21 段 26 dpf 鱼)介绍了第三个和第四个模具,并通过修剪样品周围的块状物的切割表面并重叠空的冷冻培养基,显示了空间排列的持续改进。这些改进使我们有机会在空间转录组载玻片的成像区域放置 179 个切片,并测试 4 个不同年龄的鱼。
在方案完成时,我们得到了可以使用现成的多路复 用原位 软件和定制方法轻松分析的样品。这里使用的多重软件采用了伪 phred 评分,松散地基于测序数据中的 phred 质量评分9。分数范围为 59%-70%,其中 60% 是低质量读取警告的临界值。经检查,低伪 phred 评分是由于切片之间空白空间的信号复杂度低。尽管玻片区域得到了有效利用,但玻片区域仍然空>50%。当考虑到组织占据的载玻片面积的比例时,信号足够复杂,信号质量非常好。
在载玻片上的两个一般区域也观察到低强度、非特异性信号:标本外部和空脊索内(图 7A)。在切片之外,有一个与洗涤伪影一致的模式,这将减少从标本上移开的情况(图 7B)。在脊索占据的标本的空白区域内也观察到非特异性信号。这被认为是可能的洗涤伪影,扩增试剂可能会被捕获。两个区域的转录物主要是细胞质 (即核糖体蛋白 L3 和 L4) 或线粒体 (天冬氨酸转移酶和异柠檬酸脱氢酶)。当这些区域包含在 Baysor 分割中时,Baysor 分割根据细胞核10 周围转录物的定位和聚集来识别细胞,分割分析包括细胞边界,有时包括这些边界。这个信号足够低,很容易与标本区分开来。
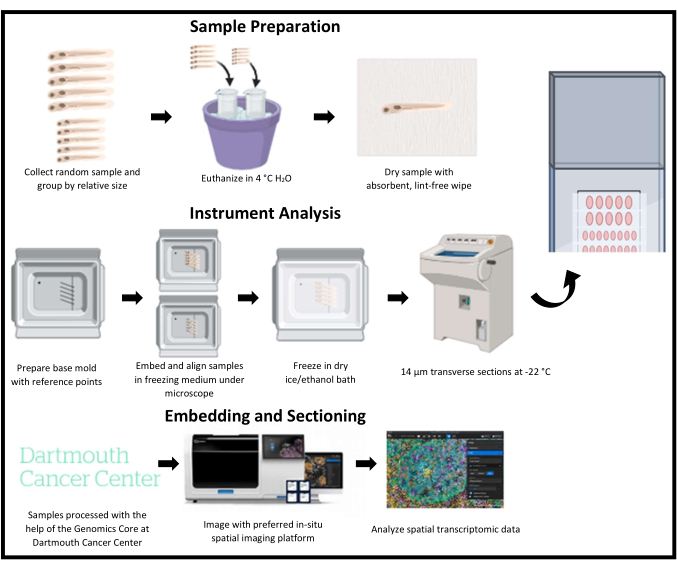
图 1:斑马鱼空间转录组学冷冻切片示意图。 随机收集幼年斑马鱼,然后按相对大小分组。然后将样品嵌入冷冻介质中,并通过基模上对应于感兴趣区域的参考点对齐。每个模具都经过快速冷冻、冷冻切片,并在同一载玻片上一次收集一行。切片后将载玻片储存在 -80 °C,并使用空间转录组成像平台进行成像和分析。 请单击此处查看此图的较大版本。

图 2:建立精确切片的参考点。 一系列图像演示了向一次性基础模具添加参考点以对齐多个样品进行冷冻切片的过程。第一步 (A) 是用实验室胶带在模具内部标记一条线,所有样品都将使用该线作为对齐的参考。(B) 在模具内侧靠近左壁或右壁的位置放置一个点,以告知冷冻切片过程中样品的正确方向,然后 (C) 以所需的角度为每个样品标记线条。 请单击此处查看此图的较大版本。
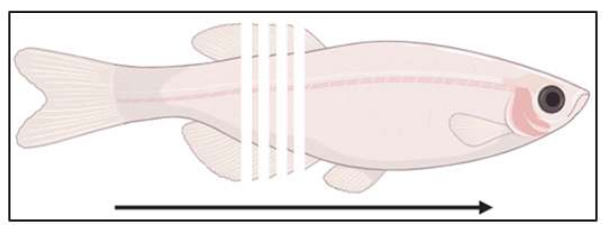
图 3:切片位置示意图。 鱼以 14 μm 的间隔从尾部到喙部进行冠状切片。 请单击此处查看此图的较大版本。
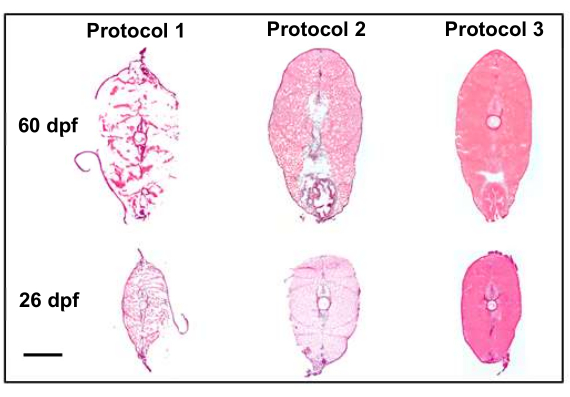
图 4:通过协议修改提高切片质量 (10x)。 该图将前两种方案(导致组织质量欠佳)与最终方案进行了比较,后者导致高质量的切片(保留了形态),是空间转录组学的良好候选者。方案 1 利用宾夕法尼亚州立大学生物图谱的比较分析8,突出表现为切片前 4% 多聚甲醛固定。方案 2 在安乐死后引入干冰/乙醇快速冷冻,并在切片后固定,这样可以更好地保留组织结构,但需要注意在整个切片中冻结伪影。方案 3 改进了安乐死技术和在快速冷冻之前的冰上包埋以及随后的收集后切片和固定,从而获得了最高质量的样品。比例尺为 500 μm。 请单击此处查看此图的较大版本。

图 5:多截面对齐验证 (20x)。 26 个 dpf 截面的代表性 HE 图像,突出了单次切割中多个样品之间的对齐。比例尺为 500 μm。 请单击此处查看此图的较大版本。

图 6:改进的标本空间排列。 这些面板突出显示了随时间推移在每张玻片的成像区域中收集的切片数。获得经验和提高技术技能有助于增加采集的样本数量。这些改进在很大程度上也是由于对方案中嵌入和收集步骤的轻微调整。面板 A (40 段 15 dpf 鱼)是早期运行,在切片过程中使用一个模具。图 B (90 个 15 dpf 鱼段和 47 个 26 dpf 鱼段)引入了第二个模具,并通过在包埋过程中减少样品之间的空间量来显示空间排列的改进。图 C (54 节 15 dpf 鱼、80 节 19 dpf 鱼、24 节 23 dpf 鱼和 21 节 26 dpf 鱼)引入了第三个和第四个模具,并通过修剪样品周围块的切割表面并重叠空的冷冻培养基,显示了空间排列的持续改进。每个面板中的支架代表切片过程中使用的不同模具。截面面积为 10.5 mm,22 mm。比例尺为 4 毫米。 请单击此处查看此图的较大版本。

图 7:我们的空间转录组学实验的代表性结果。 (A) 使用协议处理的载玻片的单个图像,如图 6C 所示。(B) 空间转录组成像后,斑马鱼在 15 dpf 下的 14 μm 切片显示与切片相邻和脊索内的非特异性信号。面板 A 中的比例尺为 4 毫米。 请单击此处查看此图的较大版本。
| 4% 多聚甲醛 | 库存集中 | 量 | 最终浓度 |
| 多聚甲醛(粉末) | 95 % 瓦/瓦 | 40 克 | 4 % w/v |
| 氢氧化钠 | 1 牛 | 逐滴(直到粉末溶解) | |
| 盐酸 | 1 牛 | 逐滴(直到 6.9 pH) | |
| PBS 1x 原液 | 1 倍 | ~1000 mL(达到 1000 mL 总体积) | 1 倍 |
| 总 | 1000 毫升 |
表 1:4% 多聚甲醛分子式。 用于固定样品的 4% 多聚甲醛溶液的组成。
| 95% 乙醇 | 库存集中 | 量 | 最终浓度 |
| 200 标准乙醇 | 100% V/V | 190 毫升 | 95% V/V |
| RO 水 | 100% V/V | 10 毫升 | 5% V/V |
| 总 | 200 毫升 |
表 2:95% 乙醇配方。 95% 乙醇溶液的成分,用于在 H&E 染色过程中对切片进行脱水。
| 0.3% 酸化酒精 | 库存集中 | 量 | 最终浓度 |
| 冰醋酸 | 100% V/V | 300 微升 | 0.3% V/V |
| RO 水 | 100% V/V | 99.7 毫升 | 99.7% V/V |
| 总 | 100 毫升 |
表 3:0.3% 酸化酒精配方。 0.3% 酸化醇的成分,用于在 HE 染色过程中进行区分。
| 50% 乙醇 | 库存集中 | 量 | 最终浓度 |
| 200 标准乙醇 | 100% V/V | 100 毫升 | 50% V/V |
| RO 水 | 100% V/V | 100 毫升 | 50% V/V |
| 总 | 200 毫升 |
表 4:50% 乙醇配方。 50% 乙醇的成分,用于在 HE 染色过程中对切片进行脱水。
讨论
本报告为开发过程中与斑马鱼作为模式生物在空间转录组学分析中相关的许多技术挑战提供了详细的解决方案。为了应对这些挑战,我们紧凑的标本布置优化了新兴空间转录组学平台的成本1。对斑马鱼幼虫进行冷冻切片以进行空间成像具有挑战性。切片应保留足够的组织结构和转录质量,以便进行令人满意的实验执行和下游空间分析8。对于空间高效成像,包含多个样品的切片必须精确对齐,以分析所有样品中的常见感兴趣区域。最后,必须有效地收集切片并间隔,以最大限度地提高成像载玻片指定区域内潜在数据点的数量。
该协议允许收集高质量的切片,这些切片是单细胞空间成像平台的绝佳候选者。第一种修改是将斑马鱼快速冷冻,然后在将切片收集到载玻片上后,将它们固定在 4% 多聚甲醛中。最初,斑马鱼在 4 °C 下用 4% 多聚甲醛固定过夜,然后包埋和切片11。选择在切片后固定样品有助于保留固定整个样品时未有效保存的内部组织(图 4)。
第二个关键的修改是改进安乐死方法以保持组织完整性。斑马鱼最初将斑马鱼置于 4 °C 水中 20 分钟,以确保它们被充分安乐死。这比 IACUC 指南的最低要求高出 10 分钟。在 4 °C 水中的额外时间使样品有更多的时间分解,并导致非常精细或精细的内部结构的切片质量不理想。将 4 °C 水中的时间减少到最低要求 10 分钟,有助于保留以前切片尝试中缺失的精致内部结构。 图 4 中未显示的其他修改包括在安乐死的同一天进行切片,将安乐死和快速冷冻之间的时间从 15 分钟减少到 5 分钟以下,以及在包埋时使用预冷的冷冻培养基。切片前样品在 -80 °C 下储存的时间越长,切片的组织质量就越差。差异很细微,但它非常适合在安乐死和区块创建同一天进行切片。将安乐死后和快速冷冻前对齐样品所需的时间缩短至不超过 5 分钟,对于切片质量至关重要。
将多个样品与感兴趣区域对齐也需要对方案进行一些修改。实现的对齐精度(图 5)按相对大小对样本进行分组,为高效的空间排列做出了最大的贡献。对齐样品的主要策略是将斑马鱼叠加到参考点上,这些参考点绘制在嵌入它们的基模上。标本通过斑马鱼标本内的解剖结构与这些参考点对齐,这些结构可以根据所需的感兴趣区域而变化。同龄发育中的鱼的大小差异最大可达 50%12。由于解剖参考点和感兴趣区域之间的距离不同,大小差异很大的样品可能会错位。按相对大小对相同年龄的样品进行分组,并将每个尺寸的样品嵌入模具中,可以提高在模具内对齐多个样品的能力。这种方法可以可靠地对齐大约 2/3 的样品,具体取决于感兴趣区域允许的窗口和解剖参考点的选择。
在嵌入和对齐时减少样品之间的空间会导致每张玻片的样品数量增加。然而,这种紧密配置进一步受到成像区域的基准限制的限制。除了低温恒温器的经验外,还描述了几种协调这些的策略。首先,切片之间重叠包埋介质的精确放置和冷冻模具的修剪会对特定成像区域可容纳的切片数量产生深远影响。 图 6 突出显示了优化包埋安排之前和之后获得的截面数量。其次,在包埋期间和冷冻之前,在最外层样品的外部放置一个边界,以帮助正确放置在成像载玻片上。第三,斑马鱼幼鱼的大小和透明性使得很难知道样本在载玻片中的位置,因此无法将它们精确地收集到载玻片上。我们发现,使用彩色纸对比白色冷冻介质以在最外层样品的外部创建一个边界,可以更精确地将切片放置在载玻片上。
当地温度的细微差别有助于在切割过程中保存样品。一旦将来自多个模具的样品收集到单个载玻片上,将成像载玻片储存在 4 °C 下,将下一个模具修剪到所需的感兴趣区域,然后再收集。成像载玻片必须比切片略热,才能正确粘附在载玻片表面。因此,在从不同模具收集样品之间,将成像载玻片储存在 -80 °C 或 -20 °C 的低温恒温器中并不理想。同样重要的是,成像载玻片上收集的样品不会经历多次冻融循环,因为这会对每个样品中 RNA 转录本的质量产生负面影响。将带有先前收集的切片的成像载玻片保持在 4 °C 可充分保存 RNA 转录本,同时保持较低的温度以实现适当的粘附,而不会产生与冻融循环相关的负面副作用13。
尽管获得了令人满意的结果,但该方法的设计确实存在可能的局限性。第一个限制是我们被限制在空间转录组载玻片的成像区域,这为同一载玻片上可以成像的切片总数设置了上限。鉴于我们在切片之间仍有空白空间,我们可能还没有达到这种方法可能的界限,但我们认识到,在某个点上,不再可能将更多的切片放在成像载玻片上。在较老年时与较大的鱼一起工作也会限制总样本量,但不应影响可以放入载玻片成像区域的组织总量。空间成像平台的技术改进可能会通过扩大成像载玻片上的成像区域来增加可能成像的组织总量。这种方法的另一个限制是该协议尚未针对小于 15 dpf 的鱼进行优化。研究发现,鱼越年轻越脆弱,小于 15 dpf 的鱼极难处理,并且在嵌入过程中很容易损坏。这导致安乐死和快速冷冻之间的时间增加,这对组织质量有害。这也降低了留给冷冻切片的活样本的百分比,并且剩下用于切片的少数活鱼不够坚硬,无法保留组织结构以进行质量分析。寻找更适合处理更脆弱鱼类的工具,并使用密度较低的冷冻介质,这也会增加切片过程中样品的刚性,可以将这种方法应用于小于 15 dpf 的鱼类。这种方法的最后一个主要限制是非常小的感兴趣区域的样品对齐。我们发现,样品中感兴趣的区域越小,我们能够正确对齐它们的可能性就越小。我们处理了一个大小约为 50 μm 的感兴趣区域,这导致大约 2/3 的切片被正确对齐。感兴趣区域小于 50 μm 的样品可能导致不到 2/3 的切片对齐。大多数未对齐的样品来自实验步骤中的嵌入步骤。在不移动已对齐的其他样品的情况下,很难在冷冻培养基中调整一个样品。研究人员在对组织质量产生负面影响之前对齐这些样品的时间也是有限的。最后,将模具从立体显微镜移动到速冻浴中,样品有可能在完全冻结之前在模具中移动。使用较冷的冷冻介质可能会使研究人员更容易移动一个样品,而不会影响其他已经对齐的样品。对准后无需移动模具即可快速冻结模具,可以在样品完全冻结到位之前消除样品移位。我们确实发现了标本之外的非特异性信号。
最终产品和初步的后分析提供了额外的经验教训。存在非特异性信号,需要考虑。根据制造商的说法,一些低信号转录本是已知的伪影,在单细胞 RNA-seq 中可以看到环境 RNA,可以在分析后进行管理14。这里使用的协议可能有助于环境转录本,因为固定发生在放置标本之后。然而,研究发现,早期固定导致这些年轻人的形态不佳且不一致。或者,混合的扩增试剂可以产生这种效果。定性地,在脊索中看到的非特异性信号最为明显。在加工过程中,脊索是唯一真正的空区域,因为它不包含安装介质和转录信号,这类似于相邻脊索衬里组织的细胞质和线粒体谱。这表明物理 “背衬”(通过组织或封固剂)有助于降低这种信号。最终,我们推断在后处理中排除信号是一个令人满意的策略。非特异性信号特征在实验后很容易识别,并且可以在下游分析中减轻,例如,通过手动排除标本外部区域的非特异性信号。
来自至少 4 个不同模具(和年龄)的斑马鱼可以在空间转录组成像区域内成功冷冻切片和收集,并且可以同时处理多达 179 个切片。根据切片质量、样品对齐、样品量和成像过程中 RNA 转录物的质量,我们得出结论,该方法是进行高效空间转录组学分析的有效方案。研究人员可以使用这种方法来降低与空间成像相关的成本,在空间转录组学分析期间增加样本量,甚至可以在单次运行中实现大型实验。
披露声明
作者对本报告没有披露或利益冲突。
致谢
切片和成像使用达特茅斯癌症中心共享资源提供的仪器进行,该中心由 NCI 癌症中心支持拨款 5P30CA023108 和达特茅斯学院定量生物学中心 (NIGMS COBRE) 资助。
材料
| Name | Company | Catalog Number | Comments |
| 1 L Beaker | Pyrex | 1003 | |
| 200 proof pure ethanol | Koptec | V1001 | |
| Acetic acid, glacial | VWR | 0714 | acidified alcohol |
| Aluminum foil | |||
| Cover slips | Epredia | 24X50-1.5-001G | |
| Disposable base mold | Fisher HealthCare | 22-363-556 | |
| Distilled water | |||
| DPX mountant | Sigma-Aldrich | 06522 | mountant for histology |
| Dry ice pellets | |||
| Dumont #5SF Forceps | Fine Science Tools | 11252-00 | |
| Eosin-Y Alcoholic | Epredia | 71204 | Eosin Y 1% |
| Gill 1 Hematoxylin | Epredia | 72411 | Hematoxylin |
| Kimwipe | Kimberly-Clark Professional | 34120 | absorbent, lint-free wipe |
| Lab labelling tape | VWR | 89097-934 | |
| Microtome blade MX35 Ultra | Epredia | 3053835 | |
| Microtome Cryostat | Thermo Scientific | Microme HM 525 | |
| O.C.T. Compound | Fisher HealthCare | 23-730-571 | freezing medium |
| Paraformaldehyde | Sigma-Aldrich | 158127 | PFA |
| Permanent Marker | VWR | 52877-886 | |
| Protractor | |||
| SafeClear Xylene Substitute | Fisherbrand | 68551-16-6 | Xylene substitute |
| Single Edge Blades | American Line | 66-0407 | |
| Steriomicroscope | Zeiss | 4350639000 | Stemi 305 w/ double spot LED (4355259020) and Stand K lab (4354259010) |
| Superfrost Plus Micro Slides | VWR | 48311-703 | |
| Transfer pipet | |||
| Xenium V1 slide | 10X/Xenium | 3000941 | spatial transcriptomic imaging slide |
参考文献
- Rao, A., Barkley, D., França, G. S., Yanai, I. Exploring tissue architecture using spatial transcriptomics. Nature. 596 (7871), 211-220 (2021).
- Longo, S. K., Guo, M. G., Ji, A. L., Khavari, P. A. Integrating single-cell and spatial transcriptomics to elucidate intercellular tissue dynamics. Nat Rev Genet. 22, 627-644 (2021).
- Duhan, L., et al. Single-cell transcriptomics: background, technologies, applications, and challenges. Mol Biol Rep. 51, 600(2024).
- Ståhl, P. L., et al. Visualization and analysis of gene expression in tissue sections by spatial transcriptomics. Science. 353 (6294), 78-82 (2016).
- Colman, R. E., et al. Whole-genome and targeted sequencing of drug-resistant Mycobacterium tuberculosis on the iSeq100 and MiSeq: A performance, ease-of-use, and cost evaluation. PLOS Med. 16 (4), e1002194(2019).
- Marques, I. J., Lupi, E., Mercader, N. Model systems for regeneration: zebrafish. Development. 146 (18), dev167692(2019).
- Mohideen, M. P. K., et al. Histology-based screen for zebrafish mutants with abnormal cell differentiation. Dev Dyn. 228 (3), 414-423 (2003).
- Copper, J. E., et al. Comparative analysis of fixation and embedding techniques for optimized histological preparation of zebrafish. Comp Biochem Physiol C Toxicol Pharmacol. 208, 38-46 (2018).
- Stock, R. J., Labudovich, M., Ducatman, B. Asymptomatic first-trimester liver cell adenoma: diagnosis by fine-needle aspiration cytology with cytochemical and ultrastructural study. Obstet Gynecol. 66 (2), 287-290 (1985).
- Petukhov, V., et al. Cell segmentation in imaging-based spatial transcriptomics. Nat Biotechnol. 40 (3), 345-354 (2022).
- Meyer, T., Tiburcy, M., Zimmermann, W. H. Cardiac macrotissues-on-a-plate models for phenotypic drug screens. Adv Drug Deliv Rev. 140, 93-100 (2019).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Dev Dyn. 203 (3), 253-310 (1995).
- Yu, K., Xing, J., Zhang, J., Zhao, R., Zhang, Y., Zhao, L. Effect of multiple cycles of freeze-thawing on the RNA quality of lung cancer tissues. Cell Tissue Bank. 18 (3), 433-440 (2017).
- Yang, S., et al. Decontamination of ambient RNA in single-cell RNA-seq with DecontX. Genome Biol. 21 (1), 57(2020).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。