Method Article
Пространственно компактное расположение срезов личинок данио-рерио для пространственного транскриптомного анализа
В этой статье
Резюме
В данной работе мы представляем метод выравнивания и криоссекции нескольких образцов личинок рыбок данио-рерио (Danio rerio) и сбора их на одном предметном стекле для пространственного транскриптомного анализа.
Аннотация
Пространственные транскриптомные методы являются сложным инструментом в биомедицинских исследованиях для визуализации пространственно зарегистрированных паттернов экспрессии генов. Визуализация и анализ нескольких образцов с помощью платформ пространственной визуализации могут быть дорогостоящими. Проведение этих испытаний в нескольких экспериментальных условиях, как видно из исследований развития, еще больше увеличивает затраты. Чтобы снизить затраты, это исследование было направлено на оптимизацию методов и стратегий пространственного расположения транскриптомных образцов для исследований развития. В исследовании использовались рыбки данио-рерио, которые представляют собой хорошо зарекомендовавшую себя модель развития позвоночных, которая прозрачна во время развития, имеют ~70% генетической гомологии с человеком и высоко аннотированный геном, идеально подходящий для транскриптомного анализа. Из-за своего небольшого размера развивающиеся рыбки данио также позволяют компактно размещать серийные секции на нескольких биологических репликах. В данной работе мы сообщаем об оптимизированной фиксации, криосекции и надежном выравнивании нескольких образцов рыб в области визуализации мультиплексной платформы пространственной визуализации гибридизации in situ. С помощью этого метода рыбки данио в возрасте 15 дней после оплодотворения (dpf) по меньшей мере из 4 различных форм и до 174 срезов могут быть успешно криоссекированы, собраны в области визуализации 22 мм 10,5 мм (для пространственного транскриптомного предметного стекла in situ ) и обработаны одновременно. Основываясь на качестве сечения, выравнивании образца и размере образца на слайде, этот метод у рыбок данио оптимизирует вывод и стоимость образца пространственных транскриптомных методов.
Введение
Оценка пространственно различных паттернов экспрессии в тканях остается критически важной для нашего понимания влияния генома на развитие, рак и болезни 1,2,3. Пространственная транскриптомика сочетает в себе методы мультиплексной экспрессии с пространственной регистрацией экспрессии в тканях. Термин «пространственная транскриптомика» был впервые придуман Столоми его коллегами, в ходе которого образцы рака были исследованы с использованием секвенирования нового поколения in situ. С тех пор «пространственная транскриптомика» используется в качестве универсального решения для высокопроизводительных исследований экспрессии в сочетании с пространственной регистрацией. Несмотря на то, что это мощные инструменты, они также являются дорогостоящими мероприятиями, которые часто требуют больших институциональных инвестиций и лабораторных расходов для получения данных. Стратегии минимизации затрат при сохранении высокого качества данных пользуются большим спросом.
Рыбки данио, Danio rerio, стали важной моделью системы для изучения биологии развития и предлагают средство для размножения анализов всего органа (и организма) позвоночных в ограниченном пространстве. Рыбки данио маленькие (4-6 мм как личинки и 2-3 см как взрослые особи) и могут отложить за один разсотни прозрачных икринок. Эмбрионы рыбок данио оплодотворяются внешне и быстро развиваются, что позволяет исследователям вводить трансгены на ранних стадиях развития, чтобы легко генерировать аллели прироста и потери функции. Размещение нескольких образцов на одном предметном стекле является привлекательной стратегией для снижения затрат. Их высокая плодовитость и небольшой размер делают рыбок данио идеальным кандидатом для мультиплексных пространственных транскриптомных анализов, которые имеют ограниченное пространство для образцов8.
Криосекция личинок данио-рерио является сложной методикой. Многие пространственные транскриптомные платформы не были оптимизированы для парафиновых срезов рыбок данио и требуют криосекции при работе с рыбками данио в качестве модельного организма для сохранения структуры тканей и сохранения транскриптов РНК. Кроме того, небольшой размер рыбок данио затрудняет получение качественных криорезов и эффективный анализ нескольких образцов. Эта задача усложняется при работе с личинками данио-рерио, которые меньше и хрупкее своих взрослых собратьев. Чтобы преодолеть эти проблемы, мы опишем метод, который надежно выравнивает несколько образцов и эффективно использует область визуализации платформ пространственной визуализации для получения множества высококачественных срезов на одном слайде, которые затем могут быть отображены и проанализированы платформами пространственной визуализации (рис. 1). В данном случае этот метод применяется к платформе пространственной транскриптомной визуализации.
протокол
Этот протокол соответствует рекомендациям комитета по уходу за животными и их использованию в учреждении Дартмутского колледжа.
1. Подготовка криостата
- Охладите криостат до -22 °C и очистите внутренние поверхности криостата, смахнув мусор в емкость. Поместите все необходимые щетки и инструменты внутрь камеры.
2. Подготовка одноразовой основы формы
- Подготовьте базовую форму (одноразовую пластиковую форму 37 мм, 24 мм, 5 мм) для выравнивания образца, проведя прямую линию через внутреннюю часть базовой формы перманентным маркером, чтобы использовать ее в качестве точки отсчета для выравнивания образца. Для достижения наилучших результатов поместите кусок лабораторной ленты на внутреннюю часть базовой формы в том месте, где должна проходить прямая линия (Рисунок 2A).
- Нарисуйте точку на внутренней стороне формы основания возле левой или правой стенки, чтобы обеспечить правильную ориентацию образца во время криосекции (рис. 2B).
- Измерьте желаемый угол реза с помощью транспортира и отметьте его на внутренней стороне базовой формы для каждого образца (Рисунок 2C).
- Нанесите неглубокий слой замораживающей среды (оптическая когерентная томография [ОКТ]) на подготовленную форму-основу. Убедитесь, что замораживающей среды достаточно для покрытия образцов.
- Избегайте образования пузырьков воздуха при нанесении замораживающей среды, загрунтовав сопло бутылки со средой и добавив необходимое количество среды в один угол базовой формы перед смещением горизонтальной плоскости базовой формы таким образом, чтобы среда равномерно распределилась по всей поверхности.
- Медленно сжимайте бутылку при дозировании замораживающей среды.
- Добавьте лед в стакан объемом 1 л, поместите форму для основы с замораживающей средой в ледяную баню и выдерживайте не менее 10 минут, чтобы охладить среду.
3. Приготовление сухого льда: ванна со 100% этанолом
- Приготовьте ванну с сухим льдом и 100% этанолом в вытяжном шкафу, добавив одну часть 100% этанола к одной части сухого льда в ведре со льдом.
- Используйте одноразовую алюминиевую тарелку или сложите алюминиевую фольгу в лодку, достаточно большую, чтобы в нее поместилась одноразовая форма для основания. Убедитесь, что блюдо или лодочка достаточно большая, чтобы форма для основания легла полностью ровно.
- Поставьте блюдо или лодку в ванну и накройте ведро крышкой. Дайте ведру остыть 5-10 минут перед замораживанием образцов.
4. Усыпление образцов
- Случайным образом выберите рыбок данио для разделов. Если выборки различаются по размеру, разделите их на группы по относительному размеру, чтобы облегчить точное выравнивание (подробнее см. обсуждение). Поместите более крупную рыбу и более мелкую рыбу в отдельную посуду.
- Наполните стакан водой для рыбной системы и поместите стакан в ведро со льдом. Окружите стакан льдом.
- Следите за температурой воды с помощью термометра. Дайте температуре стабилизироваться в пределах 2-4 °C.
- Используйте сачок или ситечко, чтобы опустить одну группу рыб в воду с температурой 4 °C. Рыба должна быть полностью погружена в воду и не соприкасаться со льдом. Как только оперкулярное движение прекратится, добавьте лед в воду, чтобы она оставалась ниже 4 °C. Оставьте рыбу в воде при температуре 4 °C на 10 минут.
ПРИМЕЧАНИЕ: Продолжайте встраивание, выравнивание и мгновенное замораживание каждой группы усыпленных образцов перед усыплением следующей группы. Каждый раз заменяйте воду.
5. Встраивание и выравнивание
- Соберите усыпленную рыбу после того, как она была погружена в воду с температурой 4 °C на 10 минут. Вытащите рыбу из воды с помощью щипцов с тонким наконечником, схватив ее за хвостовой плавник, и высушите, аккуратно прижав к впитывающей безворсовой салфетке.
ПРИМЕЧАНИЕ: Для высококачественных секций крайне важно ограничить время между извлечением рыбы из воды с температурой 4 °C и мгновенной заморозкой - Работая с подготовленной базовой формой на ледяной бане под стереомикроскопом (10-кратное увеличение), поместите каждый образец в базовую форму по опорным точкам в правильной ориентации и аккуратно накройте образцы еще одним тонким слоем замораживающей среды.
ПРИМЕЧАНИЕ: Не заполняйте всю форму замораживающей средой. Вместо этого используйте только тонкий слой, достаточный для покрытия всех образцов. - Используйте анатомическую точку отсчета, чтобы точно выровнять рыбу по линиям, отмеченным на внутренней стороне формы основания. Используйте щипцы с тонкими наконечниками, чтобы отрегулировать ориентацию каждой рыбы так, чтобы они были выровнены и находились в одной ориентации. Избегайте образования пузырьков в замораживающей среде, двигаясь медленно.
- Положите кусок сухого льда на дно базовой формы под образцы до тех пор, пока они локально не замерзнут на месте. Держите горизонтальную плоскость основания формы на одном уровне, чтобы избежать смещения образцов от их опорных точек перед замораживанием с помощью сухого льда.
- Поместите форму с образцами на алюминиевую лодку или блюдо в ванну с сухим льдом: 100% этанол. Убедитесь, что лодка плавает на поверхности ванны, а форма основания остается сухой. Накройте ванну крышкой и дайте образцам поплавать в течение 10 минут.
- Заверните замороженную форму в фольгу и храните в морозильной камере при температуре -80 °C до готовности к разделке. Повторите шаги 4.2-5.6 для всех остальных групп.
6. Криосекция
- Принесите замороженные формы для основания в предварительно охлажденный криостат для криосекции и поместите их в камеру криостата. Транспортируйте замороженные блоки в коробке с сухим льдом, чтобы предотвратить оттаивание.
- Извлеките предметное стекло из хранилища и поместите его в предварительно охлажденный держатель предметного стекла. Храните держатель предметного стекла с пространственным изображением в криостатной камере при температуре -22 °C до тех пор, пока не будет готов к сбору срезов из интересующей области.
- Извлеките замороженные образцы из базовой формы, а затем заморозьте их в патроне со свежей замораживающей средой. Заморозьте их на патроне так, чтобы режущая поверхность была обращена к лезвию.
- Поместите свежее мелкое лезвие микротома в криостат.
- Совместите форму с лезвием и обрежьте интересующую область (рекомендуемая толщина обрезки 20-50 мкм). Убедитесь, что маркировка, сделанная внутри формы, перенесена на замороженный блок образца, чтобы помочь определить местоположение внутри образцов.
- Отрегулируйте форму на этапе обрезки таким образом, чтобы поверхность резки была параллельна эталонным маркировкам в замораживающей среде.
- Соберите срезы на стандартное положительно заряженное предметное стекло микроскопа и проверьте их по светлому полю, чтобы убедиться, когда обрезка больше не требуется.
- Извлеките предметное стекло из камеры криостата и поместите его в ледяную ванну при температуре 4 °C. Держите предметное стекло в держателе для слайдов. Следите за тем, чтобы горка не намокла.
- Начать криосекцию (рекомендуется 10-14 мкм; Рисунок 3) и собирайте срезы на положительно заряженных предметных стеклах до тех пор, пока не будет достигнута область интереса в образцах. Проверьте срезы по светлому полю, чтобы убедиться, что интересующая область будет следующей секцией из формы.
- Верните предметное стекло для пространственной визуализации отдельных клеток в камеру криостата. Извлеките слайд из держателя слайда и соберите разделы из точной области интереса на слайд пространственного изображения ряд за рядом, используя кисть с тонким наконечником, чтобы предотвратить скручивание секций.
- Вдавите уголок пустой, замерзающей среды в столик для ножа тыльной стороной кисти, чтобы секция оставалась плоской при захвате предметного стекла для сбора.
- Используйте верхнюю часть предметного стекла в качестве точки опоры, медленно опустите предметное стекло на секцию и дайте секциям прилипнуть к ползуну в течение 3 секунд, прежде чем снять затвор с ножевого столика.
- При сборе срезов в области изображения предметного стекла работайте слева направо и по возможности перекрывайте слои пустой, замерзающей среды.
- Используйте цветные бумажные рамки в качестве образца для размещения участков в области визуализации предметного стекла, если ткань плохо видна.
- После сбора срезов из интересующей области поместите предметное стекло обратно в держатель предметного стекла. Если на предметном стекле больше нет образцов для сбора образцов, храните предметное стекло при температуре -80 °C в течение 2 недель, пока оно не будет готово для инструментального анализа с помощью платформы пространственной визуализации in situ . Если необходимо собрать срезы из нескольких форм, поместите предметное стекло для пространственного изображения обратно в ледяную ванну при температуре 4 °C и повторите шаги 6.3-6.11 со следующей формой.
- Перед проведением анализа соберите срезы до и после срезов интересующей области из каждой формы на стандартном положительно заряженном предметном стекле микроскопа для окрашивания гематоксилином и эозином (HE), чтобы убедиться в достаточности выравнивания образца и качества среза.
7. Фиксация образца
- Извлеките опорные стекла из криостата и высушите на воздухе при температуре RT в течение 30 минут, чтобы срезы прилипли к предметному стеклу.
- Зафиксируйте срезы, поместив их в контейнер с 4% параформальдегидом (Таблица 1) на 20 минут.
- Промойте срезы, поместив их в контейнер с дистиллированной водой на 3 минуты.
- Продолжайте окрашивание HE или высушите и храните предметные стекла при температуре -80 °C для будущего окрашивания.
8. Окрашивание срезов HE
- Обезвоживайте и очищайте секции, инкубируя предметные стекла в 100% этаноле в течение 2 минут, 95% (Таблица 2) этаноле в течение 2 минут, а затем в водопроводной воде в течение 1 минуты. Используйте штатив для окрашивания предметного стекла под микроскопом для переноса предметных стекол из ванны в ванну.
- Окрашивают ядра и дифференцируют путем инкубации предметных стекол в гематоксилине в течение 2 мин 45 с, водопроводной воде в течение 1 мин, 0,3% подкисленном спирте (табл. 3) в течение 1 мин, а затем в проточной воде в течение 1 мин. Используйте штатив для окрашивания предметного стекла под микроскопом для переноса предметных стекол из ванны в ванну.
- Окрашивание цитоплазматических компонентов и обезвоживание путем инкубации предметных стекол в эозине Y 1% в течение 45 с, 50% этаноле (Таблица 4) в течение 1 мин, 95% этаноле в течение 1 мин и 100% этаноле в течение 1 мин. Используйте штатив для окрашивания предметного стекла под микроскопом для переноса предметных стекол из ванны в ванну.
- Очистите срезы, инкубируя предметные стекла в ксилоле в течение 1 минуты. Установите и накройте предметные стекла, нанеся каплю монтажного средства на верхнюю треть предметного стекла с помощью передаточной пипетки и медленно опустив покровное стекло поверх монтажного средства с помощью щипцов.
9. Пространственная транскриптомная визуализация и анализ разрезов
- Извлеките слайды из хранилища при температуре -80 °C и получите изображение с помощью платформы пространственной визуализации in situ для пространственного транскриптомного анализа.
ПРИМЕЧАНИЕ: Точные шаги, связанные с получением изображений, будут определяться платформой пространственной съемки. - Просмотрите метрики контроля качества пространственной транскриптомной платформы. Важными показателями для проверки являются количество обнаруженных клеток, медиана транскриптов на клетку, ядерные транскрипты на 100мкм2 и общее количество высококачественных декодированных транскриптов каждого гена в наборе зондов.
ПРИМЕЧАНИЕ: Эти показатели контроля качества не имеют универсальных пороговых значений, и ожидания в отношении этих пороговых значений будут варьироваться в зависимости от используемого образца и генетической панели. - Считывайте выходные данные об обнаруживаемых транскриптах РНК, определяйте, какие транскрипты имеют низкое качество, на основе показателей контроля качества эксперимента и отфильтровывайте транскрипты низкого качества. Проанализируйте остальные высококачественные расшифровки с точки зрения их пространственного расположения в разделе.
- Просмотрите клеточную сегментацию секций и кластерных ячеек на основе экспериментальных интересов. Сравните транскрипты РНК в клеточных кластерах интересующей области в группах рыбок данио рерио разного возраста на одном и том же слайде.
Результаты
В этом методе (рис. 1) рыбка данио используется в качестве животной модели для зондирования пространственно разрешенных паттернов экспрессии генов. Эффективное криосекционирование личинок данио-рерио для пространственной визуализации является сложной задачей. Срезы должны быть высокого качества, чтобы сохранить структуру ткани и обнаруживаемые гены (Рисунок 4). Срезы, содержащие несколько образцов для пространственной визуализации, должны быть точно выровнены для анализа областей интереса во всех образцах (рис. 2 и рис. 5). Наконец, срезы должны быть собраны и эффективно распределены, чтобы максимизировать количество потенциальных точек данных в области визуализации предметного стекла пространственной транскриптомики (рис. 3 и рис. 6). Эксперименты измерялись с использованием этих трех параметров, чтобы определить, были ли они успешными или неоптимальными.
Многие изменения протокола способствовали тому, что мы смогли собрать высококачественные срезы, которые являются хорошими кандидатами для пространственной транскриптомной визуализации. Корректировка протоколов эвтаназии, фиксации и встраивания привела к улучшению качества срезов (рис. 4). В первом протоколе (рис. 4, протокол 1) качество среза было неоптимальным, и ткани не сохранили свою структуру. Чтобы исправить это, во втором протоколе (рис. 4, протокол 2) был введен этап мгновенной заморозки после встраивания образцов и фиксации тканей после сбора срезов на предметные стекла. Это улучшило общую тканевую структуру участков, но не смогло достичь приемлемого качества для пространственной транскриптомики. Наконец, в третьем протоколе (рис. 4, протокол 3) методы эвтаназии были усовершенствованы путем сокращения времени, необходимого для эвтаназии рыбы, и погружения рыбы в лед перед мгновенной заморозкой и последующим разделением и фиксацией после сбора. В результате были получены образцы высочайшего качества, которые были хорошими кандидатами для пространственной транскриптомной визуализации.
Выравнивание нескольких образцов по интересующей области также потребовало внесения некоторых изменений в протокол. Одним из изменений, которые больше всего улучшили выравнивание между образцами, было введение опорных точек в базовые формы, в которые встроены рыбки данио (рис. 2). В экспериментах, проведенных в этом исследовании, образцы были выровнены путем сравнения структур на нескольких срезах в одном и том же разрезе (Рисунок 5).
Последним важным шагом в разработке метода эффективной пространственной транскриптомики было размещение как можно большего количества этих высококачественных, выровненных образцов разного возраста на одном предметном стекле для визуализации. Накопление опыта и совершенствование технических навыков способствуют увеличению количества собираемых образцов. Эти улучшения также были в значительной степени связаны с небольшими корректировками этапов встраивания и сбора данных в протокол. На этих панелях на рисунке 6 показано количество разделов, собранных в области изображения каждого слайда с течением времени. Рисунок 6А (40 секций по 15 рыб dpf) - это ранний спуск, в котором используется одна форма во время раздела. На рисунке 6B (90 секций рыбы по 15 dpf и 47 секций по 26 рыб dpf) представлена вторая форма и показано улучшение пространственного расположения за счет уменьшения пространства между образцами во время закладки. На рисунке 6C (54 секции рыбы по 15 dpf, 80 секций по 19 dpf, 24 секции по 23 dpf и 21 секция по 26 dpf) представлена третья и четвертая формы и показано постоянное улучшение пространственного расположения за счет обрезки режущей поверхности блока вокруг образцов и наложения внахлест пустой замерзающей среды. Эти усовершенствования позволили нам разместить 179 срезов в области визуализации нашего пространственного транскриптомного предметного стекла и тестовых рыб 4 разных возрастов.
По завершении работы над протоколом у нас были образцы, которые можно было легко анализировать как с помощью готового программного обеспечения для мультиплексирования in situ, так и с помощью специальных методов. Используемое здесь программное обеспечение для мультиплекса использовало псевдо-phred-оценку, в общих чертах основанную на показателях качества phred в данных секвенирования9. Оценки варьировались от 59% до 70%, где 60% были пороговым значением для предупреждения о более низком качестве чтения. При рассмотрении выяснилось, что низкий показатель псевдо-фреда был обусловлен низкой сложностью сигнала в пустом пространстве между секциями. Несмотря на то, что область слайда использовалась эффективно, она все еще оставалась пустой на >50%. При учете доли площади предметного стекла, занятой тканью, где сигнал был достаточно сложным, качество сигнала было превосходным.
Низкоинтенсивные, неспецифические сигналы также были замечены в двух общих областях на предметном стекле: снаружи образцов и внутри пустой хорды (рис. 7A). За пределами срезов наблюдалась закономерность, соответствующая артефакту размыва, который уменьшался по мере удаления от образцов (Рисунок 7B). Неспецифический сигнал также был замечен в пустых областях образцов, занятых хордой. Это считалось вероятным артефактом промывки, где реагенты усиления могли попасть в ловушку. Транскрипты в обеих областях были в основном цитоплазматическими (т.е. рибосомальные белки L3 и L4) или митохондриальными (аспартаттрансфераза и изоцитратдегидрогеназа). Когда эти области были включены в сегментацию Байсора, которая идентифицирует клетки на основе локализации и кластеризации транскриптов вокруг ядер10, анализ сегментации включал границы клеток, которые иногда включали их. Этот сигнал был достаточно слабым, чтобы его можно было легко отличить от образца.
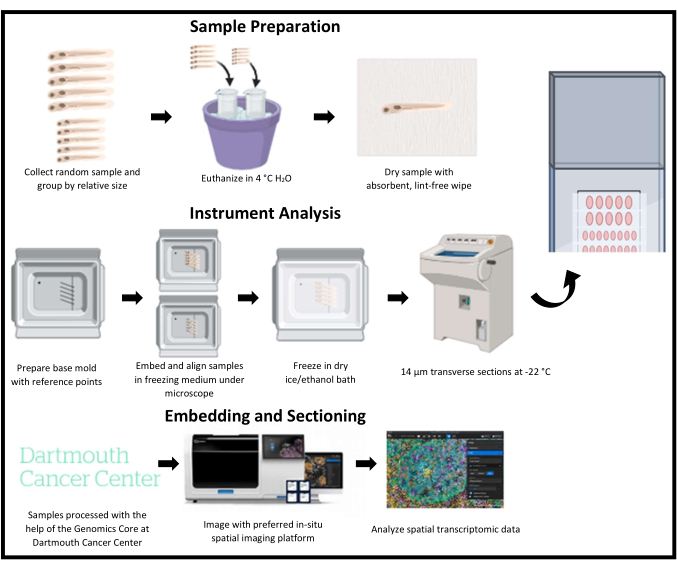
Рисунок 1: Схематический контур криоссекции для пространственной транскриптомики у рыбок данио. Молодь данио-рерио собирается случайным образом, а затем группируется по относительному размеру. Затем образцы погружают в замораживающую среду и выравнивают по опорным точкам на базовой форме, соответствующим интересующей области. Каждая форма подвергается мгновенной заморозке, криосекции и собирается по одному ряду на одном и том же предметном стекле. После среза предметные стекла хранятся при температуре -80 °C, а затем визуализируются и анализируются с помощью платформы пространственной транскриптомной визуализации. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Установление опорных точек для точного разрезания. Серия изображений демонстрирует процесс добавления опорных точек к одноразовой базовой форме для совмещения нескольких образцов для криосекции. Первым шагом (А) является использование лабораторной ленты для обозначения линии на внутренней стороне формы, которую все образцы будут использовать в качестве эталона для выравнивания. (B) Поместите точку на внутренней стороне формы рядом с левой или правой стенкой, чтобы сообщить о правильной ориентации образца во время криосекции, а затем (C) отметьте линии для каждого образца под желаемым углом. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
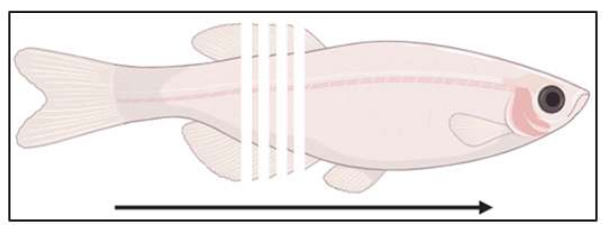
Рисунок 3: Схема расположения секционирования. Рыбы разделены коронально, от хвостового до рострального, с интервалом 14 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
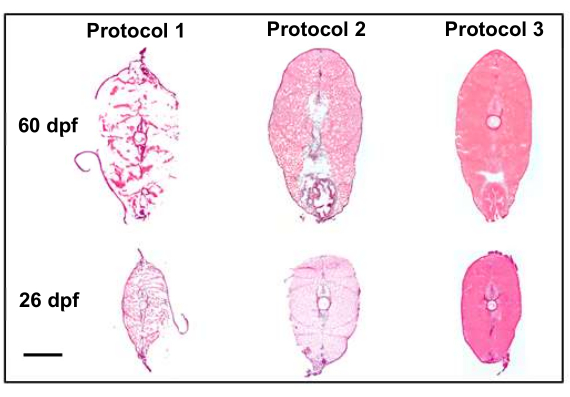
Рисунок 4: Улучшение качества раздела с модификацией протокола (в 10 раз). На рисунке сравниваются первые два протокола, которые привели к неоптимальному качеству тканей, с окончательным протоколом, который привел к высококачественным срезам (сохранившим морфологию), которые являются хорошими кандидатами для пространственной транскриптомики. Протокол 1 использует сравнительный анализ биоатласа штата Пенсильвания8, выделенный 4% фиксацией параформальдегида перед срезом. Протокол 2 вводит мгновенную заморозку сухого льда/этанола после эвтаназии и фиксацию после разреза, что значительно лучше сохраняет структуру тканей с оговоркой о артефактах замораживания по всему сечению. Протокол 3 усовершенствовал методы эвтаназии и встраивания в лед перед мгновенной заморозкой и последующим срезом и фиксацией после сбора, что привело к получению образцов высочайшего качества. Масштабная линейка составляет 500 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 5: Проверка выравнивания нескольких секций (20x). Репрезентативные изображения HE 26 секций dpf, которые подчеркивают выравнивание между несколькими образцами в одном разрезе. Масштабная линейка составляет 500 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 6: Улучшенное пространственное расположение образцов. На этих панелях отображается количество разделов, собранных в области изображения каждого слайда с течением времени. Накопление опыта и совершенствование технических навыков способствуют увеличению количества собираемых образцов. Эти улучшения также были в значительной степени связаны с небольшими корректировками этапов встраивания и сбора данных в протокол. Панель А (40 секций по 15 dpf рыбы) - это ранний спуск, в котором используется одна форма во время разделки. На панели B (90 секций рыбы по 15 dpf и 47 секций по 26 рыб dpf) представлена вторая форма и демонстрируется улучшение пространственного расположения за счет уменьшения пространства между образцами во время встраивания. На панели C (54 секции рыбы по 15 dpf, 80 секций по 19 dpf, 24 секции по 23 dpf и 21 секция по 26 dpf) представлена третья и четвертая формы и демонстрируется постоянное улучшение пространственного расположения за счет обрезки режущей поверхности блока вокруг образцов и наложения внахлест пустой замерзающей среды. Кронштейны на каждой панели представляют различные формы, используемые во время секционирования. Профили находятся на площади 10,5 мм 22 мм. Масштабная линейка составляет 4 мм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой фигуры.

Рисунок 7: Репрезентативные результаты нашего пространственного транскриптомного эксперимента. (A) Одно изображение слайда, обработанное с помощью протокола, как показано на рисунке 6C. (B) 14 мкм срезы данио-рерио с углом 15 dpf после пространственной транскриптомной визуализации, демонстрирующие неспецифический сигнал рядом со срезами и в пределах хорды. Масштабная линейка составляет 4 мм на панели А. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой фигуры.
| 4% параформальдегида | Концентрация запасов | Количество | Окончательная концентрация |
| Параформальдегид (порошок) | 95 % по масу | 40 г | 4 % по объему |
| НаОХ | 1 Н | По каплям (до растворения порошка) | |
| Список совместимого оборудования | 1 Н | По каплям (до 6,9 pH) | |
| Стоковый PBS 1x Стоковый | 1x | ~1000 мл (общий объем достигает 1000 мл) | 1x |
| Итог | 1000 мл |
Таблица 1: 4% формула параформальдегида. Состав 4% раствора параформальдегида для фиксации образцов.
| 95% этанол | Концентрация запасов | Количество | Окончательная концентрация |
| Этанол 200 пробы | 100% об/в | 190 мл | 95% v/v |
| Вода обратного осмоса | 100% об/в | 10 мл | 5% v/v |
| Итог | 200 мл |
Таблица 2: формула 95% этанола. Состав 95% раствора этанола для обезвоживания участков при окрашивании H&E.
| 0,3% Подкисленный спирт | Концентрация запасов | Количество | Окончательная концентрация |
| Ледяная уксусная кислота | 100% об/в | 300 μл | 0,3% v/v |
| Вода обратного осмоса | 100% об/в | 99,7 мл | 99,7% v/v |
| Итог | 100 мл |
Таблица 3: 0,3% формула подкисленного спирта. Состав 0,3% подкисленного спирта для дифференциации при окрашивании HE.
| 50% этанол | Концентрация запасов | Количество | Окончательная концентрация |
| Этанол 200 пробы | 100% об/в | 100 мл | 50% v/v |
| Вода обратного осмоса | 100% об/в | 100 мл | 50% v/v |
| Итог | 200 мл |
Таблица 4: 50% формула этанола. Состав 50% этанола для обезвоживания участков при окрашивании HE.
Обсуждение
В этом отчете представлены подробные решения многих технических проблем, связанных с рыбками данио рерио в качестве модельного организма в пространственном транскриптомном анализе во время разработки. Для решения этих проблем наша компактная компоновка образцов оптимизирует затраты на новые пространственные транскриптомные платформы1. Криосекция личинок данио рерио для пространственной визуализации является сложной задачей. Срезы должны сохранять достаточную тканевую структуру и качество транскрипта для удовлетворительного проведения эксперимента и последующего пространственного анализа8. Срезы, содержащие несколько образцов для пространственной визуализации, должны быть точно выровнены для анализа общих областей интереса во всех образцах. Наконец, срезы должны быть собраны и эффективно распределены, чтобы максимизировать количество потенциальных точек данных в пределах обозначенной области предметного стекла.
Протокол позволяет собирать высококачественные срезы, которые являются отличными кандидатами для платформ пространственной визуализации отдельных клеток. Первая модификация заключалась в том, чтобы заморозить рыбок данио-рерио, а затем зафиксировать срезы в 4% параформальдегиде после сбора их на предметном стекле. Первоначально рыбок данио фиксировали с помощью 4% параформальдегида при 4 °C в течение ночи, а затем заделывали и разрезали11. Выбор способа фиксации образцов после их разреза помог сохранить внутренние ткани, которые не были эффективно сохранены при фиксации целого образца (Рисунок 4).
Второй важной модификацией было усовершенствование метода эвтаназии для сохранения целостности тканей. Рыбок данио первоначально помещали в воду с температурой 4 °C на 20 минут, чтобы убедиться, что они достаточно усыплены. Это на 10 минут превышает минимальные требования рекомендаций IACUC. Это дополнительное время в воде при температуре 4 °C дало образцам больше времени для разложения и способствовало неидеальному качеству среза очень тонких или нежных внутренних структур. Сокращение времени пребывания в воде при температуре 4 °C до минимального требования в 10 минут помогло сохранить хрупкие внутренние структуры, которые отсутствовали при предыдущих попытках секционирования. Другие модификации, не показанные на рисунке 4 , включают секционирование в тот же день, что и эвтаназию, сокращение времени между эвтаназией и мгновенным замораживанием с 15 минут до менее чем 5 минут, а также работу с предварительно охлажденной замораживающей средой при встраивании. Чем дольше образцы хранились при температуре -80 °C перед срезом, тем хуже оказывалось качество ткани среза. Различия были незначительными, но он идеально подходит для секционирования в тот же день, что и эвтаназия и создание блока. Сокращение времени, необходимого для выравнивания образцов после усыпления и до мгновенной заморозки, до не более чем 5 минут имеет решающее значение для качества среза.
Выравнивание нескольких образцов по интересующей области также потребовало внесения некоторых изменений в протокол. Достигнутая точность выравнивания (рис. 5) позволила сгруппировать выборки по относительному размеру и внесла наибольший вклад в эффективную пространственную организацию. Основная стратегия выравнивания образцов заключается в наложении рыбок данио на контрольные точки, которые нарисованы на базовых формах, в которые они встроены. Образцы выровнены по этим контрольным точкам с помощью анатомических структур внутри образцов рыбок данио, которые могут варьироваться в зависимости от желаемой области интереса. Развивающиеся рыбы одного возраста могут различаться по размеру до 50%12. Образцы с совершенно разными размерами могут смещаться из-за разного расстояния между анатомической точкой отсчета и областью интереса. Группировка образцов одного возраста по относительному размеру и встраивание каждого размера в их формы улучшили возможность выравнивания нескольких образцов в их форме. Этот метод позволяет надежно выровнять примерно 2/3 образцов в зависимости от окна, допускаемого областью интереса, и выбора анатомической точки отсчета.
Уменьшение пространства между образцами при встраивании и выравнивании приводит к увеличению количества образцов на слайде. Однако эта жесткая конфигурация еще больше ограничена реперными точками в области визуализации. В дополнение к опыту работы с криостатом, описывается несколько стратегий их согласования. Во-первых, точное размещение перекрывающейся среды для встраивания между секциями и обрезка замороженной формы могут оказать существенное влияние на количество секций, которые могут поместиться в определенной области визуализации. На рисунке 6 показано количество разделов, полученных до и после оптимизации компоновки закладки. Во-вторых, граница была размещена снаружи внешних образцов во время встраивания и перед замораживанием, чтобы помочь правильно разместить их на предметном стекле. В-третьих, размер и прозрачная природа личинок данио-рерио могут затруднить понимание того, где находятся образцы на предметном стекле, чтобы их можно было точно собрать на предметном стекле. Мы обнаружили, что использование цветной бумаги для контраста с белой замораживающей средой для создания границы на внешней стороне внешних образцов привело к гораздо более точному размещению срезов на предметных стеклах.
Нюансы местной температуры помогают сохранить образец в процессе резки. После того, как образцы из нескольких форм собраны на одном предметном стекле, предметное стекло хранится при температуре 4 °C, следующая форма обрезается до нужной области интереса перед повторным сбором. Предметное стекло должно быть немного теплее секций, чтобы оно правильно прилегало к поверхности предметного стекла. Таким образом, хранение предметного стекла при температуре -80 °C или в криостате при температуре -20 °C между сбором образцов из разных форм не является идеальным. Также важно, чтобы собранные образцы на предметном стекле не подвергались многократным циклам замораживания/размораживания, так как это может негативно повлиять на качество транскриптов РНК в каждом образце. Хранение предметного стекла с ранее собранными срезами при температуре 4 °C адекватно сохраняет транскрипты РНК при сохранении более низкой температуры для надлежащего прилегания без негативных побочных эффектов, связанных с циклами замораживания/размораживания13.
Несмотря на то, что были получены удовлетворительные результаты, дизайн этого метода сопряжен с возможными ограничениями. Первое ограничение заключается в том, что мы ограничены областью изображения пространственного транскриптомного предметного стекла, что накладывает потолок на общее количество разделов, которые могут быть изображены на одном и том же слайде. Учитывая, что у нас все еще есть пустое пространство между секциями, вполне вероятно, что мы еще не достигли границ того, что возможно для этого метода, но мы признаем, что есть точка, где уже невозможно уместить больше секций на предметном стекле. Работа с более крупными рыбами в более старшем возрасте также ограничивает общий размер выборки, но не должна влиять на общее количество ткани, которое может поместиться в область визуализации предметного стекла. Технические усовершенствования платформ пространственной визуализации могут увеличить общее количество тканей, которые могут быть изображены, за счет увеличения области визуализации на предметных стеклах. Еще одним ограничением этого метода является то, что протокол не был оптимизирован для рыб моложе 15 dpf. Было обнаружено, что рыба становится тем более хрупкой, чем она моложе, и что рыба моложе 15 dpf чрезвычайно сложна в обращении и легко повреждается в процессе встраивания. Это привело к увеличению времени между эвтаназии и мгновенной заморозкой, что отрицательно сказалось на качестве тканей. Это также снизило процент жизнеспособных образцов, оставленных для криосекции, а те немногие жизнеспособные рыбы, которые остались для секции, не были достаточно жесткими, чтобы сохранить структуру ткани для качественного анализа. Поиск инструментов, которые лучше подходят для работы с более хрупкой рыбой и работы с менее плотной замораживающей средой, которая также увеличивает жесткость образцов во время раздела, может позволить применять этот метод к рыбам моложе 15 дпф. Последним существенным ограничением этого метода является выравнивание выборки для очень маленьких областей интереса. Мы обнаружили, что чем меньше интересующая нас область в выборке, тем меньше вероятность того, что мы сможем выровнять их правильно. Мы работали с областью интереса размером примерно 50 мкм, и это привело к правильному выравниванию около 2/3 сечений. Образцы с областью интереса меньше 50 мкм могут привести к выравниванию менее 2/3 участков. Большинство смещенных образцов происходит на этапе встраивания в протокол. Трудно встроить один образец в замораживающую среду без перемещения других образцов, которые уже были выровнены. Кроме того, существует ограниченное количество времени, которое есть у исследователя для выравнивания этих образцов, прежде чем это негативно повлияет на качество тканей. Наконец, формы перемещаются из стереомикроскопа в ванну для мгновенной заморозки, и образцы могут перемещаться в форме до того, как они будут полностью заморожены. Вполне возможно, что работа с более холодной замораживающей средой может позволить исследователю легче перемещать один образец, не затрагивая другие образцы, которые уже выровнены. Мгновенная заморозка формы без необходимости перемещать ее после выравнивания может исключить смещение образцов до того, как они полностью замерзнут на месте. Мы идентифицировали неспецифические сигналы за пределами образцов.
Конечный продукт и первоначальный пост-анализ позволили извлечь дополнительные уроки. Присутствовали неспецифические сигналы, которые требовали рассмотрения. Согласно заявлению производителя, некоторые транскрипты с низким уровнем сигнала являются известным артефактом, и окружающая РНК может быть обнаружена в одноклеточной РНК-секвенации, которой можно управлять после анализа14. Использованный здесь протокол мог способствовать созданию стенограмм окружающей среды, поскольку фиксация происходила после размещения образцов. Тем не менее, было обнаружено, что ранняя фиксация привела к плохой и непоследовательной морфологии для этих молодых возрастов. В качестве альтернативы, реагенты для амплификации, которые объединяются, могут создать такой эффект. Качественно наиболее выраженным был неспецифический сигнал, наблюдаемый в хорде. Во время обработки хорда была единственной по-настоящему пустой областью, поскольку она не содержала восходящих сред и транскриптов, которые напоминали цитоплазматические и митохондриальные профили соседних тканей выстилки хорды. Это говорит о том, что физическая «подложка» (ткань или монтажная среда) полезна для снижения этого сигнала. В конечном счете, мы считаем, что исключение сигнала при постобработке является удовлетворительной стратегией. Особенности неспецифических сигналов были легко идентифицируемы после экспериментов и могли быть смягчены во время последующего анализа, например, путем ручного исключения неспецифических сигналов областей за пределами образца.
Рыбки данио-рерио в возрасте 15 dpf по крайней мере из 4 различных форм (и возрастов) могут быть успешно криоссекированы и собраны в области пространственной транскриптомной визуализации, а также могут быть обработаны до 179 срезов одновременно. Основываясь на качестве среза, выравнивании образца, размере образца и качестве транскриптов РНК во время визуализации, мы приходим к выводу, что этот метод является эффективным протоколом для проведения эффективных пространственных транскриптомных анализов. Исследователи могут использовать этот метод для снижения затрат, связанных с пространственной визуализацией, увеличения размера выборки во время пространственных транскриптомных анализов и даже проведения крупных экспериментов за один прогон.
Раскрытие информации
Авторы не раскрывают информацию или не имеют конфликта интересов в отношении этого отчета.
Благодарности
Секционирование и визуализация были выполнены с помощью инструментов, предоставленных общими ресурсами Дартмутского онкологического центра, финансируемого грантом поддержки онкологического центра NCI 5P30CA023108, и Центром количественной биологии Дартмутского колледжа (NIGMS COBRE).
Материалы
| Name | Company | Catalog Number | Comments |
| 1 L Beaker | Pyrex | 1003 | |
| 200 proof pure ethanol | Koptec | V1001 | |
| Acetic acid, glacial | VWR | 0714 | acidified alcohol |
| Aluminum foil | |||
| Cover slips | Epredia | 24X50-1.5-001G | |
| Disposable base mold | Fisher HealthCare | 22-363-556 | |
| Distilled water | |||
| DPX mountant | Sigma-Aldrich | 06522 | mountant for histology |
| Dry ice pellets | |||
| Dumont #5SF Forceps | Fine Science Tools | 11252-00 | |
| Eosin-Y Alcoholic | Epredia | 71204 | Eosin Y 1% |
| Gill 1 Hematoxylin | Epredia | 72411 | Hematoxylin |
| Kimwipe | Kimberly-Clark Professional | 34120 | absorbent, lint-free wipe |
| Lab labelling tape | VWR | 89097-934 | |
| Microtome blade MX35 Ultra | Epredia | 3053835 | |
| Microtome Cryostat | Thermo Scientific | Microme HM 525 | |
| O.C.T. Compound | Fisher HealthCare | 23-730-571 | freezing medium |
| Paraformaldehyde | Sigma-Aldrich | 158127 | PFA |
| Permanent Marker | VWR | 52877-886 | |
| Protractor | |||
| SafeClear Xylene Substitute | Fisherbrand | 68551-16-6 | Xylene substitute |
| Single Edge Blades | American Line | 66-0407 | |
| Steriomicroscope | Zeiss | 4350639000 | Stemi 305 w/ double spot LED (4355259020) and Stand K lab (4354259010) |
| Superfrost Plus Micro Slides | VWR | 48311-703 | |
| Transfer pipet | |||
| Xenium V1 slide | 10X/Xenium | 3000941 | spatial transcriptomic imaging slide |
Ссылки
- Rao, A., Barkley, D., França, G. S., Yanai, I. Exploring tissue architecture using spatial transcriptomics. Nature. 596 (7871), 211-220 (2021).
- Longo, S. K., Guo, M. G., Ji, A. L., Khavari, P. A. Integrating single-cell and spatial transcriptomics to elucidate intercellular tissue dynamics. Nat Rev Genet. 22, 627-644 (2021).
- Duhan, L., et al. Single-cell transcriptomics: background, technologies, applications, and challenges. Mol Biol Rep. 51, 600(2024).
- Ståhl, P. L., et al. Visualization and analysis of gene expression in tissue sections by spatial transcriptomics. Science. 353 (6294), 78-82 (2016).
- Colman, R. E., et al. Whole-genome and targeted sequencing of drug-resistant Mycobacterium tuberculosis on the iSeq100 and MiSeq: A performance, ease-of-use, and cost evaluation. PLOS Med. 16 (4), e1002194(2019).
- Marques, I. J., Lupi, E., Mercader, N. Model systems for regeneration: zebrafish. Development. 146 (18), dev167692(2019).
- Mohideen, M. P. K., et al. Histology-based screen for zebrafish mutants with abnormal cell differentiation. Dev Dyn. 228 (3), 414-423 (2003).
- Copper, J. E., et al. Comparative analysis of fixation and embedding techniques for optimized histological preparation of zebrafish. Comp Biochem Physiol C Toxicol Pharmacol. 208, 38-46 (2018).
- Stock, R. J., Labudovich, M., Ducatman, B. Asymptomatic first-trimester liver cell adenoma: diagnosis by fine-needle aspiration cytology with cytochemical and ultrastructural study. Obstet Gynecol. 66 (2), 287-290 (1985).
- Petukhov, V., et al. Cell segmentation in imaging-based spatial transcriptomics. Nat Biotechnol. 40 (3), 345-354 (2022).
- Meyer, T., Tiburcy, M., Zimmermann, W. H. Cardiac macrotissues-on-a-plate models for phenotypic drug screens. Adv Drug Deliv Rev. 140, 93-100 (2019).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Dev Dyn. 203 (3), 253-310 (1995).
- Yu, K., Xing, J., Zhang, J., Zhao, R., Zhang, Y., Zhao, L. Effect of multiple cycles of freeze-thawing on the RNA quality of lung cancer tissues. Cell Tissue Bank. 18 (3), 433-440 (2017).
- Yang, S., et al. Decontamination of ambient RNA in single-cell RNA-seq with DecontX. Genome Biol. 21 (1), 57(2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены