Method Article
Oksijene Bağlı Retinopati Fare Modelinde Retina Damarlarının Dinamik Büyümesinin İzlenmesi
Bu Makalede
Özet
Bu protokol, farelerin retinal düz montajlarının hazırlanması ve immünofloresan boyanması ve analizi için ayrıntılı bir yöntemi açıklamaktadır. Floresein fundus anjiyografinin (FFA) fare yavruları ve görüntü işleme için kullanımı da ayrıntılı olarak açıklanmaktadır.
Özet
Oksijene bağlı retinopati (OIR), prematüre retinopatisi (ROP), proliferatif diyabetik retinopati (PDR) ve retinal ven tıkanıklığı (RVO) dahil olmak üzere iskemik retina hastalıklarında anormal damar büyümesini incelemek için yaygın olarak kullanılmaktadır. Çoğu OIR çalışması retinal neovaskülarizasyonu belirli zaman noktalarında gözlemler; Bununla birlikte, OIR ile ilişkili damar hastalıklarını anlamak için gerekli olan bir zaman seyri boyunca canlı farelerde dinamik damar büyümesi yeterince çalışılmamıştır. Burada, OIR fare modelinin indüksiyonu için adım adım bir protokol açıklıyoruz, potansiyel tuzakları vurguluyoruz ve immünofloresan boyama kullanarak vazo-obliterasyon (VO) ve neovaskülarizasyon (NV) alanlarını hızlı bir şekilde ölçmek için geliştirilmiş bir yöntem sunuyoruz. Daha da önemlisi, OIR fare modelinde floresein fundus anjiyografi (FFA) yaparak P15'ten P25'e canlı farelerde damar büyümesini izledik. FFA'nın OIR fare modeline uygulanması, damar yeniden büyümesi sırasında yeniden şekillendirme sürecini gözlemlememizi sağlar.
Giriş
Yeni patolojik damarların mevcut retinal damarlardan kaynaklandığı bir durum olarak tanımlanan retinal neovaskülarizasyon (RNV), genellikle retinanın iç yüzeyi boyunca uzanır ve vitreusa (veya bazı koşullar altında subretinal boşluğa) doğru büyür1. Prematüre retinopatisi (ROP), retinal ven tıkanıklığı (RVO) ve proliferatif diyabetik retinopati (PDR)2 dahil olmak üzere birçok iskemik retinopatinin ayırt edici özelliği ve ortak özelliğidir.
Çok sayıda klinik ve deneysel gözlem iskeminin retinal neovaskülarizasyonun ana nedeni olduğunu göstermiştir 3,4. ROP'ta, yenidoğanlar hayatta kalma oranlarını arttırmak için kapalı inkübatörlerde yüksek seviyeli oksijene maruz kalırlar ve bu da vasküler büyümenin durması için önemli bir itici güçtür. Tedavi yapıldıktan sonra, yenidoğanların retinaları nispeten hipoksik bir dönemyaşar 5. RVO'da santral veya dal retinal venlerin tıkanmasında başka durumlar da görülmekte ve PDR2'de mikroanjiyopatinin neden olduğu retinal kılcal damarların hasarı da gözlenmektedir. Hipoksi, vasküler endotelyal büyüme faktörü (VEGF) gibi anjiyojenik faktörlerin, hipoksiye bağlı faktör-1α (HIF-1α) sinyal yolu aracılığıyla ekspresyonunu arttırır ve bu da vasküler endotel hücrelerini hipoksik alana büyümeye ve yeni damarlar oluşturmaya yönlendirir 6,7.
ROP, preterm bebeklerde bir tür vasküler proliferatif retinopatidir ve retina hipoksisi, retinal neovaskülarizasyon ve fibröz hiperplazi10,11,12 ile karakterize çocukluk çağı körlüğünün önde gelen bir nedeni 8,9'dur. 1950'lerde araştırmacılar, yüksek oksijen konsantrasyonunun prematüre bebeklerin solunum semptomlarını önemli ölçüde iyileştirebileceğini bulmuşlardır13,14. Sonuç olarak, oksijen tedavisi o zamanlar prematüre bebeklerde giderek daha fazla kullanılmaya başlandı15. Bununla birlikte, preterm bebeklerde oksijen tedavisinin yaygın kullanımı ile eş zamanlı olarak, ROP insidansı yıldan yıla artmıştır. O zamandan beri, araştırmacılar oksijeni ROP'a bağladılar ve ROP ve RNV16'nın patogenezini anlamak için çeşitli hayvan modellerini araştırdılar.
İnsanlarda, retinal vaskülatür gelişiminin çoğu doğumdan önce tamamlanırken, kemirgenlerde retinal vaskülatür doğumdan sonra gelişir ve retinal vaskülatürdeki anjiyogenezi incelemek için erişilebilir bir model sistemi sağlar2. Araştırmanın sürekli ilerlemesiyle birlikte, oksijene bağlı retinopati (OIR) modelleri, iskemiye bağlı patolojik anjiyogenezi taklit etmek için önemli modeller haline gelmiştir. OIR modelinin çalışmasında belirli bir hayvan türü yoktur ve model, yavru kedi17, sıçan18, fare19, beagle köpek yavrusu 20 ve zebra balığı21 dahil olmak üzere çeşitli hayvan türlerinde geliştirilmiştir. Tüm modeller, erken retinal gelişim sırasında hiperoksiye maruz kaldıkları ve daha sonra normoksik ortama geri döndükleri aynı mekanizmayı paylaşırlar. Smith ve ark., fare yavrularını 5 gün boyunca P7'den hiperoksiye maruz bırakmanın, merkezi retinada aşırı bir damar regresyonu formuna neden olduğunu ve onları P12'deki oda havasına geri getirmenin, yavaş yavaş vitreus gövdesine doğru büyüyen neovasküler tutamları tetiklediğini gözlemlemiştir19. Bu, Smith modeli olarak da adlandırılan standartlaştırılmış bir OIR fare modeliydi. Connor ve ark. protokolü daha da optimize etti ve 2009 yılında VO (vazo-obliterasyon) ve NV (neovaskülarizasyon) alanını ölçmek için evrensel olarak uygulanabilir bir yöntem sağladı ve bu da model22'nin kabulünü ve kullanımını artırdı. OIR fare modeli, küçük boyutu, hızlı üremesi, net genetik arka planı, iyi tekrarlanabilirliği ve yüksek başarı oranı nedeniyle şu anda hala en yaygın kullanılan modeldir.
Farelerde, retinal vaskülarizasyon doğumdan sonra damarların optik sinir kafasından iç retinaya ora serrata'ya doğru büyümesiyle başlar. Normal retinal gelişim sırasında, ilk retinal damarlar doğum sırasında optik sinir başından filizlenir ve doğum sonrası 7 (P7) 23 civarında çevreye ulaşan genişleyen bir ağ (primer pleksus) oluşturur. Daha sonra damarlar derin bir tabaka oluşturmak, retinaya nüfuz etmek ve insan24'te olduğu gibi iç nükleer tabakanın (INL) etrafında laminer bir ağ oluşturmak için retinaya doğru büyümeye başlar. Üçüncü doğum sonrası haftanın (P21) sonunda, daha derin pleksus gelişimi neredeyse tamamlanır. OIR fare modeli için, hiperoksiye maruz kalma sırasında merkezi bölgedeki çok sayıda olgunlaşmamış vasküler ağın hızlı dejenerasyonu nedeniyle vasküler tıkanıklık her zaman merkezi retinada görülür. Bu nedenle, patolojik neovaskülarizasyonun büyümesi, perfüzyon dışı alanın ve vasküler alanın sınırı olan orta periferik retinada da meydana gelir. Bununla birlikte, insan retina damarları neredeyse doğumdan önce oluşmuştur. Prematüre bebeklere gelince, periferik retina hiperoksiye maruz kaldığında tamamen vaskülarize değildir25,26. Bu nedenle vasküler oklüzyon ve neovaskülarizasyon esas olarak periferik retinada görülür27,28. Bu farklılıklara rağmen, fare OIR modeli, iskemiye bağlı neovaskülarizasyon sırasında ortaya çıkan patolojik olayları yakından özetlemektedir.
OIR modelinin indüksiyonu iki faza ayrılabilir29: faz 1'de (hiperoksi faz), retinal vasküler gelişim, VEGF'deki düşüş ve endotel hücrelerinin apoptozu 24,30'un bir sonucu olarak kan damarlarının tıkanması ve gerilemesi ile durdurulur veya geciktirilir; faz 2'de (hipoksi faz), retinal oksijen kaynağı, nöral gelişim ve homeostaz19,31 için gerekli olan oda hava koşulları29 altında yetersiz kalacaktır. Bu iskemik durum genellikle düzenlenmemiş, anormal neovaskülarizasyon ile sonuçlanır.
Şu anda, yaygın olarak kullanılan modelleme yöntemi alternatif olarak yüksek / düşük oksijene maruz kalmaktadır: Anneler ve yavruları P7'de 5 gün boyunca% 75 oksijene maruz kalmaktadır, ardından P17, OIR fare modeli indüksiyonunun son noktası olankarşılaştırılabilir sonuçlar 22'yi gösterene kadar oda havasında 5 gün beklemektedir. (Şekil 1). ROP'u simüle etmenin yanı sıra, bu iskemi aracılı patolojik neovaskülarizasyon, diğer iskemik retina hastalıklarını incelemek için de kullanılabilir. Bu modelin ana ölçümleri, immünofloresan boyama veya FITC-dekstran perfüzyonu ile retinal düz montajlardan analiz edilen VO ve NV alanının ölçülmesini içerir. Her fare, ölümcül operasyon nedeniyle sadece bir kez incelenebilir. Günümüzde, vasküler regresyon ve patolojik anjiyogenez sürecinde retinal vaskülatürün dinamik değişikliklerini sürekli olarak gözlemlemek için birkaç yöntem vardır32. Bu yazıda, OIR model indüksiyonunun ayrıntılı bir protokolünü, retinal düz montajların analizini ve fareler üzerinde floresein fundus anjiyografi (FFA) iş akışını sunuyoruz ve bu da OIR fare modelinin iki aşamasında vasküler dinamik değişikliklerin daha kapsamlı bir şekilde anlaşılmasına yardımcı olacaktır.
Protokol
Farelerin kullanımını içeren tüm prosedürler, Zhongshan Oftalmik Merkezi, Sun Yat-sen Üniversitesi, Çin'in hayvan deney etik komitesi (yetkili numara: 2020-082) tarafından ve Zhongshan Oftalmik Merkezi Hayvan Bakımı ve Kullanımı Komitesi'nin onaylanmış kılavuzlarına ve Görme ve Oftalmolojide Araştırma Derneği (ARVO) Oftalmik ve Görme Araştırmalarında Hayvanların Kullanımı Beyanı'na uygun olarak onaylanmıştır.
1. Fare OIR modelinin indüksiyonu
- Gözlerin doğuştan malformasyon oranı daha düşük olan fareler kullanın, örneğin C57BL / 6J fareler ve bunları erkek / dişi = 1: 2 oranında çiftleştirin. Yavruları aynı gün doğdurun ve P7'de OIR modelini indüklemeye başlayın. Modellemeden önce fare yavrularının vücut ağırlığını kesinlikle kaydedin.
NOT: Doğum gününü P0 olarak not edin. Her farenin ağırlığını düzenli olarak kaydedin. Yenidoğan yavruların vücut ağırlığı, OIR'nin indüksiyonu sırasında çok önemlidir, çünkü farklı durumlardaki farelerin oksijene duyarlılığı farklıdır. Karşılaştırılabilir sonuçlar elde etmek için yavruları P7'de 5 g'dan fazla hariç tutun. - Emziren anneler ve yavruları için, sıcaklığı 23 ° C ± 2 ° C'ye ayarlamak, nemi% 40 -% 65 arasında kontrol etmek, her gün 12 saat ışık ve 12 saat karanlığı değiştirmek, yuvalama için kafese biraz pamuk yünü eklemek, yeterli sterilize edilmiş yiyecek ve su sağlamak ve bunları ayrı ayrı havalandırılan kafeslerde (IVC) tutmak gibi uygun bir yaşam ortamı sağlayın.
- Odanın içindeki nem ve sıcaklık seviyesini izleyin. Nemi %40 ila %65 arasında kontrol edin ve sıcaklığı 23 °C ± 2 °C'de tutun.
- Oksijen sensörleriyle oksijen beslemesini kontrol edin, oksijen seviyesini %75'te sabit tutun ve oksijen akış hızını 0,5-0,75 L/dak'da kontrol edin. Aşırı CO2'yi emmek ve CO2 değerlerini% 3'ün altında tutmak için odanın dibine 50 g soda kireci koyun22.
- Emziren annelerin yuva kurma davranışı, yavrularını ısırma ve laktasyonu günde en az bir kez reddetme gibi davranışlarını izleyin. Zayıf anneliği olan emziren anneleri ortadan kaldırın.
- P7 yavrularını (erkek ve dişi) ve emziren annelerini, oksijen seviyesinin P12'ye 5 gün boyunca% 75 olduğu bir oksijen odasına yerleştirin. Model indüksiyonu döneminde odanın gereksiz yere açılmasını önleyin. Emziren annelerin hiperoksi sırasında akciğer hasarı nedeniyle ölmesi durumunda, değiştirme için ekstra taşıyıcı anneler olduğundan emin olun.
NOT: Deneyin karşılaştırılabilirliğini sağlamak için, sayıyı her anne için 6-8 yavru ile sınırlandırın. Bazı emziren annelerin ölümüne neden olan potansiyel oksijen toksisitesi sorununa dikkat edin. Emziren annelerde hiperoksik akciğer hasarı belirtileri, bunlarla sınırlı olmamak üzere, dalgalanan solunum hızı, azalmış aktivite ve azalmış beslenmeyi içerir. Yukarıdaki fenomen ortaya çıktığında, emziren anneyi mümkün olan en kısa sürede% 1 pentobarbital sodyum (50 mg / kg) ile ötenazi yapın. Bazı taşıyıcı anneleri hazırlayın, örneğin, 129S1 / SvImJ değiştirme için ve bunları yalnızca gerekirse kullanın. Emziren annelerin rutin olarak değiştirilmesi önerilmez, çünkü bu bir oksijen odasının sık sık açılmasına yol açacak ve kararsız oksijen seviyelerine ve maternal saldırganlığa neden olacaktır. - Yavruları ve emziren annelerini P12'deki oda havasına geri getirin ve tüm yavruların ağırlığını P17'ye kadar sürekli izleyin. Her deney grubunun benzer bir ağırlık dağılımına sahip olduğundan emin olmak için yavruları ağırlığa göre gruplandırın.
2. Retinal bütün montajların hazırlanması ve immünofloresan boyama
- Yavruların vücut ağırlığını kaydedin. Yavruları aşırı dozda anestezik (% 1 pentobarbital sodyum 50 mg / kg) veya CO2 inhalasyonu ile feda edin. Gerekirse servikal çıkık ve bilateral torakotomi gibi diğer ötenazi yöntemleri kullanılabilir.
- Göz küreleri ve orbital doku arasındaki bağlantıyı serbest bırakmak için kavisli makas kullanın. Ardından, göz küresinin arka kısmına kavisli forseps koyun, optik siniri sıkıştırın ve gözü yörüngeden hızla kaldırın. Saçları ve kanı göz kürelerinin yüzeyinden çıkarmak için göz kürelerini önceden soğutulmuş 1x fosfat tampon salin (PBS) içinde yıkayın.
- Temizlenmiş göz kürelerini% 4 paraformaldehit (PFA) ile doldurulmuş 2 mL'lik bir mikrosantrifüj tüpüne yerleştirin ve oda sıcaklığında 15 dakika boyunca dakikada 12-15 devir (rpm) hızında bir çalkalayıcı üzerinde inkübe edin (ilk fiksasyon).
DİKKAT: Paraformaldehitin alerjenik, genellikle toksik ve aşırı derecede sitotoksik olduğu bilinmektedir. Güvenlik talimatlarını kesinlikle izleyin ve soluma ve cilt temasından kaçının. - Bir kültür kabı kullanın ve orta kısma 1x PBS'lik bir damla koyun ve aşağıdaki adımları diseksiyon mikroskobu altında gerçekleştirin ve bu damlaya bir göz küresi yerleştirin. Göz küresini bir çift forseps ile tutun ve 1 mL'lik bir şırınga iğnesi kullanarak kornea limbusunda korneayı dikkatlice delin. Makasın ucunu bu deliğe yerleştirin ve kornea limbus boyunca korneayı dikkatlice kesin. Retinayı kesmemeye dikkat edin.
- İris ve lensi bir çift forseps ile çıkarın. Daha sonra kalan vizör adaptörünü% 4 PFA'ya yerleştirin ve oda sıcaklığında 45 dakika daha çalkalayıcı üzerinde 12-15 rpm hızında (ikincil sabitleme) tekrar sabitleyin.
- Bir kültür tabağı kullanın ve orta kısma 1x PBS'lik bir damla koyun. Sabit göz küresini bu damlaya yerleştirin. Göz küresini bir çift forseps ile tutun. İki forseps kullanarak retina ve sklera tabakalarını nazikçe ayırın. Makasın ucunu retina ve sklera tabakaları arasına yerleştirin ve sklerayı optik sinire doğru kesin. Sklerayı retinadan soyun ve retina kabını elde edin.
NOT: Arka kabı forseps ile optik sinir tarafından tutun, ardından optik sinir başındaki skleraya bastırmak için başka bir forsepsin kavisli ucunu kullanın ve retinayı serbest bırakmak için alternatif olarak retinayı ileri doğru süpürme hareketiyle hafifçe masaj yapın. - Radyal hyaloid damarlar ve periferik retina arasındaki bağlantıyı serbest bırakmak için forseps kullanın, optik sinir kafasına yakın olan hyaloid damarların kökünü kelepçeleyin ve hyaloid damarları dikkatlice kesin.
- Retinal kabı aktarmak için ucu kesilmiş 2 mL'lik bir pipet kullanın. Retinal kabı 48 delikli bir plakada bir kuyucuğa yerleştirin ve oda sıcaklığında 1x PBS ile 3 x 5 dakika boyunca 12-15 rpm hızında bir çalkalayıcı üzerinde yıkayın.
- Retinal kabı, 4 ° C'de gece boyunca% 1 Triton X-100 (PBS'de) ve% 5 normal eşek serumundan (PBS'de) oluşan karışık bir çözelti içinde inkübe edin.
- Alternatif olarak, alternatif olarak retinaları oda sıcaklığında 1 saat boyunca bloke edin ve geçirgenleştirin. Bloke edici serumu sekonder antikorun kaynağına göre değiştirin.
- Retinal vaskülatürü İzolektin B4 kullanarak etiketliyorsanız, retinayı% 0.1 normal eşek serumu (400 μL) ve IsolectinB4-594 (1:400) ile 48 delikli bir plaka kuyusunda, 12-15 rpm hızında bir çalkalayıcıda 4 ° C'de gece boyunca inkübe edin.
NOT: Kan damarlarını CD31 gibi diğer belirteçlerle etiketliyorsanız veya diğer hücreleri etiketliyorsanız, bunları etiketlemek için spesifik birincil antikorlar kullanın. - Retinayı 1:100-1:500 spesifik primer antikorlarla (400 μL% 0.1 normal eşek serumunda) 4 ° C'de 48 saat boyunca 12-15 rpm hızında bir çalkalayıcıda inkübe edin. (isteğe bağlı)
- Oda sıcaklığına döndükten sonra, retinayı 12-15 rpm hızında bir çalkalayıcıda 3 x 20 dakika boyunca% 0.1 PBST (PBS'de% 0.1 TritonX-100) ile yıkayın.
- Retinayı 1:1.000 sekonder antikor (400 μL % 0.1 normal eşek serumunda) ile gece boyunca 4 ° C'de 12-15 rpm hızında bir çalkalayıcıda inkübe edin. (isteğe bağlı)
- Alternatif olarak, retinayı oda sıcaklığında 1 saat boyunca yüksek afiniteli ikincil antikorlarla inkübe edin.
- Çekirdeği etiketlemek için retinayı oda sıcaklığında DAPI (1:1.000) ile 20-25 dakika boyunca inkübe edin.
NOT: Ön deneyde adım 10-11 ve 13-14'te kullanılan tüm antikorlar için optimum seyreltme oranlarını test edin. - Retinayı, oda sıcaklığında 12-15 rpm hızında bir çalkalayıcıda% 0,1 PBST ile 3 x 30 dakika boyunca yıkayın.
- Retina kabını, açıklığı yukarı bakacak şekilde temiz bir slayda aktarın. Retinayı optik sinir kafasından yaklaşık 1-1,5 mm uzağa keserek retinayı periferikten merkeze saat 3, 6, 9 ve 12 pozisyonlarında radyal olarak kesin.
- Retinayı üç kez durulamak için birkaç damla 1x PBS ekleyin. Retinayı kurutmak ve düzleştirmek için hava yoluyla döşenen kağıt kullanın. Kapak kaymasının ortasına bir damla montaj ortamı ekleyin (bkz. Malzeme Tablosu) ve damlacığın çapı kapak kaymasının yarısına yükselene kadar eklemeyi bırakın. Kapak kapağını hızla ters çevirin ve yayılmış retinanın üzerine yerleştirin. Kabarcık oluşturmaktan kaçının.
- Retinal düz montajların görüntülerini çekin veya slaytları 4 °C'de saklayın ve ışıktan koruyun.
3. Retinal düz montajların analizi ve nicelleştirilmesi
NOT: OIR fare modeli için, araştırmacılar genellikle P12-P25 sırasında merkezi retinal vasküler tıkanıklık ve periferik retinal patolojik neovaskülarizasyon alanını kaydederler. Önceki çalışmalar, retinanın merkezi avasküler alanının P12'de maksimuma ulaştığını ve yavaş yavaş P13'ten P17'ye küçüldüğünü göstermiştir; Aynı zamanda, OIR farelerinin retinası, P1722,29 civarında neovaskülarizasyon alanının zirvesine ulaşır. P17'den itibaren neodamarlar yavaş yavaş geriler ve fonksiyonel damarlar avasküler bölgeye doğru yeniden büyür. Retinal vaskülatür temel olarak P2533'te normale döner.
- 10x objektif lensle floresan mikroskopla retinal düz montajların görüntülerini alın ( Malzeme Tablosuna bakınız). İlk olarak, DAPI kanalını seçin ve optik sinir kafasını görme alanının ortasına ayarlayın. Ardından, diğer kanalları ayarlayın ve retinanın yüzeysel vaskülatürüne odaklanın. Bir fotoğraf yazılımında Kutucuklar'ı işaretleyin (bkz. Malzeme Tablosu) ve dikilmesi gereken fotoğraf sayısını ayarlayın. Tüm retinayı yakalamak için Deneyi Başlat'a tıklayın.
- İmmünofloresan boyama sonrası vazo-obliterasyon (VO) ve neovaskülarizasyon (NV) alanını ölçmek için bir görüntü işleme programı kullanın (bakınız Malzeme Tablosu).
- İlk olarak, Sihirli Değnek Aracı'na tıklayın ve parlaklık farkına göre uygun bir tolerans ayarlayın ve imleci arka plana taşıyın ve fareyi tıklayın. Ardından, retinanın temel bir taslağını elde etmek için Ters Seç'i seçin. Retinanın ayrıntılarını daha da özetlemek için Kement Aracı'nı kullanın. Histogram işlevini kullanarak, tüm retinanın piksel değerini kaydedin ve bir yere yazın veya bir veritabanı programında bir tablo oluşturun.
- Retina görüntüsünü dört kadrana bölün. Her çeyrekte, VO alanını çizmek için Kement Aracı'nı kullanın (Şekil 2A-C) ve NV alanını seçmek için Sihirli Değnek Aracı'nı kullanın (Şekil 2D-F). Histogramdaki piksel bilgileri sayesinde, VO ve NV'nin tüm retinaya piksel oranını, yani VO veya NV alanının tüm retinaya göre yüzdesini hesaplayın.
NOT: Ayrıca, derin öğrenme sinir ağları (http://oirseg.org/) kullanılarak OIR görüntülerindeki VO ve NV alanlarının nicelleştirilmesi için araştırmacılar için güvenilir ve zaman kazandıran bir yol sağlayan veniceleme standardını birleştiren açık kaynaklı ve tam otomatik bir boru hattı da vardır 34.
- Piksel bilgilerini, sonraki analizler için uygun olan bir e-tablo tablosuna kaydedin.
4. Floresein fundus anjiyografi (FFA) ile in vivo görüntüleme
NOT: OIR fareleri için, hem FITC perfüzyonu hem de immünofloresan boyama, deney hayvanlarının ölümü nedeniyle yalnızca bir kez kullanılabilir. Bununla karşılaştırıldığında, FFA'nın avantajlarından biri, in vivo35,36 gelişimi ve patolojik durumu sırasında fare retina damarlarının dinamik değişikliklerinin gözlemlenmesidir.
- Anesteziden önce yavruları tartın.
- 30-50 mg / kg'lık bir dozda% 0.3 pentobarbital sodyumun intraperitoneal enjeksiyonu ile yavruları anestezi altına alın.
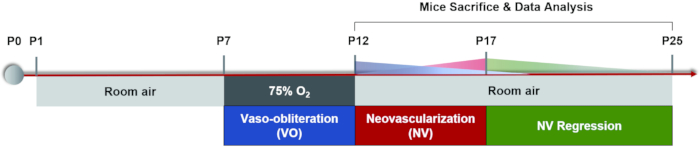
NOT: 1 ay içindeki fareler için, anestezik dozlara dikkat edin. Anestezinin neden olduğu farelerin ölümünü azaltmak için daha düşük konsantrasyonlarda ve anestezik dozlarında kullanın. Yavrular anestezi altına alındıktan sonra, vücut ısısını korumak için küçük bir ısıtma yastığı kullanın. Hipotermi sadece yavruların fizyolojik fonksiyonlarını etkilemekle kalmaz, aynı zamanda kristalinde değişikliklere yol açar ve katarakt gelişimini hızlandırır. - Her yavru için 20 μL midriatik göz damlası (%0,5 tropikamid/tr + %0,5 fenilefrin hidroklorür) kullanın ve uzun süreli göz bebeği genişlemesi elde etmek için 5 dakika bekleyin (Şekil 3A,B).
- Anestezi uygulanan yavruları görüntüleme cihazının önüne getirin (bkz. Yavruları küçük bir ısıtma yastığı üzerinde tutun, yavruları sabit bir konuma getirin ve korneadaki nemi korumak için düzenli olarak yapay gözyaşları kullanın. Optik sinir kafasını ekranın ortasına ayarlamak için Kızılötesi Fundus Görüntüleme (IR) moduna tıklayın.
NOT: Yavruların bir gözünü gözlemlerken, diğer gözü korumayı unutmayın. Korneanın kuruluk nedeniyle beyazlamasını önlemek için Hypromellose göz damlası kullanın. - 0.15 mL% 0.5 floresein sodyum tuzu çözeltisinin intraperitoneal enjeksiyonundan sonra, zamanlamaya başlamak için görüntüleme cihazının dokunmatik panelindeki FA düğmesine ve hemen Enjeksiyon düğmesine tıklayın. Retinanın kan dolaşımı venöz faza girdiğinde 3 dakika sonra görüntüleri kaydedin ve retinayı 6-8 dakikadan az olmamak üzere gözlemleyin.
NOT: Floresein sodyum tuzu çözeltisinin intraperitoneal enjeksiyonundan sonra, yavruların derisi, mukozası ve idrarı belirgin sarımsı yeşil gösterir. Floreseinin çoğu yavrular tarafından bir gün içinde atılır. Floresein sodyumun intraperitoneal olarak her gün altı kez enjekte edilmesi önemli yan etkilere neden olmaz37. - Optik sinir kafasını görüntü alma alanının merkezine doğru hareket ettirin ve merkezi retinanın ilk görüntüsünü alın. Ardından, optik sinir kafası görüntü yakalama alanının bir tarafının orta noktasına yerleştirilene kadar görüntüleme cihazının lensini yatay olarak gözün burun tarafına doğru hareket ettirin ve ikinci görüntüyü alın. Bu yöntemi kullanarak sırasıyla zamansal, superior ve inferior retinanın görüntülerini çekmeye devam edin (Şekil 3C).
NOT: Regresyon aşaması gerçekleşirken 12 dakika içinde "Beş yönlü" görüntüler alın. Optik sinir kafasının alt görüntüdeki konumunun, lensin sınırlı açı ayarı nedeniyle kenar çizgisine düşmemesine izin verilir. - Görüntüleri kaydedin ve dikiş için bir görüntü işleme programı kullanın.
5. Floresein fundus anjiyografinin (FFA) görüntü işleme
- Görüntüleme işleme programını açın ve siyah arka plana sahip yeni bir tuval oluşturmak için Dosyada Yeni'ye tıklayın (Şekil 4A).
- Arka plan katmanında önce merkezi retinanın görüntüsünü açın. Dosya'ya tıklayın ve ikinci resmi ekleyin. İkinci görüntünün opaklığını %60'a ayarlayın, iki görüntünün aynı bölümleri üst üste binene kadar ikinci görüntüyü taşıyın ve yeniden boyutlandırın. Serbest Dönüşüm ve Çarpıtma Modları Arasında Geçiş Yap düğmesine tıklayın ve gerekirse gemilerde ince ayarlamalar yapın. Ardından, ikinci görüntünün opaklığını tekrar %100'e çevirin (Şekil 4A,B).
- Aynı anda iki görüntü seçin ve Katmanları Otomatik Karıştır'a tıklayın. Karışım yöntemi olarak Panorama'yı kontrol edin ve aşağıdaki iki cümleyi seçin. Tamam'a tıklayın ve ilk iki görüntünün görüntü dikişini bitirin (Şekil 4C, D).
- İlk iki dikişli görüntüyü bir bütün olarak alın, üçüncü görüntüyü ekleyin ve karıştırmaya devam edin. Beş görüntünün dikişini tamamlamak için yukarıdaki yöntemleri tekrarlayın (Şekil 4E).
- FFA'nın farklı zaman noktalarındaki görüntülerini düzgün bir boyuta kesmek ve retinal vaskülatürün P15'ten P25'e hem normal hem de OIR yavrularında dinamik değişikliklerini gözlemlemek için Kırpma Aracı'nı kullanın.
6. İstatistiksel analiz
- Ortalama ± standart sapma (s.d.) olarak bugünkü değerler.
- İki bağımsız örneği karşılaştırmak için Öğrencinin t-testini kullanın. Birden fazla veri kümesini karşılaştırmak ve yaygın olarak kullanılan çoklu karşılaştırma testi olan Dunnett veya Tukey testi ile birleştirmek için Tek Yönlü ANOVA'yı kullanın.
- Normal olarak dağıtılmamış veriler için Mann-Whitney U testi veya Kruskal Wallis testi kullanın. P 0,05 < olduğunda önemli istatistiksel farklılıkları göz önünde bulundurun.
Sonuçlar
OIR fare modelinde, en önemli ve temel sonuç, VO ve NV alanının nicelleştirilmesidir. P7'den 5 gün boyunca hiperoksi ortamında yaşadıktan sonra, yavruların merkezi retinası en büyük perfüzyon dışı alanı gösterdi. 5 gün içinde hipoksinin uyarılması altında, retinal neovaskülarizasyon yavaş yavaş üretildi ve bu da normal damarları çevreleyen normal damarlardan daha yoğun bir şekilde floresan oldu. P17'den sonra, patolojik neovaskülarizasyonun floresan sinyali, retinanın yeniden şekillenmesiyle hızla gerilemiştir (Şekil 5A). Yavruların çöp boyutunu ve doğum sonrası kilo alımını kontrol ederek, OIR fare modelinin VO ve NV alanı iyi tekrarlanabilirlik ve stabilite gösterdi ve retinal neovaskülarizasyonun zirvesi, önceki çalışmalarla uyumlu olan P17'de meydana geldi (Şekil 5B, C).
FFA, retinal vaskülatürü incelemek için ideal bir araçtır. FFA'nın in vivo uygulaması göz önüne alındığında, deney hayvanlarının atıklarında büyük bir azalma olduğu gibi, retina damarlarının zamanla dinamik değişikliklerini de göstermektedir. Önceki çalışmalarda, FFA fare yavrularında sıklıkla kullanılmadı ve daha fazla çalışma için zor olan tek görünümlü bir görüntüde sunuldu. Bu protokolde, retina vaskülatürünün "Beş yönlü" görüntüleri, retinanın daha geniş bir alanını bir kerede görüntülemek için bir görüntü işleme yazılımı kullanılarak bir araya getirildi ve bu da gerekirse sonraki analizler için yardımcı oldu (Şekil 4). Ayrıca, OIR fare yavruları uzun bir göz açıklığı gösterdi, bu nedenle FFA görüntüleri hayvan etiğinin gereksinimlerini karşılamak için P15'ten alındı. OIR fare modelinin retinasında, kan damarlarının çapı belirgin bir şekilde arttı ve normal farelerle karşılaştırıldığında oldukça kıvrımlı hale geldi. Ayrıca, FFA, yavruların ölümü olmadan P15-P25'ten izolektin B4-594 ile immünofloresan boyama ile retinal vaskülatürün dinamik değişikliklerinin benzer bir eğilimini göstermiştir (Şekil 6).
Resim 1: OIR fare modelinin çizgi film şeması. OIR fare modeli, yavruları ve emziren annelerini bir süre odada tutarak indüklendi (P0-P7). P7'de, her ikisi de retinal damar büyümesini inhibe eden ve merkezi retinada önemli damar kaybına neden olan 5 gün boyunca% 75 oksijene maruz kaldı. Fareler daha sonra P12'de oda havasına geri getirildi ve avasküler retina nispeten hipoksik hale gelmeye başladı, hem normal damar büyümesini hem de orta periferik retina çevresinde patolojik bir yanıtı tetikledi. Maksimum neovaskülarizasyon (NV) P17'de görüldü. Daha sonra patolojik neovaskülarizasyon spontan regresyon sürecine girdi. Retinal vasküler sistem P25 civarında tekrar normale döndü. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 2: Fare retinasında vazo-obliterasyon (VO) ve neovaskülarizasyon (NV) ölçümü. (A) İzolektin B4-594 ile endotel hücreleri için boyanmış 10x P12 OIR retinal tam montajlı görüntü. (B) Avasküler alan seçili bir retinanın ekran görüntüsü. Bu ölçümü yapmak için gerekli araçlar beyaz oklarla vurgulanır: Sihirli Değnek Aracı ve Kement Aracı. (C) Retinanın avasküler alanını vurgulayın ve görüntüyü bir kopya olarak kaydedin. (D) İzolektin B4-594 ile endotel hücreleri için boyanmış 10x P17 OIR retinal tam montajlı görüntü. (E) Neovasküler tutamları seçilmiş bir retinanın ekran görüntüsü. Sihirli Değnek Aracı'nı kullanın ve NV'yi vurgulamak için en uygun Toleransı ayarlayın. Toleransı 3-5 olarak ayarlayın ve kenar yumuşatma ve bitişik kutuları işaretleyin. (F) Neovaskülarizasyon bölgesini sadece kopya olarak saklayın. Ölçek çubukları 1.000 μm'yi temsil eder. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
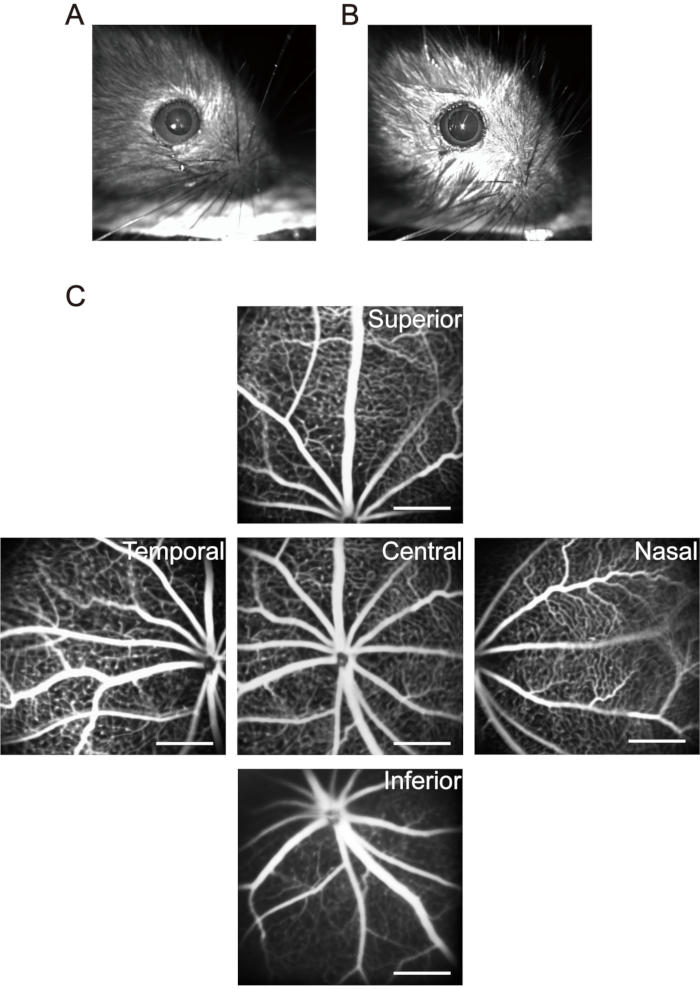
Şekil 3: Fare retinasındaki "Beş yönlü" görüntülerin elde edilmesi. (A) Normal fare göz bebeği. (B) Midryaziste fare göz bebeği. (C) Retinanın merkezi, nazal, zamansal, üst ve alt bölgesinin "Beş yönlü" görüntüleri sırasıyla toplandı (oda havasındaki P17 yavruları). Ölçek çubukları 500 μm'yi temsil eder. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 4: Floresein fundus anjiyografiden (FFA) "Beş yönlü" görüntüleri dikmek için genel iş akışı. (A) Siyah arka plana sahip yeni bir tuval oluşturun ve merkezi retinanın FFA görüntüsünü açın. (B) Temporal retinanın FFA görüntüsünü açın ve ikinci görüntünün opaklığını %60'a ayarlayın; iki görüntünün aynı bölümleri üst üste binene kadar görüntüyü taşıyın ve yeniden boyutlandırın. Gerekirse ince ayarlamalar yapmak için Serbest Dönüştürme ve Çarpıtma Modları Arasında Geçiş Yap'a tıklayın. İkinci görüntünün opaklığını tekrar %100'e çevirin. (C) Aynı anda iki görüntü seçin ve Katmanları Otomatik Karıştır'a tıklayın. (D) İlk iki görüntünün görüntü dikişini bitirmek için karışım yöntemi olarak Panorama'yı kullanın. (E) Tüm görüntülerin dikişini tamamlamak için yukarıdaki yöntemleri tekrarlayarak görüntüleri dikmeye devam edin. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 5: OIR fare modelinin retinasında vazo-obliterasyon (VO) ve neovaskülarizasyonun (NV) miktarı. (A) P12'den P25'e izolektin B4-594 ile endotel hücreleri için boyanmış 10x OIR retinal tam montajın görüntüsü. 5 gün boyunca% 75 oksijene maruz kaldıktan sonra, yavrular ve emziren anneleri, vazo-obliterasyon alanının maksimuma ulaştığı P12'deki oda havasına geri getirildi. Merkezi retinadaki göreceli hipoksi, bu bölgede damar büyümesine ve orta periferik retinada patolojik anjiyogeneze yol açtı. P17'de, retina öncesi neovasküler tutamlar maksimuma ulaştı ve daha sonra hızla küçüldü. NV tamamen geriledi ve retina P25 civarında normal görünüyordu. (B) VO alanının nicelleştirilmesi, P12'de bir zirve ve P25 civarında kaybolma gösterdi. (C) NV alanının nicelleştirilmesi, P17'de bir zirve ve P25 civarında bir regresyon gösterdi. Ölçek çubukları A'da 1.000 μm'yi temsil eder (Tek Yönlü ANOVA, *P < 0,05, **P < 0,01, ***P < 0,001, **** P < 0,0001). Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
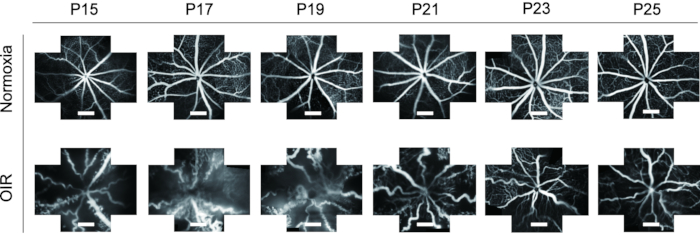
Şekil 6: OIR fare modelinde floresein fundus anjiyografinin (FFA) in vivo görüntülenmesi. OIR fare modelinin retinasında, kan damarlarının çapı belirgin bir şekilde arttı ve normal farelerle karşılaştırıldığında oldukça kıvrımlı hale geldi. Ayrıca, FFA, fare yavrularının ölümü olmadan P15-P25'ten izolektin B4-594 ile immünofloresan boyama ile retinal vaskülatürün dinamik değişikliklerinin benzer bir eğilimini göstermiştir. Ölçek çubukları 500 μm'yi temsil eder. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Farelerin OIR'ye duyarlılığı birçok faktörden etkilenir. Farklı genetik geçmişe ve suşlara sahip yavrular karşılaştırılamaz. BALB / c albino farelerde, damarlar VO bölgesine hızla yeniden büyür ve önemli ölçüde azalmış neovasküler tutamlar38 ile araştırmaya bazı zorluklar getirir. C57BL/6 farelerde, BALB/cJ fare suşu39,40 ile karşılaştırıldığında fotoreseptör hasarı artmıştır. Aynı şey farklı transgenik fare türleri için de geçerlidir41,42,43. Ayrıca, C57BL / 6 fareleri, 129S3 / SvIM fareleri44 ile karşılaştırıldığında daha düşük bir anjiyogenez seviyesi gösterir.
Doğum sonrası kilo alımı (PWG) da45 olarak dikkate alınması önemlidir ve yenidoğanların beslenme durumunu değerlendirmek için göstergelerden biridir. Ayrıca, birçok hayvan modelleyicisinin dikkatini çeken ROP'u tahmin etmek için güvenilir bir yöntem haline gelmiştir46. PWG, farelerin hiperoksi ve hipoksiye tepkisini etkiler. P7'de, vücut ağırlığı artmış (>5 g) olan yavrular yetersiz vazo-obliterasyon ve retinal neovaskülarizasyon gösterirken, vücut ağırlığı azalmış (<5 g) olan yavrular hiperoksi ve hipoksiye belirgin yanıt gösterir. Ayrıca, P17'de, zayıf (<5 g) ve geniş (>7.5 g) kilo alımı olan yavrular NV'nin azaldığını göstermektedir. Bununla birlikte, zayıf kilo alımı (<5 g) olan yavrular, NV pik45 oluşumunda gecikme ile birlikte, vazo-obliterasyon (VO) ve neovaskülarizasyon (NV) evresini önemli ölçüde uzatmıştır. Bu nedenle, deneyin tekrarlanabilirliğini ve karşılaştırılabilirliğini sağlamak için P7 ve P17'deki yavruların PWG'sini kaydetmek ve kontrol etmek ve düşük PWG'li yavruları (P17'de < 6 g) ortadan kaldırmak gerekir.
Çöp büyüklüğünün PWG üzerinde daha büyük bir etkisi vardır ve bazı araştırmacılar PWG22,31 gereksinimlerini karşılamak için 6-8 yavru / baraj ile sınırlandırılması gerektiğini öne sürmektedir. Emziren annenin durumu da dikkate alınmalıdır. Emziren annelerin hiperoksik bir ortamda akciğer hasarından ölme olasılığı daha yüksektir47. Emziren anneler OIR'nin indüksiyonu sırasında ve sonrasında yavrularını ölür veya ihmal ederse, yavrular kolayca kilo verir ve hatta beslenme eksikliği nedeniyle ölür32. Bu nedenle, onları değiştirmek için yeterli taşıyıcı anne olduğundan emin olmak gerekir. Bununla birlikte, bu taşıyıcı annelerin yalnızca annenin süresi dolduğunda kullanılması önerilmektedir, bu da genellikle hiperoksiye maruz kalma döneminde veya oda havasına geri döndüğünde olur22. Emziren anneler için yeterli gıda sağlamak, yavrularının beslenme durumunu iyileştirmek için de yararlıdır.
Retinal düz montajları hazırlamak için yararlı bir not, daha uzun süreli boyama için genellikle optimal bir fiksasyon süresinin gerekli olmasıdır. P12-P25 fareleri olarak, oda sıcaklığında 15 dakika + 45 dakikalık bir sabitleme önerilir29. Retinayı gece boyunca 4 ° C'de sabitlemek, zaman sınırlıysa bir alternatiftir. Ayrıca,% 1 Triton X-100 ve% 5 normal eşek serumu daha yüksek konsantrasyona sahip geçirgen ve bloke edici tampon, deneyimlerimize göre immünofloresan boyamanın arka planını etkili bir şekilde azaltmaktadır.
İzolektin B4 boyama ve FITC-dekstran perfüzyonu, neovasküler48,49'u görselleştirmek ve ölçmek için yaygın olarak kullanılan yöntemlerdir. Bu iki yöntemin en büyük sınırlaması, farelerin kurban edilmesi gerektiğidir. Bu nedenle, NV'nin in vivo görüntüleme ve nicelleştirilmesi için yöntemlere ihtiyaç vardır29. Paques ve ark., canlı farelerde retinanın yüksek çözünürlüklü dijital fotoğraflarını sağlayan topikal endoskopi fundus görüntüleme (TEFI) adlı bir teknik geliştirdiler50. TEFI, retinal vasküler değişiklikleri P15 kadar erken tespit edebilir ve elde edilen görüntüler geleneksel değerlendirme yöntemlerine uygundur. Mezu-Ndubuisi ve ark. daha sonra in vivo retinal vasküler oksijen gerilimi (PO2) ölçümleri ve floresein anjiyografi (FA) için yöntemler sunarak ROP ve diğer iskemik retina hastalıklarına bağlı retinal vasküler değişikliklerin ve oksijenasyon değişikliklerinin anlaşılmasını sağlamıştır37. Ne TEFI ne de FA geleneksel yöntemler kadar doğru olmasa da, deney hayvanlarının ölümünü azaltır ve tekrar tekrar yapılabilir. Ayrıca, her farenin kendi kontrolü olarak hizmet etmesine izin verir, böylece OIR verilerini daha karşılaştırılabilir hale getirir. Bu yazıda FFA görüntüleme ve görüntü dikiş için geliştirilmiş bir yöntem sunulmuştur. 1 ay içinde yavrulara FFA yapmak kolay değildir çünkü aşırı anestezi ve hipotermi doğrudan yavruların ölümüne neden olur. Bu nedenle, minimum anestezi dozunu kullanmaya çalışın ve küçük bir ısıtma yastığı kullanarak işlem boyunca ve sonrasında yavruların vücut ısısını korumaya özellikle dikkat edin. Aşağıdaki gözlemin başarısız olması durumunda oküler yüzeyi daima salin ve Hypromellose ile nemlendirin.
Özetle, OIR fare modeli, retinal iskemi ve patolojik neovaskülarizasyonun çok yaygın ve yaygın olarak kullanılan bir modelidir. Bu modelin en büyük sorunlarından biri, yenidoğan fare yavrularının esasen sağlıklı olmaları ve erken doğmuş bebeklere kıyasla metabolik instabilite veya solunum problemleri olmamasıdır. OIR fare modeli ile insanlar arasındaki bir diğer fark, insan retinal neovaskülarizasyonunda her zaman fibrovasküler proliferasyon olması, oysa OIR fare modeli51'de retinal neovasküler fibrozis ile ilişkili olmamasıdır. Bu modelden daha iyi yararlanmak ve daha fazla bilgi edinmek için, "Beş yönlü" görüntü alma ve görüntü işleme yöntemleri de dahil olmak üzere, OIR retinal vaskülatürün dinamik değişikliklerini izlemek için FFA kullanımının ayrıntılı bir açıklaması sağlanmıştır. FFA'nın, retinal vaskülatürün morfolojisini ve fonksiyonunu gözlemlemek ve değerlendirmek için immünofloresan boyamanın yerini kısmen veya tamamen almak için etkili bir yöntem olacağına inanılmaktadır49. OIR fare modeli, insanlarda çeşitli iskemik retinopatinin mikroçevre ve patogenezine tam olarak benzemese de, bize ilaç ve transgenik deneyler yapmanın yanı sıra iskemik retina üzerindeki patolojik anjiyogenez mekanizmasını keşfetme fırsatı sunar51.
Açıklamalar
Yazarların açıklayacak hiçbir şeyleri yoktur.
Teşekkürler
Laboratuvarımızdan ve Zhongshan Oftalmik Merkezi Oftalmik Hayvan Laboratuvarından tüm üyelere teknik yardımları için teşekkür ederiz. Ayrıca deneysel destek için Prof. Chunqiao Liu'ya teşekkür ederiz. Bu çalışma, Çin Ulusal Doğa Bilimleri Vakfı'ndan (NSFC: 81670872; Pekin, Çin), Guangdong Eyaleti Doğa Bilimleri Vakfı, Çin (Hibe No.2019A1515011347) ve Zhongshan Oftalmik Merkezi'ndeki Devlet Anahtar Oftalmoloji Laboratuvarı'ndan Yüksek Düzey hastane inşaatı projesi (Hibe No. 303020103; Guangzhou, Guangdong Eyaleti, Çin).
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1 mL sterile syringe | Solarbio | YA0550 | For preparation of retinal flat mounts and intraperitoneal injection |
| 1× Phosphate buffered saline (PBS) | Transgen Biotech | FG701-01 | For preparation of retinal flat mounts |
| 2 ml Microcentrifuge Tube | Corning | MCT-200-C | For preparation of retinal flat mounts |
| 48 Well Clear TC-Treated Multiple Well Plates | Corning | 3548 | For preparation of retinal flat mounts |
| Adhesive microscope slides | Various | For preparation of retinal flat mounts | |
| Adobe Photoshop CC 2019 | Adobe Inc. | For image analysis | |
| Carbon dioxide gas | Various | For sacrifice | |
| Cover slide | Various | For preparation of retinal flat mounts | |
| Curved forceps | World Precision Instruments | 14127 | For preparation of retinal flat mounts |
| DAPI staining solution | Abcam | ab228549 | For labeling nucleus on retinal flat mounts |
| Dissecting microscope | Olmpus | SZ61 | For preparation of retinal flat mounts |
| Fluorescein sodium | Sigma-Aldrich | F6377 | For in vivo imaging |
| Fluorescent Microscope | Zeiss | AxioImager.Z2 | For acquisition of fluorescence images of retinal flat mounts |
| Fluoromount-G Mounting media | SouthernBiotech | 0100-01 | For preparation of retinal flat mounts |
| Hydroxypropyl Methylcellulose | Maya | 89161 | For in vivo imaging |
| Isolectin B4 594 antibody | Invitrogen | I21413 | For labeling retinal vasculature on retinal flat mounts |
| Mice C57/BL6J | GemPharmatech of Jiangsu Province | For OIR model induction | |
| Micro dissecting scissors-straight blade | World Precision Instruments | 503242 | For preparation of retinal flat mounts |
| No.4 straight forceps | World Precision Instruments | 501978-6 | For preparation of retinal flat mounts |
| Normal donkey serum | Abcam | ab7475 | For preparation of retinal flat mounts |
| O2 sensor | Various | For monitoring the level of O2 | |
| OxyCycler | Biospherix | A84XOV | For OIR model induction |
| Paraformaldehyde (PFA) | Sigma | P6148-1KG | For tissue fixation |
| Pentobarbital sodium | Various | For anesthesia | |
| Soda lime | Various | For absorbing excess CO2 in the oxygen chamber | |
| SPECTRALIS HRA+OCT | Heidelberg | HC00500002 | For in vivo imaging |
| SPSS Statistics 22.0 | IBM | For statistical analysis | |
| Tansference decloring shaker | Kylin-Bell | ZD-2008 | For preparation of retinal flat mounts |
| Tissue culture dish (Low attachment) | Corning | 3261-20EA | For preparation of retinal flat mounts |
| Transfer pipettes | Various | For preparation of retinal flat mounts | |
| Triton X-100 | Sigma-Aldrich | SLBW6818 | For preparation of retinal flat mounts |
| Tropicamide | Various | For in vivo imaging | |
| ZEN Imaging Software | ZEISS | For image acquisition and export |
Referanslar
- Vavvas, D. G., Miller, J. W. Chapter 26 - Basic Mechanisms of Pathological Retinal and Choroidal Angiogenesis. Retina (Fifth Edition). 1, 562-578 (2013).
- Selvam, S., Kumar, T., Fruttiger, M. Retinal vasculature development in health and disease. Progress in Retinal and Eye Research. 63, 1-19 (2018).
- Shimizu, K., Kobayashi, Y., Muraoka, K. Midperipheral fundus involvement in diabetic retinopathy. Ophthalmology. 88 (7), 601-612 (1981).
- Ashton, N. Retinal vascularization in health and disease: Proctor Award Lecture of the Association for Research in Ophthalmology. American Journal of Ophthalmology. 44 (4), 7-17 (1957).
- Hellström, A., Smith, L. E., Dammann, O. Retinopathy of prematurity. Lancet. 382 (9902), 1445-1457 (2013).
- Xu, Y., et al. Melatonin attenuated retinal neovascularization and neuroglial dysfunction by inhibition of HIF-1α-VEGF pathway in oxygen-induced retinopathy mice. Journal of Pineal Research. 64 (4), 12473 (2018).
- Cavallaro, G., et al. The pathophysiology of retinopathy of prematurity: an update of previous and recent knowledge. Acta Ophthalmologica. 92 (1), 2-20 (2014).
- Gilbert, C., Rahi, J., Eckstein, M., O'Sullivan, J., Foster, A. Retinopathy of prematurity in middle-income countries. Lancet. 350 (9070), 12-14 (1997).
- Chen, J., Smith, L. E. Retinopathy of prematurity. Angiogenesis. 10 (2), 133-140 (2007).
- Fielder, A., Blencowe, H., O'Connor, A., Gilbert, C. Impact of retinopathy of prematurity on ocular structures and visual functions. Archives of Disease in Childhood. Fetal and Neonatal Edition. 100 (2), 179-184 (2015).
- Moshfeghi, D. M. Presumed transient reactive astrocytic hyperplasia in immature retina. Retina. 26, 69-73 (2006).
- Kandasamy, Y., Hartley, L., Rudd, D., Smith, R. The association between systemic vascular endothelial growth factor and retinopathy of prematurity in premature infants: a systematic review. British Journal of Ophthalmology. 101 (1), 21-24 (2017).
- Shah, P. K., et al. Retinopathy of prematurity: Past, present and future. World Journal of Clinical Pediatrics. 5 (1), 35-46 (2016).
- Kinsey, V. E. Retrolental fibroplasia; cooperative study of retrolental fibroplasia and the use of oxygen. AMA Archives of Ophthalmology. 56 (4), 481-543 (1956).
- Tin, W., Gupta, S. Optimum oxygen therapy in preterm babies. Archives of Disease in Childhood. Fetal and Neonatal Edition. 92 (2), 143-147 (2007).
- Liu, C. H., Wang, Z., Sun, Y., Chen, J. Animal models of ocular angiogenesis: from development to pathologies. FASEB Journal : Official Publication of the Federation of American Societies for Experimental Biology. 31 (11), 4665-4681 (2017).
- Ashton, N., Ward, B., Serpell, G. Effect of oxygen on developing retinal vessels with particular reference to the problem of retrolental fibroplasia. The British Journal of Ophthalmology. 38 (7), 397-432 (1954).
- Penn, J. S., Tolman, B. L., Lowery, L. A. Variable oxygen exposure causes preretinal neovascularization in the newborn rat. Investigative Ophthalmology & Visual Science. 34 (3), 576-585 (1993).
- Smith, L. E., et al. Oxygen-induced retinopathy in the mouse. Investigative Ophthalmology & Visual Science. 35 (1), 101-111 (1994).
- McLeod, D. S., Brownstein, R., Lutty, G. A. Vaso-obliteration in the canine model of oxygen-induced retinopathy. Investigative Ophthalmology & Visual Science. 37 (2), 300-311 (1996).
- Cao, R., Jensen, L. D., Söll, I., Hauptmann, G., Cao, Y. Hypoxia-induced retinal angiogenesis in zebrafish as a model to study retinopathy. PLoS One. 3 (7), 2748 (2008).
- Connor, K. M., et al. Quantification of oxygen-induced retinopathy in the mouse: a model of vessel loss, vessel regrowth and pathological angiogenesis. Nature Protocols. 4 (11), 1565-1573 (2009).
- Fruttiger, M. Development of the mouse retinal vasculature: angiogenesis versus vasculogenesis. Investigative Ophthalmology & Visual Science. 43 (2), 522-527 (2002).
- Stahl, A., et al. The mouse retina as an angiogenesis model. Investigative Ophthalmology & Visual Science. 51 (6), 2813-2826 (2010).
- Rivera, J. C., et al. Ischemic retinopathies: oxidative stress and inflammation. Oxidative Medicine and Cellular Longevity. 2017, 3940241 (2017).
- Bashinsky, A. L. Retinopathy of prematurity. North Carolina Medical Journal. 78 (2), 124-128 (2017).
- Flynn, J. T., et al. Retinopathy of prematurity. Diagnosis, severity, and natural history. Ophthalmology. 94 (6), 620-629 (1987).
- Aguilar, E., et al. Chapter 6. Ocular models of angiogenesis. Methods in Enzymology. 444, 115-158 (2008).
- Liegl, R., Priglinger, C., Ohlmann, A. Induction and readout of oxygen-induced retinopathy. Methods in Molecular Biology. 1834, 179-191 (2019).
- Lutty, G. A., McLeod, D. S. Retinal vascular development and oxygen-induced retinopathy: a role for adenosine. Progress in Retinal and Eye Research. 22 (1), 95-111 (2003).
- Vähätupa, M., et al. Oxygen-induced retinopathy model for ischemic retinal diseases in rodents. Journal of Visualized Experiments: JoVE. (163), (2020).
- Kim, C. B., D'Amore, P. A., Connor, K. M. Revisiting the mouse model of oxygen-induced retinopathy. Eye and Brain. 8, 67-79 (2016).
- Gammons, M. V., Bates, D. O. Models of oxygen induced retinopathy in rodents. Methods in Molecular Biology. 1430, 317-332 (2016).
- Xiao, S., et al. Fully automated, deep learning segmentation of oxygen-induced retinopathy images. Journal of Clinical Investigation Insight. 2 (24), (2017).
- McLeod, D. S., D'Anna, S. A., Lutty, G. A. Clinical and histopathologic features of canine oxygen-induced proliferative retinopathy. Investigative Ophthalmology & Visual Science. 39 (10), 1918-1932 (1998).
- Penn, J. S., Johnson, B. D. Fluorescein angiography as a means of assessing retinal vascular pathology in oxygen-exposed newborn rats. Current Eye Research. 12 (6), 561-570 (1993).
- Mezu-Ndubuisi, O. J., et al. In vivo retinal vascular oxygen tension imaging and fluorescein angiography in the mouse model of oxygen-induced retinopathy. Investigative Ophthalmology & Visual Science. 54 (10), 6968-6972 (2013).
- Zeilbeck, L. F., Müller, B., Knobloch, V., Tamm, E. R., Ohlmann, A. Differential angiogenic properties of lithium chloride in vitro and in vivo. PLoS One. 9 (4), 95546 (2014).
- Walsh, N., Bravo-Nuevo, A., Geller, S., Stone, J. Resistance of photoreceptors in the C57BL/6-c2J, C57BL/6J, and BALB/cJ mouse strains to oxygen stress: evidence of an oxygen phenotype. Current Eye Research. 29 (6), 441-447 (2004).
- Zhang, Q., Zhang, Z. M. Oxygen-induced retinopathy in mice with retinal photoreceptor cell degeneration. Life Sciences. 102 (1), 28-35 (2014).
- Okamoto, N., et al. Transgenic mice with increased expression of vascular endothelial growth factor in the retina: a new model of intraretinal and subretinal neovascularization. The American Journal of Pathology. 151 (1), 281-291 (1997).
- Ohlmann, A., et al. Norrin promotes vascular regrowth after oxygen-induced retinal vessel loss and suppresses retinopathy in mice. The Journal of Neuroscience. 30 (1), 183-193 (2010).
- Fang, L., Barber, A. J., Shenberger, J. S. Regulation of fibroblast growth factor 2 expression in oxygen-induced retinopathy. Investigative Ophthalmology & Visual Science. 56 (1), 207-215 (2014).
- Chan, C. K., et al. Differential expression of pro- and antiangiogenic factors in mouse strain-dependent hypoxia-induced retinal neovascularization. Laboratory Investigation. 85 (6), 721-733 (2005).
- Stahl, A., et al. Postnatal weight gain modifies severity and functional outcome of oxygen-induced proliferative retinopathy. The American Journal of Pathology. 177 (6), 2715-2723 (2010).
- Vanhaesebrouck, S., et al. Association between retinal neovascularization and serial weight measurements in murine and human newborns. European Journal of Ophthalmology. 23 (5), 678-682 (2013).
- Gerschman, R., Nadig, P. W., Snell, A. C., Nye, S. W. Effect of high oxygen concentrations on eyes of newborn mice. The American Journal of Physiology. 179 (1), 115-118 (1954).
- Lange, C., et al. Kinetics of retinal vaso-obliteration and neovascularisation in the oxygen-induced retinopathy (OIR) mouse model. Graefe's Archive for Clinical and Experimental Ophthalmology. 247 (9), 1205-1211 (2009).
- Huang, S., et al. Comparison of dextran perfusion and GSI-B4 isolectin staining in a mouse model of oxygen-induced retinopathy. Eye Science. 30 (2), 70-74 (2015).
- Paques, M., et al. Panretinal, high-resolution color photography of the mouse fundus. Investigative Ophthalmology & Visual Science. 48 (6), 2769-2774 (2007).
- Fletcher, E. L., et al. Animal models of retinal disease. Progress in Molecular Biology and Translational Science. 100, 211-286 (2011).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır