Method Article
Monitoreo del crecimiento dinámico de los vasos retinianos en un modelo de ratón con retinopatía inducida por oxígeno
En este artículo
Resumen
Este protocolo describe un método detallado para la preparación y tinción de inmunofluorescencia de ratones montados planos de retina y análisis. El uso de la angiografía con fondo de ojo de fluoresceína (FFA) para crías de ratones y el procesamiento de imágenes también se describen en detalle.
Resumen
La retinopatía inducida por oxígeno (OIR) se usa ampliamente para estudiar el crecimiento anormal de vasos en enfermedades isquémicas de la retina, incluida la retinopatía del prematuro (ROP), la retinopatía diabética proliferativa (PDR) y la oclusión de la vena retiniana (RVO). La mayoría de los estudios OIR observan neovascularización retiniana en puntos de tiempo específicos; sin embargo, el crecimiento dinámico de vasos en ratones vivos a lo largo de un curso de tiempo, que es esencial para comprender las enfermedades vasculares relacionadas con OIR, ha sido poco estudiado. Aquí, describimos un protocolo paso a paso para la inducción del modelo de ratón OIR, destacando las posibles dificultades y proporcionando un método mejorado para cuantificar rápidamente las áreas de vaso-obliteración (VO) y neovascularización (NV) utilizando tinción de inmunofluorescencia. Más importante aún, monitoreamos el recrecimiento de los vasos en ratones vivos de P15 a P25 mediante la realización de angiografía de fondo de ojo fluoresceína (FFA) en el modelo de ratón OIR. La aplicación de FFA al modelo de ratón OIR nos permite observar el proceso de remodelación durante el recrecimiento del vaso.
Introducción
La neovascularización retiniana (RNV), que se define como un estado en el que nuevos vasos patológicos se originan en las venas retinianas existentes, generalmente se extiende a lo largo de la superficie interna de la retina y crece en el espacio vítreo (o subretiniano en algunas condiciones)1. Es un sello distintivo y una característica común de muchas retinopatías isquémicas, incluyendo la retinopatía del prematuro (ROP), la oclusión de la vena retiniana (RVO) y la retinopatía diabética proliferativa (RDP)2.
Numerosas observaciones clínicas y experimentales han indicado que la isquemia es la principal causa de neovascularización retiniana 3,4. En la ROP, los neonatos están expuestos a oxígeno de alto nivel en incubadoras cerradas para aumentar las tasas de supervivencia, lo que también es un factor importante para la detención del crecimiento vascular. Después del tratamiento, las retinas de los recién nacidos experimentan un período relativamente hipóxico5. Otras situaciones se observan en la oclusión de las venas retinianas centrales o ramificadas en la OVR y también se observa daño de los capilares retinianos causado por microangiopatía en la PDR2. La hipoxia aumenta aún más la expresión de factores angiogénicos como el factor de crecimiento endotelial vascular (VEGF) a través de la vía de señalización del factor 1α inducido por hipoxia (HIF-1α) que a su vez guía a las células endoteliales vasculares para crecer en el área hipóxica y formar nuevos vasos 6,7.
La RP es un tipo de retinopatía proliferativa vascular en lactantes prematuros y una de las principales causas de ceguera infantil 8,9, que se caracteriza por hipoxia retiniana, neovascularización retiniana e hiperplasia fibrosa10,11,12. En la década de 1950, los investigadores encontraron que la alta concentración de oxígeno puede mejorar significativamente los síntomas respiratorios de los bebés prematuros13,14. Como resultado, la oxigenoterapia se usaba cada vez más en bebés prematuros en ese momento15. Sin embargo, simultáneamente con el uso generalizado de oxigenoterapia en lactantes prematuros, la incidencia de RP aumentó año tras año. Desde entonces, los investigadores han relacionado el oxígeno con la ROP, explorando varios modelos animales para comprender la patogénesis de la ROP y la RNV16.
En humanos, la mayor parte del desarrollo de la vasculatura retiniana se completa antes del nacimiento, mientras que en roedores la vasculatura retiniana se desarrolla después del nacimiento, proporcionando un sistema modelo accesible para estudiar la angiogénesis en la vasculatura retiniana2. Con el progreso continuo de la investigación, los modelos de retinopatía inducida por oxígeno (OIR) se han convertido en modelos importantes para imitar la angiogénesis patológica resultante de la isquemia. No hay especies animales específicas en el estudio del modelo OIR y el modelo se ha desarrollado en varias especies animales, incluyendo gatito 17, rata18, ratón19, cachorro beagle 20 y pez cebra21. Todos los modelos comparten el mismo mecanismo por el cual están expuestos a la hiperoxia durante el desarrollo temprano de la retina y luego regresan al ambiente normóxico. Smith et al. observaron que la exposición de crías de ratón a la hiperoxia de P7 durante 5 días indujo una forma extrema de regresión de los vasos en la retina central y traerlas de vuelta al aire ambiente en P12 desencadenó gradualmente mechones neovasculares, que crecieron hacia el cuerpo vítreo19. Este fue un modelo de ratón OIR estandarizado también llamado modelo Smith. Connor et al. optimizaron aún más el protocolo y proporcionaron un método universalmente aplicable para cuantificar el área de VO (vaso-obliteración) y NV (neovascularización) en 2009, lo que aumentó la aceptación y utilización del modelo22. El modelo de ratón OIR sigue siendo el modelo más utilizado ahora debido a su pequeño tamaño, reproducción rápida, antecedentes genéticos claros, buena repetibilidad y alta tasa de éxito.
En ratones, la vascularización retiniana comienza después del nacimiento con el crecimiento interno de vasos desde la cabeza del nervio óptico hacia la retina interna hacia la ora serrata. Durante el desarrollo normal de la retina, los primeros vasos retinianos brotan de la cabeza del nervio óptico alrededor del nacimiento, formando una red en expansión (el plexo primario) que llega a la periferia alrededor del día postnatal 7 (P7) 23. Luego, los vasos comienzan a crecer en la retina para formar una capa profunda, penetrar en la retina y establecer una red laminar alrededor de la capa nuclear interna (INL) como en el humano24. Al final de la tercera semana postnatal (P21), el desarrollo más profundo del plexo está casi completo. Para el modelo de ratón OIR, la oclusión vascular siempre aparece en la retina central debido a la rápida degeneración de un gran número de redes vasculares inmaduras en la región central durante la exposición a la hiperoxia. Por lo tanto, el crecimiento de la neovascularización patológica también ocurre en la retina periférica media, que es el límite del área de no perfusión y el área vascular. Sin embargo, los vasos retinianos humanos casi se han formado antes del nacimiento. En cuanto a los bebés prematuros, la retina periférica no está completamente vascularizada cuando se expone a la hiperoxia25,26. Así, la oclusión vascular y la neovascularización aparecen principalmente en la retina periférica27,28. A pesar de estas diferencias, el modelo OIR de ratón recapitula de cerca los eventos patológicos que ocurren durante la neovascularización inducida por isquemia.
La inducción del modelo OIR se puede dividir en dos fases29: en la fase 1 (fase de hiperoxia), el desarrollo vascular retiniano se detiene o retrasa con oclusión y regresión de los vasos sanguíneos como resultado de la disminución del VEGF y la apoptosis de las células endoteliales 24,30; En la fase 2 (fase de hipoxia), el suministro de oxígeno retiniano será insuficiente en condiciones de aire ambiente29, lo cual es esencial para el desarrollo neural y la homeostasis 19,31. Esta situación isquémica generalmente resulta en una neovascularización anormal no regulada.
Actualmente, el método de modelado comúnmente utilizado es alternar la exposición alta / baja al oxígeno: las madres y sus cachorros están expuestos al 75% de oxígeno durante 5 días en P7 seguido de 5 días en el aire ambiente hasta que P17 demostró resultados comparables22, que es el punto final de la inducción del modelo de ratón OIR. (Figura 1). Además de simular la ROP, esta neovascularización patológica mediada por isquemia también se puede utilizar para estudiar otras enfermedades isquémicas de la retina. Las principales mediciones de este modelo incluyen la cuantificación del área de VO y NV, que se analizan a partir de montajes planos retinianos mediante tinción de inmunofluorescencia o perfusión FITC-dextrano. Cada ratón puede ser estudiado sólo una vez debido a la operación letal. En la actualidad, existen pocos métodos para observar continuamente cambios dinámicos de la vasculatura retiniana durante el proceso de regresión vascular y angiogénesis patológica32. En este documento, proporcionamos un protocolo detallado de inducción del modelo OIR, análisis de montajes planos retinianos, así como un flujo de trabajo de angiografía de fondo de ojo fluoresceína (FFA) en ratones que sería útil para obtener una comprensión más completa de los cambios dinámicos vasculares durante dos fases del modelo de ratón OIR.
Protocolo
Todos los procedimientos que involucran el uso de ratones fueron aprobados por el comité de ética experimental animal del Centro Oftalmológico Zhongshan, Universidad Sun Yat-sen, China (número autorizado: 2020-082), y de acuerdo con las pautas aprobadas del Comité de Cuidado y Uso de Animales del Centro Oftalmológico Zhongshan y la Declaración de la Asociación de Investigación en Visión y Oftalmología (ARVO) para el Uso de Animales en Investigación Oftálmica y de la Visión.
1. Inducción del modelo OIR del ratón
- Use ratones con una tasa más baja de malformación congénita de los ojos, por ejemplo, ratones C57BL / 6J, y aparee con ellos en una proporción de macho / hembra = 1: 2. Haga que los cachorros nazcan el mismo día y comience a inducir el modelo OIR en P7. Registre el peso corporal de los cachorros de ratón estrictamente antes de modelar.
NOTA: Anote el día de nacimiento como P0. Registre el peso de cada ratón regularmente. El peso corporal de las crías recién nacidas es muy importante durante la inducción de OIR ya que la sensibilidad de los ratones en diferentes estados al oxígeno es diferente. Excluya a los cachorros más de 5 g en P7 para garantizar resultados comparables. - Proporcionar un entorno de vida adecuado para las madres lactantes y sus cachorros, como ajustar la temperatura a 23 °C ± 2 °C, controlar la humedad al 40%-65%, alternar 12 h de luz y 12 h de oscuridad todos los días, agregar un poco de algodón a la jaula para anidar, asegurar alimentos y agua esterilizados adecuados y mantenerlos en jaulas ventiladas individualmente (IVC).
- Controle el nivel de humedad y temperatura dentro de la cámara. Controle la humedad entre 40% a 65% y mantenga la temperatura a 23 °C ± 2 °C.
- Compruebe el suministro de oxígeno con sensores de oxígeno, mantenga un nivel de oxígeno constante al 75% y controle el caudal de oxígeno a 0,5-0,75 L/min. Coloque 50 g de cal sodada en el fondo de la cámara para absorber el exceso de CO2 y mantener los valores de CO2 por debajo del 3%22.
- Controle los comportamientos de las madres lactantes, como el comportamiento de construcción de nidos, morder a sus cachorros y rechazar la lactancia al menos una vez al día. Eliminar a las madres lactantes con maternidad deficiente.
- Coloque a los cachorros P7 (machos y hembras) y sus madres lactantes en una cámara de oxígeno en la que el nivel de oxígeno sea del 75% durante 5 días a P12. Evite la apertura innecesaria de la cámara durante el período de inducción del modelo. Asegúrese de que haya madres sustitutas adicionales para el reemplazo, en caso de que las madres lactantes mueran debido a una lesión pulmonar mientras están en hiperoxia.
NOTA: Para garantizar la comparabilidad del experimento, restrinja el número a 6-8 cachorros por cada madre. Preste atención al problema potencial de la toxicidad del oxígeno, que causa la muerte de algunas madres lactantes. Los signos de lesión pulmonar hiperóxica en madres lactantes incluyen, pero no se limitan a, frecuencia respiratoria fluctuante, disminución de la actividad y disminución de la alimentación. Cuando ocurra el fenómeno anterior, eutanasia a la madre lactante con pentobarbital sódico al 1% (50 mg / kg) tan pronto como sea posible. Prepare algunas madres sustitutas, por ejemplo, 129S1 / SvImJ para el reemplazo y úselas solo si es necesario. No se recomienda reemplazar a las madres lactantes como una rutina, ya que esto conducirá a la apertura frecuente de una cámara de oxígeno, lo que resultará en niveles inestables de oxígeno y agresión materna. - Lleve a los cachorros y a sus madres lactantes de vuelta al aire de la habitación en P12 y controle el peso de todos los cachorros continuamente hasta P17. Agrupe a los cachorros según el peso para asegurarse de que cada grupo experimental tenga una distribución de peso similar.
2. Preparación de monturas enteras retinianas y tinción por inmunofluorescencia
- Registre el peso corporal de los cachorros. Sacrificar a los cachorros por una sobredosis de anestésico (1% pentobarbital sódico 50 mg/kg) o inhalación de CO2 . Otros métodos de eutanasia, como la luxación cervical y la toracotomía bilateral, se pueden utilizar si es necesario.
- Use tijeras curvas para liberar la conexión entre los globos oculares y el tejido orbital. Luego, coloque fórceps curvos en la parte posterior del globo ocular, sujete el nervio óptico y levante rápidamente el ojo de la órbita. Lave los globos oculares en una solución salina tampón fosfato (PBS) 1x preenfriada para eliminar el vello y la sangre de la superficie de los globos oculares.
- Coloque los globos oculares limpios en un tubo de microcentrífuga de 2 ml lleno de paraformaldehído al 4% (PFA) e incube durante 15 minutos a temperatura ambiente en un agitador a una velocidad de 12-15 revoluciones por minuto (rpm) (fijación inicial).
PRECAUCIÓN: Se sabe que el paraformaldehído es alergénico, generalmente tóxico y extremadamente citotóxico. Siga estrictamente las instrucciones de seguridad y evite la inhalación y el contacto con la piel. - Use una placa de cultivo y ponga una gota de 1x PBS en la parte central y realice los siguientes pasos bajo un microscopio de disección y coloque un globo ocular en esta gota. Sostenga el globo ocular con un par de fórceps y perfore cuidadosamente la córnea en el limbo corneal con una aguja de jeringa de 1 ml. Inserte la punta de las tijeras en este orificio y corte la córnea cuidadosamente a lo largo del limbo de la córnea. Tenga cuidado de no cortar la retina.
- Retire el iris y el cristalino con un par de fórceps. Luego coloque el ocular restante en el PFA al 4% y fije nuevamente durante otros 45 minutos a temperatura ambiente en un agitador a una velocidad de 12-15 rpm (fijación secundaria).
- Use un plato de cultivo y ponga una gota de 1x PBS en la parte central. Coloque el globo ocular fijo en esta gota. Sostenga el globo ocular con un par de fórceps. Separe suavemente las capas de retina y esclerótica con dos fórceps. Coloque la punta de las tijeras entre las capas de retina y esclerótica y corte la esclerótica hacia el nervio óptico. Despegue la esclerótica de la retina y obtenga la copa retiniana.
NOTA: Sostenga la copa posterior por el nervio óptico con fórceps, luego use el extremo curvo de otro fórceps para presionar hacia abajo la esclerótica en la cabeza del nervio óptico y masajee suavemente la retina en un movimiento de barrido hacia adelante como alternativa para liberar la retina. - Use fórceps para liberar la conexión entre los vasos hialoides radiales y la retina periférica, sujete la raíz de los vasos hialoideos que está cerca de la cabeza del nervio óptico y corte los vasos hialoideos con cuidado.
- Use una pipeta de 2 ml con la punta cortada para transferir la copa retiniana. Coloque la copa retiniana en un pocillo en una placa de 48 pocillos y lávela durante 3 x 5 min con 1x PBS a temperatura ambiente en un agitador a una velocidad de 12-15 rpm.
- Incubar la copa retiniana en una solución mixta de Triton X-100 al 1% (en PBS) y suero de burro normal al 5% (en PBS) durante la noche a 4 °C.
- Alternativamente, bloquear y permeabilizar las retinas a temperatura ambiente durante 1 h como alternativa. Cambie el suero bloqueante de acuerdo con la fuente del anticuerpo secundario.
- Si se marca la vasculatura retiniana con isolectina B4, incubar la retina en un pocillo de placa de 48 pocillos con 0,1% de suero de burro normal (400 μL) e isolectinaB4-594 (1:400) durante la noche a 4 °C en un agitador a una velocidad de 12-15 rpm.
NOTA: Si marca los vasos sanguíneos con otros marcadores, como CD31, o marca otras células, use anticuerpos primarios específicos para etiquetarlos. - Incubar la retina con anticuerpos primarios específicos 1:100-1:500 (en 400 μL 0,1% de suero de burro normal) a 4 °C en un agitador a una velocidad de 12-15 rpm durante 48 h. (opcional)
- Después de volver a la temperatura ambiente, lave la retina con PBST al 0,1% (TritonX-100 al 0,1% en PBS) durante 3 x 20 min en un agitador a una velocidad de 12-15 rpm.
- Incubar la retina con 1:1.000 anticuerpos secundarios (en 400 μL 0,1% de suero de burro normal) durante la noche a 4 °C en un agitador a una velocidad de 12-15 rpm. (opcional)
- Alternativamente, incubar la retina con anticuerpos secundarios de alta afinidad a temperatura ambiente durante 1 h.
- Incubar la retina con DAPI (1:1.000) a temperatura ambiente durante 20-25 min para marcar el núcleo.
NOTA: Pruebe las proporciones de dilución óptimas para todos los anticuerpos utilizados en los pasos 10-11 y 13-14 en el pre-experimento. - Lave la retina durante 3 x 30 min con 0,1% de PBST en un agitador a una velocidad de 12-15 rpm a temperatura ambiente.
- Transfiera la copa retiniana a un portaobjetos limpio con la abertura hacia arriba. Corte la retina radialmente en las posiciones de las 3, 6, 9 y 12 en punto de periférica a central cortando aproximadamente 1-1.5 mm de distancia de la cabeza del nervio óptico.
- Agregue unas gotas de 1x PBS para enjuagar la retina tres veces. Use papel colocado al aire para secar y aplanar la retina. Agregue una gota de medio de montaje (consulte la Tabla de materiales) al centro del cubreobjetos y deje de agregarlo hasta que el diámetro de la gota aumente a la mitad del cubreobjetos. Voltee rápidamente el cubreobjetos y colóquelo encima de la retina extendida. Evite formar burbujas.
- Tome imágenes de los soportes planos de retina o guarde y proteja las diapositivas de la luz a 4 °C.
3. Análisis y cuantificación de soportes planos retinianos
NOTA: Para el modelo de ratón OIR, los investigadores a menudo registran el área de oclusión vascular central de la retina y la neovascularización patológica periférica de la retina durante P12-P25. Estudios previos han demostrado que el área avascular central de la retina alcanza el máximo en P12 y se reduce gradualmente de P13 a P17; al mismo tiempo, la retina de los ratones OIR alcanza el pico del área de neovascularización alrededor de P1722,29. A partir de P17, los neovasos retroceden gradualmente y los vasos funcionales vuelven a crecer en el área avascular. La vasculatura retiniana básicamente vuelve a la normalidad en P2533.
- Tome imágenes de monturas planas retinianas con un microscopio de fluorescencia (consulte la Tabla de materiales) con lente de objetivo 10x. Primero, elija el canal DAPI y coloque la cabeza del nervio óptico en el centro del campo visual. Luego, ajuste otros canales y concéntrese en la vasculatura superficial de la retina. Compruebe los mosaicos en un software fotográfico (consulte Tabla de materiales) y establezca el número de fotos que deben coserse. Haga clic en Iniciar experimento para capturar toda la retina.
- Use un programa de procesamiento de imágenes (consulte la Tabla de materiales) para cuantificar el área de vaso-obliteración (VO) y neovascularización (NV) después de la tinción de inmunofluorescencia.
- Primero, haga clic en la herramienta Varita mágica y establezca una tolerancia adecuada de acuerdo con la diferencia de brillo y mueva el cursor al fondo y haga clic con el mouse. A continuación, elija Seleccionar inversa para obtener un contorno básico de la retina. Utilice la herramienta Lazo para delinear aún más los detalles de la retina. Usando la función Histograma , registre el valor de píxeles de toda la retina y escríbalo o genere una tabla en un programa de base de datos.
- Divide la imagen de la retina en cuatro cuadrantes. En cada cuadrante, use la herramienta Lazo para dibujar el área VO (Figura 2A-C) y use la herramienta Varita mágica para seleccionar el área NV (Figura 2D-F). A través de la información de píxeles en el histograma, calcule la proporción de píxeles de VO y NV a toda la retina, es decir, el porcentaje de área de VO o NV en relación con toda la retina.
NOTA: También existe una canalización de código abierto y totalmente automatizada para la cuantificación de áreas VO y NV en imágenes OIR utilizando redes neuronales de aprendizaje profundo (http://oirseg.org/), que proporciona una forma confiable y de ahorro de tiempo para los investigadores, así como unifica el estándar de la cuantificación34.
- Registre la información de píxeles en una tabla de hoja de cálculo, lo cual es conveniente para el análisis posterior.
4. Imágenes in vivo con angiografía de fondo de fluoresceína (FFA)
NOTA: Para ratones OIR, tanto la perfusión FITC como la tinción de inmunofluorescencia solo se pueden usar una vez debido a la muerte de animales de experimentación. En comparación con esto, una de las ventajas de FFA es la observación de los cambios dinámicos de los vasos retinianos del ratón durante el desarrollo y el estado patológico in vivo35,36.
- Pesar a los cachorros antes de la anestesia.
- Anestesiar a las crías mediante inyección intraperitoneal de pentobarbital sódico al 0,3% a una dosis de 30-50 mg/kg.
NOTA: Para ratones dentro de 1 mes, preste atención a las dosis de anestesia. Use concentraciones y dosis más bajas de anestésico para reducir la muerte de ratones causada por la anestesia. Después de anestesiar a los cachorros, use una pequeña almohadilla térmica para mantener la temperatura corporal. La hipotermia no solo afecta la función fisiológica de los cachorros, sino que también conduce a cambios en la cristalina y acelera el desarrollo de cataratas. - Use gotas oftálmicas midriáticas de 20 μL (0,5% tropicamida + 0,5% clorhidrato de fenilefrina) para cada cachorro y espere 5 minutos para lograr una dilatación pupilar duradera (Figura 3A, B).
- Lleve a los cachorros anestesiados frente al dispositivo de imágenes (consulte la Tabla de materiales). Mantenga a los cachorros en una pequeña almohadilla térmica, colóquelos en una posición estable y use lágrimas artificiales regularmente para mantener la humedad en la córnea. Haga clic en el modo de imágenes infrarrojas del fondo de ojo (IR) para ajustar la cabeza del nervio óptico al centro de la pantalla.
NOTA: Al observar un ojo de los cachorros, no olvide proteger el otro ojo. Use gotas oftálmicas de hipromelosa para evitar que la córnea se blanquee debido a la sequedad. - Después de la inyección intraperitoneal de 0,15 ml de solución de sal de sodio fluoresceína al 0,5%, haga clic en el botón FA y en el botón Inyección inmediatamente en el panel táctil del dispositivo de imágenes para iniciar el cronometraje. Grabe las imágenes después de 3 minutos cuando la circulación sanguínea de la retina entre en la fase venosa y observe la retina no menos de 6-8 minutos.
NOTA: Después de la inyección intraperitoneal de solución salina de sodio fluoresceína, la piel, la mucosa y la orina de los cachorros muestran un verde amarillento evidente. La mayor parte de la fluoresceína es excretada por los cachorros en un día. La inyección de fluoresceína sódica por vía intraperitoneal cada dos días durante seis veces no causa efectos secundarios significativos37. - Mueva la cabeza del nervio óptico al centro del área de adquisición de imágenes y tome la primera imagen de la retina central. Luego, mueva la lente del dispositivo de imágenes horizontalmente hacia el lado nasal del ojo hasta que la cabeza del nervio óptico se encuentre en el punto medio de un lado del área de adquisición de imágenes y tome la segunda imagen. Continuar tomando imágenes de la retina temporal, superior e inferior, respectivamente utilizando este método (Figura 3C).
NOTA: Tome imágenes de "Cinco orientaciones" dentro de los 12 minutos a medida que ocurre la fase de regresión. Se permite que la posición de la cabeza del nervio óptico en la imagen inferior no caiga en la línea lateral debido al ajuste limitado del ángulo de la lente. - Guarde las imágenes y utilice un programa de procesamiento de imágenes para coser.
5. Procesamiento de imágenes de la angiografía con fondo de ojo de fluoresceína (FFA)
- Abra el programa de procesamiento de imágenes y haga clic en Nuevo en archivo para crear un nuevo lienzo con un fondo negro (Figura 4A).
- Abra primero una imagen de la retina central en la capa de fondo. Haga clic en Archivo y agregue la segunda imagen. Ajuste la opacidad de la segunda imagen al 60%, mueva y cambie el tamaño de la segunda imagen hasta que las mismas partes de las dos imágenes se superpongan altamente. Haga clic en el botón Cambiar entre los modos de transformación libre y deformación y realice ajustes sutiles en los recipientes si es necesario. Luego, vuelva a colocar la opacidad de la segunda imagen al 100% (Figura 4A, B).
- Seleccione dos imágenes al mismo tiempo y haga clic en Fusionar capas automáticamente. Marque Panorama como método de mezcla y seleccione las dos oraciones siguientes. Haga clic en Aceptar y termine la costura de la imagen de las dos primeras imágenes (Figura 4C, D).
- Tome las dos primeras imágenes cosidas como un todo, agregue la tercera imagen y continúe mezclando. Repita los métodos anteriores para completar la costura de cinco imágenes (Figura 4E).
- Utilice la herramienta Recortar para cortar imágenes de FFA en diferentes puntos de tiempo a un tamaño uniforme y observe cambios dinámicos de la vasculatura retiniana de P15 a P25 tanto en cachorros normales como OIR.
6. Análisis estadístico
- Presentar valores como media ± desviación estándar (d.e.).
- Utilice la prueba t de Student para comparar dos muestras independientes. Utilice ANOVA unidireccional para comparar múltiples conjuntos de datos y combinarlos con la prueba de Dunnett o Tukey, que es una prueba de comparación múltiple de uso común.
- Para datos no distribuidos normalmente, utilice la prueba U de Mann-Whitney o la prueba de Kruskal Wallis. Considere diferencias estadísticas significativas cuando P < 0,05.
Resultados
En el modelo de ratón OIR, el resultado más importante y básico es la cuantificación del área VO y NV. Después de vivir en el ambiente de hiperoxia durante 5 días desde P7, la retina central de las crías mostró el área de no perfusión más grande. Bajo la estimulación de la hipoxia en otros 5 días, se produjo gradualmente una neovascularización retiniana que fluoresceba más intensamente que los vasos normales circundantes. Después de P17, la señal de fluorescencia de neovascularización patológica retrocedió rápidamente como la remodelación de la retina (Figura 5A). Al controlar el tamaño de la camada y el aumento de peso postnatal de los cachorros, el área de VO y NV del modelo de ratón OIR mostró buena repetibilidad y estabilidad y el pico de neovascularización retiniana ocurrió en P17, lo que estuvo en línea con los estudios previos (Figura 5B, C).
FFA es una herramienta ideal para estudiar la vasculatura retiniana. Dada la aplicación de FFA in vivo, muestra una gran reducción en el desperdicio de animales de experimentación, así como muestra los cambios dinámicos de los vasos retinianos con el tiempo. En estudios anteriores, FFA no se usaba a menudo en cachorros de ratones y se presentaba en una imagen de vista única, lo que era difícil de estudiar más a fondo. En este protocolo, las imágenes de "cinco orientaciones" de la vasculatura de la retina se unieron utilizando un software de procesamiento de imágenes para mostrar un campo más amplio de la retina a la vez, lo que fue útil para el análisis posterior, si era necesario (Figura 4). Además, los cachorros de ratón OIR mostraron una apertura de ojos prolongada, por lo que las imágenes de FFA se tomaron desde P15 para cumplir con los requisitos de la ética animal. En la retina del modelo de ratón OIR, el diámetro de los vasos sanguíneos aumentó evidentemente y se volvió muy tortuoso en comparación con los ratones normales. Además, el FFA mostró una tendencia similar de cambios dinámicos de la vasculatura retiniana con tinción de inmunofluorescencia con isolectina B4-594 de P15-P25 sin la muerte de los cachorros (Figura 6).
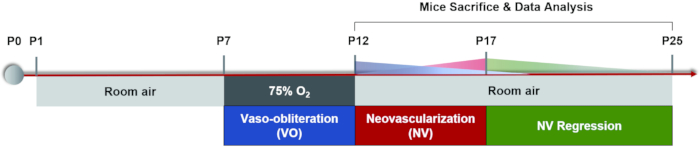
Figura 1: Esquema de dibujos animados del modelo de ratón OIR. El modelo de ratón OIR fue inducido manteniendo a los cachorros y sus madres lactantes en una habitación durante algún tiempo (P0-P7). En P7, ambos fueron expuestos al 75% de oxígeno durante 5 días, lo que inhibió el crecimiento de los vasos retinianos y causó una pérdida significativa de vasos en la retina central. Luego, los ratones fueron devueltos al aire ambiente en P12 y la retina avascular comenzó a volverse relativamente hipóxica, desencadenando tanto un nuevo crecimiento normal de los vasos como una respuesta patológica alrededor de la retina periférica media. La neovascularización máxima (NV) se observó en P17. Luego, la neovascularización patológica sufrió un proceso de regresión espontánea. El sistema vascular retiniano volvió a la normalidad alrededor de P25. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Medición de vaso-obliteración (VO) y neovascularización (NV) en la retina del ratón. (A) Imagen de 10x P12 OIR retinal de montaje entero teñido para células endoteliales con isolectina B4-594. (B) Captura de pantalla de una retina con el área avascular seleccionada. Las herramientas necesarias para realizar esta medición se resaltan con flechas blancas: Magic Wand Tool y Lasso Tool. (C) Resalte el área avascular de la retina y guarde la imagen como una copia. (D) Imagen de 10x P17 OIR retinal de montaje entero teñido para células endoteliales con isolectina B4-594. (E) Captura de pantalla de una retina con mechones neovasculares seleccionados. Use la herramienta Varita mágica y establezca una tolerancia óptima para resaltar NV. Establezca la tolerancia en 3-5 y marque las casillas anti-alias y contiguas. (F) Guardar el área de neovascularización sólo como una copia. Las barras de escala representan 1.000 μm. Haga clic aquí para ver una versión más grande de esta figura.
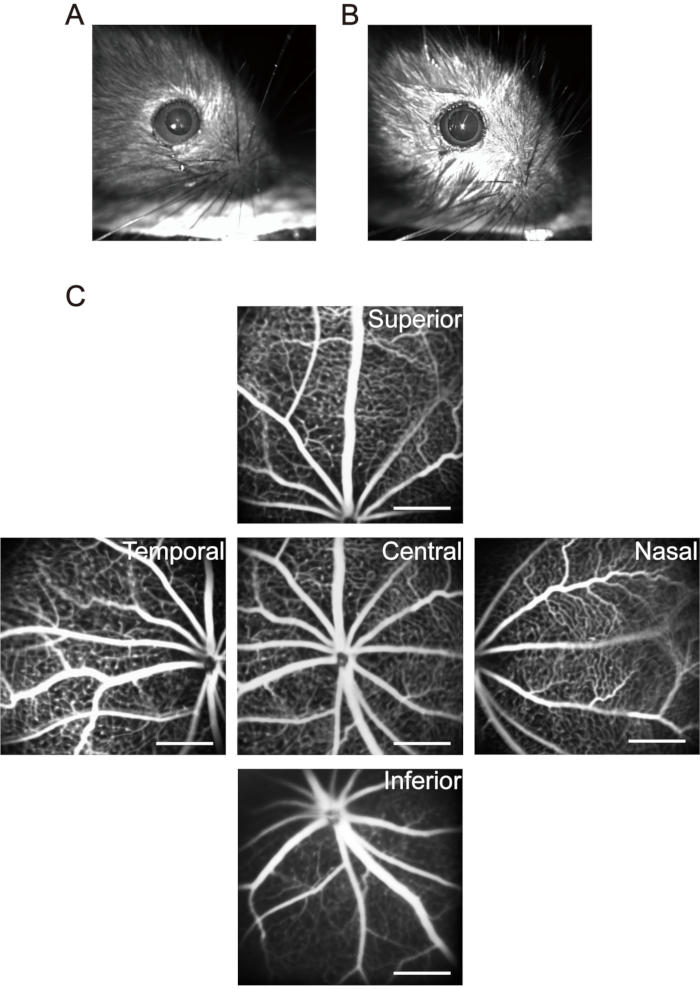
Figura 3: Adquisición de las imágenes de "Cinco orientaciones" en la retina del ratón. (A) La pupila normal del ratón. (B) Pupila de ratón en midriasis. (C) Se recogieron las imágenes de "cinco orientaciones" de la zona central, nasal, temporal, superior e inferior de la retina, respectivamente (crías P17 en aire ambiente). Las barras de escala representan 500 μm. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Flujo de trabajo general de unión de las imágenes de "cinco orientaciones" de la angiografía con fondo de ojo de fluoresceína (FFA). (A) Crear un nuevo lienzo con un fondo negro y abrir la imagen FFA de la retina central. (B) Abrir una imagen FFA de la retina temporal y ajustar la opacidad de la segunda imagen al 60%; Mueva y cambie el tamaño de la imagen hasta que las mismas partes de las dos imágenes se superpongan en gran medida. Haga clic en Cambiar entre los modos de transformación libre y deformación para realizar ajustes sutiles si es necesario. Vuelva a colocar la opacidad de la segunda imagen al 100%. (C) Seleccione dos imágenes al mismo tiempo y haga clic en Capas de mezcla automática. (D) Utilice Panorama como método de mezcla para terminar la unión de imágenes de las dos primeras imágenes. (E) Continúe cosiendo imágenes repitiendo los métodos anteriores para completar la unión de todas las imágenes. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Cuantificación de vaso-obliteración (VO) y neovascularización (NV) en la retina del modelo de ratón OIR. (A) Imagen de 10x monturas enteras de retina OIR teñidas para células endoteliales con isolectina B4-594 de P12 a P25. Después de estar expuestos al 75% de oxígeno durante 5 días, los cachorros y sus madres lactantes fueron devueltos al aire de la habitación en P12 en el que el área de vaso-obliteración alcanzó el máximo. La hipoxia relativa en la retina central condujo a un nuevo crecimiento de los vasos en esta área, así como a la angiogénesis patológica en la retina periférica media. En P17, los mechones neovasculares prerretinianos alcanzaron el máximo y luego se encogieron rápidamente. NV retrocedió completamente y la retina parecía ser normal alrededor de P25. (B) La cuantificación del área de VO mostró un pico en P12 y la desaparición alrededor de P25. (C) La cuantificación del área de NV mostró un pico en P17 y una regresión en alrededor de P25. Las barras de escala representan 1.000 μm en A. (ANOVA unidireccional, *P < 0,05, **P < 0,01, ***P < 0,001, **** P < 0,0001). Haga clic aquí para ver una versión más grande de esta figura.
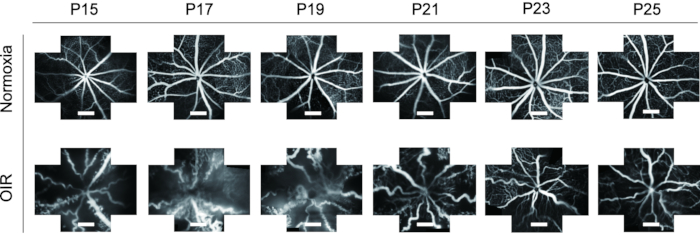
Figura 6: Imágenes in vivo de la angiografía del fondo de ojo de fluoresceína (FFA) en el modelo de ratón OIR. En la retina del modelo de ratón OIR, el diámetro de los vasos sanguíneos aumentó evidentemente y se volvió muy tortuoso en comparación con los ratones normales. Además, el FFA mostró una tendencia similar de cambios dinámicos de la vasculatura retiniana con tinción de inmunofluorescencia con isolectina B4-594 de P15-P25 sin la muerte de crías de ratones. Las barras de escala representan 500 μm. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
La susceptibilidad de los ratones a OIR se ve afectada por muchos factores. Los cachorros de diferentes antecedentes genéticos y cepas no se pueden comparar. En ratones albinos BALB/c, los vasos vuelven a crecer rápidamente en el área de VO con mechones neovasculares significativamente reducidos38, lo que trae algunas dificultades a la investigación. En ratones C57BL/6, hay un aumento del daño a los fotorreceptores en comparación con la cepa de ratón BALB/cJ39,40. Lo mismo ocurre con los diferentes tipos de ratones transgénicos41,42,43. Además, los ratones C57BL/6 muestran un nivel más bajo de angiogénesis en comparación con los ratones 129S3/SvIM44.
El aumento de peso postnatal (PWG) también es importante considerar45 y es uno de los indicadores para evaluar el estado nutricional de los recién nacidos. También se ha convertido en un método confiable para predecir ROP, lo que atrae la atención de muchos modeladores de animales46. PWG afecta la respuesta de los ratones a la hiperoxia y la hipoxia. En P7, las crías con aumento de peso corporal (>5 g) muestran una vaso-obliteración insuficiente y neovascularización retiniana, mientras que las crías con disminución del peso corporal (<5 g) muestran una respuesta obvia a la hiperoxia y la hipoxia. Además, en P17, los cachorros con un aumento de peso pobre (<5 g) y extenso (>7,5 g) muestran una disminución de NV. Sin embargo, las crías con poco aumento de peso (<5 g) tienen una etapa de vaso-obliteración (VO) y neovascularización (NV) significativamente prolongada con un retraso en la aparición de NV pico45. Por lo tanto, es necesario registrar y controlar el PWG de los cachorros en P7 y P17 y eliminar los cachorros con PWG bajo (< 6 g en P17) para garantizar la repetibilidad y comparabilidad del experimento.
El tamaño de la camada tiene un mayor impacto en PWG, y algunos investigadores sugieren que debe limitarse a 6-8 cachorros / madre para cumplir con los requisitos de PWG22,31. El estado de la madre lactante también necesita una consideración. Las madres lactantes tienen más probabilidades de morir por daño pulmonar en un ambiente hiperóxico47. Si las madres lactantes mueren o descuidan a sus cachorros durante y después de la inducción de OIR, los cachorros perderán peso fácilmente o incluso morirán debido a la falta de nutrición32. Por lo tanto, es necesario asegurarse de que haya suficientes madres sustitutas para reemplazarlas. Sin embargo, se sugiere que estas madres sustitutas sean utilizadas solo cuando la madre expire, lo que generalmente ocurre durante el período de exposición a la hiperoxia o retorno al aire ambiente22. Proporcionar alimentos adecuados para las madres lactantes también es útil para mejorar el estado nutricional de sus cachorros.
Una nota útil para preparar los soportes planos retinianos es que generalmente es necesario un momento óptimo de fijación para una tinción adicional a largo plazo. Como ratones de P12-P25, se recomienda una fijación de 15 min + 45 min a temperatura ambiente29. Fijar la retina a 4 °C durante la noche es una alternativa si el tiempo es limitado. Además, el tampón permeable y bloqueante con una mayor concentración de 1% Triton X-100 y 5% de suero de burro normal reduce efectivamente el fondo de tinción de inmunofluorescencia según nuestra experiencia.
La tinción de isolectina B4 y la perfusión FITC-dextrano son métodos comúnmente utilizados para visualizar y cuantificar el neovascular48,49. Una limitación importante de estos dos métodos es que los ratones deben ser sacrificados. Por lo tanto, los métodos para la imagen in vivo y la cuantificación de NV son necesarios29. Paques et al. desarrollaron una técnica llamada imagen de fondo de ojo de endoscopia tópica (TEFI), que proporciona fotografías digitales de alta resolución de la retina en ratones vivos50. El TEFI puede detectar cambios vasculares retinianos ya en P15 y las imágenes obtenidas están de acuerdo con los métodos convencionales de evaluación. Mezu-Ndubuisi et al. proporcionaron los métodos para mediciones in vivo de la tensión vascular retiniana de oxígeno (PO2) y angiografía fluoresceínica (AF), mejorando la comprensión de los cambios vasculares retinianos y las alteraciones de oxigenación debidas a ROP y otras enfermedades isquémicas de la retina37. Aunque ni TEFI ni FA son tan precisos como los métodos convencionales, reducen la muerte de animales de experimentación y se pueden realizar repetidamente. Además, permiten que cada ratón sirva como su propio control, lo que hace que los datos OIR sean más comparables. En este documento, se proporciona un método mejorado de imágenes FFA y costura de imágenes. Realizar FFA en cachorros dentro de 1 mes no es fácil porque la anestesia excesiva y la hipotermia causan directamente la muerte de los cachorros. Por lo tanto, trate de usar la dosis mínima de anestesia y preste especial atención a mantener la temperatura corporal de los cachorros durante y después del proceso mediante el uso de una pequeña almohadilla térmica. Siempre humedezca la superficie ocular con solución salina e hipromelosa en caso de fracaso de la siguiente observación.
En resumen, el modelo de ratón OIR es un modelo muy común y ampliamente utilizado de isquemia retiniana y neovascularización patológica. Uno de los principales problemas de este modelo es que las crías de ratones neonatos son esencialmente sanas y no tienen inestabilidad metabólica o problemas respiratorios en comparación con los bebés nacidos prematuramente. Otra diferencia entre el modelo de ratón OIR y los humanos es que siempre hay proliferación fibrovascular en la neovascularización retiniana humana, mientras que el neovascular retiniano no está asociado con fibrosis en el modelo de ratón OIR51. Para hacer un mejor uso de este modelo y adquirir más información, se proporciona una descripción detallada del uso de FFA para monitorear los cambios dinámicos de la vasculatura retiniana OIR, incluidos los métodos para tomar imágenes de "Cinco orientaciones" y el procesamiento de imágenes. Se cree que la FFA se convertirá en un método eficaz parcial o totalmente para reemplazar la tinción de inmunofluorescencia para observar y evaluar la morfología y función de la vasculatura retiniana49. Aunque el modelo de ratón OIR no se parece completamente al microambiente y la patogénesis de varias retinopatía isquémica en humanos, nos brinda la oportunidad de realizar experimentos farmacológicos y transgénicos, así como de explorar el mecanismo de angiogénesis patológica en la retina isquémica51.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Agradecemos a todos los miembros de nuestro laboratorio y del Laboratorio de Animales Oftálmicos del Centro Oftalmológico Zhongshan por su asistencia técnica. También agradecemos al Prof. Chunqiao Liu por su apoyo experimental. Este trabajo fue apoyado por subvenciones de la Fundación Nacional de Ciencias Naturales de China (NSFC: 81670872; Beijing, China), la Fundación de Ciencias Naturales de la provincia de Guangdong, China (Subvención No.2019A1515011347), y el proyecto de construcción de hospitales de alto nivel del Laboratorio Estatal Clave de Oftalmología en el Centro Oftalmológico Zhongshan (Subvención No. 303020103; Guangzhou, provincia de Guangdong, China).
Materiales
| Name | Company | Catalog Number | Comments |
| 1 mL sterile syringe | Solarbio | YA0550 | For preparation of retinal flat mounts and intraperitoneal injection |
| 1× Phosphate buffered saline (PBS) | Transgen Biotech | FG701-01 | For preparation of retinal flat mounts |
| 2 ml Microcentrifuge Tube | Corning | MCT-200-C | For preparation of retinal flat mounts |
| 48 Well Clear TC-Treated Multiple Well Plates | Corning | 3548 | For preparation of retinal flat mounts |
| Adhesive microscope slides | Various | For preparation of retinal flat mounts | |
| Adobe Photoshop CC 2019 | Adobe Inc. | For image analysis | |
| Carbon dioxide gas | Various | For sacrifice | |
| Cover slide | Various | For preparation of retinal flat mounts | |
| Curved forceps | World Precision Instruments | 14127 | For preparation of retinal flat mounts |
| DAPI staining solution | Abcam | ab228549 | For labeling nucleus on retinal flat mounts |
| Dissecting microscope | Olmpus | SZ61 | For preparation of retinal flat mounts |
| Fluorescein sodium | Sigma-Aldrich | F6377 | For in vivo imaging |
| Fluorescent Microscope | Zeiss | AxioImager.Z2 | For acquisition of fluorescence images of retinal flat mounts |
| Fluoromount-G Mounting media | SouthernBiotech | 0100-01 | For preparation of retinal flat mounts |
| Hydroxypropyl Methylcellulose | Maya | 89161 | For in vivo imaging |
| Isolectin B4 594 antibody | Invitrogen | I21413 | For labeling retinal vasculature on retinal flat mounts |
| Mice C57/BL6J | GemPharmatech of Jiangsu Province | For OIR model induction | |
| Micro dissecting scissors-straight blade | World Precision Instruments | 503242 | For preparation of retinal flat mounts |
| No.4 straight forceps | World Precision Instruments | 501978-6 | For preparation of retinal flat mounts |
| Normal donkey serum | Abcam | ab7475 | For preparation of retinal flat mounts |
| O2 sensor | Various | For monitoring the level of O2 | |
| OxyCycler | Biospherix | A84XOV | For OIR model induction |
| Paraformaldehyde (PFA) | Sigma | P6148-1KG | For tissue fixation |
| Pentobarbital sodium | Various | For anesthesia | |
| Soda lime | Various | For absorbing excess CO2 in the oxygen chamber | |
| SPECTRALIS HRA+OCT | Heidelberg | HC00500002 | For in vivo imaging |
| SPSS Statistics 22.0 | IBM | For statistical analysis | |
| Tansference decloring shaker | Kylin-Bell | ZD-2008 | For preparation of retinal flat mounts |
| Tissue culture dish (Low attachment) | Corning | 3261-20EA | For preparation of retinal flat mounts |
| Transfer pipettes | Various | For preparation of retinal flat mounts | |
| Triton X-100 | Sigma-Aldrich | SLBW6818 | For preparation of retinal flat mounts |
| Tropicamide | Various | For in vivo imaging | |
| ZEN Imaging Software | ZEISS | For image acquisition and export |
Referencias
- Vavvas, D. G., Miller, J. W. Chapter 26 - Basic Mechanisms of Pathological Retinal and Choroidal Angiogenesis. Retina (Fifth Edition). 1, 562-578 (2013).
- Selvam, S., Kumar, T., Fruttiger, M. Retinal vasculature development in health and disease. Progress in Retinal and Eye Research. 63, 1-19 (2018).
- Shimizu, K., Kobayashi, Y., Muraoka, K. Midperipheral fundus involvement in diabetic retinopathy. Ophthalmology. 88 (7), 601-612 (1981).
- Ashton, N. Retinal vascularization in health and disease: Proctor Award Lecture of the Association for Research in Ophthalmology. American Journal of Ophthalmology. 44 (4), 7-17 (1957).
- Hellström, A., Smith, L. E., Dammann, O. Retinopathy of prematurity. Lancet. 382 (9902), 1445-1457 (2013).
- Xu, Y., et al. Melatonin attenuated retinal neovascularization and neuroglial dysfunction by inhibition of HIF-1α-VEGF pathway in oxygen-induced retinopathy mice. Journal of Pineal Research. 64 (4), 12473 (2018).
- Cavallaro, G., et al. The pathophysiology of retinopathy of prematurity: an update of previous and recent knowledge. Acta Ophthalmologica. 92 (1), 2-20 (2014).
- Gilbert, C., Rahi, J., Eckstein, M., O'Sullivan, J., Foster, A. Retinopathy of prematurity in middle-income countries. Lancet. 350 (9070), 12-14 (1997).
- Chen, J., Smith, L. E. Retinopathy of prematurity. Angiogenesis. 10 (2), 133-140 (2007).
- Fielder, A., Blencowe, H., O'Connor, A., Gilbert, C. Impact of retinopathy of prematurity on ocular structures and visual functions. Archives of Disease in Childhood. Fetal and Neonatal Edition. 100 (2), 179-184 (2015).
- Moshfeghi, D. M. Presumed transient reactive astrocytic hyperplasia in immature retina. Retina. 26, 69-73 (2006).
- Kandasamy, Y., Hartley, L., Rudd, D., Smith, R. The association between systemic vascular endothelial growth factor and retinopathy of prematurity in premature infants: a systematic review. British Journal of Ophthalmology. 101 (1), 21-24 (2017).
- Shah, P. K., et al. Retinopathy of prematurity: Past, present and future. World Journal of Clinical Pediatrics. 5 (1), 35-46 (2016).
- Kinsey, V. E. Retrolental fibroplasia; cooperative study of retrolental fibroplasia and the use of oxygen. AMA Archives of Ophthalmology. 56 (4), 481-543 (1956).
- Tin, W., Gupta, S. Optimum oxygen therapy in preterm babies. Archives of Disease in Childhood. Fetal and Neonatal Edition. 92 (2), 143-147 (2007).
- Liu, C. H., Wang, Z., Sun, Y., Chen, J. Animal models of ocular angiogenesis: from development to pathologies. FASEB Journal : Official Publication of the Federation of American Societies for Experimental Biology. 31 (11), 4665-4681 (2017).
- Ashton, N., Ward, B., Serpell, G. Effect of oxygen on developing retinal vessels with particular reference to the problem of retrolental fibroplasia. The British Journal of Ophthalmology. 38 (7), 397-432 (1954).
- Penn, J. S., Tolman, B. L., Lowery, L. A. Variable oxygen exposure causes preretinal neovascularization in the newborn rat. Investigative Ophthalmology & Visual Science. 34 (3), 576-585 (1993).
- Smith, L. E., et al. Oxygen-induced retinopathy in the mouse. Investigative Ophthalmology & Visual Science. 35 (1), 101-111 (1994).
- McLeod, D. S., Brownstein, R., Lutty, G. A. Vaso-obliteration in the canine model of oxygen-induced retinopathy. Investigative Ophthalmology & Visual Science. 37 (2), 300-311 (1996).
- Cao, R., Jensen, L. D., Söll, I., Hauptmann, G., Cao, Y. Hypoxia-induced retinal angiogenesis in zebrafish as a model to study retinopathy. PLoS One. 3 (7), 2748 (2008).
- Connor, K. M., et al. Quantification of oxygen-induced retinopathy in the mouse: a model of vessel loss, vessel regrowth and pathological angiogenesis. Nature Protocols. 4 (11), 1565-1573 (2009).
- Fruttiger, M. Development of the mouse retinal vasculature: angiogenesis versus vasculogenesis. Investigative Ophthalmology & Visual Science. 43 (2), 522-527 (2002).
- Stahl, A., et al. The mouse retina as an angiogenesis model. Investigative Ophthalmology & Visual Science. 51 (6), 2813-2826 (2010).
- Rivera, J. C., et al. Ischemic retinopathies: oxidative stress and inflammation. Oxidative Medicine and Cellular Longevity. 2017, 3940241 (2017).
- Bashinsky, A. L. Retinopathy of prematurity. North Carolina Medical Journal. 78 (2), 124-128 (2017).
- Flynn, J. T., et al. Retinopathy of prematurity. Diagnosis, severity, and natural history. Ophthalmology. 94 (6), 620-629 (1987).
- Aguilar, E., et al. Chapter 6. Ocular models of angiogenesis. Methods in Enzymology. 444, 115-158 (2008).
- Liegl, R., Priglinger, C., Ohlmann, A. Induction and readout of oxygen-induced retinopathy. Methods in Molecular Biology. 1834, 179-191 (2019).
- Lutty, G. A., McLeod, D. S. Retinal vascular development and oxygen-induced retinopathy: a role for adenosine. Progress in Retinal and Eye Research. 22 (1), 95-111 (2003).
- Vähätupa, M., et al. Oxygen-induced retinopathy model for ischemic retinal diseases in rodents. Journal of Visualized Experiments: JoVE. (163), (2020).
- Kim, C. B., D'Amore, P. A., Connor, K. M. Revisiting the mouse model of oxygen-induced retinopathy. Eye and Brain. 8, 67-79 (2016).
- Gammons, M. V., Bates, D. O. Models of oxygen induced retinopathy in rodents. Methods in Molecular Biology. 1430, 317-332 (2016).
- Xiao, S., et al. Fully automated, deep learning segmentation of oxygen-induced retinopathy images. Journal of Clinical Investigation Insight. 2 (24), (2017).
- McLeod, D. S., D'Anna, S. A., Lutty, G. A. Clinical and histopathologic features of canine oxygen-induced proliferative retinopathy. Investigative Ophthalmology & Visual Science. 39 (10), 1918-1932 (1998).
- Penn, J. S., Johnson, B. D. Fluorescein angiography as a means of assessing retinal vascular pathology in oxygen-exposed newborn rats. Current Eye Research. 12 (6), 561-570 (1993).
- Mezu-Ndubuisi, O. J., et al. In vivo retinal vascular oxygen tension imaging and fluorescein angiography in the mouse model of oxygen-induced retinopathy. Investigative Ophthalmology & Visual Science. 54 (10), 6968-6972 (2013).
- Zeilbeck, L. F., Müller, B., Knobloch, V., Tamm, E. R., Ohlmann, A. Differential angiogenic properties of lithium chloride in vitro and in vivo. PLoS One. 9 (4), 95546 (2014).
- Walsh, N., Bravo-Nuevo, A., Geller, S., Stone, J. Resistance of photoreceptors in the C57BL/6-c2J, C57BL/6J, and BALB/cJ mouse strains to oxygen stress: evidence of an oxygen phenotype. Current Eye Research. 29 (6), 441-447 (2004).
- Zhang, Q., Zhang, Z. M. Oxygen-induced retinopathy in mice with retinal photoreceptor cell degeneration. Life Sciences. 102 (1), 28-35 (2014).
- Okamoto, N., et al. Transgenic mice with increased expression of vascular endothelial growth factor in the retina: a new model of intraretinal and subretinal neovascularization. The American Journal of Pathology. 151 (1), 281-291 (1997).
- Ohlmann, A., et al. Norrin promotes vascular regrowth after oxygen-induced retinal vessel loss and suppresses retinopathy in mice. The Journal of Neuroscience. 30 (1), 183-193 (2010).
- Fang, L., Barber, A. J., Shenberger, J. S. Regulation of fibroblast growth factor 2 expression in oxygen-induced retinopathy. Investigative Ophthalmology & Visual Science. 56 (1), 207-215 (2014).
- Chan, C. K., et al. Differential expression of pro- and antiangiogenic factors in mouse strain-dependent hypoxia-induced retinal neovascularization. Laboratory Investigation. 85 (6), 721-733 (2005).
- Stahl, A., et al. Postnatal weight gain modifies severity and functional outcome of oxygen-induced proliferative retinopathy. The American Journal of Pathology. 177 (6), 2715-2723 (2010).
- Vanhaesebrouck, S., et al. Association between retinal neovascularization and serial weight measurements in murine and human newborns. European Journal of Ophthalmology. 23 (5), 678-682 (2013).
- Gerschman, R., Nadig, P. W., Snell, A. C., Nye, S. W. Effect of high oxygen concentrations on eyes of newborn mice. The American Journal of Physiology. 179 (1), 115-118 (1954).
- Lange, C., et al. Kinetics of retinal vaso-obliteration and neovascularisation in the oxygen-induced retinopathy (OIR) mouse model. Graefe's Archive for Clinical and Experimental Ophthalmology. 247 (9), 1205-1211 (2009).
- Huang, S., et al. Comparison of dextran perfusion and GSI-B4 isolectin staining in a mouse model of oxygen-induced retinopathy. Eye Science. 30 (2), 70-74 (2015).
- Paques, M., et al. Panretinal, high-resolution color photography of the mouse fundus. Investigative Ophthalmology & Visual Science. 48 (6), 2769-2774 (2007).
- Fletcher, E. L., et al. Animal models of retinal disease. Progress in Molecular Biology and Translational Science. 100, 211-286 (2011).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados