Method Article
산소 유발 망막병증 마우스 모델에서 망막 혈관의 동적 성장 모니터링
요약
이 프로토콜은 망막 플랫 마운트 마우스의 제조 및 면역형광 염색 및 분석을 위한 상세한 방법을 기술한다. 마우스 새끼를위한 fluorescein 안저 혈관 조영술 (FFA)의 사용 및 이미지 처리도 자세히 설명되어 있습니다.
초록
산소 유발 망막병증(OIR)은 미숙아 망막병증(ROP), 증식성 당뇨병성 망막병증(PDR) 및 망막 정맥 폐색(RVO)을 포함한 허혈성 망막 질환에서 비정상적인 혈관 성장을 연구하는 데 널리 사용됩니다. 대부분의 OIR 연구는 특정 시점에서 망막 신생 혈관을 관찰합니다. 그러나 OIR 관련 혈관 질환을 이해하는 데 필수적인 시간 경과에 따른 살아있는 마우스의 동적 혈관 성장은 연구되지 않았습니다. 여기에서는 OIR 마우스 모델의 유도를 위한 단계별 프로토콜을 설명하고, 잠재적인 위험을 강조하며, 면역형광 염색을 사용하여 혈관 소색(VO) 및 신생혈관(NV) 영역을 신속하게 정량화하는 개선된 방법을 제공합니다. 더 중요한 것은 OIR 마우스 모델에서 플루오레세인 안저 혈관조영술(FFA)을 수행하여 P15에서 P25까지의 살아있는 마우스에서 혈관 재성장을 모니터링했다는 것입니다. OIR 마우스 모델에 FFA를 적용하면 혈관 재성장 중 리모델링 과정을 관찰 할 수 있습니다.
서문
새로운 병리학 혈관이 기존 망막 정맥에서 시작되는 상태로 정의되는 망막 신생 혈관 형성 (RNV)은 일반적으로 망막의 내부 표면을 따라 확장되어 유리체 (또는 일부 조건에서는 망막 하 공간)로 성장합니다 1. 이는 미숙아 망막병증(ROP), 망막 정맥 폐색(RVO) 및 증식성 당뇨병성 망막병증(PDR)을 포함한 많은 허혈성 망막병증의 특징이자 공통적인 특징입니다2.
수많은 임상 및 실험 관찰에 따르면 허혈이 망막 신생 혈관의 주요 원인입니다 3,4. ROP에서 신생아는 생존율을 높이기 위해 밀폐 된 인큐베이터에서 높은 수준의 산소에 노출되며, 이는 혈관 성장을 막는 중요한 동인이기도합니다. 치료가 끝나면 신생아의 망막은 상대적으로 저산소 기간을 경험합니다5. RVO에서 중앙 또는 가지 망막 정맥의 폐색에서 다른 상황이 나타나고 PDR2에서 미세 혈관 병증으로 인한 망막 모세 혈관의 손상도 관찰됩니다. 저산소증은 저산소증 유도 인자 -1α (HIF-1α) 신호 전달 경로를 통해 혈관 내피 성장 인자 (VEGF)와 같은 혈관 형성 인자의 발현을 더욱 증가시켜 혈관 내피 세포가 저산소 영역으로 성장하고 새로운 혈관을 형성하도록 유도합니다 6,7.
ROP는 미숙아의 혈관 증식성 망막병증의 일종이며 망막 저산소증, 망막 신생혈관 및 섬유성 증식증10,11,12를 특징으로 하는 소아 실 명 8,9의 주요 원인입니다. 1950년대에 연구자들은 고농도의 산소가 미숙아의 호흡기 증상을 크게 개선할 수 있음을 발견했습니다13,14. 그 결과, 산소 요법은 그 당시 미숙아에서 점점 더 많이 사용되었습니다15. 그러나 미숙아에서 산소 요법이 널리 사용됨에 따라 ROP의 발병률은 해마다 증가했습니다. 그 이후로 연구자들은 산소를 ROP에 연결하여 ROP와 RNV16의 발병 기전을 이해하기 위해 다양한 동물 모델을 탐색했습니다.
인간의 경우 대부분의 망막 혈관 발달은 출생 전에 완료되는 반면 설치류에서는 망막 혈관 구조가 출생 후에 발달하여 망막 혈관 구조2에서 혈관 신생을 연구하기위한 접근 가능한 모델 시스템을 제공합니다. 연구의 지속적인 진행과 함께, 산소 유도 망막병증 (OIR) 모델은 허혈로 인한 병리학적 혈관신생을 모방하기 위한 주요 모델이 되었다. OIR 모델의 연구에는 특정 동물 종이 없으며 모델은 새끼 고양이 17, 쥐18, 마우스19, 비글 강아지 20 및 제브라 피쉬21을 포함한 다양한 동물 종에서 개발되었습니다. 모든 모델은 초기 망막 발달 동안 과산소증에 노출된 다음 정상 환경으로 되돌아가는 동일한 메커니즘을 공유합니다. Smith et al. 마우스 새끼를 P7의 과산소증에 5일 동안 노출시키면 중앙 망막에서 극단적인 형태의 혈관 퇴행이 유발되고 P12에서 실내 공기로 다시 가져오면 유리체(19)쪽으로 자라는 신생 혈관 술이 점차적으로 유발된다는 것을 관찰했습니다. 이것은 스미스 모델로도 명명 된 표준화 된 OIR 마우스 모델이었습니다. Connor et al.은 프로토콜을 더욱 최적화하고 2009 년에 VO (혈관 소멸) 및 NV (신생 혈관)의 면적을 정량화하기 위해 보편적으로 적용 가능한 방법을 제공하여 모델22의 수용과 활용도를 높였습니다. OIR 마우스 모델은 작은 크기, 빠른 번식, 명확한 유전적 배경, 우수한 반복성 및 높은 성공률로 인해 현재 가장 널리 사용되는 모델입니다.
생쥐에서 망막 혈관 형성은 출생 후 시신경 머리에서 혈관이 오라 세라 타쪽으로 망막 내부로 내 성장하면서 시작됩니다. 정상적인 망막 발달 동안 첫 번째 망막 혈관은 출생 전후 시신경 머리에서 돋아나 출생 후 7일(P7)23 주변의 주변에 도달하는 확장 네트워크(일차 신경총)를 형성합니다. 그런 다음 혈관은 망막으로 성장하기 시작하여 깊은 층을 형성하고 망막을 관통하며 인간24에서와 같이 내부 핵층 (INL) 주위에 층류 네트워크를 구축합니다. 출생 후 3 주 (P21)가 끝날 무렵, 더 깊은 신경총 발달이 거의 완료됩니다. OIR 마우스 모델의 경우, 혈관 폐색은 고 산소 노출 동안 중앙 영역에서 많은 수의 미성숙 혈관 네트워크의 급속한 퇴행으로 인해 항상 중심 망막에 나타납니다. 따라서 병리학 적 신생 혈관의 성장은 비 관류 영역과 혈관 영역의 경계 인 중간 말초 망막에서도 발생합니다. 그러나 인간의 망막 혈관은 출생 전에 거의 형성되었습니다. 미숙아의 경우, 말초 망막은 고 산소 증25,26에 노출되었을 때 완전히 혈관 화되지 않습니다. 따라서 혈관 폐색과 신생 혈관은 주로 말초 망막27,28에서 나타납니다. 이러한 차이에도 불구하고, 마우스 OIR 모델은 허혈-유도된 신생혈관형성 동안 발생하는 병리학적 사건을 면밀히 요약한다.
OIR 모델의 유도는 2 단계로 나눌 수 있습니다 (29) : 제 1 상 (고 옥시아 단계)에서, 망막 혈관 발달은 VEGF의 감소 및 내피 세포의 세포 사멸의 결과로 혈관의 폐색 및 퇴행으로 정지되거나 지연된다24,30; 2 단계 (저산소증 단계)에서는 망막 산소 공급이 실내 공기 조건 29 하에서 불충분 해지게되며, 이는 신경 발달 및 항상성19,31에 필수적입니다. 이 허혈성 상황은 일반적으로 조절되지 않은 비정상적인 신생 혈관을 초래합니다.
현재, 일반적으로 사용되는 모델링 방법은 고산소 / 저 산소 노출을 번갈아 가며 사용하는 것입니다 : 어미와 새끼는 P7에서 5 일 동안 75 % 산소에 노출 된 다음 P17이 OIR 마우스 모델 유도의 종점 인 비교 가능한 결과22를 입증 할 때까지 실내 공기에서 5 일 동안 노출됩니다. (그림 1). ROP를 시뮬레이션하는 것 외에도 이 허혈 매개 병리학적 신생혈관은 다른 허혈성 망막 질환을 연구하는 데에도 사용할 수 있습니다. 이 모델의 주요 측정에는 면역 형광 염색 또는 FITC- 덱스 트란 관류에 의해 망막 플랫 마운트에서 분석 된 VO 및 NV의 면적을 정량화하는 것이 포함됩니다. 각 마우스는 치명적인 수술 때문에 한 번만 연구 할 수 있습니다. 현재, 혈관 퇴행 및 병리학 적 혈관 신생 과정 동안 망막 혈관계의 동적 변화를 지속적으로 관찰하는 방법은 거의 없다32. 이 백서에서는 OIR 마우스 모델의 두 단계에서 혈관 동적 변화에 대한 보다 포괄적인 이해를 얻는 데 도움이 될 마우스에 대한 플루오레세인 안저 혈관 조영술(FFA)의 워크플로뿐만 아니라 OIR 모델 유도, 망막 플랫 마운트 분석에 대한 자세한 프로토콜을 제공합니다.
프로토콜
마우스 사용과 관련된 모든 절차는 중국 쑨원대학교 중산 안과 센터의 동물 실험 윤리 위원회(승인 번호: 2020-082)와 중산 안과 센터의 동물 관리 및 사용 위원회의 승인된 지침과 안과 및 시력 연구에서 동물 사용에 대한 시력 및 안과 협회(ARVO) 성명서의 승인에 따라 승인되었습니다.
1. 마우스 OIR 모델의 유도
- 눈의 선천성 기형 비율이 낮은 마우스(예: C57BL/6J 마우스)를 사용하고 수컷/암컷 = 1:2의 비율로 짝짓기합니다. 같은 날 태어난 새끼를 데리고 P7에서 OIR 모델을 유도하기 시작합니다. 모델링하기 전에 마우스 강아지의 체중을 엄격하게 기록하십시오.
참고: 생년월일은 P0으로 기록해 둡니다. 각 마우스의 무게를 정기적으로 기록하십시오. 신생아 새끼의 체중은 산소에 대한 다른 상태의 마우스의 민감도가 다르기 때문에 OIR을 유도하는 동안 매우 중요합니다. 비교 가능한 결과를 얻으려면 P5에서 7g 이상의 새끼를 제외하십시오. - 온도를 23 ° C± 2 ° C로 설정하고, 습도를 40 % -65 %로 제어하고, 매일 12 시간의 빛과 12 시간의 어둠을 번갈아 가며, 둥지를 짓기 위해 새장에 면봉을 추가하고, 적절한 살균 된 음식과 물을 보장하고, 개별 환기 케이지 (IVC)에 보관하는 등 수유부와 새끼에게 적합한 생활 환경을 제공합니다.
- 챔버 내부의 습도 및 온도 수준을 모니터링하십시오. 습도를 40%에서 65% 사이로 제어하고 온도를 23°C± 2°C로 유지하십시오.
- 산소 센서로 산소 공급을 확인하고 75%에서 일정한 산소 수준을 유지하고 산소 유량을 0.5-0.75L/min으로 제어합니다. 챔버 바닥에 소다 라임 50g을 넣어 과도한 CO2를 흡수하고 CO2 값을 3 % 22 미만으로 유지하십시오.
- 둥지 짓기 행동, 새끼를 물기, 수유 거부와 같은 수유부의 행동을 적어도 하루에 한 번 모니터링하십시오. 가난한 모성을 가진 간호 어머니를 제거하십시오.
- P7 새끼(수컷과 암컷)와 수유부를 산소 수준이 75%인 산소 챔버에 5-5일 동안 12%를 넣습니다. 모델 유도 기간 동안 챔버를 불필요하게 열지 마십시오. 수유부가 과산소증 상태에서 폐 손상으로 사망하는 경우를 대비하여 교체할 추가 대리모가 있는지 확인하십시오.
알림: 실험의 비교 가능성을 보장하려면 각 어미에 대해 6-8 마리의 새끼로 수를 제한하십시오. 일부 수유부의 사망을 초래하는 산소 독성의 잠재적 인 문제에주의하십시오. 수유부의 고산소 성 폐 손상의 징후에는 호흡 수 변동, 활동 감소 및 수유 감소가 포함되지만 이에 국한되지는 않습니다. 위와 같은 현상이 발생하면 수유부를 가능한 한 빨리 1 % 펜토 바르비탈 나트륨 (50mg / kg)으로 안락사시킵니다. 교체를 위해 일부 대리모(예: 129S1/SvImJ)를 준비하고 필요한 경우에만 사용하십시오. 수유부를 일상적으로 교체하는 것은 권장되지 않는데, 이는 산소 챔버가 자주 열리 며 불안정한 산소 수준과 모성 침략을 초래합니다. - 새끼와 수유부를 P12의 실내 공기로 다시 가져오고 P17까지 모든 새끼의 체중을 지속적으로 모니터링하십시오. 각 실험 그룹이 유사한 체중 분포를 갖도록 체중을 기준으로 새끼를 그룹화합니다.
2. 망막 전체 마운트 및 면역 형광 염색의 제조
- 새끼의 체중을 기록하십시오. 과다 복용 마취제 (1 % 펜토 바르비탈 나트륨 50mg / kg) 또는 CO2 흡입으로 새끼를 희생하십시오. 필요한 경우 자궁 경부 탈구 및 양측 개흉술과 같은 다른 안락사 방법을 사용할 수 있습니다.
- 구부러진 가위를 사용하여 안구와 안와 조직 사이의 연결을 해제하십시오. 그런 다음 구부러진 집게를 안구의 뒤쪽 부분에 넣고 시신경을 고정하고 안와에서 눈을 빠르게 들어 올립니다. 미리 냉각된 1x 인산염 완충 식염수(PBS)로 안구를 씻어 안구 표면에서 모발과 혈액을 제거합니다.
- 세척된 안구를 2% 파라포름알데히드(PFA)로 채워진 4mL 미세 원심분리 튜브에 넣고 셰이커에서 분당 12-15회전(rpm)(초기 고정)의 속도로 실온에서 15분 동안 배양합니다.
주의 : 파라 포름 알데히드는 알레르기를 일으키고 일반적으로 독성이 있으며 극도로 세포 독성이있는 것으로 알려져 있습니다. 안전 지침을 엄격히 따르고 흡입 및 피부 접촉을 피하십시오. - 배양 접시를 사용하여 중앙 부분에 1x PBS 한 방울을 넣고 해부 현미경으로 다음 단계를 수행하고이 방울에 하나의 안구를 놓습니다. 한 쌍의 집게로 안구를 잡고 1mL 주사기 바늘을 사용하여 각막 윤부의 각막을 조심스럽게 뚫습니다. 가위 끝을이 구멍에 넣고 각막 윤부를 따라 각막을 조심스럽게 자릅니다. 망막을 자르지 않도록주의하십시오.
- 한 쌍의 집게로 조리개와 렌즈를 제거하십시오. 그런 다음 나머지 아이컵을 4% PFA에 넣고 실온에서 12-15rpm의 속도로 셰이커에서 45분 더 고정합니다(2차 고정).
- 배양 접시를 사용하고 중앙 부분에 1x PBS 한 방울을 넣습니다. 이 방울에 고정 된 안구를 놓습니다. 한 쌍의 집게로 안구를 잡으십시오. 두 개의 집게를 사용하여 망막과 공막 층을 부드럽게 분리하십시오. 망막과 공막 층 사이에 가위 끝을 놓고 공막을 시신경쪽으로 자릅니다. 망막에서 공막을 벗겨내고 망막 컵을 얻습니다.
알림: 집게로 시신경으로 후방 컵을 잡은 다음 다른 집게의 구부러진 끝을 사용하여 시신경 머리의 공막을 누르고 망막을 해제하는 대안으로 앞으로 쓸어 넘기는 동작으로 망막을 부드럽게 마사지하십시오. - 겸자를 사용하여 요골 히알로이드 혈관과 말초 망막 사이의 연결을 풀고 시신경 머리에 가까운 히알로이드 혈관의 뿌리를 고정하고 히알로이드 혈관을 조심스럽게 잘라냅니다.
- 끝이 잘린 상태에서 2mL 피펫을 사용하여 망막 컵을 옮깁니다. 망막 컵을 48웰 플레이트의 한 웰에 넣고 셰이커에서 실온에서 12-15rpm의 속도로 1x PBS로 3 x 5분 동안 세척합니다.
- 망막 컵을 1% 트리톤 X-100(PBS 중) 및 5% 정상 당나귀 혈청(PBS 중)의 혼합 용액에서 4°C에서 밤새 배양합니다.
- 또는 대안으로 실온에서 1시간 동안 망막을 차단하고 투과화합니다. 2 차 항체의 공급원에 따라 혈청 차단을 변경하십시오.
- Isolectin B4를 사용하여 망막 혈관구조를 표지하는 경우, 망막을 0.1% 정상 당나귀 혈청(400μL) 및 IsolectinB4-594(1:400)와 함께 48웰 플레이트의 웰에서 4°C에서 밤새 12-15rpm의 속도로 쉐이커에서 밤새 배양합니다.
참고: CD31과 같은 다른 마커로 혈관을 표지하거나 다른 세포에 표지를 붙이는 경우 특정 1차 항체를 사용하여 표지하십시오. - 망막을 1:100-1:500 특이적 1차 항체(400μL 0.1% 정상 당나귀 혈청 중)와 함께 4°C에서 셰이커에서 12-15rpm의 속도로 48시간 동안 배양합니다(선택 사항).
- 실온으로 돌아온 후 망막을 0.1% PBST(PBS 중 0.1% TritonX-100)로 셰이커에서 12-15rpm의 속도로 3 x 20분 동안 세척합니다.
- 망막을 1:1,000 2차 항체(400 μL 0.1% 정상 당나귀 혈청 중)와 함께 4°C에서 12-15 rpm의 속도로 셰이커에서 밤새 배양합니다. (선택 사항)
- 대안적으로, 망막을 실온에서 1시간 동안 고친화성 2차 항체와 함께 인큐베이션한다.
- 망막을 DAPI(1:1,000)와 함께 실온에서 20-25분 동안 배양하여 핵에 라벨을 붙입니다.
참고: 사전 실험에서 10-11단계 및 13-14단계에서 사용된 모든 항체에 대해 최적의 희석 비율을 테스트합니다. - 실온에서 3-30rpm의 속도로 셰이커에서 0.1% PBST로 12 x 15분 동안 망막을 세척합니다.
- 망막 컵을 개구부가 위를 향하도록 깨끗한 슬라이드로 옮깁니다. 시신경 머리에서 약 1-1.5mm 떨어진 곳을 절단하여 말초에서 중앙으로 3시, 6시, 9시 및 12시 위치에서 망막을 방사상으로 절단합니다.
- 1x PBS 몇 방울을 추가하여 망막을 세 번 헹굽니다. 공기 처리 된 종이를 사용하여 망막을 말리고 평평하게하십시오. 커버 슬립 중앙에 장착 매체 한 방울 ( 재료 표 참조)을 추가하고 물방울의 직경이 커버 슬립의 절반으로 증가 할 때까지 추가를 중지하십시오. 커버 슬립을 빠르게 뒤집어 펼쳐진 망막 위에 놓습니다. 거품 형성을 피하십시오.
- 망막 플랫 마운트의 이미지를 촬영하거나 4 ° C에서 빛으로부터 슬라이드를 보관하고 보호하십시오.
3. 망막 플랫 마운트의 분석 및 정량화
참고: OIR 마우스 모델의 경우 연구원은 종종 P12-P25 동안 중심 망막 혈관 폐색 및 말초 망막 병리학적 신생혈관 영역을 기록합니다. 이전 연구에 따르면 망막의 중앙 무혈관 영역은 P12에서 최대에 도달하고 P13에서 P17로 점차 축소됩니다. 동시에, OIR 마우스의 망막은 약 P1722,29에서 신생 혈관 영역의 피크에 도달합니다. P17에서 신 혈관은 점차 퇴행하고 기능적 혈관은 무 혈관 영역으로 다시 자랍니다. 망막 혈관계는 기본적으로 P2533에서 정상으로 돌아갑니다.
- 망막 플랫 마운트의 이미지를 형광 현미경( 재료 표 참조)으로 10x 대물 렌즈로 촬영합니다. 먼저 DAPI 채널을 선택하고 시신경 헤드를 시야 중앙에 설정합니다. 그런 다음 다른 채널을 조정하고 망막의 표면 혈관에 초점을 맞춥니다. 사진 소프트웨어에서 타일을 확인하고( 재료 표 참조) 스티칭해야 하는 사진 수를 설정합니다. 실험 시작을 클릭하여 전체 망막을 캡처합니다.
- 이미지 처리 프로그램( 재료 표 참조)을 사용하여 면역형광 염색 후 혈관 소색(VO) 및 신생혈관(NV) 영역을 정량화합니다.
- 먼저 Magic Wand Tool 을 클릭하고 밝기 차이에 따라 적절한 허용 오차를 설정하고 커서를 배경으로 이동하고 마우스를 클릭합니다. 그런 다음 역전 선택을 선택하여 망막의 기본 윤곽을 얻습니다. 올가미 도구를 사용하여 망막의 세부 사항을 자세히 설명합니다. 히스토그램 함수를 사용하여 전체 망막의 픽셀 값을 기록하고 기록하거나 데이터베이스 프로그램에 테이블을 생성합니다.
- 망막 이미지를 4 개의 사분면으로 나눕니다. 각 사분면에서 올가미 도구를 사용하여 VO 영역을 그리고 (그림 2A-C) 마술 지팡이 도구를 사용하여 NV 영역을 선택합니다 (그림 2D-F). 히스토그램 내의 화소 정보를 통해, 망막 전체에 대한 VO 및 NV의 화소 비율, 즉 망막 전체에 대한 VO 또는 NV 영역의 백분율을 계산한다.
참고: 딥 러닝 신경망(http://oirseg.org/)을 사용하여 OIR 이미지에서 VO 및 NV 영역의 정량화를 위한 오픈 소스 및 완전 자동화된 파이프라인도 있으며, 이는 연구자에게 안정적이고 시간을 절약하는 방법을 제공할 뿐만 아니라 정량화34의 표준을 통합합니다.
- 픽셀 정보를 스프레드 시트 테이블에 기록하면 후속 분석에 편리합니다.
4. 플루오레세인 안저 혈관 조영술(FFA) 을 사용한 생체 내 영상
참고: OIR 마우스의 경우 FITC 관류 및 면역형광 염색은 실험 동물의 죽음으로 인해 한 번만 사용할 수 있습니다. 이와 비교하여 FFA의 장점 중 하나는 생체 내 발달 및 병리학 적 상태 동안 마우스 망막 혈관의 동적 변화를 관찰하는 것입니다 35,36.
- 마취하기 전에 새끼의 무게를 측정하십시오.
- 0.3-30 mg / kg의 용량으로 50 % 펜토 바르비탈 나트륨을 복강 내 주사하여 새끼를 마취하십시오.
참고: 1개월 이내의 생쥐의 경우 마취 용량에 주의하십시오. 마취로 인한 생쥐의 사망을 줄이기 위해 더 낮은 농도와 용량의 마취제를 사용하십시오. 새끼를 마취 한 후 작은 가열 패드를 사용하여 체온을 유지하십시오. 저체온증은 새끼의 생리적 기능에 영향을 미칠뿐만 아니라 결정질의 변화를 일으키고 백내장의 발달을 가속화합니다. - 각 강아지에 20μL 산동 점안액(0.5% 트로피아미드 + 0.5% 페닐에프린 염산염)을 사용하고 5분 동안 기다렸다가 오래 지속되는 동공 확장을 달성합니다(그림 3A, B).
- 마취 된 새끼를 영상 장치 앞으로 가져옵니다 ( 재료 표 참조). 새끼를 작은 가열 패드에 놓고 새끼를 안정된 위치에 놓고 정기적으로 인공 눈물을 사용하여 각막의 수분을 유지하십시오. 적외선 안저 영상(IR) 모드를 클릭하여 시신경 헤드를 화면 중앙으로 조정합니다.
알림: 새끼의 한쪽 눈을 관찰 할 때 다른 쪽 눈을 보호하는 것을 잊지 마십시오. Hypromellose 점안액을 사용하여 건조로 인한 각막 미백을 방지하십시오. - 0.5% 플루오레세인 나트륨염 용액 0.15mL를 복강주사한 후 영상장치의 터치패널에서 FA 버튼과 주입 버튼을 즉시 클릭하여 타이밍을 시작합니다. 망막의 혈액 순환이 정맥 단계에 들어갈 때 3 분 후에 이미지를 기록하고 6-8 분 이상 망막을 관찰하십시오.
알림: 플루오레세인 나트륨염 용액을 복강 주사한 후 새끼의 피부, 점막 및 소변이 명백한 황록색을 보입니다. 대부분의 플루오레세인은 하루 안에 새끼에 의해 배설됩니다. 플루오레세인 나트륨을 격일로 6회 복강내 주사해도 심각한 부작용이 발생하지 않는다37. - 시신경 헤드를 이미지 획득 영역의 중앙으로 이동하고 중앙 망막의 첫 번째 이미지를 촬영합니다. 그런 다음 시신경 헤드가 이미지 획득 영역의 한쪽 중간 지점에 위치할 때까지 이미징 장치의 렌즈를 눈의 비강 쪽으로 수평으로 이동하고 두 번째 이미지를 촬영합니다. 이 방법을 사용하여 각각 측두엽, 상하 망막, 하부 망막의 이미지를 계속 촬영합니다(그림 3C).
참고: 회귀 단계가 발생하는 동안 12분 이내에 "5방향" 이미지를 촬영합니다. 열등한 이미지에서 시신경 머리의 위치는 렌즈의 제한된 각도 조정으로 인해 부업에 떨어지지 않도록 허용됩니다. - 이미지를 저장하고 이미지 처리 프로그램을 사용하여 스티칭합니다.
5. 플루오레세인 안저 혈관조영술(FFA)의 영상 처리
- 이미징 처리 프로그램을 열고 파일에서 새로 만들기를 클릭하여 검은색 배경의 새 캔버스를 만듭니다(그림 4A).
- 배경 레이어에서 먼저 중앙 망막의 이미지를 엽니다. 파일을 클릭하고 두 번째 이미지를 추가합니다. 두 번째 이미지의 불투명도를 60%로 조정하고 두 이미지의 동일한 부분이 크게 겹칠 때까지 두 번째 이미지를 이동하고 크기를 조정합니다. 자유 변형과 워프 모드 간 전환 버튼을 클릭하고 필요한 경우 선박을 미묘하게 조정합니다. 그런 다음 두 번째 이미지의 불투명도를 다시 100%로 설정합니다(그림 4A, B).
- 동시에 두 개의 이미지를 선택하고 레이어 자동 혼합을 클릭합니다. 확인 파노라마 혼합 방법으로 다음 두 문장을 선택하십시오. 확인을 클릭하고 처음 두 이미지의 이미지 스티칭을 완료합니다(그림 4C, D).
- 처음 두 개의 스티칭된 이미지를 전체적으로 가져와 세 번째 이미지를 추가한 다음 계속 혼합합니다. 위의 방법을 반복하여 5개의 이미지 스티칭을 완료합니다(그림 4E).
- 자르기 도구를 사용하여 서로 다른 시점에서 FFA의 이미지를 균일한 크기로 자르고 정상 및 OIR 강아지 모두에서 P15에서 P25로 망막 혈관의 동적 변화를 관찰합니다.
6. 통계 분석
- 값을 평균± 표준 편차(s.d.)로 표시합니다.
- 스튜던트 t-검정을 사용하여 두 개의 독립 표본을 비교할 수 있습니다. 일원 분산 분석을 사용하여 여러 데이터 집합을 비교하고 일반적으로 사용되는 다중 비교 검정인 Dunnett 또는 Tukey의 검정과 결합합니다.
- 정규 분포를 따르지 않는 데이터의 경우 Mann-Whitney U 검정 또는 Kruskal Wallis 검정을 사용하십시오. P 가 0.05일 때 유의< 통계적 차이를 고려하십시오.
결과
OIR 마우스 모델에서 가장 중요하고 기본적인 결과는 VO 및 NV 영역의 정량화입니다. P7로부터 5일 동안 과산소 환경에서 생활한 후, 새끼의 중심 망막은 가장 큰 비관류 면적을 보였다. 또 다른 5 일 동안 저산소증의 자극 하에, 망막 신생 혈관이 점차적으로 생성되어 주변의 정상 혈관보다 더 강하게 형광을 발했습니다. P17 이후, 병리학적 신생혈관의 형광 신호는 망막의 리모델링으로서 빠르게 퇴행하였다(도 5A). 새끼의 깔짚 크기와 출생 후 체중 증가를 제어함으로써 OIR 마우스 모델의 VO 및 NV 영역은 우수한 반복성과 안정성을 보였으며 망막 신생 혈관의 피크는 P17에서 발생했으며 이는 이전 연구와 일치했습니다 (그림 5B, C).
FFA는 망막 혈관계를 연구하는 데 이상적인 도구입니다. 생체 내에서 FFA의 적용을 감안할 때, 시간에 따른 망막 혈관의 동적 변화를 나타낼 뿐만 아니라 실험 동물의 폐기물의 큰 감소를 보여줍니다. 이전 연구에서 FFA는 생쥐 새끼에게 자주 사용되지 않았으며 단일 보기 이미지로 제시되어 추가 연구가 어려웠습니다. 이 프로토콜에서는 망막 혈관구조의 "5배향" 이미지를 이미지 처리 소프트웨어를 사용하여 함께 스티칭하여 망막의 더 넓은 필드를 한 번에 표시했으며, 이는 필요한 경우 후속 분석에 도움이 되었습니다(그림 4). 게다가, OIR 마우스 새끼는 동물 윤리의 요구 사항을 충족시키기 위해 P15에서 FFA 이미지를 촬영하기 위해 장시간 눈을 뜨는 것을 보여주었습니다. OIR 마우스 모델의 망막에서 혈관의 직경이 분명히 증가하여 정상 마우스와 비교할 때 매우 구불 구불 해졌습니다. 게다가, FFA는 새끼의 죽음없이 P15-P25에서 이소 렉틴 B4-594로 면역 형광 염색을 통해 망막 혈관계의 동적 변화의 유사한 경향을 보였다 (그림 6).
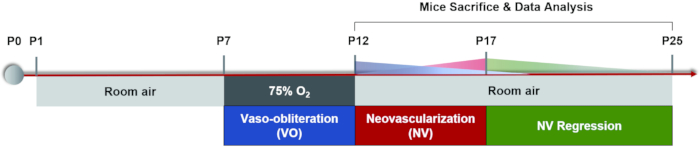
그림 1: OIR 마우스 모델의 만화 개략도. OIR 마우스 모델은 강아지와 그들의 수유부를 한동안 방에 가두어 유도하였다(P0-P7). P7에서 둘 다 5 일 동안 75 % 산소에 노출되어 망막 혈관 성장을 억제하고 중앙 망막에서 상당한 혈관 손실을 일으켰습니다. 그런 다음 마우스를 P12에서 실내 공기로 되돌려 놓았고 무 혈관 망막은 상대적으로 저산소 상태가되기 시작하여 정상적인 혈관 재성장과 중간 말초 망막 주변의 병리학 적 반응을 유발했습니다. 최대 신생혈관형성(NV)은 P17에서 나타났다. 그런 다음 병리학 적 신생 혈관은 자발적인 퇴행 과정을 거쳤습니다. 망막 혈관계는 약 P25에서 다시 정상으로 돌아 왔습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 마우스 망막의 혈관 소멸(VO) 및 신생혈관(NV) 측정. (A) 이소렉틴 B10-12로 내피 세포에 대해 염색된 4x P594 망막 전체 마운트의 이미지. (B) 무혈관 영역이 선택된 망막의 스크린샷. 이 측정에 필요한 도구는 흰색 화살표로 강조 표시됩니다 : 마술 지팡이 도구 및 올가미 도구. (C) 망막의 무혈관 영역을 강조 표시하고 이미지를 사본으로 저장합니다. (D) 이소렉틴 B10-17로 내피 세포에 대해 염색된 4x P594 망막 전체 마운트의 이미지. (E) 신생 혈관 술이 선택된 망막의 스크린 샷. 마술 지팡이 도구를 사용하고 NV를 강조 표시하도록 최적의 허용 오차를 설정하십시오. 허용 오차를 3-5로 설정하고 앤티 앨리어싱 및 연속 상자를 선택하십시오. (F) 신생 혈관 영역을 사본으로 만 저장하십시오. 스케일 바는 1,000μm를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
그림 3: 마우스 망막의 "5방향" 이미지 획득. (A) 정상 마우스 동공. (B) 산동선의 마우스 동공. (C) 망막의 중앙, 비강, 측두엽, 상하 및 하부 영역의 "5 방향"이미지를 각각 수집했습니다 (실내 공기에서 P17 강아지). 스케일 바는 500μm를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: 플루오레세인 안저 혈관조영술(FFA)에서 "5배향" 이미지를 스티칭하는 일반적인 워크플로. (A) 검은 색 배경의 새 캔버스를 만들고 중앙 망막의 FFA 이미지를 엽니 다. (b) 측두 망막의 FFA 이미지를 열고 두 번째 이미지의 불투명도를 60 %로 조정합니다. 두 이미지의 동일한 부분이 매우 겹칠 때까지 이미지를 이동하고 크기를 조정합니다. 자유 변형과 워프 모드 간 전환을 클릭하여 필요한 경우 미묘하게 조정합니다. 두 번째 이미지의 불투명도를 다시 100%로 바꿉니다. (C) 동시에 두 개의 이미지를 선택하고 자동 혼합 레이어를 클릭합니다. (D) 파노라마를 혼합 방법으로 사용하여 처음 두 이미지의 이미지 스티칭을 완료합니다. (E) 위의 방법을 반복하여 이미지를 계속 스티칭하여 모든 이미지의 스티칭을 완료합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: OIR 마우스 모델의 망막에서 혈관 소멸(VO) 및 신생혈관(NV)의 정량화. (A) P12에서 P25까지 이소렉틴 B4-594로 내피 세포에 대해 염색 된 10x OIR 망막 전체 마운트의 이미지. 5 일 동안 75 % 산소에 노출 된 후, 강아지와 수유부는 혈관 제거 영역이 최대에 도달 한 P12의 실내 공기로 돌아 왔습니다. 중심 망막의 상대적 저산소증은이 부위의 혈관 재성장과 중간 말초 망막의 병리학 적 혈관 신생으로 이어졌습니다. P17에서, 망막 전 신생 혈관 술은 최대에 도달 한 다음 빠르게 축소되었습니다. NV는 완전히 퇴행했고 망막은 약 P25에서 정상인 것처럼 보였습니다. (B) VO 면적의 정량화는 P12에서 피크를 나타내고 P25 주변에서 소실을 보였다. (C) NV 면적의 정량화는 P17에서 피크를 나타내었고 P25 주변에서 회귀를 보였다. 스케일 바는 A에서 1,000μm를 나타냅니다(일원 분산 분석, *P < 0.05, **P < 0.01, ***P < 0.001, **** P < 0.0001). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
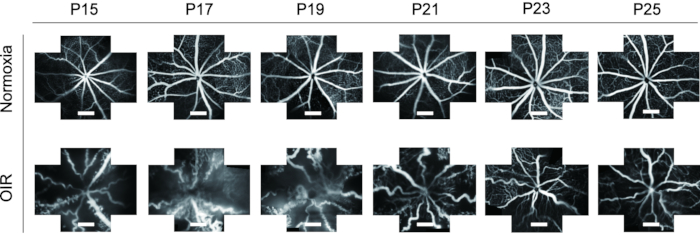
그림 6: OIR 마우스 모델에서 플루오레세인 안저 혈관조영술(FFA)의 생체 내 이미징. OIR 마우스 모델의 망막에서 혈관의 직경이 분명히 증가하여 정상 마우스와 비교할 때 매우 구불 구불 해졌습니다. 게다가, FFA는 마우스 새끼의 죽음없이 P15-P25에서 이소 렉틴 B4-594로 면역 형광 염색을 통해 망막 혈관계의 동적 변화의 유사한 경향을 보였다. 스케일 바는 500μm를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
OIR에 대한 마우스의 감수성은 많은 요인에 의해 영향을받습니다. 다른 유전 적 배경과 균주의 새끼는 비교할 수 없습니다. BALB/c 알비노 마우스에서 혈관은 VO 영역으로 빠르게 재성장하여 신생 혈관 술38이 크게 감소하여 연구에 약간의 어려움을 가져옵니다. C57BL/6 마우스에서, BALB/cJ 마우스 균주39,40과 비교할 때 광수용체 손상이 증가하였다. 다른 유형의 형질 전환 마우스41,42,43도 마찬가지입니다. 게다가, C57BL/6 마우스는 129S3/SvIM 마우스(44)와 비교할 때 더 낮은 수준의 혈관신생을 나타낸다.
출생 후 체중 증가 (PWG)도45 를 고려하는 것이 중요하며 신생아의 영양 상태를 평가하는 지표 중 하나입니다. 또한 ROP를 예측하는 신뢰할 수 있는 방법이 되었으며, 이는 많은 동물 모델러(46)의 관심을 끌고 있다. PWG는 과산화 및 저산소증에 대한 마우스의 반응에 영향을 미칩니다. P7에서 체중이 증가한 새끼(>5g)는 혈관 폐색 및 망막 신생혈관이 불충분하고 체중이 감소한 새끼(<5g)는 과산소증과 저산소증에 명백한 반응을 보입니다. 게다가, P17에서, 가난한 (<5g) 및 광범위한 (>7.5g) 체중 증가를 가진 강아지는 NV가 감소한 것으로 나타났습니다. 그러나 체중 증가가 좋지 않은 강아지 (<5g)는 NV 피크45의 발생이 지연되면서 혈관 폐쇄 (VO) 및 신생 혈관 (NV) 단계가 상당히 연장되었습니다. 따라서 실험의 반복성과 비교성을 보장하기 위해 P7 및 P17에서 강아지의 PWG를 기록 및 제어하고 PWG가 낮은 강아지(P17에서 < 6g)를 제거하는 것이 필요합니다.
깔짚 크기는 PWG에 더 큰 영향을 미치며 일부 연구자들은 PWG 6의 요구 사항을 충족하기 위해8-22,31 강아지/댐으로 제한되어야 한다고 제안합니다. 수유부의 상태도 고려가 필요합니다. 수유부는 고산소 환경에서 폐 손상으로 사망 할 가능성이 더 높습니다47. 수유부가 OIR 유도 중 및 후에 새끼를 죽거나 방치하면 새끼는 영양 부족으로 쉽게 체중이 감소하거나 사망합니다32. 따라서 대리모를 대체 할 충분한 대리모가 있는지 확인해야합니다. 그러나, 이들 대리모는 산모가 만료될 때만 사용되는 것이 좋으며, 이는 보통 과산소 노출 기간 동안 발생하거나 실내 공기로 복귀한다(22). 수유부에게 적절한 음식을 제공하는 것도 새끼의 영양 상태를 개선하는 데 도움이 됩니다.
망막 플랫 마운트를 준비하는 데 유용한 참고 사항은 일반적으로 추가 장시간 염색을 위해 최적의 고정 시간이 필요하다는 것입니다. P12-P25의 마우스로서, 실온에서 15분 + 45분 고정을 권장한다29. 망막을 밤새 4°C로 고정하는 것은 시간이 제한된 경우 대안입니다. 게다가, 1% Triton X-100 및 5% 일반 당나귀 혈청의 더 높은 농도를 가진 투과성 및 차단 완충액은 우리의 경험에 따르면 면역 형광 염색의 배경을 효과적으로 감소시킵니다.
Isolectin B4 염색 및 FITC-덱스트란 관류는 신생혈관48,49를 시각화하고 정량화하기 위해 일반적으로 사용되는 방법입니다. 이 두 가지 방법의 주요 한계는 마우스를 희생해야한다는 것입니다. 그래서, 생체 내 이미징 및 NV의 정량화를위한 방법이 필요합니다29. Paques et al.은 살아있는 마우스 50에서 망막의 고해상도 디지털 사진을 제공하는 국소 내시경 안저 영상 (TEFI)이라는 기술을 개발했습니다. TEFI는 빠르면 P15에서 망막 혈관 변화를 검출할 수 있고 획득된 영상은 종래의 평가 방법에 따른다. Mezu-Ndubuisi 등은 생체 내 망막 혈관 산소 장력 (PO2) 측정 및 플루오레세인 혈관 조영술 (FA)을 위한 방법을 제공하여 ROP 및 기타 허혈성 망막 질환으로 인한 망막 혈관 변화 및 산소화 변화에 대한 이해를 개선했습니다37. TEFI도 FA도 기존 방법만큼 정확하지는 않지만 실험 동물의 죽음을 줄이고 반복적으로 수행 할 수 있습니다. 또한 각 마우스가 자체 제어 역할을 할 수 있으므로 OIR 데이터를 더 쉽게 비교할 수 있습니다. 이 논문에서는 FFA 이미징 및 이미지 스티칭의 개선된 방법을 제공합니다. 과도한 마취와 저체온증이 새끼의 죽음을 직접적으로 유발하기 때문에 1 개월 이내에 새끼에게 FFA를 수행하는 것은 쉽지 않습니다. 따라서 최소 용량의 마취를 사용하고 작은 가열 패드를 사용하여 과정 내내 및 후에 새끼의 체온을 유지하는 데 특별한주의를 기울이십시오. 다음 관찰이 실패한 경우 항상 식염수와 Hypromelose로 안구 표면을 적시십시오.
요약하면, OIR 마우스 모델은 망막 허혈 및 병리학 적 신생 혈관의 매우 일반적이고 널리 사용되는 모델입니다. 이 모델의 주요 문제점 중 하나는 신생아 마우스 새끼가 본질적으로 건강하고 조기에 태어난 유아와 비교할 때 대사 불안정성 또는 호흡기 문제가 없다는 것입니다. OIR 마우스 모델과 인간 사이의 또 다른 차이점은 인간 망막 신생혈관에서 항상 섬유혈관 증식이 존재하는 반면, 망막 신생혈관은 OIR 마우스 모델51에서 섬유증과 관련이 없다는 것이다. 이 모델을 더 잘 활용하고 더 많은 정보를 얻기 위해 FFA를 사용하여 OIR 망막 혈관의 동적 변화를 모니터링하는 방법에 대한 자세한 설명이 제공되며, 여기에는 "5 방향"이미지 촬영 및 이미지 처리 방법이 포함됩니다. FFA는 망막 혈관구조49의 형태 및 기능을 관찰하고 평가하기 위해 면역형광 염색을 부분적으로 또는 완전히 대체하는 효과적인 방법이 될 것으로 여겨진다. OIR 마우스 모델은 인간의 다양한 허혈성 망막병증의 미세환경 및 발병기전과 완전히 유사하지는 않지만, 약물 및 형질전환 실험을 수행하고 허혈성 망막51에서 병리학적 혈관신생의 메커니즘을 탐구할 수 있는 기회를 제공합니다.
공개
저자는 공개 할 것이 없습니다.
감사의 말
기술 지원에 대해 우리 실험실과 중산 안과 센터의 안과 동물 실험실의 모든 구성원에게 감사드립니다. 또한 실험적 지원에 대해 Chunqiao Liu 교수에게 감사드립니다. 이 연구는 중국 국립 자연 과학 재단 (NSFC : 81670872; 중국 베이징), 중국 광둥성 자연과학재단(보조금 No.2019A1515011347), 중산 안과 센터 국가 안과학연구소의 고위급 병원 건설 프로젝트(보조금 No. 303020103; 광저우, 광동성, 중국).
자료
| Name | Company | Catalog Number | Comments |
| 1 mL sterile syringe | Solarbio | YA0550 | For preparation of retinal flat mounts and intraperitoneal injection |
| 1× Phosphate buffered saline (PBS) | Transgen Biotech | FG701-01 | For preparation of retinal flat mounts |
| 2 ml Microcentrifuge Tube | Corning | MCT-200-C | For preparation of retinal flat mounts |
| 48 Well Clear TC-Treated Multiple Well Plates | Corning | 3548 | For preparation of retinal flat mounts |
| Adhesive microscope slides | Various | For preparation of retinal flat mounts | |
| Adobe Photoshop CC 2019 | Adobe Inc. | For image analysis | |
| Carbon dioxide gas | Various | For sacrifice | |
| Cover slide | Various | For preparation of retinal flat mounts | |
| Curved forceps | World Precision Instruments | 14127 | For preparation of retinal flat mounts |
| DAPI staining solution | Abcam | ab228549 | For labeling nucleus on retinal flat mounts |
| Dissecting microscope | Olmpus | SZ61 | For preparation of retinal flat mounts |
| Fluorescein sodium | Sigma-Aldrich | F6377 | For in vivo imaging |
| Fluorescent Microscope | Zeiss | AxioImager.Z2 | For acquisition of fluorescence images of retinal flat mounts |
| Fluoromount-G Mounting media | SouthernBiotech | 0100-01 | For preparation of retinal flat mounts |
| Hydroxypropyl Methylcellulose | Maya | 89161 | For in vivo imaging |
| Isolectin B4 594 antibody | Invitrogen | I21413 | For labeling retinal vasculature on retinal flat mounts |
| Mice C57/BL6J | GemPharmatech of Jiangsu Province | For OIR model induction | |
| Micro dissecting scissors-straight blade | World Precision Instruments | 503242 | For preparation of retinal flat mounts |
| No.4 straight forceps | World Precision Instruments | 501978-6 | For preparation of retinal flat mounts |
| Normal donkey serum | Abcam | ab7475 | For preparation of retinal flat mounts |
| O2 sensor | Various | For monitoring the level of O2 | |
| OxyCycler | Biospherix | A84XOV | For OIR model induction |
| Paraformaldehyde (PFA) | Sigma | P6148-1KG | For tissue fixation |
| Pentobarbital sodium | Various | For anesthesia | |
| Soda lime | Various | For absorbing excess CO2 in the oxygen chamber | |
| SPECTRALIS HRA+OCT | Heidelberg | HC00500002 | For in vivo imaging |
| SPSS Statistics 22.0 | IBM | For statistical analysis | |
| Tansference decloring shaker | Kylin-Bell | ZD-2008 | For preparation of retinal flat mounts |
| Tissue culture dish (Low attachment) | Corning | 3261-20EA | For preparation of retinal flat mounts |
| Transfer pipettes | Various | For preparation of retinal flat mounts | |
| Triton X-100 | Sigma-Aldrich | SLBW6818 | For preparation of retinal flat mounts |
| Tropicamide | Various | For in vivo imaging | |
| ZEN Imaging Software | ZEISS | For image acquisition and export |
참고문헌
- Vavvas, D. G., Miller, J. W. Chapter 26 - Basic Mechanisms of Pathological Retinal and Choroidal Angiogenesis. Retina (Fifth Edition). 1, 562-578 (2013).
- Selvam, S., Kumar, T., Fruttiger, M. Retinal vasculature development in health and disease. Progress in Retinal and Eye Research. 63, 1-19 (2018).
- Shimizu, K., Kobayashi, Y., Muraoka, K. Midperipheral fundus involvement in diabetic retinopathy. Ophthalmology. 88 (7), 601-612 (1981).
- Ashton, N. Retinal vascularization in health and disease: Proctor Award Lecture of the Association for Research in Ophthalmology. American Journal of Ophthalmology. 44 (4), 7-17 (1957).
- Hellström, A., Smith, L. E., Dammann, O. Retinopathy of prematurity. Lancet. 382 (9902), 1445-1457 (2013).
- Xu, Y., et al. Melatonin attenuated retinal neovascularization and neuroglial dysfunction by inhibition of HIF-1α-VEGF pathway in oxygen-induced retinopathy mice. Journal of Pineal Research. 64 (4), 12473 (2018).
- Cavallaro, G., et al. The pathophysiology of retinopathy of prematurity: an update of previous and recent knowledge. Acta Ophthalmologica. 92 (1), 2-20 (2014).
- Gilbert, C., Rahi, J., Eckstein, M., O'Sullivan, J., Foster, A. Retinopathy of prematurity in middle-income countries. Lancet. 350 (9070), 12-14 (1997).
- Chen, J., Smith, L. E. Retinopathy of prematurity. Angiogenesis. 10 (2), 133-140 (2007).
- Fielder, A., Blencowe, H., O'Connor, A., Gilbert, C. Impact of retinopathy of prematurity on ocular structures and visual functions. Archives of Disease in Childhood. Fetal and Neonatal Edition. 100 (2), 179-184 (2015).
- Moshfeghi, D. M. Presumed transient reactive astrocytic hyperplasia in immature retina. Retina. 26, 69-73 (2006).
- Kandasamy, Y., Hartley, L., Rudd, D., Smith, R. The association between systemic vascular endothelial growth factor and retinopathy of prematurity in premature infants: a systematic review. British Journal of Ophthalmology. 101 (1), 21-24 (2017).
- Shah, P. K., et al. Retinopathy of prematurity: Past, present and future. World Journal of Clinical Pediatrics. 5 (1), 35-46 (2016).
- Kinsey, V. E. Retrolental fibroplasia; cooperative study of retrolental fibroplasia and the use of oxygen. AMA Archives of Ophthalmology. 56 (4), 481-543 (1956).
- Tin, W., Gupta, S. Optimum oxygen therapy in preterm babies. Archives of Disease in Childhood. Fetal and Neonatal Edition. 92 (2), 143-147 (2007).
- Liu, C. H., Wang, Z., Sun, Y., Chen, J. Animal models of ocular angiogenesis: from development to pathologies. FASEB Journal : Official Publication of the Federation of American Societies for Experimental Biology. 31 (11), 4665-4681 (2017).
- Ashton, N., Ward, B., Serpell, G. Effect of oxygen on developing retinal vessels with particular reference to the problem of retrolental fibroplasia. The British Journal of Ophthalmology. 38 (7), 397-432 (1954).
- Penn, J. S., Tolman, B. L., Lowery, L. A. Variable oxygen exposure causes preretinal neovascularization in the newborn rat. Investigative Ophthalmology & Visual Science. 34 (3), 576-585 (1993).
- Smith, L. E., et al. Oxygen-induced retinopathy in the mouse. Investigative Ophthalmology & Visual Science. 35 (1), 101-111 (1994).
- McLeod, D. S., Brownstein, R., Lutty, G. A. Vaso-obliteration in the canine model of oxygen-induced retinopathy. Investigative Ophthalmology & Visual Science. 37 (2), 300-311 (1996).
- Cao, R., Jensen, L. D., Söll, I., Hauptmann, G., Cao, Y. Hypoxia-induced retinal angiogenesis in zebrafish as a model to study retinopathy. PLoS One. 3 (7), 2748 (2008).
- Connor, K. M., et al. Quantification of oxygen-induced retinopathy in the mouse: a model of vessel loss, vessel regrowth and pathological angiogenesis. Nature Protocols. 4 (11), 1565-1573 (2009).
- Fruttiger, M. Development of the mouse retinal vasculature: angiogenesis versus vasculogenesis. Investigative Ophthalmology & Visual Science. 43 (2), 522-527 (2002).
- Stahl, A., et al. The mouse retina as an angiogenesis model. Investigative Ophthalmology & Visual Science. 51 (6), 2813-2826 (2010).
- Rivera, J. C., et al. Ischemic retinopathies: oxidative stress and inflammation. Oxidative Medicine and Cellular Longevity. 2017, 3940241 (2017).
- Bashinsky, A. L. Retinopathy of prematurity. North Carolina Medical Journal. 78 (2), 124-128 (2017).
- Flynn, J. T., et al. Retinopathy of prematurity. Diagnosis, severity, and natural history. Ophthalmology. 94 (6), 620-629 (1987).
- Aguilar, E., et al. Chapter 6. Ocular models of angiogenesis. Methods in Enzymology. 444, 115-158 (2008).
- Liegl, R., Priglinger, C., Ohlmann, A. Induction and readout of oxygen-induced retinopathy. Methods in Molecular Biology. 1834, 179-191 (2019).
- Lutty, G. A., McLeod, D. S. Retinal vascular development and oxygen-induced retinopathy: a role for adenosine. Progress in Retinal and Eye Research. 22 (1), 95-111 (2003).
- Vähätupa, M., et al. Oxygen-induced retinopathy model for ischemic retinal diseases in rodents. Journal of Visualized Experiments: JoVE. (163), (2020).
- Kim, C. B., D'Amore, P. A., Connor, K. M. Revisiting the mouse model of oxygen-induced retinopathy. Eye and Brain. 8, 67-79 (2016).
- Gammons, M. V., Bates, D. O. Models of oxygen induced retinopathy in rodents. Methods in Molecular Biology. 1430, 317-332 (2016).
- Xiao, S., et al. Fully automated, deep learning segmentation of oxygen-induced retinopathy images. Journal of Clinical Investigation Insight. 2 (24), (2017).
- McLeod, D. S., D'Anna, S. A., Lutty, G. A. Clinical and histopathologic features of canine oxygen-induced proliferative retinopathy. Investigative Ophthalmology & Visual Science. 39 (10), 1918-1932 (1998).
- Penn, J. S., Johnson, B. D. Fluorescein angiography as a means of assessing retinal vascular pathology in oxygen-exposed newborn rats. Current Eye Research. 12 (6), 561-570 (1993).
- Mezu-Ndubuisi, O. J., et al. In vivo retinal vascular oxygen tension imaging and fluorescein angiography in the mouse model of oxygen-induced retinopathy. Investigative Ophthalmology & Visual Science. 54 (10), 6968-6972 (2013).
- Zeilbeck, L. F., Müller, B., Knobloch, V., Tamm, E. R., Ohlmann, A. Differential angiogenic properties of lithium chloride in vitro and in vivo. PLoS One. 9 (4), 95546 (2014).
- Walsh, N., Bravo-Nuevo, A., Geller, S., Stone, J. Resistance of photoreceptors in the C57BL/6-c2J, C57BL/6J, and BALB/cJ mouse strains to oxygen stress: evidence of an oxygen phenotype. Current Eye Research. 29 (6), 441-447 (2004).
- Zhang, Q., Zhang, Z. M. Oxygen-induced retinopathy in mice with retinal photoreceptor cell degeneration. Life Sciences. 102 (1), 28-35 (2014).
- Okamoto, N., et al. Transgenic mice with increased expression of vascular endothelial growth factor in the retina: a new model of intraretinal and subretinal neovascularization. The American Journal of Pathology. 151 (1), 281-291 (1997).
- Ohlmann, A., et al. Norrin promotes vascular regrowth after oxygen-induced retinal vessel loss and suppresses retinopathy in mice. The Journal of Neuroscience. 30 (1), 183-193 (2010).
- Fang, L., Barber, A. J., Shenberger, J. S. Regulation of fibroblast growth factor 2 expression in oxygen-induced retinopathy. Investigative Ophthalmology & Visual Science. 56 (1), 207-215 (2014).
- Chan, C. K., et al. Differential expression of pro- and antiangiogenic factors in mouse strain-dependent hypoxia-induced retinal neovascularization. Laboratory Investigation. 85 (6), 721-733 (2005).
- Stahl, A., et al. Postnatal weight gain modifies severity and functional outcome of oxygen-induced proliferative retinopathy. The American Journal of Pathology. 177 (6), 2715-2723 (2010).
- Vanhaesebrouck, S., et al. Association between retinal neovascularization and serial weight measurements in murine and human newborns. European Journal of Ophthalmology. 23 (5), 678-682 (2013).
- Gerschman, R., Nadig, P. W., Snell, A. C., Nye, S. W. Effect of high oxygen concentrations on eyes of newborn mice. The American Journal of Physiology. 179 (1), 115-118 (1954).
- Lange, C., et al. Kinetics of retinal vaso-obliteration and neovascularisation in the oxygen-induced retinopathy (OIR) mouse model. Graefe's Archive for Clinical and Experimental Ophthalmology. 247 (9), 1205-1211 (2009).
- Huang, S., et al. Comparison of dextran perfusion and GSI-B4 isolectin staining in a mouse model of oxygen-induced retinopathy. Eye Science. 30 (2), 70-74 (2015).
- Paques, M., et al. Panretinal, high-resolution color photography of the mouse fundus. Investigative Ophthalmology & Visual Science. 48 (6), 2769-2774 (2007).
- Fletcher, E. L., et al. Animal models of retinal disease. Progress in Molecular Biology and Translational Science. 100, 211-286 (2011).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유