Method Article
مراقبة النمو الديناميكي لأوعية الشبكية في نموذج فأر اعتلال الشبكية الناجم عن الأكسجين
In This Article
Summary
يصف هذا البروتوكول طريقة مفصلة لإعداد وتلطيخ التألق المناعي للحوامل المسطحة لشبكية العين لدى الفئران وتحليلها. يتم وصف استخدام تصوير الأوعية الدموية قاع العين بالفلوريسين (FFA) لجراء الفئران ومعالجة الصور بالتفصيل أيضا.
Abstract
يستخدم اعتلال الشبكية الناجم عن الأكسجين (OIR) على نطاق واسع لدراسة نمو الأوعية غير الطبيعي في أمراض الشبكية الإقفارية، بما في ذلك اعتلال الشبكية الخداجي (ROP)، واعتلال الشبكية السكري التكاثري (PDR)، وانسداد الوريد الشبكي (RVO). معظم دراسات OIR تلاحظ الأوعية الدموية الجديدة في شبكية العين في نقاط زمنية محددة. ومع ذلك ، فإن نمو الأوعية الديناميكي في الفئران الحية على طول مسار زمني ، وهو أمر ضروري لفهم أمراض الأوعية المرتبطة ب OIR ، لم تتم دراسته بشكل كاف. هنا ، نصف بروتوكولا خطوة بخطوة لتحريض نموذج الماوس OIR ، مع تسليط الضوء على المزالق المحتملة ، وتوفير طريقة محسنة لتحديد مناطق طمس الأوعية (VO) والأوعية الدموية الجديدة (NV) بسرعة باستخدام تلطيخ التألق المناعي. الأهم من ذلك ، قمنا بمراقبة إعادة نمو الأوعية في الفئران الحية من P15 إلى P25 عن طريق إجراء تصوير الأوعية الدموية قاع العين بالفلوريسين (FFA) في نموذج فأر OIR. يسمح لنا تطبيق FFA على نموذج الماوس OIR بمراقبة عملية إعادة التشكيل أثناء إعادة نمو السفينة.
Introduction
عادة ما تمتد الأوعية الدموية الجديدة في الشبكية (RNV)، والتي تعرف بأنها حالة تنشأ فيها أوعية مرضية جديدة من الأوردة الشبكية الموجودة، على طول السطح الداخلي للشبكية وتنمو في الجسم الزجاجي (أو الفضاء تحت الشبكية في ظل بعض الظروف)1. وهو سمة مميزة وسمة مشتركة للعديد من اعتلالات الشبكية الإقفارية، بما في ذلك اعتلال الشبكية الخداجي (ROP)، وانسداد الوريد الشبكي (RVO)، واعتلال الشبكية السكري التكاثري (PDR)2.
أشارت العديد من الملاحظات السريرية والتجريبية إلى أن نقص التروية هو السبب الرئيسي لتوسع الأوعية الدموية الجديدة في الشبكية 3,4. في شرطة عمان السلطانية، يتعرض حديثي الولادة لأكسجين عالي المستوى في حاضنات مغلقة لزيادة معدلات البقاء على قيد الحياة، وهو أيضا محرك مهم لوقف نمو الأوعية الدموية. بعد الانتهاء من العلاج ، تعاني شبكية العين من الأطفال حديثي الولادة من فترة نقص الأكسجة نسبيا5. وينظر إلى حالات أخرى في انسداد الأوردة الشبكية المركزية أو الفرعية في RVO ويلاحظ أيضا تلف الشعيرات الدموية في الشبكية الذي يسببه اعتلال الأوعية الدقيقة في PDR2. يزيد نقص الأكسجة من التعبير عن العوامل الوعائية المنشأ مثل عامل النمو البطاني الوعائي (VEGF) من خلال مسار إشارات العامل الناجم عن نقص الأكسجة -1α (HIF-1α) والذي بدوره يوجه الخلايا البطانية الوعائية للنمو في منطقة نقص الأكسجة وتشكيل أوعية جديدة 6,7.
ROP هو نوع من اعتلال الشبكية التكاثري الوعائي عند الأطفال الخدج وسبب رئيسي لعمى الأطفال8,9 ، والذي يتميز بنقص الأكسجة في الشبكية ، والأوعية الدموية الجديدة في الشبكية وتضخم التنسج الليفي10,11,12. في 1950s ، وجد الباحثون أن التركيز العالي للأكسجين يمكن أن يحسن بشكل كبير الأعراض التنفسية للأطفال الخدج13,14. ونتيجة لذلك ، تم استخدام العلاج بالأكسجين بشكل متزايد في الأطفال الخدج في ذلك الوقت15. ومع ذلك ، بالتزامن مع الاستخدام الواسع النطاق للعلاج بالأكسجين في الأطفال الخدج ، زاد حدوث ROP عاما بعد عام. ومنذ ذلك الحين، ربط الباحثون الأكسجين بشرطة عمان السلطانية، مستكشفين نماذج حيوانية مختلفة لفهم التسبب في ROP و RNV16.
في الإنسان ، يتم الانتهاء من معظم تطوير الأوعية الدموية في الشبكية قبل الولادة بينما في القوارض تتطور الأوعية الدموية الشبكية بعد الولادة ، مما يوفر نظاما نموذجيا يمكن الوصول إليه لدراسة تكوين الأوعية الدموية في الأوعية الدموية الشبكية2. مع التقدم المستمر للبحث ، أصبحت نماذج اعتلال الشبكية الناجم عن الأكسجين (OIR) نماذج رئيسية لمحاكاة تولد الأوعية الدموية المرضية الناتجة عن نقص التروية. لا توجد أنواع حيوانية محددة في دراسة نموذج OIR وقد تم تطوير النموذج في أنواع حيوانية مختلفة ، بما في ذلك القطالصغير 17 ، والفئران18 ، والفأر19 ، وجرو البيجل20 ، والزرد21. تشترك جميع النماذج في نفس الآلية التي تتعرض من خلالها لفرط التأكسج أثناء تطور الشبكية المبكر ثم تعود إلى البيئة المعيارية. لاحظ سميث وآخرون أن تعريض الجراء الفئران لفرط التأكسج من P7 لمدة 5 أيام أدى إلى شكل متطرف من انحدار الأوعية الدموية في شبكية العين المركزية وإعادتها إلى هواء الغرفة في P12 أدى تدريجيا إلى خصلات الأوعية الدموية الجديدة ، والتي نمت نحو الجسم الزجاجي19. كان هذا نموذج ماوس OIR موحد يسمى أيضا نموذج سميث. وقام كونور وآخرون بتحسين البروتوكول وقدموا طريقة قابلة للتطبيق عالميا لتحديد مساحة VO (طمس الأوعية) و NV (الأوعية الدموية الجديدة) في عام 2009 ، مما زاد من قبول واستخدام النموذج22. لا يزال نموذج الماوس OIR هو النموذج الأكثر استخداما على نطاق واسع الآن بسبب صغر حجمه ، وتكاثره السريع ، وخلفيته الوراثية الواضحة ، وقابليته للتكرار الجيد ، ومعدل نجاحه العالي.
في الفئران ، تبدأ الأوعية الدموية في الشبكية بعد الولادة مع نمو الأوعية من رأس العصب البصري إلى شبكية العين الداخلية نحو أورا سيراتا. أثناء نمو الشبكية الطبيعي، تنبت الأوعية الشبكية الأولى من رأس العصب البصري حول الولادة، وتشكل شبكة موسعة (الضفيرة الأولية) التي تصل إلى المحيط حول يوم ما بعد الولادة 7 (P7)23. ثم تبدأ الأوعية في النمو في شبكية العين لتشكيل طبقة عميقة ، واختراق شبكية العين ، وإنشاء شبكة صفائحية حول الطبقة النووية الداخلية (INL) كما هو الحال في الإنسان24. بحلول نهاية الأسبوع الثالث بعد الولادة (P21) ، اكتمل تقريبا تطور الضفيرة الأعمق. بالنسبة لنموذج الماوس OIR ، يظهر انسداد الأوعية الدموية دائما في شبكية العين المركزية بسبب الانحطاط السريع لعدد كبير من شبكات الأوعية الدموية غير الناضجة في المنطقة الوسطى أثناء التعرض لفرط التأكسج. لذلك ، يحدث نمو الأوعية الدموية الجديدة المرضية أيضا في شبكية العين المحيطية الوسطى ، وهي حدود المنطقة غير التروية ومنطقة الأوعية الدموية. ومع ذلك ، فقد تشكلت أوعية الشبكية البشرية تقريبا قبل الولادة. أما بالنسبة للأطفال الخدج، فإن شبكية العين الطرفية ليست وعائية بالكامل عند تعرضها لفرط التأكسج25,26. لذلك يظهر انسداد الأوعية الدموية والأوعية الدموية الجديدة بشكل رئيسي في شبكية العين الطرفية27,28. على الرغم من هذه الاختلافات ، فإن نموذج OIR للفأر يلخص عن كثب الأحداث المرضية التي تحدث أثناء الأوعية الدموية الجديدة الناجمة عن نقص التروية.
يمكن تقسيم تحريض نموذج OIR إلى مرحلتين29: في المرحلة 1 (مرحلة فرط التأكسج) ، يتم إيقاف نمو الأوعية الدموية في شبكية العين أو تخلفه مع انسداد وانحدار الأوعية الدموية نتيجة لانخفاض VEGF وموت الخلايا المبرمج للخلايا البطانية 24,30 ؛ في المرحلة 2 (مرحلة نقص الأكسجة) ، ستصبح إمدادات الأكسجين في شبكية العين غير كافية في ظل ظروف هواء الغرفة29 ، وهو أمر ضروري للنمو العصبي والتوازن 19,31. عادة ما يؤدي هذا الوضع الإقفاري إلى توسع الأوعية الدموية الجديدة غير المنظم وغير الطبيعي.
حاليا ، طريقة النمذجة شائعة الاستخدام هي بالتناوب بين التعرض العالي / المنخفض للأكسجين: تتعرض الأمهات وصغارهن للأكسجين بنسبة 75٪ لمدة 5 أيام في P7 تليها 5 أيام في هواء الغرفة حتى أظهر P17 نتائج مماثلة22 ، وهي نقطة النهاية لتحريض نموذج الماوس OIR. (الشكل 1). بالإضافة إلى محاكاة ROP ، يمكن أيضا استخدام هذا التنسيب المرضي بوساطة نقص التروية لدراسة أمراض الشبكية الإقفارية الأخرى. تشمل القياسات الرئيسية لهذا النموذج تحديد مساحة VO و NV ، والتي يتم تحليلها من حوامل مسطحة في الشبكية عن طريق تلطيخ التألق المناعي أو تروية FITC-dextran. يمكن دراسة كل فأر مرة واحدة فقط بسبب العملية المميتة. في الوقت الحاضر ، هناك طرق قليلة لمراقبة التغيرات الديناميكية للأوعية الدموية في الشبكية بشكل مستمر أثناء عملية الانحدار الوعائي وتكوين الأوعية الدموية المرضية32. في هذه الورقة ، نقدم بروتوكولا مفصلا لتحريض نموذج OIR ، وتحليل الحوامل المسطحة في الشبكية بالإضافة إلى سير عمل تصوير الأوعية الدموية بقاع العين (FFA) على الفئران والذي سيكون مفيدا في الحصول على فهم أكثر شمولا للتغيرات الديناميكية الوعائية خلال مرحلتين من نموذج فأر OIR.
Protocol
تمت الموافقة على جميع الإجراءات التي تنطوي على استخدام الفئران من قبل لجنة أخلاقيات التجارب الحيوانية التابعة لمركز تشونغشان للعيون ، جامعة صن يات صن ، الصين (الرقم المعتمد: 2020-082) ، ووفقا للمبادئ التوجيهية المعتمدة للجنة رعاية واستخدام الحيوانات التابعة لمركز تشونغشان للعيون وبيان جمعية البحوث في الرؤية وطب العيون (ARVO) لاستخدام الحيوانات في أبحاث العيون والرؤية.
1. تحريض نموذج OIR الماوس
- استخدم الفئران ذات المعدل المنخفض من التشوه الخلقي للعينين ، على سبيل المثال ، الفئران C57BL / 6J ، وتزاوجها بنسبة ذكور / إناث = 1: 2. احصل على الجراء المولودة في نفس اليوم وابدأ في تحفيز نموذج OIR في P7. سجل وزن الجسم من الجراء الماوس بدقة قبل النمذجة.
ملاحظة: لاحظ يوم الميلاد ك P0. سجل وزن كل ماوس بانتظام. وزن الجسم من الجراء حديثي الولادة مهم جدا أثناء تحريض OIR لأن حساسية الفئران في حالات مختلفة للأكسجين مختلفة. استبعاد الجراء أكثر من 5 غرام في P7 لضمان نتائج قابلة للمقارنة. - توفير بيئة معيشية مناسبة للأمهات المرضعات وجرائهن، مثل ضبط درجة الحرارة على 23 درجة مئوية ± 2 درجة مئوية، والتحكم في الرطوبة عند 40٪-65٪، بالتناوب 12 ساعة من الضوء و12 ساعة من الظلام كل يوم، وإضافة بعض الصوف القطني إلى القفص للتعشيش، وضمان الغذاء والماء المعقمين بشكل كاف، والاحتفاظ بهما في أقفاص ذات تهوية فردية (IVC).
- مراقبة مستوى الرطوبة ودرجة الحرارة داخل الغرفة. تحكم في الرطوبة بين 40٪ إلى 65٪ وحافظ على درجة الحرارة عند 23 درجة مئوية ± 2 درجة مئوية.
- تحقق من إمدادات الأكسجين باستخدام مستشعرات الأكسجين ، وحافظ على مستوى ثابت من الأكسجين عند 75٪ وتحكم في معدل تدفق الأكسجين عند 0.5-0.75 لتر / دقيقة. ضع 50 جم من جير الصودا في الجزء السفلي من الغرفة لامتصاص CO2 المفرط والحفاظ على قيم CO2 أقل من 3٪ 22.
- راقب سلوكيات الأمهات المرضعات مثل سلوك بناء العش ، وعض الجراء ، ورفض الرضاعة مرة واحدة على الأقل في اليوم. القضاء على الأمهات المرضعات ذوات الأمومة الضعيفة.
- ضع الجراء P7 (ذكورا وإناثا) وأمهاتهم المرضعات في غرفة أكسجين يكون فيها مستوى الأكسجين 75٪ لمدة 5 أيام إلى P12. تجنب الفتح غير الضروري للغرفة خلال فترة تحريض النموذج. تأكد من وجود أمهات بديلات إضافيات للاستبدال ، في حالة وفاة الأمهات المرضعات بسبب إصابة الرئة أثناء وجودهن في فرط التأكسج.
ملاحظة: لضمان قابلية التجربة للمقارنة، قم بتقييد العدد إلى 6-8 جراء لكل أم. انتبه إلى المشكلة المحتملة لسمية الأكسجين ، والتي تسبب وفاة بعض الأمهات المرضعات. تشمل علامات إصابة الرئة مفرطة الأوكسيك لدى الأمهات المرضعات ، على سبيل المثال لا الحصر ، تقلب معدل التنفس ، وانخفاض النشاط ، وانخفاض التغذية. عندما تحدث الظاهرة المذكورة أعلاه ، قم بالقتل الرحيم للأم المرضعة بنسبة 1٪ من الصوديوم بنتوباربيتال (50 مجم / كجم) في أقرب وقت ممكن. قم بإعداد بعض الأمهات البديلات ، على سبيل المثال ، 129S1 / SvImJ للاستبدال واستخدمهن فقط إذا لزم الأمر. لا ينصح باستبدال الأمهات المرضعات كروتين ، لأن هذا سيؤدي إلى فتح متكرر لغرفة الأكسجين ، مما يؤدي إلى مستويات أكسجين غير مستقرة وعدوان الأمهات. - أحضر الجراء وأمهاتهم المرضعات مرة أخرى إلى هواء الغرفة في P12 وراقب وزن جميع الجراء باستمرار حتى P17. قم بتجميع الجراء بناء على الوزن للتأكد من أن كل مجموعة تجريبية لها توزيع وزن مماثل.
2. إعداد الشبكية يتصاعد كله وتلطيخ التألق المناعي
- سجل وزن الجسم من الجراء. التضحية الجراء عن طريق جرعة زائدة من مخدر (1٪ الصوديوم بنتوباربيتال 50 ملغ / كغ) أو استنشاق ثاني أكسيد الكربون2 . يمكن استخدام طرق أخرى للقتل الرحيم ، مثل خلع عنق الرحم واستئصال الصدر الثنائي ، إذا لزم الأمر.
- استخدم مقص منحني لإطلاق الاتصال بين مقل العيون والأنسجة المدارية. ثم ، ضع ملقطا منحنيا في الجزء الخلفي من مقلة العين ، وقم بتثبيت العصب البصري ، وارفع العين بسرعة من المدار. اغسل مقل العيون في محلول ملحي مخزن للفوسفات 1x مبرد مسبقا (PBS) لإزالة الشعر والدم من سطح مقل العيون.
- ضع مقل العيون الذي تم تنظيفه في أنبوب طرد مركزي دقيق سعة 2 مل مملوء بنسبة 4٪ بارافورمالديهايد (PFA) واحتضنه لمدة 15 دقيقة في درجة حرارة الغرفة على شاكر بسرعة 12-15 دورة في الدقيقة (دورة في الدقيقة) (التثبيت الأولي).
تحذير: من المعروف أن بارافورمالدهيد مسبب للحساسية ، سام بشكل عام ، وسام للغاية للخلايا. اتبع تعليمات السلامة بدقة وتجنب الاستنشاق وملامسة الجلد. - استخدم طبقا ثقافيا وضع قطرة من 1x PBS في الجزء المركزي وقم بتنفيذ الخطوات التالية تحت مجهر تشريح ووضع مقلة عين واحدة في هذه القطرة. امسك مقلة العين بزوج من الملقط وثقب القرنية بعناية في طرف القرنية باستخدام إبرة حقنة 1 مل. أدخل طرف المقص في هذا الثقب واقطع القرنية بعناية على طول طرف القرنية. احرص على عدم قطع شبكية العين.
- قم بإزالة القزحية والعدسة باستخدام زوج من الملقط. ثم ضع كوب العين المتبقي في PFA بنسبة 4٪ وقم بإصلاحه مرة أخرى لمدة 45 دقيقة أخرى في درجة حرارة الغرفة على شاكر بسرعة 12-15 دورة في الدقيقة (التثبيت الثانوي).
- استخدم طبقا ثقافيا وضع قطرة من 1x PBS في الجزء المركزي. ضع مقلة العين الثابتة في هذه القطرة. امسك مقلة العين بزوج من الملقط. افصل طبقات شبكية العين والصلبة بلطف باستخدام ملقطين. ضع طرف المقص بين طبقات الشبكية والصلبة واقطع الصلبة باتجاه العصب البصري. قشر الصلبة من شبكية العين والحصول على كوب الشبكية.
ملاحظة: أمسك الكأس الخلفي بالعصب البصري باستخدام الملقط، ثم استخدم الطرف المنحني لملقط آخر للضغط لأسفل على الصلبة عند رأس العصب البصري وتدليك الشبكية بلطف في حركة كاسحة إلى الأمام كبديل لإطلاق الشبكية. - استخدم الملقط لتحرير الاتصال بين الأوعية الهيالويد الشعاعية والشبكية المحيطية ، وقم بتثبيت جذر الأوعية الهيالويد القريبة من رأس العصب البصري ، واقطع الأوعية الهيالويد بعناية.
- استخدم ماصة 2 مل مع قطع الطرف لنقل كوب الشبكية. ضع كوب الشبكية في بئر واحد في طبق من 48 بئرا واغسله لمدة 3 × 5 دقائق مع 1x PBS في درجة حرارة الغرفة على شاكر بسرعة 12-15 دورة في الدقيقة.
- احتضن كوب الشبكية في محلول مختلط من 1٪ Triton X-100 (في PBS) و 5٪ مصل الحمار الطبيعي (في PBS) بين عشية وضحاها عند 4 درجات مئوية.
- بدلا من ذلك ، قم بحظر الشبكية واختراقها في درجة حرارة الغرفة لمدة 1 ساعة كبديل. تغيير مصل حجب وفقا لمصدر الجسم المضاد الثانوي.
- في حالة وضع علامة على الأوعية الدموية في الشبكية باستخدام Isolectin B4 ، احتضن شبكية العين في بئر من صفيحة 48 بئرا مع مصل الحمار الطبيعي بنسبة 0.1٪ (400 ميكرولتر) و IsolectinB4-594 (1:400) بين عشية وضحاها عند 4 درجات مئوية على شاكر بسرعة 12-15 دورة في الدقيقة.
ملاحظة: في حالة وضع علامات على الأوعية الدموية بعلامات أخرى، مثل CD31، أو وضع علامات على خلايا أخرى، استخدم أجساما مضادة أولية محددة لتصنيفها. - احتضان شبكية العين مع 1:100-1:500 الأجسام المضادة الأولية المحددة (في 400 ميكرولتر 0.1٪ مصل الحمار العادي) عند 4 درجات مئوية على شاكر بسرعة 12-15 دورة في الدقيقة لمدة 48 ساعة.
- بعد العودة إلى درجة حرارة الغرفة ، اغسل شبكية العين بنسبة 0.1٪ PBST (0.1٪ TritonX-100 في PBS) لمدة 3 × 20 دقيقة على شاكر بسرعة 12-15 دورة في الدقيقة.
- احتضان شبكية العين مع 1: 1000 من الأجسام المضادة الثانوية (في 400 ميكرولتر 0.1٪ مصل الحمير الطبيعي) بين عشية وضحاها عند 4 درجات مئوية على شاكر بسرعة 12-15 دورة في الدقيقة. (اختياري)
- بدلا من ذلك ، احتضن شبكية العين بأجسام مضادة ثانوية عالية التقارب في درجة حرارة الغرفة لمدة 1 ساعة.
- احتضان شبكية العين باستخدام DAPI (1:1000) في درجة حرارة الغرفة لمدة 20-25 دقيقة لوضع علامة على النواة.
ملاحظة: اختبر نسب التخفيف المثلى لجميع الأجسام المضادة المستخدمة في الخطوات 10-11 و13-14 في مرحلة ما قبل التجربة. - اغسل شبكية العين لمدة 3 × 30 دقيقة مع 0.1٪ PBST على شاكر بسرعة 12-15 دورة في الدقيقة في درجة حرارة الغرفة.
- انقل كوب الشبكية إلى شريحة نظيفة مع توجيه الفتحة لأعلى. اقطع شبكية العين شعاعيا في مواضع الساعة 3 و 6 و 9 و 12 من الطرفية إلى المركزية عن طريق قطع حوالي 1-1.5 مم بعيدا عن رأس العصب البصري.
- أضف بضع قطرات من 1x PBS لشطف شبكية العين ثلاث مرات. استخدم الورق المصنوع من الهواء لتجفيف شبكية العين وتسطيحها. أضف قطرة من وسط التركيب (انظر جدول المواد) إلى وسط الغطاء وتوقف عن إضافته حتى يزداد قطر القطرة إلى نصف الغطاء الانزلاقي. اقلب الغطاء بسرعة وضعه فوق شبكية العين المنتشرة. تجنب تشكيل فقاعات.
- التقط صورا لحوامل الشبكية المسطحة أو قم بتخزين الشرائح وحمايتها من الضوء عند 4 درجات مئوية.
3. تحليل وتقدير كمي للحوامل المسطحة للشبكية
ملاحظة: بالنسبة لنموذج الفأر OIR ، غالبا ما يسجل الباحثون منطقة انسداد الأوعية الدموية المركزية في الشبكية والأوعية الدموية المرضية المحيطية للشبكية خلال P12-P25. وقد أظهرت الدراسات السابقة أن المنطقة اللاوعائية المركزية في شبكية العين تصل إلى الحد الأقصى عند P12 وتتقلص تدريجيا من P13 إلى P17. في الوقت نفسه ، تصل شبكية العين من الفئران OIR إلى ذروة منطقة الأوعية الدموية الجديدة في حوالي P1722,29. من P17 ، تتراجع الأوعية الجديدة تدريجيا وتنمو الأوعية الوظيفية مرة أخرى في المنطقة اللاوعائية. يعود الأوعية الدموية في الشبكية بشكل أساسي إلى طبيعته في P2533.
- التقط صورا لحوامل الشبكية المسطحة بواسطة مجهر فلوري (انظر جدول المواد) باستخدام عدسة موضوعية 10x. أولا ، اختر قناة DAPI واضبط رأس العصب البصري في وسط المجال البصري. ثم اضبط القنوات الأخرى وركز على الأوعية الدموية السطحية للشبكية. تحقق من اللوحات في برنامج صور (راجع جدول المواد) وقم بتعيين عدد الصور التي تحتاج إلى خياطة. انقر على بدء التجربة لالتقاط شبكية العين بأكملها.
- استخدم برنامج معالجة الصور (انظر جدول المواد) لتحديد مساحة طمس الأوعية (VO) والأوعية الدموية الجديدة (NV) بعد تلطيخ التألق المناعي.
- أولا ، انقر فوق أداة العصا السحرية وقم بتعيين تسامح مناسب وفقا للاختلاف في السطوع وحرك المؤشر إلى الخلفية وانقر فوق الماوس. ثم، اختر تحديد عكس للحصول على مخطط تفصيلي أساسي للشبكية. استخدم أداة Lasso لمزيد من التفاصيل حول شبكية العين. باستخدام دالة الرسم البياني ، سجل قيمة البكسل لشبكية العين بأكملها وقم بتدوينها أو إنشاء جدول في برنامج قاعدة بيانات.
- قسم صورة شبكية العين إلى أربعة أرباع. في كل رباعي، استخدم أداة لاسو لرسم منطقة VO (الشكل 2A-C)، واستخدم أداة العصا السحرية لتحديد منطقة NV (الشكل 2D-F). من خلال معلومات البكسل في الرسم البياني ، احسب نسبة بكسل VO و NV إلى شبكية العين بأكملها ، أي النسبة المئوية لمنطقة VO أو NV بالنسبة إلى شبكية العين بأكملها.
ملاحظة: هناك أيضا خط أنابيب مفتوح المصدر ومؤتمت بالكامل لتحديد كمي لمناطق VO و NV في صور OIR باستخدام الشبكات العصبية للتعلم العميق (http://oirseg.org/) ، مما يوفر طريقة موثوقة وموفرة للوقت للباحثين وكذلك يوحد معيار القياس الكمي34.
- سجل معلومات البكسل في جدول جداول بيانات، وهو مناسب للتحليل اللاحق.
4. التصوير في الجسم الحي مع تصوير الأوعية الوريدية قاع العين الفلوريسين (FFA)
ملاحظة: بالنسبة لفئران OIR ، لا يمكن استخدام كل من تروية FITC وتلطيخ التألق المناعي إلا لمرة واحدة بسبب وفاة التجارب. بالمقارنة مع هذا ، فإن إحدى مزايا FFA هي ملاحظة التغيرات الديناميكية لأوعية شبكية العين للفئران أثناء التطور والحالة المرضية في الجسم الحي35,36.
- وزن الجراء قبل التخدير.
- تخدير الجراء عن طريق الحقن داخل الصفاق من 0.3 ٪ من الصوديوم بنتوباربيتال بجرعة 30-50 ملغ / كغ.
ملاحظة: بالنسبة للفئران في غضون 1 شهر ، انتبه إلى جرعات التخدير. استخدم تركيزات وجرعات أقل من المخدر لتقليل موت الفئران الناجم عن التخدير. بعد تخدير الجراء ، استخدم وسادة تدفئة صغيرة للحفاظ على درجة حرارة الجسم. انخفاض حرارة الجسم لا يؤثر فقط على الوظيفة الفسيولوجية للجراء ، ولكن يؤدي أيضا إلى تغييرات في البلورات ويسرع من تطور إعتام عدسة العين. - استخدم 20 ميكرولتر من قطرات العين الحدقة (0.5٪ تروبيكاميد + 0.5٪ فينيليفرين هيدروكلوريد) لكل جرو وانتظر لمدة 5 دقائق لتحقيق توسع حدقة العين طويل الأمد (الشكل 3A ، B).
- أحضر الجراء المخدرة أمام جهاز التصوير (انظر جدول المواد). احتفظ بالجراء على وسادة تسخين صغيرة ، وضع الجراء في وضع مستقر ، واستخدم الدموع الاصطناعية بانتظام للحفاظ على الرطوبة في القرنية. انقر على وضع تصوير قاع العين بالأشعة تحت الحمراء (IR) لضبط رأس العصب البصري إلى وسط الشاشة.
ملاحظة: عند مراقبة عين واحدة من الجراء ، لا تنس حماية العين الأخرى. استخدم قطرات العين هيبروميلوز لمنع القرنية من التبييض بسبب الجفاف. - بعد الحقن داخل الصفاق من محلول ملح الصوديوم الفلوريسين 0.5٪ ، انقر فوق الزر FA وزر الحقن على الفور على لوحة اللمس في جهاز التصوير لبدء التوقيت. تسجيل الصور بعد 3 دقائق عندما تدخل الدورة الدموية للشبكية في المرحلة الوريدية ومراقبة شبكية العين بما لا يقل عن 6-8 دقائق.
ملاحظة: بعد الحقن داخل الصفاق لمحلول ملح الصوديوم الفلوريسين ، يظهر الجلد والغشاء المخاطي والبول للجراء أخضر مصفر واضح. يتم إفراز معظم الفلوريسين من قبل الجراء في غضون يوم واحد. حقن الصوديوم الفلوريسين داخل الصفاق كل يوم لمدة ست مرات لا يسبب آثارا جانبية كبيرة37. - حرك رأس العصب البصري إلى وسط منطقة التقاط الصورة والتقط الصورة الأولى للشبكية المركزية. ثم حرك عدسة جهاز التصوير أفقيا إلى الجانب الأنفي من العين حتى يقع رأس العصب البصري في منتصف جانب واحد من منطقة التقاط الصورة والتقط الصورة الثانية. استمر في التقاط صور للشبكية الصدغية والعليا والسفلية، على التوالي باستخدام هذه الطريقة (الشكل 3C).
ملاحظة: التقط صورا "خمسة اتجاهات" في غضون 12 دقيقة عند حدوث مرحلة الانحدار. يسمح لموضع رأس العصب البصري في الصورة السفلية بعدم السقوط على الهامش بسبب ضبط الزاوية المحدودة للعدسة. - احفظ الصور واستخدم برنامج معالجة الصور للخياطة.
5. معالجة الصور لتصوير الأوعية الدموية قاع العين بالفلوريسين (FFA)
- افتح برنامج معالجة التصوير وانقر على جديد في ملف لإنشاء لوحة قماشية جديدة بخلفية سوداء (الشكل 4A).
- افتح صورة للشبكية المركزية أولا في طبقة الخلفية. انقر فوق ملف وأضف الصورة الثانية. اضبط عتامة الصورة الثانية على 60٪ ، حرك الصورة الثانية وقم بتغيير حجمها حتى تتداخل نفس الأجزاء من الصورتين بشكل كبير. انقر فوق الزر التبديل بين أوضاع التحويل الحر والاعوجاج وقم بإجراء تعديلات دقيقة على الأوعية إذا لزم الأمر. ثم ، قم بإعادة عتامة الصورة الثانية إلى 100٪ (الشكل 4A ، B).
- حدد صورتين في نفس الوقت وانقر على طبقات المزج التلقائي. تحقق من البانوراما كطريقة مزج بالإضافة إلى تحديد الجملتين التاليتين. انقر فوق موافق وأكمل خياطة الصورة لأول صورتين (الشكل 4C ، D).
- التقط أول صورتين مخيطتين ككل ، وأضف الصورة الثالثة ، واستمر في المزج. كرر الطرق المذكورة أعلاه لإكمال خياطة خمس صور (الشكل 4E).
- استخدم أداة الاقتصاص لقص صور FFA في أوقات مختلفة إلى حجم موحد ومراقبة التغيرات الديناميكية للأوعية الدموية في الشبكية من P15 إلى P25 في كل من الجراء العادية و OIR.
6. التحليل الإحصائي
- القيم الحالية كمتوسط ± الانحراف المعياري (s.d.).
- استخدم اختبار t الخاص بالطالب لمقارنة عينتين مستقلتين. استخدم ANOVA أحادي الاتجاه لمقارنة مجموعات متعددة من البيانات ودمجها مع اختبار Dunnett أو Tukey ، وهو اختبار مقارنة متعدد شائع الاستخدام.
- بالنسبة للبيانات غير الموزعة بشكل طبيعي، استخدم اختبار Mann-Whitney U أو اختبار Kruskal Wallis. ضع في اعتبارك وجود فروق ذات دلالة إحصائية عند < P 0.05.
النتائج
في نموذج الماوس OIR ، فإن النتيجة الأكثر أهمية وأساسية هي التحديد الكمي لمنطقة VO و NV. بعد العيش في بيئة فرط التأكسج لمدة 5 أيام من P7 ، أظهرت شبكية العين المركزية للجراء أكبر منطقة غير تروية. تحت تحفيز نقص الأكسجة في 5 أيام أخرى ، تم إنتاج الأوعية الدموية الجديدة في الشبكية تدريجيا والتي تألقت بشكل مكثف أكثر من الأوعية الطبيعية المحيطة. بعد P17 ، تراجعت إشارة التألق للأوعية الدموية الجديدة المرضية بسرعة مع إعادة تشكيل شبكية العين (الشكل 5A). من خلال التحكم في حجم القمامة وزيادة وزن الجراء بعد الولادة ، أظهرت منطقة VO و NV من نموذج فأر OIR قابلية جيدة للتكرار والاستقرار وحدثت ذروة تجديد الأوعية الدموية في الشبكية في P17 ، والتي كانت تتماشى مع الدراسات السابقة (الشكل 5B ، C).
FFA هو أداة مثالية لدراسة الأوعية الدموية في الشبكية. بالنظر إلى تطبيق FFA في الجسم الحي ، فإنه يظهر انخفاضا كبيرا في نفايات التجارب وكذلك يعرض التغيرات الديناميكية لأوعية الشبكية مع مرور الوقت. في الدراسات السابقة ، لم يتم استخدام FFA في كثير من الأحيان في الجراء الفئران وتم تقديمه في صورة ذات عرض واحد ، والتي كان من الصعب إجراء مزيد من الدراسة. في هذا البروتوكول ، تم خياطة الصور "ذات الاتجاهات الخمسة" للأوعية الدموية في شبكية العين معا باستخدام برنامج معالجة الصور لعرض مجال أوسع من شبكية العين في وقت واحد ، مما كان مفيدا للتحليل اللاحق ، إذا لزم الأمر (الشكل 4). إلى جانب ذلك ، أظهرت الجراء الفأرة OIR فتح العين لفترة طويلة لذلك تم التقاط صور FFA من P15 لتلبية متطلبات أخلاقيات الحيوان. في شبكية العين من نموذج الفأر OIR ، زاد قطر الأوعية الدموية بشكل واضح وأصبح ملتويا للغاية عند مقارنته بالفئران العادية. إلى جانب ذلك ، أظهر FFA اتجاها مشابها للتغيرات الديناميكية للأوعية الدموية في الشبكية مع تلطيخ التألق المناعي مع الأيزوليكتين B4-594 من P15-P25 دون وفاة الجراء (الشكل 6).
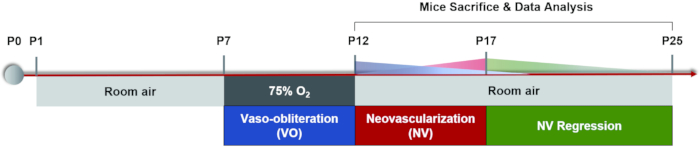
الشكل 1: مخطط كرتوني لنموذج الماوس OIR. تم تحفيز نموذج الماوس OIR عن طريق الاحتفاظ بالجراء وأمهاتهم المرضعات في غرفة لبعض الوقت (P0-P7). في P7 ، تعرض كلاهما ل 75٪ من الأكسجين لمدة 5 أيام ، مما أدى إلى تثبيط نمو الأوعية الشبكية وتسبب في فقدان كبير للأوعية الدموية في شبكية العين المركزية. ثم أعيدت الفئران إلى هواء الغرفة في P12 وبدأت شبكية العين اللاوعائية تصبح ناقصة الأكسجة نسبيا ، مما أدى إلى إعادة نمو الأوعية الطبيعية والاستجابة المرضية حول شبكية العين في منتصف المحيط. شوهد الحد الأقصى للأوعية الدموية الجديدة (NV) في P17. ثم ، خضع neovascularization المرضي لعملية الانحدار التلقائي. عاد نظام الأوعية الدموية الشبكية إلى طبيعته مرة أخرى في حوالي P25. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: قياس طمس الأوعية (VO) والأوعية الدموية الجديدة (NV) في شبكية العين الفأرية. (A) صورة لشبكية العين 10x P12 OIR كاملة التركيب ملطخة للخلايا البطانية مع isolectin B4-594. (ب) لقطة شاشة لشبكية العين مع تحديد المنطقة اللاوعائية. يتم تمييز الأدوات اللازمة لإجراء هذا القياس باستخدام الأسهم البيضاء: أداة العصا السحرية وأداة لاسو. (ج) تسليط الضوء على المنطقة اللاوعائية من شبكية العين وحفظ الصورة كنسخة. (D) صورة 10x P17 OIR شبكية العين كاملة جبل ملطخة للخلايا البطانية مع isolectin B4-594. (ه) لقطة شاشة لشبكية العين مع خصلات الأوعية الدموية الجديدة المختارة. استخدم أداة العصا السحرية واضبط التسامح الأمثل لتسليط الضوء على NV. اضبط التسامح على 3-5 وحدد المربعات المضادة للأسماء المستعارة والمتجاورة. (و) حفظ منطقة الأوعية الدموية الجديدة فقط كنسخة. تمثل أشرطة المقياس 1000 ميكرومتر، يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
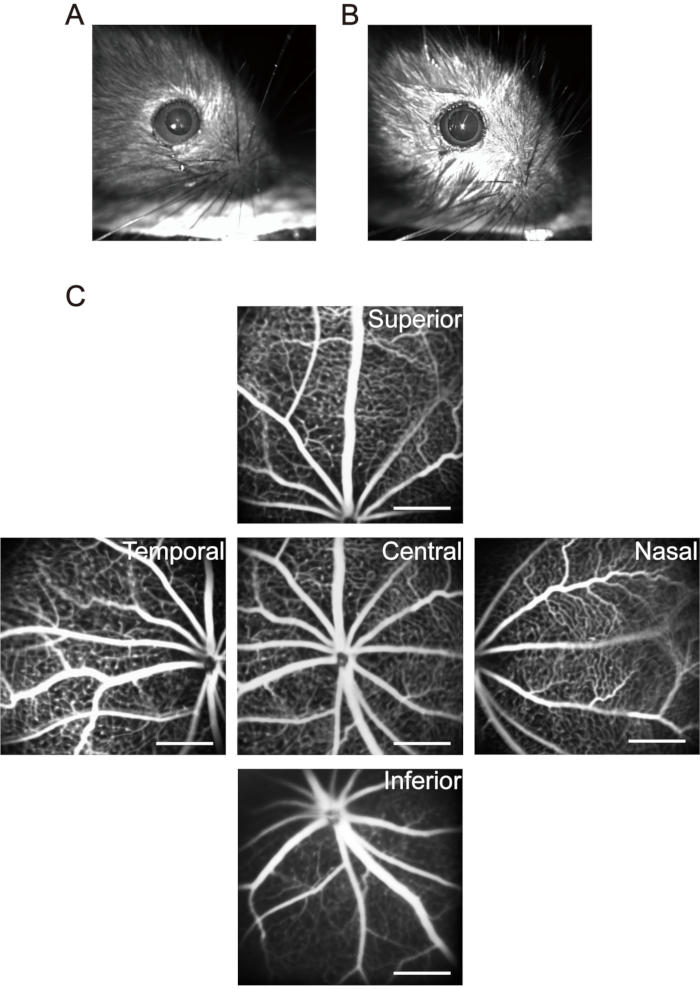
الشكل 3: الحصول على صور "خمسة اتجاهات" في شبكية العين الفأر. (أ) تلميذ الفأر العادي. (ب) تلميذ الفأر في حدقة العين. (ج) تم جمع صور "خمسة اتجاهات" للمنطقة الوسطى والأنفية والزمنية والعليا والسفلية من شبكية العين ، على التوالي (الجراء P17 في هواء الغرفة). تمثل أشرطة المقياس 500 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: سير العمل العام لخياطة صور "خمسة اتجاهات" من تصوير الأوعية الدموية بالفلوريسين قاع العين (FFA). (أ) إنشاء قماش جديد بخلفية سوداء وفتح صورة FFA للشبكية المركزية. (ب) فتح صورة FFA للشبكية الصدغية وضبط عتامة الصورة الثانية إلى 60٪ ؛ نقل الصورة وتغيير حجمها حتى تتداخل نفس الأجزاء من الصورتين بشكل كبير. انقر فوق التبديل بين وضعي التحويل الحر والاعوجاج لإجراء تعديلات دقيقة إذا لزم الأمر. أعد عتامة الصورة الثانية إلى 100٪. (ج) حدد صورتين في نفس الوقت وانقر على طبقات المزج التلقائي. (د) استخدم البانوراما كطريقة مزج لإنهاء خياطة الصورة لأول صورتين. (ه) الاستمرار في خياطة الصور عن طريق تكرار الطرق المذكورة أعلاه لإكمال خياطة جميع الصور. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 5: القياس الكمي لطمس الأوعية (VO) والأوعية الدموية الجديدة (NV) في شبكية العين لنموذج فأر OIR. (أ) صورة ل 10x حوامل شبكية العين OIR كاملة ملطخة للخلايا البطانية مع isolectin B4-594 من P12 إلى P25. بعد تعرضهم ل 75٪ من الأكسجين لمدة 5 أيام ، تم إعادة الجراء وأمهاتهم المرضعات إلى هواء الغرفة في P12 حيث وصلت منطقة طمس الأوعية إلى الحد الأقصى. أدى نقص الأكسجة النسبي في شبكية العين المركزية إلى إعادة نمو الأوعية الدموية في هذه المنطقة وكذلك تولد الأوعية الدموية المرضية في شبكية العين المحيطية الوسطى. في P17 ، وصلت خصلات الأوعية الدموية الجديدة قبل الشبكية إلى الحد الأقصى ثم تقلصت بسرعة. تراجع NV تماما وبدا أن شبكية العين طبيعية في حوالي P25. (ب) أظهر التقدير الكمي لمنطقة VO ذروة عند P12 واختفاء في حوالي P25. (ج) أظهر التقدير الكمي لمنطقة NV ذروة عند P17 وانحدار عند حوالي P25. تمثل أشرطة المقياس 1000 ميكرومتر في A. (أنوفا أحادية الاتجاه ، * P < 0.05 ، ** P < 0.01 ، ***P < 0.001 ، **** P < 0.0001). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
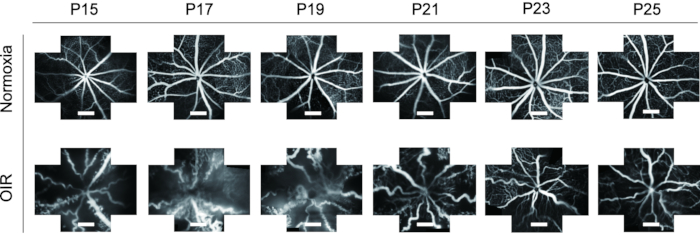
الشكل 6: التصوير في الجسم الحي لتصوير الأوعية الدموية بقاع العين بالفلوريسين (FFA) في نموذج فأر OIR. في شبكية العين من نموذج الفأر OIR ، زاد قطر الأوعية الدموية بشكل واضح وأصبح ملتويا للغاية عند مقارنته بالفئران العادية. إلى جانب ذلك ، أظهر FFA اتجاها مشابها للتغيرات الديناميكية للأوعية الدموية في الشبكية مع تلطيخ التألق المناعي مع الإيزوليكتين B4-594 من P15-P25 دون وفاة الجراء الفئران. تمثل أشرطة المقياس 500 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
تتأثر قابلية الفئران ل OIR بالعديد من العوامل. لا يمكن مقارنة الجراء من خلفية وراثية مختلفة وسلالات. في الفئران البيضاء BALB / c ، تنمو الأوعية مرة أخرى في منطقة VO بسرعة مع انخفاض كبير في خصلات الأوعية الدموية الجديدة38 ، والتي تجلب بعض الصعوبات للبحث. في الفئران C57BL / 6 ، هناك زيادة في تلف المستقبلات الضوئية بالمقارنة مع سلالة الماوس BALB / cJ39,40. وينطبق الشيء نفسه على أنواع مختلفة من الفئران المعدلة وراثيا41،42،43. إلى جانب ذلك ، تعرض الفئران C57BL / 6 مستوى أقل من تكوين الأوعية الدموية مقارنة بالفئران 129S3 / SvIM44.
زيادة الوزن بعد الولادة (PWG) من المهم أيضا النظر في45 وهو أحد المؤشرات لتقييم الحالة الغذائية لحديثي الولادة. كما أصبحت طريقة موثوقة للتنبؤ بشرطة عمان السلطانية ، والتي تجذب انتباه العديد من مصممي النماذج الحيوانية46. يؤثر PWG على استجابة الفئران لفرط التأكسج ونقص الأكسجة. في P7 ، تظهر الجراء ذات الوزن المتزايد (>5 جم) عدم كفاية طمس الأوعية الدموية والأوعية الدموية الجديدة في الشبكية ، في حين تظهر الجراء ذات الوزن المنخفض (<5 جم) استجابة واضحة لفرط التأكسج ونقص الأكسجة. إلى جانب ذلك ، في P17 ، تظهر الجراء ذات الزيادة الفقيرة (<5 جم) والواسعة (>7.5 جم) انخفاضا في NV. ومع ذلك ، فإن الجراء الذين يعانون من ضعف زيادة الوزن (<5 جم) لديهم مرحلة طمس الأوعية الدموية (VO) ومرحلة الأوعية الدموية الجديدة (NV) مع تأخير في حدوث ذروة NV45. لذلك ، من الضروري تسجيل PWG من الجراء والتحكم فيه في P7 و P17 والقضاء على الجراء ذات PWG المنخفض (< 6 g في P17) لضمان تكرار التجربة وقابليتها للمقارنة.
حجم القمامة له تأثير أكبر على PWG ، ويقترح بعض الباحثين أنه يجب أن يقتصر على 6-8 جراء / سد لتلبية متطلبات PWG22,31. حالة الأم المرضعة تحتاج إلى دراسة أيضا. الأمهات المرضعات أكثر عرضة للوفاة من تلف الرئة في بيئة فرط الأوكسيك47. إذا ماتت الأمهات المرضعات أو أهملن الجراء أثناء وبعد تحريض OIR ، فإن الجراء سوف تفقد الوزن بسهولة أو حتى تموت بسبب نقص التغذية32. لذلك ، من الضروري التأكد من وجود ما يكفي من الأمهات البديلات لاستبدالهن. ومع ذلك ، يقترح استخدام هذه الأمهات البديلات فقط عند انتهاء صلاحية الأم ، وهو ما يحدث عادة خلال فترة التعرض لفرط التأكسج أو العودة إلى هواء الغرفة22. توفير الغذاء الكافي للأمهات المرضعات مفيد أيضا لتحسين الحالة الغذائية للجراء الخاصة بهم.
ملاحظة مفيدة لإعداد حوامل الشبكية المسطحة هي أن الوقت الأمثل للتثبيت عادة ما يكون ضروريا لمزيد من التلطيخ لفترة طويلة. كفئران من P12-P25 ، يوصى بتثبيت 15 دقيقة + 45 دقيقة في درجة حرارة الغرفة29. يعد تثبيت شبكية العين عند 4 درجات مئوية بين عشية وضحاها بديلا إذا كان الوقت محدودا. إلى جانب ذلك ، فإن المخزن المؤقت القابل للنفاذ والمانع بتركيز أعلى من 1٪ Triton X-100 و 5٪ مصل الحمير العادي يقلل بشكل فعال من خلفية تلطيخ التألق المناعي وفقا لتجربتنا.
يعد تلطيخ Isolectin B4 وتروية FITC-dextran من الطرق الشائعة الاستخدام لتصور وقياس الأوعية الدموية الجديدة48,49. أحد القيود الرئيسية على هاتين الطريقتين هو أنه يجب التضحية بالفئران. لذلك ، هناك حاجة إلى طرق التصوير في الجسم الحي وتحديد كمية NV29. طور Paques et al. تقنية تسمى تصوير قاع العين بالمنظار الموضعي (TEFI) ، والتي توفر صورا رقمية عالية الدقة لشبكية العين في الفئران الحية50. يمكن ل TEFI اكتشاف التغيرات الوعائية في شبكية العين في وقت مبكر من P15 والصور التي تم الحصول عليها تتوافق مع الطرق التقليدية للتقييم. ثم قدم Mezu-Ndubuisi et al. طرق قياسات توتر الأكسجين الوعائي في الشبكية (PO2) في الجسم الحي وتصوير الأوعية الدموية بالفلوريسين (FA) ، مما يحسن فهم التغيرات الوعائية في الشبكية وتغيرات الأوكسجين بسبب ROP وغيرها من أمراض الشبكية الإقفارية37. على الرغم من أن TEFI أو FA لا دقيقان مثل الطرق التقليدية ، إلا أنهما يقللان من موت التجارب ويمكن إجراؤهما بشكل متكرر. إلى جانب ذلك ، فإنها تسمح لكل ماوس بالعمل كعنصر تحكم خاص به ، مما يجعل بيانات OIR أكثر قابلية للمقارنة. في هذه الورقة ، يتم توفير طريقة محسنة لتصوير FFA وخياطة الصور. أداء FFA على الجراء في غضون 1 شهر ليس بالأمر السهل لأن التخدير المفرط وانخفاض حرارة الجسم يسبب مباشرة وفاة الجراء. وبالتالي ، حاول استخدام الحد الأدنى من جرعة التخدير وإيلاء اهتمام خاص للحفاظ على درجة حرارة الجسم من الجراء طوال العملية وبعدها باستخدام وسادة تدفئة صغيرة. قم دائما بترطيب سطح العين بالمحلول الملحي والهيبروميلوز في حالة فشل الملاحظة التالية.
باختصار ، نموذج الفأر OIR هو نموذج شائع جدا ويستخدم على نطاق واسع من نقص تروية الشبكية والأوعية الدموية الجديدة المرضية. واحدة من المشاكل الرئيسية لهذا النموذج هي أن الجراء الفئران حديثي الولادة هي في الأساس صحية وليس لديها عدم الاستقرار الأيضي أو مشاكل في الجهاز التنفسي بالمقارنة مع الرضع المولودين قبل الأوان. فرق آخر بين نموذج الفأر OIR والبشر هو أن هناك دائما انتشار الأوعية الدموية الليفية في الأوعية الدموية الجديدة للشبكية البشرية في حين أن الأوعية الدموية الجديدة في الشبكية لا ترتبط بالتليف في نموذج الفأر OIR51. للاستفادة بشكل أفضل من هذا النموذج والحصول على مزيد من المعلومات ، يتم توفير وصف مفصل لاستخدام FFA لمراقبة التغيرات الديناميكية للأوعية الدموية الشبكية OIR ، بما في ذلك طرق التقاط صور "خمسة اتجاهات" ومعالجة الصور. ويعتقد أن FFA ستصبح طريقة فعالة جزئيا أو كليا لتحل محل تلطيخ التألق المناعي لمراقبة وتقييم مورفولوجيا ووظيفة الأوعية الدموية الشبكية49. على الرغم من أن نموذج الفأر OIR لا يشبه تماما البيئة الدقيقة والتسبب في اعتلال الشبكية الإقفاري المختلفة في البشر ، إلا أنه يوفر لنا فرصة لإجراء تجارب دوائية ومعدلة وراثيا بالإضافة إلى استكشاف آلية تكوين الأوعية الدموية المرضية على الشبكية الإقفارية51.
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
نشكر جميع الأعضاء من مختبرنا ومختبر العيون في مركز تشونغشان لطب العيون على مساعدتهم التقنية. كما نشكر البروفيسور تشونكياو ليو على الدعم التجريبي. تم دعم هذا العمل من خلال منح من المؤسسة الوطنية للعلوم الطبيعية في الصين (NSFC: 81670872; بكين، الصين)، ومؤسسة العلوم الطبيعية في مقاطعة قوانغدونغ، الصين (المنحة رقم 2019A1515011347)، ومشروع بناء مستشفى رفيع المستوى من مختبر الدولة الرئيسي لطب العيون في مركز تشونغشان لطب العيون (المنحة رقم 303020103؛ قوانغتشو ، مقاطعة قوانغدونغ ، الصين).
Materials
| Name | Company | Catalog Number | Comments |
| 1 mL sterile syringe | Solarbio | YA0550 | For preparation of retinal flat mounts and intraperitoneal injection |
| 1× Phosphate buffered saline (PBS) | Transgen Biotech | FG701-01 | For preparation of retinal flat mounts |
| 2 ml Microcentrifuge Tube | Corning | MCT-200-C | For preparation of retinal flat mounts |
| 48 Well Clear TC-Treated Multiple Well Plates | Corning | 3548 | For preparation of retinal flat mounts |
| Adhesive microscope slides | Various | For preparation of retinal flat mounts | |
| Adobe Photoshop CC 2019 | Adobe Inc. | For image analysis | |
| Carbon dioxide gas | Various | For sacrifice | |
| Cover slide | Various | For preparation of retinal flat mounts | |
| Curved forceps | World Precision Instruments | 14127 | For preparation of retinal flat mounts |
| DAPI staining solution | Abcam | ab228549 | For labeling nucleus on retinal flat mounts |
| Dissecting microscope | Olmpus | SZ61 | For preparation of retinal flat mounts |
| Fluorescein sodium | Sigma-Aldrich | F6377 | For in vivo imaging |
| Fluorescent Microscope | Zeiss | AxioImager.Z2 | For acquisition of fluorescence images of retinal flat mounts |
| Fluoromount-G Mounting media | SouthernBiotech | 0100-01 | For preparation of retinal flat mounts |
| Hydroxypropyl Methylcellulose | Maya | 89161 | For in vivo imaging |
| Isolectin B4 594 antibody | Invitrogen | I21413 | For labeling retinal vasculature on retinal flat mounts |
| Mice C57/BL6J | GemPharmatech of Jiangsu Province | For OIR model induction | |
| Micro dissecting scissors-straight blade | World Precision Instruments | 503242 | For preparation of retinal flat mounts |
| No.4 straight forceps | World Precision Instruments | 501978-6 | For preparation of retinal flat mounts |
| Normal donkey serum | Abcam | ab7475 | For preparation of retinal flat mounts |
| O2 sensor | Various | For monitoring the level of O2 | |
| OxyCycler | Biospherix | A84XOV | For OIR model induction |
| Paraformaldehyde (PFA) | Sigma | P6148-1KG | For tissue fixation |
| Pentobarbital sodium | Various | For anesthesia | |
| Soda lime | Various | For absorbing excess CO2 in the oxygen chamber | |
| SPECTRALIS HRA+OCT | Heidelberg | HC00500002 | For in vivo imaging |
| SPSS Statistics 22.0 | IBM | For statistical analysis | |
| Tansference decloring shaker | Kylin-Bell | ZD-2008 | For preparation of retinal flat mounts |
| Tissue culture dish (Low attachment) | Corning | 3261-20EA | For preparation of retinal flat mounts |
| Transfer pipettes | Various | For preparation of retinal flat mounts | |
| Triton X-100 | Sigma-Aldrich | SLBW6818 | For preparation of retinal flat mounts |
| Tropicamide | Various | For in vivo imaging | |
| ZEN Imaging Software | ZEISS | For image acquisition and export |
References
- Vavvas, D. G., Miller, J. W. Chapter 26 - Basic Mechanisms of Pathological Retinal and Choroidal Angiogenesis. Retina (Fifth Edition). 1, 562-578 (2013).
- Selvam, S., Kumar, T., Fruttiger, M. Retinal vasculature development in health and disease. Progress in Retinal and Eye Research. 63, 1-19 (2018).
- Shimizu, K., Kobayashi, Y., Muraoka, K. Midperipheral fundus involvement in diabetic retinopathy. Ophthalmology. 88 (7), 601-612 (1981).
- Ashton, N. Retinal vascularization in health and disease: Proctor Award Lecture of the Association for Research in Ophthalmology. American Journal of Ophthalmology. 44 (4), 7-17 (1957).
- Hellström, A., Smith, L. E., Dammann, O. Retinopathy of prematurity. Lancet. 382 (9902), 1445-1457 (2013).
- Xu, Y., et al. Melatonin attenuated retinal neovascularization and neuroglial dysfunction by inhibition of HIF-1α-VEGF pathway in oxygen-induced retinopathy mice. Journal of Pineal Research. 64 (4), 12473 (2018).
- Cavallaro, G., et al. The pathophysiology of retinopathy of prematurity: an update of previous and recent knowledge. Acta Ophthalmologica. 92 (1), 2-20 (2014).
- Gilbert, C., Rahi, J., Eckstein, M., O'Sullivan, J., Foster, A. Retinopathy of prematurity in middle-income countries. Lancet. 350 (9070), 12-14 (1997).
- Chen, J., Smith, L. E. Retinopathy of prematurity. Angiogenesis. 10 (2), 133-140 (2007).
- Fielder, A., Blencowe, H., O'Connor, A., Gilbert, C. Impact of retinopathy of prematurity on ocular structures and visual functions. Archives of Disease in Childhood. Fetal and Neonatal Edition. 100 (2), 179-184 (2015).
- Moshfeghi, D. M. Presumed transient reactive astrocytic hyperplasia in immature retina. Retina. 26, 69-73 (2006).
- Kandasamy, Y., Hartley, L., Rudd, D., Smith, R. The association between systemic vascular endothelial growth factor and retinopathy of prematurity in premature infants: a systematic review. British Journal of Ophthalmology. 101 (1), 21-24 (2017).
- Shah, P. K., et al. Retinopathy of prematurity: Past, present and future. World Journal of Clinical Pediatrics. 5 (1), 35-46 (2016).
- Kinsey, V. E. Retrolental fibroplasia; cooperative study of retrolental fibroplasia and the use of oxygen. AMA Archives of Ophthalmology. 56 (4), 481-543 (1956).
- Tin, W., Gupta, S. Optimum oxygen therapy in preterm babies. Archives of Disease in Childhood. Fetal and Neonatal Edition. 92 (2), 143-147 (2007).
- Liu, C. H., Wang, Z., Sun, Y., Chen, J. Animal models of ocular angiogenesis: from development to pathologies. FASEB Journal : Official Publication of the Federation of American Societies for Experimental Biology. 31 (11), 4665-4681 (2017).
- Ashton, N., Ward, B., Serpell, G. Effect of oxygen on developing retinal vessels with particular reference to the problem of retrolental fibroplasia. The British Journal of Ophthalmology. 38 (7), 397-432 (1954).
- Penn, J. S., Tolman, B. L., Lowery, L. A. Variable oxygen exposure causes preretinal neovascularization in the newborn rat. Investigative Ophthalmology & Visual Science. 34 (3), 576-585 (1993).
- Smith, L. E., et al. Oxygen-induced retinopathy in the mouse. Investigative Ophthalmology & Visual Science. 35 (1), 101-111 (1994).
- McLeod, D. S., Brownstein, R., Lutty, G. A. Vaso-obliteration in the canine model of oxygen-induced retinopathy. Investigative Ophthalmology & Visual Science. 37 (2), 300-311 (1996).
- Cao, R., Jensen, L. D., Söll, I., Hauptmann, G., Cao, Y. Hypoxia-induced retinal angiogenesis in zebrafish as a model to study retinopathy. PLoS One. 3 (7), 2748 (2008).
- Connor, K. M., et al. Quantification of oxygen-induced retinopathy in the mouse: a model of vessel loss, vessel regrowth and pathological angiogenesis. Nature Protocols. 4 (11), 1565-1573 (2009).
- Fruttiger, M. Development of the mouse retinal vasculature: angiogenesis versus vasculogenesis. Investigative Ophthalmology & Visual Science. 43 (2), 522-527 (2002).
- Stahl, A., et al. The mouse retina as an angiogenesis model. Investigative Ophthalmology & Visual Science. 51 (6), 2813-2826 (2010).
- Rivera, J. C., et al. Ischemic retinopathies: oxidative stress and inflammation. Oxidative Medicine and Cellular Longevity. 2017, 3940241 (2017).
- Bashinsky, A. L. Retinopathy of prematurity. North Carolina Medical Journal. 78 (2), 124-128 (2017).
- Flynn, J. T., et al. Retinopathy of prematurity. Diagnosis, severity, and natural history. Ophthalmology. 94 (6), 620-629 (1987).
- Aguilar, E., et al. Chapter 6. Ocular models of angiogenesis. Methods in Enzymology. 444, 115-158 (2008).
- Liegl, R., Priglinger, C., Ohlmann, A. Induction and readout of oxygen-induced retinopathy. Methods in Molecular Biology. 1834, 179-191 (2019).
- Lutty, G. A., McLeod, D. S. Retinal vascular development and oxygen-induced retinopathy: a role for adenosine. Progress in Retinal and Eye Research. 22 (1), 95-111 (2003).
- Vähätupa, M., et al. Oxygen-induced retinopathy model for ischemic retinal diseases in rodents. Journal of Visualized Experiments: JoVE. (163), (2020).
- Kim, C. B., D'Amore, P. A., Connor, K. M. Revisiting the mouse model of oxygen-induced retinopathy. Eye and Brain. 8, 67-79 (2016).
- Gammons, M. V., Bates, D. O. Models of oxygen induced retinopathy in rodents. Methods in Molecular Biology. 1430, 317-332 (2016).
- Xiao, S., et al. Fully automated, deep learning segmentation of oxygen-induced retinopathy images. Journal of Clinical Investigation Insight. 2 (24), (2017).
- McLeod, D. S., D'Anna, S. A., Lutty, G. A. Clinical and histopathologic features of canine oxygen-induced proliferative retinopathy. Investigative Ophthalmology & Visual Science. 39 (10), 1918-1932 (1998).
- Penn, J. S., Johnson, B. D. Fluorescein angiography as a means of assessing retinal vascular pathology in oxygen-exposed newborn rats. Current Eye Research. 12 (6), 561-570 (1993).
- Mezu-Ndubuisi, O. J., et al. In vivo retinal vascular oxygen tension imaging and fluorescein angiography in the mouse model of oxygen-induced retinopathy. Investigative Ophthalmology & Visual Science. 54 (10), 6968-6972 (2013).
- Zeilbeck, L. F., Müller, B., Knobloch, V., Tamm, E. R., Ohlmann, A. Differential angiogenic properties of lithium chloride in vitro and in vivo. PLoS One. 9 (4), 95546 (2014).
- Walsh, N., Bravo-Nuevo, A., Geller, S., Stone, J. Resistance of photoreceptors in the C57BL/6-c2J, C57BL/6J, and BALB/cJ mouse strains to oxygen stress: evidence of an oxygen phenotype. Current Eye Research. 29 (6), 441-447 (2004).
- Zhang, Q., Zhang, Z. M. Oxygen-induced retinopathy in mice with retinal photoreceptor cell degeneration. Life Sciences. 102 (1), 28-35 (2014).
- Okamoto, N., et al. Transgenic mice with increased expression of vascular endothelial growth factor in the retina: a new model of intraretinal and subretinal neovascularization. The American Journal of Pathology. 151 (1), 281-291 (1997).
- Ohlmann, A., et al. Norrin promotes vascular regrowth after oxygen-induced retinal vessel loss and suppresses retinopathy in mice. The Journal of Neuroscience. 30 (1), 183-193 (2010).
- Fang, L., Barber, A. J., Shenberger, J. S. Regulation of fibroblast growth factor 2 expression in oxygen-induced retinopathy. Investigative Ophthalmology & Visual Science. 56 (1), 207-215 (2014).
- Chan, C. K., et al. Differential expression of pro- and antiangiogenic factors in mouse strain-dependent hypoxia-induced retinal neovascularization. Laboratory Investigation. 85 (6), 721-733 (2005).
- Stahl, A., et al. Postnatal weight gain modifies severity and functional outcome of oxygen-induced proliferative retinopathy. The American Journal of Pathology. 177 (6), 2715-2723 (2010).
- Vanhaesebrouck, S., et al. Association between retinal neovascularization and serial weight measurements in murine and human newborns. European Journal of Ophthalmology. 23 (5), 678-682 (2013).
- Gerschman, R., Nadig, P. W., Snell, A. C., Nye, S. W. Effect of high oxygen concentrations on eyes of newborn mice. The American Journal of Physiology. 179 (1), 115-118 (1954).
- Lange, C., et al. Kinetics of retinal vaso-obliteration and neovascularisation in the oxygen-induced retinopathy (OIR) mouse model. Graefe's Archive for Clinical and Experimental Ophthalmology. 247 (9), 1205-1211 (2009).
- Huang, S., et al. Comparison of dextran perfusion and GSI-B4 isolectin staining in a mouse model of oxygen-induced retinopathy. Eye Science. 30 (2), 70-74 (2015).
- Paques, M., et al. Panretinal, high-resolution color photography of the mouse fundus. Investigative Ophthalmology & Visual Science. 48 (6), 2769-2774 (2007).
- Fletcher, E. L., et al. Animal models of retinal disease. Progress in Molecular Biology and Translational Science. 100, 211-286 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved