Method Article
Surveillance de la croissance dynamique des vaisseaux rétiniens dans un modèle murin de rétinopathie induite par l’oxygène
Dans cet article
Résumé
Ce protocole décrit une méthode détaillée pour la préparation et la coloration par immunofluorescence de supports plats rétiniens de souris et l’analyse. L’utilisation de l’angiographie à la fluorescéine du fond d’œil (FFA) pour les petits de souris et le traitement d’images sont également décrits en détail.
Résumé
La rétinopathie induite par l’oxygène (OIR) est largement utilisée pour étudier la croissance anormale des vaisseaux dans les maladies rétiniennes ischémiques, y compris la rétinopathie du prématuré (RDP), la rétinopathie diabétique proliférante (PDR) et l’occlusion veineuse rétinienne (OVR). La plupart des études OIR observent la néovascularisation rétinienne à des moments précis; cependant, la croissance dynamique des vaisseaux chez les souris vivantes le long d’un parcours temporel, ce qui est essentiel pour comprendre les maladies des vaisseaux liées à l’OIR, a été sous-étudiée. Ici, nous décrivons un protocole étape par étape pour l’induction du modèle murin OIR, en soulignant les pièges potentiels et en fournissant une méthode améliorée pour quantifier rapidement les zones de vaso-oblitération (VO) et de néovascularisation (NV) en utilisant la coloration par immunofluorescence. Plus important encore, nous avons surveillé la repousse des vaisseaux chez des souris vivantes de P15 à P25 en effectuant une angiographie du fond d’œil à la fluorescéine (FFA) dans le modèle murin OIR. L’application de FFA au modèle murin OIR nous permet d’observer le processus de remodelage pendant la repousse des vaisseaux.
Introduction
La néovascularisation rétinienne (RNV), qui est définie comme un état où de nouveaux vaisseaux pathologiques proviennent des veines rétiniennes existantes, s’étend généralement le long de la surface interne de la rétine et se développe dans l’espace vitré (ou sous-rétinien dans certaines conditions)1. C’est une caractéristique caractéristique et une caractéristique commune de nombreuses rétinopathies ischémiques, y compris la rétinopathie du prématuré (RDP), l’occlusion veineuse rétinienne (OVR) et la rétinopathie diabétique proliférative (PDR)2.
De nombreuses observations cliniques et expérimentales ont indiqué que l’ischémie est la principale cause de néovascularisation rétinienne 3,4. Dans la RDP, les nouveau-nés sont exposés à un niveau élevé d’oxygène dans des incubateurs fermés pour augmenter les taux de survie, ce qui est également un facteur important pour l’arrêt de la croissance vasculaire. Une fois le traitement terminé, les rétines des nouveau-nés connaissent une période relativement hypoxique5. D’autres situations sont observées dans l’occlusion des veines rétiniennes centrales ou branchées dans la RVO et des lésions des capillaires rétiniens sont également observées, causées par la microangiopathie dans PDR2. L’hypoxie augmente encore l’expression de facteurs angiogéniques tels que le facteur de croissance de l’endothélium vasculaire (VEGF) par la voie de signalisation du facteur 1α induit par l’hypoxie (HIF-1α) qui, à son tour, guide les cellules endothéliales vasculaires pour se développer dans la zone hypoxique et former de nouveaux vaisseaux 6,7.
La RDP est une sorte de rétinopathie proliférative vasculaire chez les nouveau-nés prématurés et l’une des principales causes de cécité infantile 8,9, caractérisée par une hypoxie rétinienne, une néovascularisation rétinienne et une hyperplasie fibreuse10,11,12. Dans les années 1950, les chercheurs ont découvert qu’une concentration élevée d’oxygène peut améliorer considérablement les symptômes respiratoires des prématurés13,14. En conséquence, l’oxygénothérapie était de plus en plus utilisée chez les prématurés à cette époque15. Cependant, parallèlement à l’utilisation généralisée de l’oxygénothérapie chez les nouveau-nés prématurés, l’incidence de la RDP augmentait d’année en année. Depuis lors, les chercheurs ont lié l’oxygène à la RDP, explorant divers modèles animaux pour comprendre la pathogenèse de la ROP et de la RNV16.
Chez l’homme, la majeure partie du développement vasculaire rétinien est achevée avant la naissance, tandis que chez les rongeurs, le système vasculaire rétinien se développe après la naissance, fournissant un système modèle accessible pour étudier l’angiogenèse dans le système vasculaire rétinien2. Avec les progrès continus de la recherche, les modèles de rétinopathie induite par l’oxygène (OIR) sont devenus des modèles majeurs pour imiter l’angiogenèse pathologique résultant de l’ischémie. Il n’y a pas d’espèce animale spécifique dans l’étude du modèle OIR et le modèle a été développé chez diverses espèces animales, y compris chaton 17, rat18, souris 19, beagle puppy 20 et poisson zèbre 21. Tous les modèles partagent le même mécanisme par lequel ils sont exposés à l’hyperoxie au début du développement rétinien, puis retournés dans l’environnement normoxique. Smith et al. ont observé que l’exposition des bébés souris à l’hyperoxie de P7 pendant 5 jours induisait une forme extrême de régression des vaisseaux dans la rétine centrale et les ramener à l’air ambiant à P12 déclenchait progressivement des touffes néovasculaires, qui se sont développées vers le corps vitré19. Il s’agissait d’un modèle de souris OIR standardisé également nommé modèle Smith. Connor et al. ont encore optimisé le protocole et fourni une méthode universellement applicable pour quantifier la zone de VO (vaso-oblitération) et NV (néovascularisation) en 2009, ce qui a augmenté l’acceptation et l’utilisation du modèle22. Le modèle murin OIR est toujours le modèle le plus largement utilisé aujourd’hui en raison de sa petite taille, de sa reproduction rapide, de son bagage génétique clair, de sa bonne répétabilité et de son taux de réussite élevé.
Chez la souris, la vascularisation rétinienne commence après la naissance avec la croissance des vaisseaux de la tête du nerf optique dans la rétine interne vers l’ora serrata. Au cours du développement rétinien normal, les premiers vaisseaux rétiniens jaillissent de la tête du nerf optique autour de la naissance, formant un réseau en expansion (le plexus primaire) qui atteint la périphérie vers le jour postnatal 7 (P7) 23. Ensuite, les vaisseaux commencent à se développer dans la rétine pour former une couche profonde, pénétrer dans la rétine et établir un réseau laminaire autour de la couche nucléaire interne (INL) comme chez l’homme24. À la fin de la troisième semaine postnatale (P21), le développement plus profond du plexus est presque terminé. Pour le modèle murin OIR, l’occlusion vasculaire apparaît toujours dans la rétine centrale en raison de la dégénérescence rapide d’un grand nombre de réseaux vasculaires immatures dans la région centrale lors de l’exposition à l’hyperoxie. Ainsi, la croissance de la néovascularisation pathologique se produit également dans la rétine périphérique moyenne, qui est la limite de la zone de non-perfusion et de la zone vasculaire. Cependant, les vaisseaux rétiniens humains se sont presque formés avant la naissance. Comme pour les prématurés, la rétine périphérique n’est pas complètement vascularisée lorsqu’elle est exposée à l’hyperoxie25,26. Ainsi, l’occlusion vasculaire et la néovascularisation apparaissent principalement dans la rétine périphérique27,28. Malgré ces différences, le modèle OIR murin récapitule étroitement les événements pathologiques qui se produisent lors de la néovascularisation induite par l’ischémie.
L’induction du modèle OIR peut être divisée en deux phases29 : en phase 1 (phase hyperoxie), le développement vasculaire rétinien est arrêté ou retardé avec occlusion et régression des vaisseaux sanguins à la suite du déclin du VEGF et de l’apoptose des cellules endothéliales 24,30 ; En phase 2 (phase hypoxie), l’apport rétinien en oxygène deviendra insuffisant dans les conditions de l’air ambiant29, ce qui est essentiel pour le développement neuronal et l’homéostasie 19,31. Cette situation ischémique entraîne généralement une néovascularisation anormale non régulée.
Actuellement, la méthode de modélisation couramment utilisée est l’alternance d’une exposition élevée / faible à l’oxygène: les mères et leurs petits sont exposés à 75% d’oxygène pendant 5 jours à P7, suivis de 5 jours dans l’air ambiant jusqu’à ce que P17 ait démontré des résultats comparables22, qui est le critère d’évaluation de l’induction du modèle murin OIR. (Figure 1). En plus de simuler la RDP, cette néovascularisation pathologique médiée par l’ischémie peut également être utilisée pour étudier d’autres maladies ischémiques de la rétine. Les principales mesures de ce modèle comprennent la quantification de la zone de VO et NV, qui sont analysées à partir de supports plats rétiniens par coloration par immunofluorescence ou perfusion FITC-dextrane. Chaque souris ne peut être étudiée qu’une seule fois en raison de l’opération létale. À l’heure actuelle, il existe peu de méthodes pour observer les changements dynamiques du système vasculaire rétinien en continu au cours du processus de régression vasculaire et d’angiogenèse pathologique32. Dans cet article, nous fournissons un protocole détaillé d’induction du modèle OIR, l’analyse des montures plates rétiniennes ainsi qu’un flux de travail d’angiographie du fond d’œil à la fluorescéine (FFA) sur des souris, ce qui serait utile pour acquérir une compréhension plus complète des changements dynamiques vasculaires au cours des deux phases du modèle murin OIR.
Protocole
Toutes les procédures impliquant l’utilisation de souris ont été approuvées par le comité d’éthique expérimentale animale du Zhongshan Ophthalmic Center, Sun Yat-sen University, Chine (numéro autorisé: 2020-082), et conformément aux directives approuvées du Comité de soin et d’utilisation des animaux du Zhongshan Ophthalmic Center et de la Déclaration de l’Association Research in Vision and Ophthalmology (ARVO) pour l’utilisation des animaux dans la recherche ophtalmique et visuelle.
1. Induction du modèle OIR de souris
- Utilisez des souris présentant un taux plus faible de malformation congénitale des yeux, par exemple des souris C57BL/6J, et accouplez-les à un ratio mâle/femelle = 1:2. Faites naître les chiots le même jour et commencez à induire le modèle OIR à P7. Enregistrez le poids corporel des chiots de souris strictement avant la modélisation.
NOTE: Notez le jour de naissance comme P0. Notez régulièrement le poids de chaque souris. Le poids corporel des nouveau-nés est très important lors de l’induction de l’OIR car la sensibilité des souris dans différents états à l’oxygène est différente. Exclure les petits de plus de 5 g à P7 pour assurer des résultats comparables. - Fournir un cadre de vie approprié pour les mères allaitantes et leurs chiots, par exemple en réglant la température à 23 °C ± 2 °C, en contrôlant l’humidité à 40%-65%, en alternant 12 h de lumière et 12 heures d’obscurité chaque jour, en ajoutant du coton à la cage pour la nidification, en assurant une nourriture et de l’eau stérilisées adéquates et en les gardant dans des cages ventilées individuellement (IVC).
- Surveillez le niveau d’humidité et de température à l’intérieur de la chambre. Contrôlez l’humidité entre 40% et 65% et maintenez la température à 23 °C ± 2 °C.
- Vérifiez l’alimentation en oxygène avec des capteurs d’oxygène, maintenez un niveau d’oxygène constant à 75% et contrôlez le débit d’oxygène à 0,5-0,75 L / min. Mettez 50 g de chaux sodée au fond de la chambre pour absorber l’excès de CO2 et maintenir les valeurs de CO2 en dessous de 3%22.
- Surveillez les comportements des mères qui allaitent, tels que le comportement de construction de nids, de mordre leurs chiots et de refuser la lactation au moins une fois par jour. Éliminer les mères allaitantes dont la maternité est pauvre.
- Placez les petits P7 (mâles et femelles) et leurs mères allaitantes dans une chambre à oxygène dans laquelle le niveau d’oxygène est de 75% pendant 5 jours à P12. Évitez l’ouverture inutile de la chambre pendant la période d’induction du modèle. Assurez-vous qu’il y a des mères porteuses supplémentaires pour le remplacement, au cas où les mères allaitantes mourraient en raison d’une lésion pulmonaire pendant l’hyperoxie.
REMARQUE: Pour assurer la comparabilité de l’expérience, limitez le nombre à 6-8 petits pour chaque mère. Faites attention au problème potentiel de la toxicité de l’oxygène, qui provoque la mort de certaines mères allaitantes. Les signes de lésion pulmonaire hyperoxique chez les mères allaitantes comprennent, sans toutefois s’y limiter, la fluctuation de la fréquence respiratoire, la diminution de l’activité et la diminution de l’alimentation. Lorsque le phénomène ci-dessus se produit, euthanasier la mère allaitante avec 1% de pentobarbital sodique (50 mg / kg) dès que possible. Préparez certaines mères porteuses, par exemple, 129S1 / SvImJ pour le remplacement et utilisez-les seulement si nécessaire. Il n’est pas recommandé de remplacer systématiquement les mères allaitantes, car cela entraînerait l’ouverture fréquente d’une chambre à oxygène, entraînant des niveaux d’oxygène instables et une agression maternelle. - Ramenez les chiots et leurs mères allaitantes à l’air ambiant à P12 et surveillez le poids de tous les chiots en continu jusqu’à P17. Regroupez les petits en fonction du poids pour vous assurer que chaque groupe expérimental a une répartition de poids similaire.
2. Préparation des montures entières rétiniennes et coloration par immunofluorescence
- Notez le poids corporel des chiots. Sacrifier les petits par une surdose d’anesthésique (1% de pentobarbital sodique 50 mg/kg) ou par inhalation de CO2 . D’autres méthodes d’euthanasie, telles que la luxation cervicale et la thoracotomie bilatérale, peuvent être utilisées si nécessaire.
- Utilisez des ciseaux incurvés pour libérer la connexion entre les globes oculaires et le tissu orbitaire. Ensuite, placez des pinces incurvées dans la partie postérieure du globe oculaire, serrez le nerf optique et soulevez rapidement l’œil de l’orbite. Lavez les globes oculaires dans une solution saline tampon phosphate 1x (PBS) pré-refroidie pour enlever les cheveux et le sang de la surface des globes oculaires.
- Placer les globes oculaires nettoyés dans un tube microcentrifuge de 2 ml rempli de 4 % de paraformaldéhyde (PFA) et incuber pendant 15 minutes à température ambiante sur un agitateur à une vitesse de 12 à 15 tours par minute (tr/min) (fixation initiale).
ATTENTION : Le paraformaldéhyde est connu pour être allergène, généralement toxique et extrêmement cytotoxique. Suivez strictement les consignes de sécurité et évitez l’inhalation et le contact avec la peau. - Utilisez une boîte de culture et mettez une goutte de 1x PBS dans la partie centrale et effectuez les étapes suivantes sous un microscope à dissection et placez un globe oculaire dans cette goutte. Tenez le globe oculaire avec une paire de pinces et percez soigneusement la cornée au niveau du limbe cornéen à l’aide d’une aiguille de seringue de 1 mL. Insérez la pointe des ciseaux dans ce trou et coupez soigneusement la cornée le long du limbe cornéen. Veillez à ne pas couper la rétine.
- Retirez le diaphragme et la lentille à l’aide d’une pince. Ensuite, placez l’œilleton restant dans le PFA à 4% et fixez à nouveau pendant 45 minutes à température ambiante sur un agitateur à une vitesse de 12-15 tr / min (fixation secondaire).
- Utilisez un plat de culture et mettez une goutte de 1x PBS dans la partie centrale. Placez le globe oculaire fixe dans cette goutte. Tenez le globe oculaire avec une paire de pinces. Séparez délicatement les couches de la rétine et de la sclérotique à l’aide de deux pinces. Placez la pointe des ciseaux entre les couches de la rétine et de la sclérotique et coupez la sclérotique vers le nerf optique. Décollez la sclérotique de la rétine et obtenez la coupe rétinienne.
REMARQUE: Tenez la coupe postérieure par le nerf optique avec une pince, puis utilisez l’extrémité incurvée d’une autre pince pour appuyer sur la sclérotique à la tête du nerf optique et masser doucement la rétine dans un mouvement de balayage vers l’avant comme alternative pour libérer la rétine. - Utilisez des forceps pour libérer la connexion entre les vaisseaux hyaloïdes radiaux et la rétine périphérique, serrez soigneusement la racine des vaisseaux hyaloïdes qui est proche de la tête du nerf optique et coupez soigneusement les vaisseaux hyaloïdes.
- Utilisez une pipette de 2 ml avec l’embout coupé pour transférer la coupe rétinienne. Placez la coupelle rétinienne dans un puits dans une assiette de 48 puits et lavez-la pendant 3 x 5 min avec 1x PBS à température ambiante sur un shaker à une vitesse de 12-15 tr / min.
- Incuber la coupe rétinienne dans une solution mélangée de 1% de Triton X-100 (dans PBS) et 5% de sérum d’âne normal (dans PBS) pendant une nuit à 4 °C.
- Alternativement, bloquer et perméabiliser les rétines à température ambiante pendant 1 h comme alternative. Changez le sérum bloquant en fonction de la source de l’anticorps secondaire.
- Si vous marquez le système vasculaire rétinien à l’aide d’isolectine B4, incuber la rétine dans un puits de plaque de 48 puits avec 0,1% de sérum d’âne normal (400 μL) et d’IsolectinB4-594 (1:400) pendant une nuit à 4 ° C sur un agitateur à une vitesse de 12-15 tr / min.
REMARQUE: Si vous marquez les vaisseaux sanguins avec d’autres marqueurs, tels que CD31, ou marquez d’autres cellules, utilisez des anticorps primaires spécifiques pour les marquer. - Incuber la rétine avec 1:100-1:500 anticorps primaires spécifiques (dans 400 μL 0,1% de sérum d’âne normal) à 4 °C sur un agitateur à une vitesse de 12-15 rpm pendant 48 h. (facultatif)
- Après le retour à la température ambiante, laver la rétine avec 0,1% PBST (0,1% TritonX-100 dans PBS) pendant 3 x 20 min sur un shaker à une vitesse de 12-15 rpm.
- Incuber la rétine avec 1:1 000 anticorps secondaires (dans 400 μL de sérum d’âne normal à 0,1 %) pendant une nuit à 4 °C sur un agitateur à une vitesse de 12-15 rpm. (facultatif)
- Alternativement, incuber la rétine avec des anticorps secondaires de haute affinité à température ambiante pendant 1 h.
- Incuber la rétine avec DAPI (1:1 000) à température ambiante pendant 20-25 min pour marquer le noyau.
NOTE: Testez les taux de dilution optimaux pour tous les anticorps utilisés aux étapes 10-11 et 13-14 de la pré-expérience. - Laver la rétine pendant 3 x 30 min avec 0,1% de PBST sur un agitateur à une vitesse de 12-15 rpm à température ambiante.
- Transférer la coupe rétinienne sur une lame propre avec l’ouverture tournée vers le haut. Coupez radialement la rétine aux positions 3, 6, 9 et 12 heures de périphérique à centrale en coupant environ 1-1,5 mm de la tête du nerf optique.
- Ajoutez quelques gouttes de 1x PBS pour rincer la rétine trois fois. Utilisez du papier posé à l’air pour sécher et aplatir la rétine. Ajoutez une goutte de support de montage (voir Tableau des matériaux) au centre du bordereau de couverture et arrêtez de l’ajouter jusqu’à ce que le diamètre de la gouttelette atteigne la moitié du bordereau. Retournez rapidement le couvercle et placez-le sur la rétine écartée. Évitez de former des bulles.
- Prenez des images des supports plats rétiniens ou rangez et protégez les lames de la lumière à 4 °C.
3. Analyse et quantification des supports plats rétiniens
NOTE: Pour le modèle murin OIR, les chercheurs enregistrent souvent la zone d’occlusion vasculaire centrale de la rétine et de néovascularisation pathologique rétinienne périphérique pendant P12-P25. Des études antérieures ont montré que la zone avasculaire centrale de la rétine atteint le maximum à P12 et rétrécit progressivement de P13 à P17; dans le même temps, la rétine des souris OIR atteint le pic de la zone de néovascularisation autour de P1722,29. À partir de P17, les néovaisseaux régressent progressivement et les vaisseaux fonctionnels repoussent dans la zone avasculaire. Le système vasculaire rétinien revient essentiellement à la normale à P2533.
- Prenez des images de montures plates rétiniennes à l’aide d’un microscope à fluorescence (voir le tableau des matériaux) avec une lentille d’objectif 10x. Tout d’abord, choisissez le canal DAPI et placez la tête du nerf optique au centre du champ visuel. Ensuite, ajustez les autres canaux et concentrez-vous sur le système vasculaire superficiel de la rétine. Vérifiez les tuiles dans un logiciel photo (voir Tableau des matériaux) et définissez le nombre de photos à assembler. Cliquez sur Démarrer l’expérience pour capturer toute la rétine.
- Utiliser un programme de traitement d’images (voir le tableau des matériaux) pour quantifier la zone de vaso-oblitération (VO) et de néovascularisation (NV) après coloration par immunofluorescence.
- Tout d’abord, cliquez sur l’outil Baguette magique et définissez une tolérance appropriée en fonction de la différence de luminosité et déplacez le curseur sur l’arrière-plan et cliquez sur la souris. Ensuite, choisissez l’inverse de sélection pour obtenir un contour de base de la rétine. Utilisez l’outil Lasso pour décrire plus en détail les détails de la rétine. À l’aide de la fonction Histogramme , enregistrez la valeur en pixels de l’ensemble de la rétine et notez-la ou générez une table dans un programme de base de données.
- Divisez l’image de la rétine en quatre quadrants. Dans chaque quadrant, utilisez l’outil Lasso pour dessiner la zone VO (Figure 2A-C) et utilisez l’outil Baguette magique pour sélectionner la zone NV (Figure 2D-F). Grâce aux informations de pixel dans l’histogramme, calculez le rapport de pixels de VO et NV à l’ensemble de la rétine, c’est-à-dire le pourcentage de zone VO ou NV par rapport à l’ensemble de la rétine.
REMARQUE: Il existe également un pipeline open source et entièrement automatisé pour la quantification des zones VO et NV dans les images OIR à l’aide de réseaux neuronaux d’apprentissage profond (http://oirseg.org/), ce qui constitue un moyen fiable et rapide pour les chercheurs et unifie la norme de quantification34.
- Enregistrez les informations de pixels dans un tableau de feuille de calcul, ce qui est pratique pour une analyse ultérieure.
4. Imagerie in vivo avec angiographie à la fluorescéine du fond d’œil (FFA)
REMARQUE: Pour les souris OIR, la perfusion FITC et la coloration par immunofluorescence ne peuvent être utilisées qu’une seule fois en raison de la mort d’animaux de laboratoire. Par rapport à cela, l’un des avantages de FFA est l’observation des changements dynamiques des vaisseaux rétiniens de souris au cours du développement et de l’état pathologique in vivo35,36.
- Pesez les chiots avant l’anesthésie.
- Anesthésier les petits par injection intrapéritonéale de pentobarbital sodique à 0,3% à une dose de 30-50 mg / kg.
REMARQUE: Pour les souris dans 1 mois, faites attention aux doses anesthésiques. Utilisez des concentrations et des doses d’anesthésique plus faibles pour réduire la mort des souris causée par l’anesthésie. Une fois les chiots anesthésiés, utilisez un petit coussin chauffant pour maintenir la température corporelle. L’hypothermie affecte non seulement la fonction physiologique des chiots, mais entraîne également des changements dans la cristalline et accélère le développement de la cataracte. - Utilisez 20 μL de gouttes ophtalmiques mydriatiques (0,5 % de tropicamide + 0,5 % de chlorhydrate de phényléphrine) pour chaque chiot et attendez 5 minutes pour obtenir une dilatation pupillaire durable (Figure 3A,B).
- Placez les chiots anesthésiés devant l’appareil d’imagerie (voir le tableau des matériaux). Gardez les chiots sur un petit coussin chauffant, placez-les dans une position stable et utilisez régulièrement des larmes artificielles pour maintenir l’humidité dans la cornée. Cliquez sur le mode d’imagerie infrarouge du fond d’œil (IR) pour ajuster la tête du nerf optique au centre de l’écran.
REMARQUE: Lorsque vous observez un œil des chiots, n’oubliez pas de protéger l’autre œil. Utilisez des gouttes ophtalmiques d’hypromellose pour empêcher la cornée de blanchir en raison de la sécheresse. - Après injection intrapéritonéale de 0,15 mL de solution de sel de fluorescéine sodique à 0,5 %, cliquez immédiatement sur le bouton FA et le bouton Injection sur l’écran tactile de l’appareil d’imagerie pour commencer le chronométrage. Enregistrez les images après 3 min lorsque la circulation sanguine de la rétine entre dans la phase veineuse et observez la rétine pas moins de 6-8 min.
REMARQUE: Après injection intrapéritonéale de solution de sel de sodium fluorescéine, la peau, la muqueuse et l’urine des chiots montrent un vert jaunâtre évident. La majeure partie de la fluorescéine est excrétée par les petits en une journée. L’injection intrapéritonéale de fluorescéine sodique tous les deux jours pendant six fois ne provoque pas d’effets secondaires significatifs37. - Déplacez la tête du nerf optique vers le centre de la zone d’acquisition d’image et prenez la première image de la rétine centrale. Ensuite, déplacez la lentille de l’appareil d’imagerie horizontalement vers le côté nasal de l’œil jusqu’à ce que la tête du nerf optique soit située au milieu d’un côté de la zone d’acquisition d’image et prenez la deuxième image. Continuez à prendre des images de la rétine temporale, supérieure et inférieure, respectivement en utilisant cette méthode (Figure 3C).
REMARQUE: Prenez des images « Cinq orientations » dans les 12 minutes pendant la phase de régression. La position de la tête du nerf optique dans l’image inférieure ne doit pas tomber sur la ligne de touche en raison du réglage limité de l’angle de la lentille. - Enregistrez les images et utilisez un programme de traitement d’image pour l’assemblage.
5. Traitement d’image de l’angiographie du fond d’œil à la fluorescéine (FFA)
- Ouvrez le programme de traitement d’imagerie et cliquez sur Nouveau dans le fichier pour créer une nouvelle zone de dessin avec un fond noir (Figure 4A).
- Ouvrez d’abord une image de la rétine centrale dans le calque d’arrière-plan. Cliquez sur Fichier et ajoutez la deuxième image. Ajustez l’opacité de la deuxième image à 60 %, déplacez et redimensionnez la deuxième image jusqu’à ce que les mêmes parties des deux images se chevauchent fortement. Cliquez sur le bouton Basculer entre les modes de transformation libre et de déformation et effectuez des ajustements subtils aux vaisseaux si nécessaire. Ensuite, réglez l’opacité de la deuxième image à 100% (Figure 4A,B).
- Sélectionnez deux images en même temps et cliquez sur Fusion automatique des calques. Cochez Panorama comme méthode de fusion et sélectionnez les deux phrases suivantes. Cliquez sur OK et terminez l’assemblage des deux premières images (Figure 4C,D).
- Prenez les deux premières images assemblées dans leur ensemble, ajoutez la troisième image et continuez à fusionner. Répétez les méthodes ci-dessus pour terminer l’assemblage de cinq images (Figure 4E).
- Utilisez l’outil Recadrage pour couper des images de FFA à différents moments à une taille uniforme et observer les changements dynamiques du système vasculaire rétinien de P15 à P25 chez les chiots normaux et OIR.
6. Analyse statistique
- Valeurs actualisées sous forme de moyenne ±écart type (s.d.).
- Utilisez le test t de Student pour comparer deux échantillons indépendants. Utilisez l’ANOVA unidirectionnelle pour comparer plusieurs ensembles de données et combinez-les avec le test de Dunnett ou de Tukey, qui est un test de comparaison multiple couramment utilisé.
- Pour les données non distribuées normalement, utilisez le test U de Mann-Whitney ou le test de Kruskal Wallis. Considérez les différences statistiques significatives lorsque P < 0,05.
Résultats
Dans le modèle murin OIR, le résultat le plus important et le plus fondamental est la quantification de la zone VO et NV. Après avoir vécu dans l’environnement hyperoxique pendant 5 jours à partir de P7, la rétine centrale des chiots a montré la plus grande zone de non-perfusion. Sous la stimulation de l’hypoxie dans 5 jours supplémentaires, une néovascularisation rétinienne a été progressivement produite qui a fluorescé plus intensément que les vaisseaux normaux environnants. Après P17, le signal de fluorescence de la néovascularisation pathologique a régressé rapidement au fur et à mesure du remodelage de la rétine (Figure 5A). En contrôlant la taille de la portée et la prise de poids postnatale des petits, l’aire de la VO et de la NV du modèle murin OIR a montré une bonne répétabilité et stabilité et le pic de néovascularisation rétinienne s’est produit à P17, ce qui était conforme aux études précédentes (Figure 5B,C).
FFA est un outil idéal pour étudier le système vasculaire rétinien. Compte tenu de l’application de FFA in vivo, il montre une grande réduction des déchets d’animaux de laboratoire ainsi que les changements dynamiques des vaisseaux rétiniens avec le temps. Dans les études précédentes, l’AFL n’était pas souvent utilisée chez les bébés souris et était présentée dans une image à vue unique, ce qui était difficile pour une étude ultérieure. Dans ce protocole, les images « à cinq orientations » du système vasculaire de la rétine ont été assemblées à l’aide d’un logiciel de traitement d’images pour afficher un champ plus large de la rétine à la fois, ce qui a été utile pour une analyse ultérieure, si nécessaire (Figure 4). En outre, les bébés souris OIR ont montré une ouverture prolongée, de sorte que les images FFA ont été prises à partir de P15 pour répondre aux exigences de l’éthique animale. Dans la rétine du modèle murin OIR, le diamètre des vaisseaux sanguins a augmenté de manière évidente et est devenu très tortueux par rapport aux souris normales. En outre, la FFA a montré une tendance similaire de changements dynamiques du système vasculaire rétinien avec coloration par immunofluorescence avec l’isolectine B4-594 de P15-P25 sans la mort des petits (Figure 6).
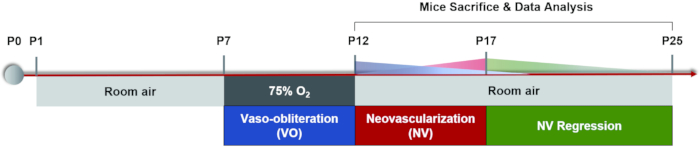
Figure 1 : Schéma de bande dessinée du modèle murin OIR. Le modèle murin OIR a été induit en gardant les petits et leurs mères allaitantes dans une pièce pendant un certain temps (P0-P7). À P7, les deux ont été exposés à 75% d’oxygène pendant 5 jours, ce qui a inhibé la croissance des vaisseaux rétiniens et provoqué une perte importante des vaisseaux dans la rétine centrale. Les souris ont ensuite été ramenées à l’air ambiant à P12 et la rétine avasculaire a commencé à devenir relativement hypoxique, déclenchant à la fois une repousse normale des vaisseaux et une réponse pathologique autour de la rétine périphérique moyenne. La néovascularisation maximale (NV) a été observée à P17. Ensuite, la néovascularisation pathologique a subi un processus de régression spontanée. Le système vasculaire rétinien était revenu à la normale vers P25. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Mesure de la vaso-oblitération (VO) et de la néovascularisation (NV) dans la rétine de la souris. (A) Image de 10x P12 OIR montage rétinien entier coloré pour les cellules endothéliales avec isolectine B4-594. (B) Capture d’écran d’une rétine avec la zone avasculaire sélectionnée. Les outils nécessaires pour effectuer cette mesure sont mis en évidence par des flèches blanches: Magic Wand Tool et Lasso Tool. (C) Mettez en surbrillance la zone avasculaire de la rétine et enregistrez l’image en tant que copie. (D) Image de 10x P17 OIR montage rétinien entier coloré pour les cellules endothéliales avec isolectine B4-594. (E) Capture d’écran d’une rétine avec des touffes néovasculaires sélectionnées. Utilisez l’outil Baguette magique et définissez une tolérance optimale pour mettre en surbrillance NV. Définissez la tolérance sur 3-5 et cochez les cases anti-alias et contiguës. (F) Enregistrer la zone de néovascularisation uniquement en tant que copie. Les barres d’échelle représentent 1 000 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
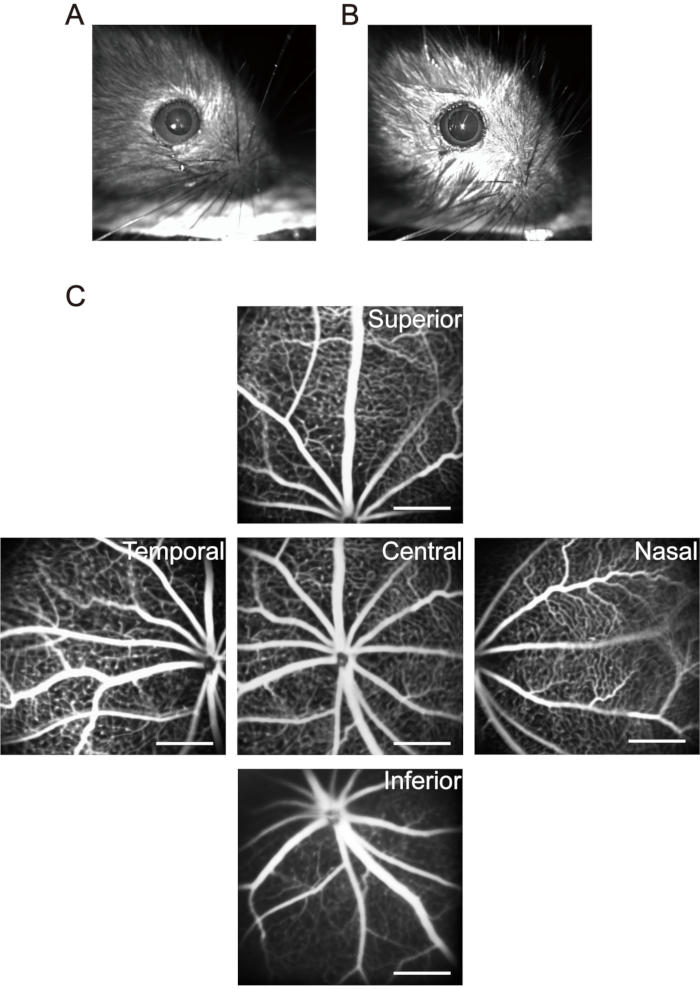
Figure 3 : Acquisition des images « Cinq orientations » dans la rétine de la souris. (A) La pupille normale de la souris. (B) Pupille de souris dans la mydriase. (C) Les images « à cinq orientations » de la zone centrale, nasale, temporale, supérieure et inférieure de la rétine ont été recueillies, respectivement (petits P17 dans l’air ambiant). Les barres d’échelle représentent 500 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Flux de travail général de l’assemblage des images « Cinq orientations » à partir de l’angiographie du fond d’œil à la fluorescéine (FFA). (A) Créez une nouvelle toile avec un fond noir et ouvrez l’image FFA de la rétine centrale. (B) Ouvrez une image FFA de la rétine temporale et ajustez l’opacité de la deuxième image à 60%; Déplacez et redimensionnez l’image jusqu’à ce que les mêmes parties des deux images se chevauchent fortement. Cliquez sur Basculer entre les modes de transformation libre et de déformation pour effectuer des ajustements subtils si nécessaire. Redéfinissez l’opacité de la deuxième image à 100 %. (C) Sélectionnez deux images en même temps et cliquez sur Auto-Blend Layers. (D) Utilisez Panorama comme méthode de fusion pour terminer l’assemblage de l’image des deux premières images. (E) Continuez à assembler les images en répétant les méthodes ci-dessus pour terminer l’assemblage de toutes les images. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 5 : Quantification de la vaso-oblitération (VO) et de la néovascularisation (NV) dans la rétine du modèle murin OIR. (A) Image de 10x montures entières de la rétine OIR colorées pour les cellules endothéliales avec de l’isolectine B4-594 de P12 à P25. Après avoir été exposés à 75% d’oxygène pendant 5 jours, les chiots et leurs mères allaitantes ont été ramenés à l’air ambiant à P12 où la zone de vaso-oblitération a atteint le maximum. L’hypoxie relative dans la rétine centrale a entraîné une repousse des vaisseaux dans cette zone ainsi qu’une angiogenèse pathologique dans la rétine périphérique moyenne. À P17, les touffes néovasculaires pré-rétiniennes ont atteint le maximum, puis ont diminué rapidement. NV a complètement régressé et la rétine semblait être normale à environ P25. (B) La quantification de la superficie de VO a montré un pic à P12 et une disparition à environ P25. (C) La quantification de la superficie de NV a montré un pic à P17 et une régression à environ P25. Les barres d’échelle représentent 1 000 μm en A. (ANOVA unidirectionnelle, *P < 0,05, **P < 0,01, ***P < 0,001, **** P < 0,0001). Veuillez cliquer ici pour voir une version agrandie de cette figure.
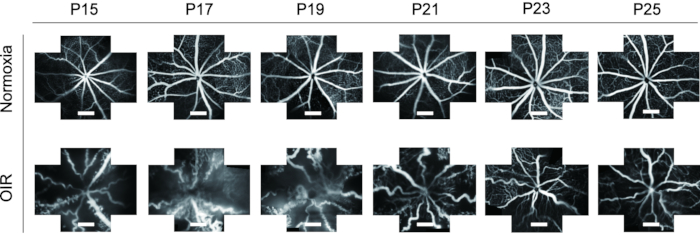
Figure 6 : Imagerie in vivo de l’angiographie du fond d’œil à la fluorescéine (FFA) dans le modèle murin OIR. Dans la rétine du modèle murin OIR, le diamètre des vaisseaux sanguins a augmenté de manière évidente et est devenu très tortueux par rapport aux souris normales. En outre, la FFA a montré une tendance similaire de changements dynamiques du système vasculaire rétinien avec coloration par immunofluorescence avec l’isolectine B4-594 de P15-P25 sans la mort des petits de souris. Les barres d’échelle représentent 500 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
La sensibilité des souris à l’OIR est affectée par de nombreux facteurs. Les petits de différents antécédents génétiques et souches ne peuvent pas être comparés. Chez les souris albinos BALB/c, les vaisseaux repoussent rapidement dans la zone VO avec une réduction significative des touffes néovasculaires38, ce qui entraîne certaines difficultés pour la recherche. Chez les souris C57BL/6, les lésions photorécepteurs sont accrues par rapport à la souche39,40 de souris BALB/cJ. Il en va de même pour différents types de souris transgéniques41,42,43. En outre, les souris C57BL / 6 présentent un niveau d’angiogenèse inférieur à celui des souris 129S3 / SvIM44.
La prise de poids postnatale (PWG) est également importante à considérer45 et est l’un des indicateurs pour évaluer l’état nutritionnel des nouveau-nés. Il est également devenu une méthode fiable pour prédire la RDP, ce qui attire l’attention de nombreux modélisateurs d’animaux46. PWG affecte la réponse des souris à l’hyperoxie et à l’hypoxie. À P7, les petits ayant un poids corporel accru (>5 g) présentent une vaso-oblitération et une néovascularisation rétinienne insuffisantes, tandis que les petits ayant un poids corporel diminué (<5 g) présentent une réponse évidente à l’hyperoxie et à l’hypoxie. En outre, à P17, les chiots ayant un gain de poids faible (<5 g) et important (>7,5 g) montrent une NV diminuée. Cependant, les chiots ayant une faible prise de poids (<5 g) ont un stade de vaso-oblitération (VO) et de néovascularisation (NV) significativement prolongé avec un retard dans l’apparition du pic NV45. Par conséquent, il est nécessaire d’enregistrer et de contrôler le PWG des petits à P7 et P17 et d’éliminer les petits à faible PWG (< 6 g à P17) pour assurer la répétabilité et la comparabilité de l’expérience.
La taille de la portée a un impact plus important sur le PWG, et certains chercheurs suggèrent qu’elle devrait être limitée à 6-8 petits / mère pour répondre aux exigences dePWG 22,31. L’état de la mère qui allaite doit également être pris en considération. Les mères allaitantes sont plus susceptibles de mourir de lésions pulmonaires dans un environnement hyperoxique47. Si les mères allaitantes meurent ou négligent leurs chiots pendant et après l’induction de l’OIR, les chiots perdront facilement du poids ou même mourront en raison du manque de nutrition32. Par conséquent, il est nécessaire de s’assurer qu’il y a suffisamment de mères porteuses pour les remplacer. Cependant, il est suggéré d’utiliser ces mères porteuses uniquement lorsque la mère expire, ce qui se produit généralement pendant la période d’exposition à l’hyperoxie ou de retour à l’air ambiant22. Fournir une nourriture adéquate aux mères qui allaitent est également utile pour améliorer l’état nutritionnel de leurs chiots.
Une note utile pour préparer les supports plats rétiniens est qu’un temps optimal de fixation est généralement nécessaire pour d’autres colorations de longue durée. Comme les souris de P12-P25, une fixation de 15 min + 45 min à température ambiante est recommandée29. Fixer la rétine à 4 °C pendant la nuit est une alternative si le temps est limité. En outre, le tampon perméable et bloquant avec une concentration plus élevée de 1% de Triton X-100 et 5% de sérum d’âne normal réduit efficacement le fond de coloration par immunofluorescence selon notre expérience.
La coloration à l’isolectine B4 et la perfusion FITC-dextran sont des méthodes couramment utilisées pour visualiser et quantifier le néovasculaire48,49. Une limitation majeure de ces deux méthodes est que les souris doivent être sacrifiées. Les méthodes d’imagerie in vivo et de quantification de NV sont donc nécessaires29. Paques et al. ont développé une technique appelée imagerie topique du fond d’œil par endoscopie (TEFI), qui fournit des photographies numériques haute résolution de la rétine chez des souris vivantes50. Le TEFI peut détecter les modifications vasculaires rétiniennes dès P15 et les images obtenues sont conformes aux méthodes conventionnelles d’évaluation. Mezu-Ndubuisi et al. ont ensuite fourni les méthodes pour les mesures in vivo de la tension vasculaire de l’oxygène (PO2) et l’angiographie à la fluorescéine (AF), améliorant la compréhension des changements vasculaires rétiniens et des altérations de l’oxygénation dues à la RDP et à d’autres maladies ischémiques de la rétine37. Bien que ni le TEFI ni l’AF ne soient aussi précis que les méthodes conventionnelles, ils réduisent la mort des animaux de laboratoire et peuvent être effectués de manière répétée. En outre, ils permettent à chaque souris de servir de propre contrôle, rendant ainsi les données OIR plus comparables. Dans cet article, une méthode améliorée d’imagerie FFA et d’assemblage d’images est fournie. Effectuer une AGL sur les chiots dans un délai de 1 mois n’est pas facile car une anesthésie excessive et une hypothermie provoquent directement la mort des chiots. Ainsi, essayez d’utiliser la dose minimale d’anesthésie et portez une attention particulière au maintien de la température corporelle des chiots tout au long et après le processus en utilisant un petit coussin chauffant. Toujours humidifier la surface oculaire avec une solution saline et de l’hypromellose en cas d’échec de l’observation suivante.
En résumé, le modèle murin OIR est un modèle très courant et largement utilisé d’ischémie rétinienne et de néovascularisation pathologique. L’un des principaux problèmes de ce modèle est que les bébés souris néonatales sont essentiellement en bonne santé et ne présentent pas d’instabilité métabolique ou de problèmes respiratoires par rapport aux nouveau-nés prématurément. Une autre différence entre le modèle murin OIR et les humains est qu’il y a toujours prolifération fibrovasculaire dans la néovascularisation rétinienne humaine alors que le néovasculaire rétinien n’est pas associé à la fibrose dans le modèle murinOIR 51. Pour mieux utiliser ce modèle et obtenir plus d’informations, une description détaillée de l’utilisation de la FFA pour surveiller les changements dynamiques du système vasculaire rétinien OIR est fournie, y compris les méthodes de prise d’images « à cinq orientations » et de traitement d’image. On pense que l’AGL deviendra une méthode efficace partiellement ou totalement pour remplacer la coloration par immunofluorescence afin d’observer et d’évaluer la morphologie et la fonction du système vasculaire rétinien49. Bien que le modèle murin OIR ne ressemble pas entièrement au microenvironnement et à la pathogenèse de diverses rétinopathies ischémiques chez l’homme, il nous donne l’occasion de mener des expériences médicamenteuses et transgéniques ainsi que d’explorer le mécanisme de l’angiogenèse pathologique sur la rétine ischémique51.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Nous remercions tous les membres de notre laboratoire et du laboratoire ophtalmique vétérinaire du centre ophtalmique de Zhongshan pour leur assistance technique. Nous remercions également le professeur Chunqiao Liu pour son soutien expérimental. Ce travail a été soutenu par des subventions de la Fondation nationale des sciences naturelles de Chine (NSFC: 81670872; Beijing, Chine), la Fondation des sciences naturelles de la province du Guangdong, Chine (subvention no 2019A1515011347) et le projet de construction d’un hôpital de haut niveau du Laboratoire clé d’État d’ophtalmologie du Centre ophtalmique de Zhongshan (subvention no 303020103; Guangzhou, province du Guangdong, Chine).
matériels
| Name | Company | Catalog Number | Comments |
| 1 mL sterile syringe | Solarbio | YA0550 | For preparation of retinal flat mounts and intraperitoneal injection |
| 1× Phosphate buffered saline (PBS) | Transgen Biotech | FG701-01 | For preparation of retinal flat mounts |
| 2 ml Microcentrifuge Tube | Corning | MCT-200-C | For preparation of retinal flat mounts |
| 48 Well Clear TC-Treated Multiple Well Plates | Corning | 3548 | For preparation of retinal flat mounts |
| Adhesive microscope slides | Various | For preparation of retinal flat mounts | |
| Adobe Photoshop CC 2019 | Adobe Inc. | For image analysis | |
| Carbon dioxide gas | Various | For sacrifice | |
| Cover slide | Various | For preparation of retinal flat mounts | |
| Curved forceps | World Precision Instruments | 14127 | For preparation of retinal flat mounts |
| DAPI staining solution | Abcam | ab228549 | For labeling nucleus on retinal flat mounts |
| Dissecting microscope | Olmpus | SZ61 | For preparation of retinal flat mounts |
| Fluorescein sodium | Sigma-Aldrich | F6377 | For in vivo imaging |
| Fluorescent Microscope | Zeiss | AxioImager.Z2 | For acquisition of fluorescence images of retinal flat mounts |
| Fluoromount-G Mounting media | SouthernBiotech | 0100-01 | For preparation of retinal flat mounts |
| Hydroxypropyl Methylcellulose | Maya | 89161 | For in vivo imaging |
| Isolectin B4 594 antibody | Invitrogen | I21413 | For labeling retinal vasculature on retinal flat mounts |
| Mice C57/BL6J | GemPharmatech of Jiangsu Province | For OIR model induction | |
| Micro dissecting scissors-straight blade | World Precision Instruments | 503242 | For preparation of retinal flat mounts |
| No.4 straight forceps | World Precision Instruments | 501978-6 | For preparation of retinal flat mounts |
| Normal donkey serum | Abcam | ab7475 | For preparation of retinal flat mounts |
| O2 sensor | Various | For monitoring the level of O2 | |
| OxyCycler | Biospherix | A84XOV | For OIR model induction |
| Paraformaldehyde (PFA) | Sigma | P6148-1KG | For tissue fixation |
| Pentobarbital sodium | Various | For anesthesia | |
| Soda lime | Various | For absorbing excess CO2 in the oxygen chamber | |
| SPECTRALIS HRA+OCT | Heidelberg | HC00500002 | For in vivo imaging |
| SPSS Statistics 22.0 | IBM | For statistical analysis | |
| Tansference decloring shaker | Kylin-Bell | ZD-2008 | For preparation of retinal flat mounts |
| Tissue culture dish (Low attachment) | Corning | 3261-20EA | For preparation of retinal flat mounts |
| Transfer pipettes | Various | For preparation of retinal flat mounts | |
| Triton X-100 | Sigma-Aldrich | SLBW6818 | For preparation of retinal flat mounts |
| Tropicamide | Various | For in vivo imaging | |
| ZEN Imaging Software | ZEISS | For image acquisition and export |
Références
- Vavvas, D. G., Miller, J. W. Chapter 26 - Basic Mechanisms of Pathological Retinal and Choroidal Angiogenesis. Retina (Fifth Edition). 1, 562-578 (2013).
- Selvam, S., Kumar, T., Fruttiger, M. Retinal vasculature development in health and disease. Progress in Retinal and Eye Research. 63, 1-19 (2018).
- Shimizu, K., Kobayashi, Y., Muraoka, K. Midperipheral fundus involvement in diabetic retinopathy. Ophthalmology. 88 (7), 601-612 (1981).
- Ashton, N. Retinal vascularization in health and disease: Proctor Award Lecture of the Association for Research in Ophthalmology. American Journal of Ophthalmology. 44 (4), 7-17 (1957).
- Hellström, A., Smith, L. E., Dammann, O. Retinopathy of prematurity. Lancet. 382 (9902), 1445-1457 (2013).
- Xu, Y., et al. Melatonin attenuated retinal neovascularization and neuroglial dysfunction by inhibition of HIF-1α-VEGF pathway in oxygen-induced retinopathy mice. Journal of Pineal Research. 64 (4), 12473 (2018).
- Cavallaro, G., et al. The pathophysiology of retinopathy of prematurity: an update of previous and recent knowledge. Acta Ophthalmologica. 92 (1), 2-20 (2014).
- Gilbert, C., Rahi, J., Eckstein, M., O'Sullivan, J., Foster, A. Retinopathy of prematurity in middle-income countries. Lancet. 350 (9070), 12-14 (1997).
- Chen, J., Smith, L. E. Retinopathy of prematurity. Angiogenesis. 10 (2), 133-140 (2007).
- Fielder, A., Blencowe, H., O'Connor, A., Gilbert, C. Impact of retinopathy of prematurity on ocular structures and visual functions. Archives of Disease in Childhood. Fetal and Neonatal Edition. 100 (2), 179-184 (2015).
- Moshfeghi, D. M. Presumed transient reactive astrocytic hyperplasia in immature retina. Retina. 26, 69-73 (2006).
- Kandasamy, Y., Hartley, L., Rudd, D., Smith, R. The association between systemic vascular endothelial growth factor and retinopathy of prematurity in premature infants: a systematic review. British Journal of Ophthalmology. 101 (1), 21-24 (2017).
- Shah, P. K., et al. Retinopathy of prematurity: Past, present and future. World Journal of Clinical Pediatrics. 5 (1), 35-46 (2016).
- Kinsey, V. E. Retrolental fibroplasia; cooperative study of retrolental fibroplasia and the use of oxygen. AMA Archives of Ophthalmology. 56 (4), 481-543 (1956).
- Tin, W., Gupta, S. Optimum oxygen therapy in preterm babies. Archives of Disease in Childhood. Fetal and Neonatal Edition. 92 (2), 143-147 (2007).
- Liu, C. H., Wang, Z., Sun, Y., Chen, J. Animal models of ocular angiogenesis: from development to pathologies. FASEB Journal : Official Publication of the Federation of American Societies for Experimental Biology. 31 (11), 4665-4681 (2017).
- Ashton, N., Ward, B., Serpell, G. Effect of oxygen on developing retinal vessels with particular reference to the problem of retrolental fibroplasia. The British Journal of Ophthalmology. 38 (7), 397-432 (1954).
- Penn, J. S., Tolman, B. L., Lowery, L. A. Variable oxygen exposure causes preretinal neovascularization in the newborn rat. Investigative Ophthalmology & Visual Science. 34 (3), 576-585 (1993).
- Smith, L. E., et al. Oxygen-induced retinopathy in the mouse. Investigative Ophthalmology & Visual Science. 35 (1), 101-111 (1994).
- McLeod, D. S., Brownstein, R., Lutty, G. A. Vaso-obliteration in the canine model of oxygen-induced retinopathy. Investigative Ophthalmology & Visual Science. 37 (2), 300-311 (1996).
- Cao, R., Jensen, L. D., Söll, I., Hauptmann, G., Cao, Y. Hypoxia-induced retinal angiogenesis in zebrafish as a model to study retinopathy. PLoS One. 3 (7), 2748 (2008).
- Connor, K. M., et al. Quantification of oxygen-induced retinopathy in the mouse: a model of vessel loss, vessel regrowth and pathological angiogenesis. Nature Protocols. 4 (11), 1565-1573 (2009).
- Fruttiger, M. Development of the mouse retinal vasculature: angiogenesis versus vasculogenesis. Investigative Ophthalmology & Visual Science. 43 (2), 522-527 (2002).
- Stahl, A., et al. The mouse retina as an angiogenesis model. Investigative Ophthalmology & Visual Science. 51 (6), 2813-2826 (2010).
- Rivera, J. C., et al. Ischemic retinopathies: oxidative stress and inflammation. Oxidative Medicine and Cellular Longevity. 2017, 3940241 (2017).
- Bashinsky, A. L. Retinopathy of prematurity. North Carolina Medical Journal. 78 (2), 124-128 (2017).
- Flynn, J. T., et al. Retinopathy of prematurity. Diagnosis, severity, and natural history. Ophthalmology. 94 (6), 620-629 (1987).
- Aguilar, E., et al. Chapter 6. Ocular models of angiogenesis. Methods in Enzymology. 444, 115-158 (2008).
- Liegl, R., Priglinger, C., Ohlmann, A. Induction and readout of oxygen-induced retinopathy. Methods in Molecular Biology. 1834, 179-191 (2019).
- Lutty, G. A., McLeod, D. S. Retinal vascular development and oxygen-induced retinopathy: a role for adenosine. Progress in Retinal and Eye Research. 22 (1), 95-111 (2003).
- Vähätupa, M., et al. Oxygen-induced retinopathy model for ischemic retinal diseases in rodents. Journal of Visualized Experiments: JoVE. (163), (2020).
- Kim, C. B., D'Amore, P. A., Connor, K. M. Revisiting the mouse model of oxygen-induced retinopathy. Eye and Brain. 8, 67-79 (2016).
- Gammons, M. V., Bates, D. O. Models of oxygen induced retinopathy in rodents. Methods in Molecular Biology. 1430, 317-332 (2016).
- Xiao, S., et al. Fully automated, deep learning segmentation of oxygen-induced retinopathy images. Journal of Clinical Investigation Insight. 2 (24), (2017).
- McLeod, D. S., D'Anna, S. A., Lutty, G. A. Clinical and histopathologic features of canine oxygen-induced proliferative retinopathy. Investigative Ophthalmology & Visual Science. 39 (10), 1918-1932 (1998).
- Penn, J. S., Johnson, B. D. Fluorescein angiography as a means of assessing retinal vascular pathology in oxygen-exposed newborn rats. Current Eye Research. 12 (6), 561-570 (1993).
- Mezu-Ndubuisi, O. J., et al. In vivo retinal vascular oxygen tension imaging and fluorescein angiography in the mouse model of oxygen-induced retinopathy. Investigative Ophthalmology & Visual Science. 54 (10), 6968-6972 (2013).
- Zeilbeck, L. F., Müller, B., Knobloch, V., Tamm, E. R., Ohlmann, A. Differential angiogenic properties of lithium chloride in vitro and in vivo. PLoS One. 9 (4), 95546 (2014).
- Walsh, N., Bravo-Nuevo, A., Geller, S., Stone, J. Resistance of photoreceptors in the C57BL/6-c2J, C57BL/6J, and BALB/cJ mouse strains to oxygen stress: evidence of an oxygen phenotype. Current Eye Research. 29 (6), 441-447 (2004).
- Zhang, Q., Zhang, Z. M. Oxygen-induced retinopathy in mice with retinal photoreceptor cell degeneration. Life Sciences. 102 (1), 28-35 (2014).
- Okamoto, N., et al. Transgenic mice with increased expression of vascular endothelial growth factor in the retina: a new model of intraretinal and subretinal neovascularization. The American Journal of Pathology. 151 (1), 281-291 (1997).
- Ohlmann, A., et al. Norrin promotes vascular regrowth after oxygen-induced retinal vessel loss and suppresses retinopathy in mice. The Journal of Neuroscience. 30 (1), 183-193 (2010).
- Fang, L., Barber, A. J., Shenberger, J. S. Regulation of fibroblast growth factor 2 expression in oxygen-induced retinopathy. Investigative Ophthalmology & Visual Science. 56 (1), 207-215 (2014).
- Chan, C. K., et al. Differential expression of pro- and antiangiogenic factors in mouse strain-dependent hypoxia-induced retinal neovascularization. Laboratory Investigation. 85 (6), 721-733 (2005).
- Stahl, A., et al. Postnatal weight gain modifies severity and functional outcome of oxygen-induced proliferative retinopathy. The American Journal of Pathology. 177 (6), 2715-2723 (2010).
- Vanhaesebrouck, S., et al. Association between retinal neovascularization and serial weight measurements in murine and human newborns. European Journal of Ophthalmology. 23 (5), 678-682 (2013).
- Gerschman, R., Nadig, P. W., Snell, A. C., Nye, S. W. Effect of high oxygen concentrations on eyes of newborn mice. The American Journal of Physiology. 179 (1), 115-118 (1954).
- Lange, C., et al. Kinetics of retinal vaso-obliteration and neovascularisation in the oxygen-induced retinopathy (OIR) mouse model. Graefe's Archive for Clinical and Experimental Ophthalmology. 247 (9), 1205-1211 (2009).
- Huang, S., et al. Comparison of dextran perfusion and GSI-B4 isolectin staining in a mouse model of oxygen-induced retinopathy. Eye Science. 30 (2), 70-74 (2015).
- Paques, M., et al. Panretinal, high-resolution color photography of the mouse fundus. Investigative Ophthalmology & Visual Science. 48 (6), 2769-2774 (2007).
- Fletcher, E. L., et al. Animal models of retinal disease. Progress in Molecular Biology and Translational Science. 100, 211-286 (2011).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon