Method Article
Überwachung des dynamischen Wachstums von Netzhautgefäßen im sauerstoffinduzierten Retinopathie-Mausmodell
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt eine detaillierte Methode zur Herstellung und Immunfluoreszenzfärbung von Netzhaut-Flachhalterungen und Analysen von Mäusen. Auch die Verwendung der Fluoresceinfundusangiographie (FFA) bei Mäusewelpen und die Bildverarbeitung werden ausführlich beschrieben.
Zusammenfassung
Sauerstoff-induzierte Retinopathie (OIR) wird häufig verwendet, um abnormales Gefäßwachstum bei ischämischen Netzhauterkrankungen zu untersuchen, einschließlich Frühgeborenen-Retinopathie (ROP), proliferativer diabetischer Retinopathie (PDR) und Netzhautvenenverschluss (RVO). Die meisten OIR-Studien beobachten eine retinale Neovaskularisation zu bestimmten Zeitpunkten; Das dynamische Gefäßwachstum bei lebenden Mäusen entlang eines Zeitverlaufs, das für das Verständnis der OIR-bedingten Gefäßerkrankungen unerlässlich ist, wurde jedoch zu wenig untersucht. Hier beschreiben wir ein Schritt-für-Schritt-Protokoll für die Induktion des OIR-Mausmodells, heben die potenziellen Fallstricke hervor und bieten eine verbesserte Methode zur schnellen Quantifizierung von Bereichen der Vasoobliteration (VO) und Neovaskularisation (NV) mittels Immunfluoreszenzfärbung. Noch wichtiger ist, dass wir das Nachwachsen von Gefäßen bei lebenden Mäusen von P15 bis P25 überwachten, indem wir eine Fluoresceinfundusangiographie (FFA) im OIR-Mausmodell durchführten. Die Anwendung von FFA auf das OIR-Mausmodell ermöglicht es uns, den Umbauprozess während des Nachwachsens von Gefäßen zu beobachten.
Einleitung
Die retinale Neovaskularisation (RNV), definiert als ein Zustand, in dem neue pathologische Gefäße aus bestehenden Netzhautvenen entstehen, erstreckt sich normalerweise entlang der inneren Oberfläche der Netzhaut und wächst in den Glaskörper (oder unter bestimmten Bedingungen subretinalen Raum)1. Es ist ein Kennzeichen und gemeinsames Merkmal vieler ischämischer Retinopathien, einschließlich Frühgeborenenretinopathie (ROP), Netzhautvenenverschluss (RVO) und proliferativer diabetischer Retinopathie (PDR)2.
Zahlreiche klinische und experimentelle Beobachtungen haben gezeigt, dass Ischämie die Hauptursache für die retinale Neovaskularisation ist 3,4. Bei ROP werden Neugeborene in geschlossenen Inkubatoren hohem Sauerstoff ausgesetzt, um die Überlebensraten zu erhöhen, was auch ein wichtiger Treiber für den Stopp des Gefäßwachstums ist. Nach Abschluss der Behandlung erleben die Netzhäute von Neugeborenen eine relativ hypoxische Periode5. Andere Situationen werden bei der Okklusion von zentralen oder verzweigten Netzhautvenen bei RVO beobachtet, und es wird auch eine Schädigung der Netzhautkapillaren beobachtet, die durch Mikroangiopathie bei PDR2 verursacht wird. Hypoxie erhöht weiter die Expression von angiogenen Faktoren wie dem vaskulären endothelialen Wachstumsfaktor (VEGF) durch den Hypoxie-induzierten Faktor-1α (HIF-1α)-Signalweg, der wiederum vaskuläre Endothelzellen dazu bringt, in den hypoxischen Bereich zu wachsen und neue Gefäße zu bilden 6,7.
ROP ist eine Art vaskuläre proliferative Retinopathie bei Frühgeborenen und eine Hauptursache für Erblindung im Kindesalter8,9, die durch Netzhauthypoxie, retinale Neovaskularisation und fibröse Hyperplasie gekennzeichnet ist10,11,12. In den 1950er Jahren fanden Forscher heraus, dass eine hohe Sauerstoffkonzentration die Atemwegssymptome von Frühgeborenen signifikant verbessern kann13,14. Infolgedessen wurde die Sauerstofftherapie damals vermehrt bei Frühgeborenen eingesetzt15. Gleichzeitig mit der weit verbreiteten Anwendung der Sauerstofftherapie bei Frühgeborenen stieg die Inzidenz von ROP jedoch von Jahr zu Jahr an. Seitdem haben Forscher Sauerstoff mit ROP verknüpft und verschiedene Tiermodelle untersucht, um die Pathogenese von ROP und RNV16 zu verstehen.
Beim Menschen ist der größte Teil der Entwicklung des retinalen Gefäßsystems vor der Geburt abgeschlossen, während sich bei Nagetieren das retinale Gefäßsystem nach der Geburt entwickelt und ein zugängliches Modellsystem zur Untersuchung der Angiogenese im retinalen Gefäßsystem bietet2. Mit dem kontinuierlichen Fortschritt der Forschung sind sauerstoffinduzierte Retinopathie-Modelle (OIR) zu wichtigen Modellen für die Nachahmung der pathologischen Angiogenese infolge von Ischämie geworden. Es gibt keine spezifischen Tierarten in der Studie des OIR-Modells und das Modell wurde in verschiedenen Tierarten entwickelt, darunter Kätzchen 17, Ratte18, Maus19, Beagle-Welpe 20 und Zebrafisch21. Alle Modelle teilen den gleichen Mechanismus, durch den sie während der frühen Netzhautentwicklung Hyperoxie ausgesetzt sind und dann in die normoxische Umgebung zurückkehren. Smith et al. beobachteten, dass die Exposition von Mäusewelpen gegenüber Hyperoxie von P7 für 5 Tage eine extreme Form der Gefäßregression in der zentralen Netzhaut induzierte und sie bei P12 zurück in die Raumluft brachte und allmählich neovaskuläre Büschel auslöste, die in Richtung des Glaskörperswuchsen 19. Dies war ein standardisiertes OIR-Mausmodell, das auch als Smith-Modell bezeichnet wurde. Connor et al. optimierten das Protokoll weiter und stellten 2009 eine universell anwendbare Methode zur Quantifizierung des Bereichs von VO (Vaso-Obliteration) und NV (Neovaskularisation) zur Verfügung, was die Akzeptanz und Nutzung des Modells22 erhöhte. Das OIR-Mausmodell ist aufgrund seiner geringen Größe, der schnellen Fortpflanzung, des klaren genetischen Hintergrunds, der guten Wiederholbarkeit und der hohen Erfolgsrate immer noch das am weitesten verbreitete Modell.
Bei Mäusen beginnt die retinale Vaskularisation nach der Geburt mit dem Einwachsen von Gefäßen vom Sehnervenkopf in die innere Netzhaut in Richtung Ora serrata. Während der normalen Netzhautentwicklung sprießen die ersten Netzhautgefäße um die Geburt herum aus dem Sehnervenkopf und bilden ein expandierendes Netzwerk (den primären Plexus), das die Peripherie um den postnatalen Tag 7(P7)23 erreicht. Dann beginnen die Gefäße in die Netzhaut zu wachsen, um eine tiefe Schicht zu bilden, die Netzhaut zu durchdringen und ein laminares Netzwerk um die innere Kernschicht (INL) zu bilden, wie beim Menschen24. Am Ende der dritten postnatalen Woche (P21) ist die tiefere Plexusentwicklung fast abgeschlossen. Für das OIR-Mausmodell tritt ein Gefäßverschluss immer in der zentralen Netzhaut auf, da während der Hyperoxie-Exposition eine große Anzahl unreifer Gefäßnetzwerke in der zentralen Region schnell degeneriert wird. So tritt das Wachstum der pathologischen Neovaskularisation auch in der mittleren peripheren Netzhaut auf, die die Grenze zwischen dem Nicht-Perfusionsbereich und dem vaskulären Bereich darstellt. Menschliche Netzhautgefäße haben sich jedoch fast vor der Geburt gebildet. Bei Frühgeborenen ist die periphere Netzhaut nicht vollständig vaskularisiert, wenn sie Hyperoxieausgesetzt ist 25,26. So treten Gefäßverschlüsse und Neovaskularisation hauptsächlich in der peripheren Netzhaut auf27,28. Trotz dieser Unterschiede rekapituliert das OIR-Modell der Maus die pathologischen Ereignisse, die während der Ischämie-induzierten Neovaskularisation auftreten.
Die Induktion des OIR-Modells kann in zwei Phasenunterteilt werden 29: In Phase 1 (Hyperoxie-Phase) wird die retinale Gefäßentwicklung durch Okklusion und Rückbildung der Blutgefäße infolge des Rückgangs von VEGF und der Apoptose von Endothelzellen gestoppt oder verzögert24,30; In Phase 2 (Hypoxiephase) wird die retinale Sauerstoffversorgung unter Raumluftbedingungenunzureichend 29, was für die neuronale Entwicklung und Homöostase essentiell ist19,31. Diese ischämische Situation führt normalerweise zu einer unregulierten, abnormalen Neovaskularisation.
Derzeit ist die häufig verwendete Modellierungsmethode die abwechselnd hohe / niedrige Sauerstoffexposition: Mütter und ihre Welpen werden 5 Tage lang bei P7 75% Sauerstoff ausgesetzt, gefolgt von 5 Tagen in Raumluft, bis P17 vergleichbare Ergebnisse zeigte22, was der Endpunkt der OIR-Mausmodellinduktion ist. (Abbildung 1). Neben der Simulation von ROP kann diese ischämievermittelte pathologische Neovaskularisation auch zur Untersuchung anderer ischämischer Netzhauterkrankungen verwendet werden. Die Hauptmessungen dieses Modells umfassen die Quantifizierung der Fläche von VO und NV, die von retinalen flachen Montierungen durch Immunfluoreszenzfärbung oder FITC-Dextranperfusion analysiert werden. Jede Maus kann wegen der tödlichen Operation nur einmal untersucht werden. Derzeit gibt es nur wenige Methoden, um dynamische Veränderungen des Netzhautgefäßsystems während des Prozesses der vaskulären Regression und pathologischen Angiogenese kontinuierlich zu beobachten32. In diesem Artikel bieten wir ein detailliertes Protokoll der OIR-Modellinduktion, die Analyse von retinalen flachen Mounts sowie einen Workflow der Fluoresceinfundusangiographie (FFA) an Mäusen, die hilfreich wären, um ein umfassenderes Verständnis der vaskulären dynamischen Veränderungen während zweier Phasen des OIR-Mausmodells zu erlangen.
Protokoll
Alle Verfahren, die die Verwendung von Mäusen beinhalten, wurden von der tierexperimentellen Ethikkommission des Zhongshan Ophthalmic Center, Sun Yat-sen University, China (autorisierte Nummer: 2020-082) und in Übereinstimmung mit den genehmigten Richtlinien des Animal Care and Use Committee des Zhongshan Ophthalmic Center und der Association Research in Vision and Ophthalmology (ARVO) Statement for the Use of Animals in Ophthalmic and Vision Research genehmigt.
1. Induktion des Maus-OIR-Modells
- Verwenden Sie Mäuse mit einer geringeren Rate angeborener Fehlbildungen der Augen, z. B. C57BL / 6J-Mäuse, und paaren Sie sie in einem Verhältnis von männlich / weiblich = 1: 2. Lassen Sie die Welpen am selben Tag geboren und beginnen Sie, das OIR-Modell bei P7 zu induzieren. Notieren Sie das Körpergewicht von Mäusewelpen genau vor dem Modellieren.
HINWEIS: Notieren Sie den Geburtstag als P0. Notieren Sie regelmäßig das Gewicht jeder Maus. Das Körpergewicht neugeborener Welpen ist während der Induktion von OIR sehr wichtig, da die Empfindlichkeit von Mäusen in verschiedenen Zuständen gegenüber Sauerstoff unterschiedlich ist. Schließen Sie die Welpen mit mehr als 5 g bei P7 aus, um vergleichbare Ergebnisse zu erzielen. - Bieten Sie ein geeignetes Lebensumfeld für stillende Mütter und ihre Welpen, z. B. die Einstellung der Temperatur auf 23 ° C ± 2 ° C, die Kontrolle der Luftfeuchtigkeit auf 40% -65%, den Wechsel von 12 Stunden Licht und 12 Stunden Dunkelheit jeden Tag, das Hinzufügen von etwas Watte in den Käfig zum Nisten, die Gewährleistung von ausreichend sterilisiertem Futter und Wasser und die Aufbewahrung in individuell belüfteten Käfigen (IVC).
- Überwachen Sie die Luftfeuchtigkeit und Temperatur in der Kammer. Kontrollieren Sie die Luftfeuchtigkeit zwischen 40% und 65% und halten Sie die Temperatur bei 23 °C ± 2 °C.
- Überprüfen Sie die Sauerstoffversorgung mit Sauerstoffsensoren, halten Sie einen konstanten Sauerstoffgehalt bei 75% und kontrollieren Sie den Sauerstoffdurchfluss bei 0,5-0,75 l / min. Geben Sie 50 g Kalknatron auf den Boden der Kammer, um überschüssiges CO2 aufzunehmen und die CO2-Werte unter 3% zu halten22.
- Überwachen Sie das Verhalten stillender Mütter wie Nestbauverhalten, Beißen ihrer Welpen und Verweigerung der Laktation mindestens einmal am Tag. Eliminieren Sie stillende Mütter mit schlechter Mutterschaft.
- Legen Sie die P7-Welpen (männlich und weiblich) und ihre stillenden Mütter in eine Sauerstoffkammer, in der der Sauerstoffgehalt für 5 Tage bis P12 75% beträgt. Vermeiden Sie unnötiges Öffnen der Kammer während der Modellinduktion. Stellen Sie sicher, dass es zusätzliche Leihmütter für den Ersatz gibt, falls die stillenden Mütter aufgrund einer Lungenverletzung während der Hyperoxie sterben.
HINWEIS: Um die Vergleichbarkeit des Experiments zu gewährleisten, beschränken Sie die Anzahl auf 6-8 Welpen pro Mutter. Achten Sie auf das potenzielle Problem der Sauerstofftoxizität, die den Tod einiger stillender Mütter verursacht. Zu den Anzeichen einer hyperoxischen Lungenverletzung bei stillenden Müttern gehören unter anderem schwankende Atemfrequenz, verminderte Aktivität und verminderte Fütterung. Wenn das oben genannte Phänomen auftritt, euthanasieren Sie die stillende Mutter so schnell wie möglich mit 1% Pentobarbitalnatrium (50 mg / kg). Bereiten Sie einige Leihmütter, z. B. 129S1 / SvImJ, auf den Ersatz vor und verwenden Sie sie nur bei Bedarf. Es wird nicht empfohlen, stillende Mütter routinemäßig zu ersetzen, da dies zu häufigem Öffnen einer Sauerstoffkammer führt, was zu instabilen Sauerstoffwerten und mütterlicher Aggression führt. - Bringen Sie die Welpen und ihre stillenden Mütter zurück in die Raumluft bei P12 und überwachen Sie das Gewicht aller Welpen kontinuierlich bis P17. Gruppieren Sie die Welpen basierend auf dem Gewicht, um sicherzustellen, dass jede Versuchsgruppe eine ähnliche Gewichtsverteilung hat.
2. Herstellung von Netzhaut-Ganzhalterungen und Immunfluoreszenzfärbung
- Notieren Sie das Körpergewicht der Welpen. Opfern Sie die Welpen durch eine Überdosis Anästhetikum (1% Pentobarbitalnatrium 50 mg/kg) oder CO2 -Inhalation. Andere Methoden der Euthanasie, wie zervikale Dislokation und bilaterale Thorakotomie, können bei Bedarf verwendet werden.
- Verwenden Sie eine gebogene Schere, um die Verbindung zwischen Augäpfeln und Orbitalgewebe zu lösen. Stecken Sie dann gekrümmte Pinzetten in den hinteren Teil des Augapfels, klemmen Sie den Sehnerv und heben Sie das Auge schnell aus der Augenhöhle. Waschen Sie die Augäpfel in einer vorgekühlten 1x Phosphatpuffer-Kochsalzlösung (PBS), um Haare und Blut von der Oberfläche der Augäpfel zu entfernen.
- Die gereinigten Augäpfel in ein mit 4% Paraformaldehyd (PFA) gefülltes 2-ml-Mikrozentrifugenröhrchen geben und 15 min bei Raumtemperatur auf einem Shaker mit einer Geschwindigkeit von 12-15 Umdrehungen pro Minute (U/min) inkubieren (Erstfixierung).
ACHTUNG: Paraformaldehyd ist als allergen, allgemein toxisch und extrem zytotoxisch bekannt. Befolgen Sie die Sicherheitshinweise strikt und vermeiden Sie Inhalation und Hautkontakt. - Verwenden Sie eine Kulturschale und geben Sie einen Tropfen 1x PBS in den zentralen Teil und führen Sie die folgenden Schritte unter einem Seziermikroskop durch und legen Sie einen Augapfel in diesen Tropfen. Halten Sie den Augapfel mit einer Pinzette fest und punktieren Sie vorsichtig die Hornhaut am Hornhautlimbus mit einer 1-ml-Spritzennadel. Führen Sie die Spitze der Schere in dieses Loch ein und schneiden Sie die Hornhaut vorsichtig entlang des Hornhautlimbus ab. Achten Sie darauf, die Netzhaut nicht zu schneiden.
- Entfernen Sie die Iris und die Linse mit einer Pinzette. Legen Sie dann die restliche Augenmuschel in die 4% PFA und fixieren Sie sie erneut für weitere 45 min bei Raumtemperatur auf einem Shaker mit einer Geschwindigkeit von 12-15 U/min (sekundäre Fixierung).
- Verwenden Sie eine Kulturschale und geben Sie einen Tropfen 1x PBS in den zentralen Teil. Legen Sie den festen Augapfel in diesen Tropfen. Halten Sie den Augapfel mit einer Pinzette. Trennen Sie die Netzhaut- und Skleraschichten vorsichtig mit zwei Pinzetten. Legen Sie die Spitze der Schere zwischen die Netzhaut- und Skleraschichten und schneiden Sie die Sklera in Richtung Sehnerv. Schälen Sie die Sklera von der Netzhaut und erhalten Sie die Netzhautbecher.
HINWEIS: Halten Sie die hintere Tasse mit einer Pinzette am Sehnerv, verwenden Sie dann das gekrümmte Ende einer anderen Pinzette, um auf die Sklera am Sehnervkopf zu drücken und die Netzhaut sanft in einer vorwärts geschwungenen Bewegung als Alternative zur Freigabe der Netzhaut zu massieren. - Verwenden Sie eine Pinzette, um die Verbindung zwischen radialen Hyaloidgefäßen und peripherer Netzhaut zu lösen, klemmen Sie die Wurzel der Hyaloidgefäße, die sich in der Nähe des Sehnervenkopfes befindet, und schneiden Sie die hyaloiden Gefäße vorsichtig ab.
- Verwenden Sie eine 2-ml-Pipette mit abgeschnittener Spitze, um den Netzhautbecher zu übertragen. Stellen Sie den Netzhautbecher in eine Vertiefung in einer 48-Well-Platte und waschen Sie ihn 3 x 5 min mit 1x PBS bei Raumtemperatur auf einem Shaker mit einer Geschwindigkeit von 12-15 U/min.
- Die Netzhautschale in einer Mischlösung aus 1% Triton X-100 (in PBS) und 5% normalem Eselserum (in PBS) über Nacht bei 4 °C inkubieren.
- Alternativ können Sie alternativ Netzhäute bei Raumtemperatur für 1 h blockieren und permeabieren. Ändern Sie das blockierende Serum entsprechend der Quelle des sekundären Antikörpers.
- Wenn Sie das Netzhautgefäßsystem mit Isolectin B4 markieren, inkubieren Sie die Netzhaut in einer Vertiefung aus 48-Well-Platte mit 0,1% normalem Eselserum (400 μL) und IsolectinB4-594 (1:400) über Nacht bei 4 °C auf einem Shaker mit einer Geschwindigkeit von 12-15 U/min.
HINWEIS: Wenn Sie die Blutgefäße mit anderen Markern wie CD31 oder anderen Zellen markieren, verwenden Sie spezifische primäre Antikörper, um sie zu markieren. - Inkubieren Sie die Netzhaut mit 1:100-1:500 spezifischen primären Antikörpern (in 400 μL 0,1% normalem Eselserum) bei 4 °C auf einem Shaker mit einer Geschwindigkeit von 12-15 U/min für 48 h. (optional)
- Nach der Rückkehr auf Raumtemperatur waschen Sie die Netzhaut mit 0,1% PBST (0,1% TritonX-100 in PBS) für 3 x 20 min auf einem Shaker mit einer Geschwindigkeit von 12-15 U/min.
- Inkubieren Sie die Netzhaut mit 1:1.000 sekundären Antikörpern (in 400 μL 0,1% normalem Eselserum) über Nacht bei 4 °C auf einem Shaker mit einer Geschwindigkeit von 12-15 U/min. (optional)
- Alternativ können Sie die Netzhaut mit hochaffinen sekundären Antikörpern bei Raumtemperatur für 1 h inkubieren.
- Inkubieren Sie die Netzhaut mit DAPI (1:1.000) bei Raumtemperatur für 20-25 min, um den Kern zu markieren.
HINWEIS: Testen Sie die optimalen Verdünnungsverhältnisse für alle in den Schritten 10-11 und 13-14 verwendeten Antikörper im Vorexperiment. - Waschen Sie die Netzhaut für 3 x 30 min mit 0,1% PBST auf einem Shaker bei einer Drehzahl von 12-15 U/min bei Raumtemperatur.
- Legen Sie den Netzhautbecher auf einen sauberen Schieber mit der Öffnung nach oben. Schneiden Sie die Netzhaut radial an den Positionen 3, 6, 9 und 12 Uhr von peripher nach zentral, indem Sie etwa 1-1,5 mm vom Sehnervenkopf entfernt schneiden.
- Fügen Sie ein paar Tropfen 1x PBS hinzu, um die Netzhaut dreimal zu spülen. Verwenden Sie luftgelegtes Papier, um die Netzhaut zu trocknen und zu glätten. Fügen Sie einen Tropfen Montagemedium (siehe Materialtabelle) in die Mitte des Deckglases und hören Sie auf, es hinzuzufügen, bis der Durchmesser des Tröpfchens auf die Hälfte des Deckglases ansteigt. Drehen Sie das Deckglas schnell um und legen Sie es auf die ausgebreitete Netzhaut. Vermeiden Sie die Bildung von Blasen.
- Machen Sie Bilder von den Netzhautflachhalterungen oder lagern und schützen Sie die Dias vor Licht bei 4 °C.
3. Analyse und Quantifizierung von Netzhaut-Flachhalterungen
HINWEIS: Für das OIR-Mausmodell erfassen die Forscher häufig den Bereich des zentralen retinalen Gefäßverschlusses und der peripheren retinalen pathologischen Neovaskularisation während P12-P25. Frühere Studien haben gezeigt, dass der zentrale avaskuläre Bereich der Netzhaut bei P12 das Maximum erreicht und allmählich von P13 auf P17 schrumpft; gleichzeitig erreicht die Netzhaut von OIR-Mäusen den Höhepunkt des Neovaskularisationsbereichs bei etwa P1722,29. Ab P17 bilden sich Neogefäße allmählich zurück und funktionsfähige Gefäße wachsen wieder in den avaskulären Bereich nach. Das retinale Gefäßsystem normalisiert sich grundsätzlich wieder bei P2533.
- Nehmen Sie Bilder von Netzhaut-Flachfassungen mit einem Fluoreszenzmikroskop (siehe Materialtabelle) mit 10-fachem Objektiv auf. Wählen Sie zunächst den DAPI-Kanal und stellen Sie den Sehnervenkopf in die Mitte des Gesichtsfeldes. Stellen Sie dann andere Kanäle ein und konzentrieren Sie sich auf das oberflächliche Gefäßsystem der Netzhaut. Überprüfen Sie Kacheln in einer Fotosoftware (siehe Materialtabelle) und legen Sie die Anzahl der Fotos fest, die zusammengefügt werden müssen. Klicken Sie auf Experiment starten , um die gesamte Netzhaut zu erfassen.
- Verwenden Sie ein Bildverarbeitungsprogramm (siehe Materialtabelle), um den Bereich der Vasobliteration (VO) und Neovaskularisation (NV) nach Immunfluoreszenzfärbung zu quantifizieren.
- Klicken Sie zuerst auf das Zauberstabwerkzeug und stellen Sie eine entsprechende Toleranz entsprechend dem Helligkeitsunterschied ein und bewegen Sie den Cursor in den Hintergrund und klicken Sie mit der Maus. Wählen Sie dann die Option Inverse auswählen , um einen Grundriss der Netzhaut zu erhalten. Verwenden Sie das Lasso-Werkzeug , um die Details der Netzhaut weiter zu skizzieren. Mit der Funktion Histogramm den Pixelwert der gesamten Netzhaut aufzeichnen und aufschreiben oder eine Tabelle in einem Datenbankprogramm generieren.
- Teilen Sie das Netzhautbild in vier Quadranten auf. Verwenden Sie in jedem Quadranten das Lasso-Werkzeug, um den VO-Bereich zu zeichnen (Abbildung 2A-C), und verwenden Sie das Zauberstabwerkzeug, um den NV-Bereich auszuwählen (Abbildung 2D-F). Berechnen Sie anhand der Pixelinformationen im Histogramm das Pixelverhältnis von VO und NV zur gesamten Netzhaut, dh den Prozentsatz der VO- oder NV-Fläche relativ zur gesamten Netzhaut.
HINWEIS: Es gibt auch eine Open-Source- und vollautomatische Pipeline für die Quantifizierung von VO- und NV-Bereichen in OIR-Bildern unter Verwendung von neuronalen Deep-Learning-Netzen (http://oirseg.org/), die Forschern eine zuverlässige und zeitsparende Möglichkeit bietet und den Standard der Quantifizierungvereinheitlicht 34.
- Zeichnen Sie Pixelinformationen in einer Tabellenkalkulation auf, die für die nachfolgende Analyse geeignet ist.
4. In-vivo-Bildgebung mit Fluorescein-Fundusangiographie (FFA)
HINWEIS: Bei OIR-Mäusen können sowohl die FITC-Perfusion als auch die Immunfluoreszenzfärbung aufgrund des Todes von Versuchstieren nur einmal verwendet werden. Im Vergleich dazu ist einer der Vorteile von FFA die Beobachtung der dynamischen Veränderungen der Netzhautgefäße der Maus während der Entwicklung und des pathologischen Zustands in vivo35,36.
- Wiegen Sie die Welpen vor der Narkose.
- Betäuben Sie Welpen durch intraperitoneale Injektion von 0,3% Pentobarbitalnatrium in einer Dosis von 30-50 mg/kg.
HINWEIS: Achten Sie bei Mäusen innerhalb von 1 Monat auf die Anästhesiedosen. Verwenden Sie niedrigere Konzentrationen und Dosen von Anästhetikum, um den Tod von Mäusen durch Anästhesie zu reduzieren. Nachdem die Welpen betäubt wurden, verwenden Sie ein kleines Heizkissen, um die Körpertemperatur aufrechtzuerhalten. Hypothermie beeinträchtigt nicht nur die physiologische Funktion der Welpen, sondern führt auch zu Veränderungen des Kristallins und beschleunigt die Entwicklung von Katarakten. - Verwenden Sie 20 μL mydriatische Augentropfen (0,5% Tropicamid + 0,5% Phenylephrinhydrochlorid) für jeden Welpen und warten Sie 5 Minuten, um eine lang anhaltende Pupillenerweiterung zu erreichen (Abbildung 3A, B).
- Bringen Sie die betäubten Welpen vor das bildgebende Gerät (siehe Materialtabelle). Halten Sie die Welpen auf einem kleinen Heizkissen, bringen Sie die Welpen in eine stabile Position und verwenden Sie regelmäßig künstliche Tränen, um Feuchtigkeit in der Hornhaut zu erhalten. Klicken Sie auf den Modus der Infrarot-Fundusbildgebung (IR), um den Sehnervenkopf in die Mitte des Bildschirms einzustellen.
HINWEIS: Wenn Sie ein Auge der Welpen beobachten, vergessen Sie nicht, das andere Auge zu schützen. Verwenden Sie Hypromellose Augentropfen, um zu verhindern, dass die Hornhaut aufgrund von Trockenheit aufhellt. - Nach der intraperitonealen Injektion von 0,15 ml 0,5% Fluorescein-Natriumsalzlösung klicken Sie sofort auf die FA-Taste und die Injektionstaste auf dem Touchpanel des Bildgebungsgeräts, um das Timing zu starten. Nehmen Sie die Bilder nach 3 Minuten auf, wenn die Blutzirkulation der Netzhaut in die venöse Phase eintritt, und beobachten Sie die Netzhaut nicht weniger als 6-8 Minuten.
HINWEIS: Nach intraperitonealer Injektion von Fluorescein-Natriumsalzlösung zeigen Haut, Schleimhaut und Urin der Welpen deutlich gelblichgrün. Der größte Teil des Fluoresceins wird von den Welpen innerhalb eines Tages ausgeschieden. Die sechsmalige intraperitoneale Injektion des Fluorescein-Natriums jeden zweiten Tag verursacht keine signifikanten Nebenwirkungen37. - Bewegen Sie den Sehnervkopf in die Mitte des Bildaufnahmebereichs und nehmen Sie das erste Bild der zentralen Netzhaut auf. Bewegen Sie dann die Linse des Bildgebungsgeräts horizontal zur nasalen Seite des Auges, bis sich der Sehnervenkopf in der Mitte einer Seite des Bildaufnahmebereichs befindet, und nehmen Sie das zweite Bild auf. Nehmen Sie mit dieser Methode weiterhin Bilder der temporalen, oberen bzw. unteren Netzhaut auf (Abbildung 3C).
HINWEIS: Nehmen Sie "Fünf-Orientierungs"-Bilder innerhalb von 12 Minuten auf, wenn die Regressionsphase auftritt. Die Position des Sehnervenkopfes im unteren Bild darf aufgrund der begrenzten Winkeleinstellung der Linse nicht auf die Seitenlinie fallen. - Speichern Sie die Bilder und verwenden Sie ein Bildbearbeitungsprogramm zum Stitching.
5. Bildverarbeitung der Fluoreszenzfundusangiographie (FFA)
- Öffnen Sie das Bildbearbeitungsprogramm, und klicken Sie auf Neu in Datei , um eine neue Leinwand mit schwarzem Hintergrund zu erstellen (Abbildung 4A).
- Öffnen Sie zuerst ein Bild der zentralen Netzhaut in der Hintergrundebene. Klicken Sie auf Datei und fügen Sie das zweite Bild hinzu. Stellen Sie die Deckkraft des zweiten Bildes auf 60% ein, verschieben Sie das zweite Bild und ändern Sie die Größe, bis sich die gleichen Teile der beiden Bilder stark überlappen. Klicken Sie auf die Schaltfläche Zwischen freiem Transformations- und Warp-Modus wechseln und nehmen Sie bei Bedarf subtile Anpassungen an den Gefäßen vor. Drehen Sie dann die Deckkraft des zweiten Bildes wieder auf 100 % (Abbildung 4A,B).
- Wählen Sie zwei Bilder gleichzeitig aus und klicken Sie auf Ebenen automatisch überblenden. Aktivieren Sie Panorama als Mischmethode und wählen Sie die folgenden zwei Sätze aus. Klicken Sie auf OK und beenden Sie das Zusammenfügen der ersten beiden Bilder (Abbildung 4C,D).
- Nehmen Sie die ersten beiden zusammengefügten Bilder als Ganzes, fügen Sie das dritte Bild hinzu und fahren Sie mit dem Mischen fort. Wiederholen Sie die obigen Methoden, um das Zusammenfügen von fünf Bildern abzuschließen (Abbildung 4E).
- Verwenden Sie das Zuschneidewerkzeug , um Bilder von FFA zu verschiedenen Zeitpunkten auf eine einheitliche Größe zu schneiden und dynamische Veränderungen des Netzhautgefäßsystems von P15 auf P25 sowohl bei normalen als auch bei OIR-Welpen zu beobachten.
6. Statistische Auswertung
- Barwerte als Mittelwert ± Standardabweichung (s.d.).
- Verwenden Sie den Student's t-Test, um zwei unabhängige Stichproben zu vergleichen. Verwenden Sie die Einweg-ANOVA, um mehrere Datensätze zu vergleichen und mit dem Dunnett- oder Tukey-Test zu kombinieren, bei dem es sich um einen häufig verwendeten Mehrfachvergleichstest handelt.
- Verwenden Sie für nicht normalverteilte Daten den Mann-Whitney-U-Test oder den Kruskal-Wallis-Test. Berücksichtigen Sie signifikante statistische Unterschiede, wenn P 0,05 <.
Ergebnisse
Im OIR-Mausmodell ist das wichtigste und grundlegendste Ergebnis die Quantifizierung des VO- und NV-Bereichs. Nach 5 Tagen in der Hyperoxie-Umgebung von P7 zeigte die zentrale Netzhaut der Welpen den größten Nicht-Perfusionsbereich. Unter der Stimulation der Hypoxie in weiteren 5 Tagen wurde allmählich eine retinale Neovaskularisation erzeugt, die intensiver fluoreszierte als die umgebenden normalen Gefäße. Nach P17 bildete sich das Fluoreszenzsignal der pathologischen Neovaskularisation schnell als Umbau der Netzhaut zurück (Abbildung 5A). Durch die Kontrolle der Wurfgröße und der postnatalen Gewichtszunahme der Welpen zeigte der Bereich der VO und NV des OIR-Mausmodells eine gute Wiederholbarkeit und Stabilität und der Höhepunkt der retinalen Neovaskularisation trat bei P17 auf, was mit den vorherigen Studien übereinstimmte (Abbildung 5B,C).
FFA ist ein ideales Werkzeug zur Untersuchung des Netzhautgefäßsystems. Angesichts der Anwendung von FFA in vivo zeigt es eine große Reduzierung der Abfälle von Versuchstieren sowie die dynamischen Veränderungen der Netzhautgefäße mit der Zeit. In früheren Studien wurde FFA nicht oft bei Mäusewelpen verwendet und in einem Single-View-Bild präsentiert, was für weitere Studien schwierig war. In diesem Protokoll wurden die "Fünf-Orientierungs"-Bilder des Netzhautgefäßsystems mit einer Bildverarbeitungssoftware zusammengefügt, um ein breiteres Feld der Netzhaut gleichzeitig darzustellen, was bei Bedarf für die nachfolgende Analyse hilfreich war (Abbildung 4). Außerdem zeigten die OIR-Mauswelpen eine verlängerte Augenöffnung, so dass die FFA-Bilder von P15 aufgenommen wurden, um die Anforderungen der Tierethik zu erfüllen. In der Netzhaut des OIR-Mausmodells nahm der Durchmesser der Blutgefäße deutlich zu und wurde im Vergleich zu normalen Mäusen sehr gewunden. Außerdem zeigte die FFA einen ähnlichen Trend dynamischer Veränderungen des retinalen Gefäßsystems mit Immunfluoreszenzfärbung mit Isolectin B4-594 von P15-P25 ohne den Tod der Welpen (Abbildung 6).
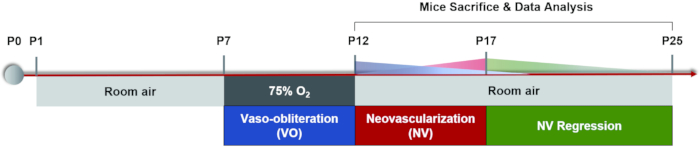
Abbildung 1: Cartoon-Schema des OIR-Mausmodells. Das OIR-Mausmodell wurde induziert, indem Welpen und ihre stillenden Mütter für einige Zeit in einem Raum gehalten wurden (P0-P7). Bei P7 wurden beide 5 Tage lang 75% Sauerstoff ausgesetzt, was das Wachstum der Netzhautgefäße hemmte und einen signifikanten Gefäßverlust in der zentralen Netzhaut verursachte. Die Mäuse wurden dann an P12 wieder in die Raumluft gebracht und die avaskuläre Netzhaut begann relativ hypoxisch zu werden, was sowohl ein normales Nachwachsen der Gefäße als auch eine pathologische Reaktion um die mittlere periphere Netzhaut auslöste. Die maximale Neovaskularisation (NV) wurde bei P17 beobachtet. Dann durchlief die pathologische Neovaskularisation einen Prozess der spontanen Regression. Das retinale Gefäßsystem war bei etwa P25 wieder normal. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 2: Messung der Vasoobliteration (VO) und Neovaskularisation (NV) in der Netzhaut der Maus . (A) Bild von 10x P12 OIR Retinal Whole-Mount gefärbt für Endothelzellen mit Isolectin B4-594. (B) Screenshot einer Netzhaut mit ausgewähltem avaskulären Bereich. Werkzeuge, die für diese Messung erforderlich sind, sind mit weißen Pfeilen hervorgehoben: Zauberstabwerkzeug und Lassowerkzeug. (C) Markieren Sie den avaskulären Bereich der Netzhaut und speichern Sie das Bild als Kopie. (D) Bild von 10x P17 OIR Retinal Whole-Mount gefärbt für Endothelzellen mit Isolectin B4-594. (E) Screenshot einer Netzhaut mit ausgewählten neovaskulären Büscheln. Verwenden Sie das Zauberstabwerkzeug und stellen Sie eine optimale Toleranz ein, um NV hervorzuheben. Stellen Sie die Toleranz auf 3-5 ein und aktivieren Sie die Kontrollkästchen Anti-Alias und Contiguous. (F) Speichern Sie den Neovaskularisationsbereich nur als Kopie. Maßstabsbalken repräsentieren 1.000 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
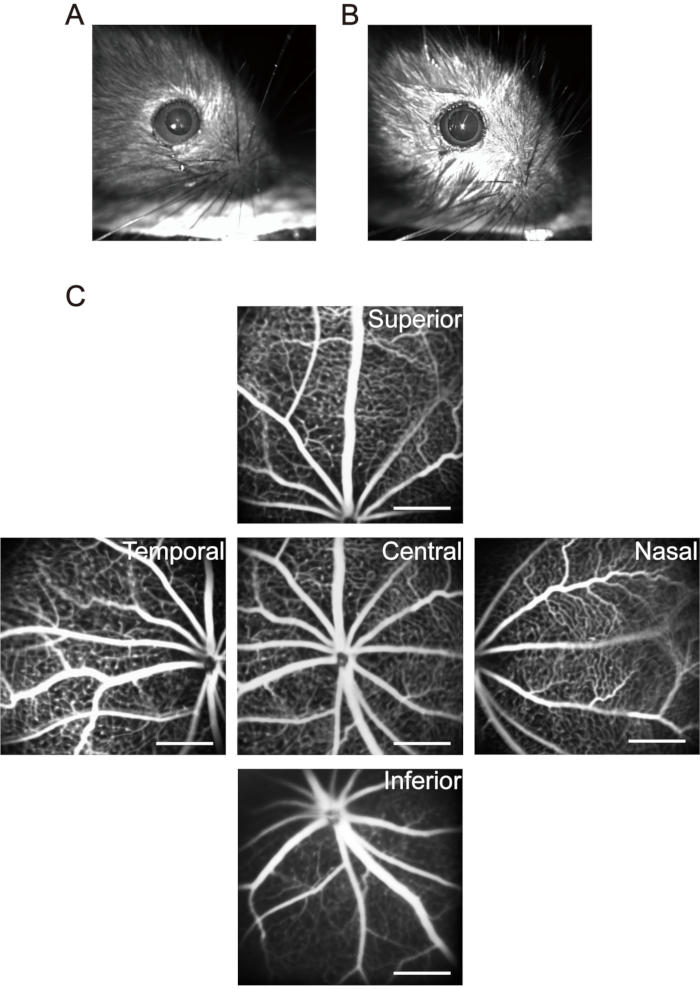
Abbildung 3: Aufnahme der "Five-orientation"-Bilder in der Netzhaut der Maus. (A) Die normale Mauspupille. (B) Mauspupille in Mydriasis. (C) Die "Fünf-Orientierungs"-Bilder des zentralen, nasalen, temporalen, oberen und unteren Bereichs der Netzhaut wurden jeweils gesammelt (P17 Welpen in Raumluft). Maßstabsbalken repräsentieren 500 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 4: Allgemeiner Arbeitsablauf beim Zusammenfügen der "Fünf-Orientierungs"-Bilder aus der Fluoreszenzfundusangiographie (FFA). (A) Erstellen Sie eine neue Leinwand mit schwarzem Hintergrund und öffnen Sie das FFA-Bild der zentralen Netzhaut. (B) Öffnen Sie ein FFA-Bild der temporalen Netzhaut und stellen Sie die Deckkraft des zweiten Bildes auf 60% ein. Verschieben und ändern Sie die Größe des Bildes, bis sich dieselben Teile der beiden Bilder stark überlappen. Klicken Sie auf Zwischen freiem Transformations - und Warp-Modus wechseln, um bei Bedarf subtile Anpassungen vorzunehmen. Stellen Sie die Deckkraft des zweiten Bildes wieder auf 100 % zurück. (C) Wählen Sie zwei Bilder gleichzeitig aus und klicken Sie auf Auto-Blend Layers. (D) Verwenden Sie Panorama als Mischmethode, um das Bild-Stitching der ersten beiden Bilder abzuschließen. (E) Fahren Sie mit dem Zusammenfügen von Bildern fort, indem Sie die oben genannten Methoden wiederholen, um das Zusammenfügen aller Bilder abzuschließen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 5: Quantifizierung der Vasoobliteration (VO) und Neovaskularisation (NV) in der Netzhaut des OIR-Mausmodells. (A) Bild von 10x OIR-Netzhaut-Ganzmounts, gefärbt für Endothelzellen mit Isolectin B4-594 von P12 bis P25. Nachdem sie 5 Tage lang 75% Sauerstoff ausgesetzt waren, wurden die Welpen und ihre stillenden Mütter wieder in die Raumluft bei P12 gebracht, an der der Bereich der Vasobliteration das Maximum erreichte. Die relative Hypoxie in der zentralen Netzhaut führte zu einem Nachwachsen der Gefäße in diesem Bereich sowie zu einer pathologischen Angiogenese in der mittleren peripheren Netzhaut. Bei P17 erreichten präretinale neovaskuläre Büschel das Maximum und schrumpften dann schnell. NV bildete sich vollständig zurück und die Netzhaut schien bei etwa P25 normal zu sein. (B) Die Quantifizierung der VO-Fläche zeigte einen Höhepunkt bei P12 und ein Verschwinden bei etwa P25. (C) Die Quantifizierung der NV-Fläche zeigte einen Höhepunkt bei P17 und eine Regression bei etwa P25. Maßstabsbalken repräsentieren 1.000 μm in A. (One-Way ANOVA, *P < 0,05, **P < 0,01, ***P < 0,001, **** P < 0,0001). Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
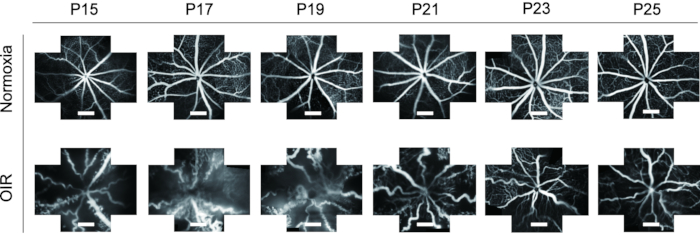
Abbildung 6: In-vivo-Bildgebung der Fluoreszenzfundusangiographie (FFA) im OIR-Mausmodell. In der Netzhaut des OIR-Mausmodells nahm der Durchmesser der Blutgefäße deutlich zu und wurde im Vergleich zu normalen Mäusen sehr gewunden. Außerdem zeigte die FFA einen ähnlichen Trend dynamischer Veränderungen des retinalen Gefäßsystems mit Immunfluoreszenzfärbung mit Isolectin B4-594 von P15-P25 ohne den Tod von Mäusewelpen. Maßstabsbalken repräsentieren 500 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Diskussion
Die Anfälligkeit von Mäusen für OIR wird von vielen Faktoren beeinflusst. Die Welpen mit unterschiedlichem genetischen Hintergrund und Stämmen können nicht verglichen werden. Bei BALB/c-Albino-Mäusen wachsen die Gefäße schnell wieder in den VO-Bereich mit signifikant reduzierten neovaskulären Büscheln38 ein, was der Forschung einige Schwierigkeiten bereitet. Bei C57BL/6-Mäusen kommt es im Vergleich zum BALB/cJ-Mausstamm39,40 zu erhöhten Photorezeptorschäden. Gleiches gilt für verschiedene Arten von transgenen Mäusen41,42,43. Außerdem zeigen C57BL/6-Mäuse ein geringeres Maß an Angiogenese im Vergleich zu 129S3/SvIM-Mäusen44.
Postnatale Gewichtszunahme (PWG) ist auch wichtig zu berücksichtigen45 und ist einer der Indikatoren zur Bewertung des Ernährungszustands von Neugeborenen. Es ist auch zu einer zuverlässigen Methode zur Vorhersage der ROP geworden, die die Aufmerksamkeit vieler Tiermodellierer auf sich zieht46. PWG beeinflusst die Reaktion von Mäusen auf Hyperoxie und Hypoxie. Bei P7 zeigen Welpen mit erhöhtem Körpergewicht (>5 g) eine unzureichende Vaso-Obliteration und retinale Neovaskularisation, während Welpen mit vermindertem Körpergewicht (<5 g) eine offensichtliche Reaktion auf Hyperoxie und Hypoxie zeigen. Außerdem zeigen Welpen mit schlechter (<5 g) und starker (>7,5 g) Gewichtszunahme bei P17 eine verminderte NV. Welpen mit schlechter Gewichtszunahme (<5 g) haben jedoch ein signifikant verlängertes Vaso-Obliterations- (VO) und Neovaskularisationsstadium (NV) mit einer Verzögerung des Auftretens von NV-Peak45. Daher ist es notwendig, den PWG von Welpen bei P7 und P17 aufzuzeichnen und zu kontrollieren und Welpen mit niedrigem PWG (< 6 g bei P17) zu eliminieren, um die Wiederholbarkeit und Vergleichbarkeit des Experiments zu gewährleisten.
Die Wurfgröße hat einen größeren Einfluss auf PWG, und einige Forscher schlagen vor, dass sie auf 6-8 Welpen / Mutter begrenzt werden sollte, um die Anforderungen für PWG 22,31 zu erfüllen. Auch der Zustand der stillenden Mutter muss berücksichtigt werden. Stillende Mütter sterben häufiger an Lungenschäden in einer hyperoxischen Umgebung47. Wenn stillende Mütter während und nach der Induktion von OIR sterben oder ihre Welpen vernachlässigen, verlieren Welpen leicht an Gewicht oder sterben sogar aufgrund mangelnder Ernährung32. Daher muss sichergestellt werden, dass genügend Leihmütter vorhanden sind, um sie zu ersetzen. Es wird jedoch empfohlen, diese Leihmütter nur zu verwenden, wenn die Mutter abläuft, was normalerweise während der Zeit der Hyperoxie-Exposition oder der Rückkehr in die Raumluft geschieht22. Die Bereitstellung von ausreichend Futter für stillende Mütter ist auch hilfreich, um den Ernährungszustand ihrer Welpen zu verbessern.
Ein nützlicher Hinweis zur Vorbereitung der Netzhaut-Flachhalterungen ist, dass für eine weitere Langzeitfärbung in der Regel ein optimaler Fixierungszeitpunkt erforderlich ist. Als Mäuse von P12-P25 wird eine 15 min + 45 min Fixierung bei Raumtemperatur empfohlen29. Eine Fixierung der Netzhaut bei 4 °C über Nacht ist eine Alternative, wenn die Zeit begrenzt ist. Außerdem reduziert der durchlässige und blockierende Puffer mit einer höheren Konzentration von 1% Triton X-100 und 5% normalem Eselserum nach unserer Erfahrung effektiv den Hintergrund der Immunfluoreszenzfärbung.
Isolectin B4-Färbung und FITC-Dextranperfusion sind häufig verwendete Methoden zur Visualisierung und Quantifizierung des neovaskulären48,49. Eine wesentliche Einschränkung dieser beiden Methoden besteht darin, dass die Mäuse geopfert werden müssen. Daher werden die Methoden für die In-vivo-Bildgebung und Quantifizierung von NV benötigt29. Paques et al. entwickelten eine Technik namens topische Endoskopie Fundus Imaging (TEFI), die hochauflösende digitale Fotos der Netzhaut in lebenden Mäusenliefert 50. Das TEFI kann retinale Gefäßveränderungen bereits ab P15 erkennen und die erhaltenen Bilder entsprechen den herkömmlichen Bewertungsmethoden. Mezu-Ndubuisi et al. lieferten dann die Methoden für In-vivo-Messungen der retinalen vaskulären Sauerstoffspannung (PO2) und der Fluoreszenzangiographie (FA), wodurch das Verständnis von retinalen Gefäßveränderungen und Oxygenierungsänderungen aufgrund von ROP und anderen ischämischen Netzhauterkrankungen verbessertwurde 37. Obwohl weder TEFI noch FA so genau sind wie herkömmliche Methoden, reduzieren sie den Tod von Versuchstieren und können wiederholt durchgeführt werden. Außerdem ermöglichen sie es jeder Maus, als eigene Steuerung zu dienen, wodurch die OIR-Daten vergleichbarer werden. In diesem Artikel wird eine verbesserte Methode der FFA-Bildgebung und des Bild-Stitchings vorgestellt. Die Durchführung von FFA bei Welpen innerhalb von 1 Monat ist nicht einfach, da übermäßige Anästhesie und Unterkühlung direkt den Tod der Welpen verursachen. Versuchen Sie daher, die minimale Anästhesiedosis zu verwenden und achten Sie besonders darauf, die Körpertemperatur der Welpen während und nach dem Prozess mit einem kleinen Heizkissen aufrechtzuerhalten. Befeuchten Sie die Augenoberfläche immer mit Kochsalzlösung und Hypromellose, falls die folgende Beobachtung nicht eingehalten wird.
Zusammenfassend ist das OIR-Mausmodell ein sehr häufiges und weit verbreitetes Modell der Netzhautischämie und pathologischen Neovaskularisation. Eines der Hauptprobleme dieses Modells ist, dass die neugeborenen Mäusewelpen im Wesentlichen gesund sind und im Vergleich zu Frühgeborenen keine metabolische Instabilität oder Atemprobleme haben. Ein weiterer Unterschied zwischen dem OIR-Mausmodell und dem Menschen besteht darin, dass es bei der humanen retinalen Neovaskularisation immer eine fibrovaskuläre Proliferation gibt, während die retinale neovaskuläre im OIR-Mausmodell51 nicht mit Fibrose assoziiert ist. Um dieses Modell besser zu nutzen und mehr Informationen zu erhalten, wird eine detaillierte Beschreibung der Verwendung von FFA zur Überwachung der dynamischen Veränderungen des OIR-Netzhautgefäßsystems bereitgestellt, einschließlich der Methoden zur Aufnahme von "Fünf-Orientierungs"-Bildern und zur Bildverarbeitung. Es wird angenommen, dass FFA eine wirksame Methode wird, um die Immunfluoreszenzfärbung teilweise oder vollständig zu ersetzen, um die Morphologie und Funktion des Netzhautgefäßsystems zu beobachten und zu bewerten49. Obwohl das OIR-Mausmodell der Mikroumgebung und Pathogenese verschiedener ischämischer Retinopathie beim Menschen nicht vollständig ähnelt, bietet es uns die Möglichkeit, medikamentöse und transgene Experimente durchzuführen sowie den Mechanismus der pathologischen Angiogenese auf der ischämischen Netzhaut zu erforschen51.
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
Wir danken allen Mitgliedern unseres Labors und des Augentierlabors des Zhongshan Ophthalmic Center für ihre technische Unterstützung. Wir danken auch Prof. Chunqiao Liu für die experimentelle Unterstützung. Diese Arbeit wurde durch Zuschüsse der National Natural Science Foundation of China (NSFC: 81670872; Peking, China), die Naturwissenschaftliche Stiftung der Provinz Guangdong, China (Fördernummer 2019A1515011347) und ein hochrangiges Krankenhausbauprojekt des State Key Laboratory of Ophthalmology am Zhongshan Ophthalmic Center (Grant No. 303020103; Guangzhou, Provinz Guangdong, China).
Materialien
| Name | Company | Catalog Number | Comments |
| 1 mL sterile syringe | Solarbio | YA0550 | For preparation of retinal flat mounts and intraperitoneal injection |
| 1× Phosphate buffered saline (PBS) | Transgen Biotech | FG701-01 | For preparation of retinal flat mounts |
| 2 ml Microcentrifuge Tube | Corning | MCT-200-C | For preparation of retinal flat mounts |
| 48 Well Clear TC-Treated Multiple Well Plates | Corning | 3548 | For preparation of retinal flat mounts |
| Adhesive microscope slides | Various | For preparation of retinal flat mounts | |
| Adobe Photoshop CC 2019 | Adobe Inc. | For image analysis | |
| Carbon dioxide gas | Various | For sacrifice | |
| Cover slide | Various | For preparation of retinal flat mounts | |
| Curved forceps | World Precision Instruments | 14127 | For preparation of retinal flat mounts |
| DAPI staining solution | Abcam | ab228549 | For labeling nucleus on retinal flat mounts |
| Dissecting microscope | Olmpus | SZ61 | For preparation of retinal flat mounts |
| Fluorescein sodium | Sigma-Aldrich | F6377 | For in vivo imaging |
| Fluorescent Microscope | Zeiss | AxioImager.Z2 | For acquisition of fluorescence images of retinal flat mounts |
| Fluoromount-G Mounting media | SouthernBiotech | 0100-01 | For preparation of retinal flat mounts |
| Hydroxypropyl Methylcellulose | Maya | 89161 | For in vivo imaging |
| Isolectin B4 594 antibody | Invitrogen | I21413 | For labeling retinal vasculature on retinal flat mounts |
| Mice C57/BL6J | GemPharmatech of Jiangsu Province | For OIR model induction | |
| Micro dissecting scissors-straight blade | World Precision Instruments | 503242 | For preparation of retinal flat mounts |
| No.4 straight forceps | World Precision Instruments | 501978-6 | For preparation of retinal flat mounts |
| Normal donkey serum | Abcam | ab7475 | For preparation of retinal flat mounts |
| O2 sensor | Various | For monitoring the level of O2 | |
| OxyCycler | Biospherix | A84XOV | For OIR model induction |
| Paraformaldehyde (PFA) | Sigma | P6148-1KG | For tissue fixation |
| Pentobarbital sodium | Various | For anesthesia | |
| Soda lime | Various | For absorbing excess CO2 in the oxygen chamber | |
| SPECTRALIS HRA+OCT | Heidelberg | HC00500002 | For in vivo imaging |
| SPSS Statistics 22.0 | IBM | For statistical analysis | |
| Tansference decloring shaker | Kylin-Bell | ZD-2008 | For preparation of retinal flat mounts |
| Tissue culture dish (Low attachment) | Corning | 3261-20EA | For preparation of retinal flat mounts |
| Transfer pipettes | Various | For preparation of retinal flat mounts | |
| Triton X-100 | Sigma-Aldrich | SLBW6818 | For preparation of retinal flat mounts |
| Tropicamide | Various | For in vivo imaging | |
| ZEN Imaging Software | ZEISS | For image acquisition and export |
Referenzen
- Vavvas, D. G., Miller, J. W. Chapter 26 - Basic Mechanisms of Pathological Retinal and Choroidal Angiogenesis. Retina (Fifth Edition). 1, 562-578 (2013).
- Selvam, S., Kumar, T., Fruttiger, M. Retinal vasculature development in health and disease. Progress in Retinal and Eye Research. 63, 1-19 (2018).
- Shimizu, K., Kobayashi, Y., Muraoka, K. Midperipheral fundus involvement in diabetic retinopathy. Ophthalmology. 88 (7), 601-612 (1981).
- Ashton, N. Retinal vascularization in health and disease: Proctor Award Lecture of the Association for Research in Ophthalmology. American Journal of Ophthalmology. 44 (4), 7-17 (1957).
- Hellström, A., Smith, L. E., Dammann, O. Retinopathy of prematurity. Lancet. 382 (9902), 1445-1457 (2013).
- Xu, Y., et al. Melatonin attenuated retinal neovascularization and neuroglial dysfunction by inhibition of HIF-1α-VEGF pathway in oxygen-induced retinopathy mice. Journal of Pineal Research. 64 (4), 12473 (2018).
- Cavallaro, G., et al. The pathophysiology of retinopathy of prematurity: an update of previous and recent knowledge. Acta Ophthalmologica. 92 (1), 2-20 (2014).
- Gilbert, C., Rahi, J., Eckstein, M., O'Sullivan, J., Foster, A. Retinopathy of prematurity in middle-income countries. Lancet. 350 (9070), 12-14 (1997).
- Chen, J., Smith, L. E. Retinopathy of prematurity. Angiogenesis. 10 (2), 133-140 (2007).
- Fielder, A., Blencowe, H., O'Connor, A., Gilbert, C. Impact of retinopathy of prematurity on ocular structures and visual functions. Archives of Disease in Childhood. Fetal and Neonatal Edition. 100 (2), 179-184 (2015).
- Moshfeghi, D. M. Presumed transient reactive astrocytic hyperplasia in immature retina. Retina. 26, 69-73 (2006).
- Kandasamy, Y., Hartley, L., Rudd, D., Smith, R. The association between systemic vascular endothelial growth factor and retinopathy of prematurity in premature infants: a systematic review. British Journal of Ophthalmology. 101 (1), 21-24 (2017).
- Shah, P. K., et al. Retinopathy of prematurity: Past, present and future. World Journal of Clinical Pediatrics. 5 (1), 35-46 (2016).
- Kinsey, V. E. Retrolental fibroplasia; cooperative study of retrolental fibroplasia and the use of oxygen. AMA Archives of Ophthalmology. 56 (4), 481-543 (1956).
- Tin, W., Gupta, S. Optimum oxygen therapy in preterm babies. Archives of Disease in Childhood. Fetal and Neonatal Edition. 92 (2), 143-147 (2007).
- Liu, C. H., Wang, Z., Sun, Y., Chen, J. Animal models of ocular angiogenesis: from development to pathologies. FASEB Journal : Official Publication of the Federation of American Societies for Experimental Biology. 31 (11), 4665-4681 (2017).
- Ashton, N., Ward, B., Serpell, G. Effect of oxygen on developing retinal vessels with particular reference to the problem of retrolental fibroplasia. The British Journal of Ophthalmology. 38 (7), 397-432 (1954).
- Penn, J. S., Tolman, B. L., Lowery, L. A. Variable oxygen exposure causes preretinal neovascularization in the newborn rat. Investigative Ophthalmology & Visual Science. 34 (3), 576-585 (1993).
- Smith, L. E., et al. Oxygen-induced retinopathy in the mouse. Investigative Ophthalmology & Visual Science. 35 (1), 101-111 (1994).
- McLeod, D. S., Brownstein, R., Lutty, G. A. Vaso-obliteration in the canine model of oxygen-induced retinopathy. Investigative Ophthalmology & Visual Science. 37 (2), 300-311 (1996).
- Cao, R., Jensen, L. D., Söll, I., Hauptmann, G., Cao, Y. Hypoxia-induced retinal angiogenesis in zebrafish as a model to study retinopathy. PLoS One. 3 (7), 2748 (2008).
- Connor, K. M., et al. Quantification of oxygen-induced retinopathy in the mouse: a model of vessel loss, vessel regrowth and pathological angiogenesis. Nature Protocols. 4 (11), 1565-1573 (2009).
- Fruttiger, M. Development of the mouse retinal vasculature: angiogenesis versus vasculogenesis. Investigative Ophthalmology & Visual Science. 43 (2), 522-527 (2002).
- Stahl, A., et al. The mouse retina as an angiogenesis model. Investigative Ophthalmology & Visual Science. 51 (6), 2813-2826 (2010).
- Rivera, J. C., et al. Ischemic retinopathies: oxidative stress and inflammation. Oxidative Medicine and Cellular Longevity. 2017, 3940241 (2017).
- Bashinsky, A. L. Retinopathy of prematurity. North Carolina Medical Journal. 78 (2), 124-128 (2017).
- Flynn, J. T., et al. Retinopathy of prematurity. Diagnosis, severity, and natural history. Ophthalmology. 94 (6), 620-629 (1987).
- Aguilar, E., et al. Chapter 6. Ocular models of angiogenesis. Methods in Enzymology. 444, 115-158 (2008).
- Liegl, R., Priglinger, C., Ohlmann, A. Induction and readout of oxygen-induced retinopathy. Methods in Molecular Biology. 1834, 179-191 (2019).
- Lutty, G. A., McLeod, D. S. Retinal vascular development and oxygen-induced retinopathy: a role for adenosine. Progress in Retinal and Eye Research. 22 (1), 95-111 (2003).
- Vähätupa, M., et al. Oxygen-induced retinopathy model for ischemic retinal diseases in rodents. Journal of Visualized Experiments: JoVE. (163), (2020).
- Kim, C. B., D'Amore, P. A., Connor, K. M. Revisiting the mouse model of oxygen-induced retinopathy. Eye and Brain. 8, 67-79 (2016).
- Gammons, M. V., Bates, D. O. Models of oxygen induced retinopathy in rodents. Methods in Molecular Biology. 1430, 317-332 (2016).
- Xiao, S., et al. Fully automated, deep learning segmentation of oxygen-induced retinopathy images. Journal of Clinical Investigation Insight. 2 (24), (2017).
- McLeod, D. S., D'Anna, S. A., Lutty, G. A. Clinical and histopathologic features of canine oxygen-induced proliferative retinopathy. Investigative Ophthalmology & Visual Science. 39 (10), 1918-1932 (1998).
- Penn, J. S., Johnson, B. D. Fluorescein angiography as a means of assessing retinal vascular pathology in oxygen-exposed newborn rats. Current Eye Research. 12 (6), 561-570 (1993).
- Mezu-Ndubuisi, O. J., et al. In vivo retinal vascular oxygen tension imaging and fluorescein angiography in the mouse model of oxygen-induced retinopathy. Investigative Ophthalmology & Visual Science. 54 (10), 6968-6972 (2013).
- Zeilbeck, L. F., Müller, B., Knobloch, V., Tamm, E. R., Ohlmann, A. Differential angiogenic properties of lithium chloride in vitro and in vivo. PLoS One. 9 (4), 95546 (2014).
- Walsh, N., Bravo-Nuevo, A., Geller, S., Stone, J. Resistance of photoreceptors in the C57BL/6-c2J, C57BL/6J, and BALB/cJ mouse strains to oxygen stress: evidence of an oxygen phenotype. Current Eye Research. 29 (6), 441-447 (2004).
- Zhang, Q., Zhang, Z. M. Oxygen-induced retinopathy in mice with retinal photoreceptor cell degeneration. Life Sciences. 102 (1), 28-35 (2014).
- Okamoto, N., et al. Transgenic mice with increased expression of vascular endothelial growth factor in the retina: a new model of intraretinal and subretinal neovascularization. The American Journal of Pathology. 151 (1), 281-291 (1997).
- Ohlmann, A., et al. Norrin promotes vascular regrowth after oxygen-induced retinal vessel loss and suppresses retinopathy in mice. The Journal of Neuroscience. 30 (1), 183-193 (2010).
- Fang, L., Barber, A. J., Shenberger, J. S. Regulation of fibroblast growth factor 2 expression in oxygen-induced retinopathy. Investigative Ophthalmology & Visual Science. 56 (1), 207-215 (2014).
- Chan, C. K., et al. Differential expression of pro- and antiangiogenic factors in mouse strain-dependent hypoxia-induced retinal neovascularization. Laboratory Investigation. 85 (6), 721-733 (2005).
- Stahl, A., et al. Postnatal weight gain modifies severity and functional outcome of oxygen-induced proliferative retinopathy. The American Journal of Pathology. 177 (6), 2715-2723 (2010).
- Vanhaesebrouck, S., et al. Association between retinal neovascularization and serial weight measurements in murine and human newborns. European Journal of Ophthalmology. 23 (5), 678-682 (2013).
- Gerschman, R., Nadig, P. W., Snell, A. C., Nye, S. W. Effect of high oxygen concentrations on eyes of newborn mice. The American Journal of Physiology. 179 (1), 115-118 (1954).
- Lange, C., et al. Kinetics of retinal vaso-obliteration and neovascularisation in the oxygen-induced retinopathy (OIR) mouse model. Graefe's Archive for Clinical and Experimental Ophthalmology. 247 (9), 1205-1211 (2009).
- Huang, S., et al. Comparison of dextran perfusion and GSI-B4 isolectin staining in a mouse model of oxygen-induced retinopathy. Eye Science. 30 (2), 70-74 (2015).
- Paques, M., et al. Panretinal, high-resolution color photography of the mouse fundus. Investigative Ophthalmology & Visual Science. 48 (6), 2769-2774 (2007).
- Fletcher, E. L., et al. Animal models of retinal disease. Progress in Molecular Biology and Translational Science. 100, 211-286 (2011).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten