Method Article
Monitoramento do crescimento dinâmico dos vasos retinais no modelo de rato de retinopatia induzido pelo oxigênio
Neste Artigo
Resumo
Este protocolo descreve um método detalhado para a preparação e a coloração da imunofluorescência de montagem e análise plana de retina de camundongos. O uso de fluoresceína fundus angiography (FFA) para filhotes de camundongos e processamento de imagem também são descritos em detalhes.
Resumo
A retinopatia induzida por oxigênio (OIR) é amplamente utilizada para estudar o crescimento anormal de vasos em doenças isquêmicas da retina, incluindo retinopatia da prematuridade (ROP), retinopatia diabética proliferativa (RDR) e oclusão da veia retinista (RVO). A maioria dos estudos de OIR observa a neovascularização da retina em pontos de tempo específicos; no entanto, o crescimento dinâmico de embarcações em camundongos vivos ao longo de um curso de tempo, essencial para a compreensão das doenças de vasos relacionadas ao OIR, tem sido subestudado. Aqui, descrevemos um protocolo passo-a-passo para a indução do modelo de mouse OIR, destacando as potenciais armadilhas, e fornecendo um método aprimorado para quantificar rapidamente áreas de vaso-obliteração (VO) e neovascularização (NV) usando coloração de imunofluorescência. Mais importante, monitoramos o recrescimento de embarcações em camundongos vivos de P15 a P25 realizando angiografia de fundus fluoresceína (FFA) no modelo de mouse OIR. A aplicação da FFA ao modelo de mouse OIR nos permite observar o processo de remodelação durante o recrescimento da embarcação.
Introdução
A neovascularização da retina (RNV), que é definida como um estado onde novos vasos patológicos se originam das veias retinárias existentes, geralmente se estende ao longo da superfície interna da retina e cresce no espaço vítreo (ou subretral sob algumas condições)1. É uma característica marcante e comum de muitas retinopatias isquêmicas, incluindo retinopatia da prematuridade (ROP), oclusão da veia da retina (RVO) e retinopatia diabética proliferativa (PDR)2.
Inúmeras observações clínicas e experimentais indicaram que a isquemia é a principal causa da neovascularizaçãoda retina 3,4. No ROP, os recém-nascidos são expostos ao oxigênio de alto nível em incubadoras fechadas para aumentar as taxas de sobrevivência, o que também é um importante motor para a prisão do crescimento vascular. Após o tratamento, as retinas dos recém-nascidos experimentam um período relativamente hipóxico5. Outras situações são observadas na oclusão das veias de retina central ou ramificada no RVO e também é observado dano de capilares de retina que é causado por microangiopatia na PDR2. A hipóxia aumenta ainda mais a expressão de fatores angiogênicos, como o fator de crescimento endotelial vascular (VEGF) através do fator induzido por hipóxia-1α (HIF-1α) caminho de sinalização que, por sua vez, guia as células endoteliais vasculares para crescer na área hipóxica e formar novos vasos 6,7.
O ROP é uma espécie de retinopatia proliferativa vascular em bebês prematuros e uma das principais causas de cegueira infantil 8,9, caracterizada por hipóxia retiniana, neovascularização da retina e hiperplasia fibrosa 10,11,12. Na década de 1950, pesquisadores descobriram que a alta concentração de oxigênio pode melhorar significativamente os sintomas respiratórios de bebês prematuros13,14. Como resultado, a oxigenoterapia foi cada vez mais utilizada em bebês prematuros na época15. No entanto, concomitantemente com o uso generalizado de oxigenoterapia em bebês prematuros, a incidência de ROP aumentou ano a ano. Desde então, pesquisadores associaram oxigênio ao ROP, explorando vários modelos animais para entender a patogênese do ROP e RNV16.
No ser humano, a maioria do desenvolvimento da vasculatura da retina é concluída antes do nascimento, enquanto nos roedores a vasculatura da retina se desenvolve após o nascimento, fornecendo um sistema modelo acessível para estudar angiogênese na vasculatura da retina2. Com o progresso contínuo da pesquisa, os modelos de retinopatia induzida por oxigênio (OIR) tornaram-se grandes modelos para imitar a angiogênese patológica resultante da isquemia. Não há espécies animais específicas no estudo do modelo OIR e o modelo foi desenvolvido em várias espécies animais, incluindo gatinho17, rato18, rato19, filhote de beagle20 e zebrafish21. Todos os modelos compartilham o mesmo mecanismo pelo qual são expostos à hiperoxia durante o desenvolvimento precoce da retina e depois retornados ao ambiente normóxico. Smith et al. observaram que expor filhotes de camundongos à hiperoxia de P7 por 5 dias induziu uma forma extrema de regressão do vaso na retina central e trazê-los de volta ao ar da sala em P12 gradualmente desencadeou tufos neovasculares, que cresceram em direção ao corpo vítreo19. Este foi um modelo de mouse OIR padronizado também chamado de modelo Smith. Connor et al. otimizaram ainda mais o protocolo e forneceram um método universalmente aplicável para quantificar a área de VO (vaso-obliteração) e NV (neovascularização) em 2009, o que aumentou a aceitação e utilização do modelo22. O modelo de mouse OIR ainda é o modelo mais utilizado agora por causa de seu pequeno tamanho, reprodução rápida, fundo genético claro, boa repetibilidade e alta taxa de sucesso.
Em camundongos, a vascularização da retina começa após o nascimento com o crescimento dos vasos da cabeça do nervo óptico para a retina interna em direção à ora serrata. Durante o desenvolvimento normal da retina, os primeiros vasos da retina brotam da cabeça do nervo óptico ao redor do nascimento, formando uma rede em expansão (o plexo primário) que atinge a periferia em torno do dia pós-natal 7(P7)23. Em seguida, os vasos começam a crescer na retina para formar uma camada profunda, penetrar na retina, e estabelecer uma rede laminar em torno da camada nuclear interna (INL) como no humano24. Ao final da terceira semana pós-natal (P21), o desenvolvimento mais profundo do plexo está quase concluído. Para o modelo de camundongo OIR, a oclusão vascular sempre aparece na retina central devido à rápida degeneração de um grande número de redes vasculares imaturas na região central durante a exposição à hiperoxia. Assim, o crescimento da neovascularização patológica também ocorre na retina periférica média, que é o limite da área de não perfusão e da área vascular. No entanto, os vasos de retina humana quase se formaram antes do nascimento. Quanto aos prematuros, a retina periférica não é completamente vascularizada quando exposta à hiperoxia 25,26. Assim, a oclusão vascular e a neovascularização aparecem principalmente na retina periférica27,28. Apesar dessas diferenças, o modelo OIR do camundongo recapitula de perto os eventos patológicos que ocorrem durante a neovascularização induzida pela isquemia.
A indução do modelo OIR pode ser dividida em duas fases29: na fase 1 (fase da hiperoxia), o desenvolvimento vascular da retina é preso ou retardado com oclusão e regressão dos vasos sanguíneos como resultado do declínio do VEGF e da apoptose das células endoteliais 24,30; na fase 2 (fase da hipóxia), o suprimento de oxigênio da retina se tornará insuficiente sob as condições de ar29, essencial para o desenvolvimento neural e homeostase19,31. Esta situação isquêmica geralmente resulta em neovascularização anormal não regulamentada.
Atualmente, o método de modelagem comumente utilizado é alternar alta/baixa exposição ao oxigênio: Mães e seus filhotes são expostos a 75% de oxigênio por 5 dias em P7 seguido por 5 dias no ar do quarto até p17 demonstrar resultadoscomparáveis 22, que é o ponto final da indução do modelo de camundongo OIR. (Figura 1). Além de simular ROP, essa neovascularização patológica mediada por isquemia também pode ser usada para estudar outras doenças isquêmicas da retina. As principais medidas deste modelo incluem quantificar a área de VO e NV, que são analisadas a partir de montagens planas de retina por coloração de imunofluorescência ou perfusão FITC-dextran. Cada rato só pode ser estudado uma vez por causa da operação letal. Atualmente, existem poucos métodos para observar mudanças dinâmicas da vasculatura da retina continuamente durante o processo de regressão vascular e angiogênese patológica32. Neste artigo, fornecemos um protocolo detalhado da indução do modelo OIR, análise de montagens planas de retina, bem como um fluxo de trabalho de angiografia de fluoresceína fundus (FFA) em camundongos que seria útil para obter uma compreensão mais abrangente das mudanças dinâmicas vasculares durante duas fases do modelo de mouse OIR.
Protocolo
Todos os procedimentos envolvendo o uso de camundongos foram aprovados pelo comitê de ética experimental animal do Centro Oftalmológico de Zhongshan, Sun Yat-sen University, China (número autorizado: 2020-082), e de acordo com as diretrizes aprovadas do Comitê de Cuidados e Uso de Animais do Centro Oftalmológico de Zhongshan e da Declaração da Associação de Pesquisa em Visão e Oftalmologia (ARVO) para o Uso de Animais em Pesquisa Oftalmológica e Visão.
1. Indução do modelo OIR do mouse
- Use camundongos com uma taxa mais baixa de malformação congênita dos olhos, por exemplo, camundongos C57BL/6J, e acasale-os em uma proporção de macho/fêmea = 1:2. Obter os filhotes nascidos no mesmo dia e começar a induzir o modelo OIR em P7. Grave o peso corporal dos filhotes de rato estritamente antes de modelar.
NOTA: Note o dia do nascimento como P0. Regissuor regularmente de cada rato. O peso corporal dos filhotes recém-nascidos é muito importante durante a indução do OIR, pois a sensibilidade dos camundongos em diferentes estados ao oxigênio é diferente. Exclua os filhotes mais de 5 g em P7 para garantir resultados comparáveis. - Proporcionar um ambiente de vida adequado para as mães de enfermagem e seus filhotes, como fixar a temperatura em 23 °C ± 2 °C, controlar a umidade em 40%-65%, alternar 12h de luz e 12h de escuridão todos os dias, adicionar um pouco de lã de algodão à gaiola para aninhar, garantir alimentos e água esterilizados adequados, e mantê-los em gaiolas individualmente ventiladas (IVC).
- Monitore o nível de umidade e temperatura dentro da câmara. Controle a umidade entre 40% e 65% e mantenha a temperatura em 23 °C ± 2 °C.
- Verifique o suprimento de oxigênio com sensores de oxigênio, mantenha um nível constante de oxigênio em 75% e controle a taxa de fluxo de oxigênio em 0,5-0,75 L/min. Coloque 50 g de limão de soda na parte inferior da câmara para absorver co2 excessivo e manter os valores de CO2 abaixo de 3%22.
- Monitore os comportamentos das mães de enfermagem, como o comportamento de construção de ninhos, mordendo seus filhotes e recusando lactação pelo menos uma vez por dia. Elimine mães amamentando com maternidade pobre.
- Coloquem os filhotes P7 (macho e fêmea) e suas mães de enfermagem em uma câmara de oxigênio na qual o nível de oxigênio é de 75% por 5 dias a P12. Evite a abertura desnecessária da câmara durante o período de indução do modelo. Certifique-se de que há mães substitutas extras para substituição, caso as mães de enfermagem morram devido a lesões pulmonares enquanto estão em hiperoxia.
NOTA: Para garantir a comparabilidade do experimento, restrinja o número a 6-8 filhotes para cada mãe. Preste atenção ao potencial problema da toxicidade do oxigênio, que causa a morte de algumas mães amamentando. Os sinais de lesão pulmonar hiperóxica nas mães de enfermagem incluem, mas não se limitam a, taxa respiratória flutuante, diminuição da atividade e diminuição da alimentação. Quando ocorre o fenômeno acima, eutanize a mãe amamentando com 1% de sódio pentobarbital (50 mg/kg) o mais rápido possível. Prepare algumas mães substitutas, por exemplo, 129S1/SvImJ para substituição e use-as somente se necessário. Não é recomendável substituir as mães amamentando como rotina, pois isso levará à abertura frequente de uma câmara de oxigênio, resultando em níveis instáveis de oxigênio e agressão materna. - Leve os filhotes e suas mães de enfermagem de volta ao ar da sala em P12 e monitore o peso de todos os filhotes continuamente até P17. Agrupar os filhotes com base no peso para garantir que cada grupo experimental tenha uma distribuição de peso semelhante.
2. Preparação de montagens inteiras de retina e coloração de imunofluorescência
- Regissão corporal dos filhotes. Sacrifique os filhotes por uma overdose de anestésico (1% de sódio pentobarbital 50 mg/kg) ou inalação de CO2 . Outros métodos de eutanásia, como luxação cervical e toracotomia bilateral, podem ser utilizados se necessário.
- Use uma tesoura curva para liberar a conexão entre os globos oculares e o tecido orbital. Em seguida, coloque fórceps curvos na parte posterior do globo ocular, aperte o nervo óptico, e rapidamente levante o olho para fora da órbita. Lave os globos oculares em um soro fisiológico tampão de fosfato 1x pré-resfriado (PBS) para remover o cabelo e o sangue da superfície dos globos oculares.
- Coloque os globos oculares limpos em um tubo de microcentrifus de 2 mL preenchido com 4% de paraformaldeído (PFA) e incubar por 15 minutos à temperatura ambiente em um shaker a uma velocidade de 12-15 rotações por minuto (rpm) (fixação inicial).
ATENÇÃO: O paraformaldeído é conhecido por ser alergênico, geralmente tóxico e extremamente citotóxico. Siga as instruções de segurança estritamente e evite a inalação e o contato com a pele. - Use um prato de cultura e coloque uma gota de 1x PBS na parte central e realize os seguintes passos sob um microscópio dissecando e coloque um globo ocular nesta gota. Segure o globo ocular com um par de fórceps e puna cuidadosamente a córnea no limbus da córnea usando uma agulha de seringa de 1 mL. Insira a ponta da tesoura neste orifício e corte cuidadosamente a córnea ao longo do limbus da córnea. Cuidado para não cortar a retina.
- Remova a íris e a lente com um par de fórceps. Em seguida, coloque a ocular restante no PFA de 4% e fixe novamente por mais 45 minutos em temperatura ambiente em um agitador a uma velocidade de 12-15 rpm (fixação secundária).
- Use um prato de cultura e coloque uma gota de 1x PBS na parte central. Coloque o globo ocular fixo nesta gota. Segure o globo ocular com um par de fórceps. Separe suavemente as camadas de retina e esclera usando duas fórceps. Coloque a ponta da tesoura entre as camadas de retina e esclera e corte a esclera em direção ao nervo óptico. Retire a esclera da retina e obtenha o copo de retina.
NOTA: Segure o copo posterior pelo nervo óptico com fórceps, em seguida, use a extremidade curva de outro fórceps para pressionar para baixo sobre a esclera na cabeça do nervo óptico e massageie suavemente a retina em um movimento de varredura para a frente como uma alternativa para liberar a retina. - Use fórceps para liberar a conexão entre os vasos hialoides radiais e a retina periférica, fixar a raiz dos vasos hialoides que está perto da cabeça do nervo óptico, e cortar os vasos hialoides cuidadosamente.
- Use uma pipeta de 2 mL com a ponta cortada para transferir o copo de retina. Coloque a xícara de retina em um poço em uma placa de 48 poços e lave-a por 3 x 5 min com 1x PBS em temperatura ambiente em um shaker a uma velocidade de 12-15 rpm.
- Incubar o copo de retina em uma solução mista de 1% Triton X-100 (em PBS) e 5% de soro de burro normal (em PBS) durante a noite a 4 °C.
- Alternativamente, bloqueie e permeabilize retinas à temperatura ambiente por 1h como alternativa. Alterar o soro de bloqueio de acordo com a fonte do anticorpo secundário.
- Se rotular a vasculatura de retina usando Isolectina B4, incubar a retina em um poço de placa de 48 poços com soro de burro 0,1% normal (400 μL) e IsolectinaB4-594 (1:400) durante a noite a 4 °C em um shaker a uma velocidade de 12-15 rpm.
NOTA: Se rotular os vasos sanguíneos com outros marcadores, como CD31, ou rotular outras células, use anticorpos primários específicos para rotulá-los. - Incubar a retina com 1:100-1:500 anticorpos primários específicos (em 400 μL 0,1% soro normal de burro) a 4 °C em um shaker a uma velocidade de 12-15 rpm por 48 h. (opcional)
- Depois de voltar à temperatura ambiente, lave a retina com 0,1% de PBST (0,1% TritonX-100 na PBS) por 3 x 20 min em um shaker a uma velocidade de 12-15 rpm.
- Incubar a retina com anticorpos secundários de 1:100 (em 400 μL 0,1% soro normal de burro) durante a noite a 4 °C em um agitador a uma velocidade de 12-15 rpm. (opcional)
- Alternativamente, incubar a retina com anticorpos secundários de alta afinidade à temperatura ambiente por 1h.
- Incubar a retina com DAPI (1:1.000) em temperatura ambiente por 20-25 min para rotular o núcleo.
NOTA: Teste as razões de diluição ideais para todos os anticorpos utilizados nas etapas 10-11 e 13-14 no pré-experimento. - Lave a retina por 3 x 30 min com 0,1% de PBST em um shaker a uma velocidade de 12-15 rpm em temperatura ambiente.
- Transfira o copo de retina para um slide limpo com a abertura voltada para cima. Corte a retina radialmente nas posições 3, 6, 9 e 12 horas de periférica para central, cortando aproximadamente 1-1,5 mm de distância da cabeça do nervo óptico.
- Adicione algumas gotas de 1x PBS para enxaguar a retina três vezes. Use papel colocado no ar para secar e achatar a retina. Adicione uma gota de meio de montagem (ver Tabela de Materiais) ao centro do deslizamento de tampas e pare de adicioná-lo até que o diâmetro da gota aumente para metade do deslizamento de tampa. Vire rapidamente a tampa e coloque-a em cima da retina generalizada. Evite formar bolhas.
- Tire imagens das montagens planas da retina ou armazene e proteja os slides da luz a 4 °C.
3. Análise e quantificação de montagens planas de retina
NOTA: Para o modelo de camundongo OIR, os pesquisadores frequentemente registram a área de oclusão vascular da retina central e neovascularização patológica da retina periférica durante P12-P25. Estudos anteriores mostraram que a área avascular central da retina atinge o máximo em P12 e gradualmente encolhe de P13 para P17; ao mesmo tempo, a retina dos camundongos OIR atinge o pico da área de neovascularização em torno de P1722,29. A partir de P17, os neovessels gradualmente regredim e os vasos funcionais recrescem na área avascular. A vasculatura da retina basicamente volta ao normal em P2533.
- Faça imagens de montagens planas de retina por um microscópio de fluorescência (ver Tabela de Materiais) com lente objetiva de 10x. Primeiro, escolha o canal DAPI e coloque a cabeça do nervo óptico no centro do campo visual. Em seguida, ajuste outros canais e foque na vasculatura superficial da retina. Verifique as telhas em um software de foto (ver Tabela de Materiais) e defina o número de fotos que precisam ser costuradas. Clique em Iniciar experimento para capturar toda a retina.
- Use um programa de processamento de imagens (ver Tabela de Materiais) para quantificar a área de vaso-obliteração (VO) e neovascularização (NV) após a coloração da imunofluorescência.
- Primeiro, clique na Ferramenta varinha mágica e defina uma tolerância apropriada de acordo com a diferença de brilho e mova o cursor para o fundo e clique no mouse. Em seguida, escolha o Select Inverse para obter um contorno básico da retina. Use a Ferramenta Laço para delinear ainda mais os detalhes da retina. Usando a função Histograma , registo o valor do pixel de toda a retina e anote ou gere uma tabela em um programa de banco de dados.
- Divida a imagem da retina em quatro quadrantes. Em cada quadrante, use a Ferramenta Laço para desenhar a área de VO (Figura 2A-C) e use a Ferramenta varinha mágica para selecionar a área NV (Figura 2D-F). Através das informações de pixels no histograma, calcule a razão de pixels de VO e NV para toda a retina, ou seja, a porcentagem de área de VO ou NV em relação a toda a retina.
NOTA: Há também um pipeline de código aberto e totalmente automatizado para a quantificação de áreas de VO e NV em imagens OIR usando redes neurais de aprendizagem profunda (http://oirseg.org/), que fornece uma maneira confiável e de economia de tempo para os pesquisadores, bem como unifica o padrão da quantificação34.
- Registo informações sobre pixels em uma tabela de planilhas, o que é conveniente para análises subsequentes.
4. Imagem in vivo com angiografia de fluoresceína fundus (FFA)
NOTA: Para camundongos OIR, tanto a perfusão FITC quanto a coloração de imunofluorescência só podem ser usadas por uma vez devido à morte de animais experimentais. Em comparação com isso, uma das vantagens da FFA é a observação das mudanças dinâmicas dos vasos de retina do camundongo durante o desenvolvimento e estado patológico in vivo35,36.
- Pesar os filhotes antes da anestesia.
- Anesthetize filhotes por injeção intraperitoneal de 0,3% de sódio pentobarbital a uma dose de 30-50 mg/kg.
NOTA: Para camundongos dentro de 1 mês, preste atenção às doses anestésicos. Use concentrações e doses mais baixas de anestésico para reduzir a morte de camundongos causados por anestesia. Depois que os filhotes forem anestesiados, use uma pequena almofada de aquecimento para manter a temperatura corporal. A hipotermia não afeta apenas a função fisiológica dos filhotes, mas também leva a mudanças na cristalina e acelera o desenvolvimento de cataratas. - Use 20 μL colírios mydritic (0,5% de tropicamida + 0,5% cloridrato de fenilefrina) para cada filhote e espere 5 minutos para alcançar a dilatação pupilar de longa duração (Figura 3A,B).
- Traga os filhotes anestesiados na frente do dispositivo de imagem (ver Tabela de Materiais). Mantenha os filhotes em uma pequena almofada de aquecimento, coloque os filhotes em uma posição estável e use lágrimas artificiais regularmente para manter a umidade na córnea. Clique no modo de Imagem fundus infravermelha (IR) para ajustar a cabeça do nervo óptico para o centro da tela.
NOTA: Ao observar um olho dos filhotes, não se esqueça de proteger o outro olho. Use colírios de hypromellose para evitar que a córnea claree devido ao ressecamento. - Após injeção intraperitoneal de 0,15 mL 0,5% de solução de sal de sódio fluoresceína, clique no botão FA e no botão Injection imediatamente no painel de toque do dispositivo de imagem para iniciar o tempo. Registo as imagens após 3 minutos quando a circulação sanguínea da retina entra na fase venosa e observe a retina não menos que 6-8 min.
NOTA: Após injeção intraperitoneal de solução de sal de sódio fluoresceína, a pele, a mucosa e a urina dos filhotes mostram verde amarelo óbvio. A maior parte do fluoresceína é excretada pelos filhotes dentro de um dia. Injetar o sódio fluoresceína intraperitonealmente a cada dois dias por seis vezes não causa efeitos colaterais significativos37. - Mova a cabeça do nervo óptico para o centro da área de aquisição de imagens e tire a primeira imagem da retina central. Em seguida, mova a lente do dispositivo de imagem horizontalmente para o lado nasal do olho até que a cabeça do nervo óptico esteja localizada no ponto médio de um lado da área de aquisição de imagens e tire a segunda imagem. Continue a tirar imagens da retina temporal, superior e inferior, respectivamente utilizando este método (Figura 3C).
NOTA: Leve as imagens de "cinco orientações" dentro de 12 minutos à medida que a fase de regressão ocorrer. A posição da cabeça do nervo óptico na imagem inferior é permitida a não cair na linha lateral devido ao ajuste de ângulo limitado da lente. - Salve as imagens e use um programa de processamento de imagens para costurar.
5. Processamento de imagem da angiografia de fundus fluoresceína (FFA)
- Abra o programa de processamento de imagens e clique em Novo em Arquivo para criar uma nova tela com fundo preto (Figura 4A).
- Abra uma imagem da retina central primeiro na camada de fundo. Clique em Arquivo e adicione a segunda imagem. Ajuste a opacidade da segunda imagem para 60%, mova-se e redimensione a segunda imagem até que as mesmas partes das duas imagens se sobreponham muito. Clique no botão Alternar Entre os modos Transformar Livre e Warp e faça ajustes sutis nas embarcações, se necessário. Em seguida, volte a opacidade da segunda imagem para 100% (Figura 4A,B).
- Selecione duas imagens ao mesmo tempo e clique em Auto-Blend Layers. Verifique panorama como o método de mistura, bem como selecione as duas frases a seguir. Clique em OK e finalize a costura de imagem das duas primeiras imagens (Figura 4C,D).
- Pegue as duas primeiras imagens costuradas como um todo, adicione a terceira imagem e continue a se misturar. Repita os métodos acima para completar a costura de cinco imagens (Figura 4E).
- Use a Ferramenta de Cultura para cortar imagens de FFA em diferentes pontos de tempo para um tamanho uniforme e observar mudanças dinâmicas da vasculatura da retina de P15 para P25 em filhotes normais e OIR.
6. Análise estatística
- Valores atuais como média ± desvio padrão (s.d.).
- Use o teste t do Aluno para comparar duas amostras independentes. Use ANOVA one-way para comparar vários conjuntos de dados e combinar com o teste de Dunnett ou Tukey, que é um teste de comparação múltipla comumente usado.
- Para dados não normalmente distribuídos, use teste Mann-Whitney U ou teste Kruskal Wallis. Considere diferenças estatísticas significativas quando P < 0,05.
Resultados
No modelo de mouse OIR, o resultado mais importante e básico é a quantificação da área de VO e NV. Depois de viver no ambiente de hiperoxia por 5 dias a partir de P7, a retina central dos filhotes apresentou a maior área de não perfusão. Sob a estimulação da hipóxia em mais 5 dias, a neovascularização da retina foi gradualmente produzida, que fluoresced mais intensamente do que vasos normais circundantes. Após P17, o sinal de fluorescência da neovascularização patológica regrediu rapidamente como a remodelagem da retina (Figura 5A). Controlando o tamanho da ninhada e o ganho de peso pós-natal dos filhotes, a área do VO e NV do modelo de mouse OIR mostrou boa repetibilidade e estabilidade e o pico de neovascularização da retina ocorreu em P17, que estava em consonância com os estudos anteriores (Figura 5B,C).
A FFA é uma ferramenta ideal para estudar vasculatura de retina. Dada a aplicação da FFA in vivo, mostra uma grande redução no desperdício de animais experimentais, bem como exibe as mudanças dinâmicas dos vasos da retina com o tempo. Em estudos anteriores, a FFA não era frequentemente utilizada em filhotes de camundongos e era apresentada em uma imagem de visão única, o que era difícil para estudos posteriores. Neste protocolo, as imagens de "cinco orientações" da vasculatura da retina foram costuradas juntas usando um software de processamento de imagem para exibir um campo mais amplo da retina ao mesmo tempo, o que foi útil para análises subsequentes, se necessário (Figura 4). Além disso, os filhotes de rato OIR mostraram uma abertura prolongada dos olhos para que as imagens da FFA fossem tiradas do P15 para atender aos requisitos da ética animal. Na retina do modelo de camundongo OIR, o diâmetro dos vasos sanguíneos aumentou evidentemente e tornou-se altamente tortuoso quando comparado com ratos normais. Além disso, a FFA mostrou uma tendência semelhante de mudanças dinâmicas da vasculatura da retina com a coloração da imunofluorescência com isolectina B4-594 de P15-P25 sem a morte dos filhotes (Figura 6).
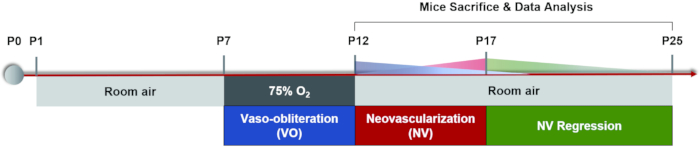
Figura 1: Esquema de desenho animado do modelo de mouse OIR. O modelo de rato OIR foi induzido por manter filhotes e suas mães de enfermagem em um quarto por algum tempo (P0-P7). Na P7, ambos foram expostos a 75% de oxigênio por 5 dias, o que inibiu o crescimento dos vasos da retina e causou perda significativa de vasos na retina central. Os camundongos foram então trazidos de volta ao ar do quarto em P12 e a retina avascular começou a se tornar relativamente hipóxica, desencadeando tanto o recrescimento normal do vaso quanto uma resposta patológica em torno da retina média periférica. A neovascularização máxima (NV) foi vista em P17. Em seguida, a neovascularização patológica passou por um processo de regressão espontânea. O sistema vascular da retina voltou ao normal novamente por volta de P25. Clique aqui para ver uma versão maior desta figura.

Figura 2: Medição da vaso-obliteração (VO) e neovascularização (NV) na retina do rato. (A) Imagem de 10x P12 OIR retina inteira manchada para células endoteliais com isolectina B4-594. (B) Captura de tela de uma retina com a área avascular selecionada. As ferramentas necessárias para fazer esta medição são destacadas com setas brancas: Magic Wand Tool e Lasso Tool. (C) Destaque a área avascular da retina e salve a imagem como cópia. (D) Imagem de 10x P17 OIR de montagem total da retina manchada para células endoteliais com isolectina B4-594. (E) Captura de tela de uma retina com tufos neovasculares selecionados. Use a ferramenta Varinha Mágica e defina uma tolerância ideal para destacar o NV. Defina a tolerância para 3-5 e verifique o anti-alias e caixas contíguas. (F) Salve a área de neovascularização apenas como uma cópia. As barras de escala representam 1.000 μm. Por favor, clique aqui para ver uma versão maior desta figura.
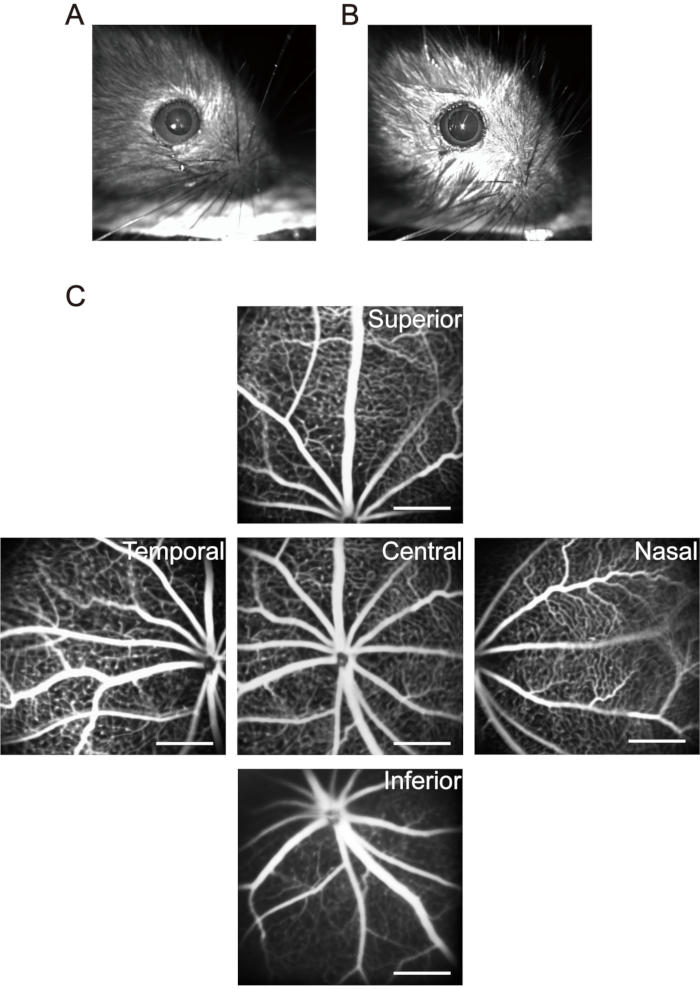
Figura 3: Aquisição das imagens de "cinco orientações" na retina do rato. (A) A pupila normal do rato. (B) Pupila de rato na midriase. (C) Foram coletadas as imagens "cinco orientações" da área central, nasal, temporal, superior e inferior da retina, respectivamente (filhotes P17 no ar da sala). As barras de escala representam 500 μm. Clique aqui para ver uma versão maior desta figura.

Figura 4: Fluxo de trabalho geral de costura das imagens "Cinco-orientação" da angiografia fluoresceína fundus (FFA). (B) Abra uma imagem FFA da retina temporal e ajuste a opacidade da segunda imagem para 60%; mover e redimensionar a imagem até que as mesmas partes das duas imagens se sobreponham muito. Clique em Modos De Transformar Livre e Dobra Livre para fazer ajustes sutis, se necessário. Volte a opacidade da segunda imagem para 100%. (C) Selecione duas imagens ao mesmo tempo e clique em Camadas de Mistura Automática. (D) Use o Panorama como método de mistura para finalizar a costura da imagem das duas primeiras imagens. (E) Continue a costurar as imagens repetindo os métodos acima para completar a costura de todas as imagens. Clique aqui para ver uma versão maior desta figura.

Figura 5: Quantificação da vaso-obliteração (VO) e neovascularização (NV) na retina do modelo de rato OIR. (A) Imagem de 10x OIR retinal de montagens inteiras manchadas para células endoteliais com isolectina B4-594 de P12 a P25. Após serem expostos a 75% de oxigênio por 5 dias, filhotes e suas mães de enfermagem foram trazidos de volta ao ar do quarto em P12, onde a área de vaso-obliteração atingiu o máximo. A hipoxia relativa na retina central levou ao recrescimento do vaso nesta área, bem como angiogênese patológica na retina periférica média. Em P17, tufos neovasculares pré-retinais atingiram o máximo e, em seguida, encolheu rapidamente. NV regrediu completamente e a retina parecia estar normal por volta de P25. (B) Quantificação da área de VO mostrou pico em P12 e desaparecimento em torno de P25. (C) Quantificação da área de NV apresentou pico em P17 e regressão em torno de P25. As barras de escala representam 1.000 μm em A. (ANOVA de mão única, *P < 0,05, **P < 0,01, ***P < 0,001, ****P < 0,0001). Clique aqui para ver uma versão maior desta figura.
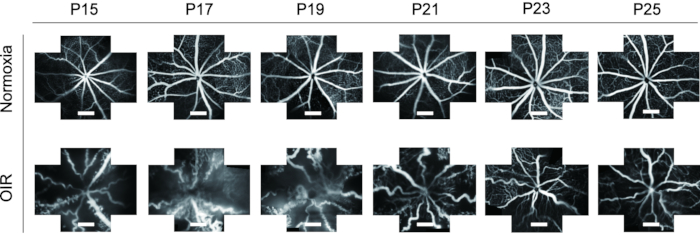
Figura 6: Imagem in vivo de fluorescein fundus angiography (FFA) no modelo de mouse OIR. Na retina do modelo de camundongo OIR, o diâmetro dos vasos sanguíneos aumentou evidentemente e tornou-se altamente tortuoso quando comparado com ratos normais. Além disso, a FFA mostrou uma tendência semelhante de mudanças dinâmicas da vasculatura da retina com a coloração da imunofluorescência com isolectina B4-594 de P15-P25 sem a morte de filhotes de camundongos. As barras de escala representam 500 μm. Clique aqui para ver uma versão maior desta figura.
Discussão
A suscetibilidade dos camundongos ao OIR é afetada por muitos fatores. Os filhotes de diferentes origens genéticas e cepas não podem ser comparados. Em camundongos albinos BALB/c, os vasos recrescem rapidamente na área de VO com tufos neovasculares reduzidos significativos38, que trazem algumas dificuldades para a pesquisa. Em camundongos C57BL/6, há aumento do dano do fotoreceptor quando comparado com a cepa de rato BALB/cJ39,40. O mesmo vale para diferentes tipos de camundongos transgênicos 41,42,43. Além disso, os camundongos C57BL/6 apresentam um nível mais baixo de angiogênese quando comparados com 129S3/SvIM camundongos44.
O ganho de peso pós-natal (PWG) também é importante considerar45 e é um dos indicadores para avaliar o estado nutricional dos recém-nascidos. Também se tornou um método confiável para prever o ROP, que atrai a atenção de muitos modeladores animais46. PwG afeta a resposta dos camundongos à hiperoxia e hipóxia. Na P7, filhotes com aumento do peso corporal (>5 g) apresentam uma insuficiente quebliteração vaso e neovascularização da retina, enquanto filhotes com menor peso corporal (<5 g) apresentam resposta óbvia à hiperoxia e à hipóxia. Além disso, na P17, filhotes com baixo (<5 g) e ganho de peso extenso (>7,5 g) apresentam uma NV reduzida. No entanto, filhotes com baixo ganho de peso (<5 g) têm estágio de vaso-obliteração (VO) e neovascularização (NV) significativamente prolongados com um atraso na ocorrência do picoNV 45. Portanto, é necessário gravar e controlar o PWG de filhotes em P7 e P17 e eliminar filhotes com baixo PWG (< 6 g em P17) para garantir a repetibilidade e comparabilidade do experimento.
O tamanho do lixo tem um impacto maior no PWG, e alguns pesquisadores sugerem que ele deve ser limitado a 6-8 filhotes/barragem para atender aos requisitos para PWG22,31. O estado da mãe amamentando também precisa de uma consideração. Mães amamentando são mais propensas a morrer de danos pulmonares em um ambiente hiperóxico47. Se as mães amamentando morrerem ou negligenciarem seus filhotes durante e após a indução de OIR, os filhotes perderão facilmente peso ou até morrerão devido à falta de nutrição32. Portanto, é necessário garantir que haja mães de aluguel suficientes para substituí-las. No entanto, essas mães substitutas são sugeridas para serem usadas apenas quando a mãe expira, o que geralmente acontece durante o período de exposição à hiperoxia ou retorno ao ardo quarto 22. Fornecer alimentos adequados para as mães de enfermagem também é útil para melhorar o estado nutricional de seus filhotes.
Uma nota útil para preparar as montagens planas da retina é que um tempo ideal de fixação geralmente é necessário para outras manchas de longa data. Como ratos de P12-P25, recomenda-se uma fixação de 15 minutos + 45 min à temperatura ambiente29. Fixar a retina a 4 °C durante a noite é uma alternativa se o tempo for limitado. Além disso, o tampão permeável e de bloqueio com maior concentração de 1% Triton X-100 e 5% soro de burro normal efetivamente reduzem o fundo de coloração de imunofluorescência de acordo com nossa experiência.
A coloração de isolectina B4 e a perfusão FITC-dextran são métodos comumente utilizados para visualizar e quantificar o neovascular48,49. Uma grande limitação desses dois métodos é que os ratos devem ser sacrificados. Assim, os métodos para imagem in vivo e quantificação de NV são necessários29. Paques et al. desenvolveram uma técnica chamada endoscopia tópica de imagem fundus (TEFI), que fornece fotografias digitais de alta resolução da retina em ratos vivos50. O TEFI pode detectar alterações vasculares de retina já em P15 e as imagens obtidas estão de acordo com os métodos convencionais de avaliação. Mezu-Ndubuisi et al. então forneceram os métodos para medidas in vivo de tensão de oxigênio vascular da retina (PO2) e angiografia fluoresceína (FA), melhorando a compreensão das alterações vasculares da retina e alterações de oxigenação devido ao ROP e outras doenças isquêmicas da retina37. Embora nem o TEFI nem a FA sejam tão precisas quanto os métodos convencionais, eles reduzem a morte de animais experimentais e podem ser realizados repetidamente. Além disso, eles permitem que cada mouse sirva como seu próprio controle, tornando os dados OIR mais comparáveis. Neste artigo, é fornecido um método aprimorado de imagem e costura de imagem da FFA. Realizar AF em filhotes dentro de 1 mês não é fácil porque anestesia excessiva e hipotermia causam diretamente a morte dos filhotes. Assim, tente usar a dose mínima de anestesia e preste especial atenção para manter a temperatura corporal dos filhotes durante todo e após o processo usando uma pequena almofada de aquecimento. Sempre umedeça a superfície ocular com soro fisiológico e hypromellose em caso de falha da observação a seguir.
Em resumo, o modelo de mouse OIR é um modelo muito comum e amplamente utilizado de isquemia de retina e neovascularização patológica. Um dos principais problemas deste modelo é que os filhotes de camundongos neonatais são essencialmente saudáveis e não têm instabilidade metabólica ou problemas respiratórios quando comparados aos bebês prematuros. Outra diferença entre o modelo de camundongo OIR e os seres humanos é que sempre há proliferação fibrovascular na neovascularização da retina humana, enquanto o neovascular da retina não está associado à fibrose no modelo51 do mouse OIR. Para aproveitar melhor este modelo e adquirir mais informações, é fornecida uma descrição detalhada do uso da FFA para monitorar as mudanças dinâmicas da vasculatura de retina OIR, incluindo os métodos de tirar imagens de "cinco orientações" e processamento de imagem. Acredita-se que a AF se tornará um método eficaz parcial ou totalmente para substituir a mancha de imunofluorescência para observar e avaliar a morfologia e a função da vasculatura da retina49. Embora o modelo de rato OIR não se assemelhe totalmente ao microambiente e à patogênese de várias retinopatia isquêmica em humanos, ele nos dá a oportunidade de realizar experimentos medicamentosos e transgênicos, bem como explorar o mecanismo da angiogênese patológica na retina isquêmica51.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Agradecemos a todos os membros do nosso laboratório e laboratório de animais oftalmológicos do Centro Oftalmológico Zhongshan por sua assistência técnica. Agradecemos também ao Prof. Chunqiao Liu pelo apoio experimental. Este trabalho foi apoiado por subsídios da Fundação Nacional de Ciência Natural da China (NSFC: 81670872; Pequim, China), a Fundação de Ciência Natural da Província de Guangdong, China (Grant No.2019A1515011347), e projeto de construção hospitalar de alto nível do Laboratório Estadual de Oftalmologia do Centro Oftalmológico Zhongshan (Grant No. 303020103; Guangzhou, Província de Guangdong, China).
Materiais
| Name | Company | Catalog Number | Comments |
| 1 mL sterile syringe | Solarbio | YA0550 | For preparation of retinal flat mounts and intraperitoneal injection |
| 1× Phosphate buffered saline (PBS) | Transgen Biotech | FG701-01 | For preparation of retinal flat mounts |
| 2 ml Microcentrifuge Tube | Corning | MCT-200-C | For preparation of retinal flat mounts |
| 48 Well Clear TC-Treated Multiple Well Plates | Corning | 3548 | For preparation of retinal flat mounts |
| Adhesive microscope slides | Various | For preparation of retinal flat mounts | |
| Adobe Photoshop CC 2019 | Adobe Inc. | For image analysis | |
| Carbon dioxide gas | Various | For sacrifice | |
| Cover slide | Various | For preparation of retinal flat mounts | |
| Curved forceps | World Precision Instruments | 14127 | For preparation of retinal flat mounts |
| DAPI staining solution | Abcam | ab228549 | For labeling nucleus on retinal flat mounts |
| Dissecting microscope | Olmpus | SZ61 | For preparation of retinal flat mounts |
| Fluorescein sodium | Sigma-Aldrich | F6377 | For in vivo imaging |
| Fluorescent Microscope | Zeiss | AxioImager.Z2 | For acquisition of fluorescence images of retinal flat mounts |
| Fluoromount-G Mounting media | SouthernBiotech | 0100-01 | For preparation of retinal flat mounts |
| Hydroxypropyl Methylcellulose | Maya | 89161 | For in vivo imaging |
| Isolectin B4 594 antibody | Invitrogen | I21413 | For labeling retinal vasculature on retinal flat mounts |
| Mice C57/BL6J | GemPharmatech of Jiangsu Province | For OIR model induction | |
| Micro dissecting scissors-straight blade | World Precision Instruments | 503242 | For preparation of retinal flat mounts |
| No.4 straight forceps | World Precision Instruments | 501978-6 | For preparation of retinal flat mounts |
| Normal donkey serum | Abcam | ab7475 | For preparation of retinal flat mounts |
| O2 sensor | Various | For monitoring the level of O2 | |
| OxyCycler | Biospherix | A84XOV | For OIR model induction |
| Paraformaldehyde (PFA) | Sigma | P6148-1KG | For tissue fixation |
| Pentobarbital sodium | Various | For anesthesia | |
| Soda lime | Various | For absorbing excess CO2 in the oxygen chamber | |
| SPECTRALIS HRA+OCT | Heidelberg | HC00500002 | For in vivo imaging |
| SPSS Statistics 22.0 | IBM | For statistical analysis | |
| Tansference decloring shaker | Kylin-Bell | ZD-2008 | For preparation of retinal flat mounts |
| Tissue culture dish (Low attachment) | Corning | 3261-20EA | For preparation of retinal flat mounts |
| Transfer pipettes | Various | For preparation of retinal flat mounts | |
| Triton X-100 | Sigma-Aldrich | SLBW6818 | For preparation of retinal flat mounts |
| Tropicamide | Various | For in vivo imaging | |
| ZEN Imaging Software | ZEISS | For image acquisition and export |
Referências
- Vavvas, D. G., Miller, J. W. Chapter 26 - Basic Mechanisms of Pathological Retinal and Choroidal Angiogenesis. Retina (Fifth Edition). 1, 562-578 (2013).
- Selvam, S., Kumar, T., Fruttiger, M. Retinal vasculature development in health and disease. Progress in Retinal and Eye Research. 63, 1-19 (2018).
- Shimizu, K., Kobayashi, Y., Muraoka, K. Midperipheral fundus involvement in diabetic retinopathy. Ophthalmology. 88 (7), 601-612 (1981).
- Ashton, N. Retinal vascularization in health and disease: Proctor Award Lecture of the Association for Research in Ophthalmology. American Journal of Ophthalmology. 44 (4), 7-17 (1957).
- Hellström, A., Smith, L. E., Dammann, O. Retinopathy of prematurity. Lancet. 382 (9902), 1445-1457 (2013).
- Xu, Y., et al. Melatonin attenuated retinal neovascularization and neuroglial dysfunction by inhibition of HIF-1α-VEGF pathway in oxygen-induced retinopathy mice. Journal of Pineal Research. 64 (4), 12473 (2018).
- Cavallaro, G., et al. The pathophysiology of retinopathy of prematurity: an update of previous and recent knowledge. Acta Ophthalmologica. 92 (1), 2-20 (2014).
- Gilbert, C., Rahi, J., Eckstein, M., O'Sullivan, J., Foster, A. Retinopathy of prematurity in middle-income countries. Lancet. 350 (9070), 12-14 (1997).
- Chen, J., Smith, L. E. Retinopathy of prematurity. Angiogenesis. 10 (2), 133-140 (2007).
- Fielder, A., Blencowe, H., O'Connor, A., Gilbert, C. Impact of retinopathy of prematurity on ocular structures and visual functions. Archives of Disease in Childhood. Fetal and Neonatal Edition. 100 (2), 179-184 (2015).
- Moshfeghi, D. M. Presumed transient reactive astrocytic hyperplasia in immature retina. Retina. 26, 69-73 (2006).
- Kandasamy, Y., Hartley, L., Rudd, D., Smith, R. The association between systemic vascular endothelial growth factor and retinopathy of prematurity in premature infants: a systematic review. British Journal of Ophthalmology. 101 (1), 21-24 (2017).
- Shah, P. K., et al. Retinopathy of prematurity: Past, present and future. World Journal of Clinical Pediatrics. 5 (1), 35-46 (2016).
- Kinsey, V. E. Retrolental fibroplasia; cooperative study of retrolental fibroplasia and the use of oxygen. AMA Archives of Ophthalmology. 56 (4), 481-543 (1956).
- Tin, W., Gupta, S. Optimum oxygen therapy in preterm babies. Archives of Disease in Childhood. Fetal and Neonatal Edition. 92 (2), 143-147 (2007).
- Liu, C. H., Wang, Z., Sun, Y., Chen, J. Animal models of ocular angiogenesis: from development to pathologies. FASEB Journal : Official Publication of the Federation of American Societies for Experimental Biology. 31 (11), 4665-4681 (2017).
- Ashton, N., Ward, B., Serpell, G. Effect of oxygen on developing retinal vessels with particular reference to the problem of retrolental fibroplasia. The British Journal of Ophthalmology. 38 (7), 397-432 (1954).
- Penn, J. S., Tolman, B. L., Lowery, L. A. Variable oxygen exposure causes preretinal neovascularization in the newborn rat. Investigative Ophthalmology & Visual Science. 34 (3), 576-585 (1993).
- Smith, L. E., et al. Oxygen-induced retinopathy in the mouse. Investigative Ophthalmology & Visual Science. 35 (1), 101-111 (1994).
- McLeod, D. S., Brownstein, R., Lutty, G. A. Vaso-obliteration in the canine model of oxygen-induced retinopathy. Investigative Ophthalmology & Visual Science. 37 (2), 300-311 (1996).
- Cao, R., Jensen, L. D., Söll, I., Hauptmann, G., Cao, Y. Hypoxia-induced retinal angiogenesis in zebrafish as a model to study retinopathy. PLoS One. 3 (7), 2748 (2008).
- Connor, K. M., et al. Quantification of oxygen-induced retinopathy in the mouse: a model of vessel loss, vessel regrowth and pathological angiogenesis. Nature Protocols. 4 (11), 1565-1573 (2009).
- Fruttiger, M. Development of the mouse retinal vasculature: angiogenesis versus vasculogenesis. Investigative Ophthalmology & Visual Science. 43 (2), 522-527 (2002).
- Stahl, A., et al. The mouse retina as an angiogenesis model. Investigative Ophthalmology & Visual Science. 51 (6), 2813-2826 (2010).
- Rivera, J. C., et al. Ischemic retinopathies: oxidative stress and inflammation. Oxidative Medicine and Cellular Longevity. 2017, 3940241 (2017).
- Bashinsky, A. L. Retinopathy of prematurity. North Carolina Medical Journal. 78 (2), 124-128 (2017).
- Flynn, J. T., et al. Retinopathy of prematurity. Diagnosis, severity, and natural history. Ophthalmology. 94 (6), 620-629 (1987).
- Aguilar, E., et al. Chapter 6. Ocular models of angiogenesis. Methods in Enzymology. 444, 115-158 (2008).
- Liegl, R., Priglinger, C., Ohlmann, A. Induction and readout of oxygen-induced retinopathy. Methods in Molecular Biology. 1834, 179-191 (2019).
- Lutty, G. A., McLeod, D. S. Retinal vascular development and oxygen-induced retinopathy: a role for adenosine. Progress in Retinal and Eye Research. 22 (1), 95-111 (2003).
- Vähätupa, M., et al. Oxygen-induced retinopathy model for ischemic retinal diseases in rodents. Journal of Visualized Experiments: JoVE. (163), (2020).
- Kim, C. B., D'Amore, P. A., Connor, K. M. Revisiting the mouse model of oxygen-induced retinopathy. Eye and Brain. 8, 67-79 (2016).
- Gammons, M. V., Bates, D. O. Models of oxygen induced retinopathy in rodents. Methods in Molecular Biology. 1430, 317-332 (2016).
- Xiao, S., et al. Fully automated, deep learning segmentation of oxygen-induced retinopathy images. Journal of Clinical Investigation Insight. 2 (24), (2017).
- McLeod, D. S., D'Anna, S. A., Lutty, G. A. Clinical and histopathologic features of canine oxygen-induced proliferative retinopathy. Investigative Ophthalmology & Visual Science. 39 (10), 1918-1932 (1998).
- Penn, J. S., Johnson, B. D. Fluorescein angiography as a means of assessing retinal vascular pathology in oxygen-exposed newborn rats. Current Eye Research. 12 (6), 561-570 (1993).
- Mezu-Ndubuisi, O. J., et al. In vivo retinal vascular oxygen tension imaging and fluorescein angiography in the mouse model of oxygen-induced retinopathy. Investigative Ophthalmology & Visual Science. 54 (10), 6968-6972 (2013).
- Zeilbeck, L. F., Müller, B., Knobloch, V., Tamm, E. R., Ohlmann, A. Differential angiogenic properties of lithium chloride in vitro and in vivo. PLoS One. 9 (4), 95546 (2014).
- Walsh, N., Bravo-Nuevo, A., Geller, S., Stone, J. Resistance of photoreceptors in the C57BL/6-c2J, C57BL/6J, and BALB/cJ mouse strains to oxygen stress: evidence of an oxygen phenotype. Current Eye Research. 29 (6), 441-447 (2004).
- Zhang, Q., Zhang, Z. M. Oxygen-induced retinopathy in mice with retinal photoreceptor cell degeneration. Life Sciences. 102 (1), 28-35 (2014).
- Okamoto, N., et al. Transgenic mice with increased expression of vascular endothelial growth factor in the retina: a new model of intraretinal and subretinal neovascularization. The American Journal of Pathology. 151 (1), 281-291 (1997).
- Ohlmann, A., et al. Norrin promotes vascular regrowth after oxygen-induced retinal vessel loss and suppresses retinopathy in mice. The Journal of Neuroscience. 30 (1), 183-193 (2010).
- Fang, L., Barber, A. J., Shenberger, J. S. Regulation of fibroblast growth factor 2 expression in oxygen-induced retinopathy. Investigative Ophthalmology & Visual Science. 56 (1), 207-215 (2014).
- Chan, C. K., et al. Differential expression of pro- and antiangiogenic factors in mouse strain-dependent hypoxia-induced retinal neovascularization. Laboratory Investigation. 85 (6), 721-733 (2005).
- Stahl, A., et al. Postnatal weight gain modifies severity and functional outcome of oxygen-induced proliferative retinopathy. The American Journal of Pathology. 177 (6), 2715-2723 (2010).
- Vanhaesebrouck, S., et al. Association between retinal neovascularization and serial weight measurements in murine and human newborns. European Journal of Ophthalmology. 23 (5), 678-682 (2013).
- Gerschman, R., Nadig, P. W., Snell, A. C., Nye, S. W. Effect of high oxygen concentrations on eyes of newborn mice. The American Journal of Physiology. 179 (1), 115-118 (1954).
- Lange, C., et al. Kinetics of retinal vaso-obliteration and neovascularisation in the oxygen-induced retinopathy (OIR) mouse model. Graefe's Archive for Clinical and Experimental Ophthalmology. 247 (9), 1205-1211 (2009).
- Huang, S., et al. Comparison of dextran perfusion and GSI-B4 isolectin staining in a mouse model of oxygen-induced retinopathy. Eye Science. 30 (2), 70-74 (2015).
- Paques, M., et al. Panretinal, high-resolution color photography of the mouse fundus. Investigative Ophthalmology & Visual Science. 48 (6), 2769-2774 (2007).
- Fletcher, E. L., et al. Animal models of retinal disease. Progress in Molecular Biology and Translational Science. 100, 211-286 (2011).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados