Method Article
Мониторинг динамического роста сосудов сетчатки в мышиной модели инсулин-индуцированной ретинопатии
В этой статье
Резюме
Этот протокол описывает подробный метод приготовления и иммунофлуоресцентного окрашивания мышей с плоскими креплениями и анализа. Также подробно описано использование флуоресцеиновой ангиографии глазного дна (FFA) для детенышей мышей и обработка изображений.
Аннотация
Кислород-индуцированная ретинопатия (OIR) широко используется для изучения аномального роста сосудов при ишемических заболеваниях сетчатки, включая ретинопатию недоношенных (РН), пролиферативную диабетическую ретинопатию (PDR) и окклюзию вен сетчатки (RVO). В большинстве исследований OIR наблюдается неоваскуляризация сетчатки в определенные моменты времени; однако динамический рост сосудов у живых мышей в течение определенного времени, который необходим для понимания заболеваний сосудов, связанных с OIR, был недостаточно изучен. Здесь мы описываем пошаговый протокол для индукции мышиной модели OIR, выделяя потенциальные подводные камни и предоставляя улучшенный метод для быстрой количественной оценки областей вазооблитерации (VO) и неоваскуляризации (NV) с использованием иммунофлуоресцентного окрашивания. Что еще более важно, мы контролировали возобновление роста сосудов у живых мышей от P15 до P25, выполняя флуоресцеиновую ангиографию глазного дна (FFA) в мышиной модели OIR. Применение FFA к мышиной модели OIR позволяет наблюдать процесс ремоделирования во время роста сосудов.
Введение
Неоваскуляризация сетчатки (РНВ), которая определяется как состояние, при котором новые патологические сосуды возникают из существующих вен сетчатки, обычно простирается вдоль внутренней поверхности сетчатки и прорастает в стекловидное тело (или субретинальное пространство при некоторых условиях)1. Это отличительная черта и общая черта многих ишемических ретинопатий, включая ретинопатию недоношенных (РН), окклюзию вен сетчатки (RVO) и пролиферативную диабетическую ретинопатию (PDR)2.
Многочисленные клинические и экспериментальные наблюдения показали, что ишемия является основной причиной неоваскуляризации сетчатки 3,4. При РН новорожденные подвергаются воздействию кислорода высокого уровня в закрытых инкубаторах для повышения выживаемости, что также является важным фактором для остановки роста сосудов. После того, как лечение сделано, сетчатка новорожденных испытывает относительно гипоксический период5. Другие ситуации наблюдаются при окклюзии центральных или ветвистых вен сетчатки в RVO, а также наблюдается повреждение капилляров сетчатки, которое вызвано микроангиопатией в PDR2. Гипоксия дополнительно увеличивает экспрессию ангиогенных факторов, таких как фактор роста эндотелия сосудов (VEGF) через сигнальный путь, вызванный гипоксией фактор-1α (HIF-1α), который, в свою очередь, направляет эндотелиальные клетки сосудов для роста в гипоксическую область и образования новых сосудов 6,7.
РН является разновидностью сосудистой пролиферативной ретинопатии у недоношенных детей и ведущей причиной детской слепоты 8,9, для которой характерны гипоксия сетчатки, неоваскуляризация сетчатки и фиброзная гиперплазия 10,11,12. В 1950-х годах исследователи обнаружили, что высокая концентрация кислорода может значительно улучшить респираторные симптомы недоношенных детей13,14. В результате кислородная терапия все чаще применялась у недоношенных детей в то время15 лет. Однако, одновременно с широким использованием кислородной терапии у недоношенных детей, заболеваемость РН увеличивалась с каждым годом. С тех пор исследователи связали кислород с РН, изучая различные животные модели, чтобы понять патогенез РН и РНВ16.
У человека большая часть развития сосудистой системы сетчатки завершается до рождения, в то время как у грызунов сосудистая система сетчатки развивается после рождения, обеспечивая доступную модельную систему для изучения ангиогенеза в сосудистой системе сетчатки2. С непрерывным прогрессом исследований модели кислород-индуцированной ретинопатии (OIR) стали основными моделями для имитации патологического ангиогенеза в результате ишемии. В исследовании модели OIR нет конкретных видов животных, и модель была разработана для различных видов животных, включая котенка17, крысу18, мышь19, щенка бигля20 и рыбку данио21. Все модели имеют один и тот же механизм, с помощью которого они подвергаются гипероксии во время раннего развития сетчатки, а затем возвращаются в нормоксическую среду. Смит и др. отметили, что подвергание детенышей мышей гипероксии от Р7 в течение 5 дней индуцировало крайнюю форму регрессии сосудов в центральной сетчатке и возвращение их в комнатный воздух при Р12 постепенно вызывало неоваскулярные пучки, которые росли к стекловидному телу19. Это была стандартизированная модель мыши OIR, также называемая моделью Смита. Connor et al. дополнительно оптимизировали протокол и предоставили универсально применимый метод количественной оценки области VO (vaso-obliteration) и NV (неоваскуляризация) в 2009 году, что увеличило принятие и использование модели22. Модель мыши OIR по-прежнему является наиболее широко используемой моделью в настоящее время из-за ее небольшого размера, быстрого размножения, четкого генетического фона, хорошей повторяемости и высокого уровня успеха.
У мышей васкуляризация сетчатки начинается после рождения с врастанием сосудов от головки зрительного нерва во внутреннюю сетчатку к ora serrata. Во время нормального развития сетчатки первые сосуды сетчатки прорастают из головки зрительного нерва вокруг рождения, образуя расширяющуюся сеть (первичное сплетение), которая достигает периферии вокруг постнатального дня 7 (P7) 23. Затем сосуды начинают расти в сетчатку, образуя глубокий слой, проникая в сетчатку и создавая ламинарную сеть вокруг внутреннего ядерного слоя (INL), как у человека24. К концу третьей постнатальной недели (Р21) развитие более глубокого сплетения почти завершено. Для мышиной модели OIR сосудистая окклюзия всегда появляется в центральной сетчатке из-за быстрой дегенерации большого количества незрелых сосудистых сетей в центральной области во время воздействия гипероксии. Так, рост патологической неоваскуляризации происходит и в средне периферической сетчатке, которая является границей неперфузионной области и сосудистой области. Однако сосуды сетчатки человека почти сформировались еще до рождения. Что касается недоношенных детей, то периферическая сетчатка не полностью васкуляризуется при воздействии гипероксии25,26. Так окклюзия сосудов и неоваскуляризация в основном появляются в периферической сетчатке27,28. Несмотря на эти различия, мышиная модель OIR точно повторяет патологические события, которые происходят во время неоваскуляризации, вызванной ишемией.
Индукцию модели OIR можно разделить на две фазы29: в фазе 1 (фаза гипероксии) развитие сосудов сетчатки останавливается или замедляется при окклюзии и регрессии кровеносных сосудов в результате снижения VEGF и апоптоза эндотелиальных клеток 24,30; в фазе 2 (фаза гипоксии) снабжение сетчатки кислородом станет недостаточным в условиях воздуха в помещении29, что необходимо для развития нервной системы и гомеостаза 19,31. Эта ишемическая ситуация обычно приводит к нерегулируемой, аномальной неоваскуляризации.
В настоящее время широко используемым методом моделирования является чередование высокого / низкого воздействия кислорода: матери и их детеныши подвергаются воздействию 75% кислорода в течение 5 дней при P7, а затем 5 дней в комнатном воздухе, пока P17 не продемонстрирует сопоставимые результаты22, что является конечной точкой индукции мышиной модели OIR. (Рисунок 1). В дополнение к моделированию РН, эта опосредованная ишемией патологическая неоваскуляризация также может быть использована для изучения других ишемических заболеваний сетчатки. Основные измерения этой модели включают количественную оценку площади VO и NV, которые анализируются из плоских креплений сетчатки путем иммунофлуоресцентного окрашивания или перфузии FITC-декстрана. Каждую мышь можно изучить только один раз из-за смертельной операции. В настоящее время существует мало методов наблюдения динамических изменений сосудистой системы сетчатки непрерывно в процессе сосудистой регрессии и патологического ангиогенеза32. В этой статье мы предоставляем подробный протокол индукции модели OIR, анализ плоских креплений сетчатки, а также рабочий процесс флуоресцеиновой ангиографии глазного дна (FFA) на мышах, что было бы полезно для получения более полного понимания сосудистых динамических изменений в течение двух фаз мышиной модели OIR.
протокол
Все процедуры, связанные с использованием мышей, были одобрены комитетом по экспериментальной этике животных Офтальмологического центра Чжуншань Университета Сунь Ятсена, Китай (авторизованный номер: 2020-082), и в соответствии с утвержденными руководящими принципами Комитета по уходу и использованию животных Офтальмологического центра Чжуншань и Заявлением Ассоциации исследований в области зрения и офтальмологии (ARVO) для использования животных в офтальмологических и визуальных исследованиях.
1. Индукция мышиной модели OIR
- Используйте мышей с более низкой частотой врожденных пороков развития глаз, например, мышей C57BL/6J, и спаривайте их в соотношении самец/самка = 1:2. Получите детенышей, родившихся в тот же день, и начните индуцировать модель OIR на P7. Записывайте массу тела детенышей мышей строго перед моделированием.
ПРИМЕЧАНИЕ: Обратите внимание на день рождения как P0. Регулярно записывайте вес каждой мыши. Масса тела новорожденных детенышей очень важна во время индукции ОИР, так как чувствительность мышей в разных состояниях к кислороду различна. Исключите детенышей более 5 г при Р7 для обеспечения сопоставимых результатов. - Обеспечить подходящую среду обитания для кормящих матерей и их детенышей, например, установить температуру на уровне 23 ° C ± 2 ° C, контролировать влажность на уровне 40-65%, чередовать 12 ч света и 12 ч темноты каждый день, добавлять немного ваты в клетку для гнездования, обеспечивать достаточное количество стерилизованной пищи и воды и содержать их в индивидуально вентилируемых клетках (IVC).
- Контролируйте уровень влажности и температуры внутри камеры. Контролируйте влажность от 40% до 65% и поддерживайте температуру на уровне 23 °C ± 2 °C.
- Проверяйте подачу кислорода с помощью датчиков кислорода, поддерживайте постоянный уровень кислорода на уровне 75% и контролируйте расход кислорода на уровне 0,5-0,75 л/мин. Поместите 50 г натриевой извести в нижнюю часть камеры, чтобы поглотить избыточный CO2 и поддерживать значения CO2 ниже 3%22.
- Следите за поведением кормящих матерей, таким как построение гнезда, укусы их детенышей и отказ от лактации, по крайней мере, один раз в день. Ликвидировать кормящих матерей с плохим материнством.
- Поместите детенышей P7 (самцов и самок) и их кормящих матерей в кислородную камеру, в которой уровень кислорода составляет 75% в течение 5 дней до P12. Избегайте ненужного открытия камеры в период индукции модели. Убедитесь, что есть дополнительные суррогатные матери для замены, в случае, если кормящие матери умирают из-за травмы легких во время гипероксии.
ПРИМЕЧАНИЕ: Чтобы обеспечить сопоставимость эксперимента, ограничьте количество до 6-8 детенышей на каждую мать. Обратите внимание на потенциальную проблему кислородной токсичности, которая становится причиной смерти некоторых кормящих матерей. Признаки гипероксического повреждения легких у кормящих матерей включают, но не ограничиваются ими, колебания частоты дыхания, снижение активности и снижение кормления. При возникновении вышеперечисленного явления как можно скорее усыпьте кормящую мать 1% пентобарбиталом натрия (50 мг/кг). Подготовьте некоторых суррогатных матерей, например, 129S1/SvImJ для замены и используйте их только при необходимости. Не рекомендуется заменять кормящих матерей в качестве рутины, так как это приведет к частому открытию кислородной камеры, что приведет к нестабильному уровню кислорода и материнской агрессии. - Верните щенков и их кормящих матерей в комнату на воздух при P12 и следите за весом всех щенков непрерывно до P17. Группируйте детенышей на основе веса, чтобы убедиться, что каждая экспериментальная группа имеет одинаковое распределение веса.
2. Подготовка цельных креплений сетчатки и иммунофлуоресцентное окрашивание
- Запишите массу тела щенков. Приносят в жертву щенков передозировкой анестетика (1% пентобарбитала натрия 50 мг/кг) или ингаляциейСО2 . При необходимости могут использоваться и другие методы эвтаназии, такие как вывих шейки матки и двусторонняя торакотомия.
- Используйте изогнутые ножницы, чтобы освободить связь между глазными яблоками и орбитальной тканью. Затем поместите изогнутые щипцы в заднюю часть глазного яблока, зажмите зрительный нерв и быстро выведите глаз с орбиты. Промыть глазные яблоки в предварительно охлажденном 1x фосфатном буферном физиологическом растворе (PBS), чтобы удалить волосы и кровь с поверхности глазных яблок.
- Поместите очищенные глазные яблоки в микроцентрифужную трубку объемом 2 мл, заполненную 4% параформальдегидом (PFA), и инкубируйте в течение 15 мин при комнатной температуре на шейкере со скоростью 12-15 оборотов в минуту (об/мин) (начальная фиксация).
ВНИМАНИЕ: Параформальдегид, как известно, аллергенный, в целом токсичный и чрезвычайно цитотоксичный. Строго следуйте инструкциям по технике безопасности и избегайте вдыхания и контакта с кожей. - Используйте чашку для культивирования и поместите каплю 1x PBS в центральную часть и выполните следующие шаги под рассекающим микроскопом и поместите одно глазное яблоко в эту каплю. Зажмите глазное яблоко парой щипцов и осторожно проколите роговицу в лимбе роговицы с помощью иглы шприца объемом 1 мл. Вставьте кончик ножниц в это отверстие и аккуратно отрежьте роговицу вдоль лимбуса роговицы. Будьте осторожны, чтобы не разрезать сетчатку.
- Снимите радужную оболочку и линзу парой щипцов. Затем поместите оставшийся наглазник в 4% PFA и снова зафиксируйте еще на 45 мин при комнатной температуре на шейкере со скоростью 12-15 об/мин (вторичная фиксация).
- Используйте чашку для культуры и положите каплю 1x PBS в центральную часть. Поместите неподвижное глазное яблоко в эту каплю. Подержите глазное яблоко парой щипцов. Аккуратно разделите слои сетчатки и склеры с помощью двух щипцов. Поместите кончик ножниц между слоями сетчатки и склеры и разрезайте склеру по направлению к зрительному нерву. Очистите склеру от сетчатки и получите чашечку сетчатки.
ПРИМЕЧАНИЕ: Держите заднюю чашечку за зрительный нерв щипцами, затем используйте изогнутый конец других щипцов, чтобы надавить на склеру в головке зрительного нерва и мягко вмассировать сетчатку вперед в качестве альтернативы высвобождению сетчатки. - Используйте щипцы, чтобы освободить связь между радиальными гиалоидными сосудами и периферической сетчаткой, зажмите корень гиалоидных сосудов, который находится близко к головке зрительного нерва, и осторожно отрежьте гиалоидные сосуды.
- Используйте пипетку объемом 2 мл с отрезанным наконечником, чтобы перенести чашку сетчатки. Поместите чашку сетчатки в одну лунку в 48-луночную пластину и промойте ее в течение 3 х 5 мин с 1x PBS при комнатной температуре на шейкере со скоростью 12-15 об/мин.
- Инкубировать чашку сетчатки в смешанном растворе 1% Тритона X-100 (в PBS) и 5% обычной ослиной сыворотки (в PBS) в течение ночи при 4 °C.
- Альтернативно, блокируют и пермеабилизируют сетчатку при комнатной температуре в течение 1 ч в качестве альтернативы. Изменение блокирующей сыворотки в зависимости от источника вторичного антитела.
- При маркировке сосудистой системы сетчатки с использованием изолектина В4 инкубируют сетчатку в лунке из 48-луночной пластины с 0,1% нормальной ослиной сывороткой (400 мкл) и изолектиномB4-594 (1:400) в течение ночи при 4 °C на шейкере со скоростью 12-15 об/мин.
ПРИМЕЧАНИЕ: При маркировке кровеносных сосудов другими маркерами, такими как CD31, или маркировке других клеток, используйте специфические первичные антитела для их маркировки. - Инкубировать сетчатку с 1:100-1:500 специфическими первичными антителами (в 400 мкл 0,1% нормальной ослиной сыворотки) при 4 °C на шейкере со скоростью 12-15 об/мин в течение 48 ч. (опционально)
- После возвращения к комнатной температуре промыть сетчатку 0,1% PBST (0,1% TritonX-100 в PBS) в течение 3 х 20 мин на шейкере со скоростью 12-15 об/мин.
- Инкубируют сетчатку с 1:1000 вторичными антителами (в 400 мкл 0,1% нормальной ослиной сыворотки) в течение ночи при 4 °C на шейкере со скоростью 12-15 об/мин. (необязательно)
- Альтернативно инкубируют сетчатку с высокоаффинными вторичными антителами при комнатной температуре в течение 1 ч.
- Инкубируют сетчатку с DAPI (1:1000) при комнатной температуре в течение 20-25 мин, чтобы пометить ядро.
ПРИМЕЧАНИЕ: Проверьте оптимальные соотношения разведения для всех антител, используемых на этапах 10-11 и 13-14 в предварительном эксперименте. - Промывайте сетчатку в течение 3 x 30 мин с 0,1% PBST на шейкере со скоростью 12-15 об/мин при комнатной температуре.
- Перенесите чашку сетчатки на чистую горку с отверстием, обращенным вверх. Отрежьте сетчатку радиально в положении 3, 6, 9 и 12 часов от периферического до центрального, отрезав примерно 1-1,5 мм от головки зрительного нерва.
- Добавьте несколько капель 1x PBS, чтобы промыть сетчатку три раза. Используйте бумагу, уложенную воздухом, чтобы высушить и сплющить сетчатку. Добавьте каплю монтажной среды (см. Таблицу материалов) в центр крышки и прекратите добавлять ее до тех пор, пока диаметр капли не увеличится до половины крышки. Быстро переверните крышку и поместите ее поверх распростертой сетчатки. Избегайте образования пузырьков.
- Сделайте снимки плоских креплений сетчатки или храните и защитите слайды от света при 4 °C.
3. Анализ и количественная оценка плоских креплений сетчатки
ПРИМЕЧАНИЕ: Для мышиной модели OIR исследователи часто регистрируют область центральной окклюзии сосудов сетчатки и патологической неоваскуляризации периферической сетчатки во время P12-P25. Предыдущие исследования показали, что центральная аваскулярная область сетчатки достигает максимума при Р12 и постепенно сжимается с Р13 до Р17; в то же время сетчатка мышей OIR достигает пика области неоваскуляризации на отметке P1722,29. От Р17 неососуды постепенно регрессируют и функциональные сосуды отрастают в аваскулярную область. Сосудистая система сетчатки в основном возвращается к норме при P2533.
- Делайте снимки плоских креплений сетчатки с помощью флуоресцентного микроскопа (см. Таблицу материалов) с объективом 10x. Сначала выберите канал DAPI и установите головку зрительного нерва в центр поля зрения. Затем скорректируйте другие каналы и сосредоточьтесь на поверхностной сосудистой системе сетчатки. Проверьте плитки в программном обеспечении для работы с фотографиями (см. Таблица материалов) и установите количество фотографий, которые необходимо сшить. Нажмите «Начать эксперимент», чтобы захватить всю сетчатку.
- Используйте программу обработки изображений (см. Таблицу материалов) для количественной оценки области вазооблитерации (VO) и неоваскуляризации (NV) после иммунофлуоресцентного окрашивания.
- Сначала нажмите на инструмент Magic Wand Tool и установите соответствующий допуск в соответствии с разницей в яркости, переместите курсор на фон и щелкните мышью. Затем выберите Select Inverse , чтобы получить базовый контур сетчатки. Используйте инструмент «Лассо» для дальнейшего описания деталей сетчатки. С помощью функции Histogram запишите значение пикселя всей сетчатки и запишите его или сгенерируйте таблицу в программе базы данных.
- Разделите изображение сетчатки на четыре квадранта. В каждом квадранте используйте инструмент «Лассо» для рисования области VO (рисунок 2A-C) и инструмент «Волшебная палочка» для выбора области NV (рисунок 2D-F). Через пиксельную информацию в гистограмме рассчитайте отношение пикселей VO и NV ко всей сетчатке, то есть процент площади VO или NV относительно всей сетчатки.
ПРИМЕЧАНИЕ: Существует также полностью автоматизированный конвейер с открытым исходным кодом для количественной оценки областей VO и NV в изображениях OIR с использованием нейронных сетей глубокого обучения (http://oirseg.org/), который обеспечивает надежный и экономящий время способ для исследователей, а также унифицирует стандарт количественной оценки34.
- Записывайте пиксельную информацию в таблицу электронной таблицы, что удобно для последующего анализа.
4. Визуализация in vivo с флуоресцеиновой ангиографией глазного дна (FFA)
ПРИМЕЧАНИЕ: Для мышей OIR как перфузия FITC, так и иммунофлуоресцентное окрашивание могут использоваться только один раз из-за смерти экспериментальных животных. По сравнению с этим одним из преимуществ ФФА является наблюдение динамических изменений сосудов сетчатки мыши в процессе развития и патологического состояния in vivo35,36.
- Взвесьте щенков перед анестезией.
- Обезболивают детенышей внутрибрюшинной инъекцией 0,3% пентобарбитала натрия в дозе 30-50 мг/кг.
ПРИМЕЧАНИЕ: Для мышей в течение 1 месяца обратите внимание на дозы анестетика. Используйте более низкие концентрации и дозы анестетика, чтобы уменьшить гибель мышей, вызванную анестезией. После того, как щенки будут обезболены, используйте небольшую грелку для поддержания температуры тела. Переохлаждение не только влияет на физиологическую функцию детенышей, но и приводит к изменениям кристаллина и ускоряет развитие катаракты. - Используйте 20 мкл мидриатических глазных капель (0,5% тропикамида + 0,5% фенилэфрина гидрохлорида) для каждого щенка и подождите 5 минут, чтобы достичь длительного расширения зрачка (рисунок 3A, B).
- Поднесите обезболенных щенков перед устройством визуализации (см. Таблицу материалов). Держите щенков на небольшой грелке, поместите щенков в стабильное положение и регулярно используйте искусственные слезы для поддержания влаги в роговице. Нажмите на режим инфракрасной визуализации глазного дна (IR), чтобы настроить головку зрительного нерва к центру экрана.
ПРИМЕЧАНИЕ: Наблюдая за одним глазом щенков, не забывайте защищать другой глаз. Используйте глазные капли Гипромеллоза, чтобы предотвратить отбеливание роговицы из-за сухости. - После внутрибрюшинной инъекции 0,15 мл 0,5% флуоресцеина раствора натриевой соли нажмите на кнопку FA и кнопку Injection непосредственно на сенсорной панели устройства визуализации, чтобы запустить синхронизацию. Записывают снимки через 3 мин, когда кровообращение сетчатки переходит в венозную фазу и наблюдают за сетчаткой не менее 6-8 мин.
ПРИМЕЧАНИЕ: После внутрибрюшинного введения раствора флуоресцеиновой натриевой соли кожа, слизистая оболочка и моча детенышей показывают явный желтовато-зеленый цвет. Большая часть флуоресцеина выводится детенышами в течение дня. Введение флуоресцеина натрия внутрибрюшинно через день в течение шести раз не вызывает значительных побочных эффектов37. - Переместите головку зрительного нерва к центру области получения изображения и сделайте первое изображение центральной сетчатки. Затем переместите линзу устройства визуализации горизонтально к носовой стороне глаза, пока головка зрительного нерва не будет расположена в средней точке одной стороны области получения изображения, и сделайте второе изображение. Продолжают делать снимки височной, верхней и нижней сетчатки соответственно с помощью этого метода (рисунок 3С).
ПРИМЕЧАНИЕ: Делайте изображения «пятиориентации» в течение 12 минут по мере наступления фазы регрессии. Положение головки зрительного нерва на нижнем изображении позволяет не падать на боковую линию из-за ограниченной регулировки угла хрусталика. - Сохраните изображения и используйте программу обработки изображений для сшивания.
5. Обработка изображений флуоресцеиновой ангиографии глазного дна (FFA)
- Откройте программу обработки изображений и нажмите «Создать в файле », чтобы создать новый холст с черным фоном (рисунок 4A).
- Откройте изображение центральной сетчатки сначала в фоновом слое. Нажмите «Файл» и добавьте второе изображение. Отрегулируйте непрозрачность второго изображения до 60%, переместите и измените размер второго изображения до тех пор, пока одни и те же части двух изображений не будут сильно перекрываться. Нажмите кнопку «Переключиться между режимами свободного преобразования» и «Деформация» и при необходимости внесите тонкие коррективы в сосуды. Затем верните непрозрачность второго изображения к 100% (рисунок 4A,B).
- Выберите два изображения одновременно и нажмите « Автоматическое наложение слоев». Проверьте Panorama как метод наложения, а также выберите следующие два предложения. Нажмите OK и завершите сшивание изображения первых двух изображений (рисунок 4C, D).
- Возьмите первые два сшитых изображения целиком, добавьте третье изображение и продолжайте смешивать. Повторите приведенные выше методы, чтобы завершить сшивание пяти изображений (рисунок 4E).
- Используйте инструмент «Кадрирование» для вырезания изображений FFA в разных точках времени до одинакового размера и наблюдения за динамическими изменениями сосудистой системы сетчатки от P15 до P25 как у нормальных, так и у OIR детенышей.
6. Статистический анализ
- Приведенное значение как среднее ± стандартное отклонение (s.d.).
- Используйте t-тест Student для сравнения двух независимых образцов. Используйте одностороннюю ANOVA для сравнения нескольких наборов данных и объедините с тестом Даннетта или Туки, который является обычно используемым множественным сравнительным тестом.
- Для ненормально распределенных данных используйте тест Манна-Уитни U или тест Крускала Уоллиса. Рассмотрим значимые статистические различия при P < 0,05.
Результаты
В мышиной модели OIR наиболее важным и базовым результатом является количественная оценка области VO и NV. После проживания в среде гипероксии в течение 5 дней от Р7 центральная сетчатка детенышей показала наибольшую неперфузионную площадь. При стимуляции гипоксии еще через 5 дней постепенно производилась неоваскуляризация сетчатки, которая флуоресцировала более интенсивно, чем окружающие нормальные сосуды. После Р17 флуоресцентный сигнал патологической неоваскуляризации быстро регрессировал по мере ремоделирования сетчатки (рисунок 5А). Контролируя размер помета и постнатальное увеличение веса детенышей, область VO и NV мышиной модели OIR показала хорошую повторяемость и стабильность, а пик неоваскуляризации сетчатки пришелся на P17, что соответствовало предыдущим исследованиям (рисунок 5B, C).
FFA является идеальным инструментом для изучения сосудистой системы сетчатки. Учитывая применение FFA in vivo, он показывает значительное сокращение отходов экспериментальных животных, а также отображает динамические изменения сосудов сетчатки со временем. В предыдущих исследованиях FFA не часто использовался у детенышей мышей и был представлен в виде одного вида, что было трудно для дальнейшего изучения. В этом протоколе «пятиориентные» изображения сосудистой системы сетчатки были сшиты вместе с использованием программного обеспечения для обработки изображений для отображения более широкого поля сетчатки за один раз, что было полезно для последующего анализа, если это необходимо (рисунок 4). Кроме того, детеныши мышей OIR показали длительное открытие глаз, поэтому изображения FFA были взяты из P15, чтобы соответствовать требованиям этики животных. В сетчатке мышиной модели OIR диаметр кровеносных сосудов, очевидно, увеличился и стал очень извилистым по сравнению с нормальными мышами. Кроме того, FFA показала аналогичную тенденцию динамических изменений сосудистой системы сетчатки при иммунофлуоресцентном окрашивании изолектином B4-594 из P15-P25 без гибели детенышей (рисунок 6).
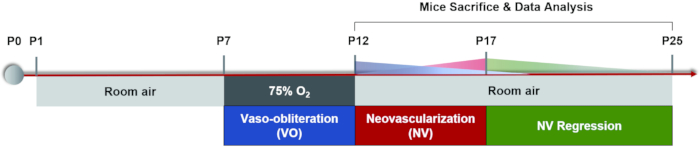
Рисунок 1: Мультяшная схема модели мыши OIR. Мышиная модель OIR была вызвана содержанием щенков и их кормящих матерей в комнате в течение некоторого времени (P0-P7). При Р7 оба они подвергались воздействию 75% кислорода в течение 5 дней, что ингибировало рост сосудов сетчатки и вызывало значительную потерю сосудов в центральной сетчатке. Затем мышей вернули в комнатный воздух при P12, и аваскулярная сетчатка начала становиться относительно гипоксической, вызывая как нормальный рост сосудов, так и патологический ответ вокруг средней периферической сетчатки. Максимальная неоваскуляризация (NV) наблюдалась при P17. Затем патологическая неоваскуляризация подверглась процессу спонтанной регрессии. Сосудистая система сетчатки снова пришла в норму примерно на уровне P25. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: Измерение облитерации сосудов (VO) и неоваскуляризации (NV) в сетчатке мыши. (A) Изображение 10x P12 OIR цельного крепления сетчатки, окрашенного для эндотелиальных клеток изолектином B4-594. (B) Снимок экрана сетчатки с выбранной аваскулярной областью. Инструменты, необходимые для этого измерения, выделены белыми стрелками: Magic Wand Tool и Lasso Tool. (C) Выделите аваскулярную область сетчатки и сохраните изображение в виде копии. (D) Изображение 10x P17 OIR retinal whole-mount окрашено для эндотелиальных клеток изолектином B4-594. (E) Снимок экрана сетчатки с выбранными неоваскулярными пучками. Используйте инструмент «Волшебная палочка» и установите оптимальный допуск для выделения NV. Установите допуск равным 3–5 и установите флажки сглаживание и смежные блоки. (F) Сохранить область неоваскуляризации только как копию. Шкалы представляют 1000 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
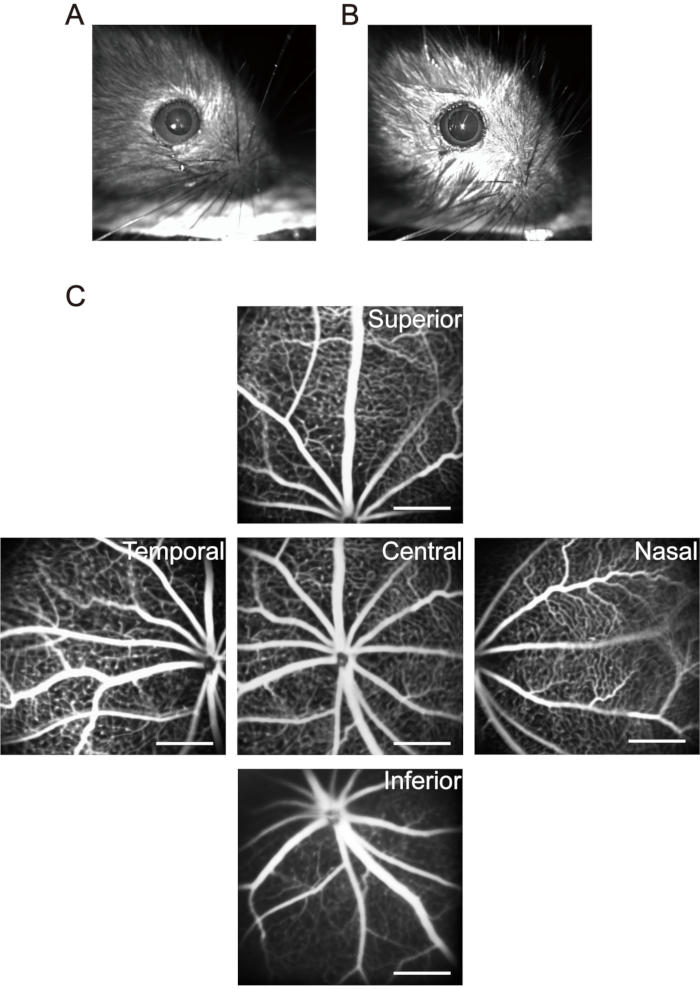
Рисунок 3: Получение «пятиориентационных» изображений в сетчатке мыши. (A) Нормальный зрачок мыши. (B) Мышиный зрачок при мидриазе. (C) Были собраны «пятиориентные» изображения центральной, носовой, височной, верхней и нижней области сетчатки соответственно (P17 щенков в комнатном воздухе). Шкалы представляют 500 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 4: Общий рабочий процесс сшивания «пятиориентных» изображений из флуоресцеиновой ангиографии глазного дна (FFA). (A) Создайте новое полотно с черным фоном и откройте FFA изображение центральной сетчатки. (B) Открыть FFA-изображение височной сетчатки и отрегулировать непрозрачность второго изображения до 60%; перемещать и изменять размер изображения до тех пор, пока одни и те же части двух изображений не будут сильно перекрываться. Нажмите «Переключение между режимами свободного преобразования» и «Деформация», чтобы при необходимости внести тонкие коррективы. Уменьшите непрозрачность второго изображения до 100%. (C) Выберите два изображения одновременно и нажмите « Автоматическое наложение слоев». (D) Используйте Panorama в качестве метода смешивания, чтобы завершить сшивание изображения первых двух изображений. (E) Продолжать сшивать изображения, повторяя вышеуказанные методы, чтобы завершить сшивание всех изображений. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 5: Количественная оценка вазооблитерации (VO) и неоваскуляризации (NV) в сетчатке мышиной модели OIR. (A) Изображение 10x OIR спинных креплений сетчатки, окрашенных для эндотелиальных клеток изолектином B4-594 от P12 до P25. После воздействия 75% кислорода в течение 5 дней детенышей и их кормящих матерей возвращали в комнату воздуха при Р12, при котором площадь вазооблитерации достигала максимума. Относительная гипоксия в центральной сетчатке привела к восстановлению сосудов в этой области, а также к патологическому ангиогенезу в средне периферической сетчатке. При Р17 предретинальные неоваскулярные пучки достигали максимума, а затем быстро сокращались. NV полностью регрессировал, и сетчатка, казалось, была нормальной на уровне около P25. B) Количественная оценка площади VO показала пик на P12 и исчезновение на уровне около P25. (C) Количественная оценка области NV показала пик на уровне P17 и регрессию на уровне около P25. Шкала баров представляет собой 1000 мкм в A. (односторонняя ANOVA, *P < 0,05, **P < 0,01, ***P < 0,001, ****P < 0,0001). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
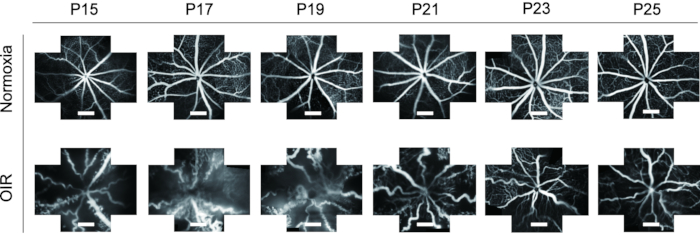
Рисунок 6: Визуализация in vivo флуоресцеиновой ангиографии глазного дна (FFA) в мышиной модели OIR. В сетчатке мышиной модели OIR диаметр кровеносных сосудов, очевидно, увеличился и стал очень извилистым по сравнению с нормальными мышами. Кроме того, FFA показала аналогичную тенденцию динамических изменений сосудистой системы сетчатки с иммунофлуоресцентным окрашиванием изолектином B4-594 из P15-P25 без гибели детенышей мышей. Шкалы представляют 500 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
На восприимчивость мышей к ОИР влияют многие факторы. Детенышей разного генетического происхождения и штаммов сравнивать нельзя. У мышей-альбиносов BALB/c сосуды быстро возвращаются в область VO со значительным снижением неоваскулярных пучков38, что создает некоторые трудности для исследования. У мышей C57BL/6 наблюдается повышенное повреждение фоторецепторов по сравнению с штаммом мыши BALB/cJ39,40. То же самое касается различных типов трансгенных мышей 41,42,43. Кроме того, мыши C57BL/6 демонстрируют более низкий уровень ангиогенеза по сравнению с мышами 129S3/SvIM44.
Послеродовое увеличение веса (ПРГ) также важно учитыватьв 45 лет и является одним из показателей для оценки состояния питания новорожденных. Он также стал надежным методом прогнозирования РН, который привлекает внимание многихживотноводов-моделистов 46. ПРГ влияет на реакцию мышей на гипероксию и гипоксию. При Р7 у детенышей с повышенной массой тела (>5 г) наблюдается недостаточная вазооблитерация и неоваскуляризация сетчатки, в то время как у детенышей со сниженной массой тела (<5 г) проявляется явная реакция на гипероксию и гипоксию. Кроме того, при Р17 у детенышей с плохим (<5 г) и обширным (>7,5 г) увеличением веса наблюдается снижение НВ. Однако у детенышей с плохой прибавкой в весе (<5 г) наблюдается значительно длительная стадия вазооблитерации (ВО) и неоваскуляризации (НВ) с задержкой наступления пикаНВ 45. Поэтому необходимо регистрировать и контролировать ПРГ щенков при Р7 и Р17 и устранять детенышей с низким ПРГ (< 6 г при Р17) для обеспечения повторяемости и сопоставимости эксперимента.
Размер помета оказывает большее влияние на PWG, и некоторые исследователи предполагают, что он должен быть ограничен 6-8 детенышами / плотиной, чтобы соответствовать требованиям для PWG22,31. Состояние кормящей матери также нуждается в рассмотрении. Кормящие матери чаще умирают от повреждения легких в гипероксичной среде47. Если кормящие матери умирают или пренебрегают своими детенышами во время и после индукции ОИР, детеныши легко похудеют или даже умрут из-за недостатка питания32. Поэтому необходимо следить за тем, чтобы суррогатных матерей было достаточно для их замены. Однако этих суррогатных матерей предлагается использовать только тогда, когда мать истекает, что обычно происходит в период воздействия гипероксии или возвращения в комнату воздуха22. Обеспечение достаточного питания кормящих матерей также полезно для улучшения состояния питания их детенышей.
Полезным примечанием для подготовки плоских креплений сетчатки является то, что оптимальное время фиксации обычно необходимо для дальнейшего длительного окрашивания. Как и у мышей P12-P25, рекомендуется фиксация 15 мин + 45 мин при комнатной температуре29. Фиксация сетчатки при 4 °C в течение ночи является альтернативой, если время ограничено. Кроме того, проницаемый и блокирующий буфер с более высокой концентрацией 1% Тритона Х-100 и 5% нормальной ослиной сыворотки эффективно снижает фон иммунофлуоресцентного окрашивания по нашему опыту.
Окрашивание изолектина B4 и перфузия FITC-декстрана являются широко используемыми методами визуализации и количественной оценки неоваскулярных48,49. Основным ограничением этих двух методов является то, что мыши должны быть принесены в жертву. Итак, методы визуализации in vivo и количественной оценки NV необходимы29. Paques et al. разработали технику под названием местная эндоскопическая визуализация глазного дна (TEFI), которая обеспечивает цифровые фотографии сетчатки с высоким разрешением у живых мышей50. TEFI может обнаружить сосудистые изменения сетчатки уже в P15, и полученные изображения соответствуют традиционным методам оценки. Затем Mezu-Ndubuisi et al. предоставили методы измерения in vivo напряжения кислорода в сосудах сетчатки (PO2) и флуоресцеиновой ангиографии (FA), улучшая понимание сосудистых изменений сетчатки и изменений оксигенации из-за РН и других ишемических заболеваний сетчатки37. Хотя ни ТЭФИ, ни ФА не являются такими точными, как обычные методы, они уменьшают гибель экспериментальных животных и могут выполняться повторно. Кроме того, они позволяют каждой мыши служить своим собственным элементом управления, что делает данные OIR более сопоставимыми. В данной работе представлен усовершенствованный метод визуализации FFA и сшивания изображений. Выполнение ФФА на щенках в течение 1 месяца непросто, потому что чрезмерная анестезия и переохлаждение непосредственно вызывают смерть детенышей. Таким образом, старайтесь использовать минимальную дозу анестезии и уделяйте особое внимание поддержанию температуры тела щенков на протяжении всего процесса и после него с помощью небольшой грелки. Всегда увлажняйте глазную поверхность физиологическим раствором и гипромеллозой в случае неудачи последующего наблюдения.
Таким образом, мышиная модель OIR является очень распространенной и широко используемой моделью ишемии сетчатки и патологической неоваскуляризации. Одна из основных проблем этой модели заключается в том, что детеныши неонатальных мышей по существу здоровы и не имеют метаболической нестабильности или респираторных проблем по сравнению с недоношенными детьми. Еще одно различие между мышиной моделью OIR и людьми заключается в том, что при неоваскуляризации сетчатки человека всегда наблюдается фиброваскулярная пролиферация, тогда как неоваскулярная сетчатка не связана с фиброзом в модели51 мыши OIR. Чтобы лучше использовать эту модель и получить больше информации, приводится подробное описание использования FFA для мониторинга динамических изменений сосудистой системы сетчатки OIR, включая методы получения изображений «пятиориентации» и обработки изображений. Считается, что FFA станет эффективным методом частично или полностью заменить иммунофлуоресцентное окрашивание для наблюдения и оценки морфологии и функции сосудистой системы сетчатки49. Хотя мышиная модель OIR не в полной мере напоминает микроокружение и патогенез различных ишемических ретинопатий у человека, она дает нам возможность проводить лекарственные и трансгенные эксперименты, а также исследовать механизм патологического ангиогенеза на ишемической сетчатке51.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Мы благодарим всех членов нашей лаборатории и лаборатории офтальмологических животных Чжуншаньского офтальмологического центра за их техническую помощь. Мы также благодарим профессора Чуньцяо Лю за экспериментальную поддержку. Эта работа была поддержана грантами Национального фонда естественных наук Китая (NSFC: 81670872; Пекин, Китай), Фонд естественных наук провинции Гуандун, Китай (грант No 2019A1515011347) и проект строительства больницы высокого уровня из Государственной ключевой лаборатории офтальмологии в Офтальмологическом центре Чжуншань (грант No 303020103; Гуанчжоу, провинция Гуандун, Китай).
Материалы
| Name | Company | Catalog Number | Comments |
| 1 mL sterile syringe | Solarbio | YA0550 | For preparation of retinal flat mounts and intraperitoneal injection |
| 1× Phosphate buffered saline (PBS) | Transgen Biotech | FG701-01 | For preparation of retinal flat mounts |
| 2 ml Microcentrifuge Tube | Corning | MCT-200-C | For preparation of retinal flat mounts |
| 48 Well Clear TC-Treated Multiple Well Plates | Corning | 3548 | For preparation of retinal flat mounts |
| Adhesive microscope slides | Various | For preparation of retinal flat mounts | |
| Adobe Photoshop CC 2019 | Adobe Inc. | For image analysis | |
| Carbon dioxide gas | Various | For sacrifice | |
| Cover slide | Various | For preparation of retinal flat mounts | |
| Curved forceps | World Precision Instruments | 14127 | For preparation of retinal flat mounts |
| DAPI staining solution | Abcam | ab228549 | For labeling nucleus on retinal flat mounts |
| Dissecting microscope | Olmpus | SZ61 | For preparation of retinal flat mounts |
| Fluorescein sodium | Sigma-Aldrich | F6377 | For in vivo imaging |
| Fluorescent Microscope | Zeiss | AxioImager.Z2 | For acquisition of fluorescence images of retinal flat mounts |
| Fluoromount-G Mounting media | SouthernBiotech | 0100-01 | For preparation of retinal flat mounts |
| Hydroxypropyl Methylcellulose | Maya | 89161 | For in vivo imaging |
| Isolectin B4 594 antibody | Invitrogen | I21413 | For labeling retinal vasculature on retinal flat mounts |
| Mice C57/BL6J | GemPharmatech of Jiangsu Province | For OIR model induction | |
| Micro dissecting scissors-straight blade | World Precision Instruments | 503242 | For preparation of retinal flat mounts |
| No.4 straight forceps | World Precision Instruments | 501978-6 | For preparation of retinal flat mounts |
| Normal donkey serum | Abcam | ab7475 | For preparation of retinal flat mounts |
| O2 sensor | Various | For monitoring the level of O2 | |
| OxyCycler | Biospherix | A84XOV | For OIR model induction |
| Paraformaldehyde (PFA) | Sigma | P6148-1KG | For tissue fixation |
| Pentobarbital sodium | Various | For anesthesia | |
| Soda lime | Various | For absorbing excess CO2 in the oxygen chamber | |
| SPECTRALIS HRA+OCT | Heidelberg | HC00500002 | For in vivo imaging |
| SPSS Statistics 22.0 | IBM | For statistical analysis | |
| Tansference decloring shaker | Kylin-Bell | ZD-2008 | For preparation of retinal flat mounts |
| Tissue culture dish (Low attachment) | Corning | 3261-20EA | For preparation of retinal flat mounts |
| Transfer pipettes | Various | For preparation of retinal flat mounts | |
| Triton X-100 | Sigma-Aldrich | SLBW6818 | For preparation of retinal flat mounts |
| Tropicamide | Various | For in vivo imaging | |
| ZEN Imaging Software | ZEISS | For image acquisition and export |
Ссылки
- Vavvas, D. G., Miller, J. W. Chapter 26 - Basic Mechanisms of Pathological Retinal and Choroidal Angiogenesis. Retina (Fifth Edition). 1, 562-578 (2013).
- Selvam, S., Kumar, T., Fruttiger, M. Retinal vasculature development in health and disease. Progress in Retinal and Eye Research. 63, 1-19 (2018).
- Shimizu, K., Kobayashi, Y., Muraoka, K. Midperipheral fundus involvement in diabetic retinopathy. Ophthalmology. 88 (7), 601-612 (1981).
- Ashton, N. Retinal vascularization in health and disease: Proctor Award Lecture of the Association for Research in Ophthalmology. American Journal of Ophthalmology. 44 (4), 7-17 (1957).
- Hellström, A., Smith, L. E., Dammann, O. Retinopathy of prematurity. Lancet. 382 (9902), 1445-1457 (2013).
- Xu, Y., et al. Melatonin attenuated retinal neovascularization and neuroglial dysfunction by inhibition of HIF-1α-VEGF pathway in oxygen-induced retinopathy mice. Journal of Pineal Research. 64 (4), 12473 (2018).
- Cavallaro, G., et al. The pathophysiology of retinopathy of prematurity: an update of previous and recent knowledge. Acta Ophthalmologica. 92 (1), 2-20 (2014).
- Gilbert, C., Rahi, J., Eckstein, M., O'Sullivan, J., Foster, A. Retinopathy of prematurity in middle-income countries. Lancet. 350 (9070), 12-14 (1997).
- Chen, J., Smith, L. E. Retinopathy of prematurity. Angiogenesis. 10 (2), 133-140 (2007).
- Fielder, A., Blencowe, H., O'Connor, A., Gilbert, C. Impact of retinopathy of prematurity on ocular structures and visual functions. Archives of Disease in Childhood. Fetal and Neonatal Edition. 100 (2), 179-184 (2015).
- Moshfeghi, D. M. Presumed transient reactive astrocytic hyperplasia in immature retina. Retina. 26, 69-73 (2006).
- Kandasamy, Y., Hartley, L., Rudd, D., Smith, R. The association between systemic vascular endothelial growth factor and retinopathy of prematurity in premature infants: a systematic review. British Journal of Ophthalmology. 101 (1), 21-24 (2017).
- Shah, P. K., et al. Retinopathy of prematurity: Past, present and future. World Journal of Clinical Pediatrics. 5 (1), 35-46 (2016).
- Kinsey, V. E. Retrolental fibroplasia; cooperative study of retrolental fibroplasia and the use of oxygen. AMA Archives of Ophthalmology. 56 (4), 481-543 (1956).
- Tin, W., Gupta, S. Optimum oxygen therapy in preterm babies. Archives of Disease in Childhood. Fetal and Neonatal Edition. 92 (2), 143-147 (2007).
- Liu, C. H., Wang, Z., Sun, Y., Chen, J. Animal models of ocular angiogenesis: from development to pathologies. FASEB Journal : Official Publication of the Federation of American Societies for Experimental Biology. 31 (11), 4665-4681 (2017).
- Ashton, N., Ward, B., Serpell, G. Effect of oxygen on developing retinal vessels with particular reference to the problem of retrolental fibroplasia. The British Journal of Ophthalmology. 38 (7), 397-432 (1954).
- Penn, J. S., Tolman, B. L., Lowery, L. A. Variable oxygen exposure causes preretinal neovascularization in the newborn rat. Investigative Ophthalmology & Visual Science. 34 (3), 576-585 (1993).
- Smith, L. E., et al. Oxygen-induced retinopathy in the mouse. Investigative Ophthalmology & Visual Science. 35 (1), 101-111 (1994).
- McLeod, D. S., Brownstein, R., Lutty, G. A. Vaso-obliteration in the canine model of oxygen-induced retinopathy. Investigative Ophthalmology & Visual Science. 37 (2), 300-311 (1996).
- Cao, R., Jensen, L. D., Söll, I., Hauptmann, G., Cao, Y. Hypoxia-induced retinal angiogenesis in zebrafish as a model to study retinopathy. PLoS One. 3 (7), 2748 (2008).
- Connor, K. M., et al. Quantification of oxygen-induced retinopathy in the mouse: a model of vessel loss, vessel regrowth and pathological angiogenesis. Nature Protocols. 4 (11), 1565-1573 (2009).
- Fruttiger, M. Development of the mouse retinal vasculature: angiogenesis versus vasculogenesis. Investigative Ophthalmology & Visual Science. 43 (2), 522-527 (2002).
- Stahl, A., et al. The mouse retina as an angiogenesis model. Investigative Ophthalmology & Visual Science. 51 (6), 2813-2826 (2010).
- Rivera, J. C., et al. Ischemic retinopathies: oxidative stress and inflammation. Oxidative Medicine and Cellular Longevity. 2017, 3940241 (2017).
- Bashinsky, A. L. Retinopathy of prematurity. North Carolina Medical Journal. 78 (2), 124-128 (2017).
- Flynn, J. T., et al. Retinopathy of prematurity. Diagnosis, severity, and natural history. Ophthalmology. 94 (6), 620-629 (1987).
- Aguilar, E., et al. Chapter 6. Ocular models of angiogenesis. Methods in Enzymology. 444, 115-158 (2008).
- Liegl, R., Priglinger, C., Ohlmann, A. Induction and readout of oxygen-induced retinopathy. Methods in Molecular Biology. 1834, 179-191 (2019).
- Lutty, G. A., McLeod, D. S. Retinal vascular development and oxygen-induced retinopathy: a role for adenosine. Progress in Retinal and Eye Research. 22 (1), 95-111 (2003).
- Vähätupa, M., et al. Oxygen-induced retinopathy model for ischemic retinal diseases in rodents. Journal of Visualized Experiments: JoVE. (163), (2020).
- Kim, C. B., D'Amore, P. A., Connor, K. M. Revisiting the mouse model of oxygen-induced retinopathy. Eye and Brain. 8, 67-79 (2016).
- Gammons, M. V., Bates, D. O. Models of oxygen induced retinopathy in rodents. Methods in Molecular Biology. 1430, 317-332 (2016).
- Xiao, S., et al. Fully automated, deep learning segmentation of oxygen-induced retinopathy images. Journal of Clinical Investigation Insight. 2 (24), (2017).
- McLeod, D. S., D'Anna, S. A., Lutty, G. A. Clinical and histopathologic features of canine oxygen-induced proliferative retinopathy. Investigative Ophthalmology & Visual Science. 39 (10), 1918-1932 (1998).
- Penn, J. S., Johnson, B. D. Fluorescein angiography as a means of assessing retinal vascular pathology in oxygen-exposed newborn rats. Current Eye Research. 12 (6), 561-570 (1993).
- Mezu-Ndubuisi, O. J., et al. In vivo retinal vascular oxygen tension imaging and fluorescein angiography in the mouse model of oxygen-induced retinopathy. Investigative Ophthalmology & Visual Science. 54 (10), 6968-6972 (2013).
- Zeilbeck, L. F., Müller, B., Knobloch, V., Tamm, E. R., Ohlmann, A. Differential angiogenic properties of lithium chloride in vitro and in vivo. PLoS One. 9 (4), 95546 (2014).
- Walsh, N., Bravo-Nuevo, A., Geller, S., Stone, J. Resistance of photoreceptors in the C57BL/6-c2J, C57BL/6J, and BALB/cJ mouse strains to oxygen stress: evidence of an oxygen phenotype. Current Eye Research. 29 (6), 441-447 (2004).
- Zhang, Q., Zhang, Z. M. Oxygen-induced retinopathy in mice with retinal photoreceptor cell degeneration. Life Sciences. 102 (1), 28-35 (2014).
- Okamoto, N., et al. Transgenic mice with increased expression of vascular endothelial growth factor in the retina: a new model of intraretinal and subretinal neovascularization. The American Journal of Pathology. 151 (1), 281-291 (1997).
- Ohlmann, A., et al. Norrin promotes vascular regrowth after oxygen-induced retinal vessel loss and suppresses retinopathy in mice. The Journal of Neuroscience. 30 (1), 183-193 (2010).
- Fang, L., Barber, A. J., Shenberger, J. S. Regulation of fibroblast growth factor 2 expression in oxygen-induced retinopathy. Investigative Ophthalmology & Visual Science. 56 (1), 207-215 (2014).
- Chan, C. K., et al. Differential expression of pro- and antiangiogenic factors in mouse strain-dependent hypoxia-induced retinal neovascularization. Laboratory Investigation. 85 (6), 721-733 (2005).
- Stahl, A., et al. Postnatal weight gain modifies severity and functional outcome of oxygen-induced proliferative retinopathy. The American Journal of Pathology. 177 (6), 2715-2723 (2010).
- Vanhaesebrouck, S., et al. Association between retinal neovascularization and serial weight measurements in murine and human newborns. European Journal of Ophthalmology. 23 (5), 678-682 (2013).
- Gerschman, R., Nadig, P. W., Snell, A. C., Nye, S. W. Effect of high oxygen concentrations on eyes of newborn mice. The American Journal of Physiology. 179 (1), 115-118 (1954).
- Lange, C., et al. Kinetics of retinal vaso-obliteration and neovascularisation in the oxygen-induced retinopathy (OIR) mouse model. Graefe's Archive for Clinical and Experimental Ophthalmology. 247 (9), 1205-1211 (2009).
- Huang, S., et al. Comparison of dextran perfusion and GSI-B4 isolectin staining in a mouse model of oxygen-induced retinopathy. Eye Science. 30 (2), 70-74 (2015).
- Paques, M., et al. Panretinal, high-resolution color photography of the mouse fundus. Investigative Ophthalmology & Visual Science. 48 (6), 2769-2774 (2007).
- Fletcher, E. L., et al. Animal models of retinal disease. Progress in Molecular Biology and Translational Science. 100, 211-286 (2011).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены