Method Article
酸素誘発網膜症マウスモデルにおける網膜血管の動的成長のモニタリング
要約
このプロトコルは、マウス網膜フラットマウントの調製および免疫蛍光染色および分析のための詳細な方法を記載する。マウスの仔に対するフルオレセイン眼底造影(FFA)の使用および画像処理についても詳細に説明されている。
要約
酸素誘発網膜症(OIR)は、未熟児網膜症(ROP)、増殖性糖尿病性網膜症(PDR)、網膜静脈閉塞症(RVO)などの虚血性網膜疾患における異常な血管成長の研究に広く使用されています。ほとんどのOIR研究は、特定の時点で網膜新生血管を観察します。しかし、生きたマウスの時間経過に沿った動的な血管成長は、OIR関連血管疾患の理解に不可欠であり、研究が進められてきました。ここでは、OIRマウスモデルの誘導のための段階的なプロトコルについて説明し、潜在的な落とし穴を強調し、免疫蛍光染色を使用して血管閉塞(VO)および新生血管(NV)の領域を迅速に定量するための改善された方法を提供します。さらに重要なことに、OIRマウスモデルでフルオレセイン眼底造影(FFA)を行うことにより、生きたマウスのP15からP25までの血管再成長を監視しました。OIRマウスモデルにFFAを適用することで、血管再成長中のリモデリング過程を観察することができます。
概要
網膜新生血管(RNV)は、既存の網膜静脈から新しい病理学的血管が始まり、通常、網膜の内面に沿って伸び、硝子体(または場合によっては網膜下腔)に成長する状態として定義されます1。これは、未熟児網膜症(ROP)、網膜静脈閉塞症(RVO)、増殖性糖尿病性網膜症(PDR)2など、多くの虚血性網膜症の特徴であり、共通の特徴です。
多くの臨床的および実験的観察は、虚血が網膜新生血管形成の主な原因であることを示しています3,4。ROPでは、新生児は密閉型インキュベーター内で高レベルの酸素にさらされて生存率を高め、これも血管の成長を停止させる重要な推進力です。治療が行われた後、新生児の網膜は比較的低酸素期間5を経験します。RVOの網膜中心静脈または分枝静脈の閉塞に他の状況が見られ、PDR2の細小血管症によって引き起こされる網膜毛細血管の損傷も観察されます。低酸素症はさらに、低酸素誘導因子-1α(HIF-1α)シグナル伝達経路を介して血管内皮増殖因子(VEGF)などの血管新生因子の発現を増加させ、血管内皮細胞を低酸素領域に成長させ、新しい血管を形成するように導きます6,7。
ROPは、早産児の血管増殖性網膜症の一種であり、小児失明の主な原因8,9であり、網膜低酸素症、網膜新生血管、線維性過形成を特徴とする10,11,12。1950年代に、研究者は高濃度の酸素が未熟児の呼吸器症状を大幅に改善できることを発見しました13,14。その結果、酸素療法は当時の未熟児にますます使用されていました15。しかし、早産児における酸素療法の普及と同時に、ROPの発生率は年々増加した。それ以来、研究者は酸素をROPに関連付け、ROPとRNV16の病因を理解するためにさまざまな動物モデルを探索してきました。
ヒトでは、ほとんどの網膜血管系の発達は出生前に完了しますが、げっ歯類では網膜血管系は出生後に発達し、網膜血管系の血管新生を研究するためのアクセス可能なモデルシステムを提供します2。研究の継続的な進歩に伴い、酸素誘発網膜症(OIR)モデルは、虚血に起因する病理学的血管新生を模倣するための主要なモデルになりました。OIRモデルの研究には特定の動物種はなく、子猫17、ラット18、マウス19、ビーグル子犬20、ゼブラフィッシュ21など、さまざまな動物種でモデルが開発されています。すべてのモデルは、初期の網膜発達中に高酸素症にさらされ、その後正常酸素環境に戻るという同じメカニズムを共有しています。Smithらは、マウスの子犬をP7からの高酸素症に5日間さらすと、網膜中心に極端な形態の血管退行が誘発され、P12の室内空気に戻すと、徐々に血管新生房が引き起こされ、硝子体に向かって成長することを観察しました19。これは、スミスモデルとも呼ばれる標準化されたOIRマウスモデルでした。Connorらはプロトコルをさらに最適化し、2009年にVO(血管閉塞)とNV(血管新生)の面積を定量化するための普遍的に適用可能な方法を提供し、モデル22の受け入れと利用を増やしました。OIRマウスモデルは、サイズが小さく、繁殖が速く、遺伝的背景が明確で、再現性が高く、成功率が高いため、現在でも最も広く使用されているモデルです。
マウスでは、網膜血管新生は出生後に視神経頭から内網膜に向かって大口鋸歯状突起に向かって血管が内向きに成長することから始まります。正常な網膜の発達中、最初の網膜血管は出生前後に視神経乳頭から発芽し、生後7日目頃に末梢に到達する拡大ネットワーク(一次神経叢)を形成します(P7)23。その後、血管は網膜に成長し始めて深層を形成し、網膜を貫通し、ヒト24のように内顆粒層(INL)の周りに層流ネットワークを確立します。生後3週目(P21)の終わりまでに、より深い神経叢の発達はほぼ完了します。OIRマウスモデルでは、高酸素曝露中に中央領域の多数の未熟な血管網が急速に変性するため、血管閉塞は常に中央網膜に現れます。したがって、病理学的新生血管の成長は、非灌流領域と血管領域の境界である中末梢網膜でも発生します。しかし、人間の網膜血管は出生前にほとんど形成されています。未熟児に関しては、末梢網膜は高酸素症にさらされたときに完全に血管新生していません25,26。そのため血管閉塞や血管新生は主に末梢網膜27,28に現れる。これらの違いにもかかわらず、マウスOIRモデルは、虚血誘発性新生血管の間に起こる病理学的事象を厳密に再現する。
OIRモデルの誘導は、2つの相29に分けることができる:第1相(高酸素相)では、VEGFの低下および内皮細胞のアポトーシスの結果として、網膜血管の発達が血管の閉塞および退行によって停止または遅延される24,30;フェーズ2(低酸素フェーズ)では、神経発達と恒常性に不可欠な室内空気条件29の下で網膜酸素供給が不十分になります19,31。この虚血状態は通常、調節されていない異常な新生血管を引き起こします。
現在、一般的に使用されているモデリング方法は、高酸素/低酸素曝露を交互に行うことです:母親とその子犬は、P7で5日間75%酸素にさらされ、その後、P17が同等の結果を示すまで室内空気中で5日間曝露されます22、これはOIRマウスモデル誘導のエンドポイントです。(図1)。ROPのシミュレーションに加えて、この虚血媒介性病理学的新生血管は、他の虚血性網膜疾患の研究にも使用できます。このモデルの主な測定値には、免疫蛍光染色またはFITCデキストラン灌流によって網膜フラットマウントから分析されるVOおよびNVの面積の定量化が含まれます。各マウスは致命的な操作のために一度だけ研究することができます。現在、血管退縮および病理学的血管新生の過程で網膜血管系の動的変化を継続的に観察する方法はほとんどありません32。この論文では、OIRモデル誘導の詳細なプロトコル、網膜フラットマウントの分析、およびマウスでのフルオレセイン眼底血管造影(FFA)のワークフローを提供し、OIRマウスモデルの2つのフェーズ中の血管動態変化をより包括的に理解するのに役立ちます。
プロトコル
マウスの使用を含むすべての手順は、中国中山大学中山眼科センターの動物実験倫理委員会(許可番号:2020-082)によって承認され、中山眼科センターの動物管理および使用委員会の承認されたガイドラインおよび眼科および視覚研究における動物の使用に関する視覚眼科研究協会(ARVO)の声明に従って承認されました。
1. マウスOIRモデルの誘導
- C57BL/6Jマウスなど、眼の先天性奇形の割合が低いマウスを使用し、雄/雌= 1:2の比率で交配します。同じ日に生まれた子犬を手に入れ、P7でOIRモデルの誘導を開始します。モデリングする前に、マウスの子犬の体重を厳密に記録してください。
注:生年月日をP0としてメモします。各マウスの体重を定期的に記録します。生まれたばかりの仔の体重は、酸素に対する異なる状態のマウスの感受性が異なるため、OIRの誘導中に非常に重要です。同等の結果を確実にするために、P7で5gを超える子犬を除外します。 - 温度を23°C±2°Cに設定し、湿度を40%〜65%に制御し、毎日12時間の光と12時間の暗闇を交互に行い、ケージに脱脂綿を追加して巣作り、適切な滅菌された食物と水を確保し、個別に換気されたケージ(IVC)に保管するなど、授乳中の母親とその子犬に適した生活環境を提供します。
- チャンバー内の湿度と温度のレベルを監視します。湿度を40%から65%に制御し、温度を23°C±2°Cに保ちます。
- 酸素センサーで酸素供給を確認し、酸素レベルを75%に一定に保ち、酸素流量を0.5〜0.75 L / minに制御します。チャンバーの底に50gのソーダライムを入れて、過剰なCO2を吸収し、CO2値を3%22未満に維持します。
- 巣作り行動、子犬を噛む、授乳を拒否するなど、授乳中の母親の行動を少なくとも1日1回監視します。母性が悪い授乳中の母親を排除します。
- P7の子犬(男性と女性)とその授乳中の母親を、酸素レベルが75%の酸素室にP12まで5日間入れます。モデル誘導期間中のチャンバーの不必要な開放を避けてください。授乳中の母親が高酸素症の間に肺損傷のために死亡した場合に備えて、交換のために追加の代理母がいることを確認してください。
注:実験の比較可能性を確保するために、各母親の数を6〜8匹に制限します。一部の授乳中の母親の死を引き起こす酸素毒性の潜在的な問題に注意を払う。授乳中の母親における高酸素性肺損傷の兆候には、呼吸数の変動、活動の低下、摂食の減少が含まれますが、これらに限定されません。.上記の現象が発生した場合は、できるだけ早く1%ペントバルビタールナトリウム(50 mg / kg)で授乳中の母親を安楽死させてください。.129S1/SvImJなどの代理母を交換用に準備し、必要な場合にのみ使用してください。授乳中の母親を日常的に交換することは、酸素室が頻繁に開き、酸素レベルが不安定になり、母親の攻撃性が生じるため、お勧めできません。 - 子犬とその授乳中の母親をP12の部屋の空気に戻し、P17まですべての子犬の体重を継続的に監視します。体重に基づいて子犬をグループ化し、各実験グループが同様の体重分布を持つようにします。
2. 網膜ホールマウントの作製と免疫蛍光染色
- 子犬の体重を記録します。過剰摂取の麻酔薬(1%ペントバルビタールナトリウム50 mg / kg)またはCO2 吸入によって子犬を犠牲にします。.必要に応じて、頸部脱臼や両側開胸術などの他の安楽死方法を使用できます。
- 湾曲したはさみを使用して、眼球と眼窩組織の間の接続を解放します。次に、湾曲した鉗子を眼球の後部に入れ、視神経をクランプし、眼窩からすばやく目を持ち上げます。予冷した1xリン酸緩衝生理食塩水(PBS)で眼球を洗浄し、眼球の表面から髪と血液を取り除きます。
- 洗浄した眼球を4%パラホルムアルデヒド(PFA)で満たされた2 mLの微量遠心チューブに入れ、毎分12〜15回転(rpm)の速度でシェーカー上で室温で15分間インキュベートします(初期固定)。
注意:パラホルムアルデヒドはアレルギー性で、一般的に毒性があり、非常に細胞毒性があることが知られています。安全上の注意に厳密に従い、吸入や皮膚への接触を避けてください。 - 培養皿を使用し、中央部に1x PBSの滴を入れ、解剖顕微鏡下で次の手順を実行し、この滴に1つの眼球を置きます。一対の鉗子で眼球を持ち、1 mLの注射針を使用して角膜辺縁部の角膜を慎重に穿刺します。この穴にハサミの先端を挿入し、角膜の縁に沿って角膜を慎重に切り取ります。網膜を切らないように注意してください。
- 鉗子で虹彩とレンズを取り外します。次に、残りのアイカップを4%PFAに入れ、12〜15 rpmの速度でシェーカーで室温でさらに45分間再度固定します(二次固定)。
- 培養皿を使用し、中央部に1x PBSを一滴入れます。固定眼球をこのドロップに入れます。一対の鉗子で眼球を持ちます。2つの鉗子を使用して網膜層と強膜層を静かに分離します。網膜層と強膜層の間にハサミの先端を置き、強膜を視神経に向かって切断します。網膜から強膜をはがし、網膜カップを入手します。
注:鉗子で視神経で後部カップを持ち、次に別の鉗子の湾曲した端を使用して視神経頭の強膜を押し下げ、網膜を解放する代わりに前方に掃引する動きで網膜を優しくマッサージします。 - 鉗子を使用して、橈骨硝子体血管と末梢網膜の間の接続を解放し、視神経乳頭に近い硝子体血管の根元をクランプし、硝子体血管を慎重に切断します。
- 先端を切り落とした2 mLピペットを使用して、網膜カップを移します。網膜カップを48ウェルプレートの1ウェルに入れ、12〜15 rpmの速度でシェーカーで室温で1x PBSで3 x 5分間洗浄します。
- 1%Triton X-100(PBS溶液)と5%正常ロバ血清(PBS溶液)の混合溶液中で網膜カップを4°Cで一晩インキュベートします。
- あるいは、代わりに、網膜を室温で1時間ブロックして透過処理します。二次抗体の供給源に応じてブロッキング血清を変更します。
- イソレクチンB4を使用して網膜血管系を標識する場合は、0.1%正常ロバ血清(400 μL)およびイソレクチンB4-594(1:400)を含む48ウェルプレートのウェルで網膜を12〜15 rpmの速度でシェーカー上で4°Cで一晩インキュベートします。
注:CD31などの他のマーカーで血管を標識する場合、または他の細胞を標識する場合は、特定の一次抗体を使用して標識します。 - 網膜を1:100-1:500の特異的一次抗体(400 μL 0.1%正常ロバ血清中)で4°C、シェーカー上で12-15 rpmの速度で48時間インキュベートします。
- 室温に戻った後、網膜を0.1%PBST(PBS中の0.1%TritonX-100)で12〜15rpmの速度でシェーカー上で3 x 20分間洗浄する。
- 網膜を1:1,000の二次抗体(400 μL 0.1%正常ロバ血清中)で12〜15 rpmの速度でシェーカー上で4°Cで一晩インキュベートします。(オプション)
- あるいは、網膜を高親和性二次抗体とともに室温で1時間インキュベートします。
- 網膜をDAPI(1:1,000)で室温で20〜25分間インキュベートして、核を標識します。
注:実験前のステップ10-11および13-14で使用したすべての抗体の最適な希釈比をテストします。 - 室温で12〜15rpmの速度でシェーカーで0.1%PBSTで網膜を3 x 30分間洗浄します。
- 開口部を上に向けて、網膜カップをきれいなスライドに移します。視神経乳頭から約1〜1.5 mm離れた場所で、末梢から中央までの3、6、9、および12時の位置で網膜を放射状に切断します。
- 1x PBSを数滴加えて網膜を3回すすぐ。網膜を乾燥させて平らにするために、空気中の紙を使用してください。カバーガラスの中央に封入剤( 材料の表を参照)を一滴加え、液滴の直径がカバーガラスの半分に大きくなるまで追加を停止します。カバーガラスをすばやく裏返して、広げた網膜の上に置きます。気泡を形成しないでください。
- 網膜フラットマウントの画像を撮影するか、4°Cでスライドを光から保護して保管します。
3. 網膜フラットマウントの解析と定量
注:OIRマウスモデルの場合、研究者はしばしばP12-P25の間に網膜中心血管閉塞と末梢網膜病理学的新生血管の領域を記録する。以前の研究では、網膜の中央無血管領域がP12で最大に達し、P13からP17まで徐々に縮小することが示されています。同時に、OIRマウスの網膜はP17付近で新生血管領域のピークに達する22、29。P17から、新生血管は徐々に退行し、機能的な血管は無血管領域に再成長します。網膜血管系は基本的にP2533で正常に戻ります。
- 10倍対物レンズを備えた蛍光顕微鏡(材料表を参照)で網膜フラットマウントの画像を撮影します。まず、DAPIチャネルを選択し、視神経頭を視野の中心に設定します。次に、他のチャネルを調整し、網膜の表在血管系に焦点を合わせます。フォトソフトウェア(材料表を参照)のタイルを確認し、ステッチする必要のある写真の数を設定します。[実験の開始]をクリックして、網膜全体をキャプチャします。
- 画像処理プログラム( 材料表を参照)を使用して、免疫蛍光染色後の血管閉塞(VO)および新生血管(NV)の領域を定量化します。
- まず、 魔法の杖ツール をクリックし、明るさの違いに応じて適切な許容値を設定し、カーソルを背景に移動してマウスをクリックします。次に、[ 逆を選択 ]を選択して、網膜の基本的なアウトラインを取得します。な げなわツールを使用して 、網膜の詳細をさらに概説します。 ヒストグラム 機能を使用して、網膜全体のピクセル値を記録し、それを書き留めるか、データベースプログラムでテーブルを生成します。
- 網膜画像を4つの象限に分割します。各象限で、なげなわツールを使用してVO領域を描画し(図2A-C)、マジックワンドツールを使用してNV領域を選択します(図2D-F)。ヒストグラムのピクセル情報を使用して、網膜全体に対するVOとNVのピクセル比、つまり網膜全体に対するVOまたはNV領域のパーセンテージを計算します。
注:ディープラーニングニューラルネットワーク(http://oirseg.org/)を使用してOIR画像のVOおよびNV領域を定量化するためのオープンソースの完全に自動化されたパイプラインもあり、研究者に信頼性が高く時間を節約する方法を提供し、定量化の標準を統一します34。
- スプレッドシートテーブルにピクセル情報を記録しておくと、その後の分析に便利です。
4.フルオレセイン眼底血管造影(FFA)による 生体内 イメージング
注:OIRマウスの場合、FITC灌流染色と免疫蛍光染色の両方は、実験動物の死亡のため、1回しか使用できません。これと比較して、FFAの利点の1つは、インビボの発生および病的状態におけるマウス網膜血管の動的変化の観察である35,36。
- 麻酔前に子犬の体重を量ります。
- 30〜50 mg / kgの用量で0.3%ペントバルビタールナトリウムの腹腔内注射によって子犬を麻酔します。.
注:1か月以内のマウスの場合、麻酔薬の投与量に注意してください。麻酔によるマウスの死亡を減らすために、より低い濃度と用量の麻酔薬を使用してください。.子犬に麻酔をかけた後、体温を維持するために小さな加熱パッドを使用します。低体温は子犬の生理機能に影響を与えるだけでなく、クリスタリンの変化を引き起こし、白内障の発症を促進します。 - 各子犬に20μLの散瞳点眼薬(0.5%トロピカミド+ 0.5%塩酸フェニレフリン)を使用し、5分間待って、瞳孔拡張を長持ちさせます(図3A、B)。
- 麻酔をかけた子犬をイメージングデバイスの前に持ってきます( 資料表を参照)。子犬を小さな加熱パッドに保ち、子犬を安定した位置に置き、角膜の水分を維持するために定期的に人工涙液を使用します。 赤外線眼底イメージング(IR) のモードをクリックして、視神経乳頭を画面の中央に調整します。
注:子犬の片方の目を観察するときは、もう一方の目を保護することを忘れないでください。ヒプロメロース点眼薬を使用して、乾燥による角膜の白化を防ぎます。 - 0.15mLの0.5%フルオレセインナトリウム塩溶液を腹腔内注射した後、すぐに撮像装置のタッチパネルにある FA ボタンと 注入 ボタンをクリックしてタイミングを開始します。網膜の血液循環が静脈相に入る3分後に画像を記録し、網膜を6〜8分以上観察します。
注:フルオレセインナトリウム塩溶液を腹腔内注射した後、子犬の皮膚、粘膜、尿は明らかな黄緑色を示します。フルオレセインのほとんどは、1日以内に子犬から排泄されます。フルオレセインナトリウムを1日おきに6回腹腔内注射しても、重大な副作用は発生しない37。 - 視神経乳頭を画像取得領域の中心に移動し、網膜中心の最初の画像を撮影します。そして、撮像装置のレンズを眼の鼻側に水平に動かし、視神経乳頭が画像取得領域の片側の中点に位置するまで、第2の画像を撮影する。この方法を使用して、側頭網膜、上網膜、下網膜の画像をそれぞれ撮影し続けます(図3C)。
注:回帰フェーズが発生すると、12分以内に「5方向」の画像を撮影します。劣像における視神経乳頭の位置は、レンズの角度調整が制限されているため、傍観者に落ちないようにすることができます。 - 画像を保存し、画像処理プログラムを使用してステッチングを行います。
5. フルオレセイン眼底血管造影(FFA)の画像処理
- 画像処理プログラムを開き、[ファイル内の新規作成]をクリックして、背景が黒い新しいキャンバスを作成します(図4A)。
- 背景レイヤーで最初に中心網膜の画像を開きます。[ ファイル ]をクリックして、2番目の画像を追加します。2番目の画像の不透明度を60%に調整し、2つの画像の同じ部分が非常に重なるまで2番目の画像を移動してサイズを変更します。 自由変形モードとワープモードの切り替え ボタンをクリックし、必要に応じて船舶を微調整します。次に、2番目の画像の不透明度を100%に戻します(図4A、B)。
- 2つの画像を同時に選択し、[ レイヤーの自動ブレンド]をクリックします。ブレンド方法として パノラマ を確認し、次の2つの文を選択します。 [OK ]をクリックして、最初の2つの画像の画像スティッチングを終了します(図4C、D)。
- 最初の 2 つのステッチされた画像を全体として取得し、3 番目の画像を追加して、ブレンドを続行します。上記の方法を繰り返して、5つの画像のスティッチングを完了します(図4E)。
- 切り抜きツールを使用して、さまざまな時点でのFFAの画像を均一なサイズにカットし、正常な子犬とOIR子犬の両方で網膜血管系のP15からP25への動的な変化を観察します。
6.統計分析
- 平均値±標準偏差(s.d.)として値を提示します。
- スチューデントの t検定を使用して、2つの独立したサンプルを比較します。一元配置分散分析を使用して複数のデータセットを比較し、一般的に使用される多重比較検定であるDunnettまたはTukeyの検定と組み合わせます。
- 正規分布しないデータの場合は、マン・ホイットニーU検定またはクラスカル・ウォリス検定を使用します。 Pが 0.05<ときの有意な統計的差を考慮します。
結果
OIRマウスモデルにおいて、最も重要かつ基本的な結果は、VOおよびNV領域の定量化である。P7から5日間高酸素環境で生活した後、仔の中心網膜は最大の非灌流領域を示した。さらに5日間の低酸素の刺激下で、網膜新生血管が徐々に生成され、周囲の正常血管よりも強く蛍光を発しました。P17以降、病的新生血管の蛍光シグナルは網膜のリモデリングとして急速に退縮した(図5A)。同腹児サイズと子犬の出生後の体重増加を制御することにより、OIRマウスモデルのVOおよびNVの領域は良好な再現性と安定性を示し、網膜新生血管のピークはP17で発生し、これは以前の研究と一致していました(図5B、C)。
FFAは網膜血管系を研究するための理想的なツールです。FFAを in vivoで適用すると、実験動物の無駄が大幅に削減され、網膜血管の動的な経時変化が表示されます。以前の研究では、FFAはマウスの仔にはあまり使用されておらず、単一ビュー画像で提示されていましたが、これはさらなる研究が困難でした。このプロトコルでは、網膜血管系の「5方向」画像を画像処理ソフトウェアを使用してつなぎ合わせ、網膜のより広い視野を一度に表示し、必要に応じてその後の分析に役立ちました(図4)。さらに、OIRマウスの子犬は長時間の開眼を示したため、FFA画像は動物倫理の要件を満たすためにP15から取得されました。OIRマウスモデルの網膜では、正常なマウスと比較して血管の直径が明らかに増加し、非常に曲がりくねったものになりました。また、FFAでは、P15-P25由来のイソレクチンB4-594による免疫蛍光染色では、仔を死滅させることなく網膜血管系の動的変化が同様の傾向を示した(図6)。
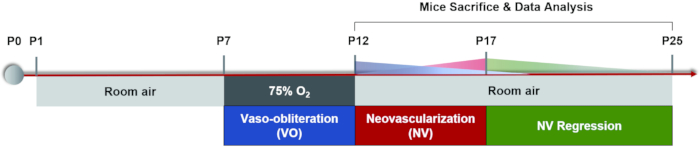
図1:OIRマウスモデルの漫画の概略図。OIRマウスモデルは、子犬とその授乳中の母親をしばらくの間部屋に留めておくことによって誘発されました(P0-P7)。P7では、両方とも75%の酸素に5日間曝露され、網膜血管の成長を阻害し、網膜中心で重大な血管喪失を引き起こしました。その後、マウスをP12の室内空気に戻すと、無血管網膜が比較的低酸素になり始め、正常な血管の再成長と末梢網膜中部の病理学的反応の両方を引き起こしました。最大新生血管(NV)はP17で見られました。その後、病的新生血管は自然退縮の過程を経た。網膜血管系はP25付近で再び正常に戻った。この図の拡大版を表示するには、ここをクリックしてください。

図2:マウス網膜における血管閉塞(VO)および血管新生(NV)の測定 。 (A)内皮細胞をイソレクチンB4-594で染色した10x P12 OIR網膜ホールマウントの画像。(B)無血管領域が選択された網膜のスクリーンショット。この測定を行うために必要なツールは、白い矢印で強調表示されています: マジックワンド ツールとな げなわツール。(C)網膜の無血管領域を強調表示し、画像をコピーとして保存します。 (D)内皮細胞をイソレクチンB4-594で染色した10x P17 OIR網膜ホールマウントの画像。(E)血管新生房が選択された網膜のスクリーンショット。 魔法の杖ツールを使用して 、NVを強調するための最適な許容値を設定します。許容値を 3-5 に設定し、アンチエイリアスと連続するチェックボックスをオンにします。(F)新生血管領域はコピーとしてのみ保存してください。スケールバーは1,000μmを表します。 この図の拡大版を表示するには、ここをクリックしてください。
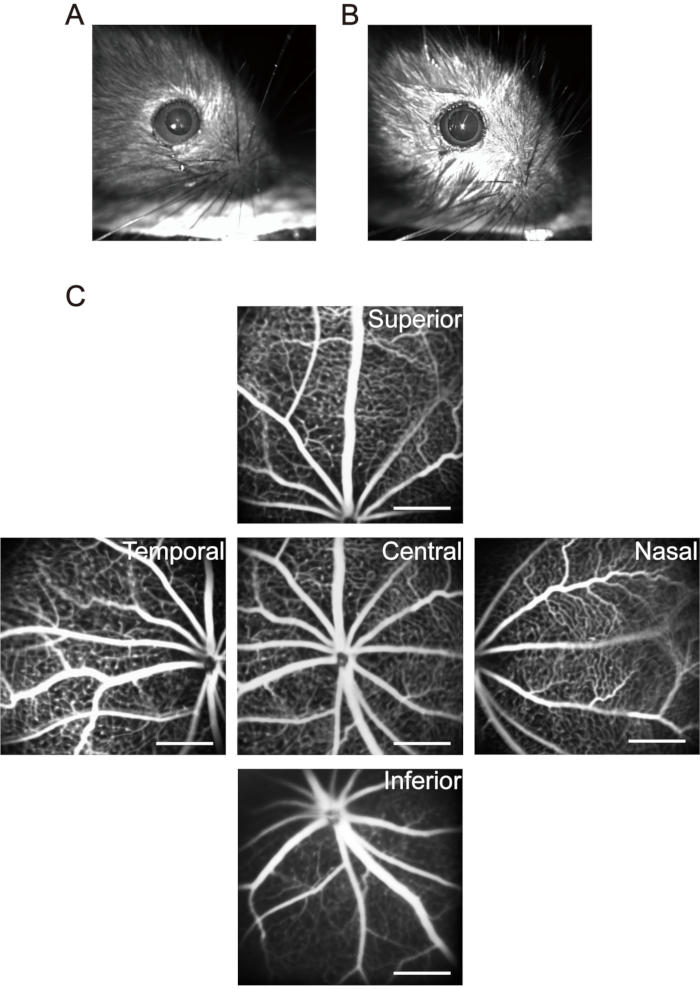
図3:マウス網膜における「5方向」画像の取得。 (a)正常なマウス瞳孔。(B)散瞳のマウス瞳孔。(C)網膜の中央、鼻、側頭、上、下領域の「5方向」画像をそれぞれ収集しました(室内空気中のP17子犬)。スケールバーは500μmを表します。 この図の拡大版を表示するには、ここをクリックしてください。

図4:フルオレセイン眼底造影(FFA)からの「5方向」画像をステッチする一般的なワークフロー 。 (A)背景が黒い新しいキャンバスを作成し、網膜中心のFFA画像を開きます。(B)側頭網膜のFFA画像を開き、2番目の画像の不透明度を60%に調整します。2 つの画像の同じ部分が大きく重なるまで、画像を移動してサイズを変更します。 [自由変形 モードと ワープモード の切り替え]をクリックして、必要に応じて微妙な調整を行います。2番目の画像の不透明度を100%に戻します。(C)2つの画像を同時に選択し、[ レイヤーの自動ブレンド]をクリックします。(D)ブレンド方法として パノラマ を使用して、最初の2つの画像の画像ステッチを終了します。(E)上記の方法を繰り返して画像のスティッチングを続行し、すべての画像のスティッチングを完了します。 この図の拡大版を表示するには、ここをクリックしてください。

図5:OIRマウスモデルの網膜における血管閉塞(VO)および新生血管形成(NV)の定量化。 (A)内皮細胞をP12からP25までのイソレクチンB4-594で染色した10倍OIR網膜ホールマウントの画像。75%の酸素に5日間さらされた後、子犬とその授乳中の母親は、血管抹消の面積が最大に達したP12の部屋の空気に戻されました。網膜中心の相対的な低酸素症は、この領域の血管再成長と末梢網膜中部の病理学的血管新生をもたらしました。P17では、網膜前新生血管房が最大に達し、その後急速に縮小しました。NVは完全に退行し、網膜はP25付近で正常であるように見えました。(B)VOの面積を定量すると、P12にピークが見られ、P25付近に消失が見られた。(C)NVの面積を定量化すると、P17にピークが見られ、P25付近に回帰が見られた。スケールバーはA.で1,000μmを表す(一元配置分散分析、*P < 0.05、**P < 0.01、***P < 0.001、**** P < 0.0001)。 この図の拡大版を表示するには、ここをクリックしてください。
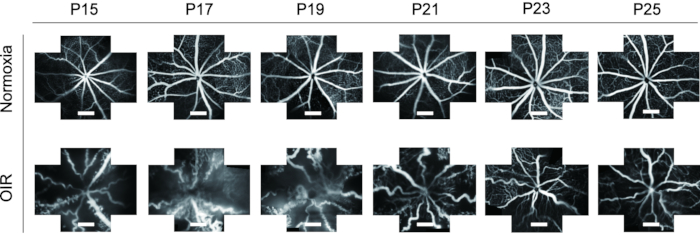
図6:OIRマウスモデルにおけるフルオレセイン眼底血管造影(FFA)の in vivo イメージング。 OIRマウスモデルの網膜では、正常なマウスと比較して血管の直径が明らかに増加し、非常に曲がりくねったものになりました。また、FFAは、マウスの仔を死なせることなく、P15-P25由来のイソレクチンB4-594による免疫蛍光染色により網膜血管系の動的変化の同様の傾向を示した。スケールバーは500μmを表します。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
マウスのOIRに対する感受性は、多くの要因の影響を受けます。異なる遺伝的背景と系統の子犬を比較することはできません。BALB/cアルビノマウスでは、血管は血管新生房を大幅に減少させながらVO領域に急速に再成長し38、研究にいくつかの困難をもたらします。C57BL/6マウスでは、BALB/cJマウス系統39,40と比較して視体損傷が増加する。同じことが異なるタイプのトランスジェニックマウスにも当てはまります41、42、43。さらに、C57BL/6マウスは、129S3/SvIMマウスと比較して血管新生のレベルが低い44。
出生後の体重増加(PWG)も考慮することが重要であり、45 であり、新生児の栄養状態を評価するための指標の1つです。また、ROPを予測するための信頼できる方法にもなり、多くの動物モデラー46の注目を集めています。PWGは、高酸素症および低酸素症に対するマウスの反応に影響を及ぼす。P7では、体重が増加した子犬(>5 g)は不十分な血管閉塞と網膜新生血管形成を示しますが、体重が減少した子犬(<5 g)は高酸素症と低酸素症に対して明らかな反応を示します。さらに、P17では、体重増加が乏しく(<5 g)、体重増加が広範囲(>7.5 g)の子犬はNVの減少を示しています。しかし、体重増加が悪い(<5 g)子犬は、血管閉塞(VO)および新生血管(NV)段階が有意に延長され、NVピーク45の発生が遅れています。したがって、実験の再現性と比較可能性を確保するために、P7とP17で子犬のPWGを記録および制御し、PWGが低い(P17で<6 g)子犬を排除する必要があります。
ごみのサイズはPWGに大きな影響を与え、一部の研究者は、PWG6の要件を満たすために8〜22,31匹の子犬/ダムに制限する必要があると提案しています。授乳中の母親の状態も考慮する必要があります。授乳中の母親は、高酸素環境で肺の損傷で死亡する可能性が高くなります47。授乳中の母親がOIRの導入中および導入後に子犬を死亡または放置すると、子犬は簡単に体重が減ったり、栄養不足のために死亡したりします32。したがって、代理母を置き換えるのに十分な代理母がいることを確認する必要があります。しかしながら、これらの代理母は、母親が満了したときにのみ使用されることが示唆され、これは通常、高酸素曝露の期間中に起こるか、または室内空気22に戻る。授乳中の母親に十分な食事を提供することは、子犬の栄養状態を改善するのにも役立ちます。
網膜フラットマウントを調製するための有用な注意点は、さらなる長時間の染色のために最適な固定時間が通常必要であるということです。P12-P25のマウスとして、室温で15分+45分の固定が推奨される29。網膜を4°Cで一晩固定することは、時間が限られている場合の代替手段です。さらに、1%Triton X-100および5%正常ロバ血清の高濃度の透過性およびブロッキングバッファーは、私たちの経験によれば、免疫蛍光染色のバックグラウンドを効果的に低減します。
イソレクチンB4染色およびFITC−デキストラン灌流は、血管新生を視覚化および定量するために一般的に使用される方法である48,49。これら2つの方法の主な制限は、マウスを犠牲にしなければならないことです。したがって、NVのin vivoイメージングおよび定量化のための方法が必要である29。Paquesらは、生きたマウスの網膜の高解像度デジタル写真を提供する局所内視鏡眼底イメージング(TEFI)と呼ばれる技術を開発しました50。TEFIは、P15という早い時期に網膜血管の変化を検出することができ、得られた画像は従来の評価方法に従っています。Mezu-Ndubuisiらは、次に、in vivo網膜血管酸素圧(PO2)測定およびフルオレセイン血管造影(FA)の方法を提供し、ROPおよび他の虚血性網膜疾患による網膜血管変化および酸素化変化の理解を改善した37。TEFIもFAも従来の方法ほど正確ではありませんが、実験動物の死亡を減らし、繰り返し行うことができます。さらに、各マウスを独自のコントロールとして機能させることができるため、OIRデータをより比較可能にします。本稿では,FFAイメージングと画像スティッチングの改良方法を提供する.過度の麻酔と低体温が直接子犬の死を引き起こすため、1か月以内に子犬にFFAを実行することは容易ではありません。したがって、麻酔の最小用量を使用し、小さな加熱パッドを使用して、プロセス全体およびプロセス後に子犬の体温を維持することに特別な注意を払うようにしてください。次の観察が失敗した場合は、常に生理食塩水とヒプロメロースで眼の表面を湿らせてください。
要約すると、OIRマウスモデルは、網膜虚血および病理学的新生血管の非常に一般的で広く使用されているモデルである。このモデルの主な問題の1つは、新生児マウスの子犬が本質的に健康であり、早産の乳児と比較して代謝不安定性や呼吸器系の問題がないことです。OIRマウスモデルとヒトとの別の違いは、ヒト網膜新生血管では線維血管増殖が常に存在するのに対し、網膜新生血管はOIRマウスモデル51では線維症と関連していないことである。このモデルをより有効に活用し、より多くの情報を取得するために、「5方向」画像の撮影方法や画像処理など、OIR網膜血管系の動的変化を監視するためにFFAを使用する方法について詳しく説明します。FFAは、網膜血管系の形態および機能を観察および評価するための免疫蛍光染色を部分的または完全に置き換えるための有効な方法になると考えられている49。OIRマウスモデルは、ヒトのさまざまな虚血性網膜症の微小環境と病因に完全には似ていませんが、薬物実験やトランスジェニック実験を行い、虚血性網膜の病的血管新生のメカニズムを探求する機会を提供します51。
開示事項
著者は開示するものは何もありません。
謝辞
中山眼科センターの研究室と眼科動物研究所のすべてのメンバーの技術支援に感謝します。また、実験的支援をしてくださった劉春橋教授にも感謝します。この研究は、中国国家自然科学財団(NSFC:81670872;中国北京)、中国広東省自然科学財団(助成金番号2019A1515011347)、および中山眼科センターの眼科国家重点研究所からの高レベル病院建設プロジェクト(助成金番号303020103;広州、広東省、中国)。
資料
| Name | Company | Catalog Number | Comments |
| 1 mL sterile syringe | Solarbio | YA0550 | For preparation of retinal flat mounts and intraperitoneal injection |
| 1× Phosphate buffered saline (PBS) | Transgen Biotech | FG701-01 | For preparation of retinal flat mounts |
| 2 ml Microcentrifuge Tube | Corning | MCT-200-C | For preparation of retinal flat mounts |
| 48 Well Clear TC-Treated Multiple Well Plates | Corning | 3548 | For preparation of retinal flat mounts |
| Adhesive microscope slides | Various | For preparation of retinal flat mounts | |
| Adobe Photoshop CC 2019 | Adobe Inc. | For image analysis | |
| Carbon dioxide gas | Various | For sacrifice | |
| Cover slide | Various | For preparation of retinal flat mounts | |
| Curved forceps | World Precision Instruments | 14127 | For preparation of retinal flat mounts |
| DAPI staining solution | Abcam | ab228549 | For labeling nucleus on retinal flat mounts |
| Dissecting microscope | Olmpus | SZ61 | For preparation of retinal flat mounts |
| Fluorescein sodium | Sigma-Aldrich | F6377 | For in vivo imaging |
| Fluorescent Microscope | Zeiss | AxioImager.Z2 | For acquisition of fluorescence images of retinal flat mounts |
| Fluoromount-G Mounting media | SouthernBiotech | 0100-01 | For preparation of retinal flat mounts |
| Hydroxypropyl Methylcellulose | Maya | 89161 | For in vivo imaging |
| Isolectin B4 594 antibody | Invitrogen | I21413 | For labeling retinal vasculature on retinal flat mounts |
| Mice C57/BL6J | GemPharmatech of Jiangsu Province | For OIR model induction | |
| Micro dissecting scissors-straight blade | World Precision Instruments | 503242 | For preparation of retinal flat mounts |
| No.4 straight forceps | World Precision Instruments | 501978-6 | For preparation of retinal flat mounts |
| Normal donkey serum | Abcam | ab7475 | For preparation of retinal flat mounts |
| O2 sensor | Various | For monitoring the level of O2 | |
| OxyCycler | Biospherix | A84XOV | For OIR model induction |
| Paraformaldehyde (PFA) | Sigma | P6148-1KG | For tissue fixation |
| Pentobarbital sodium | Various | For anesthesia | |
| Soda lime | Various | For absorbing excess CO2 in the oxygen chamber | |
| SPECTRALIS HRA+OCT | Heidelberg | HC00500002 | For in vivo imaging |
| SPSS Statistics 22.0 | IBM | For statistical analysis | |
| Tansference decloring shaker | Kylin-Bell | ZD-2008 | For preparation of retinal flat mounts |
| Tissue culture dish (Low attachment) | Corning | 3261-20EA | For preparation of retinal flat mounts |
| Transfer pipettes | Various | For preparation of retinal flat mounts | |
| Triton X-100 | Sigma-Aldrich | SLBW6818 | For preparation of retinal flat mounts |
| Tropicamide | Various | For in vivo imaging | |
| ZEN Imaging Software | ZEISS | For image acquisition and export |
参考文献
- Vavvas, D. G., Miller, J. W. Chapter 26 - Basic Mechanisms of Pathological Retinal and Choroidal Angiogenesis. Retina (Fifth Edition). 1, 562-578 (2013).
- Selvam, S., Kumar, T., Fruttiger, M. Retinal vasculature development in health and disease. Progress in Retinal and Eye Research. 63, 1-19 (2018).
- Shimizu, K., Kobayashi, Y., Muraoka, K. Midperipheral fundus involvement in diabetic retinopathy. Ophthalmology. 88 (7), 601-612 (1981).
- Ashton, N. Retinal vascularization in health and disease: Proctor Award Lecture of the Association for Research in Ophthalmology. American Journal of Ophthalmology. 44 (4), 7-17 (1957).
- Hellström, A., Smith, L. E., Dammann, O. Retinopathy of prematurity. Lancet. 382 (9902), 1445-1457 (2013).
- Xu, Y., et al. Melatonin attenuated retinal neovascularization and neuroglial dysfunction by inhibition of HIF-1α-VEGF pathway in oxygen-induced retinopathy mice. Journal of Pineal Research. 64 (4), 12473 (2018).
- Cavallaro, G., et al. The pathophysiology of retinopathy of prematurity: an update of previous and recent knowledge. Acta Ophthalmologica. 92 (1), 2-20 (2014).
- Gilbert, C., Rahi, J., Eckstein, M., O'Sullivan, J., Foster, A. Retinopathy of prematurity in middle-income countries. Lancet. 350 (9070), 12-14 (1997).
- Chen, J., Smith, L. E. Retinopathy of prematurity. Angiogenesis. 10 (2), 133-140 (2007).
- Fielder, A., Blencowe, H., O'Connor, A., Gilbert, C. Impact of retinopathy of prematurity on ocular structures and visual functions. Archives of Disease in Childhood. Fetal and Neonatal Edition. 100 (2), 179-184 (2015).
- Moshfeghi, D. M. Presumed transient reactive astrocytic hyperplasia in immature retina. Retina. 26, 69-73 (2006).
- Kandasamy, Y., Hartley, L., Rudd, D., Smith, R. The association between systemic vascular endothelial growth factor and retinopathy of prematurity in premature infants: a systematic review. British Journal of Ophthalmology. 101 (1), 21-24 (2017).
- Shah, P. K., et al. Retinopathy of prematurity: Past, present and future. World Journal of Clinical Pediatrics. 5 (1), 35-46 (2016).
- Kinsey, V. E. Retrolental fibroplasia; cooperative study of retrolental fibroplasia and the use of oxygen. AMA Archives of Ophthalmology. 56 (4), 481-543 (1956).
- Tin, W., Gupta, S. Optimum oxygen therapy in preterm babies. Archives of Disease in Childhood. Fetal and Neonatal Edition. 92 (2), 143-147 (2007).
- Liu, C. H., Wang, Z., Sun, Y., Chen, J. Animal models of ocular angiogenesis: from development to pathologies. FASEB Journal : Official Publication of the Federation of American Societies for Experimental Biology. 31 (11), 4665-4681 (2017).
- Ashton, N., Ward, B., Serpell, G. Effect of oxygen on developing retinal vessels with particular reference to the problem of retrolental fibroplasia. The British Journal of Ophthalmology. 38 (7), 397-432 (1954).
- Penn, J. S., Tolman, B. L., Lowery, L. A. Variable oxygen exposure causes preretinal neovascularization in the newborn rat. Investigative Ophthalmology & Visual Science. 34 (3), 576-585 (1993).
- Smith, L. E., et al. Oxygen-induced retinopathy in the mouse. Investigative Ophthalmology & Visual Science. 35 (1), 101-111 (1994).
- McLeod, D. S., Brownstein, R., Lutty, G. A. Vaso-obliteration in the canine model of oxygen-induced retinopathy. Investigative Ophthalmology & Visual Science. 37 (2), 300-311 (1996).
- Cao, R., Jensen, L. D., Söll, I., Hauptmann, G., Cao, Y. Hypoxia-induced retinal angiogenesis in zebrafish as a model to study retinopathy. PLoS One. 3 (7), 2748 (2008).
- Connor, K. M., et al. Quantification of oxygen-induced retinopathy in the mouse: a model of vessel loss, vessel regrowth and pathological angiogenesis. Nature Protocols. 4 (11), 1565-1573 (2009).
- Fruttiger, M. Development of the mouse retinal vasculature: angiogenesis versus vasculogenesis. Investigative Ophthalmology & Visual Science. 43 (2), 522-527 (2002).
- Stahl, A., et al. The mouse retina as an angiogenesis model. Investigative Ophthalmology & Visual Science. 51 (6), 2813-2826 (2010).
- Rivera, J. C., et al. Ischemic retinopathies: oxidative stress and inflammation. Oxidative Medicine and Cellular Longevity. 2017, 3940241 (2017).
- Bashinsky, A. L. Retinopathy of prematurity. North Carolina Medical Journal. 78 (2), 124-128 (2017).
- Flynn, J. T., et al. Retinopathy of prematurity. Diagnosis, severity, and natural history. Ophthalmology. 94 (6), 620-629 (1987).
- Aguilar, E., et al. Chapter 6. Ocular models of angiogenesis. Methods in Enzymology. 444, 115-158 (2008).
- Liegl, R., Priglinger, C., Ohlmann, A. Induction and readout of oxygen-induced retinopathy. Methods in Molecular Biology. 1834, 179-191 (2019).
- Lutty, G. A., McLeod, D. S. Retinal vascular development and oxygen-induced retinopathy: a role for adenosine. Progress in Retinal and Eye Research. 22 (1), 95-111 (2003).
- Vähätupa, M., et al. Oxygen-induced retinopathy model for ischemic retinal diseases in rodents. Journal of Visualized Experiments: JoVE. (163), (2020).
- Kim, C. B., D'Amore, P. A., Connor, K. M. Revisiting the mouse model of oxygen-induced retinopathy. Eye and Brain. 8, 67-79 (2016).
- Gammons, M. V., Bates, D. O. Models of oxygen induced retinopathy in rodents. Methods in Molecular Biology. 1430, 317-332 (2016).
- Xiao, S., et al. Fully automated, deep learning segmentation of oxygen-induced retinopathy images. Journal of Clinical Investigation Insight. 2 (24), (2017).
- McLeod, D. S., D'Anna, S. A., Lutty, G. A. Clinical and histopathologic features of canine oxygen-induced proliferative retinopathy. Investigative Ophthalmology & Visual Science. 39 (10), 1918-1932 (1998).
- Penn, J. S., Johnson, B. D. Fluorescein angiography as a means of assessing retinal vascular pathology in oxygen-exposed newborn rats. Current Eye Research. 12 (6), 561-570 (1993).
- Mezu-Ndubuisi, O. J., et al. In vivo retinal vascular oxygen tension imaging and fluorescein angiography in the mouse model of oxygen-induced retinopathy. Investigative Ophthalmology & Visual Science. 54 (10), 6968-6972 (2013).
- Zeilbeck, L. F., Müller, B., Knobloch, V., Tamm, E. R., Ohlmann, A. Differential angiogenic properties of lithium chloride in vitro and in vivo. PLoS One. 9 (4), 95546 (2014).
- Walsh, N., Bravo-Nuevo, A., Geller, S., Stone, J. Resistance of photoreceptors in the C57BL/6-c2J, C57BL/6J, and BALB/cJ mouse strains to oxygen stress: evidence of an oxygen phenotype. Current Eye Research. 29 (6), 441-447 (2004).
- Zhang, Q., Zhang, Z. M. Oxygen-induced retinopathy in mice with retinal photoreceptor cell degeneration. Life Sciences. 102 (1), 28-35 (2014).
- Okamoto, N., et al. Transgenic mice with increased expression of vascular endothelial growth factor in the retina: a new model of intraretinal and subretinal neovascularization. The American Journal of Pathology. 151 (1), 281-291 (1997).
- Ohlmann, A., et al. Norrin promotes vascular regrowth after oxygen-induced retinal vessel loss and suppresses retinopathy in mice. The Journal of Neuroscience. 30 (1), 183-193 (2010).
- Fang, L., Barber, A. J., Shenberger, J. S. Regulation of fibroblast growth factor 2 expression in oxygen-induced retinopathy. Investigative Ophthalmology & Visual Science. 56 (1), 207-215 (2014).
- Chan, C. K., et al. Differential expression of pro- and antiangiogenic factors in mouse strain-dependent hypoxia-induced retinal neovascularization. Laboratory Investigation. 85 (6), 721-733 (2005).
- Stahl, A., et al. Postnatal weight gain modifies severity and functional outcome of oxygen-induced proliferative retinopathy. The American Journal of Pathology. 177 (6), 2715-2723 (2010).
- Vanhaesebrouck, S., et al. Association between retinal neovascularization and serial weight measurements in murine and human newborns. European Journal of Ophthalmology. 23 (5), 678-682 (2013).
- Gerschman, R., Nadig, P. W., Snell, A. C., Nye, S. W. Effect of high oxygen concentrations on eyes of newborn mice. The American Journal of Physiology. 179 (1), 115-118 (1954).
- Lange, C., et al. Kinetics of retinal vaso-obliteration and neovascularisation in the oxygen-induced retinopathy (OIR) mouse model. Graefe's Archive for Clinical and Experimental Ophthalmology. 247 (9), 1205-1211 (2009).
- Huang, S., et al. Comparison of dextran perfusion and GSI-B4 isolectin staining in a mouse model of oxygen-induced retinopathy. Eye Science. 30 (2), 70-74 (2015).
- Paques, M., et al. Panretinal, high-resolution color photography of the mouse fundus. Investigative Ophthalmology & Visual Science. 48 (6), 2769-2774 (2007).
- Fletcher, E. L., et al. Animal models of retinal disease. Progress in Molecular Biology and Translational Science. 100, 211-286 (2011).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved