Method Article
ניטור צמיחה דינמית של כלי רשתית במודל עכבר רטינופתיה המושרה על ידי חמצן
In This Article
Summary
פרוטוקול זה מתאר שיטה מפורטת להכנה וצביעה אימונופלואורסצנטית של תושבות שטוחות רשתית של עכברים וניתוח. השימוש באנגיוגרפיה פלואורסצנטית פונדוס (FFA) עבור גורי עכברים ועיבוד תמונה מתוארים בפירוט גם כן.
Abstract
רטינופתיה הנגרמת על-ידי חמצן (OIR) נמצאת בשימוש נרחב לחקר צמיחת כלי דם חריגה במחלות רשתית איסכמיות, כולל רטינופתיה של פגות (ROP), רטינופתיה סוכרתית מתרבה (PDR) וחסימת ורידים ברשתית (RVO). רוב מחקרי OIR מתבוננים בניאו-וסקולריזציה של הרשתית בנקודות זמן ספציפיות; עם זאת, הצמיחה הדינמית של כלי שיט בעכברים חיים לאורך מסלול זמן, החיונית להבנת מחלות כלי הדם הקשורות ל-OIR, לא נחקרה. כאן, אנו מתארים פרוטוקול שלב אחר שלב להשראת מודל עכבר OIR, המדגיש את המלכודות הפוטנציאליות, ומספק שיטה משופרת לכימות מהיר של אזורים של מחיקת כלי דם (VO) וניאו-וסקולריזציה (NV) באמצעות צביעת אימונופלואורסצנציה. חשוב מכך, עקבנו אחר צמיחה מחדש של כלי דם בעכברים חיים מ-P15 עד P25 על-ידי ביצוע אנגיוגרפיה פלואורסצנטית פונדוס (FFA) במודל עכבר OIR. היישום של FFA למודל העכבר OIR מאפשר לנו לבחון את תהליך השיפוץ במהלך צמיחה מחדש של כלי שיט.
Introduction
ניאו-וסקולריזציה של הרשתית (RNV), המוגדרת כמצב שבו כלי דם פתולוגיים חדשים מקורם בוורידים קיימים ברשתית, משתרעת בדרך כלל לאורך המשטח הפנימי של הרשתית וגדלה לתוך הזגוגית (או החלל התת-קרקעי בתנאים מסוימים)1. זהו סימן היכר ומאפיין נפוץ של רטינופתיות איסכמיות רבות, כולל רטינופתיה של פגות (ROP), חסימת ורידים ברשתית (RVO) ורטינופתיה סוכרתית מתפשטת (PDR)2.
תצפיות קליניות וניסיוניות רבות הצביעו על כך שאיסכמיה היא הגורם העיקרי לניאו-וסקולריזציה של הרשתית 3,4. ב- ROP, ילודים נחשפים לחמצן ברמה גבוהה באינקובטורים סגורים כדי להגדיל את שיעורי ההישרדות, שהוא גם מניע חשוב לעצירת צמיחת כלי הדם. לאחר סיום הטיפול, הרשתיות של תינוקות חווים תקופה היפוקסית יחסית5. מצבים אחרים נראים בחסימה של ורידים ברשתית מרכזית או מסועפת ב- RVO ונזק של נימי הרשתית נצפה גם אשר נגרמת על ידי מיקרואנגיופתיה ב PDR2. היפוקסיה מגבירה עוד יותר את הביטוי של גורמים אנגיוגניים כגון גורם גדילה אנדותל וסקולרי (VEGF) דרך מסלול האיתות המושרה על ידי היפוקסיה-1α (HIF-1α) אשר בתורו מנחה את תאי אנדותל כלי הדם לגדול לתוך האזור ההיפוקסי וליצור כלי דם חדשים 6,7.
ROP הוא סוג של רטינופתיה שגשוגית וסקולרית בפגים וגורם מוביל לעיוורון ילדות8,9, המאופיין בהיפוקסיה ברשתית, ניאו-וסקולריזציה של הרשתית והיפרפלזיה סיבית10,11,12. בשנות ה-50 של המאה ה-20, חוקרים מצאו כי ריכוז גבוה של חמצן יכול לשפר באופן משמעותי את התסמינים הנשימתיים של פגים13,14. כתוצאה מכך, טיפול בחמצן היה בשימוש הולך וגובר בפגים באותה תקופה15. עם זאת, במקביל לשימוש הנרחב בטיפול בחמצן בפגים, שכיחות ה-ROP עלתה משנה לשנה. מאז, חוקרים קישרו חמצן ל-ROP, וחקרו מודלים שונים של בעלי חיים כדי להבין את הפתוגנזה של ROP ו-RNV16.
באדם, רוב התפתחות כלי הדם ברשתית מסתיימת לפני הלידה ואילו במכרסמים כלי הדם ברשתית מתפתחים לאחר הלידה, ומספקים מערכת מודל נגישה לחקר אנגיוגנזה בכלי הדם ברשתית2. עם ההתקדמות המתמשכת של המחקר, מודלים של רטינופתיה הנגרמת על ידי חמצן (OIR) הפכו למודלים מרכזיים לחיקוי אנגיוגנזה פתולוגית הנובעת מאיסכמיה. אין מיני בעלי חיים ספציפיים במחקר של מודל OIR והמודל פותח במיני בעלי חיים שונים, כולל חתלתול 17, חולדה18, עכבר19, גור ביגל 20 ודג זברה21. כל המודלים חולקים את אותו מנגנון שבאמצעותו הם נחשפים להיפראוקסיה במהלך התפתחות הרשתית המוקדמת ולאחר מכן מוחזרים לסביבה הנורמוקסית. סמית' ואחרים הבחינו בכך שחשיפת גורי עכברים להיפרוקסיה מ-P7 במשך 5 ימים גרמה לצורה קיצונית של רגרסיה של כלי הדם ברשתית המרכזית והחזרתם לאוויר החדר ב-P12 עוררה בהדרגה ציצים ניאו-וסקולריים, שגדלו לכיוון הגוף הזגוגי19. זה היה דגם עכבר OIR סטנדרטי שנקרא גם כמודל סמית'. Connor et al. המשיכו לייעל את הפרוטוקול וסיפקו שיטה ישימה אוניברסלית לכימות האזור של VO (מחיקה של vaso) ו- NV (neovascularization) בשנת 2009, מה שהגדיל את הקבלה והניצול של מודל22. מודל עכבר OIR הוא עדיין המודל הנפוץ ביותר כיום בגלל גודלו הקטן, רבייה מהירה, רקע גנטי ברור, יכולת חזרה טובה ושיעור הצלחה גבוה.
בעכברים, כלי הדם ברשתית מתחילים לאחר הלידה עם צמיחה של כלי דם מראש עצב הראייה לתוך הרשתית הפנימית לכיוון ora serrata. במהלך התפתחות רשתית תקינה, כלי הרשתית הראשונים נובטים מראש עצב הראייה סביב הלידה, ויוצרים רשת מתרחבת (מקלעת ראשונית) המגיעה לפריפריה סביב היום שלאחר הלידה 7(P7)23. לאחר מכן כלי הדם מתחילים לגדול לתוך הרשתית כדי ליצור שכבה עמוקה, לחדור את הרשתית, וליצור רשת למינרית סביב השכבה הגרעינית הפנימית (INL) כמו באדם24. בסוף השבוע השלישי שלאחר הלידה (P21), פיתוח מקלעת עמוקה יותר כמעט הושלם. עבור מודל עכבר OIR, חסימת כלי הדם מופיעה תמיד ברשתית המרכזית בגלל התנוונות מהירה של מספר רב של רשתות כלי דם לא בשלות באזור המרכז במהלך חשיפה להיפרוקסיה. לכן, הצמיחה של neovascularization פתולוגי מתרחשת גם ברשתית ההיקפית האמצעית, שהיא הגבול של האזור שאינו זלוף ואת אזור כלי הדם. עם זאת, כלי רשתית אנושיים כמעט נוצרו לפני הלידה. באשר לפגים, הרשתית ההיקפית אינה וסקולרית לחלוטין כאשר היא נחשפת להיפרוקסיה25,26. אז חסימת כלי דם וניאו-וסקולריזציה מופיעות בעיקר ברשתית ההיקפית27,28. למרות הבדלים אלה, מודל OIR העכבר משחזר מקרוב את האירועים הפתולוגיים המתרחשים במהלך ניאו-וסקולריזציה הנגרמת על ידי איסכמיה.
ניתן לחלק את האינדוקציה של מודל OIR לשני שלבים29: בשלב 1 (שלב היפרוקסיה), התפתחות כלי הדם ברשתית נעצרת או מפגרת עם חסימה ורגרסיה של כלי הדם כתוצאה מהירידה ב- VEGF והאפופטוזיס של תאי האנדותל 24,30; בשלב 2 (שלב ההיפוקסיה), אספקת החמצן ברשתית תהפוך לבלתי מספקת בתנאי אוויר בחדר29, החיוניים להתפתחות עצבית ולהומאוסטזיס 19,31. מצב איסכמי זה גורם בדרך כלל לניאו-וסקולריזציה לא מפוקחת ולא תקינה.
נכון לעכשיו, שיטת המידול הנפוצה היא חשיפה לחמצן גבוה/נמוך לסירוגין: אמהות והגורים שלהן נחשפים ל-75% חמצן במשך 5 ימים ב-P7 ולאחר מכן 5 ימים באוויר החדר עד ש-P17 הדגים תוצאות דומות22, שהיא נקודת הקצה של אינדוקציה של מודל עכבר OIR. (איור 1). בנוסף להדמיית ROP, זה neovascularization פתולוגי בתיווך איסכמיה יכול לשמש גם כדי לחקור מחלות רשתית איסכמיות אחרות. המדידות העיקריות של מודל זה כוללות כימות השטח של VO ו- NV, אשר מנותחים מתוך תושבות שטוחות רשתית על ידי צביעת אימונופלואורסצנציה או זלוף FITC-dextran. כל עכבר יכול להיחקר רק פעם אחת בגלל הפעולה הקטלנית. כיום, ישנן כמה שיטות לבחון שינויים דינמיים של כלי הדם ברשתית ברציפות במהלך תהליך של רגרסיה וסקולרית ואנגיוגנזה פתולוגית32. במאמר זה, אנו מספקים פרוטוקול מפורט של אינדוקציה של מודל OIR, ניתוח של תושבות שטוחות ברשתית, כמו גם זרימת עבודה של אנגיוגרפיה פלואורסצנטית פונדוס (FFA) על עכברים אשר יהיה מועיל להשיג הבנה מקיפה יותר של שינויים דינמיים של כלי הדם במהלך שני שלבים של מודל עכבר OIR.
Protocol
כל ההליכים הכרוכים בשימוש בעכברים אושרו על ידי ועדת האתיקה הניסויית בבעלי חיים של מרכז העיניים Zhongshan, אוניברסיטת סון יאט-סן, סין (מספר מורשה: 2020-082), ובהתאם להנחיות המאושרות של ועדת הטיפול והשימוש בבעלי חיים של מרכז העיניים Zhongshan והצהרת האגודה לחקר ראייה ועיניים (ARVO) לשימוש בבעלי חיים בחקר עיניים וראייה.
1. אינדוקציה של מודל OIR עכבר
- השתמש בעכברים עם שיעור נמוך יותר של מום מולד בעיניים, למשל עכברי C57BL/6J, והזדווג איתם ביחס של זכר/נקבה = 1:2. קבלו את הגורים שנולדו באותו היום והתחילו לגרום למודל OIR ב-P7. תעדו את משקל הגוף של גורי עכברים בקפדנות לפני הדוגמנות.
הערה: שים לב ליום הלידה כ- P0. רשום את המשקל של כל עכבר באופן קבוע. משקל הגוף של גורים שזה עתה נולדו חשוב מאוד במהלך אינדוקציה של OIR כמו הרגישות של עכברים במצבים שונים לחמצן שונה. אל תכלול את הגורים במשקל של יותר מ-5 גרם ב-P7 כדי להבטיח תוצאות דומות. - לספק סביבת מחיה מתאימה לאמהות מניקות ולגורים שלהן, כגון קביעת הטמפרטורה על 23 מעלות צלזיוס ± 2 מעלות צלזיוס, שליטה על הלחות ב -40%-65%, לסירוגין 12 שעות של אור ו -12 שעות של חושך מדי יום, הוספת צמר גפן לכלוב לקינון, הבטחת מזון ומים מעוקרים מספיקים, ושמירתם בכלובים מאווררים בנפרד (IVC).
- עקוב אחר רמת הלחות והטמפרטורה בתוך התא. לשלוט על הלחות בין 40% ל 65% ולשמור על הטמפרטורה ב 23 °C ± 2 °C (76 °F).
- בדוק את אספקת החמצן באמצעות חיישני חמצן, שמור על רמת חמצן קבועה של 75% ושלוט בקצב זרימת החמצן ב 0.5-0.75 ליטר לדקה. שים 50 גרם סודה ליים בתחתית התא כדי לספוג CO2 עודף ולשמור על ערכי CO2 מתחת 3%22.
- עקוב אחר התנהגויות של אמהות מניקות כגון התנהגות בניית קן, נשיכת הגורים שלהן וסירוב להנקה לפחות פעם ביום. לחסל אמהות מיניקות עם אמהות ענייה.
- הכניסו את גורי ה-P7 (זכר ונקבה) ואת האימהות המניקות שלהם לתא חמצן שבו רמת החמצן היא 75% למשך 5 ימים עד P12. הימנע פתיחה מיותרת של החדר במהלך תקופת אינדוקציה המודל. יש לוודא כי ישנן אמהות פונדקאיות נוספות להחלפה, למקרה שהאמהות המניקות ימותו עקב פגיעה בריאות בזמן שהן נמצאות בהיפרוקסיה.
הערה: כדי להבטיח את יכולת ההשוואה של הניסוי, הגבל את המספר ל-6-8 גורים עבור כל אם. שימו לב לבעיה הפוטנציאלית של רעילות חמצן, הגורמת למוות של כמה אמהות מיניקות. הסימנים לפגיעה ריאתית היפראוקסית אצל אמהות מניקות כוללים, בין היתר, תנודות בקצב הנשימה, ירידה בפעילות וירידה בהאכלה. כאשר התופעה הנ"ל מתרחשת, להרדים את האם המניקה עם 1% נתרן pentobarbital (50 מ"ג / ק"ג) בהקדם האפשרי. הכינו כמה אמהות פונדקאיות, למשל, 129S1/SvImJ להחלפה והשתמשו בהן רק במידת הצורך. לא מומלץ להחליף אמהות מניקות כשגרה, שכן הדבר יוביל לפתיחה תכופה של תא חמצן, וכתוצאה מכך לרמות חמצן לא יציבות ותוקפנות אימהית. - החזירו את הגורים ואת אמהותיהם המניקות לאוויר החדר ב-P12 ועקבו אחר משקלם של כל הגורים ברציפות עד ל-P17. קבץ את הגורים לפי המשקל כדי להבטיח שלכל קבוצת ניסוי תהיה חלוקת משקל דומה.
2. הכנת תושבות שלמות ברשתית וכתמים אימונופלואורסצנטיים
- רשמו את משקל הגוף של הגורים. הקריבו את הגורים על ידי מנת יתר של חומר הרדמה (1% נתרן פנטוברביטל 50 מ"ג/ק"ג) או שאיפת CO2 . שיטות אחרות של המתת חסד, כגון פריקת צוואר הרחם וכריתת בית החזה הדו-צדדית, ניתן להשתמש במידת הצורך.
- השתמש במספריים מעוקלים כדי לשחרר את הקשר בין גלגלי העין לרקמה מסלולית. לאחר מכן, הכניסו מלקחיים מעוקלים לחלק האחורי של גלגל העין, הידקו את עצב הראייה והרימו במהירות את העין מהמסלול. יש לשטוף את גלגלי העיניים במלח זרחתי (PBS) מקורר מראש כדי להסיר את השיער והדם מפני השטח של גלגלי העיניים.
- הניחו את גלגלי העיניים המנוקים בצינור מיקרוצנטריפוגה בגודל 2 מ"ל מלא ב-4% פרפורמלדהיד (PFA) ודגרו במשך 15 דקות בטמפרטורת החדר על שייקר במהירות של 12-15 סיבובים לדקה (סל"ד) (קיבוע ראשוני).
אזהרה: פרפורמלדהיד ידוע כאלרגני, רעיל בדרך כלל וציטוטוקסי ביותר. יש להקפיד על הוראות הבטיחות ולהימנע משאיפה וממגע עם העור. - השתמשו בצלחת תרבית והכניסו טיפה של 1x PBS לחלק המרכזי ובצעו את השלבים הבאים תחת מיקרוסקופ מנתח והניחו גלגל עין אחד בטיפה זו. החזיקו את גלגל העין עם זוג מלקחיים ונקבו בזהירות את הקרנית בלימבוס הקרנית באמצעות מחט מזרק של 1 מ"ל. מכניסים את קצה המספריים לחור הזה וחותכים את הקרנית בזהירות לאורך הלימבוס של הקרנית. היזהר לא לחתוך את הרשתית.
- הסר את הקשתית ואת העדשה עם זוג מלקחיים. לאחר מכן מניחים את ה-eyecup הנותר ב-PFA של 4% ומתקנים שוב למשך 45 דקות נוספות בטמפרטורת החדר על שייקר במהירות של 12-15 סל"ד (קיבוע משני).
- השתמשו בצלחת תרבית והכניסו טיפה של 1x PBS לחלק המרכזי. מניחים את גלגל העין הקבוע בטיפה זו. החזיקו את גלגל העין עם זוג מלקחיים. מפרידים בעדינות את שכבות הרשתית והסקלרה באמצעות שני מלקחיים. מניחים את קצה המספריים בין שכבות הרשתית והסקלרה וחותכים את הסקלרה לכיוון עצב הראייה. מקלפים את הסקלרה מהרשתית ומקבלים את הרשתית.
הערה: החזיקו את הגביע האחורי על ידי עצב הראייה בעזרת מלקחיים, ולאחר מכן השתמשו בקצה המעוקל של מלקחיים נוספים כדי ללחוץ על הסקלרה בראש עצב הראייה ולעסות בעדינות את הרשתית בתנועת טאטוא קדימה כחלופה לשחרור הרשתית. - השתמשו במלקחיים כדי לשחרר את החיבור בין כלי היאלואיד רדיאליים לרשתית ההיקפית, הידקו את שורש כלי ההיאלואיד הקרוב לראש עצב הראייה, וחתכו את כלי הדם ההיאלואידיים בזהירות.
- יש להשתמש בפיפטה של 2 מ"ל כשהקצה חתוך כדי להעביר את הרשתית. מניחים את הרשתית לתוך באר אחת בצלחת של 48 באר ושוטפים אותה במשך 3 x 5 דקות עם 1x PBS בטמפרטורת החדר על שייקר במהירות של 12-15 סל"ד.
- לדגום את הרשתית בתמיסה מעורבת של 1% טריטון X-100 (ב-PBS) ו-5% סרום חמור רגיל (ב-PBS) למשך הלילה ב-4 מעלות צלזיוס.
- לחלופין, יש לחסום ולחדור לרשתיות בטמפרטורת החדר למשך שעה כחלופה. שינוי סרום חוסם בהתאם למקור הנוגדן המשני.
- אם מתייגים את כלי הדם ברשתית באמצעות איזולקטין B4, דגרו את הרשתית בבאר של 48 סרום חמור רגיל עם סרום חמור רגיל של 0.1% (400 μL) ואיזולקטיןB4-594 (1:400) למשך הלילה בטמפרטורה של 4 מעלות צלזיוס על שייקר במהירות של 12-15 סל"ד.
הערה: אם אתה מתייג את כלי הדם עם סמנים אחרים, כגון CD31, או מתייג תאים אחרים, השתמש בנוגדנים ראשוניים ספציפיים כדי לסמן אותם. - לדגום את הרשתית עם נוגדנים ראשוניים ספציפיים 1:100-1:500 (בסרום חמור רגיל של 400 μL 0.1%) בטמפרטורה של 4 מעלות צלזיוס על שייקר במהירות של 12-15 סל"ד למשך 48 שעות (אופציונלי)
- לאחר החזרה לטמפרטורת החדר, יש לשטוף את הרשתית עם 0.1% PBST (0.1% TritonX-100 ב-PBS) למשך 3 x 20 דקות על שייקר במהירות של 12-15 סל"ד.
- לדגום את הרשתית עם 1:1,000 נוגדנים משניים (ב 400 μL 0.1% סרום חמור רגיל) לילה ב 4 מעלות צלזיוס על שייקר במהירות של 12-15 סל"ד. (אופציונלי)
- לחלופין, יש לדגור על הרשתית עם נוגדנים משניים בעלי זיקה גבוהה בטמפרטורת החדר למשך שעה.
- דגרו את הרשתית עם DAPI (1:1,000) בטמפרטורת החדר למשך 20-25 דקות כדי לסמן את הגרעין.
הערה: בדוק את יחסי הדילול האופטימליים עבור כל הנוגדנים המשמשים בשלבים 10-11 ו- 13-14 לפני הניסוי. - שטפו את הרשתית במשך 3 x 30 דקות עם PBST של 0.1% על שייקר במהירות של 12-15 סל"ד בטמפרטורת החדר.
- מעבירים את הרשתית למגלשה נקייה כשהפתח פונה כלפי מעלה. חתכו את הרשתית באופן רדיאלי בעמדות 3, 6, 9 ו-12 מהיקפית למרכז על ידי חיתוך במרחק של כ-1-1.5 מ"מ מראש עצב הראייה.
- הוסיפו כמה טיפות של 1x PBS כדי לשטוף את הרשתית שלוש פעמים. השתמש בנייר מונח אוויר כדי לייבש ולשטח את הרשתית. הוסיפו טיפה של מדיום הרכבה (ראו טבלת חומרים) למרכז הכיסוי והפסיקו להוסיף אותה עד שקוטר הטיפה יעלה למחצית מהכריכה. הפכו במהירות את הכיסוי והניחו אותו על גבי הרשתית החיצונית. הימנעו מיצירת בועות.
- צלם תמונות של התושבות השטוחות של הרשתית או אחסן והגן על השקופיות מפני אור בטמפרטורה של 4 מעלות צלזיוס.
3. ניתוח וכימות של תושבות שטוחות רשתית
הערה: עבור מודל עכבר OIR, החוקרים רושמים לעתים קרובות את האזור של חסימת כלי הדם ברשתית המרכזית ואת הניאו-וסקולריזציה הפתולוגית של הרשתית ההיקפית במהלך P12-P25. מחקרים קודמים הראו כי האזור הווסקולרי המרכזי של הרשתית מגיע למקסימום ב- P12 ומתכווץ בהדרגה מ- P13 ל- P17; במקביל, הרשתית של עכברי OIR מגיעה לשיא אזור הניאו-וסקולריזציה בסביבות P1722,29. מ- P17, הניאו-בסים נסוגים בהדרגה וכלי הדם הפונקציונליים צומחים מחדש לאזור הוואסקולרי. כלי הדם ברשתית בעצם חוזרים לנורמה ב-P2533.
- צלם תמונות של תושבות שטוחות רשתית באמצעות מיקרוסקופ פלואורסצנטי (ראו טבלת חומרים) עם עדשה אובייקטיבית של פי 10. ראשית, בחר את ערוץ DAPI וקבע את ראש עצב הראייה במרכז שדה הראייה. לאחר מכן, התאימו ערוצים אחרים והתמקדו בכלי הדם השטחיים של הרשתית. בדוק אריחים בתוכנת תמונות (ראה טבלת חומרים) והגדר את מספר התמונות שיש לתפור. לחץ על התחל ניסוי כדי ללכוד את כל הרשתית.
- השתמש בתוכנית עיבוד תמונה (ראה טבלת חומרים) כדי לכמת את האזור של מחיקת כלי דם (VO) וניאו-וסקולריזציה (NV) לאחר צביעת אימונופלואורסצנציה.
- ראשית, לחץ על הכלי מטה הקסם והגדר סובלנות מתאימה בהתאם להבדל הבהירות והזז את הסמן לרקע ולחץ על העכבר. לאחר מכן, בחר הפוך כדי לקבל חלוקה לרמות בסיסית של הרשתית. השתמש בכלי לאסו כדי להמשיך ולתאר את פרטי הרשתית. באמצעות פונקציית היסטוגרמה , רשום את ערך הפיקסלים של הרשתית כולה וכתוב אותו או צור טבלה בתוכנית מסד נתונים.
- מחלקים את תמונת הרשתית לארבעה רבעים. בכל רבע, השתמשו בכלי לאסו כדי לצייר את אזור ה-VO (איור 2A-C), והשתמשו בכלי מטה הקסם כדי לבחור את אזור ה-NV (איור 2D-F). באמצעות נתוני הפיקסלים בהיסטוגרמה, חשב את יחס הפיקסלים של VO ו- NV לכל הרשתית, כלומר, אחוז שטח VO או NV ביחס לרשתית כולה.
הערה: יש גם צינור קוד פתוח ואוטומטי לחלוטין לכימות אזורי VO ו- NV בתמונות OIR באמצעות רשתות עצביות של למידה עמוקה (http://oirseg.org/), המספק דרך אמינה וחוסכת זמן לחוקרים, כמו גם מאחד את הסטנדרט של הכימות34.
- הקלט נתוני פיקסלים בטבלת גיליון אלקטרוני, הנוחה לניתוח הבא.
4. הדמיית In vivo עם אנגיוגרפיה פלואורסצנטית פונדוס (FFA)
הערה: עבור עכברי OIR, ניתן להשתמש הן בפרפוזיה של FITC והן בכתמים אימונופלואורסצנטיים רק פעם אחת בגלל מותם של חיות ניסוי. בהשוואה לכך, אחד היתרונות של FFA הוא תצפית על השינויים הדינמיים של כלי הרשתית של עכברים במהלך הפיתוח והמצב הפתולוגי in vivo35,36.
- שקלו את הגורים לפני ההרדמה.
- הרדמת גורים בהזרקה תוך-צפקית של 0.3% נתרן פנטוברביטל במינון של 30-50 מ"ג/ק"ג.
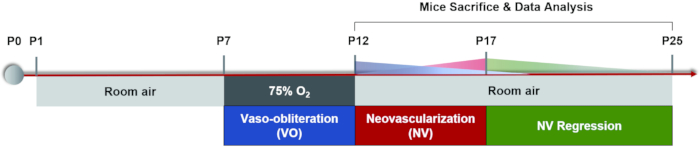
הערה: לעכברים בתוך חודש אחד, שימו לב למינוני ההרדמה. השתמש בריכוזים ובמינונים נמוכים יותר של חומר הרדמה כדי להפחית את מותם של עכברים הנגרם על ידי הרדמה. לאחר הרדמת הגורים, השתמשו בכרית חימום קטנה כדי לשמור על טמפרטורת הגוף. היפותרמיה לא רק משפיעה על התפקוד הפיזיולוגי של הגורים, אלא גם מובילה לשינויים בקריסטלין ומאיצה את התפתחות הקטרקט. - השתמשו ב-20 μL טיפות עיניים מידריאטיות (0.5% טרופיקמיד + 0.5% פנילפרין הידרוכלוריד) עבור כל גור והמתינו 5 דקות כדי להשיג התרחבות אישונים לאורך זמן (איור 3A,B).
- הביאו את הגורים המורדמים לפני מכשיר ההדמיה (ראו טבלת חומרים). השאירו את הגורים על כרית חימום קטנה, הניחו את הגורים בתנוחה יציבה והשתמשו בקרעים מלאכותיים באופן קבוע כדי לשמור על לחות בקרנית. לחץ על מצב הדמיית פונדוס אינפרא אדום (IR) כדי להתאים את ראש עצב הראייה למרכז המסך.
הערה: כאשר מתבוננים בעין אחת של הגורים, אל תשכחו להגן על העין השנייה. השתמשו בטיפות עיניים היפרומלוז כדי למנוע מהקרנית להלבין עקב יובש. - לאחר הזרקה תוך צפקית של 0.15 מ"ל תמיסת מלח נתרן פלואורסצין 0.5%, לחץ על כפתור FA ועל כפתור ההזרקה מיד בלוח המגע של מכשיר ההדמיה כדי להתחיל בתזמון. הקלט את התמונות לאחר 3 דקות כאשר זרימת הדם של הרשתית נכנסת לשלב הוורידי ולבחון את הרשתית לא פחות מ 6-8 דקות.
הערה: לאחר הזרקה תוך-צפקית של תמיסת מלח נתרן פלואורסצין, העור, הרירית והשתן של הגורים מראים ירוק צהבהב ברור. רוב הפלואורסצין מופרש על ידי הגורים תוך יום. הזרקת נתרן פלואורסצין תוך צפק כל יומיים במשך שש פעמים אינה גורמת לתופעות לוואי משמעותיות37. - הזז את ראש עצב הראייה למרכז אזור רכישת התמונה וצלם את התמונה הראשונה של הרשתית המרכזית. לאחר מכן, הזז את העדשה של מכשיר ההדמיה אופקית לצד האף של העין עד שראש עצב הראייה ממוקם בנקודת האמצע של צד אחד של אזור רכישת התמונה וצלם את התמונה השנייה. המשיכו לצלם תמונות של הרשתית הטמפורלית, העליונה והנחותה, בהתאמה בשיטה זו (איור 3C).
הערה: צלם תמונות "עם חמישה כיוונים" תוך 12 דקות כאשר שלב הרגרסיה מתרחש. המיקום של ראש עצב הראייה בתמונה נחותה מותר לא ליפול על הצד בשל התאמת זווית מוגבלת של העדשה. - שמור את התמונות והשתמש בתוכנית עיבוד תמונה לתפירה.
5. עיבוד תמונה של אנגיוגרפיה פלואורסצנטית פונדוס (FFA)
- פתח את תוכנית עיבוד ההדמיה ולחץ על חדש בקובץ כדי ליצור בד ציור חדש עם רקע שחור (איור 4A).
- פתחו תמונה של הרשתית המרכזית תחילה בשכבת הרקע. לחץ על קובץ והוסף את התמונה השנייה. התאימו את האטימות של התמונה השנייה ל- 60%, הזיזו את התמונה השנייה ושנו את גודלה עד שאותם חלקים של שתי התמונות יחפפו מאוד. לחץ על הלחצן עבור בין מצבי שינוי צורה ועיקום חופשיים ובצע התאמות עדינות בכלי השיט במידת הצורך. לאחר מכן, החזירו את האטימות של התמונה השנייה ל-100% (איור 4A,B).
- בחרו שתי תמונות בו-זמנית ולחצו על 'מיזוג שכבות אוטומטי'. בדוק את פנורמה כשיטת המיזוג וכן בחר את שני המשפטים הבאים. לחץ על אישור וסיים את תפירת התמונה של שתי התמונות הראשונות (איור 4C,D).
- קח את שתי התמונות התפורות הראשונות כמכלול, הוסף את התמונה השלישית והמשך למזג. חזור על השיטות לעיל כדי להשלים את התפירה של חמש תמונות (איור 4E).
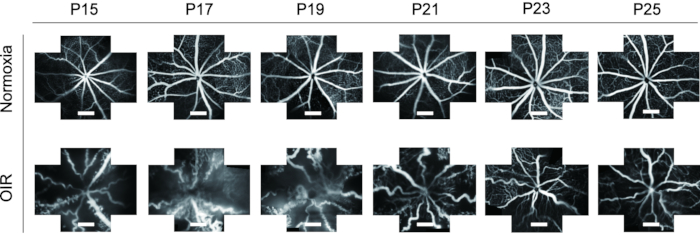
- השתמש בכלי החיתוך כדי לחתוך תמונות של FFA בנקודות זמן שונות לגודל אחיד ולבחון שינויים דינמיים של כלי הדם ברשתית מ- P15 ל- P25 הן בגורים רגילים והן בגורים OIR.
6. ניתוח סטטיסטי
- הצגת ערכים כממוצע ± סטיית תקן (s.d.).
- השתמש במבחן t של סטודנט כדי להשוות בין שתי דגימות בלתי תלויות. השתמש ב- ANOVA חד-כיווני כדי להשוות קבוצות מרובות של נתונים ולשלב עם המבחן של Dunnett או Tukey, שהוא מבחן השוואה מרובה נפוץ.
- עבור נתונים שאינם מופצים בדרך כלל, השתמש במבחן Mann-Whitney U או במבחן Kruskal Wallis. שקול הבדלים סטטיסטיים משמעותיים כאשר P < 0.05.
תוצאות
במודל עכבר OIR, התוצאה החשובה והבסיסית ביותר היא כימות אזור ה- VO וה- NV. לאחר שחיו בסביבת היפרוקסיה במשך 5 ימים מ-P7, הרשתית המרכזית של הגורים הראתה את האזור הגדול ביותר ללא זילוף. תחת גירוי של היפוקסיה בעוד 5 ימים, neovascularization הרשתית הופק בהדרגה אשר פלואורסצנטי בעוצמה רבה יותר מאשר סביב כלי הדם הרגילים. לאחר P17, האות הפלואורסצנטי של ניאו-וסקולריזציה פתולוגית נסוג במהירות עם השיפוץ של הרשתית (איור 5A). על-ידי שליטה בגודל ההמלטה ובעלייה במשקל לאחר הלידה של הגורים, האזור של ה-VO וה-NV במודל עכברי OIR הראה יכולת חזרה ויציבות טובות, ושיא הניאו-וסקולריזציה של הרשתית התרחש ב-P17, מה שהיה תואם למחקרים הקודמים (איור 5B,C).
FFA הוא כלי אידיאלי לחקר כלי הדם ברשתית. בהתחשב ביישום של FFA in vivo, הוא מראה הפחתה גדולה בפסולת של חיות ניסוי, כמו גם מציג את השינויים הדינמיים של כלי הרשתית עם הזמן. במחקרים קודמים, FFA לא שימש לעתים קרובות בגורי עכברים והוצג בתמונה חד-פעמית, מה שהיה קשה למחקר נוסף. בפרוטוקול זה, התמונות "בעלות חמשת הכיוונים" של כלי הדם ברשתית נתפרו יחד באמצעות תוכנת עיבוד תמונה כדי להציג שדה רחב יותר של הרשתית בבת אחת, מה שהיה מועיל לניתוח הבא, במידת הצורך (איור 4). חוץ מזה, גורי עכברי OIR הראו פתיחת עיניים ממושכת ולכן תמונות ה- FFA נלקחו מ- P15 כדי לעמוד בדרישות של אתיקה של בעלי חיים. ברשתית של מודל עכבר OIR, קוטר כלי הדם גדל ככל הנראה והפך מפותל מאוד בהשוואה לעכברים רגילים. חוץ מזה, ה-FFA הראה מגמה דומה של שינויים דינמיים של כלי הדם ברשתית עם צביעה אימונופלואורסצנטית עם איזולקטין B4-594 מ-P15-P25 ללא מותם של הגורים (איור 6).
איור 1: שרטוט מצויר של מודל עכבר OIR. מודל עכבר OIR הושרה על ידי החזקת גורים ואמהותיהם המניקות בחדר במשך זמן מה (P0-P7). ב-P7, שניהם נחשפו ל-75% חמצן במשך 5 ימים, מה שעיכב את צמיחת כלי הדם ברשתית וגרם לאובדן כלי דם משמעותי ברשתית המרכזית. לאחר מכן הוחזרו עכברים לאוויר החדר ב-P12 והרשתית האווסקולרית החלה להיות היפוקסית יחסית, מה שגרם הן לצמיחה תקינה של כלי הדם והן לתגובה פתולוגית סביב הרשתית האמצעית-היקפית. הניאו-וסקולריזציה המקסימלית (NV) נראתה ב-P17. לאחר מכן, ניאו-וסקולריזציה פתולוגית עברה תהליך של רגרסיה ספונטנית. מערכת כלי הדם ברשתית חזרה לקדמותה בסביבות P25. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 2: מדידת כריתת כלי דם (VO) וניאו-וסקולריזציה (NV) ברשתית העכבר. (A) תמונה של 10x P12 OIR רשתית שלמה מוכתמת עבור תאי אנדותל עם איזולקטין B4-594. (B) צילום מסך של רשתית עם אזור האבסקולרי שנבחר. הכלים הדרושים לביצוע מדידה זו מודגשים בחצים לבנים: הכלי מטה הקסם וכלי הלאסו. (C) סמן את האזור האווסקולרי של הרשתית ושמור את התמונה כעותק. (D) תמונה של 10x P17 OIR רשתית שלמה מוכתמת עבור תאי אנדותל עם איזולקטין B4-594. (E) צילום מסך של רשתית עם ציצים ניאו-וסקולריים שנבחרו. השתמשו בכלי מטה הקסם והגדירו סבילות אופטימלית כדי להדגיש את ה-NV. הגדר את הרגישות ל- 3-5 וסמן את תיבות ההחלקה והרצף. (F) שמור את אזור הניאו-וסקולריזציה רק כעותק. סרגלי קנה מידה מייצגים 1,000 מיקרומטר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
איור 3: רכישת תמונות "חמישה כיוונים" ברשתית העכבר. (A) אישון העכבר הרגיל. (B) תלמיד עכבר במידריאזיס. (C) נאספו תמונות "חמשת הכיוונים" של האזור המרכזי, האף, הטמפורלי, העליון והתחתון של הרשתית, בהתאמה (גורי P17 באוויר החדר). סרגלי קנה מידה מייצגים 500 מיקרומטר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 4: זרימת עבודה כללית של תפירת תמונות "חמישה כיוונים" מאנגיוגרפיה פלואורסצנטית פונדוס (FFA). (A) צור בד ציור חדש עם רקע שחור ופתח את תמונת ה- FFA של הרשתית המרכזית. (B) לפתוח תמונת FFA של הרשתית הטמפורלית ולהתאים את אטימות התמונה השנייה ל-60%; הזיזו את התמונה ושנו את גודלה עד שאותם חלקים של שתי התמונות יחפפו מאוד. לחצו על ' עבור בין מצבי שינוי צורה חופשי' ו'עיקום ' כדי לבצע התאמות עדינות במידת הצורך. הפוך את האטימות של התמונה השנייה בחזרה ל- 100%. (C) בחרו שתי תמונות בו-זמנית ולחצו על 'מיזוג שכבות אוטומטי'. (D) השתמש בפנורמה כשיטת המיזוג לסיום תפירת התמונה של שתי התמונות הראשונות. (E) המשך לתפור תמונות על ידי חזרה על השיטות לעיל כדי להשלים את התפירה של כל התמונות. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 5: כימות של מחיקת כלי דם (VO) וניאו-וסקולריזציה (NV) ברשתית של מודל עכבר OIR. (A) תמונה של 10x תושבות שלמות של רשתית OIR מוכתמות עבור תאי אנדותל עם איזולקטין B4-594 מ-P12 עד P25. לאחר שנחשפו ל-75% חמצן במשך 5 ימים, הגורים ואמהותיהם המניקות הוחזרו לאוויר החדר ב-P12, שם אזור ההכחדה של כלי הדם הגיע למקסימום. ההיפוקסיה היחסית ברשתית המרכזית הובילה לצמיחה מחודשת של כלי הדם באזור זה, כמו גם לאנגיוגנזה פתולוגית ברשתית ההיקפית האמצעית. ב-P17, ציצים ניאו-וסקולריים טרום-רשתית הגיעו למקסימום ואז התכווצו במהירות. NV נסוג לחלוטין והרשתית נראתה תקינה בסביבות P25. (B) כימות האזור של VO הראה שיא ב-P12 והיעלמות בסביבות P25. (C) כימות האזור של NV הראה שיא ב-P17 ורגרסיה בסביבות P25. סרגלי קנה מידה מייצגים 1,000 מיקרומטר ב- A. (ANOVA חד-כיווני, *P < 0.05, **P < 0.01, ***P < 0.001, **** P < 0.0001). אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
איור 6: הדמיה in vivo של אנגיוגרפיה פלואורסצנטית פונדוס (FFA) במודל עכבר OIR. ברשתית של מודל עכבר OIR, קוטר כלי הדם גדל ככל הנראה והפך מפותל מאוד בהשוואה לעכברים רגילים. חוץ מזה, ה-FFA הראה מגמה דומה של שינויים דינמיים של כלי הדם ברשתית עם צביעה אימונופלואורסצנטית עם איזולקטין B4-594 מ-P15-P25 ללא מוות של גורי עכברים. סרגלי קנה מידה מייצגים 500 מיקרומטר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
Discussion
הרגישות של עכברים ל- OIR מושפעת מגורמים רבים. לא ניתן להשוות בין גורים בעלי רקע גנטי וזנים שונים. בעכברי לבקנים BALB/c, כלי הדם צומחים מחדש לאזור ה-VO במהירות עם הפחתה משמעותית של ציצים ניאו-וסקולריים38, מה שמביא כמה קשיים למחקר. בעכברי C57BL/6 יש נזק מוגבר לפוטורצפטור בהשוואה לזן עכבר BALB/cJ39,40. כנ"ל לגבי סוגים שונים של עכברים מהונדסים41,42,43. חוץ מזה, עכברי C57BL/6 מציגים רמה נמוכה יותר של אנגיוגנזה בהשוואה לעכברי 129S3/SvIM44.
עלייה במשקל לאחר הלידה (PWG) חשוב גם לשקול45 והוא אחד האינדיקטורים כדי להעריך את המצב התזונתי של תינוקות. זה גם הפך לשיטה אמינה לחזות ROP, אשר מושך את תשומת הלב של מודלים בעלי חיים רבים46. PWG משפיע על התגובה של עכברים היפרוקסיה והיפוקסיה. ב-P7, גורים עם משקל גוף מוגבר (>5 גרם) מראים העלמת כלי דם וניאו-וסקולריזציה של הרשתית במידה לא מספקת, בעוד שגורים עם ירידה במשקל הגוף (<5 גרם) מראים תגובה ברורה להיפרוקסיה והיפוקסיה. חוץ מזה, ב-P17, גורים עם עלייה נמוכה (<5 גרם) ועלייה נרחבת במשקל (>7.5 גרם) מראים ירידה ב-NV. עם זאת, לגורים עם עלייה נמוכה במשקל (<5 גרם) יש שלב ממושך באופן משמעותי של כריתת כלי דם (VO) וניאו-וסקולריזציה (NV) עם עיכוב בהתרחשות של NV שיא45. לכן, יש צורך להקליט ולשלוט ב-PWG של גורים ב-P7 וב-P17 ולחסל גורים עם PWG נמוך (< 6 גרם ב-P17) כדי להבטיח את יכולת החזרה וההשוואה של הניסוי.
לגודל ההמלטה יש השפעה גדולה יותר על PWG, וכמה חוקרים מציעים שיש להגביל אותו ל-6-8 גורים/סכר כדי לעמוד בדרישות עבור PWG22,31. גם מצבה של האם המניקה זקוק להתייחסות. אמהות מניקות נוטות יותר למות מנזק לריאות בסביבה היפראוקסית47. אם אמהות מניקות מתות או מזניחות את הגורים שלהן במהלך ואחרי השראת OIR, גורים בקלות לרדת במשקל או אפילו למות בגלל חוסר תזונה32. לכן, יש צורך להבטיח כי יש מספיק אמהות פונדקאיות כדי להחליף אותם. עם זאת, אמהות פונדקאיות אלה מוצעים לשמש רק כאשר האם פג, אשר בדרך כלל קורה במהלך התקופה של חשיפה hyperoxia או לחזור לאוויר החדר22. אספקת מזון הולם לאמהות מניקות עוזרת גם לשפר את המצב התזונתי של הגורים שלהן.
הערה שימושית להכנת התושבות השטוחות של הרשתית היא שזמן קיבוע אופטימלי נחוץ בדרך כלל להכתמה ממושכת נוספת. כעכברים של P12-P25, קיבוע של 15 דקות + 45 דקות בטמפרטורת החדר מומלץ29. תיקון הרשתית ב 4 מעלות צלזיוס בלילה היא חלופה אם הזמן מוגבל. חוץ מזה, המאגר החדיר והחוסם עם ריכוז גבוה יותר של 1% טריטון X-100 ו-5% סרום חמורים רגיל מפחית ביעילות את הרקע של צביעת אימונופלואורסצנציה על פי הניסיון שלנו.
צביעת איזולקטין B4 וזלוף FITC-dextran הן שיטות נפוצות להדמיה וכימות של48,49 כלי הדם. מגבלה מרכזית של שתי השיטות הללו היא שיש להקריב את העכברים. לכן, השיטות להדמיה in vivo וכימות של NV נדרשים29. Paques et al. פיתחו טכניקה בשם הדמיית אנדוסקופיה פונדוס מקומית (TEFI), המספקת תצלומים דיגיטליים ברזולוציה גבוהה של הרשתית בעכברים חיים50. ה- TEFI יכול לזהות שינויים בכלי הדם ברשתית כבר ב- P15 והתמונות המתקבלות תואמות את שיטות ההערכה המקובלות. לאחר מכן, Mezu-Ndubuisi et al. סיפקו את השיטות למדידות מתח חמצן של כלי דם ברשתית in vivo (PO2) ואנגיוגרפיה פלואורסצנטית (FA), ושיפרו את ההבנה של שינויים בכלי הדם ברשתית ושינויים בחמצון עקב ROP ומחלות רשתית איסכמיות אחרות37. למרות שלא TEFI ולא FA מדויקים כמו שיטות קונבנציונליות, הם מפחיתים את המוות של חיות ניסוי וניתן לבצע אותם שוב ושוב. חוץ מזה, הם מאפשרים לכל עכבר לשמש כשליטה משלו, ובכך להפוך את נתוני OIR להשוואה יותר. במאמר זה מסופקת שיטה משופרת של הדמיית FFA ותפירת תמונה. ביצוע FFA על גורים בתוך חודש אחד אינו קל מכיוון שהרדמה מוגזמת והיפותרמיה גורמות ישירות למותם של הגורים. לכן, נסו להשתמש במינון המינימלי של הרדמה והקדישו תשומת לב מיוחדת לשמירה על טמפרטורת הגוף של הגורים לאורך כל התהליך ולאחריו באמצעות כרית חימום קטנה. תמיד להרטיב את פני השטח של העין עם מלוחים Hypromellose במקרה של כישלון של התצפית הבאה.
לסיכום, מודל עכבר OIR הוא מודל נפוץ מאוד בשימוש נרחב של איסכמיה רשתית ו neovascularization פתולוגי. אחת הבעיות העיקריות של מודל זה היא שגורי העכברים היילודים הם בריאים במהותם ואינם סובלים מחוסר יציבות מטבולית או מבעיות נשימה בהשוואה לתינוקות שנולדו בטרם עת. הבדל נוסף בין מודל עכבר OIR לבין בני אדם הוא שתמיד יש התפשטות פיברוסקולרית בניאו-וסקולריזציה של הרשתית האנושית, בעוד שהניאו-וסקולריות ברשתית אינה קשורה לפיברוזיס בעכבר OIR מודל51. כדי לעשות שימוש טוב יותר במודל זה ולרכוש מידע נוסף, תיאור מפורט של שימוש ב- FFA כדי לפקח על השינויים הדינמיים של כלי הדם ברשתית OIR מסופק, כולל השיטות של צילום תמונות "חמישה כיוון" ועיבוד תמונה. הוא האמין כי FFA יהפוך שיטה יעילה חלקית או מלאה להחליף את מכתים immunofluorescence כדי לבחון ולהעריך את המורפולוגיה ואת הפונקציה של כלי הדם ברשתית49. למרות שמודל עכבר OIR אינו דומה לחלוטין למיקרו-סביבה ולפתוגנזה של רטינופתיה איסכמית שונה בבני אדם, הוא מספק לנו הזדמנות לערוך ניסויים תרופתיים ומהונדסים וכן לחקור את המנגנון של אנגיוגנזה פתולוגית על הרשתית האיסכמית51.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
אנו מודים לכל החברים מהמעבדה שלנו וממעבדת בעלי החיים של Zhongshan Ophthalmic Center על הסיוע הטכני שלהם. אנו מודים גם לפרופ' צ'ונקיאו ליו על התמיכה הניסיונית. עבודה זו נתמכה על ידי מענקים מהקרן הלאומית למדעי הטבע של סין (NSFC: 81670872; בייג'ינג, סין), הקרן למדעי הטבע של מחוז גואנגדונג, סין (מענק מס '2019A1515011347), ופרויקט בניית בית חולים ברמה גבוהה ממעבדת מפתח המדינה לרפואת עיניים במרכז העיניים ז'ונגשאן (מענק מס '303020103; גואנגג'ואו, מחוז גואנגדונג, סין).
Materials
| Name | Company | Catalog Number | Comments |
| 1 mL sterile syringe | Solarbio | YA0550 | For preparation of retinal flat mounts and intraperitoneal injection |
| 1× Phosphate buffered saline (PBS) | Transgen Biotech | FG701-01 | For preparation of retinal flat mounts |
| 2 ml Microcentrifuge Tube | Corning | MCT-200-C | For preparation of retinal flat mounts |
| 48 Well Clear TC-Treated Multiple Well Plates | Corning | 3548 | For preparation of retinal flat mounts |
| Adhesive microscope slides | Various | For preparation of retinal flat mounts | |
| Adobe Photoshop CC 2019 | Adobe Inc. | For image analysis | |
| Carbon dioxide gas | Various | For sacrifice | |
| Cover slide | Various | For preparation of retinal flat mounts | |
| Curved forceps | World Precision Instruments | 14127 | For preparation of retinal flat mounts |
| DAPI staining solution | Abcam | ab228549 | For labeling nucleus on retinal flat mounts |
| Dissecting microscope | Olmpus | SZ61 | For preparation of retinal flat mounts |
| Fluorescein sodium | Sigma-Aldrich | F6377 | For in vivo imaging |
| Fluorescent Microscope | Zeiss | AxioImager.Z2 | For acquisition of fluorescence images of retinal flat mounts |
| Fluoromount-G Mounting media | SouthernBiotech | 0100-01 | For preparation of retinal flat mounts |
| Hydroxypropyl Methylcellulose | Maya | 89161 | For in vivo imaging |
| Isolectin B4 594 antibody | Invitrogen | I21413 | For labeling retinal vasculature on retinal flat mounts |
| Mice C57/BL6J | GemPharmatech of Jiangsu Province | For OIR model induction | |
| Micro dissecting scissors-straight blade | World Precision Instruments | 503242 | For preparation of retinal flat mounts |
| No.4 straight forceps | World Precision Instruments | 501978-6 | For preparation of retinal flat mounts |
| Normal donkey serum | Abcam | ab7475 | For preparation of retinal flat mounts |
| O2 sensor | Various | For monitoring the level of O2 | |
| OxyCycler | Biospherix | A84XOV | For OIR model induction |
| Paraformaldehyde (PFA) | Sigma | P6148-1KG | For tissue fixation |
| Pentobarbital sodium | Various | For anesthesia | |
| Soda lime | Various | For absorbing excess CO2 in the oxygen chamber | |
| SPECTRALIS HRA+OCT | Heidelberg | HC00500002 | For in vivo imaging |
| SPSS Statistics 22.0 | IBM | For statistical analysis | |
| Tansference decloring shaker | Kylin-Bell | ZD-2008 | For preparation of retinal flat mounts |
| Tissue culture dish (Low attachment) | Corning | 3261-20EA | For preparation of retinal flat mounts |
| Transfer pipettes | Various | For preparation of retinal flat mounts | |
| Triton X-100 | Sigma-Aldrich | SLBW6818 | For preparation of retinal flat mounts |
| Tropicamide | Various | For in vivo imaging | |
| ZEN Imaging Software | ZEISS | For image acquisition and export |
References
- Vavvas, D. G., Miller, J. W. Chapter 26 - Basic Mechanisms of Pathological Retinal and Choroidal Angiogenesis. Retina (Fifth Edition). 1, 562-578 (2013).
- Selvam, S., Kumar, T., Fruttiger, M. Retinal vasculature development in health and disease. Progress in Retinal and Eye Research. 63, 1-19 (2018).
- Shimizu, K., Kobayashi, Y., Muraoka, K. Midperipheral fundus involvement in diabetic retinopathy. Ophthalmology. 88 (7), 601-612 (1981).
- Ashton, N. Retinal vascularization in health and disease: Proctor Award Lecture of the Association for Research in Ophthalmology. American Journal of Ophthalmology. 44 (4), 7-17 (1957).
- Hellström, A., Smith, L. E., Dammann, O. Retinopathy of prematurity. Lancet. 382 (9902), 1445-1457 (2013).
- Xu, Y., et al. Melatonin attenuated retinal neovascularization and neuroglial dysfunction by inhibition of HIF-1α-VEGF pathway in oxygen-induced retinopathy mice. Journal of Pineal Research. 64 (4), 12473 (2018).
- Cavallaro, G., et al. The pathophysiology of retinopathy of prematurity: an update of previous and recent knowledge. Acta Ophthalmologica. 92 (1), 2-20 (2014).
- Gilbert, C., Rahi, J., Eckstein, M., O'Sullivan, J., Foster, A. Retinopathy of prematurity in middle-income countries. Lancet. 350 (9070), 12-14 (1997).
- Chen, J., Smith, L. E. Retinopathy of prematurity. Angiogenesis. 10 (2), 133-140 (2007).
- Fielder, A., Blencowe, H., O'Connor, A., Gilbert, C. Impact of retinopathy of prematurity on ocular structures and visual functions. Archives of Disease in Childhood. Fetal and Neonatal Edition. 100 (2), 179-184 (2015).
- Moshfeghi, D. M. Presumed transient reactive astrocytic hyperplasia in immature retina. Retina. 26, 69-73 (2006).
- Kandasamy, Y., Hartley, L., Rudd, D., Smith, R. The association between systemic vascular endothelial growth factor and retinopathy of prematurity in premature infants: a systematic review. British Journal of Ophthalmology. 101 (1), 21-24 (2017).
- Shah, P. K., et al. Retinopathy of prematurity: Past, present and future. World Journal of Clinical Pediatrics. 5 (1), 35-46 (2016).
- Kinsey, V. E. Retrolental fibroplasia; cooperative study of retrolental fibroplasia and the use of oxygen. AMA Archives of Ophthalmology. 56 (4), 481-543 (1956).
- Tin, W., Gupta, S. Optimum oxygen therapy in preterm babies. Archives of Disease in Childhood. Fetal and Neonatal Edition. 92 (2), 143-147 (2007).
- Liu, C. H., Wang, Z., Sun, Y., Chen, J. Animal models of ocular angiogenesis: from development to pathologies. FASEB Journal : Official Publication of the Federation of American Societies for Experimental Biology. 31 (11), 4665-4681 (2017).
- Ashton, N., Ward, B., Serpell, G. Effect of oxygen on developing retinal vessels with particular reference to the problem of retrolental fibroplasia. The British Journal of Ophthalmology. 38 (7), 397-432 (1954).
- Penn, J. S., Tolman, B. L., Lowery, L. A. Variable oxygen exposure causes preretinal neovascularization in the newborn rat. Investigative Ophthalmology & Visual Science. 34 (3), 576-585 (1993).
- Smith, L. E., et al. Oxygen-induced retinopathy in the mouse. Investigative Ophthalmology & Visual Science. 35 (1), 101-111 (1994).
- McLeod, D. S., Brownstein, R., Lutty, G. A. Vaso-obliteration in the canine model of oxygen-induced retinopathy. Investigative Ophthalmology & Visual Science. 37 (2), 300-311 (1996).
- Cao, R., Jensen, L. D., Söll, I., Hauptmann, G., Cao, Y. Hypoxia-induced retinal angiogenesis in zebrafish as a model to study retinopathy. PLoS One. 3 (7), 2748 (2008).
- Connor, K. M., et al. Quantification of oxygen-induced retinopathy in the mouse: a model of vessel loss, vessel regrowth and pathological angiogenesis. Nature Protocols. 4 (11), 1565-1573 (2009).
- Fruttiger, M. Development of the mouse retinal vasculature: angiogenesis versus vasculogenesis. Investigative Ophthalmology & Visual Science. 43 (2), 522-527 (2002).
- Stahl, A., et al. The mouse retina as an angiogenesis model. Investigative Ophthalmology & Visual Science. 51 (6), 2813-2826 (2010).
- Rivera, J. C., et al. Ischemic retinopathies: oxidative stress and inflammation. Oxidative Medicine and Cellular Longevity. 2017, 3940241 (2017).
- Bashinsky, A. L. Retinopathy of prematurity. North Carolina Medical Journal. 78 (2), 124-128 (2017).
- Flynn, J. T., et al. Retinopathy of prematurity. Diagnosis, severity, and natural history. Ophthalmology. 94 (6), 620-629 (1987).
- Aguilar, E., et al. Chapter 6. Ocular models of angiogenesis. Methods in Enzymology. 444, 115-158 (2008).
- Liegl, R., Priglinger, C., Ohlmann, A. Induction and readout of oxygen-induced retinopathy. Methods in Molecular Biology. 1834, 179-191 (2019).
- Lutty, G. A., McLeod, D. S. Retinal vascular development and oxygen-induced retinopathy: a role for adenosine. Progress in Retinal and Eye Research. 22 (1), 95-111 (2003).
- Vähätupa, M., et al. Oxygen-induced retinopathy model for ischemic retinal diseases in rodents. Journal of Visualized Experiments: JoVE. (163), (2020).
- Kim, C. B., D'Amore, P. A., Connor, K. M. Revisiting the mouse model of oxygen-induced retinopathy. Eye and Brain. 8, 67-79 (2016).
- Gammons, M. V., Bates, D. O. Models of oxygen induced retinopathy in rodents. Methods in Molecular Biology. 1430, 317-332 (2016).
- Xiao, S., et al. Fully automated, deep learning segmentation of oxygen-induced retinopathy images. Journal of Clinical Investigation Insight. 2 (24), (2017).
- McLeod, D. S., D'Anna, S. A., Lutty, G. A. Clinical and histopathologic features of canine oxygen-induced proliferative retinopathy. Investigative Ophthalmology & Visual Science. 39 (10), 1918-1932 (1998).
- Penn, J. S., Johnson, B. D. Fluorescein angiography as a means of assessing retinal vascular pathology in oxygen-exposed newborn rats. Current Eye Research. 12 (6), 561-570 (1993).
- Mezu-Ndubuisi, O. J., et al. In vivo retinal vascular oxygen tension imaging and fluorescein angiography in the mouse model of oxygen-induced retinopathy. Investigative Ophthalmology & Visual Science. 54 (10), 6968-6972 (2013).
- Zeilbeck, L. F., Müller, B., Knobloch, V., Tamm, E. R., Ohlmann, A. Differential angiogenic properties of lithium chloride in vitro and in vivo. PLoS One. 9 (4), 95546 (2014).
- Walsh, N., Bravo-Nuevo, A., Geller, S., Stone, J. Resistance of photoreceptors in the C57BL/6-c2J, C57BL/6J, and BALB/cJ mouse strains to oxygen stress: evidence of an oxygen phenotype. Current Eye Research. 29 (6), 441-447 (2004).
- Zhang, Q., Zhang, Z. M. Oxygen-induced retinopathy in mice with retinal photoreceptor cell degeneration. Life Sciences. 102 (1), 28-35 (2014).
- Okamoto, N., et al. Transgenic mice with increased expression of vascular endothelial growth factor in the retina: a new model of intraretinal and subretinal neovascularization. The American Journal of Pathology. 151 (1), 281-291 (1997).
- Ohlmann, A., et al. Norrin promotes vascular regrowth after oxygen-induced retinal vessel loss and suppresses retinopathy in mice. The Journal of Neuroscience. 30 (1), 183-193 (2010).
- Fang, L., Barber, A. J., Shenberger, J. S. Regulation of fibroblast growth factor 2 expression in oxygen-induced retinopathy. Investigative Ophthalmology & Visual Science. 56 (1), 207-215 (2014).
- Chan, C. K., et al. Differential expression of pro- and antiangiogenic factors in mouse strain-dependent hypoxia-induced retinal neovascularization. Laboratory Investigation. 85 (6), 721-733 (2005).
- Stahl, A., et al. Postnatal weight gain modifies severity and functional outcome of oxygen-induced proliferative retinopathy. The American Journal of Pathology. 177 (6), 2715-2723 (2010).
- Vanhaesebrouck, S., et al. Association between retinal neovascularization and serial weight measurements in murine and human newborns. European Journal of Ophthalmology. 23 (5), 678-682 (2013).
- Gerschman, R., Nadig, P. W., Snell, A. C., Nye, S. W. Effect of high oxygen concentrations on eyes of newborn mice. The American Journal of Physiology. 179 (1), 115-118 (1954).
- Lange, C., et al. Kinetics of retinal vaso-obliteration and neovascularisation in the oxygen-induced retinopathy (OIR) mouse model. Graefe's Archive for Clinical and Experimental Ophthalmology. 247 (9), 1205-1211 (2009).
- Huang, S., et al. Comparison of dextran perfusion and GSI-B4 isolectin staining in a mouse model of oxygen-induced retinopathy. Eye Science. 30 (2), 70-74 (2015).
- Paques, M., et al. Panretinal, high-resolution color photography of the mouse fundus. Investigative Ophthalmology & Visual Science. 48 (6), 2769-2774 (2007).
- Fletcher, E. L., et al. Animal models of retinal disease. Progress in Molecular Biology and Translational Science. 100, 211-286 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved