Method Article
Biyoaktif Küçük Moleküllerin, Peptidlerin Doğal Kaynaklardan ve Proteinlerden Preparatif İzoelektrik Odaklama (IEF) Yöntemi ile Mikroplardan Ayrılması
Bu Makalede
Özet
Amaç, sıvı fazlı izoelektrik odaklama (IEF) yöntemini çalıştırarak biyoaktif küçük molekülleri, kompleks bitki özünden peptitleri ve patojen mikroplardan proteinleri fraksiyonetmek ve izole etmektir. Ayrıca ayrılan moleküller tespit edildi ve biyoaktiviteleri doğrulandı.
Özet
Bitkilerden ve mikroplardan elde edilen doğal ürünler zengin bir biyoaktif molekül kaynağıdır. Kullanımlarından önce, karmaşık ekstrelerden aktif moleküller downstream uygulamaları için saflaştırılmalıdır. Bu amaç için çeşitli kromatografik yöntemler mevcuttur ancak tüm laboratuvarlar yüksek performanslı yöntemler göze alamaz ve karmaşık biyolojik örneklerden izolasyon zor olabilir. Burada, preparatif sıvı fazizoelektrik odaklamanın (IEF) molekülleri, küçük moleküller ve peptidler de dahil olmak üzere karmaşık bitki özlerinden, izoelektrik noktalarına (pI) göre ayırabildiğimizi gösteriyoruz. Bu yöntemi karmaşık biyolojik numune fraksiyonu ve karakterizasyonu için kullandık. Kavramın bir kanıtı olarak, biz bir Gymnema sylvestre bitki ekstresi fraksiyone, terpenoid saponin küçük moleküller ve bir peptit bir aile izole. Ayrıca candida albicans mantarını model sistem olarak kullanarak etkili mikrobiyal protein ayrıştırma larını gösterdik.
Giriş
Biyomoleküllerin karmaşık biyolojik numunelerden arındırışı biyolojik deneylerde önemli ve çoğu zaman zor bir adımdır1. İzoelektrik odaklama (IEF), taşıyıcı amperatların yüklerine göre seyahat ettikleri ve bir elektrik alanında pH gradyanı nın oluşturuldukları karmaşık biyomoleküllerin yüksek çözünürlüklü ayrımı için uygundur3. IEF için ilk ticari taşıyıcı ampholyte Olof Vesterberg tarafından 1964 yılında geliştirilen ve patentli4,5. Taşıyıcı amperatlar alifatik oligo-amino oligo-karboksilik asit molekülleri değişen uzunluk ve dallanma6. Daha sonra, Vesterberg ve diğerleribiyomolekülleriayıran genişletilmiş kullanım için taşıyıcı ampholytes geliştirilmiş 6,7.
Biyomolekülleri ayırma yöntemleri arasında agarose ve poliakrilamid jel elektroforezi, iki boyutlu jel elektroforezi (2-DE), izoelektrik odaklama, kapiller elektroforez, izotachophorez ve diğer kromatografik teknikler (örn. TLC, FPLC, HPLC)2sayılabilir. "Rotofor" adı verilen bir enstrümanda gerçekleştirilen sıvı fazI IEF, Milan Bier8tarafından icat edilmiştir. Bu enstrümanın konseptine ve tasarımına öncülük etmiş ve elektroforetik göç teorisine büyük katkıda bulunmuştur. Ekibi ayrıca bilgisayar simülasyonları için elektroforetik ayırma sürecinin matematiksel bir model geliştirdi9.
Sıvı fazlı IEF aparatı, 20 gözenekli bölmeye bölünmüş bir naylon çekirdek ve sirkülasyon suyu soğutma seramik çubuktan oluşan yatay olarak dönen silindirik bir hücredir. Gözenekli bölmeler, moleküllerin elektrotlar arasındaki sulu fazdan geçmesine izin verir ve fraksiyonlarda vakum altında saflaştırılmış numunelerin toplanmasına izin verir. Bu arıtma sistemi,[lt;4 saat içinde belirli bir molekülün 1000 kata kadar saflaştırılmasını sağlayabilir. Bu aletin değerli bir özelliği, karmaşık bir karışımdan arınma için ilk adım olarak veya saflık10elde etmek için son bir adım olarak uygulanabilir olmasıdır. Eğer ilgi molekülü bir proteinise, bir diğer avantajı da ayrılma sırasında doğal konformasyonunun korunmasıdır.
Sıvı fazı IEF kullanımı proteinler, enzimler ve antikor saflaştırma6,10,11,,12,13,14için yaygın olarak bildirilmiştir. Burada tıbbi bitki Gymnema sylvestreküçük molekül ve peptidler ayıran ve arındırıcı için bu yaklaşımın kullanımını açıklar. Bu protokol, araştırmacıların düşük maliyetle aşağı akım uygulamaları için bir bitki özü aktif küçük molekülleri konsantre ve arındırmak yardımcı olacaktır. Buna ek olarak, bu IEF tabanlı sistemde Candida albicans mantar15 karmaşık bir protein ekstresinden proteinlerin zenginleştirme ikinci bir örnek olarak göstermektedir.
Protokol
1. Standart sıvı fazlı IEF ünitesinin kurulumu ve ön çalıştırımı
- Sıvı fazlı IEF elektrotlarını (ano-kırmızı düğme ve katot-siyah düğme) kullanım kılavuzuna göre kendi değişim membranları ile birleştirin (bkz. Malzeme Tablosu). Yeni membranlar kullanıldığında anyon değişim membranlarını 0,1 M NaOH ve 0,1 M H3PO4 ile katyon değişim membranlarını en az 16 saat e-posta ile dengeleyin.
- Membranları elektrolitlerde (0,1 M NaOH veya 0,1 M H3PO4)çalışır ve kurumasını bekleyin.
- İyon değişimi contalarında üç dikdörtgen deliği hizalayarak elektrotun iç ve dış kısmını birleştirin. Membranların kurumasını önlemek için elektrotları ilgili elektrolitlerle (~25-30 mL) doldurun.
- Elektrot içinde basınç oluşturup sızıntıya neden olabilecek fazlalık (elektrot odasıhacminin 1/3'ünden fazla) elektrolit eklemeyin.
- Numune toplama bağlantı noktalarını, alet montaj parçalarıyla birlikte gelen sızdırmazlık bandıyla kapatın (bkz. Malzeme Tablosu). Örnek toplama bağlantı noktaları tarafı, iki dikey metal hizalama pimi ile tanımlanabilir. Alternatif olarak, bağlantı noktalarını kapatmak için standart sızdırmazlık bandı kullanın.
- Seramik soğutma parmağı üzerinde odaklama odası montajının tüm parçalarını sırayla (anot elektrodu, naylon membran çekirdeği, odaklama odası ve katot elektrodu) birleştirin.
- 50 mL şırınga kullanarak odaklama odasını önceden soğutulmuş distile suyla (standart IEF hücresi için toplam 60 mL hacim) doldurun.
- Sıvı fazlı IEF cihazını 4 ºC'de sirkülasyonlu bir soğutma suyuna bağlayın ve üniteyi 15 W ve 3.000 V'da 3-5 dk veya gerilim dengeleyene kadar önceden çalıştırın.
NOT: Genellikle, bir dakika içinde, gerilim maksimum ayar değerlerine ulaşacaktır. Distile su ile prerunning odaklama odası ve naylon membran çekirdek artık iyonları kaldırmak için yardımcı olur. - Güç kaynağını kapatın ve fraksiyon toplayıcısını kullanarak hücreden suyu çıkarın. Toplama bağlantı noktalarını sızdırmazlık bandıyla yeniden kapatın.
NOT: Şimdi cihaz adım 2.4 kullanıma hazırdır.
2. Gymnema sylvestre ekstresinden küçük molekül ve peptidlerin ayrılması ve saflaştırılması
- Bitki ekstresinin 0,6 g'ını ölçün ve distile suda (60 mL) 5 dakika boyunca bir rulo tüpe karıştırılarak çözün.
NOT: Çözünür ve tuzsuz herhangi bir biyolojik numune bu IEF cihazı kullanılarak ayırma ve arıtma için kullanılabilir. 10 mM'ye kadar tamponlama tuz konsantrasyonu olan numuneler hafif çözünürlükte kullanılabilir. Biz triterpenoid bileşiklerin saponin aile ilgileniyoruz, jimnastik asitleri, G. sylvestre bitki kendi benzersiz antifungal özellikleri için16. - Çözünmez parçacıkları kaldırmak için 5 dk için 10.000 x g çözünür bitki ekstresi santrifüj.
- Supernatant'ı (~60 mL) 80 mL'lik bir santrifüj tüpüne aktarın ve 0,6 mL amperat (pH 3-10) ile %1(v/v) ile karıştırın.
- Sıvı fazlı IEF ünitesini hazırlamak için 1.1 – 1.7 adımlarını izleyin. Oda şimdi numuneyi yüklemeye hazır.
- 1-1/2 inç 19 G künt uç iğnesi (aletle birlikte gelir) ile 50 mL şırınga kullanın ve hazırlanan numuneyi numune toplama bağlantı noktalarından hücreye ampholyte (toplam 60 mL) yükleyin.
- Odakhücreyi standdan çıkararak ve kabarcıkları çıkarmak için elektrot odasına dokunarak örnek hücreden hava kabarcıklarını çıkarın. Hava kabarcıklarının varlığı gerilim ve akım dalgalanmalarına neden olur ve koşmayı etkiler.
- Üniteyi su soğutucuya (4 °C) bağlayın ve sabit 15 W'lık güç kaynağıyla fraksiyona başlayın.
- Cihazı 3 saat veya voltaj sabit bir değere ulaşana kadar çalıştırın.
NOT: Numune netlenmeye başladığında, gerilim sabit bir değere ulaşıncaya kadar kademeli olarak tırmanmaya başlar. - Koşudan sonra, IEF ünitesinde hasat düğmesine basarak vakum pompasına bağlı hasat kutusundaki kesirleri (20 plastik tüp, 12 mm x 75 mm, 5-6 mL hacim içeren) toplamaya hazırolun.
- 20 toplama pimlerini, bantla mühürlenmiş odak hücrenin 20 toplama bağlantı noktalarıyla hizalayın.
- Toplama pimlerini sızdırmazlık bandına itin ve vakum pompasını aynı anda Açın (Bkz. Şekil 2B, 2C & 2D).
NOT: Her odadan yaklaşık 3 mL kesir her defası tüplere toplanır. Kesirler sonraki downstream uygulamaları için kullanılabilir (Peptit niceleme için SDS-PAGE, TLC ve küçük moleküller için biyoassay).
3. Proteinlerin C. albicanlardan ayrılması ve saflaştırılması
- Maya-peptone-dekstroz (YPD) suyu16 30 °C'de bir gecede sallayarak (200 rpm) C. albicans tek koloni büyümek.
- Mayan hücreleri santrifüj (5 dk için 10.000 x g) toplayın.
- % 1 (v/v) beta-mercaptoetanol (β-ME) (kültür hacminin 1/10'u) içeren amonyum karbonat (1.89 g/L) tampondaki C. albicans maya hücrelerini askıya alın ve 5 °C15'te1 saat silindir tüpünde döndürün.
- Maya hücrelerini santrifüj (5 dk için 10.000 x g) çıkarın ve protein ekstresini 0,45 μm'lik bir filtreden filtreleyin.
NOT: C. albicans sitosol, membran veya hücre duvarından alınan protein örnekleri IEF fraksiyonu için hazırlanabilir ve kullanılabilir. Benzer şekilde, bakteri veya diğer biyolojik örneklerden (hayvan dokusu ekstresi) proteinler uygun yöntemlerle(örneğin,diyaliz veya tuzsuzsütunlar kullanılarak) herhangi bir tuz çıkarıldıktan sonra kullanılabilir. - 4 °C'de 15 saat boyunca bir diyaliz tüpünde (3.500 MWCO) protein ekstresini 15 saat boyunca diyaliz tüpünde diyalize alın. Standart17olarak gama globulin kullanarak Bradford boya bağlama yöntemi ile protein konsantrasyonu tahmin .
- Fraksiyonu için %1 (v/v) amper (pH 5-8) içeren 60 mL suda toplam proteinin 500 mg'ını kullanın.
NOT: Geniş menzilli bir ampholyte (pH 3-10) C. albicans bazı non-glucan bağlı hücre duvarı proteinleri zenginleştirmek olmadığından, dar aralıklı (pH 5-8) ampholyte kullanın. Örnek protein konsantrasyonu 2 mg/mL'den fazla ise %2'ye varan bir amper konsantrasyonu kullanılabilir; bu odaklama sırasında protein toplama en aza indirir. Örnekleri, amperleri ve suyu her zaman buzüzerinde bekletin. - IEF ünitesini hazırlamak için 1.1- 1.7 adımlarını tekrarlayın ve protein çözeltisini 3.6 adımdan iEF hücresine yüklemek için kullanın.
- Sabit bir 15 W odaklanarak 4 saat sonra, hasat protein fraksiyonları (1-20) yukarıda açıklandığı gibi (adım 2.9-2.11) ve protein örnekleri azaltarak ve kaynatıldıktan sonra% 12.5 SDS-PAGE analiz18.
- SDS-PAGE jelini Coomassie mavi boya (%0.01) ile boyanarak çözünmüş proteinleri lekeleyin bir rocker üzerinde oda sıcaklığında 2-3 saat için çözelti. Jel destain ve jel görüntüleyici kullanarak jel görüntü kaydedin.
NOT: Coomassie mavi boya (%0.01) %40 metanol ve %10 asetik asit içeren bir destaining çözeltisi içinde 0.01 g Coomassie mavisi tozu karıştırılarak hazırlanabilir.
4. Bitki özü Gymnema sylvestre saflaştırılmış küçük moleküllerin biyoaktivite
- Adım 3.1 gibi maya hücrelerinde C. albicans grow.
- Hücre süspansiyon hazırlamak için, C. albicans maya hücreleri (1/1000 seyreltme) yeni bir RPMI hücre kültürü orta 50 mM glikoz ile takviye içine bir gecede kültür seyreltmek.
NOT: C. albicans hyphal indükleme koşulları altında (RPMI 37 °C) altında maya büyüme hyphae dönüştürür. Jimnastikasit küçük moleküllerhypha indükleyici koşullar altında hyphae içine maya hücrelerinin dönüşümü inhibe gösterilmiştir16. Sıvı faz-IEF ayrılmış G. sylvestre ekstresinin bu biyoaktif molekülleri içerip içermediğini belirlemeyi amaçladık. - Hazırlanan hücre süspansiyonundan, 96 kuyulu plakanın her kuyuya 90°L ekleyin.
- Her fraksiyondan (Sıvı faz IEF'den elde edilen G. sylvestre ekstresinin 1-20 kesirleri, Şekil 4),yukarıdaki hücre süspansiyonunun 90 μL'si ile kuyulara 10°L ekleyin (adım 4.2). Tayini triplicate olarak gerçekleştirin.
- Ampholyte içeren 10 μL su ekleyin (%1) 90 μL C. albicans maya hücre süspansiyon u negatif kontrol olarak ayrı kuyulara.
NOT: Amperatlar biyoaktivite potansiyeline sahiptir ve bu nedenle herhangi bir biyoassay yaparken bir amfide kontrol dahil etmek esastır19. - 96 kuyulu plakayı 37 °C'de 12 saat kuluçkaya yatırın ve C. albicans mayadan hypha'ya inhibisyonu mikroskop16altında gözlemleyin. Ayrıca, maya-hypha dönüşüm inhibisyonu yüzdesini belirlemek.
Sonuçlar
Gymnema sylvestre bitki ekstresinden küçük molekül ve peptidlerin ayrılması ve saflaştırılması
Preparatif sıvı fazI IEF yöntemini kullanarak, tıbbi bitki özleri ve hücre yüzey proteinleri bir insan patojenik mantar, C. albicans. Bu kesirasyon protokollerinin şeması Şekil 1'degösterilmiştir.
Sıvı fazLı IEF'den elde edilen G. sylvestre ekstresinin 20 fraksiyonundan, koyu renkli moleküllerin (terpenoid saponinler) anodu ucunda göç ettiği ve zenginleştirilmiş olduğu saplanmış ve katot ucunda açık sarı açık kesirler gözlenmiştir (pH 8-9)(Şekil 2). Her fraksiyondan (1-20) aliquots (20 μL) örnekleri azaltıp kaynattıktan sonra %15 SDS-PAGE ile çözüldü. Bir Coomassie mavi lekeli jel kesirler 16-19(Şekil 3)zenginleştirilmiş yaklaşık 5 kDa dağınık polipeptid bandı gösterir. Bu G. sylvestre bitki 4.209 Da 20 öngörülen moleküler ağırlığı ile 35 amino asit gurmarin temel polipeptid içerdiğibildirilmiştir. Bakteriler, bitkiler ve hayvanlar peptidler içerir; bunların çoğu dairesel (knottins) ve insektisit ve antimikrobiyal özellikleri21,,22gibi biyolojik faaliyetlerin geniş bir yelpazede istikrarlı.
Ayrılmış jimnastikasitlerinin biyolojik aktivitesi
G. sylvestre bitki de jimnastik asitleri içerir (terpenoid saponinler) ana bileşenleri olarak16,23,24. Beklendiği gibi, kesir 1 ve sonraki birkaç fraksiyonları bu küçük moleküller sds-PAGE ve Coomassie boyama(Şekil 3) onlar non-proteinaceous beri tespit edilmedi. Ancak, bu küçük moleküller TLC ile ayrılabilir ve UV ışığı altında tespit edilebilir(Şekil 4A, şerit F1). Fraksiyon 10 TLC üzerinde organik küçük moleküllerin çoğu 1-3 kesirler zenginleştirilmiş olduğunu düşündüren bu küçük moleküllerin tespit edilebilir bir miktar içermadı. Jimnastik asitleri (GAs) molekülleri C. albicans maya-hypha geçiş inhibe gösterilmiştir16,25. Bu çalışmada toplanan 20 fraksiyonun tamamını C. albicans maya-to-hypha dönüşümü ve hyphal büyümeye karşı inhibitör aktivitelerinden dolayı saydık16. Sonuçlar Şekil 4B,4C'degösterilmiştir. En yüksek aktivite, çeşitli noktaların görülebildiği TLC sonuçlarıyla aynı fikirde olan 1. Jimnastik asitiz omerleri var ve tüm benzer biyolojik faaliyetlervar 10. Bu izomerler fraksiyon 1-3 olarak ayrılmış ve C. albicans hyphal büyüme inhibisyonu göstermektedir(Şekil 4A,4C, kesir 1). 1'den 10'a çıktıkça hipile inhibisyonu derecesi kademeli olarak azalmıştır. 10 ve üzeri kesirlerde çok az veya hiç aktivite elde edilemedi.
Hücre yüzeyi proteinlerinin patojen mantardan ayrılması, C. albicans
C. albicans hücre yüzey proteinlerinin sıvı fazı IEF fraksiyonunun sonuçları Şekil 5'tegösterilmiştir. Bu hücre yüzey proteinleri C. albicans adezyon ve patogenez önemli rol oynamaktadır26. Farklı fraksiyonlarda çeşitli zenginleştirilmiş proteinler (oklar) gözlenmiştir. Bu, Candida enfekte insan serumu ile immünolojik reaksiyonlarının belirlenmesine ve/veya kütle spektrometresi ile tanımlanmasına olanak sağlayabilir. Benzer şekilde, diğer hücresel fraksiyonlardan (örneğin, sitoplazma ve hücre duvarı) proteinler bu IEF yöntemi kullanılarak kesirlenebilir. Sıvı fazı IEF tabanlı saflaştırma, kütle spektrometresi analizi ile birleştiğinde karmaşık biyolojik örneklerden düşük miktarda proteinlerin tanımlanmasına olanak sağlayacaktır.
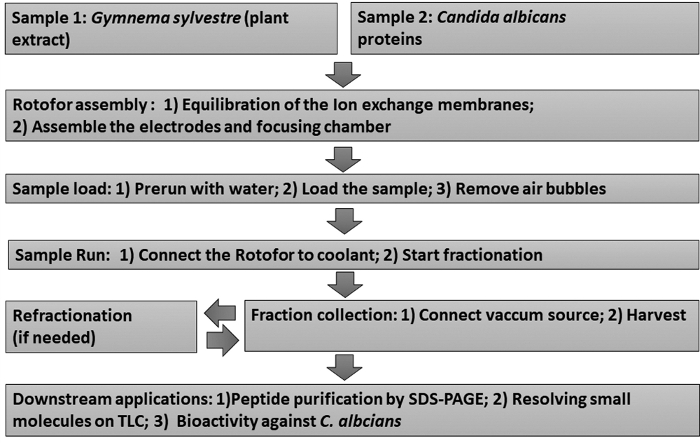
Şekil 1: Deneysel iş akışını gösteren akış şeması. Adım adım sıvı faz IEF fraksiyonişlemleri ve sonraki downstream tahlilleri gösterilmiştir. Örnekler Gymnema sylvestre yaprak ekstresi (örnek 1) ve Candida albicans non-glucan ekli maya proteinleri (örnek 2) içerir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: Sıvı fazlı IEF aparatkurulumu ve G. sylvestre bitki ekstresinin fraksiyonu. (A) Çalışma sırasında, (B) kesir toplama sırasında, (C) kesir toplama dan sonra, ve (D) sıvı fazlı IEF aparat parçaları, 1) iyon değişim membranları, 2) odaklama odası ve membran çekirdeği, 3) elektrot montajı (negatif), 4) elektrot montajı (pozitif). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: IEF odaklı bitki özü fraksiyonlarının SDS-PAGE ayırmaları. L- merdiven, PC- Pozitif kontrol (peptit), 0 - giriş örneği, 1-20 ayrılmış fraksiyonları. SDS-PAGE (%15) 1-20 kesirlerden çözülmüş peptidleri (~5 kDa) görselleştirmek için Coomassie mavi boya ile boyandı. Kesirler 1-3 küçük moleküller içerir (kesir 1 zenginleştirilmiş bileşikler gösteren koyu renk vardır) hangi lekeli olamaz / Coomassie mavi boya tarafından tespit. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
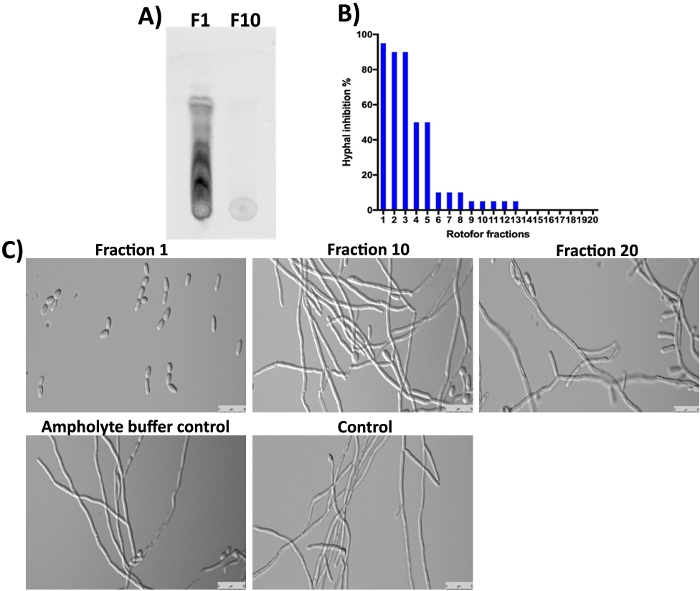
Şekil 4: IEF fraksiyonlu küçük moleküllerin TLC ile analizi ve C. albicanskarşı biyoaktivite belirlenmesi . (A) Fraksiyon#1 ve #10 küçük moleküllerin TLC analizini gösterir. Aktif silika jel plaka numunelerin ~ 5μL nokta için kullanılan ve toluen ile koştu: kloroform: çözücü ön marjı ulaşana kadar metanol çözücü (5:8:3 oranı). TLC ayrılmış bileşikler bir epifloresan UV ışığı altında tespit edildi (310 nm). (B) C. albicans maya-hypha dönüşüm ününe farklı fraksiyonlar tarafından % inhibisyonu gösterir. (C) C. albicanların hücre morfolojisini hypha indükleme koşullarında gösterir. Kesir #1 maksimum (%98) gösterir maya-to-hypha dönüşüm inhibisyonu. Diğer fraksiyonlar ve kontroller, 37 °C'de 12 saatlik kuluçkadan sonra C. albicans hyphal büyümesinin inhibisyonu olmadığını göstermektedir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 5: C. albicans hücre yüzey proteinlerinin SDS-PAGE analizi (non-glucan ekli). L- merdiven, 0 - giriş örneği, IEF'den sonra standart bir sıvı fazlı IEF hücresinde dar bir aralık (pH 5-8) ampholyte kullanılarak toplanan 1-18 fraksiyon. Resimde SDS-PAGE (%12,5) Coomassie mavi boya ile boyama sonra çözülmüş proteinler. Bazı proteinler belirli kesirlerde (oklar) zenginleştirilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Doğal ürün kaynaklarından (örneğin, bitkiler) gelen küçük moleküller, kimyasal yapı olarak oldukça çeşitli karmaşık ikincil metabolitleri içerir. Onlar bitki savunma mekanizmaları dahil olduğuna inanılmaktadır. Buna ek olarak, polipeptidler de bitki dokularında mevcuttur22. Bu doğal ürün küçük moleküller ilaç keşif ve geliştirme için test moleküllerinin zengin kaynaklarıdır. Ancak, izolasyon ve arınma için gerekli zor ve sıkıcı yöntemler terapötik uygulamalar için kullanımını sınırlar. Bu raporda kullanılan sıvı fazlı IEF yaklaşımı, bu küçük molekülleri ve polipeptidleri biyoaktivitelerinden ödün vermeden ayırma yeteneğini vurgulamaktadır.
Bu IEF tabanlı yöntem, saflaştırılmış proteinlerin karmaşık bir karışımdan konsantrasyonu, odaklama sırasında ve sonrasında yerli konformasyonun sürdürülmesi ve numunelerin çapraz kontaminasyon olmaksızın bireysel saflaştırılmış fraksiyonlar olarak toplanması gibi biyolojik moleküllerin ayrılmasında çeşitli avantajlar sunar. Gerektiğinde, numuneler protein izoformlarını arındırmak için dar bir pH aralığı ile yeniden odaklanabilir. Minyatür bir IEF odaklama hücresi (~15 mL) mevcut olduğundan, daha küçük hacimlerde numuneler için de kullanılabilir. Bu rapordan elde edilen yeni bulgu, organik küçük moleküller ve peptidler karmaşık bir bitki ekstresi ayrılabilir olmasıdır. Küçük moleküllerin IEF tarafından doğal ürün özlerinden ayrılabileceğini kabul etmek zor olsa da, amfisayısal olan bileşikler için akla yatkındır. G. sylvestre ekstresindeki gurmarin peptidinden ayrılan jimnastik asitler, karboksilik asit grubu içerdikleri için amfinik görünürler ya da en azından kullanılan amfiten in huzurunda öyle davranıyorlar. Glikozitler jimnastik asitlere benzer biyoaktif doğal moleküller olduğundan, IEF yöntemi onları karmaşık doğal kaynaklardan ayırmak için kullanılabilir. Benzer şekilde, doğal ürünlerden gelen peptidler de bu sıvı fazlı IEF yaklaşımı kullanılarak izole edilebilir.
Bu yaklaşımdaki sınırlamalardan bazıları, en azından suda çözünen ve zayıf amfijen olmaları gerektiğinden, tüm küçük moleküllerin IEF yöntemi tarafından kesirle sınırlandırılabilmeleridir. Burada kullanılan ekstre kurutulmuş bitki materyalinin % 50 metanol ekstraksiyonu ile hazırlanmıştır ancak suda çözünür. Çözücü ve amphoterik bileşikler için IEF yönteminin kullanımı, bazı organik çözücülerin sıvı fazlı IEF alet bileşenleriyle uyumsuz olması nedeniyle görülecektir. Proteinlerin düşük iyonik mukavemet li çözeltilerinde izoelektrik noktalarında (pI) çökelme eğilimi iyi bilinmektedir. Ancak, dönen bir IEF sisteminde, odaklanmış proteinler pI noktasında dolaşımda kalırken protein çökeltme azalır.
Bu IEF ayrıştırmaproteinlerinin yüksek konsantrasyonda kullanılırsa, yağış oluşabilir. Protein çökeltmesini en aza indirmek ve protein odaklılığı iyileştirmek için üre, CHAPS, digitonin ve düşük deterjan konsantrasyonu (%0.1-1) gibi 3-5 M. Noniyonik deterjanlarda kullanılabilir. iEF sırasında protein agregasyonunu azaltmak için de kullanılabilir. Ancak, üre ve deterjanların proteinleri analiz etmeden önce ortadan kaldırılması gerekir ve bazı durumlarda bu ajanlar protein fonksiyonlarını etkileyebilir. Bir sıvı fazI IEF çalışması sırasında göz önünde bulundurulması gereken birkaç kritik adım arasında IEF odaklama hücresinin hava kabarcıkları olmadan yüklenmesi, hasar görmüşse iyon değişim membranlarının değiştirilmesi ve belirli sayıda tekrarlanan kullanımdan sonra havalandırma düğmelerinin değiştirilmesi yer alır.
Sonuç olarak, sıvı fazlı IEF yöntemini kullanarak, biyoaktif gymnemic asitler ve gurmarin polipeptidin G. sylvestre yaprak ekstresinden ayrılmasını gösterdik. Ayrıca, sıvı faz IEF patojenik mikropların karmaşık ham özleri seçici proteinleri zenginleştirmek için yararlı olabilir.
Açıklamalar
Yazarlar hiçbir rakip mali çıkarları beyan etmek istiyorum.
Teşekkürler
Biz Biyoloji Bölümü ve Johnson Kanser Araştırma Merkezi BRIEF ve IRA ödülleri için, sırasıyla GV için finansman kaynakları için müteşekkiriz. Ayrıca RV için K-INBRE doktora sonrası ödül teşekkür ederiz. Bu çalışma kısmen P20 GM103418 hibe numarası altında Ulusal Sağlık Enstitüleri Genel Tıp Bilimleri Enstitüsü'nden Kurumsal Gelişim Ödülü (IDeA) tarafından desteklenmiştir. İçerik sadece yazarların sorumluluğundadır ve Ulusal Genel Tıp Bilimleri Enstitüsü'nün veya Ulusal Sağlık Enstitüleri'nin resmi görüşlerini temsil etmek zorunda değildir. Biz yararlı yorumlar için anonim yorumcular teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.45 µm syringe filter | Fisher scientfic | 09-720-004 | |
| 2-Mercaptoethanol | Sigma | M3148 | |
| Ammonium carbonate | Sigma-Aldrich | 207861-500 | |
| Bio-Lyte 3/10 Ampholyte | Bio-Rad | 163-1113 | |
| Bio-Lyte 5/8 Ampholyte | Bio-Rad | 163-1192 | |
| Compact low temperature thermostat | Lauda -Brinkmann | RM 6T | Set water cooling to 4 oC and it can be run even at 0 oC as when it passes through the Rotofor cooling core, the circulating water temperature will be around 5 or more depending on the voltage. |
| Coomassie Brilliant Blue R | Sigma-Aldrich | B7920 | |
| Dialysis tubing (3,500 MWCO) | Spectrum Spectra/Por | 132112T | |
| Gymnema plant leaf extract powder (>25% Gymnemic acids) | Suan Farma, NJ USA | ||
| Incubator | Lab companion | SI 300R | |
| Microscope | Leica | DM 6B | |
| Mini protean electrophoresis | Bio-Rad | ||
| pH meter | Mettler Toledo | S20 | Useful to determine the pH of the Rotofor (liquid-phase IEF) fractions |
| Rotofor | Bio-Rad | 170-2972 | http://www.bio-rad.com/webroot/web/pdf/lsr/literature/M1702950E.pdf (Rotofor Instruction manual for assembling the unit) |
| RPMI-1640 Medium | HyClone | DH30255.01 | |
| Sealing tape | Bio-Rad | 170-2960 | Scotch tape may also be used. |
| Sorvall legend micro 17 centrifuge | Thermo scientific | 75002432 | |
| TPP tissue culture plate -96 well flat bottom | TPP | TP92696 |
Referanslar
- Jankowska, U., et al. Optimized procedure of extraction, purification and proteomic analysis of nuclear proteins from mouse brain. Journal of Neuroscience Methods. 261, 1-9 (2016).
- Pergande, M. R., Cologna, S. M. Isoelectric Point Separations of Peptides and Proteins. Proteomes. 5 (1), (2017).
- Stoyanov, A. IEF-based multidimensional applications in proteomics: toward higher resolution. Electrophoresis. 33 (22), 3281-3290 (2012).
- Vesterberg, O. A. Y. . Method of Isoelectric Fractionation. , (1964).
- Vesterberg, O., Svensson, H. Isoelectric fractionation, analysis, and characterization of ampholytes in natural pH gradients. IV. Further studies on the resolving power in connection with separation of myoglobins. Acta Chemica Scandinavica. 20 (3), 820-834 (1966).
- Righetti, P. G. . Isoelectric Focusing: Theory, Methodology and Applications. , 1 (1983).
- Vesterberg, O. Synthesis and Isoelectric Fractionation of Carrier Ampholytes. Acta Chemica Scandinavica. 23, 2653-2666 (1969).
- Bier, M. Recycling isoelectric focusing and isotachophoresis. Electrophoresis. 19 (7), 1057-1063 (1998).
- Bier, M., Palusinski, O. A., Mosher, R. A., Saville, D. A. Electrophoresis: mathematical modeling and computer simulation. Science. 219 (4590), 1281-1287 (1983).
- Ayala, A., Parrado, J., Machado, A. Use of Rotofor preparative isoelectrofocusing cell in protein purification procedure. Applied Biochemistry and Biotechnology. 69 (1), 11-16 (1998).
- Wagner, L., et al. Isolation of dipeptidyl peptidase IV (DP 4) isoforms from porcine kidney by preparative isoelectric focusing to improve crystallization. Biological Chemistry. 392 (7), 665-677 (2011).
- Hosken, B. D., Li, C., Mullappally, B., Co, C., Zhang, B. Isolation and Characterization of Monoclonal Antibody Charge Variants by Free Flow Isoelectric Focusing. Analytical Chemistry. 88 (11), 5662-5669 (2016).
- Yu, J. J., et al. Francisella tularensis T-cell antigen identification using humanized HLA-DR4 transgenic mice. Clinical Vaccine Immunology. 17 (2), 215-222 (2010).
- Riyong, D., et al. Size and charge antigens of Dirofilaria immitis adult worm for IgG-ELISA diagnosis of bancroftian filariasis. Southeast Asian Journal of Tropical Medicine and Public Health. 41 (2), 285-297 (2010).
- Vediyappan, G., Bikandi, J., Braley, R., Chaffin, W. L. Cell surface proteins of Candida albicans: preparation of extracts and improved detection of proteins. Electrophoresis. 21 (5), 956-961 (2000).
- Vediyappan, G., Dumontet, V., Pelissier, F., d'Enfert, C. Gymnemic acids inhibit hyphal growth and virulence in Candida albicans. PLoS One. 8 (9), 74189 (2013).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry. 72, 248-254 (1976).
- Laemmli, U. K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 227 (5259), 680-685 (1970).
- Riazi, S., Dover, S., Turovskiy, Y., Chikindas, M. L. Commercial ampholytes used for isoelectric focusing may interfere with bioactivity based purification of antimicrobial peptides. Journal of Microbiological Methods. 71 (1), 87-89 (2007).
- Kamei, K., Takano, R., Miyasaka, A., Imoto, T., Hara, S. Amino-Acid-Sequence of Sweet-Taste-Suppressing Peptide (Gurmarin) from the Leaves of Gymnema-Sylvestre. Journal of Biochemistry. 111 (1), 109-112 (1992).
- Craik, D. J. Chemistry. Seamless proteins tie up their loose ends. Science. 311 (5767), 1563-1564 (2006).
- Craik, D. J., Daly, N. L., Bond, T., Waine, C. Plant cyclotides: A unique family of cyclic and knotted proteins that defines the cyclic cystine knot structural motif. Journal of Molecular Biology. 294 (5), 1327-1336 (1999).
- Stoecklin, W. Chemistry and physiological properties of gymnemic acid, the antisaccharine principle of the leaves of Gymnema sylvestre. Journal of Agricultural and Food Chemistry. 17 (4), 704-708 (1969).
- Liu, H. M., Kiuchi, F., Tsuda, Y. Isolation and structure elucidation of gymnemic acids, antisweet principles of Gymnema sylvestre. Chemical & Pharmaceutical Bulletin (Tokyo). 40 (6), 1366-1375 (1992).
- Veerapandian, R., Vediyappan, G. Gymnemic Acids Inhibit Adhesive Nanofibrillar Mediated Streptococcus gordonii-Candida albicans Mono-Species and Dual-Species Biofilms. Frontiers in Microbiology. 10, 2328 (2019).
- Chaffin, W. L. Candida albicans cell wall proteins. Microbiology and Molecular Biology Reviews. 72 (3), 495-544 (2008).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır