Method Article
생리 활성 소분자의 분리, 천연 공급원에서 펩티드 및 미생물에서 단백질(Preparative IEF) 방법에 의한
요약
목표는 액체 상 이소전 초점 (IEF) 방법을 채택하여 생리 활성 소분자, 복잡한 식물 추출물에서 펩티드 및 병원성 미생물의 단백질을 분수하고 분리하는 것입니다. 또한, 분리된 분자가 확인되었고 그들의 생체 활성이 확인되었다.
초록
식물과 미생물에서 파생 된 천연 제품은 생리 활성 분자의 풍부한 소스입니다. 사용하기 전에 복잡한 추출물의 활성 분자는 다운스트림 응용 제품에 대해 정제되어야 합니다. 이러한 목적을 위해 사용할 수 있는 다양한 크로마토그래피 방법이 있지만 모든 실험실이 고성능 방법을 감당할 수 있는 것은 아니며 복잡한 생물학적 샘플로부터의 격리가 어려울 수 있다. 여기서 우리는 전두엽 액체 상 등소 초점 (IEF)이 그들의 동전 점 (pI)에 따라 복잡한 식물 추출물에서 작은 분자 및 펩티드를 포함하여 분자를 분리 할 수 있음을 보여줍니다. 우리는 복잡한 생물학적 샘플 분별 및 특성화를 위한 방법을 사용했습니다. 개념의 증거로, 우리는 체메마 실베스트레 식물 추출물을 분획하여 테르페노이드 사포닌 소분자와 펩타이드 가족을 격리시켰습니다. 우리는 또한 모델 시스템으로 칸디다 알비칸스 균구를 사용하여 효과적인 미생물 단백질 분리를 시연했습니다.
서문
복잡한 생물학적 샘플로부터의 생체 분자의 정제는 생물학적 실험1에서필수적이고 종종 어려운 단계이다. 동전 적 초점 (IEF)은 캐리어 앰프가 자신의 전하에 여행하고 전기 필드3에서pH 그라데이션을 설정하는 복잡한 생체 분자의 고해상도 분리에 적합합니다. IEF를 위한 최초의 상용 캐리어 앰프는 1964년 올로프 베스터버그에 의해 개발되었으며4,5의5특허를 받았습니다. 담체 앰플은 다양한 길이와 분지6의알리팔 올리고-아미노 올리고 카복실산 분자이다. 그 후, 베스터버그 와 그 외는 생체 분자를분리하는 확장된 사용을 위해 담체 앰프를6,7로개선하였다.
생체분자를 분리하는 방법에는 아가로즈 및 다환핵증 겔 전기포레시스, 2차원 겔 전기포전증(2-DE), 이소전 초점, 모세관 전기포리스, 이소타초포레시스 및 기타 크로마토그래피 기술(예를 들어, TLC, FPLC, HPLC)2를포함한다. "로토포"라는 기기에서 수행된 액체 상 IEF는 밀라노 비어8에의해 발명되었다. 그는 이 기기의 개념과 디자인을 개척했으며 전기 전구 이동 이론에 광범위하게 기여했습니다. 그의 팀은 또한 컴퓨터 시뮬레이션9에대한 전기 전구 분리 프로세스의 수학적 모델을 개발했다.
상기 액상 IEF 장치는 20개의 다공성 구획과 순환수 냉각 세라믹 로드로 나일론 코어로 구성된 수평 회전 원통형 세포이다. 다공성 챔버는 분자가 전극 사이의 수성 단계를 통해 마이그레이션하고 분획에서 진공 상태에서 정제 된 시료의 수집을 허용합니다. 이 정제 시스템은 &4 시간 에서 특정 분자의 최대 1000 배 정제를 제공 할 수 있습니다. 이 악기의 귀중한 특징은 복잡한 혼합물에서 정화를 위한 첫 번째 단계로 또는순도(10)를달성하기 위한 최종 단계로 적용될 수 있다는 것이다. 관심있는 분자가 단백질인 경우, 또 다른 장점은 분리 중에 그것의 토착 형성이 유지될 것이라는 점입니다.
액체상 IEF의 사용은 단백질, 효소 및 항체 정화6,,10,,11,,,12,13,,14에대해 널리 보고되었다. 여기서 우리는 약용 식물 Gymnema sylvestre에서작은 분자와 펩티드를 분리하고 정화하기위한이 접근 법의 사용을 설명합니다. 이 프로토콜은 연구원이 낮은 비용으로 다운스트림 응용 프로그램을 위해 식물 추출물에서 활성 소분자를 집중하고 정화하는 데 도움이 될 것입니다. 또한, 우리는 또한 칸디다 알비칸스 균류(15)로부터 의 복잡한 단백질 추출물로부터 단백질의 농축이 두 번째 예로 이 IEF 기반 시스템에서 있음을 입증합니다.
프로토콜
1. 표준 액체 상 IEF 장치의 설치 및 사전 실행
- 사용 설명서에 따라 각각의 교환 멤브레인과 함께 액체 위상 IEF 전극(양극-빨간색 버튼 및 음극-블랙 버튼)을 조립합니다(재료표참조). 새로운 멤브레인을 사용할 때 0.1 M NaOH 및 양이온 교환 멤브레인을 0.1 M H3PO4로 최소 16시간 동안 상화한다.
- 멤브레인을 전해질(0.1M NaOH 또는 0.1 M H3PO4)에저장하고 건조시키지 않습니다.
- 이온 교환 개스킷에 3개의 직사각형 구멍을 정렬하여 전극의 내부 및 외부 부분을 조립합니다. 전극을 각각 전해질(~25-30mL)으로 채우면 멤브레인이 건조되는 것을 방지합니다.
- 전극 내부에 압력을 가하고 누출을 일으킬 수 있는 초과(전극 챔버 부피의 1/3rd 이상) 전해질을 첨가하지 마십시오.
- 계측기 조립 부품과 함께 제공되는 밀봉 테이프로 샘플 수집 포트를 덮습니다(재료 표참조). 샘플 수집 포트 측은 두 개의 수직 금속 정렬 핀으로 식별할 수 있습니다. 또는 표준 밀봉 테이프를 사용하여 포트를 밀봉하십시오.
- 세라믹 냉각 손가락 위에 초점 챔버 어셈블리의 모든 부분을 순서대로 조립 (양극 전극, 나일론 멤브레인 코어, 초점 챔버 및 음극 전극).
- 50mL 주사기를 사용하여 미리 냉각된 증류수(표준 IEF 셀의 총 부피 60mL)로 초점 챔버를 채웁니다.
- 액체 상 IEF 기기를 4ºC의 순환 냉각수에 연결하고 장치가 15 W 및 3,000 V에서 3-5분 동안 또는 전압이 안정될 때까지 예식합니다.
참고: 일반적으로 1분 이내에 전압이 최대 설정 값에 도달합니다. 증류수로 미리 실행하면 초점 챔버와 나일론 멤브레인 코어에서 잔류 이온을 제거하는 데 도움이됩니다. - 전원을 끄고 분수 수집기를 사용하여 셀에서 물을 제거합니다. 밀봉 테이프로 컬렉션 포트를 다시 밀봉합니다.
참고: 이제 계측기는 2.4단계에서 사용할 준비가 되었습니다.
2. 짐네마 실베스트레 추출물에서 작은 분자와 펩티드의 분리 및 정제
- 5 분 동안 롤러 튜브에 혼합하여 식물 추출물 0.6 g을 측정하고 증류수 (60 mL)에 용해하십시오.
참고: 용해성 및 염이 없는 모든 생물학적 시료는 이 IEF 계측기를 사용하여 분리 및 정제에 사용할 수 있습니다. 최대 10mM의 완충염 농도를 가진 샘플을 약간 감소된 해상도로 사용할 수 있습니다. 우리는 트리테르페노이드 화합물의 사포닌 가족에 관심이, 체육관 산, G. sylvestre 식물에서 독특한 항진균 속성16. - 용해성 식물 추출물을 10,000 x g에서 5분 동안 원심분리하여 불용성 입자를 제거합니다.
- 상체(~60mL)를 80mL 원심분리기 튜브로 옮기고 0.6mL의 앰프홀리트(pH 3-10)와 1%(v/v)로 혼합한다.
- 1.1 - 1.7 단계를 수행하여 액체 위상 IEF 장치를 준비하십시오. 챔버는 이제 샘플을 로드할 준비가 되었습니다.
- 1-1/2 인치 19 G 무딘 엔드 바늘 (기기와 함께 제공)와 50 mL 주사기를 사용하고 샘플 수집 포트를 통해 셀에 ampholyte (총 60 mL)로 준비 된 샘플을로드합니다.
- 스탠드에서 초점 셀을 제거하고 전극 챔버를 눌러 기포를 제거하여 기포를 제거합니다. 기포가 존재하면 전압 및 전류 변동이 발생하고 실행에 영향을 미칩니다.
- 장치를 물 냉각수(4°C)에 연결하고 일정한 15W의 전원 공급 장치로 분획을 시작합니다.
- 3시간 동안 또는 전압이 일정한 값에 도달할 때까지 장치를 실행합니다.
참고: 샘플의 집중이 시작되면 전압이 일정한 값에 도달할 때까지 점진적으로 상승하기 시작합니다. - 실행 후, IEF 장치에서 수확 버튼 ON을 눌러 진공 펌프에 연결된 수확 상자 (20 개의 플라스틱 튜브, 12mm x 75mm, 5-6 mL 부피 포함)에서 분획을 수집 할 준비를하십시오.
- 테이프로 밀봉된 초점 셀의 20개 컬렉션 포트와 20컬렉션 핀을 정렬합니다.
- 밀봉 테이프를 통해 컬렉션 핀을 밀어 동시에 진공 펌프ON을 켭니다(그림 2B, 2C 및 2D참조).
참고: 각 챔버에서 약 3mL 분획은 매번 튜브로 수집됩니다. 분수는 후속 다운스트림 응용 분야(펩타이드 정량화를 위한 SDS-PAGE, 작은 분자의 경우 TLC 및 바이오아세이)에 사용될 수 있다.
3. C. 알비칸에서 단백질의 분리 및 정제
- 효모 펩톤-덱스트로스(YPD)에서 C. 알비칸의 단일콜로니를 30°C에서 30°C에서 16개에서 성장시키고, 밤새 흔들림(200rpm)을 드키세요.
- 원심분리(5분 동안 10,000 x g)로 효모 세포를 수집합니다.
- 암모늄 탄산염(1.89 g/L) 완충제에서 알비칸 효모 세포를 일시 중단하고 1% (v/v) 베타-메르카토에탄올(β-ME) (배양 볼륨의 1/10번째)를 함유하고 5°C15에서1시간 동안 롤러튜브에서 회전한다.
- 원심분리(5분 동안 10,000x g)에 의해 효모 세포를 제거하고 0.45 μm 필터를 통해 단백질 추출물을 필터링한다.
참고: C. 알비칸시토솔, 막 또는 세포벽의 단백질 샘플은 IEF 분획을 위해 제조및 사용될 수 있다. 유사하게, 박테리아 또는 다른 생물학적 샘플(동물 조직 추출물)의 단백질은 적절한방법(예:투석 또는 탈염 컬럼 을 사용하여)에 의해 어떤 염도를 제거한 후에 사용될 수 있다. - 투석 튜브(3,500 MWCO)에서 4°C에서 15시간 동안 물에 단백질 추출물을 투석합니다. 표준17로감마 글로불린을 사용하여 브래드포드 염료 결합 방법에 의한 단백질 농도를 추정한다.
- 분획을 위해 1% (v/v) 앰프홀리트(pH 5-8)를 함유한 60mL의 물에 총 단백질 500 mg을 사용하십시오.
참고: 광대한 앰프(pH 3-10)는 C. 알비칸스의 특정 비글루칸 부착 세포벽 단백질을 풍부하게 하지 않기 때문에, 좁은 범위(pH 5-8) 앰프를 사용한다. 시료 단백질 농도가 2 mg/mL 이상이면 최대 2%의 앰프를 사용할 수 있습니다. 이것은 집중하는 동안 단백질 응집을 최소화합니다. 항상 샘플, 앰프홀리트 및 물을 얼음 위에 미리 냉각하십시오. - IEF 장치를 준비하고 IEF 세포에 로드하는 단계 3.6에서 단백질 용액을 사용하기 위해 1.1- 1.7 단계를 반복합니다.
- 상수 15W에 초점을 맞춘 4시간 후, 전술한 바와 같이 단백질 분수(1-20)를 수확하고(단계 2.9-2.11) 단백질 샘플을 감소시키고 끓인 후 12.5% SDS-PAGE를분석한다.
- 쿠마시 블루 염료(0.01%)로 SDS-PAGE 젤을 염색하여 해결된 단백질을 얼룩지게 합니다. 로커의 실온에서 2-3 h용액. 젤을 데스테인하고 젤 이미저를 사용하여 젤 이미지를 기록합니다.
참고: 쿠마시 블루 염료 (0.01%) 40% 메탄올과 10% 아세트산을 함유한 디스테인링 용액에 쿠마시 블루 파우더 0.01 g을 혼합하여 제조할 수 있다.
4. 식물 추출물 짐네마 실베스트레에서 정제 된 작은 분자의 생물 활성
- 3.1 단계에서와 같이 효모 세포에서 C. 알비칸을 성장시다.
- 세포 현탁액을 준비하기 위해, C. 알비칸효모세포(1/1000 희석)의 하룻밤 배양을 50mM의 포도당으로 보충한 신선한 RPMI 세포 배양 배지로 희석한다. C. albicans
참고: C. 알비칸은 효모 성장에서 최면 유도 조건하에서 하이프로 변환합니다(RPMI at 37°C). 김네믹산 소분자는 효모세포의 효모세포의 효모세포의 효모세포의 효모세포의 효모세포의 효모를 하이파유도조건(16)에서하이파로 변환하는 것을 억제하는 것으로 나타났다. 우리는 액체 상-IEF 분리 G. 실베스트레 추출물이 이러한 생리 활성 분자를 포함하고 있는지 확인하는 것을 목표로했습니다. - 준비된 셀 서스펜션에서 96웰 플레이트의 각 웰에 90 μL을 추가합니다.
- 각 분획(액체상 IEF, 도 4로부터얻어진 G. 실베스트레 추출물의 1-20개 수확분획에서) 상기 세포 현탁액의 90 μL을 가진 우물에 10μL을 첨가한다(단계 4.2). 삼중에서 분석작업을 수행합니다.
- 앰프홀리트가 포함된 물 10μL 추가(1%) C. 알비칸스 효모 세포 현탁액의 90 μL을 음의 대조군으로 분리된 우물로 넣습니다.
참고 : 앰프홀리트는 생체 활성 잠재력을 가지고 있으므로 생물 분석19을수행하는 동안 앰프를 포함하는 것이 필수적입니다. - 12시간 동안 37°C에서 96웰 플레이트를 배양하고현미경(16)에서 C. 알비칸효모-하이파 변환의 억제를 관찰한다. 또한 효모-hypha 변환의 억제 비율을 결정합니다.
결과
짐네마 실베스트레 식물 추출물에서 작은 분자와 펩티드의 분리 및 정제
전균형 액체상 IEF 방법을 사용하여, 우리는 인간 병원성 곰팡이, C. 알비칸으로부터약용 식물 추출물과 세포 표면 단백질을 분획하였다. 이러한 분별 프로토콜의 회로도는 그림 1에표시됩니다.
액체 상 IEF로부터 얻은 G. 실베스트레 추출물의 20분피로부터, 어두운 색분자(테르페노이드 사포닌)는 양극 단부(pH 2-3)에서 이동하고 농축되는 것으로 나타났으며, 음극 말단(pH 8-9)에서 경황한 맑은 분획이 관찰되었다(그림 2). 각 분획(1-20)에서 알리쿼트(20 μL)는 시료를 줄이고 끓인 후 15% SDS-PAGE에서 해결하였다. 쿠마시 블루 스테인드 젤은 분수 16-19(도 3)로농축되는 약 5 kDa의 확산 된 폴리 펩티드 밴드를 나타낸다. G. sylvestre 식물은 4,209 Da20의예측 분자량과 35 아미노산 gurmarin 기본 폴리 펩티드를 포함하는 것으로 보고되었다. 박테리아, 식물 및 동물은 펩티드를 함유하고 있습니다. 이들 중 상당수는 원형(knottins)이며 살충제 및 항균성질(21,,22)과같은 광범위한 생물학적 활동으로 안정적이다.
분리된 체육관산의 생물학적 활성
G. sylvestre 식물은 또한 주요 성분으로 체육관산 (테르페노이드 사포닌)을 포함16,,23,,24. 예상대로, 분획 1및 다음 몇 분획에서 이러한 작은 분자는 비 단백질이기 때문에 SDS-PAGE 및 Coomassie 염색(그림 3)에의해 검출되지 않았다. 그러나, 이러한 작은 분자는 TLC에 의해 분리되고 UV빛(도 4A,차선 F1)하에서 검출될 수 있다. 분수 10은 대부분의 유기 소분자가 분수 1-3에서 농축되었다는 것을 건의하는 TLC에 이러한 작은 분자의 검출 가능한 양을 포함하지 않았다. 김계산(GAs) 분자는 C. 알비칸효약-하이파 전이(16,,25)를억제하는 것으로 나타났다. 우리는 C. 알비칸효약-하이파 변환 및 최면 성장에 대한 그들의 억제 활성을 위해 이 연구에서 수집된 모든 20개의 분수(16)를 분석하였다.16 결과는 그림 4B,4C에표시됩니다. 가장 높은 활동은 여러 반점을 볼 수있는 TLC 결과에 동의하는 분수 1에서 관찰됩니다. 체육관산의 이소머스가 존재하며 모두 유사한 생물학적 활동이10. 이들 이소목은 분수 1-3으로 분리되었고 C. 알비칸스 최면성장(도 4A,4C, 분획 1)의 억제를 보여주었다. 1에서 10으로 진행됨에 따라 최면 억제 정도가 점차 감소하였다. 거의 또는 전혀 활성분획 10 이상으로 얻어졌다.
병원성 곰팡이, C. 알비칸에서 세포 표면 단백질의 분리
C. 알비칸스 세포 표면 단백질의 액체 상 IEF 분획으로부터의 결과는 도 5에도시된다. 이러한 세포 표면 단백질은 C. 알비칸 접착 및 병기발생 (26)에서중요한 역할을한다. 다른 분획에서 몇몇 농축된 단백질 (화살표)가 관찰되었습니다. 이것은 칸디다 감염 인간 혈청 및/또는 질량 분석법에 의한 그들의 식별을 가진 그들의 면역학적 반응을 확인을 허용할 수 있습니다. 유사하게, 다른 세포 분수(예를 들어, 세포질 및 세포벽)에서 단백질은 이 IEF 방법을 사용하여 분별될 수 있다. 액체 상 IEF 기지를 둔 정제는 질량 분광법 분석과 결합될 때 복잡한 생물학 견본에서 저풍부 단백질의 확인을 허용할 것입니다.
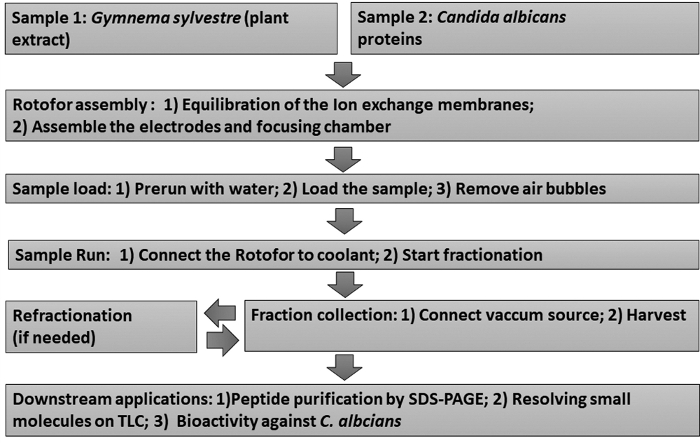
그림 1: 실험 워크플로를 보여주는 흐름 차트입니다. 단계별 액체 상 IEF 분별 절차 및 후속 다운스트림 소표가 묘사됩니다. 샘플에는 Gymnema sylvestre 잎 추출물 (샘플 1) 및 칸디다 알비칸스 비 글루칸 부착 효모 단백질 (샘플 2)이 포함됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: G. 실베스트레 식물 추출물의 액체 상 IEF 장치 설정 및 분획. (A)실행 중,(B)분획 수집 중,(C)분획 수집 후,(D)액체 상 IEF 장치 부품, 1) 이온 교환 멤브레인, 2) 초점 챔버 및 멤브레인 코어, 3) 전극 조립 (네거티브), 4) 전극 조립 (양성). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: IEF 집중 식물 추출물 분획의 SDS-PAGE 분리. L-래더, PC-양성 제어(펩티드), 0-입력 샘플, 1-20 분리된 분획. SDS-PAGE(15% 해결 젤)는 쿠마시 블루 염료에 의해 염색되어 분수 1-20으로부터 해결된 펩티드(~5kDa)를 시각화하였다. 분수 1-3은 쿠마시 블루 염료에 의해 염색/ 검출할 수 없는 작은 분자(분수 1에는 농축된 화합물을 나타내는 어두운 색을 가지고 있음)를 함유하고 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
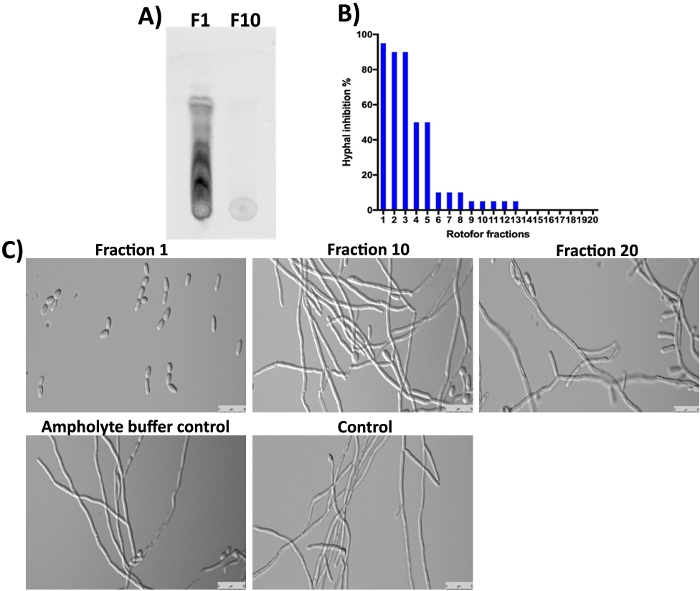
그림 4: TLC에 의한 IEF 분획 된 작은 분자의 분석 및 C. albicans에대한 생체 활성의 결정. (A)분수 #1 및 #10 소분자의 TLC 분석을 나타낸다. 활성화된 실리카 젤 플레이트는 샘플의 ~5 μL을 발견하고 톨루엔으로 달렸다: 클로로폼: 메탄올 용매(5:8:3 비율)가 용매 전면이 마진에 도달할 때까지. TLC 분리 화합물은 피형성 UV 광(310 nm) 하에서 검출되었다. (B) C. 알비칸효약체의 효모-하이파 변환의 %억제를 상이한 분획에 의한 억제를 나타낸다. (C)하이파 유도 조건 하에서 C. 알비칸의 세포 형태를 입증한다. 분수 #1 최대(98%)를 표시합니다. 효모-하이파 변환의 억제. 다른 분획 및 대조군은 37°C에서 12시간 동안 배양한 후 C. 알비칸스 최면 성장을 억제하지 않는다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: C. 알비칸세포 표면 단백질(비글루칸 부착)의 SDS-PAGE 분석. L-래더, 0-입력 샘플, 좁은 범위(pH 5-8) 앰프를 사용하여 표준 액체 상 IEF 셀에서 IEF 후 수집된 1-18 분획. 이미지는 SDS 페이지(12.5%)를 보여줍니다. 쿠마시 블루 염료로 염색 한 후 단백질을 해결했습니다. 몇몇 단백질은 특정 분수 (화살표)에서 풍부했습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
천연 제품 소스에서 작은 분자 (예를 들어, 식물) 화학 구조에서 매우 다양 한 복잡 한 이차 대사 산물을 포함. 그들은 식물 방어 메커니즘에 관여하는 것으로 추정된다. 또한, 폴리펩타이드는 식물조직(22)에도존재한다. 이러한 천연 제품 작은 분자는 약물 발견 및 개발을 위한 테스트 분자의 풍부한 소스. 그러나, 그들의 격리 및 정화에 필요한 어렵고 지루한 방법은 치료 응용 프로그램에 대한 사용을 제한한다. 이 보고서에 사용된 액체 상 IEF 접근법은 생체 활동을 손상시키지 않고 이러한 작은 분자와 폴리펩티드를 분리하는 능력을 강조합니다.
이 IEF 기반 방법은 복잡한 혼합물에서 정제 된 단백질의 농도, 집중 중 및 후 토착 변형의 유지, 교차 오염없이 개별 정제 된 분획으로 샘플의 수집을 포함하여 생물학적 분자를 분리하는 몇 가지 장점을 제공합니다. 필요한 경우, 샘플은 단백질 동위 형태를 정화하기 위해 좁은 pH 범위로 다시 초점을 맞출 수 있습니다. 소형 IEF 초점 셀(~15mL)을 사용할 수 있기 때문에 소량의 샘플에도 사용할 수 있습니다. 이 보고서에서 새로운 발견은 유기 작은 분자와 펩티드는 복잡한 식물 추출물에서 분리 될 수 있다는 것입니다. 작은 분자가 IEF에 의해 천연 제품 추출물과 분리 될 수 있다는 것에 동의하기는 어렵지만, 암포성 화합물인 화합물에 대해 그럴듯합니다. G. sylvestre 추출물의 gurmarin 펩타이드로부터 분리된 체육관산은 카복실산 군을 함유하거나 적어도 사용되는 앰프홀리트의 존재에서 그렇게 행동하기 때문에 암포성으로 보입니다. 글리코사이드는 체육관산과 유사한 생리활성 천연 분자이기 때문에, IEF 방법을 사용하여 복잡한 천연 공급원으로부터 분리할 수 있다. 유사하게, 천연 물에서 펩티드는 또한 이 액체 상 IEF 접근을 사용하여 격리될 수 있습니다.
이 접근법의 한계 중 일부는 모든 작은 분자가 적어도 수용성 및 약하게 증폭되어야하기 때문에 IEF 방법에 의해 분별 될 수 있다는 것입니다. 여기에 사용된 추출물은 건조된 식물 물질의 50% 메탄올 추출에 의해 제조되었지만 수용성이다. 용매 용해성 및 앰포상 화합물에 대한 IEF 방법의 사용은 일부 유기 용매가 액체 상 IEF 기기 구성 요소와 호환되지 않는 것으로 볼 수 남아있다. 낮은 이온 강도 솔루션에서 동전점(pI)에서 침전하는 단백질의 경향은 잘 알려져 있습니다. 그러나, 회전IEF 시스템에서, 단백질 강수량은 그들의 pI 지점에서 순환에 집중된 단백질이 남아 있기 때문에 감소됩니다.
이 IEF 분리에서 고농도의 단백질을 사용하는 경우 강수량이 발생할 수 있습니다. 단백질 강수량을 최소화하고 단백질 집중을 개선하기 위해, 우레아는 CHAPS, 디지토닌 및 낮은 농축 세제(0.1-1%)와 같은 3-5M의 니오니안 세제까지 사용할 수 있습니다. 또한 IEF 동안 단백질 응집을 줄이기 위해 사용할 수 있습니다. 그러나, 우레아와 세제는 그들의 활동을 위한 단백질을 분석하기 전에 제거될 필요가 있고 어떤 경우에는, 이 에이전트는 단백질 기능에 영향을 미칠 수 있습니다. 액체 단계 IEF 실행 중에 고려해야 할 몇 가지 중요한 단계는 기포없이 IEF 초점 셀을 로드하고, 손상된 경우 이온 교환 멤브레인을 교체하고, 특정 수의 반복 된 사용 후 통풍구 버튼을 교체하는 것을 포함한다.
결론적으로, 액체상 IEF 방법을 사용하여, 우리는 G. 실베스트레 잎 추출물로부터 생리활성 체육관산과 구르마린 폴리펩티드의 분리를 보여주었다. 또한, 액체 상 IEF는 병원성 미생물의 복잡한 조질 추출물로부터 선택적 단백질을 풍부하게 하는 데 유용할 수 있다.
공개
저자는 경쟁 적인 재정적 이익을 선언 하 고 싶습니다.
감사의 말
우리는 GV에 각각, BRIEF와 IRA 상을위한 생물학과 존슨 암 연구 센터의 자금 출처에 감사드립니다. 또한 RV에 대한 K-INBRE 박사 후 상을 수상해 주셔서 감사합니다. 이 작품은 보조금 번호 P20 GM103418에서 건강의 국립 연구소의 국립 일반 의학 연구소에서 기관 개발 상 (IDeA)에 의해 부분적으로 지원되었다. 콘텐츠는 전적으로 저자의 책임이며 반드시 국립 일반 의학 연구소 또는 국립 보건 원의 공식 견해를 나타내는 것은 아닙니다. 익명의 검토자에게 유용한 의견을 전해 주셔서 감사합니다.
자료
| Name | Company | Catalog Number | Comments |
| 0.45 µm syringe filter | Fisher scientfic | 09-720-004 | |
| 2-Mercaptoethanol | Sigma | M3148 | |
| Ammonium carbonate | Sigma-Aldrich | 207861-500 | |
| Bio-Lyte 3/10 Ampholyte | Bio-Rad | 163-1113 | |
| Bio-Lyte 5/8 Ampholyte | Bio-Rad | 163-1192 | |
| Compact low temperature thermostat | Lauda -Brinkmann | RM 6T | Set water cooling to 4 oC and it can be run even at 0 oC as when it passes through the Rotofor cooling core, the circulating water temperature will be around 5 or more depending on the voltage. |
| Coomassie Brilliant Blue R | Sigma-Aldrich | B7920 | |
| Dialysis tubing (3,500 MWCO) | Spectrum Spectra/Por | 132112T | |
| Gymnema plant leaf extract powder (>25% Gymnemic acids) | Suan Farma, NJ USA | ||
| Incubator | Lab companion | SI 300R | |
| Microscope | Leica | DM 6B | |
| Mini protean electrophoresis | Bio-Rad | ||
| pH meter | Mettler Toledo | S20 | Useful to determine the pH of the Rotofor (liquid-phase IEF) fractions |
| Rotofor | Bio-Rad | 170-2972 | http://www.bio-rad.com/webroot/web/pdf/lsr/literature/M1702950E.pdf (Rotofor Instruction manual for assembling the unit) |
| RPMI-1640 Medium | HyClone | DH30255.01 | |
| Sealing tape | Bio-Rad | 170-2960 | Scotch tape may also be used. |
| Sorvall legend micro 17 centrifuge | Thermo scientific | 75002432 | |
| TPP tissue culture plate -96 well flat bottom | TPP | TP92696 |
참고문헌
- Jankowska, U., et al. Optimized procedure of extraction, purification and proteomic analysis of nuclear proteins from mouse brain. Journal of Neuroscience Methods. 261, 1-9 (2016).
- Pergande, M. R., Cologna, S. M. Isoelectric Point Separations of Peptides and Proteins. Proteomes. 5 (1), (2017).
- Stoyanov, A. IEF-based multidimensional applications in proteomics: toward higher resolution. Electrophoresis. 33 (22), 3281-3290 (2012).
- Vesterberg, O. A. Y. . Method of Isoelectric Fractionation. , (1964).
- Vesterberg, O., Svensson, H. Isoelectric fractionation, analysis, and characterization of ampholytes in natural pH gradients. IV. Further studies on the resolving power in connection with separation of myoglobins. Acta Chemica Scandinavica. 20 (3), 820-834 (1966).
- Righetti, P. G. . Isoelectric Focusing: Theory, Methodology and Applications. , 1 (1983).
- Vesterberg, O. Synthesis and Isoelectric Fractionation of Carrier Ampholytes. Acta Chemica Scandinavica. 23, 2653-2666 (1969).
- Bier, M. Recycling isoelectric focusing and isotachophoresis. Electrophoresis. 19 (7), 1057-1063 (1998).
- Bier, M., Palusinski, O. A., Mosher, R. A., Saville, D. A. Electrophoresis: mathematical modeling and computer simulation. Science. 219 (4590), 1281-1287 (1983).
- Ayala, A., Parrado, J., Machado, A. Use of Rotofor preparative isoelectrofocusing cell in protein purification procedure. Applied Biochemistry and Biotechnology. 69 (1), 11-16 (1998).
- Wagner, L., et al. Isolation of dipeptidyl peptidase IV (DP 4) isoforms from porcine kidney by preparative isoelectric focusing to improve crystallization. Biological Chemistry. 392 (7), 665-677 (2011).
- Hosken, B. D., Li, C., Mullappally, B., Co, C., Zhang, B. Isolation and Characterization of Monoclonal Antibody Charge Variants by Free Flow Isoelectric Focusing. Analytical Chemistry. 88 (11), 5662-5669 (2016).
- Yu, J. J., et al. Francisella tularensis T-cell antigen identification using humanized HLA-DR4 transgenic mice. Clinical Vaccine Immunology. 17 (2), 215-222 (2010).
- Riyong, D., et al. Size and charge antigens of Dirofilaria immitis adult worm for IgG-ELISA diagnosis of bancroftian filariasis. Southeast Asian Journal of Tropical Medicine and Public Health. 41 (2), 285-297 (2010).
- Vediyappan, G., Bikandi, J., Braley, R., Chaffin, W. L. Cell surface proteins of Candida albicans: preparation of extracts and improved detection of proteins. Electrophoresis. 21 (5), 956-961 (2000).
- Vediyappan, G., Dumontet, V., Pelissier, F., d'Enfert, C. Gymnemic acids inhibit hyphal growth and virulence in Candida albicans. PLoS One. 8 (9), 74189 (2013).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry. 72, 248-254 (1976).
- Laemmli, U. K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 227 (5259), 680-685 (1970).
- Riazi, S., Dover, S., Turovskiy, Y., Chikindas, M. L. Commercial ampholytes used for isoelectric focusing may interfere with bioactivity based purification of antimicrobial peptides. Journal of Microbiological Methods. 71 (1), 87-89 (2007).
- Kamei, K., Takano, R., Miyasaka, A., Imoto, T., Hara, S. Amino-Acid-Sequence of Sweet-Taste-Suppressing Peptide (Gurmarin) from the Leaves of Gymnema-Sylvestre. Journal of Biochemistry. 111 (1), 109-112 (1992).
- Craik, D. J. Chemistry. Seamless proteins tie up their loose ends. Science. 311 (5767), 1563-1564 (2006).
- Craik, D. J., Daly, N. L., Bond, T., Waine, C. Plant cyclotides: A unique family of cyclic and knotted proteins that defines the cyclic cystine knot structural motif. Journal of Molecular Biology. 294 (5), 1327-1336 (1999).
- Stoecklin, W. Chemistry and physiological properties of gymnemic acid, the antisaccharine principle of the leaves of Gymnema sylvestre. Journal of Agricultural and Food Chemistry. 17 (4), 704-708 (1969).
- Liu, H. M., Kiuchi, F., Tsuda, Y. Isolation and structure elucidation of gymnemic acids, antisweet principles of Gymnema sylvestre. Chemical & Pharmaceutical Bulletin (Tokyo). 40 (6), 1366-1375 (1992).
- Veerapandian, R., Vediyappan, G. Gymnemic Acids Inhibit Adhesive Nanofibrillar Mediated Streptococcus gordonii-Candida albicans Mono-Species and Dual-Species Biofilms. Frontiers in Microbiology. 10, 2328 (2019).
- Chaffin, W. L. Candida albicans cell wall proteins. Microbiology and Molecular Biology Reviews. 72 (3), 495-544 (2008).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유