Method Article
Отделение биологически активных малых молекул, пептиды из природных источников и белки от микробов по методу preparative Isoelectric Focusing (IEF)
В этой статье
Резюме
Цель состоит в том, чтобы дробить и изолировать биологически активные мелкие молекулы, пептиды из сложного растительного экстракта и белки из патогенных микробов, используя жидко-фазный изоэлектрический метод фокусировки (IEF). Кроме того, были идентифицированы разделенные молекулы и подтверждена их биоактивность.
Аннотация
Натуральные продукты, полученные из растений и микробов, являются богатым источником биологически активных молекул. Перед их использованием активные молекулы из сложных экстрактов должны быть очищены для применения ниже по течению. Существуют различные хроматографические методы, доступные для этой цели, но не все лаборатории могут позволить себе методы высокой производительности и изоляции от сложных биологических образцов может быть трудно. Здесь мы демонстрируем, что preparative liquid-phase isoelectric focusing (IEF) может отделять молекулы, в том числе небольшие молекулы и пептиды из сложных растительных экстрактов, на основе их изоэлектрических точек (pI). Мы использовали метод для сложной фракционации и характеристики биологических образцов. В качестве доказательства концепции, мы дроболовый экстракт Гимнема сильвестр растений, изолируя семейство терпеноидных сапонин малых молекул и пептид. Мы также продемонстрировали эффективное разделение микробного белка с использованием грибка Candida Albicans в качестве модели системы.
Введение
Очистка биомолекулы из сложных биологических образцов является важным и часто трудным шагом в биологических экспериментах1. Изоэлектрическая фокусировка (IEF) хорошо подходит для разделения высокого разрешения сложных биомолекул, где несущая амфолиты путешествуют в соответствии с их зарядом и устанавливают градиент рН в электрическом поле3. Первый коммерческий авиаперевозчик для IEF был разработан Улофом Вестербергом в 1964 году и запатентовал4,5. Перевозчик амфолиты алифатические олиго-амино олиго-карбокслихиловой кислоты молекул различной длины и ветвящихся6. Впоследствии Вестерберг и другие улучшили перевозчик амфолитов для их расширенного использования в разделении биомолекул6,7.
Методы разделения биомолекул включают агарозу и полиакриламинид гель электрофорез, двухмерный гель электрофорез (2-DE), изоэлектрической фокусировки, капиллярный электрофорез, изотахофорез и другие хроматографические методы (например, TLC, FPLC, HPLC)2. Ликвид-фазный IEF, выполненный в инструменте под названием "Rotofor", был изобретен Миланом Биром8. Он был инициатором концепции и дизайна этого инструмента и внес значительный вклад в теорию электрофоретической миграции. Его команда также разработала математическую модель электрофоретического процесса разделения для компьютерного моделирования9.
Аппарат IEF-фазы является горизонтально вращающейся цилиндрической ячейкой, состоящей из нейлонового ядра, разделенного на 20 пористых отсеков и циркулирующего керамического стержня для охлаждения воды. Пористие камеры позволяют молекулам мигрировать через аквеи между электродами и позволяют сбор очищенных образцов под вакуумом в фракциях. Эта система очистки может обеспечить до 1000-кратное очищение конкретной молекулы в Зтт;4 часа. Ценной особенностью этого инструмента является то, что он может быть применен в качестве первого шага для очистки от сложной смеси или в качестве заключительного шага для достижения чистоты10. Если молекулой интереса является белок, еще одним преимуществом является то, что его родная конформация будет поддерживаться во время разделения.
Использование жидко-фазы IEF было широко сообщено для белков, ферментов и очищения антител6,,10,,11,12,13,14. Здесь мы описываем использование этого подхода для разделения и очистки малых молекул и пептидов от лекарственного растения Gymnema sylvestre. Этот протокол поможет исследователям сконцентрировать и очистить активные малые молекулы из растительного экстракта для приложений ниже по течению по низкой цене. Кроме того, мы также демонстрируем, что обогащение белков из сложного белкового экстракта из гриба Candida albicans 15 в этой системе на основе IEF в качестве второго примера.
протокол
1. Настройка и предзахугивание стандартного жидко-фазного блока IEF
- Соберите жидко-фазные электроды IEF (анодно-красная кнопка и катодно-черная кнопка) с их соответствующими мембранами обмена в соответствии с инструкцией (см. Таблицу Материалов). Эквилибрировать мембраны аниона обмена с 0,1 M NaOH и катиона обменных мембран с 0,1 M H3PO4 по крайней мере для 16 ч, когда новые мембраны используются.
- Храните мембраны в электролитах (0,1 M NaOH или 0.1 M H3PO4) между пробегами и не позволяйте высохнуть.
- Соберите внутреннюю и внешнюю часть электрода, выровняв три продолговатых отверстия в ионо-обменных прокладок. Заполните электроды соответствующими электролитами (25-30 мЛ), чтобы предотвратить высыхание их мембран.
- Не добавляйте избыток (более 1/3rd объема электродной камеры) электролит, который может создать давление внутри электрода и вызвать утечку.
- Обложка порта сбора образцов с уплотнительной лентой, которая поставляется с инструментами сборки частей (см. Таблица материалов). Сторона портов сбора образца может быть идентифицирована двумя вертикальными металлическими контактами выравнивания. Кроме того, используйте стандартную уплотнительную ленту для уплотнения портов.
- Соберите все части фокусировки камеры сборки в последовательности (анодный электрод, ядро нейлоновой мембраны, фокусировки камеры и катодный электрод) над керамическим охлаждающим пальцем.
- Заполните фокусировочный зал предварительно позолоченной дистиллированной водой (общий объем 60 мл для стандартной ячейки IEF) с помощью шприца 50 мл.
- Подключите жидкостную фазу IEF-прибора к циркулирующей охлаждающей воде при 4 oC и препроводите устройство при 15 Вт и 3000 В в течение 3-5 мин или до тех пор, пока напряжение не стабилизируется.
ПРИМЕЧАНИЕ: Как правило, в течение одной минуты напряжение достигнет максимальных значений набора. Предварительное обслуживание дистиллированной водой помогает удалить остаточные ионы из фокусировочных камер и ядра нейлоновой мембраны. - Выключите источник питания и удалите воду из ячейки с помощью фракционного коллектора. Повторно запечатывание коллекторских портов с уплотнительной лентой.
ПРИМЕЧАНИЕ: Теперь инструмент готов к использованию в шаге 2.4.
2. Разделение и очищение малых молекул и пептидов из экстракта Gymnema sylvestre
- Измерьте 0,6 г растительного экстракта и растворите в дистиллированной воде (60 мл) путем смешивания в роликовой трубке в течение 5 мин.
ПРИМЕЧАНИЕ: Любой биологический образец, который растворим и не состоит из соли, может быть использован для разделения и очистки с помощью этого инструмента IEF. Образцы с буферизацией концентрации соли до 10 мМ можно использовать с немного пониженным разрешением. Мы заинтересованы в сапонин семьи тритерпеноидных соединений, gymnemic кислоты, от G. sylvestre завода за их уникальные противогрибковые свойства16. - Центрифуга солюбилизованный растительный экстракт на 10000 х г в течение 5 минут для удаления нерастворимых частиц.
- Перенесите супернатант (60 мЛ) в центрифуговую трубку 80 мЛ и смешайте его с 0,6 мл амфолита (рН 3-10) до 1% (v/v).
- Следуйте шагам 1.1 – 1.7 для подготовки жидко-фазного блока IEF. Камера готова к загрузке образца.
- Используйте шприц 50 мЛ с 1-1/2 дюйма 19 G тупой иглой конца (поставляется с инструментом) и загрузить подготовленный образец с амфолитом (60 мл всего) в ячейке через порты сбора образцов.
- Удалите пузырьки воздуха из образец ячейки, удалив фокусировки ячейки из стенда и нажав на электрод камеры, чтобы выбить пузырьки. Наличие пузырьков воздуха вызовет напряжение и текущие колебания и повлияет на пробег.
- Подключите устройство к водяной охлаждающей охлаждающей охлаждающей охлаждающей энергии (4 градуса По Цельсию) и начните фракционирование с блоком питания при постоянном 15 Вт.
- Выполнить аппарат для 3 ч или до тех пор, пока напряжение достигает постоянного значения.
ПРИМЕЧАНИЕ: По мере того как образец начинает фокусировать, напряжение начнет поднимать постепенно до тех пор пока оно не достигнет постоянн значения. - После пробежки приготовьтесь собирать фракции в ящике для сбора урожая (содержащих 20 пластиковых трубок, 12 мм х 75 мм, объем 5-6 мл), подключенных к вакуумному насосу, нажав кнопку сбора урожая ON в блоке IEF.
- Выровняйте 20-коллекционные булавки с 20-коллекционных портов фокусировочной ячейки, которая запечатана лентой.
- Нажмите коллекционные булавки через уплотнительную ленту и поверните вакуумный насос ON одновременно (см. рисунок 2B, 2C и 2D).
ПРИМЕЧАНИЕ: Около 3 мЛ фракций от каждой камеры будут собраны в трубы для каждого времени. Фракции могут быть использованы для последующих приложений вниз по течению (SDS-PAGE для пептидной количественной оценки, TLC и биоанализа для малых молекул).
3. Разделение и очищение белков от C. albicans
- Выращивайте одноколечную колонию C. albicans в дрожжевом пептоне-декстрозы (YPD)бульоне 16 при 30 градусах с встряхиванием (200 об/мин) на ночь.
- Собирайте дрожжевые клетки путем центробежия (10 000 х г в течение 5 мин).
- Приостановить C. albicans дрожжевых клеток в карбонат аммония (1,89 г/ л) буфер, содержащий 1% (v/v) бета-меркаптоэтанол (Я-ME) (1/10th объема культуры) и вращаться в роликовой трубке на 1 ч при 5 С15.
- Удалите дрожжевые клетки путем центрифугации (10000 х г в течение 5 мин) и фильтруем экстракт белка через фильтр 0,45 мкм.
ПРИМЕЧАНИЕ: Образцы белка из C. Albicans цитозол, мембраны или клеточной стенки могут быть подготовлены и использованы для фракционации IEF. Аналогичным образом, белки из бактерий или других биологических образцов (экстракт тканей животных) могут быть использованы после удаления любой соли соответствующими методами(например,путем диализа или с использованием опреснения столбцов). - Диализный экстракт белка в диализной трубке (3500 МВТКО) против воды в течение 15 ч при 4 градусах Цельсия. Оцените концентрацию белка методом связывания красителей Брэдфорда с использованием гамма-глобулина в качестве стандартного17.
- Используйте 500 мг общего белка в 60 мл воды, содержащей 1% (v/v) амфолит (рН 5-8) для фракционации.
ПРИМЕЧАНИЕ: Поскольку широко диапазон амфолита (рН 3-10) не обогащает некоторые неглукановые прикрепленные клеточные стенки белки C. albicans хорошо, используйте узкий диапазон (рН 5-8) амфолит. Концентрация амфолита до 2% может быть использована, если концентрация белка образца превышает 2 мг/мЛ; это сводит к минимуму агрегацию белка во время фокусировки. Всегда держите образцы, амфолиты, и вода предварительно помолилась на льду. - Повторите шаги 1.1- 1.7 для подготовки блока IEF и используйте белковый раствор от шага 3.6 к нагрузке в ячейку IEF.
- После 4 h фокусировки на постоянной 15 Вт, урожай белковых фракций (1-20), как описано выше (шаги 2,9-2,11) и проанализировать на 12,5% SDS-PAGE после сокращения и кипячения белковых образцов18.
- Окрашивание решенных белков путем окрашивания гель SDS-PAGE с синим красителем Coomassie (0.01%) раствор для 2-3 ч при комнатной температуре на рокере. Отсейть гель и записать изображение геля с помощью геля.
ПРИМЕЧАНИЕ: Кумасси синий краситель (0.01%) может быть подготовлен путем смешивания 0,01 г Синяя порошок Coomassie в растворе, содержащем 40% метанола и 10% уксусной кислоты.
4. Биоактивность очищенных малых молекул из растительного экстракта Gymnema sylvestre
- Выращивайте C. albicans в дрожжевых клетках как в шаге 3.1.
- Для подготовки клеточной суспензии разбавляйте ночную культуру дрожжевых клеток C. albicans (1/1000 разбавления) в свежую клеточную культуру RPMI, дополненную 50 мМ глюкозой.
ПРИМЕЧАНИЕ: C. albicans преобразует из роста дрожжей в гифы при гипхальском индуцирующих условиях (RPMI при 37 градусов по Цельсию). Гимнемические кислоты малых молекул, как показано, ингибируют преобразование дрожжевых клеток в гифы под гифа индуцирующих условия16. Мы стремились определить, содержит ли жидкий фаз-IEF-отделенный экстракт G. sylvestre эти биологически активные молекулы. - Из подготовленной суспензии к каждому колодцу из 96-го колодца добавьте 90 л.
- Из каждой фракции (1-20 собранных фракций экстракта G. sylvestre, полученного из жидко-фазы IEF, Рисунок 4),добавьте 10 мл в скважины с 90 мл вышеуказанной клеточной подвески (шаг 4.2). Выполните анализ в трипликате.
- Добавьте 10 мл воды, содержащей амфолит (1%) в отдельные скважины с 90 мл суспензии дрожжевых клеток C. albicans в качестве отрицательного контроля.
ПРИМЕЧАНИЕ: Амфолиты обладают потенциалом биоактивности, и поэтому необходимо включить контроль амфолита при выполнении любой биоанализии19. - Инкубировать 96-хорошо пластины при 37 градусов по Цельсию в течение 12 ч и наблюдать ингибирование C. albicans дрожжей к гифу преобразования под микроскопом16. Кроме того, определить процент ингибирования дрожжей к гифа преобразования.
Результаты
Разделение и очищение малых молекул и пептидов из экстракта растений Gymnema sylvestre
Используя предпаративный жидко-фазный метод IEF, мы дроболилили лекарственные растительные экстракты и белки поверхности клеток из патогенного гриба человека, C. albicans. Схема этих протоколов фракционности показана на рисунке 1.
Из 20 фракций экстракта G. sylvestre, полученного из жидко-фазы IEF, были обнаружены молекулы темного цвета (терпеноидные сапонины) для миграции и обогащения в энде анода (рН 2-3) и светло-желтые прозрачные фракции наблюдались в конце катода (pH 8-9)(рисунок 2). Аликты (20 мл) от каждой фракции (1-20) были решены на 15% SDS-PAGE после уменьшения и кипячения образцов. Coomassie сине-окрашенные гель показывает рассеянный полипептид полоса около 5 кДа, которая обогащена в фракциях 16-19 (Рисунок 3). Было сообщено, что G. sylvestre завод содержит 35 аминокислот гурмарин основной полипептид с прогнозируемым молекулярным весом 4209 Da20. Бактерии, растения и животные содержат пептиды; многие из них являются круговыми (узелтинами) и стабильными с широким спектром биологической деятельности, таких как инсектицидные и противомикробные свойства21,22.
Биологическая активность разделенных гимнастических кислот
G. sylvestre завод также содержит gymnemic кислоты (терпеноидные сапонины) в качестве основных составляющих16,23,24. Как и ожидалось, эти небольшие молекулы в фракции 1 и следующие несколько фракций не были обнаружены SDS-PAGE и Coomassie окрашивания (Рисунок 3), так как они не-протеина. Тем не менее, эти небольшие молекулы могут быть разделены TLC и обнаружены под ультрафиолетовым светом(Рисунок 4A, переулок F1). Фракция 10 не содержала обнаруживаемого количества этих небольших молекул на TLC, предполагая, что большинство органических малых молекул были обогащены фракциями 1-3. Гимнемические кислоты (ГСП) молекулы были показаны, чтобы ингибировать C. Albicans дрожжей к гифа переход16,25. Мы анализили все 20 фракций, собранных в этом исследовании для их ингибирующей деятельности против C. Albicans дрожжей к гифа преобразования и гипального роста16. Результаты показаны на рисунке 4B,4C. Самая высокая активность наблюдается в фракции 1, что согласуется с результатами TLC, где можно увидеть несколько пятен. Изомеры гимнастических кислот существуют, и все они имеют аналогичные биологические деятельности10. Эти изомеры были разделены в фракции 1-3 и показывают ингибирование C. Albicans гипального роста(Рисунок 4A,4C, фракция 1). Степень ингибирования гифаля постепенно снижалась по мере ее снижения с 1 до 10. Мало или вообще не было получено в фракциях 10 и выше.
Отделение белков поверхности клеток от патогенного грибка, C. albicans
Результаты жидко-фазы фракционации IEF поверхностных белков К. Альбиканов показаны на рисунке 5. Эти белки поверхности клеток играют важную роль в C. albicans адгезии и патогенеза26. Наблюдалось несколько обогащенных белков (стрелки) в различных фракциях. Это может позволить идентифицировать их иммунологические реакции с candida инфицированных сыворотки человека и / или их идентификации с помощью масс-спектрометрии. Аналогичным образом, белки из других клеточных фракций (например, цитоплазма и клеточные стенки) могут быть дробен с помощью этого метода IEF. Очистка на основе жидкой фазы IEF позволит выявить белки с низким уровнем изобилия из сложных биологических образцов в сочетании с анализом масс-спектрометрии.
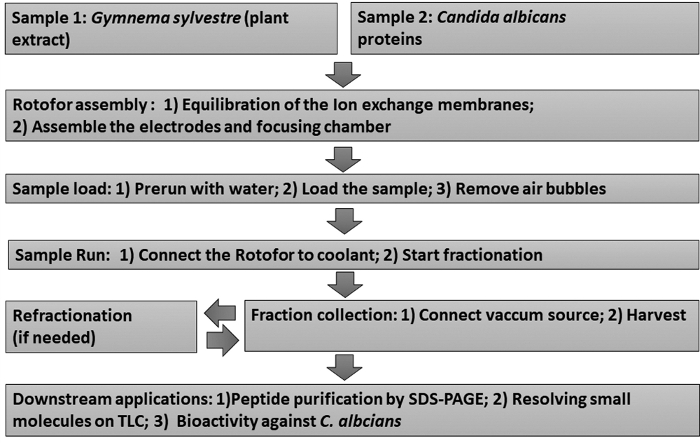
Рисунок 1: Диаграмма потока, показывающая экспериментальный рабочий процесс. На рисунке изображены процедуры фракционации фазовой жидкости и фазы IEF и последующие анализы ниже по течению. Образцы включают Gymnema sylvestre экстракт листьев (образец 1) и Candida albicans не-глюкан прилагается дрожжевых белков (образец 2). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой фигуры.

Рисунок 2: установка жидкостного аппарата IEF и фракционирование растительного экстракта G. sylvestre. (A) Во время запуска, (B) во время сбора фракций, (C) после сбора фракций, и(D) жидко-фазы IEF части аппарата, 1) ионные мембраны обмена, 2) фокусировка камеры и мембранного ядра, 3) электрод сборки (отрицательный), 4) электрода сборки (положительный). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой фигуры.

Рисунок 3: SDS-PAGE разделения IEF сосредоточены растительных экстрактов фракций. L-лестница, PC- Положительный контроль (пептид), 0 - входной образец, 1-20 разделенных фракций. SDS-PAGE (15% решение гель) был окрашен Coomassie синий краситель для визуализации решенных пептидов (No 5 kDa) от фракций 1-20. Фракции 1-3 содержат небольшие молекулы (фракция 1 имеет более темный цвет, указывающий на обогащенные соединения), которые не могут быть окрашены/обнаружены синим красителем Coomassie. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой фигуры.
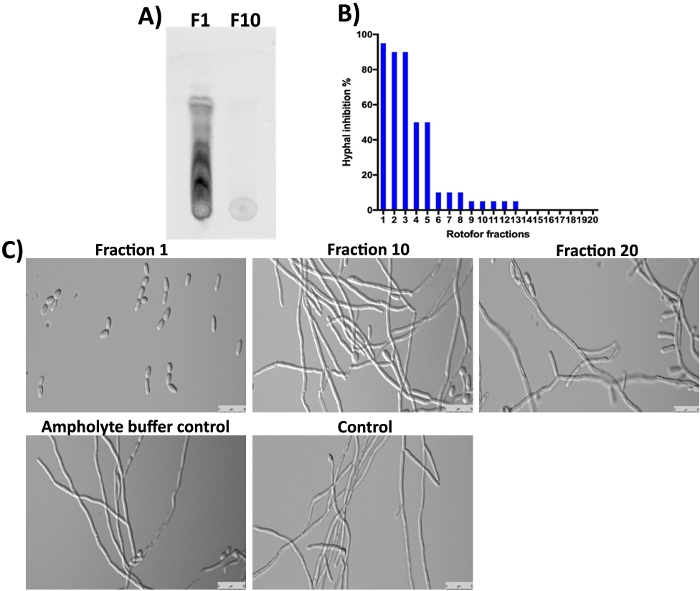
Рисунок 4: Анализ IEF дробных малых молекул TLC и определение биоактивности против C. albicans. (A) Показывает TLC анализ малых молекул из фракции #1 и #10. Активированный кремнезем гель пластины был использован для месте 5 мл образцов и побежал с толуолом: хлороформ: метанол растворитель (5:8:3 соотношение) до растворителя фронт достиг края. TLC разделенных соединений были обнаружены под эпифлюоресценции УФ-излучения (310 нм). (B) Показывает % ингибирование C. Albicans дрожжей к гифа преобразования различными фракциями. (C) Демонстрирует морфологию клеток C. albicans под гифа вызывая условия. Фракция #1 показывает максимум (98%) ингибирование дрожжей к гифа преобразования. Другие фракции и элементы управления не показывают ингибирования C. Albicans hyphal роста после 12 часов инкубации при 37 градусов по Цельсию. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой фигуры.

Рисунок 5: SDS-PAGE анализ C. Albicans клеточных белков поверхности (не-глюкан прилагается). L-лестница, 0 - входный образец, 1-18 фракций, собранных после МЭФ в стандартной жидкой фазе МЭФ ячейки с использованием узкого диапазона (рН 5-8) амфолита. На рисунке показан sDS-PAGE (12,5%) решенные белки после окрашивания синим красителем Coomassie. Несколько белков были обогащены определенными фракциями (стрелками). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой фигуры.
Обсуждение
Небольшие молекулы из натуральных источников продукта (например, растения) включают сложные вторичные метаболиты, которые очень разнообразны в химической структуре. Считается, что они участвуют в механизмах защиты растений. Кроме того, полипептиды также присутствуют в тканях растений22. Эти натуральные молекулы продукта малых богатых источников молекул испытания для открытия и развития снадобья. Однако трудные и утомительные методы, необходимые для их изоляции и очищения, ограничивают их использование в терапевтических целях. Подход, используемый в данном отчете, выделяет возможность разделения этих маленьких молекул и полипептидов без ущерба для их биоактивности.
Этот метод на основе IEF предлагает ряд преимуществ в делении биологических молекул, включая концентрацию очищенных белков от сложной смеси, поддержание родной конформации во время и после их фокусировки, а также сбор образцов в виде отдельных очищенных фракций без перекрестного загрязнения. При необходимости образцы могут быть переориентированы с узким диапазоном рН для очистки изоформ белка. Так как миниатюрная фокусирово-фокусная ячейка IEF (15 м/с) доступна, она может быть использована и для меньших объемов образцов. Новый вывод из этого доклада заключается в том, что органические маленькие молекулы и пептиды могут быть отделены от сложного растительного экстракта. Хотя трудно согласиться, что небольшие молекулы могут быть отделены от натуральных экстрактов продукта IEF, это правдоподобно для тех соединений, которые являются аммфотерическими. Gymnemic кислоты, которые были отделены от пептида гурмарина в экстракте G. sylvestre, как представляется, амфотерические, поскольку они содержат карбокслийной кислоты группы или они ведут себя так по крайней мере в присутствии амфолита используется. Поскольку гликозиды являются биологически активными природными молекулами, похожими на гимнемические кислоты, метод IEF может быть использован для отделения их от сложных природных источников. Аналогичным образом, пептиды из натуральных продуктов также могут быть изолированы с помощью этого жидко-фазы IEF-подхода.
Некоторые из ограничений в этом подходе в том, что не все малые молекулы могут быть дробичены методом IEF, поскольку они должны быть водорастворимыми и слабо амфотерическими, по крайней мере. Экстракт, используемый здесь, был подготовлен 50% по извлечению метанола из высушенного растительного материала, но водорастворимый. Использование метода IEF для растворителей растворимых и амфотерических соединений еще предстоит увидеть, как некоторые из органических растворителей несовместимы с жидкой фазы IEF инструмент компонентов. Тенденция белков к осадке в их изоэлектрических точках (pI) в низкой ионной прочности решений хорошо известна. Однако в вращающейся системе IEF осадки из белка уменьшаются по мере того, как сфокусированные белки остаются в обращении в точке PI.
Если использовать высокую концентрацию белков в этом разделении IEF, осадки могут произойти. Чтобы свести к минимуму осадки белка и улучшить фокусировку белка, мочевина может быть использована до 3-5 М. Нелогические моющие средства, такие как CHAPS, digitonin и низкая концентрация моющих средств (0,1-1%) может также использоваться для уменьшения агрегации белка во время МЭФ. Однако, мочевины и моющих средств должны быть удалены до анализа белков для их деятельности, а в некоторых случаях, эти агенты могут повлиять на функции белка. Несколько важных шагов, которые следует рассмотреть во время жидкостно-фазы IEF перспективе включают загрузку фокусировки ячейки IEF без пузырьков воздуха, замена ионных мембран обмена, если они были повреждены, и замена вентиляционных кнопок после определенного числа повторных применений.
В заключение, используя жидко-фазный метод IEF, мы показали разделение биологически активных gymnemic кислот и гурмарина полипептида из экстракта листьев G. sylvestre. Кроме того, жидко-фазный IEF может быть полезен для обогащения селективных белков из сложных сырых экстрактов патогенных микробов.
Раскрытие информации
Авторы хотели бы заявить об отсутствии конкурирующих финансовых интересов.
Благодарности
Мы благодарны за источники финансирования из Отдела биологии и Джонсона онкологический научный центр BRIEF и ИРА награды, соответственно, GV. Мы также благодарим K-INBRE постдокторской награды Р.В. Эта работа была частично поддержана Премией за институциональное развитие (IDeA) от Национального института общих медицинских наук Национальных институтов здравоохранения под грантовым номером P20 GM103418. Содержание является исключительно ответственностью авторов и не обязательно отражает официальные взгляды Национального института общих медицинских наук или Национальных институтов здравоохранения. Мы благодарим анонимных рецензентов за их полезные комментарии.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.45 µm syringe filter | Fisher scientfic | 09-720-004 | |
| 2-Mercaptoethanol | Sigma | M3148 | |
| Ammonium carbonate | Sigma-Aldrich | 207861-500 | |
| Bio-Lyte 3/10 Ampholyte | Bio-Rad | 163-1113 | |
| Bio-Lyte 5/8 Ampholyte | Bio-Rad | 163-1192 | |
| Compact low temperature thermostat | Lauda -Brinkmann | RM 6T | Set water cooling to 4 oC and it can be run even at 0 oC as when it passes through the Rotofor cooling core, the circulating water temperature will be around 5 or more depending on the voltage. |
| Coomassie Brilliant Blue R | Sigma-Aldrich | B7920 | |
| Dialysis tubing (3,500 MWCO) | Spectrum Spectra/Por | 132112T | |
| Gymnema plant leaf extract powder (>25% Gymnemic acids) | Suan Farma, NJ USA | ||
| Incubator | Lab companion | SI 300R | |
| Microscope | Leica | DM 6B | |
| Mini protean electrophoresis | Bio-Rad | ||
| pH meter | Mettler Toledo | S20 | Useful to determine the pH of the Rotofor (liquid-phase IEF) fractions |
| Rotofor | Bio-Rad | 170-2972 | http://www.bio-rad.com/webroot/web/pdf/lsr/literature/M1702950E.pdf (Rotofor Instruction manual for assembling the unit) |
| RPMI-1640 Medium | HyClone | DH30255.01 | |
| Sealing tape | Bio-Rad | 170-2960 | Scotch tape may also be used. |
| Sorvall legend micro 17 centrifuge | Thermo scientific | 75002432 | |
| TPP tissue culture plate -96 well flat bottom | TPP | TP92696 |
Ссылки
- Jankowska, U., et al. Optimized procedure of extraction, purification and proteomic analysis of nuclear proteins from mouse brain. Journal of Neuroscience Methods. 261, 1-9 (2016).
- Pergande, M. R., Cologna, S. M. Isoelectric Point Separations of Peptides and Proteins. Proteomes. 5 (1), (2017).
- Stoyanov, A. IEF-based multidimensional applications in proteomics: toward higher resolution. Electrophoresis. 33 (22), 3281-3290 (2012).
- Vesterberg, O. A. Y. . Method of Isoelectric Fractionation. , (1964).
- Vesterberg, O., Svensson, H. Isoelectric fractionation, analysis, and characterization of ampholytes in natural pH gradients. IV. Further studies on the resolving power in connection with separation of myoglobins. Acta Chemica Scandinavica. 20 (3), 820-834 (1966).
- Righetti, P. G. . Isoelectric Focusing: Theory, Methodology and Applications. , 1 (1983).
- Vesterberg, O. Synthesis and Isoelectric Fractionation of Carrier Ampholytes. Acta Chemica Scandinavica. 23, 2653-2666 (1969).
- Bier, M. Recycling isoelectric focusing and isotachophoresis. Electrophoresis. 19 (7), 1057-1063 (1998).
- Bier, M., Palusinski, O. A., Mosher, R. A., Saville, D. A. Electrophoresis: mathematical modeling and computer simulation. Science. 219 (4590), 1281-1287 (1983).
- Ayala, A., Parrado, J., Machado, A. Use of Rotofor preparative isoelectrofocusing cell in protein purification procedure. Applied Biochemistry and Biotechnology. 69 (1), 11-16 (1998).
- Wagner, L., et al. Isolation of dipeptidyl peptidase IV (DP 4) isoforms from porcine kidney by preparative isoelectric focusing to improve crystallization. Biological Chemistry. 392 (7), 665-677 (2011).
- Hosken, B. D., Li, C., Mullappally, B., Co, C., Zhang, B. Isolation and Characterization of Monoclonal Antibody Charge Variants by Free Flow Isoelectric Focusing. Analytical Chemistry. 88 (11), 5662-5669 (2016).
- Yu, J. J., et al. Francisella tularensis T-cell antigen identification using humanized HLA-DR4 transgenic mice. Clinical Vaccine Immunology. 17 (2), 215-222 (2010).
- Riyong, D., et al. Size and charge antigens of Dirofilaria immitis adult worm for IgG-ELISA diagnosis of bancroftian filariasis. Southeast Asian Journal of Tropical Medicine and Public Health. 41 (2), 285-297 (2010).
- Vediyappan, G., Bikandi, J., Braley, R., Chaffin, W. L. Cell surface proteins of Candida albicans: preparation of extracts and improved detection of proteins. Electrophoresis. 21 (5), 956-961 (2000).
- Vediyappan, G., Dumontet, V., Pelissier, F., d'Enfert, C. Gymnemic acids inhibit hyphal growth and virulence in Candida albicans. PLoS One. 8 (9), 74189 (2013).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry. 72, 248-254 (1976).
- Laemmli, U. K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 227 (5259), 680-685 (1970).
- Riazi, S., Dover, S., Turovskiy, Y., Chikindas, M. L. Commercial ampholytes used for isoelectric focusing may interfere with bioactivity based purification of antimicrobial peptides. Journal of Microbiological Methods. 71 (1), 87-89 (2007).
- Kamei, K., Takano, R., Miyasaka, A., Imoto, T., Hara, S. Amino-Acid-Sequence of Sweet-Taste-Suppressing Peptide (Gurmarin) from the Leaves of Gymnema-Sylvestre. Journal of Biochemistry. 111 (1), 109-112 (1992).
- Craik, D. J. Chemistry. Seamless proteins tie up their loose ends. Science. 311 (5767), 1563-1564 (2006).
- Craik, D. J., Daly, N. L., Bond, T., Waine, C. Plant cyclotides: A unique family of cyclic and knotted proteins that defines the cyclic cystine knot structural motif. Journal of Molecular Biology. 294 (5), 1327-1336 (1999).
- Stoecklin, W. Chemistry and physiological properties of gymnemic acid, the antisaccharine principle of the leaves of Gymnema sylvestre. Journal of Agricultural and Food Chemistry. 17 (4), 704-708 (1969).
- Liu, H. M., Kiuchi, F., Tsuda, Y. Isolation and structure elucidation of gymnemic acids, antisweet principles of Gymnema sylvestre. Chemical & Pharmaceutical Bulletin (Tokyo). 40 (6), 1366-1375 (1992).
- Veerapandian, R., Vediyappan, G. Gymnemic Acids Inhibit Adhesive Nanofibrillar Mediated Streptococcus gordonii-Candida albicans Mono-Species and Dual-Species Biofilms. Frontiers in Microbiology. 10, 2328 (2019).
- Chaffin, W. L. Candida albicans cell wall proteins. Microbiology and Molecular Biology Reviews. 72 (3), 495-544 (2008).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены