Method Article
Separação de Pequenas Moléculas Bioativas, Peptídeos de Fontes Naturais e Proteínas de Micróbios pelo Método De Foco Isoelétrico Preparatório (IEF)
Neste Artigo
Resumo
O objetivo é fracionar e isolar pequenas moléculas bioativas, peptídeos de um complexo extrato vegetal e proteínas de micróbios patogênicos, empregando o método de focalização isoelétrica de fase líquida (IEF). Além disso, as moléculas separadas foram identificadas e sua bioatividade confirmada.
Resumo
Produtos naturais derivados de plantas e micróbios são uma rica fonte de moléculas bioativas. Antes de seu uso, as moléculas ativas de extratos complexos devem ser purificadas para aplicações a jusante. Existem vários métodos cromatográficos disponíveis para este fim, mas nem todos os laboratórios podem pagar métodos de alto desempenho e o isolamento de amostras biológicas complexas pode ser difícil. Aqui demonstramos que o foco isoelétrico de fase líquida (IEF) pode separar moléculas, incluindo pequenas moléculas e peptídeos de extratos de plantas complexas, com base em seus pontos isoelétricos (iI). Utilizamos o método para fracionamento e caracterização de amostras biológicas complexas. Como prova de conceito, fracionamos um extrato de planta gymnema sylvestre, isolando uma família de pequenas moléculas terpenoides de sapono e um peptídeo. Também demonstramos uma separação eficaz de proteína microbiana usando o fungo Candida albicans como um sistema modelo.
Introdução
A purificação de biomoléculas a partir de amostras biológicas complexas é um passo essencial e muitas vezes difícil em experimentos biológicos1. O foco isoelétrico (IEF) é adequado para a separação em alta resolução de biomoléculas complexas onde os amfolitos portadores viajam de acordo com sua carga e estabelecem o gradiente de pH em um campo elétrico3. O primeiro ampholyte de transportadora comercial para IEF foi desenvolvido por Olof Vesterberg em 1964 e patenteado4,5. Os amfolitos portadores são moléculas de ácido oligo-carboxílico alifático de comprimento e ramificação6. Posteriormente, Vesterberg e outros melhoraram os amóglifos portadores para seu uso expandido na separação de biomoléculas6,7.
Os métodos para separar as biomoléculas incluem eletroforese de gel de agarose e poliacrilamida, eletroforese de gel bidimensional (2-DE), foco isoelétrico, eletroforese capilar, isotacoforese e outras técnicas cromatográficas (por exemplo, TLC, FPLC, HPLC)2. O IEF de fase líquida realizado em um instrumento chamado "Rotofor" foi inventado por Milan Bier8. Ele foi pioneiro no conceito e design deste instrumento e contribuiu extensivamente para a teoria da migração eletroforética. Sua equipe também desenvolveu um modelo matemático de processo de separação eletroforética para simulações computacional9.
O aparelho IEF de fase líquida é uma célula cilíndrica rotativa horizontal, consistindo de um núcleo de nylon dividido em 20 compartimentos porosos e uma haste de cerâmica de resfriamento de água circulante. As câmaras porosas permitem que as moléculas migrem através da fase aquosa entre os eletrodos e permitem a coleta de amostras purificadas sob vácuo em frações. Este sistema de purificação pode fornecer até 1000 vezes a purificação de uma molécula específica em <4 horas. Uma característica valiosa deste instrumento é que ele pode ser aplicado como um primeiro passo para purificação a partir de uma mistura complexa ou como um passo final para alcançar a pureza10. Se a molécula de interesse é uma proteína, outra vantagem é que sua conformação nativa será mantida durante a separação.
O uso de IEF de fase líquida tem sido amplamente relatado para proteínas, enzimas e purificação de anticorpos6,10,11,12,13,14. Aqui descrevemos o uso dessa abordagem para separar e purificar pequenas moléculas e peptídeos da planta medicinal Gymnema sylvestre. Este protocolo ajudará os pesquisadores a concentrar e purificar pequenas moléculas ativas de um extrato vegetal para aplicações a jusante a baixo custo. Além disso, também demonstramos que o enriquecimento de proteínas de um complexo extrato de proteína do fungo Candida albicans 15 neste sistema baseado em IEF como segundo exemplo.
Protocolo
1. Configuração e pré-ressarificação da unidade IEF de fase líquida padrão
- Monte os eletrodos IEF de fase líquida (botão vermelho-ânodo e botão cathode-preto) com suas respectivas membranas de troca de acordo com o manual de instruções (ver Tabela de Materiais). Equilibre as membranas de troca de ânion com 0,1 M NaOH e as membranas de troca de cáção com 0,1 M H3PO4 pelo menos por 16 h quando novas membranas são usadas.
- Armazene as membranas em eletrólitos (0,1 M NaOH ou 0,1 M H3PO4) entre as corridas e não deixe secar.
- Monte a porção interna e externa do eletrodo alinhando três orifícios oblongos nas juntas de troca de íons. Encha os eletrodos com os respectivos eletrólitos (~25-30 mL) para evitar que suas membranas sequem.
- Não adicione excesso (mais de 1/3de volume de câmara de eletrodos) eletrólitos que possam aumentar a pressão dentro do eletrodo e causar vazamento.
- Cubra as portas de coleta de amostras com fita de vedação que vem com as peças de montagem do instrumento (ver Tabela de Materiais). O lado das portas de coleta de amostras pode ser identificado pelos dois pinos de alinhamento metálico vertical. Alternativamente, use fita de vedação padrão para selar as portas.
- Monte todas as partes do conjunto da câmara focal em sequência (eletrodo de ânodo, núcleo de membrana de nylon, câmara de foco e eletrodo de cátodo) sobre o dedo de resfriamento cerâmico.
- Encha a câmara de foco com água destilada pré-identificada (volume total de 60 mL para a célula IEF padrão) usando uma seringa de 50 mL.
- Conecte o instrumento IEF de fase líquida a uma água de resfriamento circulante a 4 ºC e pré-run a unidade a 15 W e 3.000 V por 3-5 min ou até que a tensão estabilize.
NOTA: Geralmente, dentro de um minuto, a tensão atingirá os valores máximos definidos. A pré-corrida com água destilada ajuda a remover os íons residuais da câmara de foco e do núcleo da membrana de nylon. - Desligue a fonte de energia e remova a água da célula usando o coletor de frações. Selar as portas de coleta com fita de vedação.
NOTA: Agora o instrumento está pronto para uso na etapa 2.4.
2. Separação e purificação de pequenas moléculas e peptídeos do extrato de Gymnema sylvestre
- Meça 0,6 g de extrato vegetal e dissolva em água destilada (60 mL) misturando-se em um tubo de rolo por 5 min.
NOTA: Qualquer amostra biológica solúvel e livre de sal pode ser usada para separação e purificação usando este instrumento IEF. Podem ser utilizadas amostras com concentração de sal tampão de até 10 mM com resolução ligeiramente reduzida. Estamos interessados na família saponina de compostos triterpenóides, os ácidos gymnémicos, da planta G. sylvestre para suas propriedades antifúngicas únicas16. - Centrifugar o extrato da planta solubilizada a 10.000 x g por 5 minutos para remover partículas insolúveis.
- Transfira o supernatante (~60 mL) para um tubo de centrífuga de 80 mL e misture-o com 0,6 mL de amfolito (pH 3-10) a 1% (v/v).
- Siga as etapas 1.1 – 1.7 para preparar a unidade IEF de fase líquida. A câmara está pronta para carregar a amostra.
- Use uma seringa de 50 mL com uma agulha final de 1-1/2 polegada 19 G (vem com o instrumento) e carregue a amostra preparada com amfolito (total de 60 mL) na célula através de portas de coleta.
- Remova bolhas de ar da célula amostra, removendo a célula focal do suporte e tocando na câmara de eletrodos para desalojar as bolhas. A presença de bolhas de ar causará flutuações de tensão e corrente e afetará a corrida.
- Conecte a unidade ao refrigerante de água (4 °C) e inicie o fracionamento com a fonte de alimentação a uma constante de 15 W.
- Execute o aparelho por 3h ou até que a tensão atinja um valor constante.
NOTA: À medida que a amostra começa a se concentrar, a tensão começará a subir gradualmente até atingir um valor constante. - Após a execução, prepare-se para coletar as frações na caixa de colheita (contendo 20 tubos plásticos, 12 mm x 75 mm, 5-6 mL de volume) conectados à bomba de vácuo pressionando o botão de colheita ON na unidade IEF.
- Alinhe os pinos de 20 coleções com as portas de 20 coleções da célula focal que está lacrada com a fita.
- Empurre os pinos de coleta através da fita de vedação e gire a bomba de vácuo ON simultaneamente (ver Figura 2B, 2C & 2D).
NOTA: Cerca de 3 mL frações de cada câmara serão coletadas nos tubos para cada vez. Frações podem ser usadas para aplicações a jusante subsequentes (SDS-PAGE para quantificação de peptídeos, TLC e bioensaio para pequenas moléculas).
3. Separação e purificação de proteínas de C. albicans
- Cresça colônia única de C. albicans em levedura-peptone-dextrose (YPD) caldo16 a 30 °C com agitação (200 rpm) durante a noite.
- Coletar as células de levedura por centrifugação (10.000 x g por 5 min).
- Suspender as células de levedura C. albicans em carbonato de amônio (1,89 g/L) tampão contendo 1% (v/v) beta-mercaptoethanol (β-ME) (1/10º do volume cultural) e girar em um tubo de rolo por 1 h a 5 °C15.
- Remova as células de levedura por centrifugação (10.000 x g por 5 min) e filtre o extrato de proteína através de um filtro de 0,45 μm.
NOTA: Amostras de proteínas de C. albicans cytosol, membrana ou parede celular podem ser preparadas e usadas para fracionamento de IEF. Da mesma forma, proteínas de bactérias ou outras amostras biológicas (extrato de tecido animal) podem ser usadas após a remoção de qualquer sal por métodos apropriados ( porexemplo,por diálise ou usando colunas de desalização). - Dique o extrato de proteína em um tubo de diálise (3.500 MWCO) contra a água por 15 h a 4 °C. Estime a concentração proteica pelo método de ligação de corante de Bradford usando globulina gama como padrão17.
- Use 500 mg de proteína total em 60 mL de água contendo 1% (v/v) ampholyto (pH 5-8) para o fracionamento.
NOTA: Uma vez que um amfolito de larga alcance (pH 3-10) não enriquece certas proteínas de parede celular não-glucanas de C. albicans bem, use um amfolito de alcance estreito (pH 5-8). Uma concentração de amfolitos de até 2% pode ser usada se a concentração de proteínas amostrais for superior a 2 mg/mL; isso minimiza a agregação de proteínas durante o foco. Mantenha sempre as amostras, amólitos e água pré-cozido no gelo. - Repita os passos 1.1- 1.7 para preparar a unidade IEF e use a solução proteica da etapa 3.6 para carregar na célula IEF.
- Após 4h de foco em 15 W constantes, colher frações de proteína (1-20) conforme descrito acima (etapas 2,9-2,11) e analisar em 12,5% SDS-PAGE após reduzir e ferver as amostras de proteína18.
- Manche as proteínas resolvidas manchando o gel SDS-PAGE com o corante azul Coomassie (0,01%) solução para 2-3 h à temperatura ambiente em um roqueiro. Destain o gel e gravar a imagem em gel usando um imager gel.
NOTA: Corante azul coomassie (0,01%) pode ser preparado misturando 0,01 g de pó azul Coomassie em uma solução desestabilizadora contendo 40% de metanol e 10% ácido acético.
4. Bioatividade de pequenas moléculas purificadas do extrato vegetal Gymnema sylvestre
- Cresça C. albicans em células de levedura como na etapa 3.1.
- Para preparar a suspensão celular, diluir a cultura noturna das células de levedura de C. albicans (diluição de 1/1000) em um meio de cultura celular RPMI fresco complementado com 50 mM de glicose.
NOTA: C. albicans converte do crescimento da levedura em hifa sob condições de indução de hifa (RPMI a 37 °C). Pequenas moléculas de ácido gymnêmico são mostradas para inibir a conversão de células de levedura em hifas sob condições indutoras de higiais16. Nosso objetivo era determinar se o extrato G. sylvestre separado por fase líquida-IEF contém essas moléculas bioativas. - Da suspensão celular preparada, adicione 90 μL a cada poço da placa de 96 poços.
- A partir de cada fração (1-20 frações colhidas de extrato g. sylvestre obtidos a partir de IEF de fase líquida, Figura 4), adicione 10 μL nos poços com 90 μL da suspensão celular acima (etapa 4.2). Realize o ensaio em triplicado.
- Adicione 10 μL de água que contenha amfolito (1%) em poços separados com 90 μL de suspensão de células de levedura C. albicans como um controle negativo.
NOTA: Os ampholytes têm potencial de bioatividade e, por isso, é essencial incluir um controle de amólise durante a realização de qualquer bioensaio19. - Incubar a placa de 96-well a 37 °C por 12 h e observar a inibição da conversão de leveduras de C. albicans sob o microscópio16. Além disso, determine a porcentagem de inibição da conversão de levedura para hifa.
Resultados
Separação e purificação de pequenas moléculas e peptídeos do extrato vegetal de Gymnema sylvestre
Usando o método de IEF de fase líquida preparatória, fracionamos extratos de plantas medicinais e proteínas da superfície celular de um fungo patogênico humano, C. albicans. Um esquema desses protocolos de fracionamento é mostrado na Figura 1.
A partir de 20 frações de extrato g. sylvestre obtidos a partir de IEF de fase líquida, as moléculas de cor escura (saponinas terpenóides) foram encontradas para migrar e ser enriquecidas na extremidade ânodo (pH 2-3) e as frações claras claras amarelo-claros foram observadas na extremidade do cátodo (pH 8-9)(Figura 2). As alíquotas (20 μL) de cada fração (1-20) foram resolvidas em 15% de SDS-PAGE após a redução e a fervura das amostras. Um gel de colorir azul Coomassie mostra a banda de polipeptídeo difusa de cerca de 5 kDa que é enriquecida em frações 16-19(Figura 3). Foi relatado que a planta G. sylvestre contém um polipeptídeo básico de 35 aminoácidos gurmarin com o peso molecular previsto de 4.209 da20. Bactérias, plantas e animais contêm peptídeos; muitas delas são circulares (knottins) e estáveis com ampla gama de atividades biológicas, como propriedades inseticidas e antimicrobianas21,22.
Atividade biológica de ácidos gymnémicos separados
A planta G. sylvestre também contém ácidos gymnémicos (saponinas terpenoides) como principais constituintes16,23,24. Como esperado, essas pequenas moléculas na fração 1 e nas próximas frações não foram detectadas pela mancha SDS-PAGE e Coomassie(Figura 3),uma vez que são não-proteináceos. No entanto, essas pequenas moléculas podem ser separadas por TLC e detectadas sob luz UV(Figura 4A, pista F1). A fração 10 não continha uma quantidade detectável dessas pequenas moléculas no TLC sugerindo que a maioria das pequenas moléculas orgânicas foram enriquecidas em frações 1-3. As moléculas de ácidos gymnémicos (GAs) foram mostradas para inibir a transição de levedura-hifa c. albicans 16,25. Nós onecíamos todas as 20 frações coletadas neste estudo para sua atividade inibitória contra a conversão de leveduras-hifa de C. albicans e crescimento hiphal16. Os resultados são mostrados na Figura 4B,4C. A maior atividade é observada na fração 1, que concorda com os resultados do TLC onde vários pontos podem ser vistos. Os isômeros de ácidos gymnémicos existem e todos têm atividades biológicas semelhantes10. Estes isômeros foram separados na fração 1-3 e mostram inibição do crescimento hifál de C. albicans (Figura 4A,4C, fração 1). O grau de inibição do higfálico foi gradualmente diminuído à medida que passa de 1 para 10. Pouca ou nenhuma atividade foi obtida em frações 10 ou superiores.
Separação de proteínas da superfície celular de fungos patogênicos, C. albicans
Os resultados do fracionamento de IEF de fase líquida das proteínas da superfície celular de C. albicans são mostrados na Figura 5. Essas proteínas de superfície celular desempenham papéis importantes na adesão de C. albicans e patogênese26. Várias proteínas enriquecidas (flechas) em diferentes frações foram observadas. Isso pode permitir a identificação de suas reações imunológicas com soro humano infectado por Candida e/ou sua identificação por espectrometria de massa. Da mesma forma, proteínas de outras frações celulares (por exemplo, citoplasma e parede celular) podem ser fracionadas usando este método IEF. A purificação baseada em IEF em fase líquida permitirá a identificação de proteínas de baixa abundância a partir de amostras biológicas complexas, quando juntamente com a análise de espectrometria de massa.
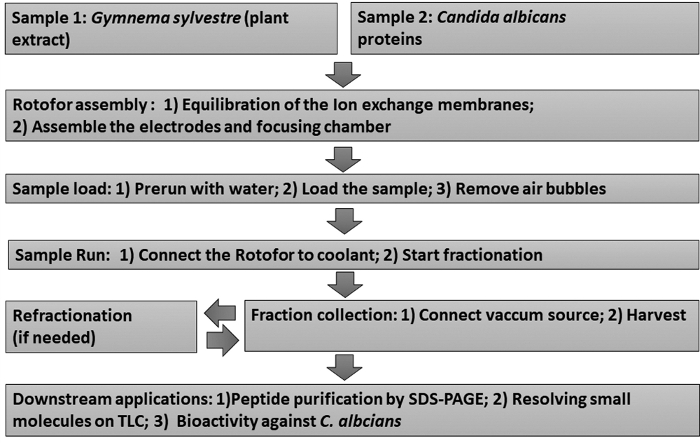
Figura 1: Gráfico de fluxo mostrando o fluxo de trabalho experimental. Os procedimentos de fracionamento de IEF de fase líquida stepwise e ensaios subsequentes a jusante são retratados. As amostras incluem o extrato da folha de Gymnema sylvestre (amostra 1) e as proteínas de levedura não glucanas não glucanas (amostra 2). Clique aqui para ver uma versão maior desta figura.

Figura 2: Configuração do aparelho IEF de fase líquida e fracionamento do extrato da planta G. sylvestre. (A) Durante a execução, (B) durante a coleta de frações, (C) após a coleta de frações, e (D) peças de aparelho iEF de fase líquida, 1) membranas de troca de íons, 2) concentrando câmara e núcleo de membrana, 3) conjunto de eletrodos (negativo), 4) conjunto de eletrodos (positivo). Clique aqui para ver uma versão maior desta figura.

Figura 3: Separações SDS-PAGE das frações de extrato de planta focadas no IEF. L-escada, PC- Controle positivo (peptídeo), 0 - amostra de entrada, 1-20 frações separadas. O SDS-PAGE (gel de resolução de 15%) foi manchado pelo corante azul Coomassie para visualizar os peptídeos resolvidos (~5 kDa) das frações 1-20. As frações 1-3 contêm pequenas moléculas (a fração 1 tem cor mais escura indicando compostos enriquecidos) que não podem ser manchadas/detectadas pelo corante azul Coomassie. Clique aqui para ver uma versão maior desta figura.
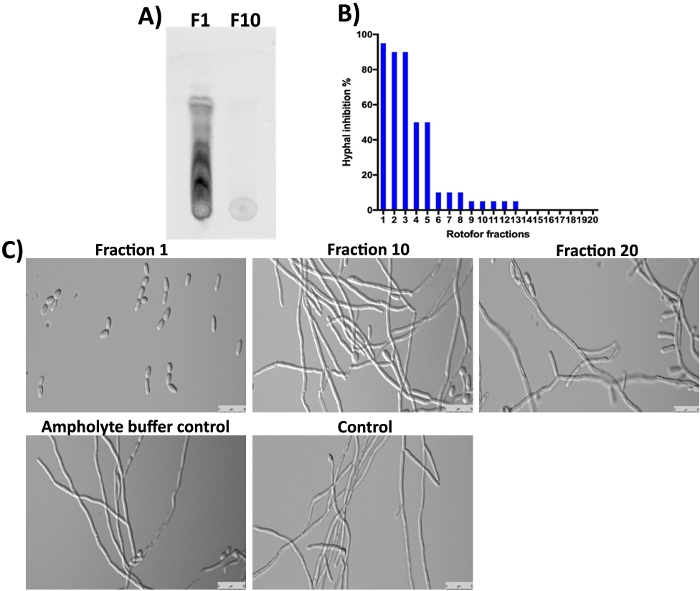
Figura 4: Análise de pequenas moléculas fracionadas pelo IEF por TLC e determinação da bioatividade contra c. albicans. (A) Mostra a análise tlc de pequenas moléculas de fração #1 e #10. A placa de gel de sílica ativada foi usada para detectar ~5 μL de amostras e correu com tolueno: clorofórmio: solvente de metanol (proporção 5:8:3) até que a frente solvente atingiu a margem. Compostos separados tlc foram detectados sob uma luz UV epifluorescência (310 nm). (B) Mostra a % de inibição da conversão de leveduras de C. albicans por diferentes frações. (C) Demonstra a morfologia celular de C. albicans sob condições indutoras de higia. Fração #1 mostra máximo (98%) inibição da conversão de levedura para hifa. Outras frações e controles não mostram inibição do crescimento hifál de C. albicans após 12 horas de incubação a 37 °C. Clique aqui para ver uma versão maior desta figura.

Figura 5: Análise SDS-PAGE das proteínas da superfície celular C. albicans (não-glucano ligado). L- escada, 0 - amostra de entrada, 1-18 frações coletadas após IEF em uma célula IEF de fase líquida padrão usando uma faixa estreita (pH 5-8) ampholyto. A imagem mostra SDS-PAGE (12,5%) proteínas resolvidas após a coloração com corante azul Coomassie. Várias proteínas foram enriquecidas em certas frações (flechas). Clique aqui para ver uma versão maior desta figura.
Discussão
Pequenas moléculas de fontes de produtos naturais (por exemplo, plantas) incluem metabólitos secundários complexos que são altamente diversos em estrutura química. Acredita-se que estejam envolvidos em mecanismos de defesa de plantas. Além disso, os polipeptídeos também estão presentes nos tecidos vegetais22. Essas pequenas moléculas de produtos naturais são fontes ricas de moléculas de teste para descoberta e desenvolvimento de drogas. No entanto, os métodos difíceis e tediosos necessários para seu isolamento e purificação limitam seu uso para aplicações terapêuticas. A abordagem IEF de fase líquida utilizada neste relatório destaca a capacidade de separar essas pequenas moléculas e polipeptídeos sem comprometer suas bioatividades.
Este método baseado em IEF oferece várias vantagens na separação de moléculas biológicas, incluindo concentração de proteínas purificadas de uma mistura complexa, manutenção da conformação nativa durante e após seu foco, e coleta de amostras como frações purificadas individuais sem contaminação cruzada. Quando necessário, as amostras podem ser reem foco com uma faixa estreita de pH para purificar isoforms proteicos. Uma vez que uma célula focal de IEF em miniatura (~15 mL) está disponível, ela pode ser usada para volumes menores de amostras também. A nova descoberta deste relatório é que pequenas moléculas e peptídeos orgânicos podem ser separados de um complexo extrato vegetal. Embora seja difícil concordar que pequenas moléculas podem ser separadas dos extratos de produtos naturais pelo IEF, é plausível para os compostos que são anfotéricos. Os ácidos gymnémicos que foram separados do peptídeo de gurmarin no extrato de G. sylvestre parecem ser anfotéricos, pois contêm um grupo de ácido carboxílico ou se comportam assim pelo menos na presença do ampholyte usado. Uma vez que os gllicosides são moléculas naturais bioativas semelhantes aos ácidos gymnémicos, o método IEF pode ser usado para separá-los de fontes naturais complexas. Da mesma forma, peptídeos de produtos naturais também podem ser isolados usando esta abordagem IEF de fase líquida.
Algumas das limitações nesta abordagem são que nem todas as pequenas moléculas podem ser fracionadas pelo método IEF, pois devem ser solúveis em água e fracamente anfotericais, pelo menos. O extrato utilizado aqui foi preparado por uma extração de 50% de metanol de material vegetal seco, mas é solúvel em água. O uso do método IEF para compostos solúveis em solventes e anfotéricos continua a ser visto como alguns dos solventes orgânicos são incompatíveis com os componentes do instrumento IEF de fase líquida. A tendência das proteínas precipitarem-se em seus pontos isoelétricos (iI) em soluções de baixa resistência iônica é bem conhecida. No entanto, em um sistema rotativo de IEF, a precipitação proteica é reduzida à medida que as proteínas focadas permanecem em circulação em seu ponto de iI.
Se alguém usar uma alta concentração de proteínas nesta separação do IEF, pode ocorrer precipitação. Para minimizar a precipitação proteica e melhorar o foco da proteína, a ureia pode ser usada até 3-5 M. Detergentes noniônicos como CHAPS, digitonina e baixa concentração de detergentes (0,1-1%) também pode ser usado para reduzir a agregação de proteínas durante o IEF. No entanto, ureia e detergentes precisam ser removidos antes de analisar as proteínas para sua atividade e, em alguns casos, esses agentes podem afetar as funções proteicas. Algumas etapas críticas a serem consideradas durante uma execução de IEF de fase líquida incluem carregar a célula focal do IEF sem bolhas de ar, substituir as membranas de troca de íons se elas foram danificadas e substituir os botões de ventilação após um certo número de usos repetidos.
Em conclusão, utilizando o método IEF de fase líquida, mostramos a separação de ácidos gymnémicos bioativos e polipeptídeos de gurmarin do extrato da folha G. sylvestre. Além disso, o IEF de fase líquida pode ser útil para enriquecer proteínas seletivas dos complexos extratos brutos de micróbios patogênicos.
Divulgações
Os autores gostariam de declarar que não há interesses financeiros concorrentes.
Agradecimentos
Somos gratos pelas fontes de financiamento da Divisão de Biologia e johnson Cancer Research Center para prêmios BREVE e IRA, respectivamente para gv. Agradecemos também o prêmio de pós-doutorado K-INBRE à RV. Este trabalho foi apoiado em parte pelo Prêmio de Desenvolvimento Institucional (IDeA) do Instituto Nacional de Ciências Médicas Gerais dos Institutos Nacionais de Saúde sob o número de bolsas P20 GM103418. O conteúdo é de responsabilidade exclusiva dos autores e não representa necessariamente as opiniões oficiais do Instituto Nacional de Ciências Médicas Gerais ou dos Institutos Nacionais de Saúde. Agradecemos aos revisores anônimos por seus comentários úteis.
Materiais
| Name | Company | Catalog Number | Comments |
| 0.45 µm syringe filter | Fisher scientfic | 09-720-004 | |
| 2-Mercaptoethanol | Sigma | M3148 | |
| Ammonium carbonate | Sigma-Aldrich | 207861-500 | |
| Bio-Lyte 3/10 Ampholyte | Bio-Rad | 163-1113 | |
| Bio-Lyte 5/8 Ampholyte | Bio-Rad | 163-1192 | |
| Compact low temperature thermostat | Lauda -Brinkmann | RM 6T | Set water cooling to 4 oC and it can be run even at 0 oC as when it passes through the Rotofor cooling core, the circulating water temperature will be around 5 or more depending on the voltage. |
| Coomassie Brilliant Blue R | Sigma-Aldrich | B7920 | |
| Dialysis tubing (3,500 MWCO) | Spectrum Spectra/Por | 132112T | |
| Gymnema plant leaf extract powder (>25% Gymnemic acids) | Suan Farma, NJ USA | ||
| Incubator | Lab companion | SI 300R | |
| Microscope | Leica | DM 6B | |
| Mini protean electrophoresis | Bio-Rad | ||
| pH meter | Mettler Toledo | S20 | Useful to determine the pH of the Rotofor (liquid-phase IEF) fractions |
| Rotofor | Bio-Rad | 170-2972 | http://www.bio-rad.com/webroot/web/pdf/lsr/literature/M1702950E.pdf (Rotofor Instruction manual for assembling the unit) |
| RPMI-1640 Medium | HyClone | DH30255.01 | |
| Sealing tape | Bio-Rad | 170-2960 | Scotch tape may also be used. |
| Sorvall legend micro 17 centrifuge | Thermo scientific | 75002432 | |
| TPP tissue culture plate -96 well flat bottom | TPP | TP92696 |
Referências
- Jankowska, U., et al. Optimized procedure of extraction, purification and proteomic analysis of nuclear proteins from mouse brain. Journal of Neuroscience Methods. 261, 1-9 (2016).
- Pergande, M. R., Cologna, S. M. Isoelectric Point Separations of Peptides and Proteins. Proteomes. 5 (1), (2017).
- Stoyanov, A. IEF-based multidimensional applications in proteomics: toward higher resolution. Electrophoresis. 33 (22), 3281-3290 (2012).
- Vesterberg, O. A. Y. . Method of Isoelectric Fractionation. , (1964).
- Vesterberg, O., Svensson, H. Isoelectric fractionation, analysis, and characterization of ampholytes in natural pH gradients. IV. Further studies on the resolving power in connection with separation of myoglobins. Acta Chemica Scandinavica. 20 (3), 820-834 (1966).
- Righetti, P. G. . Isoelectric Focusing: Theory, Methodology and Applications. , 1 (1983).
- Vesterberg, O. Synthesis and Isoelectric Fractionation of Carrier Ampholytes. Acta Chemica Scandinavica. 23, 2653-2666 (1969).
- Bier, M. Recycling isoelectric focusing and isotachophoresis. Electrophoresis. 19 (7), 1057-1063 (1998).
- Bier, M., Palusinski, O. A., Mosher, R. A., Saville, D. A. Electrophoresis: mathematical modeling and computer simulation. Science. 219 (4590), 1281-1287 (1983).
- Ayala, A., Parrado, J., Machado, A. Use of Rotofor preparative isoelectrofocusing cell in protein purification procedure. Applied Biochemistry and Biotechnology. 69 (1), 11-16 (1998).
- Wagner, L., et al. Isolation of dipeptidyl peptidase IV (DP 4) isoforms from porcine kidney by preparative isoelectric focusing to improve crystallization. Biological Chemistry. 392 (7), 665-677 (2011).
- Hosken, B. D., Li, C., Mullappally, B., Co, C., Zhang, B. Isolation and Characterization of Monoclonal Antibody Charge Variants by Free Flow Isoelectric Focusing. Analytical Chemistry. 88 (11), 5662-5669 (2016).
- Yu, J. J., et al. Francisella tularensis T-cell antigen identification using humanized HLA-DR4 transgenic mice. Clinical Vaccine Immunology. 17 (2), 215-222 (2010).
- Riyong, D., et al. Size and charge antigens of Dirofilaria immitis adult worm for IgG-ELISA diagnosis of bancroftian filariasis. Southeast Asian Journal of Tropical Medicine and Public Health. 41 (2), 285-297 (2010).
- Vediyappan, G., Bikandi, J., Braley, R., Chaffin, W. L. Cell surface proteins of Candida albicans: preparation of extracts and improved detection of proteins. Electrophoresis. 21 (5), 956-961 (2000).
- Vediyappan, G., Dumontet, V., Pelissier, F., d'Enfert, C. Gymnemic acids inhibit hyphal growth and virulence in Candida albicans. PLoS One. 8 (9), 74189 (2013).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry. 72, 248-254 (1976).
- Laemmli, U. K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 227 (5259), 680-685 (1970).
- Riazi, S., Dover, S., Turovskiy, Y., Chikindas, M. L. Commercial ampholytes used for isoelectric focusing may interfere with bioactivity based purification of antimicrobial peptides. Journal of Microbiological Methods. 71 (1), 87-89 (2007).
- Kamei, K., Takano, R., Miyasaka, A., Imoto, T., Hara, S. Amino-Acid-Sequence of Sweet-Taste-Suppressing Peptide (Gurmarin) from the Leaves of Gymnema-Sylvestre. Journal of Biochemistry. 111 (1), 109-112 (1992).
- Craik, D. J. Chemistry. Seamless proteins tie up their loose ends. Science. 311 (5767), 1563-1564 (2006).
- Craik, D. J., Daly, N. L., Bond, T., Waine, C. Plant cyclotides: A unique family of cyclic and knotted proteins that defines the cyclic cystine knot structural motif. Journal of Molecular Biology. 294 (5), 1327-1336 (1999).
- Stoecklin, W. Chemistry and physiological properties of gymnemic acid, the antisaccharine principle of the leaves of Gymnema sylvestre. Journal of Agricultural and Food Chemistry. 17 (4), 704-708 (1969).
- Liu, H. M., Kiuchi, F., Tsuda, Y. Isolation and structure elucidation of gymnemic acids, antisweet principles of Gymnema sylvestre. Chemical & Pharmaceutical Bulletin (Tokyo). 40 (6), 1366-1375 (1992).
- Veerapandian, R., Vediyappan, G. Gymnemic Acids Inhibit Adhesive Nanofibrillar Mediated Streptococcus gordonii-Candida albicans Mono-Species and Dual-Species Biofilms. Frontiers in Microbiology. 10, 2328 (2019).
- Chaffin, W. L. Candida albicans cell wall proteins. Microbiology and Molecular Biology Reviews. 72 (3), 495-544 (2008).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados