Method Article
Separazione delle piccole molecole bioattive, Peptidi da fonti naturali e proteine dai microbi di Preparative Isoelectric Focusing (IEF) Metodo
In questo articolo
Riepilogo
L'obiettivo è frazionare e isolare piccole molecole bioattive, peptidi da un complesso estratto vegetale e proteine da microbi patogeni utilizzando il metodo di messa a fuoco isoelettrica a fase liquida (IEF). Inoltre, sono state identificate le molecole separate e la loro bioattività è stata confermata.
Abstract
I prodotti naturali derivati da piante e microbi sono una ricca fonte di molecole bioattive. Prima del loro utilizzo, le molecole attive da estratti complessi devono essere purificate per applicazioni a valle. Ci sono vari metodi cromatografici disponibili per questo scopo, ma non tutti i laboratori possono permettersi metodi ad alte prestazioni e l'isolamento da campioni biologici complessi può essere difficile. Qui dimostriamo che la messa a fuoco isoelettrica in fase liquida preparata (IEF) può separare le molecole, tra cui piccole molecole e peptidi da complessi estratti vegetali, in base ai loro punti isoelettrici (pI). Abbiamo usato il metodo per la frazionamento e la caratterizzazione complesse dei campioni biologici. Come prova di concetto, abbiamo frazionato un estratto di pianta di Gymnema sylvestre, isolando una famiglia di salonina terpenoide piccole molecole e un peptide. Abbiamo anche dimostrato un'efficace separazione delle proteine microbiche usando il fungo Candida albicans come sistema modello.
Introduzione
La purificazione delle biomolecole da complessi campioni biologici è un passo essenziale e spesso difficile negli esperimenti biologici1. La messa a fuoco isoelettrica (IEF) è adatta per la separazione ad alta risoluzione di biomolecole complesse in cui gli amplificatori portante viaggiano secondo la loro carica e stabiliscono il gradiente di pH in un campo elettrico3. Il primo amplificatore commerciale per IEF è stato sviluppato da Olof Vesterberg nel 1964 e brevettato4,5. Gli ampifiti portatrici sono molecole di acido oligo-amino-amino-carboxylicia alatoriche a varia lunghezza e ramificazione6. Successivamente, Vesterberg e altri migliorarono gli amplificatori del vettore per il loro uso espanso nel separare le biomolecole6,7.
I metodi per separare le biomolecole includono l'elettroforesi gel agarosa e poliacrilamina, l'elettroforesi gel bidimensionale (2-DE), la messa a fuoco isoelettrica, l'elettroforesi capillare, l'isotachophoresi e altre tecniche cromografiche (ad esempio, TLC, FPLC, HPLC)2. La IEF in fase liquida eseguita in uno strumento chiamato "Rotofor" è stata inventata da Milan Bier8. Fu pioniere nel concetto e nella progettazione di questo strumento e contribuì ampiamente alla teoria della migrazione elettroforetica. Il suo team ha anche sviluppato un modello matematico del processo di separazione elettroforetica per simulazioni al computer9.
L'apparato IEF a fase liquida è una cella cilindrica a rotazione orizzontale costituita da un nucleo di nylon diviso in 20 compartimenti porosi e un'asta di ceramica di raffreddamento ad acqua circolante. Le camere porose permettono alle molecole di migrare attraverso la fase acquosa tra gli elettrodi e permettono la raccolta di campioni purificati sotto vuoto in frazioni. Questo sistema di purificazione può fornire fino a 1000 volte la purificazione di una molecola specifica in <4 ore. Una caratteristica preziosa di questo strumento è che può essere applicato come primo passo per la purificazione da una miscela complessa o come passo finale per raggiungere la purezza10. Se la molecola di interesse è una proteina, un altro vantaggio è che la sua conformazione nativa sarà mantenuta durante la separazione.
L'uso di IEF a fase liquida è stato ampiamente segnalato per proteine, enzimi e purificazione degli anticorpi6,10,11,12,,13,14. Qui descriviamo l'uso di questo approccio per separare e purificare piccole molecole e peptidi dalla pianta medicinale Gymnema sylvestre. Questo protocollo aiuterà i ricercatori a concentrato e a purificare le piccole molecole attive da un estratto di pianta per applicazioni a valle a basso costo. Inoltre, dimostriamo anche che l'arricchimento delle proteine da un complesso estratto di proteine da Candida albicans fungo15 in questo sistema basato su IEF come secondo esempio.
Protocollo
1. Configurazione e pre-esecuzione dell'unità IEF standard in fase liquida
- Assemblare gli elettrodi IEF a fase liquida (pulsante anodo-rosso e pulsante catodo-nero) con le rispettive membrane di scambio secondo il manuale di istruzioni (vedere Tabella dei materiali). E' necessario scambiare le membrane di scambio dell'anione con 0,1 M NaOH e le membrane di scambio di 0,1 M H34 almeno per 16 h quando vengono utilizzate nuove membrane.
- Conservare le membrane negli elettroliti (0,1 M NaOH o 0,1 M H3PO4) tra le rampe e non lasciare asciugare.
- Assemblare la parte interna ed esterna dell'elettrodo allineando tre fori oblunghi nelle guarnizioni di scambio io-io. Riempire gli elettrodi con i rispettivi elettroliti (25-30 mL) per evitare che le loro membrane si asciughino.
- Non aggiungere l'elettrolita in eccesso (più di 1/3rd di volume della camera dell'elettrodo) che può accumulare pressione all'interno dell'elettrodo e causare perdite.
- Coprire le porte di raccolta di esempio con nastro di sguarsione fornito con le parti di assieme dello strumento (vedere Tabella dei materiali). Il lato delle porte di raccolta del campione può essere identificato dai due perni di allineamento in metallo verticale. In alternativa, utilizzare il nastro di sguarsioni standard per sigillare le porte.
- Assemblare tutte le parti dell'assieme della camera di messa a fuoco in sequenza (elettrodo anodo, nucleo di membrana di nylon, camera di messa a fuoco ed elettrodo catodo) sopra il dito di raffreddamento in ceramica.
- Riempire la camera di messa a fuoco con acqua distillata preraffreddata (volume totale di 60 mL per la cella iEF standard) utilizzando una siringa da 50 mL.
- Collegare lo strumento IEF a fase liquida ad un'acqua di raffreddamento circolante a 4 oC e preeseguire l'unità a 15 W e 3.000 V per 3-5 min o fino a quando la tensione si stabilizza.
NOTA: Generalmente, entro un minuto, la tensione raggiungerà i valori massimi impostati. Pre-running con acqua distillata aiuta a rimuovere gli ioni residui dalla camera di messa a fuoco e dal nucleo della membrana di nylon. - Spegnere la fonte di alimentazione e rimuovere l'acqua dalla cella utilizzando il collettore di frazioni. Sigillare nuovamente le porte di raccolta con nastro adesivo.
NOTA: Ora lo strumento è pronto per l'uso nel passaggio 2.4.
2. Separazione e purificazione di piccole molecole e peptidi dall'estratto di Gymnema sylvestre
- Misurare 0,6 g di estratto vegetale e sciogliere in acqua distillata (60 mL) mescolando in un tubo a rulli per 5 min.
NOTA: Qualsiasi campione biologico solubile e privo di sale può essere utilizzato per la separazione e la purificazione utilizzando questo strumento IEF. I campioni con concentrazione di sale da tampone fino a 10 mM possono essere utilizzati con una risoluzione leggermente ridotta. Siamo interessati alla famiglia saponina di composti triterpenoidi, gli acidi gymnemici, dalla pianta di G. sylvestre per le loro proprietà antifungini uniche16. - Centrifugare l'estratto di pianta solubile a 10.000 x g per 5 min per rimuovere le particelle insolubili.
- Trasferire il supernatante (60 mL) in un tubo di centrifuga di 80 mL e mescolarlo con 0,6 mL di ampholyte (pH 3-10) all'1% (v/v).
- Seguire i passaggi da 1.1 a 1.7 per preparare l'unità IEF in fase liquida. La camera è ora pronta per caricare il campione.
- Utilizzare una siringa da 50 mL con un ago di estremità consuntifino da 1-1/2 pollice (fornito con lo strumento) e caricare il campione preparato con ampholyte (60 mL totali) nella cella attraverso le porte di raccolta dei campioni.
- Rimuovere le bolle d'aria dalla cella campione rimuovendo la cella di messa a fuoco dal supporto e toccando la camera dell'elettrodo per spostare le bolle. La presenza di bolle d'aria causerà fluttuazioni di tensione e corrente e influenzerà la corsa.
- Collegare l'unità al refrigerante per l'acqua (4 gradi centigradi) e iniziare la frazione con l'alimentazione a una costante di 15 W.
- Eseguire l'apparato per 3 h o fino a quando la tensione raggiunge un valore costante.
NOTA: Quando il campione inizia a mettere a fuoco, la tensione inizierà a salire gradualmente fino a raggiungere un valore costante. - Dopo la corsa, prepararsi a raccogliere le frazioni nella scatola di raccolta (contenente 20 tubi di plastica, 12 mm x 75 mm, 5-6 mL di volume) collegati alla pompa a vuoto premendo il pulsante di raccolta ON nell'unità IEF.
- Allineare i pin di raccolta 20 con le 20 porte di raccolta della cella di messa a fuoco che è sigillato con il nastro.
- Spingere i perni di raccolta attraverso il nastro di sigillatura e accendere contemporaneamente la pompa a vuoto (vedere Figura 2B, 2C e 2D).
NOTA: Circa 3 frazioni mL da ogni camera saranno raccolte nei tubi per ogni volta. Le frazioni possono essere utilizzate per le successive applicazioni a valle (SDS-PAGE per la quantificazione dei peptidi, Il TLC e il bioassaggio per piccole molecole).
3. Separazione e purificazione delle proteine dai C. albicans
- Coltivare una singola colonia di C. albicans nel brodo di lievito-peptone-dextrose (YPD)16 a 30 s con agitazione (200 rpm) per una notte.
- Raccogliere le cellule di lievito mediante centrifugazione (10.000 x g per 5 min).
- Sospendere le celle di lievito C. albicans nel buffer di carbonato di ammonio (1,89 g/L) contenente 1% (v/v) beta-mercaptoetanolo (-ME) (1/10 del volume di coltura) e ruotare in un tubo a rulli per 1 h a 5 .15
- Rimuovere le cellule di lievito mediante centrifugazione (10.000 x g per 5 min) e filtrare l'estratto di proteina attraverso un filtro di 0,45 m.
NOTA: campioni di proteine da C. albicans cytosol, membrana o parete cellulare possono essere preparati e utilizzati per la frazione IEF. Allo stesso modo, le proteine di batteri o altri campioni biologici (estratto di tessuto animale) possono essere utilizzate dopo la rimozione di qualsiasi sale con metodi appropriati(ad esempio,mediante dialisi o utilizzando colonne di delsalazione). - Dialisi l'estratto di proteine in un tubo di dialisi (3.500 MWCO) contro l'acqua per 15 h a 4 gradi centigradi. Stimare la concentrazione proteica con il metodo di legame dei coloranti Bradford utilizzando la globulina gamma come standard17.
- Utilizzare 500 mg di proteine totali in 60 mL di acqua contenente 1% (v/v) ampholyte (pH 5-8) per la frazione.
NOTA: Poiché un ampholyte ad ampio raggio (pH 3-10) non arricchisce bene alcune proteine cellulari non gluchesi di C. albicans, utilizzare un ampholyte a fascia stretta (pH 5-8). Una concentrazione di ampiste fino al 2% può essere utilizzata se la concentrazione proteica del campione è superiore a 2 mg/mL; questo riduce al minimo l'aggregazione proteica durante la messa a fuoco. Tenere sempre i campioni, gli amplificatori e l'acqua preraffreddati sul ghiaccio. - Ripetere i passaggi da 1.1 a 1.7 per preparare l'unità IEF e utilizzare la soluzione proteica del passaggio 3.6 per caricare nella cella IEF.
- Dopo 4 h di messa a fuoco a una costante di 15 W, raccogliere le frazioni proteiche (1-20) come descritto sopra (passaggi 2.9-2.11) e analizzare su 12.5% SDS-PAGE dopo aver ridotto e bollito i campioni di proteine18.
- Macchiare le proteine risolte macchiando il gel SDS-PAGE con la tintura blu Coomassie (0,01%) soluzione per 2-3 h a temperatura ambiente su un rocker. Demacchiare il gel e registrare l'immagine gel utilizzando un imager gel.
NOTA: Colora blu Coomassie (0,01%) può essere preparato mescolando 0,01 g di polvere blu Coomassie in una soluzione di destaining contenente il 40% di metanolo e il 10% di acido acetico.
4. Bioattività di piccole molecole purificate dall'estratto vegetale Gymnema sylvestre
- Crescere C. albicans in cellule di lievito come nel passaggio 3.1.
- Per preparare la sospensione cellulare, diluire la coltura notturna delle cellule di lievito di C. albicans (1/1000 diluizione) in un nuovo mezzo di coltura cellulare RPMI integrato con 50 mM di glucosio.
NOTA: C. albicans converte dalla crescita del lievito alle iphae in condizioni di induzione dell'isatra (RPMI a 37 gradi centigradi). L'acido gymnemico piccole molecole sono mostrate per inibire la conversione delle cellule di lievito in hyphae in condizioni di ipfa che inducono16. Abbiamo cercato di determinare se l'estratto di G. silvestre separato da G. IEF dalla fase liquida contenga queste molecole bioattive. - Dalla sospensione a celle preparate, aggiungere 90 gradi a ogni pozzetto della piastra di 96 pozze.
- Da ogni frazione (1-20 frazioni raccolte dell'estratto di G. sylvestre ottenute dalla IEF in fase liquida, figura 4),aggiungere 10 l nelle pozze con 90 gradi l della sospensione cellulare di cui sopra (passaggio 4.2). Eseguire il saggio in triplice copia.
- Aggiungere 10 - L di acqua che contiene ampholyte (1%) in pozzi separati con 90 L di C. albicans lievito sospensione cellulare come controllo negativo.
NOTA: Gli ampeti hanno un potenziale di bioattività e quindi è essenziale includere un controllo amplificato durante l'esecuzione di qualsiasi bioassay19. - Incubare la piastra di 96 pozzea a 37 gradi centigradi per 12 h e osservare l'inibizione della conversione da lievito a ipofha C. albicans al microscopio16. Inoltre, determinare la percentuale di inibizione della conversione tra lievito e ipha.
Risultati
Separazione e purificazione di piccole molecole e peptidi dall'estratto vegetale di Gymnema sylvestre
Utilizzando il metodo iEF preparativo in fase liquida, abbiamo frazionato estratti vegetali medicinali e proteine della superficie cellulare da un fungo patogeno umano, C. albicans. Uno schema di questi protocolli di frazionamento è illustrato nella Figura 1.
Da 20 frazioni di G. sylvestre estratto ottenuto da Liquid-phase IEF, le molecole di colore scuro (saponine terpenoide) sono state trovate migrano e sono arricchite all'estremità dell'anodo (pH 2-3) e le frazioni chiare giallo chiaro sono state osservate all'estremità catodica(pH8-9) ( Figura 2 ). Le aliquote (20- L) di ogni frazione (1-20) sono state risolte il 15% di SDS-PAGE dopo aver ridotto e bollito i campioni. Un gel Coomassie dalle macchie blu mostra la banda polipeptide diffusa di circa 5 kDa che è arricchita in frazioni 16-19 (Figura 3). È stato riferito che la pianta di G. sylvestre contiene un 35 aminoacido gurmarin polipeptide di base con il peso molecolare previsto di 4,209 Da20. Batteri, piante e animali contengono peptidi; molti di essi sono circolari (nodi) e stabili con un'ampia gamma di attività biologiche come le proprietà insetticide e antimicrobiche21,22.
Attività biologica di acidi gymnemici separati
La pianta di G. sylvestre contiene anche acidi gymnemici (saponine terpenoidi) come principali costituenti16,23,24. Come previsto, queste piccole molecole nella frazione 1 e nelle successive frazioni non sono state rilevate da SDS-PAGE e Coomassie colorazione (Figura 3) poiché non sono-proteinaceo. Tuttavia, queste piccole molecole possono essere separate da TLC e rilevate sotto la luce UV(Figura 4A, corsia F1). La frazione 10 non conteneva una quantità rilevabile di queste piccole molecole sul TLC, suggerendo che la maggior parte delle piccole molecole organiche sono state arricchite in frazioni 1-3. Le molecole di acidi gymnemici (G) hanno dimostrato di inibire la transizione C. albicans lievito-ipha16,25. Abbiamo analizzato tutte le 20 frazioni raccolte in questo studio per la loro attività inibitoria contro la conversione da lievito a ipfa C. albicans e la crescita dell'hyfalo16. I risultati sono illustrati nella figura 4B,4C. L'attività più alta si osserva nella frazione 1, che concorda con i risultati del TLC in cui si possono vedere diversi punti. Isomeri di acidi gymnemici esistono e tutti hanno attività biologiche simili10. Questi isomeri sono stati separati nella frazione 1-3 e mostrano l'inibizione della crescita isale di C. albicans (Figura 4A,4C, frazione 1). Il grado di inibizione dell'hyphal è stato gradualmente diminuito man mano che va da 1 a 10. Poca o nessuna attività è stata ottenuta in frazioni 10 e superiori.
Separazione delle proteine della superficie cellulare da funghi patogeni, C. albicans
I risultati della frazione di IEF in fase liquida delle proteine di superficie delle cellule C. albicans sono riportati nella Figura 5. Queste proteine della superficie cellulare svolgono un ruolo importante in C. albicans adesione e patogenesi26. Sono state osservate diverse proteine arricchite (frecce) in diverse frazioni. Ciò può consentire l'identificazione delle loro reazioni immunologiche con il siero umano infetto da Candida e/o la loro identificazione mediante spettrometria di massa. Allo stesso modo, le proteine di altre frazioni cellulari (ad esempio, il citoplasma e la parete cellulare) possono essere frazionate utilizzando questo metodo IEF. La purificazione basata sull'IEF a fase liquida consentirà l'identificazione di proteine a bassa abbondanza da complessi campioni biologici, se abbinati all'analisi della spettrometria di massa.
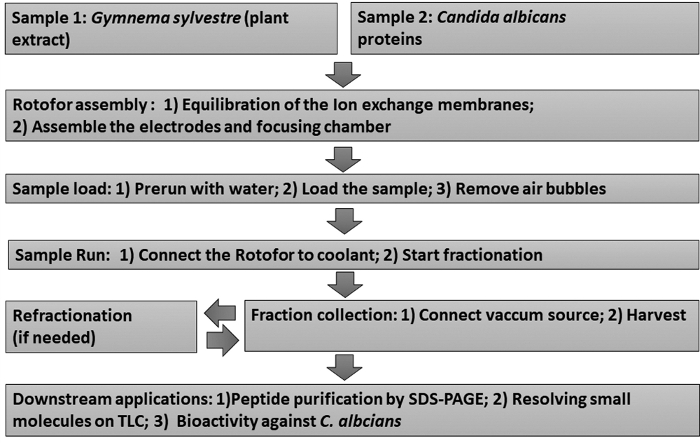
Figura 1: Diagramma di flusso che mostra il flusso di lavoro sperimentale. Sono raffigurate le procedure di frazionamento IEF in fase liquida e i successivi saggi a valle. I campioni includono Estratto di foglia di Gymnema sylvestre (campione 1) e Candida albicans proteine di lievito non glucano (campione 2). Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2: Impostazione dell'apparato IEF in fase liquida e frazionamento dell'estratto dell'impianto G. sylvestre. (A) Durante la corsa, (B) durante la raccolta delle frazioni, (C) dopo la raccolta delle frazioni e (D) le parti dell'apparato IEF in fase liquida, 1) le membrane di scambio ionica, 2) la camera di messa a fuoco e il nucleo della membrana, 3) l'assemblaggio dell'elettrodi (negativo), 4) l'assemblaggio dell'elettrodi (positivo). Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 3: Separazioni SDS-PAGE delle frazioni di estratto di pianta focalizzate iEF. L- scala, PC- Controllo positivo (peptide), 0 - campione di ingresso, 1-20 frazioni separate. SDS-PAGE (15% gel di risoluzione) è stato colorato da Coomassie tintura blu per visualizzare i peptidi risolti (5 kDa) dalle frazioni 1-20. Le frazioni 1-3 contengono piccole molecole (la frazione 1 ha un colore più scuro che indica composti arricchiti) che non possono essere macchiate/rilevate da Coomassie blue dye. Fare clic qui per visualizzare una versione più grande di questa figura.
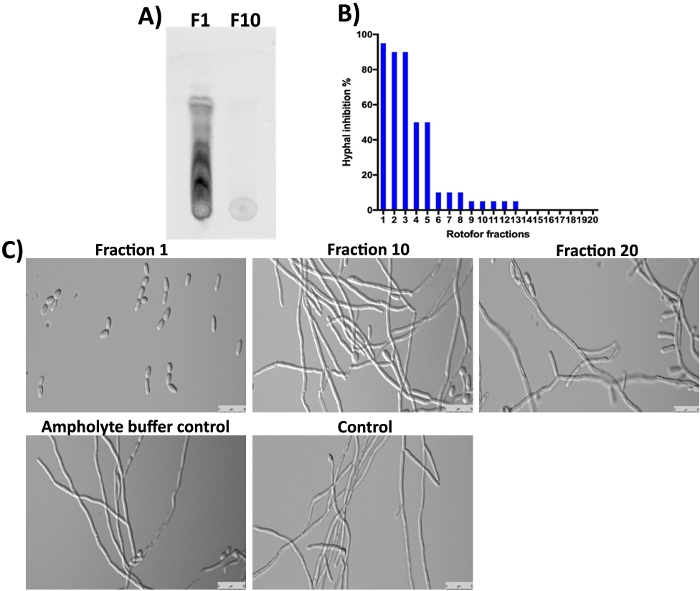
Figura 4: Analisi delle piccole molecole frazionate da IEF da parte del TLC e determinazione della bioattività nei confronti di C. albicans. (A) Mostra l'analisi TLC di piccole molecole da #1 e #10 di frazione. La piastra di gel di silice attivata è stata utilizzata per individuare 5 dollari di campioni e correva con toluene: cloroformio: solvente di metanolo (rapporto 5:8:3) fino a quando il fronte del solvente non ha raggiunto il margine. Composti separati da TLC sono stati rilevati sotto una luce UV a epifluorescenza (310 nm). (B) Indica l'inibizione della percentuale di conversione da lievito a ipha di C. albicans mediante frazioni diverse. (C) Dimostra la morfologia cellulare di C. albicans in condizioni di induzione di ipfa. La #1 frazione mostra il massimo (98%) inibizione della conversione tra lievito e ipha. Altre frazioni e controlli non mostrano alcuna inibizione della crescita isatale di C. albicans dopo 12 ore di incubazione a 37 gradi centigradi. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 5: SDS-PAGE analisi delle proteine della superficie cellulare C. albicans (non glucano attaccate). L- scala, 0 - campione di input, 1-18 frazioni raccolte dopo IEF in una cella IEF di fase liquida standard utilizzando un intervallo ristretto (pH 5-8) ampholyte. L'immagine mostra SDS-PAGE (12,5%) proteine risolte dopo la colorazione con Colorante blu Coomassie. Diverse proteine sono state arricchite in alcune frazioni (frecce). Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
Le piccole molecole provenienti da fonti di prodotti naturali (ad esempio, piante) includono metaboliti secondari complessi che sono altamente diversificati nella struttura chimica. Si ritiene che siano coinvolti nei meccanismi di difesa delle piante. Inoltre, i polipeptidi sono presenti anche nei tessuti vegetali22. Questi piccoli molecole di prodotto naturale sono ricche fonti di molecole di prova per la scoperta e lo sviluppo di farmaci. Tuttavia, i metodi difficili e noiosi necessari per il loro isolamento e purificazione ne limitano l'uso per applicazioni terapeutiche. L'approccio IEF a fase liquida utilizzato in questa relazione evidenzia la capacità di separare queste piccole molecole e polipeptidi senza compromettere le loro bioattività.
Questo metodo basato su IEF offre diversi vantaggi nel separare le molecole biologiche, tra cui la concentrazione di proteine purificate da una miscela complessa, il mantenimento della conformazione nativa durante e dopo la loro messa a fuoco e la raccolta di campioni come singole frazioni purificate senza contaminazione incrociata. Se necessario, i campioni possono essere concentrati nuovamente con una gamma di pH stretta per purificare le isoforme proteiche. Dal momento che è disponibile una cella di messa a fuoco IEF in miniatura (15 mL), può essere utilizzata anche per piccoli volumi di campioni. La nuova scoperta di questa relazione è che piccole molecole organiche e peptidi possono essere separati da un complesso estratto vegetale. Anche se è difficile concordare sul fatto che piccole molecole possono essere separate da estratti di prodotto naturali da IEF, è plausibile per quei composti che sono amphoteric. Gli acidi gymnemici che sono stati separati dal peptide gurmarin nell'estratto di G. sylvestre sembrano essere amphoteric in quanto contengono un gruppo di acido carboxilico o si comportano così almeno in presenza dell'ampholyte utilizzato. Poiché i glicosides sono molecole naturali bioattive simili agli acidi gymnemici, il metodo IEF può essere utilizzato per separarli da fonti naturali complesse. Allo stesso modo, i peptidi dei prodotti naturali possono anche essere isolati utilizzando questo approccio IEF in fase liquida.
Alcune delle limitazioni di questo approccio sono che non tutte le piccole molecole possono essere frazionate con il metodo IEF in quanto devono essere almeno solubili in acqua e debolmente umide. L'estratto utilizzato qui è stato preparato da un 50% di estrazione di metanolo di materiale vegetale essiccato, ma è solubile in acqua. L'uso del metodo IEF per composti solubili e amphoterici deve essere visto come alcuni dei solventi organici sono incompatibili con i componenti dello strumento IEF in fase liquida. La tendenza delle proteine a precipitare nei loro punti isoelettrici (pI) in soluzioni a bassa resistenza ionica è ben nota. Tuttavia, in un sistema IEF rotante, la precipitazione delle proteine si riduce man mano che le proteine mirate rimangono in circolazione al loro punto di pI.
Se si utilizza un'alta concentrazione di proteine in questa separazione IEF, può verificarsi precipitazioni. Per ridurre al minimo le precipitazioni proteiche e migliorare la messa a fuoco delle proteine, l'urea può essere utilizzato fino a 3-5 M. Detergenti nonionic come CHAPS, digitonin e bassa concentrazione di detergenti (0,1-1%) può essere utilizzato anche per ridurre l'aggregazione proteica durante l'IEF. Tuttavia, urea e detergenti devono essere rimossi prima di analizzare le proteine per la loro attività e, in alcuni casi, questi agenti possono influenzare le funzioni proteiche. Alcuni passaggi critici da considerare durante un'esecuzione IEF in fase liquida includono il caricamento della cella di messa a fuoco IEF senza bolle d'aria, la sostituzione delle membrane di scambio ioleose se sono state danneggiate e la sostituzione dei pulsanti di sfiato dopo un certo numero di usi ripetuti.
In conclusione, utilizzando il metodo IEF di fase liquida, abbiamo dimostrato la separazione di acidi ginterra bioattivi e polipeptide gurmarin dall'estratto di foglia G. sylvestre. Inoltre, l'IEF a fase liquida può essere utile per arricchire le proteine selettive dai complessi estratti grezzi di microbi patogeni.
Divulgazioni
Gli autori vorrebbero dichiarare interessi finanziari concorrenti.
Riconoscimenti
Siamo grati per le fonti di finanziamento della Divisionof Biology e Johnson Cancer Research Center per i premi BRIEF e IRA, rispettivamente a GV. Ringraziamo anche il premio post-dottorato K-INBRE al camper. Questo lavoro è stato sostenuto in parte dall'Institutional Development Award (IDeA) dell'Istituto Nazionale di Scienze Mediche Generali degli Istituti Nazionali di Sanità con il numero di sovvenzione P20 GM103418. Il contenuto è di esclusiva responsabilità degli autori e non rappresenta necessariamente le opinioni ufficiali dell'Istituto Nazionale di Scienze Mediche Generali o degli Istituti Nazionali di Sanità. Ringraziamo i revisori anonimi per i loro commenti utili.
Materiali
| Name | Company | Catalog Number | Comments |
| 0.45 µm syringe filter | Fisher scientfic | 09-720-004 | |
| 2-Mercaptoethanol | Sigma | M3148 | |
| Ammonium carbonate | Sigma-Aldrich | 207861-500 | |
| Bio-Lyte 3/10 Ampholyte | Bio-Rad | 163-1113 | |
| Bio-Lyte 5/8 Ampholyte | Bio-Rad | 163-1192 | |
| Compact low temperature thermostat | Lauda -Brinkmann | RM 6T | Set water cooling to 4 oC and it can be run even at 0 oC as when it passes through the Rotofor cooling core, the circulating water temperature will be around 5 or more depending on the voltage. |
| Coomassie Brilliant Blue R | Sigma-Aldrich | B7920 | |
| Dialysis tubing (3,500 MWCO) | Spectrum Spectra/Por | 132112T | |
| Gymnema plant leaf extract powder (>25% Gymnemic acids) | Suan Farma, NJ USA | ||
| Incubator | Lab companion | SI 300R | |
| Microscope | Leica | DM 6B | |
| Mini protean electrophoresis | Bio-Rad | ||
| pH meter | Mettler Toledo | S20 | Useful to determine the pH of the Rotofor (liquid-phase IEF) fractions |
| Rotofor | Bio-Rad | 170-2972 | http://www.bio-rad.com/webroot/web/pdf/lsr/literature/M1702950E.pdf (Rotofor Instruction manual for assembling the unit) |
| RPMI-1640 Medium | HyClone | DH30255.01 | |
| Sealing tape | Bio-Rad | 170-2960 | Scotch tape may also be used. |
| Sorvall legend micro 17 centrifuge | Thermo scientific | 75002432 | |
| TPP tissue culture plate -96 well flat bottom | TPP | TP92696 |
Riferimenti
- Jankowska, U., et al. Optimized procedure of extraction, purification and proteomic analysis of nuclear proteins from mouse brain. Journal of Neuroscience Methods. 261, 1-9 (2016).
- Pergande, M. R., Cologna, S. M. Isoelectric Point Separations of Peptides and Proteins. Proteomes. 5 (1), (2017).
- Stoyanov, A. IEF-based multidimensional applications in proteomics: toward higher resolution. Electrophoresis. 33 (22), 3281-3290 (2012).
- Vesterberg, O. A. Y. Method of Isoelectric Fractionation. , US3485736A (1964).
- Vesterberg, O., Svensson, H. Isoelectric fractionation, analysis, and characterization of ampholytes in natural pH gradients. IV. Further studies on the resolving power in connection with separation of myoglobins. Acta Chemica Scandinavica. 20 (3), 820-834 (1966).
- Righetti, P. G. Isoelectric Focusing: Theory, Methodology and Applications. , Elsevier Science. 1(1983).
- Vesterberg, O. Synthesis and Isoelectric Fractionation of Carrier Ampholytes. Acta Chemica Scandinavica. 23, 2653-2666 (1969).
- Bier, M. Recycling isoelectric focusing and isotachophoresis. Electrophoresis. 19 (7), 1057-1063 (1998).
- Bier, M., Palusinski, O. A., Mosher, R. A., Saville, D. A. Electrophoresis: mathematical modeling and computer simulation. Science. 219 (4590), 1281-1287 (1983).
- Ayala, A., Parrado, J., Machado, A. Use of Rotofor preparative isoelectrofocusing cell in protein purification procedure. Applied Biochemistry and Biotechnology. 69 (1), 11-16 (1998).
- Wagner, L., et al. Isolation of dipeptidyl peptidase IV (DP 4) isoforms from porcine kidney by preparative isoelectric focusing to improve crystallization. Biological Chemistry. 392 (7), 665-677 (2011).
- Hosken, B. D., Li, C., Mullappally, B., Co, C., Zhang, B. Isolation and Characterization of Monoclonal Antibody Charge Variants by Free Flow Isoelectric Focusing. Analytical Chemistry. 88 (11), 5662-5669 (2016).
- Yu, J. J., et al. Francisella tularensis T-cell antigen identification using humanized HLA-DR4 transgenic mice. Clinical Vaccine Immunology. 17 (2), 215-222 (2010).
- Riyong, D., et al. Size and charge antigens of Dirofilaria immitis adult worm for IgG-ELISA diagnosis of bancroftian filariasis. Southeast Asian Journal of Tropical Medicine and Public Health. 41 (2), 285-297 (2010).
- Vediyappan, G., Bikandi, J., Braley, R., Chaffin, W. L. Cell surface proteins of Candida albicans: preparation of extracts and improved detection of proteins. Electrophoresis. 21 (5), 956-961 (2000).
- Vediyappan, G., Dumontet, V., Pelissier, F., d'Enfert, C. Gymnemic acids inhibit hyphal growth and virulence in Candida albicans. PLoS One. 8 (9), 74189(2013).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry. 72, 248-254 (1976).
- Laemmli, U. K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 227 (5259), 680-685 (1970).
- Riazi, S., Dover, S., Turovskiy, Y., Chikindas, M. L. Commercial ampholytes used for isoelectric focusing may interfere with bioactivity based purification of antimicrobial peptides. Journal of Microbiological Methods. 71 (1), 87-89 (2007).
- Kamei, K., Takano, R., Miyasaka, A., Imoto, T., Hara, S. Amino-Acid-Sequence of Sweet-Taste-Suppressing Peptide (Gurmarin) from the Leaves of Gymnema-Sylvestre. Journal of Biochemistry. 111 (1), 109-112 (1992).
- Craik, D. J. Chemistry. Seamless proteins tie up their loose ends. Science. 311 (5767), 1563-1564 (2006).
- Craik, D. J., Daly, N. L., Bond, T., Waine, C. Plant cyclotides: A unique family of cyclic and knotted proteins that defines the cyclic cystine knot structural motif. Journal of Molecular Biology. 294 (5), 1327-1336 (1999).
- Stoecklin, W. Chemistry and physiological properties of gymnemic acid, the antisaccharine principle of the leaves of Gymnema sylvestre. Journal of Agricultural and Food Chemistry. 17 (4), 704-708 (1969).
- Liu, H. M., Kiuchi, F., Tsuda, Y. Isolation and structure elucidation of gymnemic acids, antisweet principles of Gymnema sylvestre. Chemical & Pharmaceutical Bulletin (Tokyo). 40 (6), 1366-1375 (1992).
- Veerapandian, R., Vediyappan, G. Gymnemic Acids Inhibit Adhesive Nanofibrillar Mediated Streptococcus gordonii-Candida albicans Mono-Species and Dual-Species Biofilms. Frontiers in Microbiology. 10, 2328(2019).
- Chaffin, W. L. Candida albicans cell wall proteins. Microbiology and Molecular Biology Reviews. 72 (3), 495-544 (2008).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon