Method Article
Separación de Moléculas Pequeñas Bioactivas, Péptidos de Fuentes Naturales y Proteínas de Microbios por Método de Enfoque Isoeléctrico Preparativo (IEF)
En este artículo
Resumen
El objetivo es fraccionar y aislar moléculas pequeñas bioactivas, péptidos de un extracto de planta complejo y proteínas de microbios patógenos mediante el empleo de un método de enfoque isoeléctrico de fase líquida (IEF). Además, se identificaron las moléculas separadas y se confirmó su bioactividad.
Resumen
Los productos naturales derivados de plantas y microbios son una rica fuente de moléculas bioactivas. Antes de su uso, las moléculas activas de extractos complejos deben purificarse para aplicaciones posteriores. Hay varios métodos cromatográficos disponibles para este propósito, pero no todos los laboratorios pueden permitirse métodos de alto rendimiento y el aislamiento de muestras biológicas complejas puede ser difícil. Aquí demostramos que el enfoque isoeléctrico de fase líquida preparatoria (IEF) puede separar moléculas, incluyendo moléculas pequeñas y péptidos de extractos de plantas complejas, basados en sus puntos isoeléctricos (pI). Hemos utilizado el método para la fraccionamiento y caracterización de muestras biológicas complejas. Como prueba de concepto, fraccionamos un extracto de planta de Gymnema sylvestre, aislando una familia de saponina terpenoides pequeñas moléculas y un péptido. También demostramos una separación eficaz de las proteínas microbianas utilizando el hongo Candida albicans como sistema modelo.
Introducción
La purificación de biomoléculas a partir de muestras biológicas complejas es un paso esencial y a menudo difícil en los experimentos biológicos1. El enfoque isoeléctrico (IEF) es adecuado para la separación de alta resolución de biomoléculas complejas donde los anfieles portadores viajan de acuerdo con su carga y establecen el gradiente de pH en un campo eléctrico3. El primer ampholyte de soporte comercial para IEF fue desarrollado por Olof Vesterberg en 1964 y patentado4,5. Los anfólitos portadores son moléculas de ácido oligo-amino oligo-carboxílico alifático de longitud variable y ramificación6. Posteriormente, Vesterberg y otros mejoraron los anfilitos portadores para su uso ampliado en la separación de biomoléculas6,7.
Los métodos para separar las biomoléculas incluyen la electroforesis de gel de agarosa y policrilamida, la electroforesis de gel bidimensional (2-DE), el enfoque isoeléctrico, la electroforesis capilar, la isotachoforesis y otras técnicas cromatográficas (por ejemplo, TLC, FPLC, HPLC)2. IEF de fase líquida interpretado en un instrumento llamado "Rotofor" fue inventado por el Milan Bier8. Fue pionero en el concepto y diseño de este instrumento y contribuyó ampliamente a la teoría de la migración electroforética. Su equipo también desarrolló un modelo matemático de proceso de separación electroforética para simulaciones por ordenador9.
El aparato IEF de fase líquida es una célula cilíndrica giratoria horizontal que consiste en un núcleo de nylon dividido en 20 compartimentos porosos y una varilla de cerámica de enfriamiento de agua circulante. Las cámaras porosas permiten que las moléculas migren a través de la fase acuosa entre los electrodos y permiten la recolección de muestras purificadas al vacío en fracciones. Este sistema de purificación puede proporcionar hasta 1000 veces la purificación de una molécula específica en <4 horas. Una característica valiosa de este instrumento es que se puede aplicar como un primer paso para la purificación de una mezcla compleja o como paso final para lograr la pureza10. Si la molécula de interés es una proteína, otra ventaja es que su conformación nativa se mantendrá durante la separación.
El uso de IEF de fase líquida se ha notificado ampliamente para proteínas, enzimas y purificación de anticuerpos6,10,11,12,13,14. Aquí describimos el uso de este enfoque para separar y purificar pequeñas moléculas y péptidos de la planta medicinal Gymnema sylvestre. Este protocolo ayudará a los investigadores a concentrar y purificar moléculas pequeñas activas de un extracto de planta para aplicaciones posteriores a bajo costo. Además, también demostramos que el enriquecimiento de proteínas de un extracto de proteína complejo del hongo Candida albicans 15 en este sistema basado en IEF como segundo ejemplo.
Protocolo
1. Configuración y prerugiendo de la unidad IEF de fase líquida estándar
- Montar los electrodos IEF de fase líquida (botón de ánodo-rojo y botón catódo-negro) con sus respectivas membranas de intercambio de acuerdo con el manual de instrucciones (ver Tabla de materiales). Equilibrar las membranas de intercambio de aniones con 0,1 M NaOH y las membranas de intercambio catiónicos con 0,1 M H3PO4 al menos durante 16 h cuando se utilizan nuevas membranas.
- Conservar las membranas en electrolitos (0,1 M NaOH o 0,1 M H3PO4) entre conductos y no permitir que se sequen.
- Montar la parte interior y exterior del electrodo alineando tres orificios oblongos en las juntas de intercambio iónico. Llene los electrodos con los electrolitos respectivos (25-30 ml) para evitar que sus membranas se sequen.
- No agregue el exceso (más de 1/3rd de volumen de la cámara del electrodo) de electrolito que pueda acumular presión dentro del electrodo y causar fugas.
- Cubra los puertos de recogida de muestras con cinta de sellado que viene con las piezas de ensamblaje del instrumento (consulte Tabla de materiales). El lado de los puertos de colección de muestras se puede identificar mediante los dos pasadores de alineación de metal vertical. Alternativamente, utilice cinta de sellado estándar para sellar los puertos.
- Montar todas las partes del conjunto de la cámara de enfoque en secuencia (electrodo de ánodo, núcleo de membrana de nylon, cámara de enfoque y electrodo de cátodo) sobre el dedo de enfriamiento de cerámica.
- Llene la cámara de enfoque con agua destilada preenfriada (volumen total de 60 ml para la celda IEF estándar) utilizando una jeringa de 50 ml.
- Conecte el instrumento IEF de fase líquida a un agua de refrigeración circulante a 4 oC y prerun la unidad a 15 W y 3,000 V durante 3-5 min o hasta que la tensión se estabilice.
NOTA: Generalmente, en un minuto, la tensión alcanzará los valores máximos establecidos. Prerunning con agua destilada ayuda a eliminar los iones residuales de la cámara de enfoque y el núcleo de la membrana de nylon. - Apague la fuente de alimentación y retire el agua de la celda con el colector de fracciones. Vuelva a sellar los puertos de recogida con cinta adhesiva.
NOTA: Ahora el instrumento está listo para su uso en el paso 2.4.
2. Separación y purificación de moléculas pequeñas y péptidos del extracto de Gymnema sylvestre
- Mida 0,6 g de extracto de planta y disuelva en agua destilada (60 ml) mezclando en un tubo de rodillo durante 5 min.
NOTA: Cualquier muestra biológica que sea soluble y libre de sal se puede utilizar para la separación y purificación utilizando este instrumento IEF. Las muestras con concentración de sal amortiguadora de hasta 10 mM se pueden utilizar con una resolución ligeramente disminuida. Estamos interesados en la familia saponina de compuestos triterpenoides, los ácidos gimnómicos, de la planta G. sylvestre por sus propiedades antifúngicas únicas16. - Centrifugar el extracto de planta solubilizada a 10.000 x g durante 5 min para eliminar partículas insolubles.
- Transfiera el sobrenadante (60 ml) a un tubo centrífugo de 80 ml y mezcle con 0,6 ml de anfólito (pH 3-10) a 1% (v/v).
- Siga los pasos 1.1 a 1.7 para preparar la unidad IEF de fase líquida. La cámara ya está lista para cargar la muestra.
- Utilice una jeringa de 50 ml con una aguja de extremo romo de 1-1/2 pulgadas y 19 G (viene con el instrumento) y cargue la muestra preparada con anzuelo (60 ml en total) en la celda a través de puertos de recogida de muestras.
- Retire las burbujas de aire de la celda de muestra quitando la célula de enfoque del soporte y tocando la cámara del electrodo para desalojar las burbujas. La presencia de burbujas de aire causará fluctuaciones de tensión y corriente y afectarán a la carrera.
- Conecte la unidad al refrigerante de agua (4 oC) y arranque el fraccionamiento con la fuente de alimentación a una temperatura de 15 W.
- Ejecute el aparato durante 3 h o hasta que la tensión alcance un valor constante.
NOTA: A medida que la muestra comienza a enfocarse, el voltaje comenzará a subir gradualmente hasta que alcance un valor constante. - Después de la carrera, prepárese para recoger las fracciones en la caja de cosecha (que contiene 20 tubos de plástico, 12 mm x 75 mm, 5-6 ml de volumen) conectados a la bomba de vacío pulsando el botón de cosecha ON en la unidad IEF.
- Alinee los pines de 20 colecciones con los puertos de 20 colecciones de la celda de enfoque que está sellada con la cinta.
- Empuje los pasadores de recogida a través de la cinta de sellado y encienda la bomba de vacío simultáneamente (consulte la Figura 2B, 2C y 2D).
NOTA: Alrededor de 3 fracciones de ml de cada cámara se recogerán en los tubos para cada vez. Las fracciones se pueden utilizar para aplicaciones posteriores posteriores (SDS-PAGE para la cuantificación de péptidos, TLC y bioensayo para moléculas pequeñas).
3. Separación y purificación de proteínas de C. albicans
- Cultivar una sola colonia de C. albicans en caldo de levadura-peptona-dextrosa (YPD)16 a 30 oC con temblor (200 rpm) durante la noche.
- Recoger las células de levadura por centrifugación (10.000 x g durante 5 min).
- Suspenda las células de levadura C. albicans en carbonato de amonio (1,89 g/L) tampón que contenga un 1% (v/v) beta-mercaptoetanol (-ME) (1/10 del volumen de cultivo) y gire en un tubo de rodillos durante 1 h a 5 oC15.
- Retire las células de levadura por centrifugación (10.000 x g durante 5 min) y filtre el extracto de proteína a través de un filtro de 0,45 m.
NOTA: Las muestras de proteínas de C. albicans cytosol, membrana o pared celular se pueden preparar y utilizar para fraccionamiento IEF. Del mismo modo, las proteínas de bacterias u otras muestras biológicas (extracto de tejido animal) se pueden utilizar después de eliminar cualquier sal mediante métodos apropiados (porejemplo,mediante diálisis o utilizando columnas de desaladación). - Dialyze el extracto de proteína en un tubo de diálisis (3.500 MWCO) contra el agua durante 15 h a 4 oC. Estimar la concentración de proteínas por el método de unión de colorante Bradford utilizando la globulina gamma como estándar17.
- Utilice 500 mg de proteína total en 60 ml de agua que contenga 1% (v/v) anzuelo (pH 5-8) para la fraccionación.
NOTA: Dado que un anfilito de amplio alcance (pH 3-10) no enriquece bien ciertas proteínas de pared celular no-glucano de C. albicans, utilice un antillito de rango estrecho (pH 5-8). Se puede utilizar una concentración de anfilito de hasta 2% si la concentración de proteína de la muestra es superior a 2 mg/ml; esto minimiza la agregación de proteínas durante el enfoque. Mantenga siempre las muestras, los anfilitos y el agua preenfriado sobre hielo. - Repita los pasos 1.1 a 1.7 para preparar la unidad IEF y utilizar la solución proteica del paso 3.6 para cargarla en la célula IEF.
- Después de 4 horas de enfocarse en una constante de 15 W, cosecha fracciones de proteínas (1-20) como se describió anteriormente (pasos 2.9-2.11) y analiza en 12.5% SDS-PAGE después de reducir y hervir las muestras deproteínas 18.
- Manchar las proteínas resueltas manchando el gel SDS-PAGE con el tinte azul Coomassie (0,01%) solución para 2-3 h a temperatura ambiente en un balancín. Detenga el gel y grabe la imagen del gel con un imán de gel.
NOTA: Tinte azul Coomassie (0,01%) se puede preparar mezclando 0,01 g de polvo azul de Coomassie en una solución de detención que contiene 40% de metanol y 10% ácido acético.
4. Bioactividad de moléculas pequeñas purificadas del extracto de plantas Gymnema sylvestre
- Cultivar C. albicans en células de levadura como en el paso 3.1.
- Para preparar la suspensión celular, diluir el cultivo nocturno de C. albicans células de levadura (1/1000 dilución) en un medio de cultivo celular RPMI fresco complementado con 50 mM de glucosa.
NOTA: C. albicans convierte del crecimiento de la levadura a hifas en condiciones de inductor hifalal (RPMI a 37 oC). Se ha demostrado que las moléculas pequeñas de ácido gimnómico inhiben la conversión de células de levadura en hifas en condiciones de inducción hifa16. Nuestro objetivo era determinar si el extracto de G. sylvestre separado por la fase líquida-IEF contiene estas moléculas bioactivas. - A partir de la suspensión de la célula preparada, agregue 90 l a cada pocód en cada pocód en la placa de 96 pocillos.
- De cada fracción (1-20 fracciones cosechadas de extracto de G. sylvestre obtenidas de IEF de fase líquida, Figura 4), añadir 10 l en los pocós con 90 l de la suspensión celular anterior (paso 4.2). Realice el ensayo por triplicado.
- Añadir 10 l de agua que contenga anfilito (1%) en pozos separados con 90 ml de C. suspensión de células de levadura albicans como un control negativo.
NOTA: Los anfilitos tienen potencial de bioactividad, por lo que es esencial incluir un control de anfieles mientras se realiza cualquier bioensayo19. - Incubar la placa de 96 pocillos a 37oC durante 12 h y observar la inhibición de la conversión de C. albicans de levadura a hifa bajo el microscopio16. Además, determinar el porcentaje de inhibición de la conversión de levadura a hifa.
Resultados
Separación y purificación de moléculas pequeñas y péptidos del extracto de la planta Gymnema sylvestre
Utilizando el método IEF de fase líquida preparatoria, fraccionamos extractos de plantas medicinales y proteínas de superficie celular de un hongo patógeno humano, C. albicans. Un esquema de estos protocolos de fraccionamiento se muestra en la Figura 1.
A partir de 20 fracciones de extracto de G. sylvestre obtenidas de IEF de fase líquida, se encontraron las moléculas de color oscuro (saponinas terpenoides) para migrar y enriquecerse en el extremo del ánodo (pH 2-3) y las fracciones claras claras de color amarillo claro en el extremo del cátodo (pH 8-9) (Figura 2). Las alícuotas (20 l) de cada fracción (1-20) se resolvieron en un 15% de SDS-PAGE después de reducir y hervir las muestras. Un gel de coomassie teñido de azul muestra la banda de polipéptido difusa de aproximadamente 5 kDa que se enriquece en fracciones 16-19 (Figura 3). Se ha informado que la planta G. sylvestre contiene un polipéptido básico de 35 aminoácidos gurmarin con el peso molecular previsto de 4,209 Da20. Las bacterias, plantas y animales contienen péptidos; muchos de ellos son circulares (knottinas) y estables con una amplia gama de actividades biológicas como las propiedades insecticidas y antimicrobianas21,,22.
Actividad biológica de ácidos gimnómicos separados
La planta G. sylvestre también contiene ácidos gimnómicos (saponinas terpenoides) como componentes principales16,23,24. Como era de esperar, estas moléculas pequeñas en la fracción 1 y las siguientes fracciones no fueron detectadas por SDS-PAGE y la tinción de Coomassie (Figura 3) ya que no son proteicas. Sin embargo, estas moléculas pequeñas pueden ser separadas por TLC y detectadas bajo luz UV(Figura 4A, carril F1). La Fracción 10 no contenía una cantidad detectable de estas moléculas pequeñas en TLC sugiriendo que la mayoría de las moléculas pequeñas orgánicas se enriquecieron en fracciones 1-3. Se demostró que las moléculas de ácidos gimnómicos (GIA) inhiben la transición de C. albicans de levadura a hifa16,25. Hemos ensayado las 20 fracciones recogidas en este estudio para su actividad inhibitoria contra C. albicans conversión de levadura a hifa y crecimientohifalo 16. Los resultados se muestran en la Figura 4B,4C. La actividad más alta se observa en la fracción 1, que está de acuerdo con los resultados de TLC donde se pueden ver varios puntos. Los isómeros de los ácidos gimnómicos existen y todos tienen actividades biológicas similares10. Estos isómeros se separaron en la fracción 1-3 y muestran inhibición del crecimiento hipphal de C. albicans (Figura 4A,4C, fracción 1). El grado de inhibición hifalal disminuyó gradualmente a medida que pasa de 1 a 10. Se obtuvo poca o ninguna actividad en fracciones 10 o superiores.
Separación de proteínas superficiales celulares del hongo patógeno, C. albicans
Los resultados del fraccionamiento IEF en fase líquida de proteínas superficiales celulares C. albicans se muestran en la Figura 5. Estas proteínas de superficie celular desempeñan un papel importante en la adhesión de C. albicans y la patogénesis26. Se observaron varias proteínas enriquecidas (flechas) en diferentes fracciones. Esto puede permitir la identificación de sus reacciones inmunológicas con el suero humano infectado por Candida y/o su identificación por espectrometría de masas. Del mismo modo, las proteínas de otras fracciones celulares (por ejemplo, citoplasma y pared celular) se pueden fraccionar utilizando este método IEF. La purificación basada en IEF en fase líquida permitirá la identificación de proteínas de baja abundancia a partir de muestras biológicas complejas, cuando se combina con análisis de espectrometría de masas.
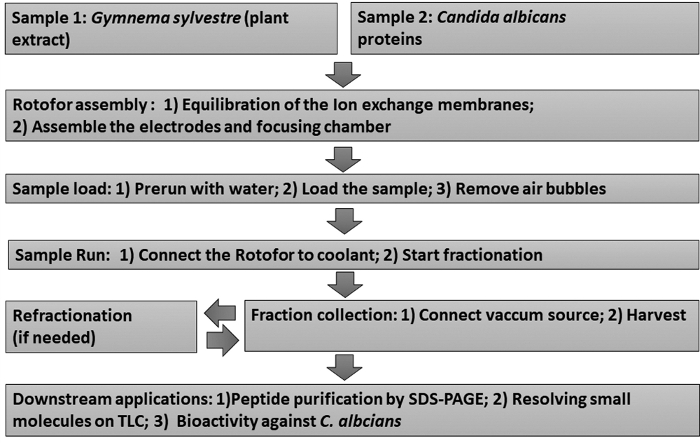
Figura 1: Gráfico de flujo que muestra el flujo de trabajo experimental. Se representan procedimientos de fraccionamiento IEF de fase líquida escalonada y ensayos posteriores posteriores. Las muestras incluyen extracto de hoja de Gymnema sylvestre (muestra 1) y Candida albicans proteínas de levadura no glucano (muestra 2). Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Configuración del aparato IEF en fase líquida y fraccionamiento del extracto de planta G. sylvestre. (A) Durante la carrera, (B) durante la recolección de fracciones, (C) después de la recolección de fracciones, y (D) piezas de aparato IEF de fase líquida, 1) membranas de intercambio iónico, 2) cámara de enfoque y núcleo de membrana, 3) conjunto de electrodos (negativo), 4) conjunto de electrodos (positivo). Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Separaciones SDS-PAGE de las fracciones de extracto de plantas enfocadas en IEF. L- escalera, PC- Control positivo (péptido), 0 - muestra de entrada, 1-20 fracciones separadas. SDS-PAGE (15% gel de resolución) fue manchado por el tinte azul Coomassie para visualizar los péptidos resueltos (5 kDa) de las fracciones 1-20. Las fracciones 1-3 contienen moléculas pequeñas (la fracción 1 tiene un color más oscuro que indica compuestos enriquecidos) que no pueden ser manchadas/detectadas por el tinte azul De Coomassie. Haga clic aquí para ver una versión más grande de esta figura.
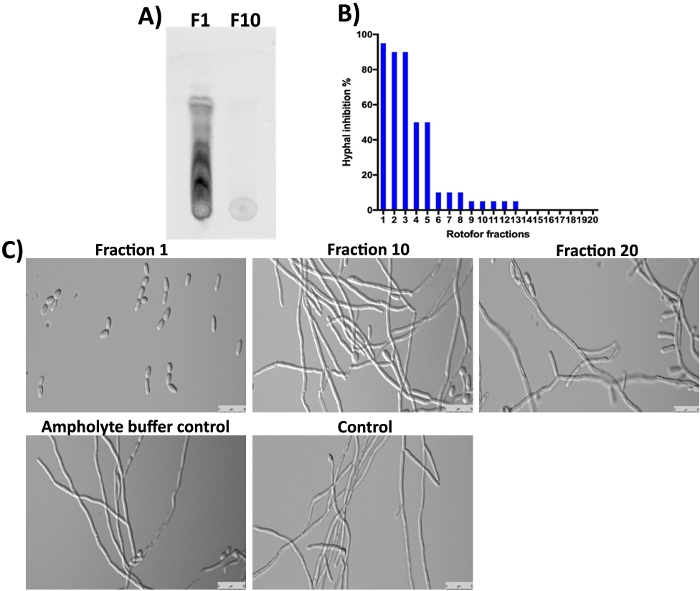
Figura 4: Análisis de moléculas pequeñas fraccionadas del IEF por TLC y determinación de la bioactividad contra C. albicans. (A) Muestra el análisis TLC de moléculas pequeñas a partir de #1 de fracción y #10. La placa de gel de sílice activada se utilizó para detectar 5 ml de muestras y corrió con tolueno: cloroformo: disolvente de metanol (5:8:3 relación) hasta que el frente del disolvente alcanzó el margen. Los compuestos separados por TLC se detectaron bajo una luz UV de epifluorescencia (310 nm). (B) Muestra el porcentaje de inhibición de la conversión de levadura a hifa de C. albicans por diferentes fracciones. (C) Demuestra la morfología celular de C. albicans en condiciones de inducción de hifas. Fracción #1 muestra máximo (98%) inhibición de la conversión de levadura a hifa. Otras fracciones y controles no muestran inhibición del crecimiento hipórico de C. albicans después de 12 horas de incubación a 37 oC. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Análisis SDS-PAGE de proteínas superficiales celulares C. albicans (no asadas a glucano). Escalera L, 0 - muestra de entrada, 1-18 fracciones recogidas después de IEF en una célula IEF de fase líquida estándar utilizando un ampholyte de rango estrecho (pH 5-8). La imagen muestra SDS-PAGE (12,5%) proteínas resueltas después de la tinción con tinte azul Coomassie. Varias proteínas se enriquecieron en ciertas fracciones (flechas). Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Las moléculas pequeñas de fuentes de productos naturales (por ejemplo, plantas) incluyen metabolitos secundarios complejos que son muy diversos en la estructura química. Se cree que están involucrados en los mecanismos de defensa de las plantas. Además, los polipéptidos también están presentes en los tejidos vegetales22. Estas moléculas pequeñas de producto natural son ricas fuentes de moléculas de prueba para el descubrimiento y desarrollo de fármacos. Sin embargo, los métodos difíciles y tediosos requeridos para su aislamiento y purificación limitan su uso para aplicaciones terapéuticas. El enfoque de IEF de fase líquida utilizado en este informe pone de relieve la capacidad de separar estas pequeñas moléculas y polipéptidos sin comprometer sus bioactividades.
Este método basado en IEF ofrece varias ventajas en la separación de moléculas biológicas, incluida la concentración de proteínas purificadas de una mezcla compleja, el mantenimiento de la conformación nativa durante y después de su enfoque, y la recolección de muestras como fracciones purificadas individuales sin contaminación cruzada. Cuando sea necesario, las muestras se pueden volver a enfocar con un rango de pH estrecho para purificar las isoformas proteicas. Dado que una celda de enfoque IEF en miniatura (15 ml) está disponible, también se puede utilizar para volúmenes más pequeños de muestras. El nuevo hallazgo de este informe es que las moléculas pequeñas orgánicas y los péptidos pueden separarse de un extracto de planta compleja. Aunque es difícil estar de acuerdo en que las moléculas pequeñas pueden ser separadas de los extractos de productos naturales por IEF, es plausible para aquellos compuestos que son anfítelos. Los ácidos gimnémicos que se separaron del péptido de gurmarin en el extracto de g. sylvestre parecen ser anfóteros ya que contienen un grupo de ácido carboxílico o se comportan al menos en presencia del anfólito utilizado. Dado que los glucósidos son moléculas naturales bioactivas similares a los ácidos gimnómicos, el método IEF se puede utilizar para separarlos de fuentes naturales complejas. Del mismo modo, los péptidos de productos naturales también pueden aislarse utilizando este enfoque de IEF en fase líquida.
Algunas de las limitaciones de este enfoque son que no todas las moléculas pequeñas pueden ser fraccionadas por el método IEF, ya que deben ser solubles en agua y débilmente anfóteas, al menos. El extracto utilizado aquí fue preparado por una extracción de metanol 50% de material vegetal seco, pero es soluble en agua. El uso del método IEF para compuestos solubles en disolventes y anfíteicos sigue siendo visto como algunos de los disolventes orgánicos son incompatibles con los componentes del instrumento IEF de fase líquida. La tendencia de las proteínas a precipitarse en sus puntos isoeléctricos (pI) en soluciones de baja resistencia iónica es bien conocida. Sin embargo, en un sistema IEF giratorio, la precipitación de proteínas se reduce a medida que las proteínas enfocadas permanecen en circulación en su punto de pI.
Si se utiliza una alta concentración de proteínas en esta separación de IEF, puede producirse precipitación. Para minimizar la precipitación de proteínas y mejorar el enfoque proteico, la urea se puede utilizar hasta 3-5 M. Detergentes no iónicos como CHAPS, digitonina y baja concentración de detergentes (0,1-1%) también se puede utilizar para reducir la agregación de proteínas durante el IEF. Sin embargo, es necesario eliminar la urea y los detergentes antes de analizar las proteínas para su actividad y, en algunos casos, estos agentes pueden afectar a las funciones proteicas. Algunos pasos críticos a tener en cuenta durante una ejecución de IEF en fase líquida incluyen cargar la célula de enfoque IEF sin burbujas de aire, reemplazar las membranas de intercambio iónico si estaban dañadas, y reemplazar los botones de ventilación después de un cierto número de usos repetidos.
En conclusión, utilizando el método IEF de fase líquida, hemos demostrado la separación de ácidos gimnómicos bioactivos y polipéptido de gurmarina del extracto de hoja de G. sylvestre. Además, el IEF de fase líquida puede ser útil para enriquecer proteínas selectivas a partir de los complejos extractos crudos de microbios patógenos.
Divulgaciones
A los autores les gustaría declarar que no hay intereses financieros competidores.
Agradecimientos
Estamos agradecidos por las fuentes de financiamiento de la División de Biología y Johnson Cancer Research Center para los premios BRIEF y IRA, respectivamente a GV. También agradecemos el premio postdoctoral K-INBRE a RV. Este trabajo fue apoyado en parte por el Premio de Desarrollo Institucional (IDeA) del Instituto Nacional de Ciencias Médicas Generales de los Institutos Nacionales de Salud bajo el número de subvención P20 GM103418. El contenido es responsabilidad exclusiva de los autores y no representa necesariamente las opiniones oficiales del Instituto Nacional de Ciencias Médicas Generales o de los Institutos Nacionales de Salud. Agradecemos a los revisores anónimos por sus comentarios útiles.
Materiales
| Name | Company | Catalog Number | Comments |
| 0.45 µm syringe filter | Fisher scientfic | 09-720-004 | |
| 2-Mercaptoethanol | Sigma | M3148 | |
| Ammonium carbonate | Sigma-Aldrich | 207861-500 | |
| Bio-Lyte 3/10 Ampholyte | Bio-Rad | 163-1113 | |
| Bio-Lyte 5/8 Ampholyte | Bio-Rad | 163-1192 | |
| Compact low temperature thermostat | Lauda -Brinkmann | RM 6T | Set water cooling to 4 oC and it can be run even at 0 oC as when it passes through the Rotofor cooling core, the circulating water temperature will be around 5 or more depending on the voltage. |
| Coomassie Brilliant Blue R | Sigma-Aldrich | B7920 | |
| Dialysis tubing (3,500 MWCO) | Spectrum Spectra/Por | 132112T | |
| Gymnema plant leaf extract powder (>25% Gymnemic acids) | Suan Farma, NJ USA | ||
| Incubator | Lab companion | SI 300R | |
| Microscope | Leica | DM 6B | |
| Mini protean electrophoresis | Bio-Rad | ||
| pH meter | Mettler Toledo | S20 | Useful to determine the pH of the Rotofor (liquid-phase IEF) fractions |
| Rotofor | Bio-Rad | 170-2972 | http://www.bio-rad.com/webroot/web/pdf/lsr/literature/M1702950E.pdf (Rotofor Instruction manual for assembling the unit) |
| RPMI-1640 Medium | HyClone | DH30255.01 | |
| Sealing tape | Bio-Rad | 170-2960 | Scotch tape may also be used. |
| Sorvall legend micro 17 centrifuge | Thermo scientific | 75002432 | |
| TPP tissue culture plate -96 well flat bottom | TPP | TP92696 |
Referencias
- Jankowska, U., et al. Optimized procedure of extraction, purification and proteomic analysis of nuclear proteins from mouse brain. Journal of Neuroscience Methods. 261, 1-9 (2016).
- Pergande, M. R., Cologna, S. M. Isoelectric Point Separations of Peptides and Proteins. Proteomes. 5 (1), (2017).
- Stoyanov, A. IEF-based multidimensional applications in proteomics: toward higher resolution. Electrophoresis. 33 (22), 3281-3290 (2012).
- Vesterberg, O. A. Y. Method of Isoelectric Fractionation. , US3485736A (1964).
- Vesterberg, O., Svensson, H. Isoelectric fractionation, analysis, and characterization of ampholytes in natural pH gradients. IV. Further studies on the resolving power in connection with separation of myoglobins. Acta Chemica Scandinavica. 20 (3), 820-834 (1966).
- Righetti, P. G. Isoelectric Focusing: Theory, Methodology and Applications. , Elsevier Science. 1(1983).
- Vesterberg, O. Synthesis and Isoelectric Fractionation of Carrier Ampholytes. Acta Chemica Scandinavica. 23, 2653-2666 (1969).
- Bier, M. Recycling isoelectric focusing and isotachophoresis. Electrophoresis. 19 (7), 1057-1063 (1998).
- Bier, M., Palusinski, O. A., Mosher, R. A., Saville, D. A. Electrophoresis: mathematical modeling and computer simulation. Science. 219 (4590), 1281-1287 (1983).
- Ayala, A., Parrado, J., Machado, A. Use of Rotofor preparative isoelectrofocusing cell in protein purification procedure. Applied Biochemistry and Biotechnology. 69 (1), 11-16 (1998).
- Wagner, L., et al. Isolation of dipeptidyl peptidase IV (DP 4) isoforms from porcine kidney by preparative isoelectric focusing to improve crystallization. Biological Chemistry. 392 (7), 665-677 (2011).
- Hosken, B. D., Li, C., Mullappally, B., Co, C., Zhang, B. Isolation and Characterization of Monoclonal Antibody Charge Variants by Free Flow Isoelectric Focusing. Analytical Chemistry. 88 (11), 5662-5669 (2016).
- Yu, J. J., et al. Francisella tularensis T-cell antigen identification using humanized HLA-DR4 transgenic mice. Clinical Vaccine Immunology. 17 (2), 215-222 (2010).
- Riyong, D., et al. Size and charge antigens of Dirofilaria immitis adult worm for IgG-ELISA diagnosis of bancroftian filariasis. Southeast Asian Journal of Tropical Medicine and Public Health. 41 (2), 285-297 (2010).
- Vediyappan, G., Bikandi, J., Braley, R., Chaffin, W. L. Cell surface proteins of Candida albicans: preparation of extracts and improved detection of proteins. Electrophoresis. 21 (5), 956-961 (2000).
- Vediyappan, G., Dumontet, V., Pelissier, F., d'Enfert, C. Gymnemic acids inhibit hyphal growth and virulence in Candida albicans. PLoS One. 8 (9), 74189(2013).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry. 72, 248-254 (1976).
- Laemmli, U. K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 227 (5259), 680-685 (1970).
- Riazi, S., Dover, S., Turovskiy, Y., Chikindas, M. L. Commercial ampholytes used for isoelectric focusing may interfere with bioactivity based purification of antimicrobial peptides. Journal of Microbiological Methods. 71 (1), 87-89 (2007).
- Kamei, K., Takano, R., Miyasaka, A., Imoto, T., Hara, S. Amino-Acid-Sequence of Sweet-Taste-Suppressing Peptide (Gurmarin) from the Leaves of Gymnema-Sylvestre. Journal of Biochemistry. 111 (1), 109-112 (1992).
- Craik, D. J. Chemistry. Seamless proteins tie up their loose ends. Science. 311 (5767), 1563-1564 (2006).
- Craik, D. J., Daly, N. L., Bond, T., Waine, C. Plant cyclotides: A unique family of cyclic and knotted proteins that defines the cyclic cystine knot structural motif. Journal of Molecular Biology. 294 (5), 1327-1336 (1999).
- Stoecklin, W. Chemistry and physiological properties of gymnemic acid, the antisaccharine principle of the leaves of Gymnema sylvestre. Journal of Agricultural and Food Chemistry. 17 (4), 704-708 (1969).
- Liu, H. M., Kiuchi, F., Tsuda, Y. Isolation and structure elucidation of gymnemic acids, antisweet principles of Gymnema sylvestre. Chemical & Pharmaceutical Bulletin (Tokyo). 40 (6), 1366-1375 (1992).
- Veerapandian, R., Vediyappan, G. Gymnemic Acids Inhibit Adhesive Nanofibrillar Mediated Streptococcus gordonii-Candida albicans Mono-Species and Dual-Species Biofilms. Frontiers in Microbiology. 10, 2328(2019).
- Chaffin, W. L. Candida albicans cell wall proteins. Microbiology and Molecular Biology Reviews. 72 (3), 495-544 (2008).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados