Method Article
Séparation des petites molécules bioactives, peptides des sources naturelles et des protéines des microbes par la méthode de mise au point isoélectrique préparative (IEF)
Dans cet article
Résumé
L’objectif est de fractionner et d’isoler les petites molécules bioactives, les peptides d’un extrait de plante complexe et les protéines de microbes pathogènes en utilisant la méthode de mise au point isoélectrique (IEF) en phase liquide. En outre, les molécules séparées ont été identifiées et leur bioactivité confirmée.
Résumé
Les produits naturels dérivés des plantes et des microbes sont une riche source de molécules bioactives. Avant leur utilisation, les molécules actives provenant d’extraits complexes doivent être purifiées pour des applications en aval. Il existe diverses méthodes chromatographiques disponibles à cette fin, mais tous les laboratoires ne peuvent pas se permettre des méthodes de haute performance et l’isolement des échantillons biologiques complexes peut être difficile. Nous démontrons ici que la mise au point isoélectrique en phase liquide préparative (IEF) peut séparer les molécules, y compris les petites molécules et les peptides à partir d’extraits de plantes complexes, en fonction de leurs points isoélectriques (pI). Nous avons utilisé la méthode pour la fractionnement et la caractérisation des échantillons biologiques complexes. Comme preuve de concept, nous avons fractionné un extrait de plante gymnema sylvestre, isolant une famille de petites molécules de saponine terpénoïde et un peptide. Nous avons également démontré une séparation efficace des protéines microbiennes en utilisant le champignon Candida albicans comme système modèle.
Introduction
La purification des biomolécules à partir d’échantillons biologiques complexes est une étape essentielle et souvent difficile dans les expériences biologiques1. La mise au point isoélectrique (IEF) convient bien à la séparation à haute résolution des biomolécules complexes où les ampholytes de transport voyagent selon leur charge et établissent le gradient de pH dans un champ électrique3. Le premier amphlyte de transporteur commercial pour IEF a été développé par Olof Vesterberg en 1964 et breveté4,5. Les amplyantes porteuses sont des molécules d’acide oligo-carboxylique oligo-amino aliphatique de longueur variable et de branchement6. Par la suite, Vesterberg et d’autres ont amélioré les ampholytes de support pour leur utilisation accrue dans la séparation des biomolécules6,7.
Les méthodes de séparation des biomolécules comprennent l’électrophorèse de gel d’agarose et de polyacrylamide, l’électrophorèse bidimensionnelle de gel (2-DE), la mise au point isoélectrique, l’électrophorèse capillaire, l’énoachhoresis et d’autres techniques chromatographiques (par exemple, TLC, FPLC, HPLC)2. La phase liquide IEF réalisée dans un instrument appelé « Rotofor » a été inventé par Milan Bier8. Il a été le pionnier du concept et de la conception de cet instrument et a largement contribué à la théorie de la migration électrophorétique. Son équipe a également développé un modèle mathématique de processus de séparation électrophorétique pour les simulations informatiques9.
L’appareil IEF de phase liquide est une cellule cylindrique à rotation horizontale composée d’un noyau de nylon divisé en 20 compartiments poreux et d’une tige en céramique de refroidissement de l’eau circulante. Les chambres poreuses permettent aux molécules de migrer à travers la phase aqueuse entre les électrodes et permettent la collecte d’échantillons purifiés sous vide en fractions. Ce système de purification peut fournir jusqu’à 1000 fois la purification d’une molécule spécifique en <4 heures. Une caractéristique précieuse de cet instrument est qu’il peut être appliqué comme une première étape pour la purification à partir d’un mélange complexe ou comme une dernière étape pour atteindre la pureté10. Si la molécule d’intérêt est une protéine, un autre avantage est que sa conformation native sera maintenue pendant la séparation.
L’utilisation de la phase liquide IEF a été largement rapportée pour les protéines, les enzymes et la purification des anticorps6,10,11,12,13,14. Ici, nous décrivons l’utilisation de cette approche pour séparer et purifier les petites molécules et peptides de la plante médicinale Gymnema sylvestre. Ce protocole aidera les chercheurs à concentrer et à purifier les petites molécules actives à partir d’un extrait de plante pour des applications en aval à faible coût. En outre, nous démontrons également que l’enrichissement des protéines à partir d’un extrait de protéine complexe de Candida albicans champignon15 dans ce système basé sur l’IEF comme un deuxième exemple.
Protocole
1. Installation et prérunning de l’unité IEF standard de phase liquide
- Assemblez les électrodes IEF en phase liquide (bouton anode-rouge et bouton cathode-noir) avec leurs membranes d’échange respectives selon le manuel d’instructions (voir Tableau des matériaux). Équilibrez les membranes d’échange d’anions avec 0,1 M De NaOH et les membranes d’échange de cations avec 0,1 M H3PO4 au moins pendant 16 h lorsque de nouvelles membranes sont utilisées.
- Rangez les membranes dans des électrolytes (0,1 M De NaOH ou 0,1 M H3PO4) entre les pistes et ne laissez pas sécher.
- Assemblez la partie intérieure et externe de l’électrode en alignant trois trous oblongues dans les joints d’échange d’ions. Remplissez les électrodes d’électrolytes respectifs (~25-30 mL) pour éviter que leurs membranes ne se dessèchent.
- N’ajoutez pas d’électrolyte excédentaire (plus d’un 1/3rd de volume de chambre électrode) qui peut augmenter la pression à l’intérieur de l’électrode et provoquer des fuites.
- Couvrez les ports de collecte d’échantillons avec du ruban adhésif qui est livré avec les pièces d’assemblage d’instruments(voir tableau des matériaux). Le côté des ports de collecte d’échantillons peut être identifié par les deux broches verticales d’alignement en métal. Vous pouvez également utiliser du ruban d’étanchéité standard pour sceller les ports.
- Assemblez toutes les parties de l’assemblage de la chambre de mise au point en séquence (électrode anode, noyau de membrane de nylon, chambre de mise au point et électrode cathodique) sur le doigt de refroidissement en céramique.
- Remplissez la chambre de mise au point d’eau distillée précoolée (volume total de 60 mL pour la cellule IEF standard) à l’aide d’une seringue de 50 mL.
- Connectez l’instrument IEF de phase liquide à une eau de refroidissement circulante à 4 ºC et prérunez l’appareil à 15 W et 3 000 V pendant 3 à 5 min ou jusqu’à ce que la tension se stabilise.
REMARQUE : En général, en moins d’une minute, la tension atteindra les valeurs maximales définies. Le prérunning avec de l’eau distillée aide à enlever les ions résiduels de la chambre de mise au point et du noyau de la membrane de nylon. - Éteignez la source d’alimentation et retirez l’eau de la cellule à l’aide du collecteur de fractions. Resceller les ports de collecte avec du ruban adhésif.
REMARQUE : Maintenant, l’instrument est prêt à être utilisé à l’étape 2.4.
2. Séparation et purification de petites molécules et peptides de l’extrait de gymnema sylvestre
- Mesurer 0,6 g d’extrait de plante et se dissoudre dans de l’eau distillée (60 ml) en mélangeant dans un tube à rouleaux pendant 5 min.
REMARQUE : Tout échantillon biologique soluble et exempt de sel peut être utilisé pour la séparation et la purification à l’aide de cet instrument IEF. Les échantillons dont la concentration de sel tamponnant jusqu’à 10 mM peuvent être utilisés avec une résolution légèrement diminuée. Nous sommes intéressés par la famille de saponine de composés triterpénoïdes, les acides gymnémiques, de la plante G. sylvestre pour leurs propriétés antifongiquesuniques 16. - Centrifuge l’extrait de plante solubilisé à 10 000 x g pendant 5 min pour éliminer les particules insolubles.
- Transférer le supernatant (~60 mL) à un tube de centrifugeuse de 80 mL, et mélanger avec 0,6 mL d’ampholyte (pH 3-10) à 1% (v/v).
- Suivez les étapes 1.1 – 1.7 pour préparer l’unité IEF de phase liquide. La chambre est maintenant prête à charger l’échantillon.
- Utilisez une seringue de 50 mL avec une aiguille d’extrémité émoussée de 1-1/2 pouce 19 G (est livré avec l’instrument) et chargez l’échantillon préparé avec de l’ampholyte (60 mL au total) dans la cellule par l’intermédiaire des ports de collecte d’échantillons.
- Retirez les bulles d’air de la cellule d’échantillon en enlevant la cellule de mise au point du support et en tapant sur la chambre de l’électrode pour déloger les bulles. La présence de bulles d’air provoquera des fluctuations de tension et de courant et affectera la course.
- Connectez l’appareil au liquide de refroidissement de l’eau (4 °C) et commencez la fractionnement avec l’alimentation à une constante de 15 W.
- Exécutez l’appareil pendant 3 h ou jusqu’à ce que la tension atteigne une valeur constante.
REMARQUE : Lorsque l’échantillon commence à se concentrer, la tension commencera à grimper progressivement jusqu’à ce qu’elle atteigne une valeur constante. - Après la course, préparez-vous à recueillir les fractions de la boîte de récolte (contenant 20 tubes en plastique, 12 mm x 75 mm, 5-6 mL) reliées à la pompe à vide en appuyant sur le bouton de récolte ON dans l’unité IEF.
- Alignez les broches de 20 collections avec les ports de 20 collections de la cellule de mise au point qui est scellée avec le ruban adhésif.
- Poussez les broches de collecte à travers le ruban d’étanchéité et tournez la pompe à vide en même temps (voir la figure 2B, 2C et 2D).
REMARQUE : Environ 3 fractions mL de chaque chambre seront recueillies dans les tubes à chaque fois. Les fractions peuvent être utilisées pour des applications ultérieures en aval (SDS-PAGE pour la quantification des peptides, le TLC et le biotest pour les petites molécules).
3. Séparation et purification des protéines de C. albicans
- Cultiver une seule colonie de C. albicans dans le bouillon de levure-peptone-dextrose (YPD)16 à 30 °C avec secousse (200 tr/min) pour la nuit.
- Recueillir les cellules de levure par centrifugation (10 000 x g pendant 5 min).
- Suspendre les cellules de levure C. albicans dans le tampon de carbonate d’ammonium (1,89 g/L) contenant 1% (v/v) bêta-mercaptoéthanol (β-ME) (1/10ème du volume de culture) et tourner dans un tube à rouleaux pendant 1 h à 5 °C15.
- Retirer les cellules de levure par centrifugation (10 000 x g pendant 5 min) et filtrer l’extrait de protéine à travers un filtre de 0,45 μm.
REMARQUE : Des échantillons de protéines provenant du cytosol, de la membrane ou de la paroi cellulaire de C. albicans peuvent être préparés et utilisés pour la fractionnement de l’IEF. De même, les protéines provenant de bactéries ou d’autres échantillons biologiques (extrait de tissu animal) peuvent être utilisées après avoir enlevé tout sel par des méthodes appropriées(p. ex.,par dialyse ou en utilisant des colonnes de dessalte). - Dialyze l’extrait de protéine dans un tube de dialyse (3 500 MWCO) contre l’eau pendant 15 h à 4 °C. Estimer la concentration de protéines par la méthode de liaison de colorants Bradford en utilisant la globuline gamma comme norme17.
- Utiliser 500 mg de protéines totales dans 60 mL d’eau contenant 1% (v/v) ampholyte (pH 5-8) pour la fractionnement.
REMARQUE : Comme un ampholyte à large gamme (pH 3-10) n’enrichit pas certaines protéines de la paroi cellulaire non glucanes attachées de C. albicans bien, utilisez une gamme étroite (pH 5-8) amphyte. Une concentration d’ampholyte pouvant atteindre 2 % peut être utilisée si la concentration de protéines de l’échantillon est supérieure à 2 mg/mL; cela minimise l’agrégation des protéines pendant la mise au point. Gardez toujours les échantillons, les ampholytes et l’eau précoolées sur la glace. - Répétez les étapes 1.1- 1.7 pour préparer l’unité IEF et utilisez la solution protéique de l’étape 3.6 pour charger dans la cellule IEF.
- Après 4 h de concentration à une constante de 15 W, récolter les fractions de protéines (1-20) comme décrit ci-dessus (étapes 2.9-2.11) et analyser sur 12,5% SDS-PAGE après la réduction et l’ébullition des échantillons de protéines18.
- Tacher les protéines résolues en tachant le gel SDS-PAGE avec le colorant bleu Coomassie (0,01%) solution pour 2-3 h à température ambiante sur un rocker. Destain le gel et enregistrer l’image de gel à l’aide d’un imageur de gel.
NOTE: Colorant bleu Coomassie (0.01%) peut être préparé en mélangeant 0,01 g de poudre bleue Coomassie dans une solution de désantrage contenant 40% de méthanol et 10% d’acide acétique.
4. Bioactivité des petites molécules purifiées à partir de l’extrait de plante Gymnema sylvestre
- Cultiver des C. albicans dans les cellules de levure comme à l’étape 3.1.
- Pour préparer la suspension cellulaire, diluer la culture du jour au lendemain des cellules de levure de C. albicans (1/1000 dilution) dans un milieu frais de culture cellulaire RPMI complété par 50 mM de glucose.
NOTE : C. albicans se convertit de la croissance de levure en hyphe dans des conditions d’induction d’hyphane (RPMI à 37 °C). Il est démontré que les petites molécules d’acide gymnémique inhibent la conversion des cellules de levure en hyphes dans des conditions d’induction d’hyphas16. Nous avons cherché à déterminer si l’extrait de G. sylvestre séparé en phase liquide-IEF contient ces molécules bioactives. - À partir de la suspension de cellules préparée, ajouter 90 μL à chaque puits de la plaque de 96 puits.
- De chaque fraction (1 à 20 fractions récoltées d’extrait de G. sylvestre obtenue à partir de la phase liquide IEF, figure 4),ajouter 10 μL dans les puits avec 90 μL de la suspension cellulaire ci-dessus (étape 4.2). Effectuez l’analyse en triple.
- Ajouter 10 μL d’eau contenant de l’ampholyte (1%) dans des puits séparés avec 90 μL de suspension de cellules de levure C. albicans comme un contrôle négatif.
REMARQUE : Les ampholytes ont un potentiel de bioactivité et il est donc essentiel d’inclure un contrôle ampholyte tout en effectuant n’importe quel bioassay19. - Incuber la plaque de 96 puits à 37 °C pendant 12 h et observer l’inhibition de la conversion de levure-hypha de C. albicans sous le microscope16. En outre, déterminer le pourcentage d’inhibition de la conversion de levure à hypha.
Résultats
Séparation et purification de petites molécules et peptides de l’extrait de plante de Gymnema sylvestre
En utilisant la méthode préparateur de phase liquide IEF, nous avons fractionné des extraits de plantes médicinales et des protéines de surface cellulaire d’un champignon pathogène humain, C. albicans. Un schéma de ces protocoles de fractionnement est illustré à la figure 1.
À partir de 20 fractions d’extrait de G. sylvestre obtenues à partir de l’IEF de phase liquide, les molécules de couleur foncée (saponines terpénoïdes) ont été trouvées pour migrer et être enrichies à l’extrémité anode (pH 2-3) et les fractions claires jaune clair ont été observées à l’extrémité cathodique (pH 8-9) (Figure 2). Les aliquots (20 μL) de chaque fraction (1-20) ont été résolus sur 15 % de SDS-PAGE après avoir réduit et fait bouillir les échantillons. Un gel coomassie teinté bleu montre la bande de polypeptide diffuse d’environ 5 kDa qui est enrichie en fractions 16-19 (Figure 3). Il a été rapporté que la plante G. sylvestre contient un polypeptide de base de gurmarin de 35 acides aminés avec le poids moléculaire prévu de 4 209 Da20. Les bactéries, les plantes et les animaux contiennent des peptides; beaucoup d’entre eux sont circulaires (nouggins) et stables avec un large éventail d’activités biologiques telles que les propriétés insecticides et antimicrobiennes21,22.
Activité biologique des acides gymnémiques séparés
L’usine G. sylvestre contient également des acides gymnémiques (saponines terpénoïdes) comme constituants majeurs16,23,24. Comme prévu, ces petites molécules en fraction 1 et les quelques fractions suivantes n’ont pas été détectées par la coloration SDS-PAGE et Coomassie (Figure 3) puisqu’elles ne sont pas protéiques. Cependant, ces petites molécules peuvent être séparées par TLC et détectées sous la lumière UV (Figure 4A, voie F1). La fraction 10 ne contenait pas une quantité détectable de ces petites molécules sur TLC suggérant que la plupart des petites molécules organiques ont été enrichies en fractions 1-3. Il a été démontré que les molécules d’acides gymnémiques (GA) inhibent la transition de levure-hypha de C. albicans 16,25. Nous avons analysé les 20 fractions recueillies dans cette étude pour leur activité inhibitrice contre la conversion de levure-hypha de C. albicans et la croissance d’hyphe16. Les résultats sont indiqués à la figure 4B,4C. L’activité la plus élevée est observée dans la fraction 1, qui est d’accord avec les résultats TLC où plusieurs taches peuvent être vues. Isomers d’acides gymnémiques existent et tous ont des activités biologiques similaires10. Ces isomères ont été séparés en fraction 1-3 et montrent l’inhibition de la croissance hyphale de C. albicans (figure 4A,4C, fraction 1). Le degré d’inhibition hyphale a été progressivement diminué comme il va de 1 à 10. Peu ou pas d’activité a été obtenue en fractions 10 et plus.
Séparation des protéines de surface cellulaire du champignon pathogène, C. albicans
Les résultats de la fractionnement de la surface des cellules C. albicans en phase liquide sont indiqués à la figure 5. Ces protéines de surface cellulaire jouent un rôle important dans l’adhérence et la pathogénie de C. albicans 26. Plusieurs protéines enrichies (flèches) en différentes fractions ont été observées. Cela peut permettre l’identification de leurs réactions immunologiques avec le sérum humain infecté par Candida et/ou leur identification par spectrométrie de masse. De même, les protéines d’autres fractions cellulaires (p. ex., cytoplasme et paroi cellulaire) peuvent être fractionnées à l’aide de cette méthode IEF. La purification à base d’IEF en phase liquide permettra d’identifier les protéines de faible abondance à partir d’échantillons biologiques complexes, lorsqu’elles sont associées à une analyse de spectrométrie de masse.
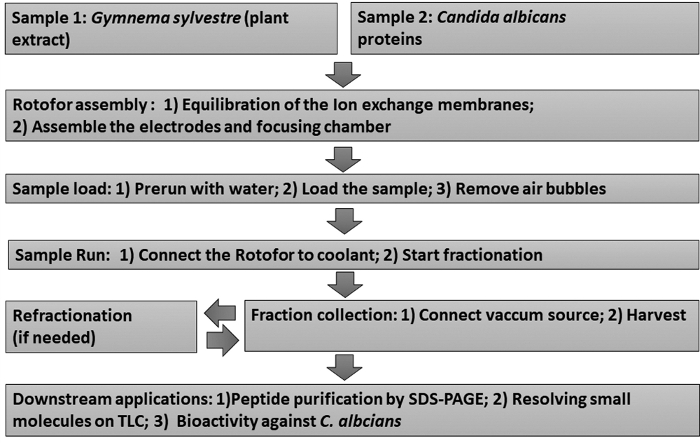
Figure 1 : Graphique de flux montrant le flux de travail expérimental. Des procédures de fractionnement de la phase liquide étape de l’IEF et des essais en aval subséquents sont représentés. Les échantillons incluent l’extrait de feuille de Gymnema sylvestre (échantillon 1) et les protéines de levure attachées à Candida albicans (échantillon 2). Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 2 : Installation et fractionnement de l’extrait de l’appareil IEF en phase liquide. (A) Pendant la course, (B) pendant la collecte de fraction, (C) après la collecte de fraction, et (D) parties d’appareil IEF de phase liquide, 1) membranes d’échange d’ions, 2) chambre de mise au point et noyau membranage, 3) assemblage d’électrodes (négatif), 4) assemblage d’électrodes (positif). Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 3 : Séparations SDS-PAGE des fractions d’extrait de plantes axées sur l’IEF. L- échelle, PC- Contrôle positif (peptide), 0 - échantillon d’entrée, 1-20 fractions séparées. SDS-PAGE (gel résolu de 15%) a été taché par le colorant bleu Coomassie pour visualiser les peptides résolus (~5 kDa) à partir de fractions 1-20. Les fractions 1-3 contiennent de petites molécules (la fraction 1 a une couleur plus foncée indiquant des composés enrichis) qui ne peuvent pas être tachées/détectées par le colorant bleu de Coomassie. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
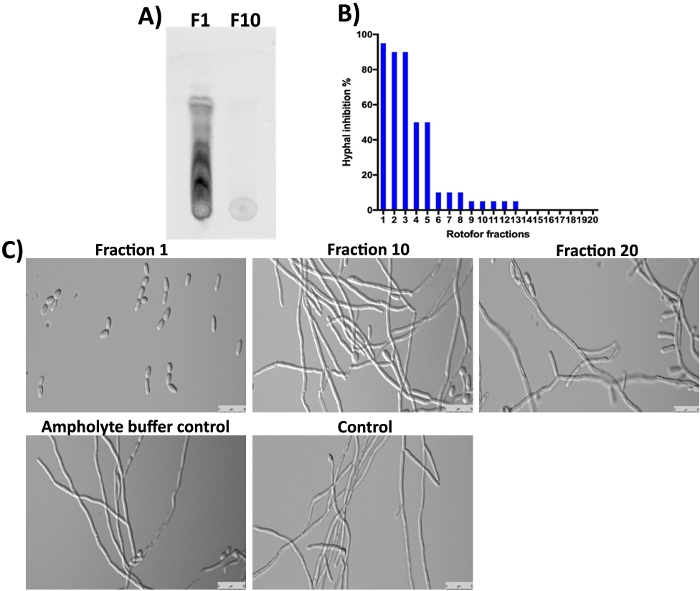
Figure 4 : Analyse des petites molécules fractionnées de l’IEF par TLC et détermination de la bioactivité par rapport à C. albicans. (A) Montre l’analyse TLC des petites molécules à partir de #1 fraction et #10. La plaque de gel de silice activée a été utilisée pour repérer ~5 μL d’échantillons et a couru avec du toluène : chloroforme : solvant de méthanol (rapport de 5:8:3) jusqu’à ce que le front de solvant atteigne la marge. Des composés séparés de TLC ont été détectés sous une lumière UV d’épifluorescence (310 nm). (B) Montre l’inhibition % de la conversion de levure-hypha de C. albicans par différentes fractions. (C) Démontre la morphologie cellulaire de C. albicans dans des conditions d’induction d’hypha. Fraction #1 montre maximum (98%) l’inhibition de la conversion de la levure à l’hyphe. D’autres fractions et contrôles ne montrent aucune inhibition de la croissance hyphale de C. albicans après 12 heures d’incubation à 37 °C. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 5 : Analyse SDS-PAGE des protéines de surface des cellules C. albicans (non-glucanes attachés). Échelle L, 0 - échantillon d’entrée, 1-18 fractions recueillies après IEF dans une cellule IEF standard de phase liquide à l’aide d’une gamme étroite (pH 5-8) ampholyte. L’image montre SDS-PAGE (12.5%) protéines résolues après coloration avec coomassie colorant bleu. Plusieurs protéines ont été enrichies en certaines fractions (flèches). Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
Discussion
Les petites molécules provenant de sources naturelles de produits (p. ex., les plantes) comprennent des métabolites secondaires complexes qui sont très divers dans la structure chimique. On pense qu’ils sont impliqués dans les mécanismes de défense des plantes. En outre, les polypeptides sont également présents dans les tissus végétaux22. Ces petites molécules naturelles sont de riches sources de molécules d’essai pour la découverte et le développement de médicaments. Cependant, les méthodes difficiles et fastidieuses requises pour leur isolement et purification limitent leur utilisation pour des applications thérapeutiques. L’approche IEF en phase liquide utilisée dans ce rapport met en évidence la capacité de séparer ces petites molécules et polypeptides sans compromettre leurs bioactivités.
Cette méthode basée sur l’IEF offre plusieurs avantages dans la séparation des molécules biologiques, y compris la concentration de protéines purifiées à partir d’un mélange complexe, le maintien de la conformation indigène pendant et après leur mise au point, et la collecte d’échantillons en tant que fractions purifiées individuelles sans contamination croisée. Si nécessaire, les échantillons peuvent être re-concentrés avec une gamme étroite de pH pour purifier les isoformes protéiques. Étant donné qu’une cellule de mise au point miniature de l’IEF (~15 mL) est disponible, elle peut également être utilisée pour de plus petits volumes d’échantillons. La nouvelle conclusion de ce rapport est que les petites molécules organiques et les peptides peuvent être séparés d’un extrait de plante complexe. Bien qu’il soit difficile de convenir que les petites molécules peuvent être séparées des extraits de produits naturels par l’IEF, il est plausible pour les composés qui sont amphotériques. Les acides gymnémiques qui ont été séparés du peptide de gurmarin dans l’extrait de G. sylvestre semblent être amphotériques car ils contiennent un groupe d’acide carboxylique ou ils se comportent ainsi au moins en présence de l’ampholyte utilisé. Puisque les glycosides sont des molécules naturelles bioactives semblables aux acides gymnémiques, la méthode IEF peut être utilisée pour les séparer de sources naturelles complexes. De même, les peptides provenant de produits naturels peuvent également être isolés en utilisant cette approche IEF en phase liquide.
Certaines des limites de cette approche sont que toutes les petites molécules ne peuvent pas être fractionnées par la méthode IEF car elles doivent être solubles dans l’eau et faiblement amphériques, au moins. L’extrait utilisé ici a été préparé par une extraction de 50% de méthanol de matières végétales séchées, mais est soluble dans l’eau. L’utilisation de la méthode IEF pour les composés solubles dans le solvant et l’amphotérique reste à voir car certains des solvants organiques sont incompatibles avec les composants de l’instrument IEF en phase liquide. La tendance des protéines à se précipiter à leurs points isoélectriques (pI) dans les solutions à faible résistance ionique est bien connue. Toutefois, dans un système IEF rotatif, les précipitations protéiques sont réduites à mesure que les protéines concentrées restent en circulation à leur point d’i P.
Si l’on utilise une forte concentration de protéines dans cette séparation IEF, des précipitations peuvent se produire. Pour minimiser les précipitations protéiques et améliorer la concentration des protéines, l’urée peut être utilisée jusqu’à 3-5 M. Les détergents nonioniques tels que le CHAPS, la digitonine et une faible concentration de détergent (0,1-1 %) peut également être utilisé pour réduire l’agrégation de protéines pendant l’IEF. Cependant, l’urée et les détergents doivent être enlevés avant d’analyser les protéines pour leur activité et dans certains cas, ces agents peuvent affecter les fonctions protéiques. Quelques étapes critiques à prendre en considération lors d’une exécution de la phase liquide IEF comprennent le chargement de la cellule de mise au point IEF sans bulles d’air, le remplacement des membranes d’échange d’ions si elles ont été endommagées, et le remplacement des boutons d’aération après un certain nombre d’utilisations répétées.
En conclusion, en utilisant la méthode de la phase liquide IEF, nous avons montré la séparation des acides gymnémiques bioactifs et du polypeptide de gurmarin de l’extrait de feuille de G. sylvestre. En outre, la phase liquide IEF peut être utile pour enrichir les protéines sélectives des extraits bruts complexes de microbes pathogènes.
Déclarations de divulgation
Les auteurs voudraient ne déclarer aucun intérêt financier concurrent.
Remerciements
Nous sommes reconnaissants pour les sources de financement de la Division de biologie et Johnson Cancer Research Center pour BRIEF et IRA prix, respectivement à GV. Nous remercions également le prix postdoctoral K-INBRE à RV. Ce travail a été soutenu en partie par le Prix de développement institutionnel (IDeA) de l’Institut national des sciences médicales générales des National Institutes of Health sous le numéro de subvention P20 GM103418. Le contenu est uniquement de la responsabilité des auteurs et ne représente pas nécessairement les vues officielles de l’Institut national des sciences médicales générales ou des Instituts nationaux de la santé. Nous remercions les examinateurs anonymes pour leurs commentaires utiles.
matériels
| Name | Company | Catalog Number | Comments |
| 0.45 µm syringe filter | Fisher scientfic | 09-720-004 | |
| 2-Mercaptoethanol | Sigma | M3148 | |
| Ammonium carbonate | Sigma-Aldrich | 207861-500 | |
| Bio-Lyte 3/10 Ampholyte | Bio-Rad | 163-1113 | |
| Bio-Lyte 5/8 Ampholyte | Bio-Rad | 163-1192 | |
| Compact low temperature thermostat | Lauda -Brinkmann | RM 6T | Set water cooling to 4 oC and it can be run even at 0 oC as when it passes through the Rotofor cooling core, the circulating water temperature will be around 5 or more depending on the voltage. |
| Coomassie Brilliant Blue R | Sigma-Aldrich | B7920 | |
| Dialysis tubing (3,500 MWCO) | Spectrum Spectra/Por | 132112T | |
| Gymnema plant leaf extract powder (>25% Gymnemic acids) | Suan Farma, NJ USA | ||
| Incubator | Lab companion | SI 300R | |
| Microscope | Leica | DM 6B | |
| Mini protean electrophoresis | Bio-Rad | ||
| pH meter | Mettler Toledo | S20 | Useful to determine the pH of the Rotofor (liquid-phase IEF) fractions |
| Rotofor | Bio-Rad | 170-2972 | http://www.bio-rad.com/webroot/web/pdf/lsr/literature/M1702950E.pdf (Rotofor Instruction manual for assembling the unit) |
| RPMI-1640 Medium | HyClone | DH30255.01 | |
| Sealing tape | Bio-Rad | 170-2960 | Scotch tape may also be used. |
| Sorvall legend micro 17 centrifuge | Thermo scientific | 75002432 | |
| TPP tissue culture plate -96 well flat bottom | TPP | TP92696 |
Références
- Jankowska, U., et al. Optimized procedure of extraction, purification and proteomic analysis of nuclear proteins from mouse brain. Journal of Neuroscience Methods. 261, 1-9 (2016).
- Pergande, M. R., Cologna, S. M. Isoelectric Point Separations of Peptides and Proteins. Proteomes. 5 (1), (2017).
- Stoyanov, A. IEF-based multidimensional applications in proteomics: toward higher resolution. Electrophoresis. 33 (22), 3281-3290 (2012).
- Vesterberg, O. A. Y. . Method of Isoelectric Fractionation. , (1964).
- Vesterberg, O., Svensson, H. Isoelectric fractionation, analysis, and characterization of ampholytes in natural pH gradients. IV. Further studies on the resolving power in connection with separation of myoglobins. Acta Chemica Scandinavica. 20 (3), 820-834 (1966).
- Righetti, P. G. . Isoelectric Focusing: Theory, Methodology and Applications. , 1 (1983).
- Vesterberg, O. Synthesis and Isoelectric Fractionation of Carrier Ampholytes. Acta Chemica Scandinavica. 23, 2653-2666 (1969).
- Bier, M. Recycling isoelectric focusing and isotachophoresis. Electrophoresis. 19 (7), 1057-1063 (1998).
- Bier, M., Palusinski, O. A., Mosher, R. A., Saville, D. A. Electrophoresis: mathematical modeling and computer simulation. Science. 219 (4590), 1281-1287 (1983).
- Ayala, A., Parrado, J., Machado, A. Use of Rotofor preparative isoelectrofocusing cell in protein purification procedure. Applied Biochemistry and Biotechnology. 69 (1), 11-16 (1998).
- Wagner, L., et al. Isolation of dipeptidyl peptidase IV (DP 4) isoforms from porcine kidney by preparative isoelectric focusing to improve crystallization. Biological Chemistry. 392 (7), 665-677 (2011).
- Hosken, B. D., Li, C., Mullappally, B., Co, C., Zhang, B. Isolation and Characterization of Monoclonal Antibody Charge Variants by Free Flow Isoelectric Focusing. Analytical Chemistry. 88 (11), 5662-5669 (2016).
- Yu, J. J., et al. Francisella tularensis T-cell antigen identification using humanized HLA-DR4 transgenic mice. Clinical Vaccine Immunology. 17 (2), 215-222 (2010).
- Riyong, D., et al. Size and charge antigens of Dirofilaria immitis adult worm for IgG-ELISA diagnosis of bancroftian filariasis. Southeast Asian Journal of Tropical Medicine and Public Health. 41 (2), 285-297 (2010).
- Vediyappan, G., Bikandi, J., Braley, R., Chaffin, W. L. Cell surface proteins of Candida albicans: preparation of extracts and improved detection of proteins. Electrophoresis. 21 (5), 956-961 (2000).
- Vediyappan, G., Dumontet, V., Pelissier, F., d'Enfert, C. Gymnemic acids inhibit hyphal growth and virulence in Candida albicans. PLoS One. 8 (9), 74189 (2013).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry. 72, 248-254 (1976).
- Laemmli, U. K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 227 (5259), 680-685 (1970).
- Riazi, S., Dover, S., Turovskiy, Y., Chikindas, M. L. Commercial ampholytes used for isoelectric focusing may interfere with bioactivity based purification of antimicrobial peptides. Journal of Microbiological Methods. 71 (1), 87-89 (2007).
- Kamei, K., Takano, R., Miyasaka, A., Imoto, T., Hara, S. Amino-Acid-Sequence of Sweet-Taste-Suppressing Peptide (Gurmarin) from the Leaves of Gymnema-Sylvestre. Journal of Biochemistry. 111 (1), 109-112 (1992).
- Craik, D. J. Chemistry. Seamless proteins tie up their loose ends. Science. 311 (5767), 1563-1564 (2006).
- Craik, D. J., Daly, N. L., Bond, T., Waine, C. Plant cyclotides: A unique family of cyclic and knotted proteins that defines the cyclic cystine knot structural motif. Journal of Molecular Biology. 294 (5), 1327-1336 (1999).
- Stoecklin, W. Chemistry and physiological properties of gymnemic acid, the antisaccharine principle of the leaves of Gymnema sylvestre. Journal of Agricultural and Food Chemistry. 17 (4), 704-708 (1969).
- Liu, H. M., Kiuchi, F., Tsuda, Y. Isolation and structure elucidation of gymnemic acids, antisweet principles of Gymnema sylvestre. Chemical & Pharmaceutical Bulletin (Tokyo). 40 (6), 1366-1375 (1992).
- Veerapandian, R., Vediyappan, G. Gymnemic Acids Inhibit Adhesive Nanofibrillar Mediated Streptococcus gordonii-Candida albicans Mono-Species and Dual-Species Biofilms. Frontiers in Microbiology. 10, 2328 (2019).
- Chaffin, W. L. Candida albicans cell wall proteins. Microbiology and Molecular Biology Reviews. 72 (3), 495-544 (2008).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon