Method Article
فصل الجزيئات الصغيرة النشطة بيولوجياً، الببتيدات من المصادر الطبيعية والبروتينات من الميكروبات بواسطة طريقة التركيز الأيزوئي الإعدادي (IEF)
In This Article
Summary
والهدف هو تجزئة وعزل الجزيئات الصغيرة النشطة بيولوجيا، والببتيدات من مستخلصات نباتية معقدة، والبروتينات من الميكروبات المسببة للأمراض عن طريق استخدام طريقة التركيز الأيزوفلوري (IEF) على مراحل السائل. وعلاوة على ذلك، تم تحديد الجزيئات المنفصلة وأكد نشاطها الحيوي.
Abstract
المنتجات الطبيعية المشتقة من النباتات والميكروبات هي مصدر غني للجزيئات النشطة بيولوجيا. قبل استخدامها، يجب تنقية الجزيئات النشطة من مستخلصات معقدة لتطبيقات المصب. هناك طرق كروماتوغرافية مختلفة متاحة لهذا الغرض حتى الآن لا يمكن لجميع المختبرات تحمل أساليب عالية الأداء والعزلة عن العينات البيولوجية المعقدة يمكن أن يكون من الصعب. هنا نثبت أن التركيز الايزويتريك للمرحلة السائلة (IEF) يمكن أن يفصل الجزيئات، بما في ذلك الجزيئات الصغيرة والببتيدات من مستخلصات نباتية معقدة، بناء على نقاطها الأيزوفلوريتية (pI). وقد استخدمنا هذه الطريقة في تجزئة العينات البيولوجية المعقدة وتوصيفها. كدليل على المفهوم، ونحن مجزأة استخراج مصنع Sylvestre Gymnema، وعزل عائلة من الجزيئات الصغيرة السابونين تيربينويد والببتيد. كما أظهرنا فصل البروتين الميكروبي الفعال باستخدام فطر المبيضات ألبيكان كنظام نموذجي.
Introduction
تنقية الجزيئات الحيوية من العينات البيولوجية المعقدة هي خطوة أساسية وصعبة في كثير من الأحيان في التجارب البيولوجية1. تركيز الأزوية (IEF) هو مناسب تماما لفصل عالية الدقة من الجزيئات الحيوية المعقدة حيث يسافر أمبيروليت الناقل وفقا لشحنتها وإنشاء التدرج درجة الH في مجال كهربائي3. تم تطوير أول ناقلة تجارية أمفوليت لـ IEF من قبل أولوف فيستربيرغ في عام 1964 وبراءة اختراع4،5. ampholytes الناقل هي أليفاتية ألتيجو أمينوية oligo-carboxylic حمض جزيئات متفاوتة الطول والمتفرعة6. في وقت لاحق، فيستربرغ وغيرها تحسين أمبيروليت الناقل لاستخدامها الموسع في فصل الجزيئات الحيوية6،7.
وتشمل أساليب فصل الجزيئات الحيوية agarose و polyacrylamide هلام الكهربائي، ثنائي الأبعاد هلام electrophoresis (2-DE)، تركيز isoelectric، الشعيرات الكهربائية، isotachophoresis وغيرها من تقنيات الكروماتوغرافي (على سبيل المثال، TLC، FPLC، HPLC)2. تم اختراع المرحلة السائلة IEF التي أجريت في أداة تسمى "Rotofor" من قبل ميلان بير8. وكان رائدا في مفهوم وتصميم هذه الأداة وساهم على نطاق واسع في نظرية الهجرة الكهربائية. كما طور فريقه نموذج رياضي لعملية الفصل الكهربائي للمحاكاة الحاسوبية9.
جهاز IEF في المرحلة السائلة هو خلية أسطوانية دوارة أفقيًا تتكون من نواة نايلون مقسمة إلى 20 مقصورة مسامية وقضيب سيراميك تبريد مياه متداول. تسمح الغرف المسامية للجزيئات بالهجرة عبر المرحلة مائي بين الأقطاب الكهربائية وتسمح بجمع العينات النقية تحت فراغ في الكسور. يمكن أن يوفر نظام التنقية هذا ما يصل إلى 1000 ضعف تنقية جزيء معين في < 4 ساعات. ومن السمات القيمة لهذا الصك هو أنه يمكن تطبيقه كخطوة أولى لتنقية من خليط معقد أو كخطوة نهائية لتحقيقنقاء 10. إذا كان جزيء الفائدة هو بروتين ، فإن ميزة أخرى هي أنه سيتم الحفاظ على تركيبها الأصلي أثناء الفصل.
وقد تم الإبلاغ عن استخدام السائل المرحلة IEF على نطاق واسع للبروتينات والإنزيمات وتنقية الأجسام المضادة6,10,11,12,13,14. هنا وصفنا استخدام هذا النهج لفصل وتنقية الجزيئات الصغيرة والببتيدات من النبات الطبي Gymnema sylvestre. سيساعد هذا البروتوكول الباحثين على تركيز وتنقية الجزيئات الصغيرة النشطة من مستخلص نباتي لتطبيقات المصب بتكلفة منخفضة. بالإضافة إلى ذلك، نبرهن أيضًا على أن إثراء البروتينات من مستخلص بروتين معقد من فطر المبيضات ألبيكان 15 في هذا النظام القائم على IEF كمثال ثان.
Protocol
1. الإعداد والطور المسبق لوحدة IEF القياسية السائلة المرحلة
- تجميع الأقطاب الكهربائية IEF السائل المرحلة (زر الأنود الأحمر وزر الكاثود الأسود) مع أغشية التبادل الخاصة بها وفقا لدليل التعليمات (انظر جدول المواد). اكويت أغشية تبادل أنيون مع 0.1 M NaOH وأغشية تبادل الموجبة مع 0.1 M H3PO4 على الأقل لمدة 16 ساعة عند استخدام أغشية جديدة.
- تخزين الأغشية في الشوارد (0.1 M NaOH أو 0.1 M H3PO4) بين أشواط ولا تسمح لتجف.
- تجميع الجزء الداخلي والخارجي من القطب الكهربائي عن طريق محاذاة ثلاثة ثقوب مستطيلة في الحشيات تبادل الأيونات. تعبئة الأقطاب الكهربائية مع الشوارد على التوالي (~ 25-30 مل) لمنع أغشيتها من الجفاف.
- لا تضيف فائض (أكثر من 1/3rd من حجم غرفة القطب) المنحل بالكهرباء التي قد تزيد الضغط داخل القطب الكهربائي وتسبب التسرب.
- تغطية المنافذ مجموعة عينة مع ختم الشريط الذي يأتي مع أجزاء تجميع الصك (انظر جدول المواد). يمكن تحديد جانب منافذ تجميع العينات بواسطة دبابيس محاذاة المعادن العمودية. بدلاً من ذلك، استخدم شريط الختم القياسي لختم المنافذ.
- تجميع جميع أجزاء من الجمعية غرفة التركيز في تسلسل (القطب القطب، النايلون غشاء الأساسية، والتركيز غرفة وكاثود القطب) على إصبع التبريد السيراميك.
- املأ غرفة التركيز بالماء المقطر المُبرَّر (الحجم الإجمالي 60 مل لخلية IEF القياسية) باستخدام حقنة 50 مل.
- قم بتوصيل جهاز IEF السائل المرحلة إلى مياه التبريد المتداولة في 4 درجة مئوية وprerun الوحدة في 15 واط و 3000 V لمدة 3-5 دقيقة أو حتى يستقر الجهد.
ملاحظة: عموما، في غضون دقيقة واحدة، وسوف يصل الجهد إلى أقصى القيم المحددة. يساعد الركض المسبق مع الماء المقطر على إزالة الأيونات المتبقية من غرفة التركيز ولب غشاء النايلون. - قم بإيقاف تشغيل مصدر الطاقة وإزالة الماء من الخلية باستخدام جامع الكسور. إعادة ختم منافذ جمع مع ختم الشريط.
ملاحظة: الآن الصك جاهز للاستخدام في الخطوة 2.4.
2. فصل وتنقية الجزيئات الصغيرة والببتيدات من استخراج sylvestre Gymnema
- قياس 0.6 غرام من استخراج النبات وتذوب في الماء المقطر (60 مل) عن طريق خلط في أنبوب الأسطوانة لمدة 5 دقائق.
ملاحظة: يمكن استخدام أي عينة بيولوجية قابلة للذوبان وخالية من الملح للفصل والتنقية باستخدام أداة IEF هذه. ويمكن استخدام عينات مع تركيز الملح التخزين المؤقت تصل إلى 10 mM مع انخفاض طفيف في القرار. نحن مهتمون في عائلة سابونين من مركبات ثلاثية التربيربنويد، والأحماض الرياضية، من مصنع G. Sylvestre لخصائصها المضادة للفطريات فريدة من نوعها16. - الطرد المركزي مستخلص مصنع solubilized في 10،000 س ز لمدة 5 دقائق لإزالة الجسيمات غير قابلة للذوبان.
- نقل فائقة (~ 60 مل) إلى أنبوب 80 مل الطرد المركزي، ومزجها مع 0.6 مل من أمفوليت (pH 3-10) إلى 1٪ (v/v).
- اتبع الخطوات 1.1 - 1.7 لإعداد وحدة IEF في المرحلة السائلة. الغرفة الآن جاهزة لتحميل العينة.
- استخدام حقنة 50 مل مع 1-1/2 بوصة 19 غ إبرة نهاية حادة (يأتي مع الصك) وتحميل العينة المعدة مع أمفوليت (60 مل مجموع) في الخلية من خلال منافذ جمع العينة.
- إزالة فقاعات الهواء من خلية العينة عن طريق إزالة خلية التركيز من موقف والتنصت على غرفة القطب لإزاحة الفقاعات. وجود فقاعات الهواء سوف يسبب الجهد والتقلبات الحالية وتؤثر على المدى.
- قم بتوصيل الوحدة بمبرد الماء (4 درجات مئوية) وابدأ تجزئة التيار الكهربائي مع التيار الكهربائي عند 15 واط ثابت.
- تشغيل الجهاز لمدة 3 ساعة أو حتى يصل الجهد إلى قيمة ثابتة.
ملاحظة: مع بدء التركيز على العينة، سيبدأ الجهد في التسلق تدريجياً حتى يصل إلى قيمة ثابتة. - بعد المدى، والاستعداد لجمع الكسور في مربع الحصاد (التي تحتوي على 20 أنابيب بلاستيكية، 12 مم × 75 ملم، 5-6 مل حجم) متصلة مضخة فراغ عن طريق الضغط على زر الحصاد على في وحدة IEF.
- محاذاة دبابيس مجموعة 20 مع منافذ مجموعة 20 من الخلية التركيز التي يتم مختومة مع الشريط.
- دفع دبابيس جمع من خلال الشريط ختم وتحويل مضخة فراغ ON في وقت واحد (انظر الشكل 2B، 2C و 2D).
ملاحظة: سيتم جمع حوالي 3 مل كسور من كل غرفة في الأنابيب في كل مرة. ويمكن استخدام الكسور في التطبيقات اللاحقة للمصب (SDS-PAGE من أجل القياس الكمي للببتيد، TLC والباس الحيوي للجزيئات الصغيرة).
3. فصل وتنقية البروتينات من C. albicans
- تنمو مستعمرة واحدة من c. albicans في الخميرة بيبتون ديكستروز (YPD) مرق16 في 30 درجة مئوية مع اهتزاز (200 دورة في الدقيقة) لليلة واحدة.
- جمع خلايا الخميرة عن طريق الطرد المركزي (10000 س ز لمدة 5 دقائق).
- تعليق C. albicans خلايا الخميرة في كربونات الأمونيوم (1.89 ز / لتر) العازلة التي تحتوي على 1٪ (الخامس / الخامس) بيتا mercaptoethanol (β-ME) (1/10th من حجم الثقافة) وتدوير في أنبوب الأسطوانة لمدة 1 ساعة في 5 °C15.
- إزالة خلايا الخميرة عن طريق الطرد المركزي (10،000 س ز لمدة 5 دقائق) وتصفية استخراج البروتين من خلال مرشح 0.45 ميكرومتر.
ملاحظة: يمكن إعداد عينات البروتين من السيتوبول اليبيكان، والغشاء أو جدار الخلية واستخدامها لتجزئة IEF. وبالمثل، يمكن استخدام البروتينات من البكتيريا أو العينات البيولوجية الأخرى (مستخلص الأنسجة الحيوانية) بعد إزالة أي ملح بالطرق المناسبة(على سبيل المثال،عن طريق غسيل الكلى أو باستخدام أعمدة إزالة ماء). - Dialyze استخراج البروتين في أنابيب غسيل الكلى (3500 MWCO) ضد المياه لمدة 15 ساعة في 4 درجة مئوية. تقدير تركيز البروتين بواسطة طريقة برادفورد صبغ ملزمة باستخدام غاما الجلوبيولين كمعيار17.
- استخدام 500 ملغ من البروتين الكلي في 60 مل من الماء التي تحتوي على 1٪ (v/v) أمفوليت (درجة الHH 5-8) للكسر.
ملاحظة: منذ ampholyte واسعة النطاق (pH 3-10) لا يثري بعض غير جلوكان الخلوية المرفقة بروتينات جدار من C. albicans جيدا، واستخدام ampholyte ضيق النطاق (pH 5-8) ampholyte. ويمكن استخدام تركيز الأمفوليت بنسبة تصل إلى 2٪ إذا كان تركيز البروتين العينة أكثر من 2 ملغ / مل; وهذا يقلل من تجميع البروتين أثناء التركيز. دائماً إبقاء العينات، أمبيركوليتس، والمياه مُبَرَّكة على الجليد. - كرر الخطوات 1.1-1.7 لإعداد وحدة IEF واستخدام محلول البروتين من الخطوة 3.6 لتحميل في خلية IEF.
- بعد 4 ح من التركيز على ثابت 15 W، وجزئ البروتين الحصاد (1-20) كما هو موضح أعلاه (الخطوات 2.9-2.11) وتحليل على 12.5٪ SDS-PAGE بعد تقليل وغليان عينات البروتين18.
- وصمة عار البروتينات حلها عن طريق تلطيخ هلام SDS-PAGE مع صبغة زرقاء Coomassie (0.01٪) حل ل 2-3 ح في درجة حرارة الغرفة على الروك. Destain هلام وتسجيل صورة هلام باستخدام صورة هلام.
ملاحظة: صبغة كوزقة Coomassie (0.01%) يمكن إعدادها عن طريق خلط 0.01 غرام من مسحوق Coomassie الأزرق في محلول destaining تحتوي على 40٪ الميثانول و 10٪ حمض الخليك.
4. النشاط الحيوي من الجزيئات الصغيرة النقية من استخراج النباتات Gymnema sylvestre
- زراعة C. albicans في خلايا الخميرة كما هو الحال في الخطوة 3.1.
- لإعداد تعليق الخلية، وتمييع ثقافة بين عشية وضحاها من C. albicans خلايا الخميرة (1/1000 تخفيف) في خلية جديدة من الخلايا المتخصصة في الزرع المتوسطة تكملها مع 50 mM الجلوكوز.
ملاحظة: C. albicans يحول من نمو الخميرة إلى الواصلة تحت ظروف تحريض الواصلة (RPMI في 37 درجة مئوية). وتظهر جزيئات صغيرة حمض Gymnemic لمنع تحويل خلايا الخميرة في hyphae تحت شروط تحريض hypha16. ونحن تهدف إلى تحديد ما إذا كان السائل المرحلة IEF فصل استخراج Sylvestre تحتوي على هذه الجزيئات النشطة بيولوجيا. - من نظام التعليق الخلوي المعد، أضف 90 ميكرولتر إلى كل بئر من الـ 96 بئر.
- من كل كسر (1-20 الكسور المقطوعة من استخراج G. Sylvestre التي تم الحصول عليها من المرحلة السائلة IEF، الشكل 4)،إضافة 10 ميكرولتر في الآبار مع 90 ميكرولتر من تعليق الخلية أعلاه (الخطوة 4.2). إجراء المقايسة في ثلاث ة.
- إضافة 10 ميكرولتر من الماء الذي يحتوي على أمبيروليت (1%) في آبار منفصلة مع 90 ميكرولتر من C. albicans تعليق خلية الخميرة كتحكم سلبي.
ملاحظة: ampholytes لديها إمكانية النشاط الحيوي، ولذلك فمن الضروري أن تشمل السيطرة على أمفورسليت أثناء تنفيذ أي بيوراسا19. - احتضان لوحة 96-well في 37 °C لمدة 12 ساعة ومراقبة تثبيط C. albicans الخميرة إلى hypha التحويل تحت المجهر16. أيضا، تحديد النسبة المئوية لتثبيط تحويل الخميرة إلى هيفا.
النتائج
فصل وتنقية الجزيئات الصغيرة والببتيدات من استخراج مصنع سيمانيما
باستخدام طريقة IEF المرحلة السائلة المحض، نحن كسور مستخلصات النباتات الطبية والبروتينات سطح الخلايا من الفطريات المسببة للأمراض البشرية، C. albicans. يتم عرض مخطط من بروتوكولات الكسر هذه في الشكل 1.
من 20 كسور من استخراج G. Sylvestre التي تم الحصول عليها من المرحلة السائلة IEF، تم العثور على جزيئات داكنة اللون (السابونينات تيربينويد) للهجرة وإثراء في نهاية الأنود (درجة حِس 2-3) ولوحظت الكسور الواضحة الفاتحة الصفراء في نهاية الكاثود (الرقم PH 8-9)(الشكل 2). تم حل Aliquots (20 ميكرولتر) من كل كسر (1-20) على 15٪ من SDS-PAGE بعد تقليل العينات وغليانها. يُظهر جل Coomassie الملون باللون الأزرق نطاق البوليبتيد المُشتَّت الذي يحتوي على حوالي 5 كيلو Da التي يتم إثراؤها في الكسور 16-19(الشكل 3). وقد أفيد أن النبات G. Sylvestre يحتوي على 35 حمض أميني gurmarin الأساسية البوليبتيد مع الوزن الجزيئي المتوقع من 4,209 دا20. البكتيريا, النباتات والحيوانات تحتوي على الببتيدات; وكثير منها دائري (العقدة) ومستقرة مع مجموعة واسعة من الأنشطة البيولوجية مثل مبيدات الحشرات وخصائص مضادات الميكروبات21,22.
النشاط البيولوجي للأحماض الرياضية المنفصلة
يحتوي مصنع G. Sylvestre أيضا على الأحماض الرياضية (السابونين تيربنويد) كما المكونات الرئيسية16,23,24. كما هو متوقع، لم يتم الكشف عن هذه الجزيئات الصغيرة في الكسور 1 والكسور القليلة القادمة من قبل SDS-PAGE وCoomassie تلطيخ(الشكل 3)لأنها غير البروتينية. ومع ذلك، يمكن فصل هذه الجزيئات الصغيرة بواسطة TLC والكشف عنها تحت ضوء الأشعة فوق البنفسجية(الشكل 4A، حارة F1). لم يحتوي الكسر 10 على كمية يمكن اكتشافها من هذه الجزيئات الصغيرة على TLC مما يشير إلى أن معظم الجزيئات الصغيرة العضوية تم إثراؤها في الكسور 1-3. وقد تبين أن الأحماض الجمنامية (GAs) الجزيئات لمنع C. albicans الخميرة إلى هيفا الانتقال16,25. نحن مقهّز جميع الكسور 20 التي تم جمعها في هذه الدراسة لنشاطها المثبط ضد C. albicans تحويل الخميرة إلى الواصلة والنمو الواصلة16. وتظهر النتائج في الشكل 4B, 4C. ويلاحظ أعلى نشاط في الكسر 1، الذي يتفق مع نتائج TLC حيث يمكن رؤية عدة بقع. ايزومر من الأحماض الرياضية موجودة وجميعها لديها أنشطة بيولوجية مماثلة10. تم فصل هذه الأيزومرات في الكسر 1-3 وتظهر تثبيط النمو الواصلة C. albicans (الشكل 4A, 4C, الكسر 1). وانخفضت درجة تثبيط الواصلة تدريجيا لأنها تذهب من 1 إلى 10. تم الحصول على نشاط قليل أو معدوم في الكسور 10 وما فوق.
فصل بروتينات سطح الخلية عن الفطريات المسببة للأمراض، C. albicans
وتظهر النتائج من الطور السائل IEF تجزئة بروتينات سطح الخلايا albicans C. في الشكل 5. هذه البروتينات سطح الخلية تلعب أدوارا هامة في الالتصاق C. albicans و pathogenesis26. لوحظت عدة بروتينات (سهام) غنية في كسور مختلفة. وهذا قد يسمح بتحديد ردود فعل مناعية مع المبيضات مصل الإنسان المصاب و / أو تحديدها عن طريق قياس الطيف الشامل. وبالمثل، يمكن تجزئة البروتينات من الكسور الخلوية الأخرى (مثل السيتوبلازم وجدار الخلية) باستخدام طريقة IEF هذه. وسيتيح التنقية المستندة إلى المرحلة السائلة التي تستند إلى IEF تحديد البروتينات المنخفضة الوفرة من العينات البيولوجية المعقدة، عندما يقترن بتحليل القياس الطيفي الكتلي.
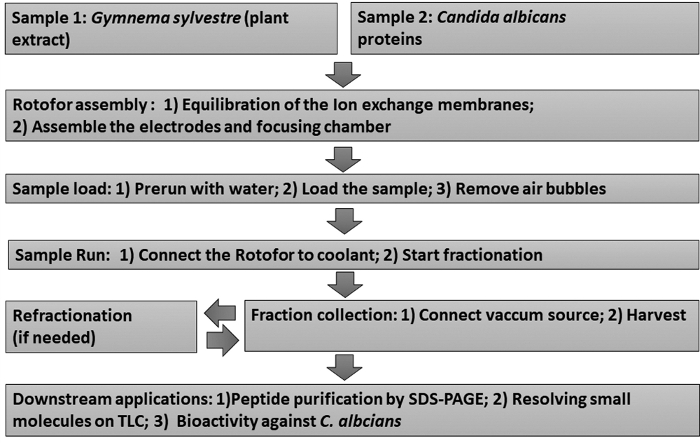
الشكل 1: مخطط تدفقي يبين سير العمل التجريبي. يتم تصوير إجراءات تجزئة IEF في المرحلة السائلة خطوة و مقايسات المصب اللاحقة. وتشمل العينات جمينيما Sylvestre استخراج ورقة (عينة 1) و Candida albicans غير glucan تعلق بروتينات الخميرة (عينة 2). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: إعداد جهاز IEF للمرحلة السائلة وتجزئة مستخلصات معمل G. sylvestre. (A)خلال المدى،(ب)خلال جمع الكسور، (C)بعد جمع الكسر، و (D) أجزاء جهاز IEF السائلة المرحلة، 1) أغشية التبادل الأيوني، 2) التركيز غرفة وغشاء الأساسية، 3) التجمع الكهربائي (سلبي)، 4) التجمع الكهربائي (إيجابية). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: فصل SDS-PAGE لكسور استخراج النباتات المركزة IEF. L- سلم، PC- التحكم الإيجابي (الببتيد)، 0- عينة الإدخال، 1-20 الكسور المنفصلة. SDS-PAGE (15٪ حل هلام) كانت ملطخة بصبغة Coomassie الزرقاء لتصور الببتيدات حل (~ 5 كيلو Da) من الكسور 1-20. الكسور 1-3 تحتوي على جزيئات صغيرة (الكسر 1 له لون أغمق يشير إلى المركبات المخصب) التي لا يمكن أن تكون ملطخة / الكشف عن صبغة Coomassie الزرقاء. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
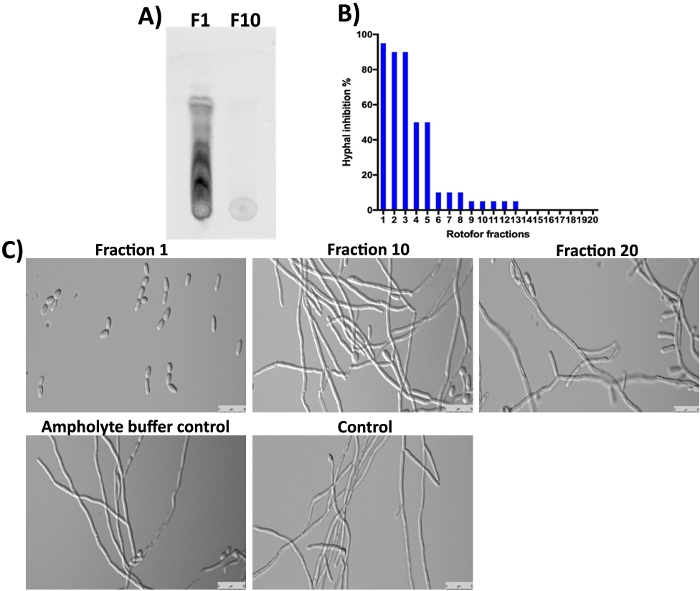
الشكل 4: تحليل الجزيئات الصغيرة المجزّئة من قبل TLC وتحديد النشاط البيولوجي ضد C. albicans. (أ)يظهر تحليل TLC من جزيئات صغيرة من #1 الكسر #10. تم استخدام لوحة هلام السيليكا المنشطة لبقعة ~ 5 ميكرولتر من العينات وركضت مع التولوين: الكلوروفورم: مذيب الميثانول (5:8:3 نسبة) حتى وصلت الجبهة المذيبة إلى الهامش. تم الكشف عن مركبات فصلت TLC تحت ضوء الأشعة فوق البنفسجية epifluorescence (310 نانومتر). (B) يظهر تثبيط % من C. albicans تحويل الخميرة إلى hypha من قبل كسور مختلفة. (C) يوضح مورفولوجيا الخلية من C. albicans تحت شروط تحريض hypha. يظهر #1 الكسر الحد الأقصى (98%) تثبيط الخميرة لتحويل hypha. الكسور والضوابط الأخرى لا تظهر تثبيط لC. albicans الواصلة النمو بعد 12 ساعة من الحضانة في 37 درجة مئوية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 5: تحليل SDS-PAGE لبروتينات سطح الخلايا البيكانز C. albicans (غير جلوكان مرفق). L- سلم، 0 - عينة الإدخال، 1-18 كسور التي تم جمعها بعد IEF في خلية IEF السائلة القياسية باستخدام نطاق ضيق (درجة PH 5-8) ampholyte. تُظهر الصورة SDS-PAGE (12.5%) حل البروتينات بعد تلطيخ مع صبغة Coomassie الزرقاء. تم إثراء العديد من البروتينات في أجزاء معينة (السهام). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
وتشمل الجزيئات الصغيرة من مصادر المنتجات الطبيعية (مثل النباتات) نواتج مستقلبات ثانوية معقدة شديدة التنوع في التركيب الكيميائي. ويعتقد أنها تشارك في آليات الدفاع النباتية. وبالإضافة إلى ذلك، توجد أيضا في الأنسجة النباتية polypeptides22. هذه الجزيئات الصغيرة المنتج الطبيعي هي مصادر غنية من جزيئات الاختبار لاكتشاف المخدرات والتنمية. ومع ذلك، فإن الطرق الصعبة والمملة اللازمة لعزلها وتنقيتها تحد من استخدامها للتطبيقات العلاجية. ويُبرز نهج المرحلة السائلة من IEF المستخدم في هذا التقرير القدرة على فصل هذه الجزيئات الصغيرة والبوليبيبيدات دون المساس بنواحي نشاطها البيولوجي.
هذه الطريقة المستندة إلى IEF توفر العديد من المزايا في فصل الجزيئات البيولوجية بما في ذلك تركيز البروتينات النقية من خليط معقد ، والحفاظ على التشكل الأصلي أثناء وبعد التركيز ، وجمع العينات ككسور منقّحة فردية دون تلوث متقاطع. عند الضرورة، يمكن إعادة تركيز العينات مع نطاق محدود من pH لتنقية ايزوفورم البروتين. منذ خلية التركيز IEF مصغرة (~ 15 مل) هو متاح، ويمكن استخدامه لأحجام أصغر من العينات أيضا. والنتيجة الجديدة التي توصل إليها هذا التقرير هي أنه يمكن فصل الجزيئات الصغيرة العضوية والببتيدات عن مستخلص نباتي معقد. على الرغم من أنه من الصعب الاتفاق على أنه يمكن فصل الجزيئات الصغيرة عن مقتطفات المنتجات الطبيعية من قبل IEF ، فمن المعقول لتلك المركبات التي هي أمفيتيرية. الأحماض gymnemic التي تم فصلها عن الببتيد gurmarin في استخراج ج. سيلفستر ويبدو أن amphoteric لأنها تحتوي على مجموعة حمض carboxylic أو أنها تتصرف على الأقل في وجود أمفوليت المستخدمة. وبما أن الجليكسيدات هي جزيئات طبيعية نشطة بيولوجياً شبيهة بالأحماض الرياضية، يمكن استخدام طريقة IEF لفصلها عن المصادر الطبيعية المعقدة. وبالمثل، قد يتم عزل الببتيدات من المنتجات الطبيعية باستخدام نهج IEF هذا المرحلة السائلة.
بعض القيود في هذا النهج هي أنه لا يمكن تجزئة جميع الجزيئات الصغيرة من طريقة IEF لأنها يجب أن تكون قابلة للذوبان في الماء و أمفيمترية ضعيفة ، على الأقل. تم إعداد المقتطف المستخدم هنا من قبل استخراج الميثانول بنسبة 50٪ من المواد النباتية المجففة ولكنه قابل للذوبان في الماء. ولا يزال يتعين النظر إلى استخدام طريقة IEF للمركبات القابلة للذوبان في المذيبات والمركبات الأمفيمترة على أنها بعض المذيبات العضوية لا تتفق مع مكونات أداة IEF في المرحلة السائلة. إن ميل البروتينات إلى الترسب في نقاطها الأيزوكيلية (pI) في حلول القوة الأيونية المنخفضة معروف جيدًا. ومع ذلك، في نظام IEF الدورية، يتم تقليل هطول البروتين كما البروتينات المركزة لا تزال في التداول عند نقطة PI الخاصة بهم.
إذا كان أحد يستخدم تركيز عال من البروتينات في هذا الفصل IEF، قد يحدث هطول الأمطار. لتقليل هطول البروتين وتحسين تركيز البروتين، يمكن استخدام اليوريا حتى 3-5 M. المنظفات غير الأيونية مثل CHAPS، digitonin وانخفاض تركيز المنظفات (0.1-1٪) يمكن أيضا أن تستخدم للحد من تجميع البروتين خلال IEF. ومع ذلك، يجب إزالة اليوريا والمنظفات قبل تحليل البروتينات لنشاطها وفي بعض الحالات، قد تؤثر هذه العوامل على وظائف البروتين. وتشمل بعض الخطوات الحاسمة التي يجب مراعاتها أثناء تشغيل IEF في المرحلة السائلة تحميل خلية التركيز IEF بدون فقاعات الهواء، واستبدال أغشية التبادل الأيوني إذا كانت تالفة، واستبدال أزرار الفتحة بعد عدد معين من الاستخدامات المتكررة.
في الختام، باستخدام طريقة IEF في المرحلة السائلة، أظهرنا فصل الأحماض الرياضية النشطة بيولوجيا وpopeptide gurmarin من استخراج أوراق Sylvestre G. علاوة على ذلك، يمكن أن يكون IEF في المرحلة السائلة مفيدًا لإثراء البروتينات الانتقائية من مستخلصات الخام المعقدة للميكروبات المسببة للأمراض.
Disclosures
ويود أصحاب البلاغ أن يعلنوا عدم وجود مصالح مالية متنافسة.
Acknowledgements
ونحن ممتنون لمصادر التمويل من شعبة علم الأحياء ومركز جونسون لأبحاث السرطان لجوائز BRIEF و IRA ، على التوالي إلى GV. كما نشكر جائزة K-INBRE ما بعد الدكتوراه إلى RV. وقد تم دعم هذا العمل جزئيا من قبل جائزة التنمية المؤسسية (IDeA) من المعهد الوطني للعلوم الطبية العامة في المعاهد الوطنية للصحة تحت رقم منحة P20 GM103418. والمحتوى هو مسؤولية المؤلفين وحدهم ولا يمثل بالضرورة وجهات النظر الرسمية للمعهد الوطني للعلوم الطبية العامة أو المعاهد الوطنية للصحة. نشكر المراجعين المجهولين على تعليقاتهم المفيدة.
Materials
| Name | Company | Catalog Number | Comments |
| 0.45 µm syringe filter | Fisher scientfic | 09-720-004 | |
| 2-Mercaptoethanol | Sigma | M3148 | |
| Ammonium carbonate | Sigma-Aldrich | 207861-500 | |
| Bio-Lyte 3/10 Ampholyte | Bio-Rad | 163-1113 | |
| Bio-Lyte 5/8 Ampholyte | Bio-Rad | 163-1192 | |
| Compact low temperature thermostat | Lauda -Brinkmann | RM 6T | Set water cooling to 4 oC and it can be run even at 0 oC as when it passes through the Rotofor cooling core, the circulating water temperature will be around 5 or more depending on the voltage. |
| Coomassie Brilliant Blue R | Sigma-Aldrich | B7920 | |
| Dialysis tubing (3,500 MWCO) | Spectrum Spectra/Por | 132112T | |
| Gymnema plant leaf extract powder (>25% Gymnemic acids) | Suan Farma, NJ USA | ||
| Incubator | Lab companion | SI 300R | |
| Microscope | Leica | DM 6B | |
| Mini protean electrophoresis | Bio-Rad | ||
| pH meter | Mettler Toledo | S20 | Useful to determine the pH of the Rotofor (liquid-phase IEF) fractions |
| Rotofor | Bio-Rad | 170-2972 | http://www.bio-rad.com/webroot/web/pdf/lsr/literature/M1702950E.pdf (Rotofor Instruction manual for assembling the unit) |
| RPMI-1640 Medium | HyClone | DH30255.01 | |
| Sealing tape | Bio-Rad | 170-2960 | Scotch tape may also be used. |
| Sorvall legend micro 17 centrifuge | Thermo scientific | 75002432 | |
| TPP tissue culture plate -96 well flat bottom | TPP | TP92696 |
References
- Jankowska, U., et al. Optimized procedure of extraction, purification and proteomic analysis of nuclear proteins from mouse brain. Journal of Neuroscience Methods. 261, 1-9 (2016).
- Pergande, M. R., Cologna, S. M. Isoelectric Point Separations of Peptides and Proteins. Proteomes. 5 (1), (2017).
- Stoyanov, A. IEF-based multidimensional applications in proteomics: toward higher resolution. Electrophoresis. 33 (22), 3281-3290 (2012).
- Vesterberg, O. A. Y. . Method of Isoelectric Fractionation. , (1964).
- Vesterberg, O., Svensson, H. Isoelectric fractionation, analysis, and characterization of ampholytes in natural pH gradients. IV. Further studies on the resolving power in connection with separation of myoglobins. Acta Chemica Scandinavica. 20 (3), 820-834 (1966).
- Righetti, P. G. . Isoelectric Focusing: Theory, Methodology and Applications. , 1 (1983).
- Vesterberg, O. Synthesis and Isoelectric Fractionation of Carrier Ampholytes. Acta Chemica Scandinavica. 23, 2653-2666 (1969).
- Bier, M. Recycling isoelectric focusing and isotachophoresis. Electrophoresis. 19 (7), 1057-1063 (1998).
- Bier, M., Palusinski, O. A., Mosher, R. A., Saville, D. A. Electrophoresis: mathematical modeling and computer simulation. Science. 219 (4590), 1281-1287 (1983).
- Ayala, A., Parrado, J., Machado, A. Use of Rotofor preparative isoelectrofocusing cell in protein purification procedure. Applied Biochemistry and Biotechnology. 69 (1), 11-16 (1998).
- Wagner, L., et al. Isolation of dipeptidyl peptidase IV (DP 4) isoforms from porcine kidney by preparative isoelectric focusing to improve crystallization. Biological Chemistry. 392 (7), 665-677 (2011).
- Hosken, B. D., Li, C., Mullappally, B., Co, C., Zhang, B. Isolation and Characterization of Monoclonal Antibody Charge Variants by Free Flow Isoelectric Focusing. Analytical Chemistry. 88 (11), 5662-5669 (2016).
- Yu, J. J., et al. Francisella tularensis T-cell antigen identification using humanized HLA-DR4 transgenic mice. Clinical Vaccine Immunology. 17 (2), 215-222 (2010).
- Riyong, D., et al. Size and charge antigens of Dirofilaria immitis adult worm for IgG-ELISA diagnosis of bancroftian filariasis. Southeast Asian Journal of Tropical Medicine and Public Health. 41 (2), 285-297 (2010).
- Vediyappan, G., Bikandi, J., Braley, R., Chaffin, W. L. Cell surface proteins of Candida albicans: preparation of extracts and improved detection of proteins. Electrophoresis. 21 (5), 956-961 (2000).
- Vediyappan, G., Dumontet, V., Pelissier, F., d'Enfert, C. Gymnemic acids inhibit hyphal growth and virulence in Candida albicans. PLoS One. 8 (9), 74189 (2013).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry. 72, 248-254 (1976).
- Laemmli, U. K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 227 (5259), 680-685 (1970).
- Riazi, S., Dover, S., Turovskiy, Y., Chikindas, M. L. Commercial ampholytes used for isoelectric focusing may interfere with bioactivity based purification of antimicrobial peptides. Journal of Microbiological Methods. 71 (1), 87-89 (2007).
- Kamei, K., Takano, R., Miyasaka, A., Imoto, T., Hara, S. Amino-Acid-Sequence of Sweet-Taste-Suppressing Peptide (Gurmarin) from the Leaves of Gymnema-Sylvestre. Journal of Biochemistry. 111 (1), 109-112 (1992).
- Craik, D. J. Chemistry. Seamless proteins tie up their loose ends. Science. 311 (5767), 1563-1564 (2006).
- Craik, D. J., Daly, N. L., Bond, T., Waine, C. Plant cyclotides: A unique family of cyclic and knotted proteins that defines the cyclic cystine knot structural motif. Journal of Molecular Biology. 294 (5), 1327-1336 (1999).
- Stoecklin, W. Chemistry and physiological properties of gymnemic acid, the antisaccharine principle of the leaves of Gymnema sylvestre. Journal of Agricultural and Food Chemistry. 17 (4), 704-708 (1969).
- Liu, H. M., Kiuchi, F., Tsuda, Y. Isolation and structure elucidation of gymnemic acids, antisweet principles of Gymnema sylvestre. Chemical & Pharmaceutical Bulletin (Tokyo). 40 (6), 1366-1375 (1992).
- Veerapandian, R., Vediyappan, G. Gymnemic Acids Inhibit Adhesive Nanofibrillar Mediated Streptococcus gordonii-Candida albicans Mono-Species and Dual-Species Biofilms. Frontiers in Microbiology. 10, 2328 (2019).
- Chaffin, W. L. Candida albicans cell wall proteins. Microbiology and Molecular Biology Reviews. 72 (3), 495-544 (2008).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved