Method Article
הפרדת מולקולות ביו-אקטיביות קטנות, פפטידים ממקורות טבעיים וחלבונים מחיידקים על ידי שיטת התמקדות איזואלקטריים
In This Article
Summary
המטרה היא לאנגיופלסטיקה ולבודד אקטיביים מולקולות קטנות, פפטידים מתוך תמצית צמח מורכב, חלבונים של חיידקים פתוגניים על ידי שימוש בשיטת מיקוד בשלב נוזלי (הארה ב) שיטה. יתרה מזאת, המולקולות המופרדות זוהו ופעילותם הביוביולוגית אושרה.
Abstract
מוצרים טבעיים הנגזרים מצמחים ומחיידקים הם מקור עשיר של מולקולות אקטיביים. לפני השימוש שלהם, המולקולות הפעילים מתמציות מורכבות חייבים להיות מטוהרים עבור יישומים במורד הזרם. יש שיטות כרומטוגרפיות שונות זמין למטרה זו עדיין לא כל המעבדות יכול להרשות לעצמם שיטות ביצועים גבוהים בידוד מדגימות ביולוגיות מורכבות יכול להיות קשה. כאן אנו מדגימים כי הסדר שלב נוזלי איזואלקטרי התמקדות (הפנים) יכול להפריד מולקולות, כולל מולקולות קטנות פפטידים מפני תמציות צמחים מורכבים, מבוסס על נקודות איזואלקטריים שלהם (pI). השתמשנו בשיטה לקבלת משבר ואפיון ביולוגיים מורכבים. כהוכחה של המושג, אנחנו מצאנו את הצמח מתחת לתמצית צמחים בבידוד, בידוד משפחה של טרפנאיד סאפונין מולקולות קטנות פפטיד. כמו כן הדגמנו הפרדת חלבון מחיידקים יעילים באמצעות פטרייה אלביקנס פטריה כמערכת מודל.
Introduction
טיהור הbiomolecules מדגימות ביולוגיות מורכבות הוא צעד חיוני וקשה לעתים קרובות בניסויים ביולוגיים1. איזואלקטריים התמקדות (הארה ב) הוא מתאים הפרדה ברזולוציה גבוהה של biomolecules מורכבים שבו המוביל ampholytes לנסוע לפי הטעינה שלהם ולהקים את הדרגתי pH בשדה חשמלי3. המוביל המסחרי הראשון של חברת הקולנוע הארצי פותח על ידי אושל וסטברג בשנת 1964 וכפטנט4,5. אמולוציטים המוביל הם אליפטיות oligo-אמינו oligo-carboxylic חומצה מולקולות באורך משתנה ומסעף6. לאחר מכן, בוסטברג ואחרים שיפרו את המוביל אמולוציטים לשימוש המורחב שלהם בהפרדת biomolecules6,7.
שיטות להפרדת הbiomolecules כוללות אגקם ו פוליאקרילמיד ג'ל אלקטרופורזה, אלקטרופורזה דו מימדית ג'ל (2-DE), איזואלקטריים התמקדות, אלקטרופורזה קפילר, isotaקוזוהורזיס וטכניקות כרומטוגרפיים אחרים (למשל, ועוד, FPLC, כרומטוגרפיה)2. במהלך האירוע הומצא הארגון הבינלאומי של מילאנו ביר8בכלי שנקרא "Rotofor". הוא ייסד את הקונספט והעיצוב של המכשיר הזה ותרם רבות לתיאוריית ההגירה האלקטרופיניטית. הצוות שלו פיתח גם מודל מתמטי של תהליך הפרדה אלקטרופלסטי לסימולציות מחשב9.
המנגנון הנוזלי הינו מנגנון מסתובב אופקית המורכב מליבת ניילון מחולק ל -20 תאים נקבובי ומים מחזורי קירור המים מוט קרמיקה. התאים הנקבובי מאפשרים למולקולות להגר דרך השלב המים בין האלקטרודות וההיתר לאיסוף דגימות מטוהרים תחת ואקום בשברים. מערכת טיהור זו יכולה לספק עד 1000 לטיהור מתקפל של מולקולה מסוימת ב-< 4 שעות. תכונה רבת ערך של מכשיר זה היא שניתן להחילם כצעד ראשון לטיהור מתערובת מורכבת או כצעד אחרון להשגת הטוהר10. אם מולקולת העניין היא חלבון, יתרון נוסף הוא שהמערך הטבעי שלו יישמר במהלך ההפרדה.
השימוש בשלב הנוזלי הינו דיווח נרחב עבור חלבונים, אנזימים וטיהור נוגדנים6,10,11,12,13,14. כאן נתאר את השימוש בגישה זו להפרדת וטיהור מולקולות קטנות ופפטידים מצמח המרפא ג'ימנמה. פרוטוקול זה יסייע לחוקרים להתרכז ולטהר מולקולות קטנות פעילות מתוך תמצית צמחים עבור יישומים במטה בעלות נמוכה. בנוסף, אנו גם להדגים כי העשרה של חלבונים מתמצית חלבון מורכב מפטרייה אלביקנס פטריה15 במערכת זו מבוססת-החוץ כדוגמה השנייה.
Protocol
1. התקנה והקמה מראש של היחידה הסטנדרטית של התוכנית הראשונה.
- הכנס את ה-gmp בשלב הנוזלי (כפתור הכפתור האדום וכפתור שחור-קתודה) עם ממברנות החליפין המתאימים שלהם לפי הוראות ההדרכה (ראה טבלת חומרים). באמצעות שימוש בממברנות ממברנות עם 0.1 M NaOH ו ממברנות הקטיון עם 0.1 M H3פו4 לפחות 16 H כאשר ממברנות חדשים משמשים.
- לאחסן את הממברנות אלקטרוליטים (0.1 M NaOH או 0.1 M H3PO4) בין רץ ואל תאפשר להתייבש.
- הכנס את החלק הפנימי והחיצוני של האלקטרודה על ידי יישור שלושה חורים מלבני ב אטמים להחלפת יונים. למלא את האלקטרודות עם אלקטרוליטים בהתאמה (~ 25-30 mL) כדי למנוע את הקרומים שלהם מייבוש.
- אין להוסיף עודף (יותר מ 1/3rd של נפח התא אלקטרודה) אלקטרוליט שעשוי לבנות לחץ בתוך האלקטרודה ולגרום דליפה.
- כסה את יציאות אוסף הדגימות עם סרט איטום המגיע עם חלקי ההרכבה של המכשיר (ראה טבלת חומרים). בצד יציאות האוסף לדוגמה ניתן לזהות על ידי שני מתכת אנכית יישור פינים. לחלופין, השתמש בסרט איטום רגיל כדי לאטום את היציאות.
- להרכיב את כל החלקים של ההרכבה קאמרית התמקדות ברצף (אלקטרודה אנאודה, ליבת קרום ניילון, התמקדות החדר והאלקטרודה הקתודה) על האצבע קירור קרמי.
- ממלאים את החדר המתמקד עם מים מזוקקים מראש (נפח כולל של 60 mL עבור תא ה-it רגיל) באמצעות מזרק 50 mL.
- חברו את המכשיר הנוזלי למים מצוננים ב -4 º C וה, המוקלטות את היחידה בשעה 15 ואט ו-3,000 V עבור 3-5 דקות או עד למייצאת המתח.
הערה: בדרך כלל, בתוך דקה אחת, המתח יגיע לערכי הערכה המרביים. מוקלטות עם מים מזוקקים מסייע להסיר את היונים שיורית מן התא התמקדות ליבת קרום ניילון. - כבה את מקור החשמל והסר את המים מתא באמצעות אספן השברים. חתום מחדש את יציאות האוסף באמצעות נייר איטום.
הערה: כעת המכשיר מוכן לשימוש בשלב 2.4.
2. הפרדה וטיהור של מולקולות קטנות ופפטידים מ- ג'ימנמה לחלץ
- מדידת 0.6 g של תמצית צמח ולפזר מים מזוקקים (60 mL) על ידי ערבוב בצינור רולר עבור 5 דקות.
הערה: ניתן להשתמש בכל דוגמה ביולוגית שהיא מסיסה ונטולת מלח, לצורך הפרדה וטיהור באמצעות כלי זה. דגימות עם אגירה הריכוז מלח עד 10 מ"מ יכול לשמש עם רזולוציה מעט ירד. אנו מעוניינים סאפונין משפחה של תרכובות triterpenoid, חומצות ג'ימנמיק, מ -G. סילברה צמח עבור שלהם תכונות פטריות ייחודי16. - צנטריפוגה את תמצית צמח מסיסות ב 10,000 x g עבור 5 דקות כדי להסיר חלקיקים מסיסים.
- העבר את סופרנטנט (~ 60 mL) לצינור צנטריפוגה של 80 mL, ותערבב אותו עם 0.6 mL של ampholyte ייט (pH 3-10) עד 1% (v/v).
- בצע את השלבים 1.1 – 1.7 להכנת יחידת האנטי-ובפאזה הנוזלית. . החדר מוכן כעת לטעון את הדגימה
- השתמש מזרק 50 mL עם 1-1/2 אינץ ' בעובי 19 G בוטה המחט (מגיע עם המכשיר) ולטעון את המדגם מוכן עם ampholyte ייט (60 mL סך) בתא באמצעות יציאות אוסף לדוגמה.
- להסיר בועות אוויר מתא לדוגמה על ידי הסרת תא מיקוד ממעמד והקשה על תא אלקטרודה לסלק את הבועות. הנוכחות של בועות אוויר יגרום תנודות מתח הנוכחי ולהשפיע על הריצה.
- חבר את היחידה למערכת קירור המים (4 ° c) והתחל במהומה עם ספק הכוח בקבוע של 15 ואט.
- הפעל את המנגנון במשך 3 שעות או עד שהמתח יגיע לערך קבוע.
הערה: כשהמדגם מתחיל להתמקד, המתח יתחיל לטפס בהדרגה עד שיגיע לערך קבוע. - לאחר הריצה, להכין לאסוף את השברים בתיבת הקציר (המכיל 20 שפופרות פלסטיק, 12 מ"מ x 75 מ"מ, 5-6 mL נפח) מחובר משאבת ואקום על ידי לחיצה על כפתור הקציר על היחידה הבין-משנית.
- יישר את הפינים של 20 האוספים עם יציאות 20 הגבייה של התא המתמקד החתום באמצעות הקלטת.
- דחפו את הפינים של האוסף דרך סרט האיטום והפוך את משאבת הוואקום בו (ראה איור 2ב', 2c & 2c).
הערה: כ-3 שברים mL מכל חדר ייאספו לתוך הצינורות בכל פעם. שברים ניתן להשתמש ליישומים הבאים במורד הזרם (SDS-עמוד עבור כימות פפטיד, ו-וביולוגית עבור מולקולות קטנות).
3. הפרדה וטיהור של חלבונים מ -C. אלביקנס
- לצמוח מושבה אחת של C. אלביקנס ב שמרים-peptone-דקסטרוז (YPD) ציר16 ב 30 ° צ' עם טלטול (200 rpm) עבור לילה.
- לאסוף את התאים שמרים על ידי צנטריפוגה (10,000 x g עבור 5 דקות).
- השעיה C. אלביקנס שמרים תאים אמוניום פחמתי (1.89 g/L) מאגר המכיל 1% (v/v) בטא-mercaptoethanol (β-ME) (1/10 של נפח התרבות) ולסובב צינור רולר עבור 1 h ב 5 ° c15.
- להסיר את התאים שמרים על ידי צנטריפוגה (10,000 x g עבור 5 דקות) ולסנן את תמצית חלבון דרך מסנן 0.45 יקרומטר.
הערה: דגימות חלבון מ -C. אלביקנס ציטוסול, ממברנה או קיר תא ניתן להכין ולהשתמש בהם עבור שבירה של האו. כמו-כן, ניתן להשתמש בחלבונים מחיידקים או בדגימות ביולוגיות אחרות (תמצית רקמת בעלי חיים) לאחר הסרת כל מלח בשיטות המתאימות (לדוגמה, באמצעות דיאליזה או שימוש בעמודות התפלה). - Dialyze תמצית חלבון בצינורות דיאליזה (3,500 MWCO) נגד מים עבור 15 h ב 4 ° c. מעריכים את ריכוז החלבון על ידי שיטת ברדפורד לצבוע באמצעות גמא גלובולין כסטנדרט17.
- השתמש 500 mg של חלבון מוחלט ב 60 mL של מים המכילים 1% (v/v) ampholyte (pH 5-8) עבור המהומה.
הערה: כיוון שהמפולציט רחב (pH 3-10) אינו מעשיר מסוימים שאינם ניתנים לשימוש בחלבונים בקיר התאים של C. אלביקנס ובכן, להשתמש בטווח הצר (pH 5-8) ampholyte. ניתן להשתמש בריכוז אמולוציט של עד 2% אם ריכוז החלבון לדוגמה הוא יותר מ-2 מ"ג/mL; זה ממזער את צבירת החלבון במהלך ההתמקדות. , תמיד שומרים את הדגימות, אמפיולוציטים. ומים מקורר בקרח - חזור על שלבים 1.1-1.7 כדי להכין את יחידת האנטי-ולהשתמש בפתרון החלבון משלב 3.6 כדי להיטען לתוך תא ה-הארה.
- לאחר 4 h של התמקדות בקבוע 15 W, הקציר שברים חלבון (1-20) כמתואר לעיל (שלבים 2.9-2.11) ולנתח ב 12.5% SDS-עמוד לאחר הפחתת והרתיחה דגימות חלבון18.
- להכתים את החלבונים שנפתרו על ידי צביעת ה-SDS-עמוד ג'ל עם הצבע הכחול של Coomassie (0.01%) פתרון עבור 2-3 h בטמפרטורת החדר על הנדנדה. להכתים את הג ולהקליט את התמונה ג'ל באמצעות ג'ל האנג'ר.
הערה: צבע כחול Coomassie (0.01%) יכול להיות מוכן על ידי ערבוב 0.01 גרם של אבקת כחול Coomassie בפתרון מכתים המכיל 40% מתנול ו-10% חומצה אצטית.
4. ביואקטיביות של מולקולות קטנות מטוהרים מתמצית צמחים ג'ימנמה
- לגדול C. אלביקנס בתאי שמרים כמו בשלב 3.1.
- כדי להכין את ההשעיה התא, לדלל את התרבות הלילה של C. אלביקנס תאים שמרים (1/1000 דילול) לתוך מדיום טרי RPMI התרבות החדשה שיושלם עם 50 mM גלוקוז.
הערה: C. אלביקנס ממיר מגידול שמרים ללקורבן בתנאים הגורם לגרימת מיקוף (RPMI בשעה 37 ° c). חומצה ג'ימנימיק מולקולות קטנות מוצגות כדי לעכב את ההמרה של תאים שמרים לתוך לקורבן תחת hypha גרימת תנאים16. כיוונו לקבוע אם לחלץ G. סילבסטרה מופרדים בשלב אחד, מכילים מולקולות ביואקטיביות אלה. - מתוך ההשעיה התא המוכן, להוסיף 90 μL לכל טוב של הצלחת 96-באר.
- מכל שבריר (1-20 שברי שברים של G. סילבסטרה לחלץ התקבל מ-בשלב נוזלי, איור 4), להוסיף 10 μl לתוך בארות עם 90 μl של השעיית התא לעיל (שלב 4.2). בצע את השיטת הביצוע בטרילקאט.
- הוסף 10 μL של מים המכילים אמפיולוציט (1%) לתוך בארות נפרדות עם 90 μl של C. אלביקנס השעיית תא שמרים כפקד שלילי.
הערה: לאמפיולוציטים יש פוטנציאל לפעילות ביולוגית ולכן חיוני לכלול בקרת אמולוציט תוך ביצוע כל בקרה ביולוגית19. - מודקת את הצלחת 96-באר ב 37 ° צ' עבור 12 h ולהתבונן עיכוב של C. אלביקנס שמרים-to-hypha המרה מתחת למיקרוסקופ16. כמו כן, לקבוע את אחוז העיכוב של ההמרה שמרים ל-hypha.
תוצאות
הפרדה וטיהור של מולקולות קטנות פפטידים מ ג'ימנמה הצמח תמצית
באמצעות השיטה הביתטיבית לטיפול בשיטת האנטי-וולטאי, היינו משלבים תמציות של צמחי מרפא וחלבונים מפני השטח מפטרייה בתוך הגוף האנושי, C. אלביקנס. תרשים שרטוט של פרוטוקולי שבירה אלה מוצג באיור 1.
מ 20 שברים של G. סילבאסטרה תמצית שהתקבל מ-בשלב נוזלי הוועד ההפוך, המולקולות בצבע כהה (הספונאיד saponins) נמצאו להגר ולהיות מועשר בסוף אנודת (ph 2-3) ושברים בצבע צהוב בהיר נצפו בקצה הקתודה (ph 8-9) (איור 2). אליבאטס (20 μL) מכל שבר (1-20) נפתרו על 15% SDS-עמוד לאחר הפחתת והרתיחה את הדגימות. Coomassie ג'ל כחול מוכתם מראה את הלהקה פוליפטידים מתפזרת של כ 5 kda כי הוא מועשר בשברים 16-19 (איור 3). זה דווח כי הצמח G. סילבאסטרה מכיל 35 חומצת אמינו בסיסי פוליפטידים רין עם המשקל המולקולרי החזוי של 4,209 Da20. חיידקים, צמחים ובעלי חיים מכילים פפטידים; רבים מהם הם עגולים (knottins) ויציבים עם מגוון רחב של פעילויות ביולוגיות כגון חרקים ומיקרוביאלית נכסים21,22.
פעילות ביולוגית של חומצות ג'ימנומיק מופרדות
הצמח G. סילבאסטרה מכיל גם חומצות ג'ימנמיק (טרפנאיד ספוננס) כמרכיבים מרכזיים16,23,24. כצפוי, אלה מולקולות קטנות בשבר 1 והשברים הבאים לא זוהו על ידי SDS-עמוד וצביעת Coomassie (איור 3) מאז הם לא פרוטטינואאוס. עם זאת, אלה מולקולות קטנות יכול להיות מופרדים על ידי ומזוהה תחת אור UV (איור 4A, ליין F1). שבר 10 לא מכיל כמות לגילוי של אלה מולקולות קטנות ב-ומציע מרבית המולקולות הקטנות האורגניות העשירו בשברים 1-3. חומצות ג'ימנומיק (גז) מולקולות הוכחו לעכב את C. אלביקנס שמרים לhypha מעבר16,25. אנו לאסוף את כל 20 שברים שנאספו במחקר זה עבור פעילות העכבות שלהם נגד C. אלביקנס שמרים-to-hypha המרה וצמיחה hyphal16. התוצאות מוצגות באיור 4ב, 4c. הפעילות הגבוהה ביותר היא נצפתה בשבר 1, אשר מסכים עם תוצאות מספר מקומות בהם ניתן לראות כמה נקודות. איזומרים של חומצות ג'ימנומיק קיימות ולכולם יש פעילות ביולוגית דומה10. אלה איזוers היו מופרדים בשבר 1-3 ולהראות עיכוב של C. אלביקנס צמיחה hyphal (איור 4A, 4c, שבר 1). הדרגה של עיכוב hyphal הצטמצמה בהדרגה כפי שהוא עובר מ 1 אל 10. פעילות קטנה או לא הושגה בשברים 10 ומעלה.
הפרדת חלבונים מפני השטח מפטרת הפתוגניים, הג. אלביק
תוצאות משבר האנטי-וולטאי של C. אלביקנס החלבונים בשלב הנוזלי מוצגים באיור 5. אלה חלבונים משטח התא לשחק תפקידים חשובים ב -C. אלביקנס הדבקה ו פתוגנזה26. כמה חלבונים מועשרים (חיצים) בשברים שונים נצפו. זה עשוי לאפשר זיהוי של התגובות האימונולוגיים שלהם עם הנסיוב האנושי נגוע קנדידה ו/או זיהוי שלהם על ידי ספקטרומטר מסה. באופן דומה, חלבונים משברים סלולריים אחרים (למשל, ציטופלסמה וקיר התא) ניתן לשבר באמצעות שיטת הא. טיהור האנרגיה האנטי-מבוססי של השלב הנוזלי יאפשר זיהוי של חלבונים משפע נמוך מדגימות ביולוגיות מורכבות, כאשר יחד עם ניתוח ספקטרומטר המסה.
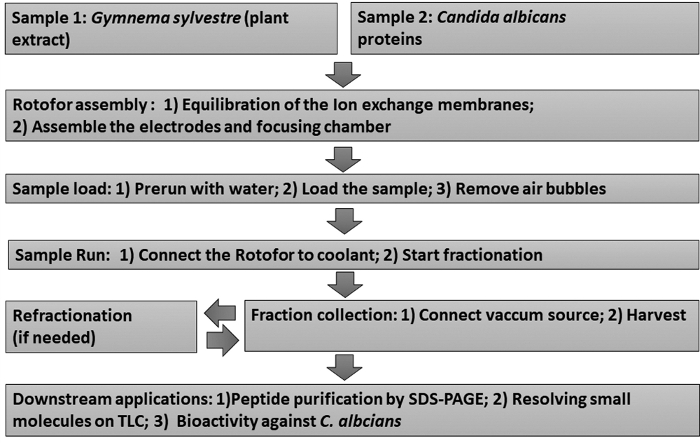
איור 1: תרשים זרימה המציג את זרימת העבודה הניסיונית. הליכי שבירה של שלב הנוזלים החורגים והבאים מתוארים במורד הזרם. הדגימות כוללות את התמצית של העלה (מדגם 1) וקנדידה אלביקנס לא-glucan לצרף חלבונים שמרים (לדוגמה 2). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 2: התקנת המנגנון והשבירה של G. סילבסטרי צמח תמצית. (א) במהלך הריצה (ב) במהלך איסוף השברים, (ג) לאחר איסוף השברים, ו-(ד) חלקים בעלי הגוף הנוזלי, 1) ממברנות יון החליפין, 2) התמקדות קאמרית וממברנה ליבה, 3) הרכבת אלקטרודה (שלילי), 4) אלקטרודה הרכבה (חיובית). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 3: ה-SDS-הפרדות העמוד של שברים של תמציות הצמחים הממוקדים. L-סולם, בקרת PC-חיוביים (פפטיד), מדגם 0-קלט, 1-20 שברים מופרדים. SDS-עמוד (15% לפתור ג'ל) היה מוכתם על ידי צבע כחול Coomassie כדי להמחיש את הפפטידים נפתרה (~ 5 kDa) משברים 1-20. שברים 1-3 מכילים מולקולות קטנות (שבר 1 יש צבע כהה יותר המציין תרכובות מועשר) אשר לא יכול להיות מוכתם/מזוהה על ידי צבע כחול Coomassie. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
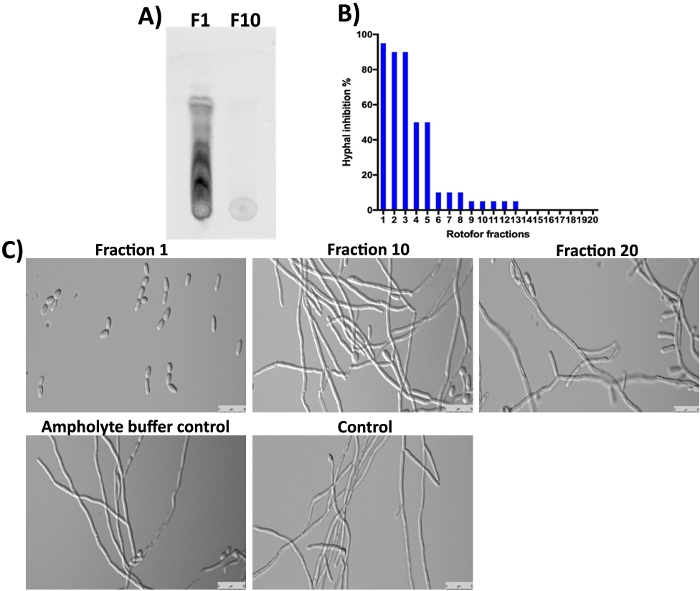
איור 4: ניתוח המולקולות הקטנות של האחים הללו באמצעות הטיפול ביולוגי וקביעת פעילות ביולוגית כנגד ה -C. אלביקנס. (א) הצגת ואנליזה של מולקולות קטנות מ#1 שבר ו#10. סיליקה ג'ל המופעל לוחית שימש לספוט ~ 5 μL של דגימות ורץ עם toluene: כלורופורם: מתנול ממס (5:8:3 יחס) עד החזית ממס הגיע לשוליים. החומרים המופרדים של האהבה זוהו תחת אור UV אפינטית (310 nm). (ב) מראה את% עיכוב של המרה של C. אלביקנס שמרים-to-hypha על ידי שברים שונים. (ג) מדגים את הורפולוגיה של התא של C. אלביקנס תחת hypha גרימת תנאים. שבר #1 מראה מקסימום (98%) עיכוב של ההמרה שמרים ל-hypha. שברים אחרים ושקרים להראות לא עיכוב של C. אלביקנס צמיחה hyphal אחרי 12 שעות של דגירה ב 37 ° c. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 5: sds-ניתוח עמודים של משטח התאים של C. אלביקנס חלבונים (שאינו ניתן לחיבור). L-סולם, 0-כניסות לדוגמה, 1-18 שברים שנאספו לאחר השימוש בתאי הקלט-משתמשים סטנדרטיים בשלב נוזלי באמצעות טווח צר (pH 5-8). התמונה מציגה SDS-עמוד (12.5%) חלבונים שנפתרו לאחר כתמים עם צבע כחול Coomassie. כמה חלבונים העשירו בשברים מסוימים (חיצים). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Discussion
מולקולות קטנות ממקורות המוצר הטבעי (למשל, צמחים) כוללים מטבוליטים מורכבים מאוד מגוונים מאוד במבנה כימי. הם מאמינים כי הם מעורבים במנגנוני ההגנה של הצמח. בנוסף, פוליפפטידים נמצאים גם ברקמות הצמח22. המוצר הטבעי הזה מולקולות קטנות הם מקורות עשירים של מולקולות בדיקה לגילוי סמים ופיתוח. עם זאת, השיטות הקשות ומייגע הנדרשות לבידוד וטיהור מגבילות את השימוש בהם ליישומים טיפוליים. הגישה בשלב הנוזלי של השימוש בדוח זה מדגישה את היכולת להפריד בין המולקולות הקטנות הללו לבין הפוליפונים מבלי להתפשר על הביו-פעילות שלהם.
שיטה זו המבוססת על הקשר מציעה מספר יתרונות בהפרדת מולקולות ביולוגיות כולל ריכוז חלבונים מטוהרים מתערובת מורכבת, תחזוקה של היווצרות מקורית במהלך ואחרי התמקדות שלהם, אוסף של דגימות כמו שברים מטוהרים בודדים ללא זיהום צולב. בעת הצורך, ניתן למקד דגימות מחדש עם טווח pH צר כדי לטהר את החלבון isoforms. מאז מיניאטורי תא התמקדות הסלולר (~ 15 mL) זמין, זה יכול לשמש עבור כמויות קטנות יותר של דגימות גם. הממצא החדש מדוח זה הוא כי מולקולות קטנות ופפטידים אורגניים ניתן להפריד מתמצית צמח מורכב. למרות שקשה להסכים כי מולקולות קטנות ניתן להפריד מתמציות מוצר טבעי על ידי ה-it, זה סביר עבור תרכובות אלה כי הם amphoteric. חומצות ג'ימנימיק אשר הופרדו מן פפטיד גוררין ב -G. סילבאסטרה להוציא להופיע amphoteric כפי שהם מכילים הקבוצה חומצה קרבוקסילית או שהם מתנהגים כך לפחות בנוכחות של האמולוציט בשימוש. מאז הגליפאות הן מולקולות ביואקטיביות טבעיות הדומות לחומצות ג'ימניקרופון, ניתן להשתמש בשיטת ה-"הארה" כדי להפריד ביניהן ממקורות טבעיים מורכבים. באופן דומה, פפטידים ממוצרים טבעיים עשויים גם להיות מבודדים באמצעות הגישה הזאת האנטי-משתמשים בשלב נוזלי.
חלק מההגבלות בגישה זו הן שלא כל המולקולות הקטנות יכולות להיות מפוגנות על ידי השיטה הבין-מלאכותית, כפי שהן חייבות להיות מסיסים במים ובלתי מואבקים, לפחות. התמצית משמש כאן הוכנו על ידי 50% מתנול החילוץ של חומר צמחי מיובש, אבל הוא מסיסים במים. השימוש בשיטת ה-הארה ב לתרכובות הממס והאמפיופאית נותר להראות כחלק מהממיסים האורגניים אינם תואמים לרכיבי המכשיר של הכלי. הנטייה של חלבונים כדי לזרז את נקודות איזואלקטריים שלהם (pI) בפתרונות כוח יוניים נמוכה ידועה היטב. עם זאת, במערכת החלפה, משקעים בחלבונים מופחתים כאשר החלבונים המתמקדים נשארים במחזור בנקודת הפאי שלהם.
אם אדם משתמש בריכוז גבוה של חלבונים בהפרדה הזאת, עלול להתרחש משקעים. כדי למזער את המשקעים בחלבון וכדי לשפר את התמקדות בחלבון, ניתן להשתמש באוריאה עד 3-5 מטרים Nonionic כגון ברנשים, דיגיטלי וריכוז נמוך של דטרגנטים (0.1-1%) יכולים לשמש גם כדי להפחית את צבירת החלבון במהלך השימוש ב-האו. עם זאת, אוריאה וחומרי ניקוי צריך להסיר לפני ניתוח החלבונים עבור פעילותם ובמקרים מסוימים, סוכנים אלה עשויים להשפיע על פונקציות חלבון. כמה צעדים קריטיים שכדאי לשקול במהלך הפעלת ה-it בשלב נוזלי כוללים את הטעינה של תא המיקוד ללא בועות אוויר, החלפת ממברנות היונים אם הם ניזוקו, והחלפת לחצני האוורור לאחר מספר מסוים של שימושים חוזרים.
לסיכום, באמצעות השיטה הנוזלית של הארה ב, הצגנו את הפרדת חומצות הביו-מיקרופון הביואקטיבית והגומארין מתמצית ה- G. סילבאסטרה . עוד, בשלב נוזלי הארה ב יכול להיות שימושי כדי להעשיר חלבונים סלקטיבית מתוך תמציות גולמי מורכבים של חיידקים פתוגניים.
Disclosures
המחברים רוצים להכריז לא על אינטרסים פיננסיים מתחרים.
Acknowledgements
אנו אסירי תודה על מקורות המימון של החטיבה לביולוגיה ומרכז ג'ונסון לחקר הסרטן עבור פרסים קצרים והרה, בהתאמה GV. אנו מודים גם לפרס הפוסט-דוקטורט של K-INBRE לקרוואן. עבודה זו נתמכת בחלקו של פרס הפיתוח המוסדי (הרעיון) מן המכון הלאומי למדעי הרפואה הכללית של המכון הלאומי לבריאות תחת מספר P20 GM103418. התוכן הוא אך ורק באחריות המחברים ואינו מייצג בהכרח את ההשקפות הרשמיות של המכון הלאומי למדעי הרפואה הכללית או המוסדות הלאומיים לבריאות. אנו מודים לסוקרים האנונימיים על הערותיהם השימושיות.
Materials
| Name | Company | Catalog Number | Comments |
| 0.45 µm syringe filter | Fisher scientfic | 09-720-004 | |
| 2-Mercaptoethanol | Sigma | M3148 | |
| Ammonium carbonate | Sigma-Aldrich | 207861-500 | |
| Bio-Lyte 3/10 Ampholyte | Bio-Rad | 163-1113 | |
| Bio-Lyte 5/8 Ampholyte | Bio-Rad | 163-1192 | |
| Compact low temperature thermostat | Lauda -Brinkmann | RM 6T | Set water cooling to 4 oC and it can be run even at 0 oC as when it passes through the Rotofor cooling core, the circulating water temperature will be around 5 or more depending on the voltage. |
| Coomassie Brilliant Blue R | Sigma-Aldrich | B7920 | |
| Dialysis tubing (3,500 MWCO) | Spectrum Spectra/Por | 132112T | |
| Gymnema plant leaf extract powder (>25% Gymnemic acids) | Suan Farma, NJ USA | ||
| Incubator | Lab companion | SI 300R | |
| Microscope | Leica | DM 6B | |
| Mini protean electrophoresis | Bio-Rad | ||
| pH meter | Mettler Toledo | S20 | Useful to determine the pH of the Rotofor (liquid-phase IEF) fractions |
| Rotofor | Bio-Rad | 170-2972 | http://www.bio-rad.com/webroot/web/pdf/lsr/literature/M1702950E.pdf (Rotofor Instruction manual for assembling the unit) |
| RPMI-1640 Medium | HyClone | DH30255.01 | |
| Sealing tape | Bio-Rad | 170-2960 | Scotch tape may also be used. |
| Sorvall legend micro 17 centrifuge | Thermo scientific | 75002432 | |
| TPP tissue culture plate -96 well flat bottom | TPP | TP92696 |
References
- Jankowska, U., et al. Optimized procedure of extraction, purification and proteomic analysis of nuclear proteins from mouse brain. Journal of Neuroscience Methods. 261, 1-9 (2016).
- Pergande, M. R., Cologna, S. M. Isoelectric Point Separations of Peptides and Proteins. Proteomes. 5 (1), (2017).
- Stoyanov, A. IEF-based multidimensional applications in proteomics: toward higher resolution. Electrophoresis. 33 (22), 3281-3290 (2012).
- Vesterberg, O. A. Y. Method of Isoelectric Fractionation. , US3485736A (1964).
- Vesterberg, O., Svensson, H. Isoelectric fractionation, analysis, and characterization of ampholytes in natural pH gradients. IV. Further studies on the resolving power in connection with separation of myoglobins. Acta Chemica Scandinavica. 20 (3), 820-834 (1966).
- Righetti, P. G. Isoelectric Focusing: Theory, Methodology and Applications. , Elsevier Science. 1(1983).
- Vesterberg, O. Synthesis and Isoelectric Fractionation of Carrier Ampholytes. Acta Chemica Scandinavica. 23, 2653-2666 (1969).
- Bier, M. Recycling isoelectric focusing and isotachophoresis. Electrophoresis. 19 (7), 1057-1063 (1998).
- Bier, M., Palusinski, O. A., Mosher, R. A., Saville, D. A. Electrophoresis: mathematical modeling and computer simulation. Science. 219 (4590), 1281-1287 (1983).
- Ayala, A., Parrado, J., Machado, A. Use of Rotofor preparative isoelectrofocusing cell in protein purification procedure. Applied Biochemistry and Biotechnology. 69 (1), 11-16 (1998).
- Wagner, L., et al. Isolation of dipeptidyl peptidase IV (DP 4) isoforms from porcine kidney by preparative isoelectric focusing to improve crystallization. Biological Chemistry. 392 (7), 665-677 (2011).
- Hosken, B. D., Li, C., Mullappally, B., Co, C., Zhang, B. Isolation and Characterization of Monoclonal Antibody Charge Variants by Free Flow Isoelectric Focusing. Analytical Chemistry. 88 (11), 5662-5669 (2016).
- Yu, J. J., et al. Francisella tularensis T-cell antigen identification using humanized HLA-DR4 transgenic mice. Clinical Vaccine Immunology. 17 (2), 215-222 (2010).
- Riyong, D., et al. Size and charge antigens of Dirofilaria immitis adult worm for IgG-ELISA diagnosis of bancroftian filariasis. Southeast Asian Journal of Tropical Medicine and Public Health. 41 (2), 285-297 (2010).
- Vediyappan, G., Bikandi, J., Braley, R., Chaffin, W. L. Cell surface proteins of Candida albicans: preparation of extracts and improved detection of proteins. Electrophoresis. 21 (5), 956-961 (2000).
- Vediyappan, G., Dumontet, V., Pelissier, F., d'Enfert, C. Gymnemic acids inhibit hyphal growth and virulence in Candida albicans. PLoS One. 8 (9), 74189(2013).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry. 72, 248-254 (1976).
- Laemmli, U. K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 227 (5259), 680-685 (1970).
- Riazi, S., Dover, S., Turovskiy, Y., Chikindas, M. L. Commercial ampholytes used for isoelectric focusing may interfere with bioactivity based purification of antimicrobial peptides. Journal of Microbiological Methods. 71 (1), 87-89 (2007).
- Kamei, K., Takano, R., Miyasaka, A., Imoto, T., Hara, S. Amino-Acid-Sequence of Sweet-Taste-Suppressing Peptide (Gurmarin) from the Leaves of Gymnema-Sylvestre. Journal of Biochemistry. 111 (1), 109-112 (1992).
- Craik, D. J. Chemistry. Seamless proteins tie up their loose ends. Science. 311 (5767), 1563-1564 (2006).
- Craik, D. J., Daly, N. L., Bond, T., Waine, C. Plant cyclotides: A unique family of cyclic and knotted proteins that defines the cyclic cystine knot structural motif. Journal of Molecular Biology. 294 (5), 1327-1336 (1999).
- Stoecklin, W. Chemistry and physiological properties of gymnemic acid, the antisaccharine principle of the leaves of Gymnema sylvestre. Journal of Agricultural and Food Chemistry. 17 (4), 704-708 (1969).
- Liu, H. M., Kiuchi, F., Tsuda, Y. Isolation and structure elucidation of gymnemic acids, antisweet principles of Gymnema sylvestre. Chemical & Pharmaceutical Bulletin (Tokyo). 40 (6), 1366-1375 (1992).
- Veerapandian, R., Vediyappan, G. Gymnemic Acids Inhibit Adhesive Nanofibrillar Mediated Streptococcus gordonii-Candida albicans Mono-Species and Dual-Species Biofilms. Frontiers in Microbiology. 10, 2328(2019).
- Chaffin, W. L. Candida albicans cell wall proteins. Microbiology and Molecular Biology Reviews. 72 (3), 495-544 (2008).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved