Method Article
Trennung von bioaktiven kleinen Molekülen, Peptiden aus natürlichen Quellen und Proteinen aus Mikroben durch Präparative Isoelektrische Fokussierung (IEF) Methode
In diesem Artikel
Zusammenfassung
Ziel ist es, bioaktive kleine Moleküle, Peptide aus einem komplexen Pflanzenextrakt und Proteine aus pathogenen Mikroben durch die Anwendung der Flüssigphasen-Isotonisierungsmethode (IEF) zu fraktionieren und zu isolieren. Darüber hinaus wurden die getrennten Moleküle identifiziert und ihre Bioaktivität bestätigt.
Zusammenfassung
Natürliche Produkte aus Pflanzen und Mikroben sind eine reiche Quelle bioaktiver Moleküle. Vor ihrer Verwendung müssen die aktiven Moleküle aus komplexen Extrakten für nachgeschaltete Anwendungen gereinigt werden. Es gibt verschiedene chromatographische Methoden für diesen Zweck zur Verfügung, aber nicht alle Labore können sich Hochleistungsmethoden leisten und die Isolierung von komplexen biologischen Proben kann schwierig sein. Hier zeigen wir, dass präparative flüssige Phasen-Isoelektrische Fokussierung (IEF) Moleküle, einschließlich kleiner Moleküle und Peptide, von komplexen Pflanzenextrakten trennen kann, basierend auf ihren isoelektrischen Punkten (pI). Wir haben die Methode zur komplexen biologischen Probenfraktionierung und Charakterisierung eingesetzt. Als Beweis des Konzepts, Wir fraktioniert einen Gymnema sylvestre Pflanzenextrakt, Isolierung einer Familie von Terpenoid Saponin kleine Moleküle und ein Peptid. Wir haben auch eine effektive mikrobielle Proteintrennung mit dem Candida albicans Pilz als Modellsystem demonstriert.
Einleitung
Die Reinigung von Biomolekülen aus komplexen biologischen Proben ist ein wesentlicher und oft schwieriger Schritt in biologischen Experimenten1. Isoelektrische Fokussierung (IEF) eignet sich gut für die hochauflösende Trennung komplexer Biomoleküle, bei denen Trägerampholyten nach ihrer Ladung reisen und den pH-Gradienten in einem elektrischen Feld3festlegen. Die erste kommerzielle Trägerampholyte für IEF wurde 1964 von Olof Vesterberg entwickelt und4,5patentiert. Trägerampholyte sind aliphatische Oligo-Amino-Oligo-Carbonsäuremoleküle unterschiedlicher Länge und Verzweigung6. Anschließend verbesserten Vesterberg und andere die Trägerampholyten für ihren erweiterten Einsatz bei der Trennung von Biomolekülen6,7.
Zu den Methoden zur Trennung von Biomolekülen gehören Agarose und Polyacrylamid-Gelelektrophorese, zweidimensionale Gelelektrophorese (2-DE), isoelektrische Fokussierung, Kapillarelektrophorese, Isotachophorese und andere chromatographische Techniken (z.B. TLC, FPLC, HPLC)2. Liquid-Phase IEF in einem Instrument namens "Rotofor" durchgeführt wurde von Milan Bier8erfunden. Er war Pionier des Konzepts und der Gestaltung dieses Instruments und trug maßgeblich zur Theorie der elektrophoretischen Migration bei. Sein Team entwickelte auch ein mathematisches Modell des elektrophoretischen Trennverfahrens für Computersimulationen9.
Das Flüssigphasen-IEF-Gerät ist eine horizontal rotierende zylindrische Zelle, die aus einem Nylonkern besteht, der in 20 poröse Fächer und einen zirkulierenden Wasserkühlkeramikstab unterteilt ist. Die porösen Kammern ermöglichen es Molekülen, durch die wässrige Phase zwischen den Elektroden zu wandern und die Sammlung von gereinigten Proben unter Vakuum in Fraktionen zu ermöglichen. Dieses Reinigungssystem kann bis zu 1000-fache Reinigung eines bestimmten Moleküls in <4 Stunden ermöglichen. Ein wertvolles Merkmal dieses Instruments ist, dass es als erster Schritt für die Reinigung aus einer komplexen Mischung oder als letzter Schritt zur Erreichung der Reinheit10angewendet werden kann. Wenn das Molekül von Interesse ein Protein ist, ist ein weiterer Vorteil, dass seine native Konformation während der Trennung erhalten bleibt.
Die Verwendung von Flüssigphase IEF wurde weithin für Proteine, Enzyme und Antikörper-Reinigung6,10,11,12,13,14berichtet. Hier beschreiben wir die Verwendung dieses Ansatzes zur Trennung und Reinigung kleiner Moleküle und Peptide von der Heilpflanze Gymnema sylvestre. Dieses Protokoll wird Forschern helfen, aktive kleine Moleküle aus einem Pflanzenextrakt für nachgelagerte Anwendungen kostengünstig zu konzentrieren und zu reinigen. Darüber hinaus zeigen wir auch, dass die Anreicherung von Proteinen aus einem komplexen Proteinextrakt aus Candida albicans Pilz15 in diesem IEF-basierten System als zweites Beispiel.
Protokoll
1. Einrichtung und Vorlauf der Standard-Flüssigphasen-IEF-Einheit
- Montieren Sie die flüssigen Phasen-IEF-Elektroden (anodenroter Knopf und Kathoden-Schwarzknopf) mit ihren jeweiligen Austauschmembranen gemäß der Bedienungsanleitung (siehe Materialtabelle). Gleichgewichten Sie die Anionenaustauschmembranen mit 0,1 M NaOH und die Kationenaustauschmembranen mit 0,1 M H3PO4 mindestens für 16 h, wenn neue Membranen verwendet werden.
- Bewahren Sie die Membranen zwischen den Durchläufen in Elektrolyten (0,1 M NaOH oder 0,1 M H3PO4) auf und lassen Sie sie nicht austrocknen.
- Montieren Sie den inneren und äußeren Teil der Elektrode, indem Sie drei längs in den Ionenaustauschdichtungen ausrichten. Füllen Sie die Elektroden mit entsprechenden Elektrolyten (ca. 25-30 ml), um ein Austrocknen ihrer Membranen zu verhindern.
- Fügen Sie keinen überschüssigen Elektrolyten (mehr als 1/3rd des Elektrodenkammervolumens) hinzu, der Druck innerhalb der Elektrode aufbauen und Leckagen verursachen kann.
- Bedecken Sie die Probenentnahmeports mit Dichtungsband, das mit den Instrumentenbaugruppenteilen enthalten ist (siehe Tabelle der Materialien). Die Seite der Probenentnahmeanschlüsse kann durch die beiden vertikalen Metallausrichtungsstifte identifiziert werden. Alternativ können Sie Standard-Dichtungsband verwenden, um die Anschlüsse zu versiegeln.
- Montieren Sie alle Teile der Fokussierkammerbaugruppe nacheinander (Anodenelektrode, Nylonmembrankern, Fokussierkammer und Kathodenelektrode) über den keramischen Kühlfinger.
- Füllen Sie die Fokussierkammer mit vorgekühltem destilliertem Wasser (Gesamtvolumen von 60 ml für die Standard-IEF-Zelle) mit einer 50 ml Spritze.
- Schließen Sie das Flüssigphasen-IEF-Instrument an ein zirkulierendes Kühlwasser bei 4 oC an und führen Sie das Gerät bei 15 W und 3.000 V für 3-5 min voroder bis sich die Spannung stabilisiert.
HINWEIS: Im Allgemeinen erreicht die Spannung innerhalb einer Minute die maximalen solligen Werte. Das Vorlaufen mit destilliertem Wasser hilft, die Restionen aus der Fokussierkammer und dem Nylonmembrankern zu entfernen. - Schalten Sie die Stromquelle aus und entfernen Sie das Wasser aus der Zelle mit dem Fraktionskollektor. Versiegeln Sie die Sammelanschlüsse erneut mit Dichtband.
HINWEIS: Jetzt ist das Instrument in Schritt 2.4 einsatzbereit.
2. Trennung und Reinigung von kleinen Molekülen und Peptiden aus Gymnema sylvestre Extrakt
- 0,6 g Pflanzenextrakt messen und in destilliertem Wasser (60 ml) durch Mischen in einem Rollenrohr für 5 min auflösen.
HINWEIS: Jede biologische Probe, die löslich und salzfrei ist, kann mit diesem IEF-Instrument zur Trennung und Reinigung verwendet werden. Proben mit puffernder Salzkonzentration bis zu 10 mM können mit leicht verringerter Auflösung verwendet werden. Wir interessieren uns für die Saponin-Familie von Triterpenoid-Verbindungen, die Gymnemsäuren, aus G. sylvestre Pflanze für ihre einzigartigen antimykotischen Eigenschaften16. - Zentrifugieren Sie den löslichen Pflanzenextrakt bei 10.000 x g für 5 min, um unlösliche Partikel zu entfernen.
- Übertragen Sie den Überstand (ca. 60 ml) auf ein 80 ml Zentrifugenrohr und mischen Sie ihn mit 0,6 ml Ampholyt (pH 3-10) auf 1% (v/v).
- Befolgen Sie die Schritte 1.1 – 1.7, um die Flüssigphasen-IEF-Einheit vorzubereiten. Die Kammer ist nun bereit, die Probe zu laden.
- Verwenden Sie eine 50 ml Spritze mit einer 1-1/2 Zoll 19 G stumpfen Endnadel (kommt mit dem Instrument) und laden Sie die vorbereitete Probe mit Ampholyt (60 ml gesamt) in die Zelle durch Probenentnahmeports.
- Entfernen Sie Luftblasen aus der Probenzelle, indem Sie die Fokussierzelle aus dem Ständer entfernen und auf die Elektrodenkammer tippen, um die Blasen zu lösen. Das Vorhandensein von Luftblasen wird Spannungs- und Stromschwankungen verursachen und den Lauf beeinflussen.
- Schließen Sie das Gerät an das Wasserkühlmittel (4 °C) an und starten Sie die Fraktionierung mit dem Netzteil bei konstant 15 W.
- Führen Sie das Gerät 3 h oder bis die Spannung einen konstanten Wert erreicht.
HINWEIS: Wenn die Probe beginnt zu fokussieren, beginnt die Spannung allmählich zu klettern, bis sie einen konstanten Wert erreicht. - Nach dem Lauf bereiten Sie sich darauf vor, die mit der Vakuumpumpe verbundenen Fraktionen im Erntekasten (mit 20 Kunststoffrohren, 12 mm x 75 mm, 5-6 ml Volumen) zu sammeln, die mit der Vakuumpumpe verbunden sind, indem Sie den Ernteknopf EIN in der IEF-Einheit drücken.
- Richten Sie die 20-Sammlungs-Pins an den 20-Sammlungs-Ports der Fokussierzelle aus, die mit dem Band versiegelt ist.
- Drücken Sie die Sammelstifte durch das Dichtband und schalten Sie die Vakuumpumpe gleichzeitig ein (siehe Abbildung 2B, 2C & 2D).
HINWEIS: Etwa 3 ml Fraktionen aus jeder Kammer werden für jedes Mal in die Rohre gesammelt. Fraktionen können für nachfolgende nachgeschaltete Anwendungen verwendet werden (SDS-PAGE für Peptidquantifizierung, TLC und Bioassay für kleine Moleküle).
3. Trennung und Reinigung von Proteinen aus C. albicans
- Einzelne Kolonie von C. Albicans in Hefe-Pepton-Dextrose (YPD) Brühe16 bei 30 °C mit Schütteln (200 U/min) für die Nacht wachsen.
- Sammeln Sie die Hefezellen durch Zentrifugation (10.000 x g für 5 min).
- Hefezellen in Ammoniumcarbonat (1,89 g/L) mit einem Beta-Mercaptoethanol (1/10 des Kulturvolumens) in einem Walzenrohr um 1 h bei 5 °C15drehen.
- Entfernen Sie die Hefezellen durch Zentrifugation (10.000 x g für 5 min) und filtern Sie den Proteinextrakt durch einen 0,45 m Filter.
HINWEIS: Proteinproben aus C. albicans Cytosol, Membran oder Zellwand können für die IEF-Fraktionierung hergestellt und verwendet werden. Ebenso können Proteine aus Bakterien oder anderen biologischen Proben (Tiergewebeextrakt) nach Entfernung von Salz durch geeignete Methoden(z. B.durch Dialyse oder mit Entsalzungssäulen) verwendet werden. - Dialyse den Proteinextrakt in einem Dialyseschlauch (3.500 MWCO) gegen Wasser für 15 h bei 4 °C. Schätzen Sie die Proteinkonzentration nach der Bradford-Färbebindungsmethode unter Verwendung von Gammaglobulin als Standard17.
- Verwenden Sie 500 mg Gesamtprotein in 60 ml Wasser, das 1% (v/v) Ampholyt (pH 5-8) für die Fraktionierung enthält.
HINWEIS: Da ein Breitbereichs-Ampholyt (pH 3-10) bestimmte nicht glucan-gebundene Zellwandproteine von C. albicans nicht gut anreichert, verwenden Sie ein Engbereichs-Ampholyt (pH 5-8). Eine Ampholytkonzentration von bis zu 2% kann verwendet werden, wenn die Probenproteinkonzentration mehr als 2 mg/ml beträgt; Dies minimiert die Proteinaggregation während der Fokussierung. Bewahren Sie die Proben, Ampholyten und Wasser immer auf Eis auf. - Wiederholen Sie die Schritte 1.1- 1.7, um die IEF-Einheit vorzubereiten, und verwenden Sie die Proteinlösung ab Schritt 3.6, um sie in die IEF-Zelle zu laden.
- Nach 4 h Fokussierung bei konstant 15 W, Ernten Sie Proteinfraktionen (1-20) wie oben beschrieben (Schritte 2.9-2.11) und analysieren Sie auf 12,5% SDS-PAGE nach Reduktion und Kochen der Proteinproben18.
- Färben Sie die gelösten Proteine, indem Sie das SDS-PAGE-Gel mit dem Coomassie-Blaufarbstoff färben (0,01%) Lösung für 2-3 h bei Raumtemperatur auf einer Wippe. Entzähen Sie das Gel und zeichnen Sie das Gelbild mit einem Gel-Imager auf.
HINWEIS: Coomassie blauer Farbstoff (0,01%) kann durch Mischen von 0,01 g Coomassie-Blaupulver in einer entzähnten Lösung mit 40% Methanol und 10% Essigsäure hergestellt werden.
4. Bioaktivität von gereinigten kleinen Molekülen aus Pflanzenextrakt Gymnema sylvestre
- Wachsen Sie C. albicans in Hefezellen wie in Schritt 3.1.
- Zur Vorbereitung der Zellsuspension die Nachtkultur von C. albicans Hefezellen (1/1000 Verdünnung) in ein frisches RPMI-Zellkulturmedium, das mit 50 mM Glukose ergänzt wird.
HINWEIS: C. Albicans wandelt von Hefewachstum zu Hyphen unter Hyphal-induzierenden Bedingungen um (RPMI bei 37 °C). Gymnemic Säure kleine Moleküle werden gezeigt, um die Umwandlung von Hefezellen in Hyphen unter Hypha induzierenden Bedingungen zu hemmen16. Wir wollten herausfinden, ob flüssigphasen-IEF-getrennte G. sylvestre Extrakt diese bioaktiven Moleküle enthalten. - Von der vorbereiteten Zellsuspension 90 l zu jedem Brunnen der 96-Well-Platte hinzufügen.
- Aus jeder Fraktion (1-20 geerntete Fraktionen des G. sylvestre Extraktes aus flüssiger Phase IEF, Abbildung 4),fügen Sie 10 l in die Brunnen mit 90 l der oben genannten Zellsuspension (Schritt 4.2) hinzu. Führen Sie den Test in dreifacher Ausführung durch.
- Fügen Sie 10 l Wasser hinzu, das Ampholyt enthält (1%) in separate Brunnen mit 90 l C. albicans Hefezellsuspension als Negativkontrolle.
HINWEIS: Ampholyten haben Bioaktivitätspotenzial und daher ist es wichtig, eine Ampholyt-Kontrolle bei der Durchführung eines Bioassays19einzuschließen. - Inkubieren Sie die 96-Well-Platte bei 37 °C für 12 h und beobachten Sie die Hemmung der C. albicans Hefe-zu-Hyphen-Umwandlung unter dem Mikroskop16. Bestimmen Sie auch den Prozentsatz der Hemmung der Hefe-zu-Hyphen-Umwandlung.
Ergebnisse
Trennung und Reinigung von kleinen Molekülen und Peptiden aus Gymnema sylvestre Pflanzenextrakt
Mit der präparativen Flüssigphase IEF-Methode fraktionierten wir medizinische Pflanzenextrakte und Zelloberflächenproteine aus einem menschlichen pathogenen Pilz, C. albicans. Ein Schaltplan dieser Fraktionierungsprotokolle ist in Abbildung 1dargestellt.
Aus 20 Fraktionen des G. sylvestre-Extrakts aus flüssiger Phase IEF wurden die dunkel gefärbten Moleküle (Terpenoidsaponine) gefunden, die am Anodenende (pH 2-3) wanderten und angereichert wurden, und die hellgelben klaren Fraktionen wurden am Kathodenende beobachtet (pH 8-9) (Abbildung 2). Aliquots (20 l) aus jeder Fraktion (1-20) wurden auf 15% SDS-PAGE nach Demreduzieren und Kochen der Proben aufgelöst. Ein Coomassie blau gefärbtes Gel zeigt das diffuse Polypeptidband von etwa 5 kDa, das in den Fraktionen 16-19 angereichert ist (Abbildung 3). Es wurde berichtet, dass die G. sylvestre Pflanze ein 35 Aminosäure gurmarin basisiges Polypeptid mit dem vorhergesagten Molekulargewicht von 4.209 Da20enthält. Bakterien, Pflanzen und Tiere enthalten Peptide; viele von ihnen sind kreisförmig (Knoten) und stabil mit einer breiten Palette von biologischen Aktivitäten wie insektizide und antimikrobielle Eigenschaften21,22.
Biologische Aktivität abgetrennter Gymnansäuren
Die G. sylvestre Pflanze enthält auch Gymnansäuren (Terpenoid saponine) als Hauptbestandteile16,23,24. Wie erwartet wurden diese kleinen Moleküle in Fraktion 1 und die nächsten Fraktionen nicht durch SDS-PAGE und Coomassie-Färbung nachgewiesen (Abbildung 3), da sie nicht proteinaceous sind. Diese kleinen Moleküle können jedoch durch TLC getrennt und unter UV-Licht detektiert werden (Abbildung 4A, Spur F1). Fraktion 10 enthielt keine nachweisbare Menge dieser kleinen Moleküle auf TLC, was darauf hindeutet, dass die meisten organischen kleinen Moleküle in den Fraktionen 1-3 angereichert wurden. Gymnemsäuren (GAs) Moleküle wurden gezeigt, um C. albicans Hefe-zu-Hyphen Übergang16,25hemmen. Wir untersuchten alle 20 Fraktionen, die in dieser Studie gesammelt wurden, auf ihre hemmende Aktivität gegen C. albicans Hefe-zu-Hyphen-Konvertierung und Hyphenwachstum16. Die Ergebnisse sind in Abbildung 4B,4Cdargestellt. Die höchste Aktivität wird in Fraktion 1 beobachtet, die mit den TLC-Ergebnissen übereinstimmt, wo mehrere Flecken zu sehen sind. Isomer von Gymnansäuren existieren und alle haben ähnliche biologische Aktivitäten10. Diese Isomere wurden in Fraktion 1-3 getrennt und zeigen eine Hemmung des Hyphalwachstums von C. albicans (Abbildung 4A,4C, Fraktion 1). Der Grad der Hypahypo-Hemmung wurde allmählich verringert, da es von 1 auf 10 geht. In den Fraktionen 10 und höher wurde wenig oder gar keine Aktivität erzielt.
Trennung von Zelloberflächenproteinen von pathogenen Pilzen, C. albicans
Die Ergebnisse der Flüssigphasen-IEF-Fraktionierung von C. albicans-Zelloberflächenproteinen sind in Abbildung 5dargestellt. Diese Zelloberflächenproteine spielen eine wichtige Rolle bei c. albicans Adhäsion und Pathogenese26. Es wurden mehrere angereicherte Proteine (Pfeile) in verschiedenen Fraktionen beobachtet. Dies kann die Identifizierung ihrer immunologischen Reaktionen mit Candida-infiziertem humanem Serum und/oder ihre Identifizierung durch Massenspektrometrie ermöglichen. Ebenso können Proteine aus anderen zellulären Fraktionen (z. B. Zytoplasma und Zellwand) mit dieser IEF-Methode fraktioniert werden. Die Flüssigphasen-IEF-basierte Reinigung ermöglicht die Identifizierung von Proteinen mit geringer Häufigkeit aus komplexen biologischen Proben, wenn sie mit der Analyse der Massenspektrometrie gekoppelt ist.
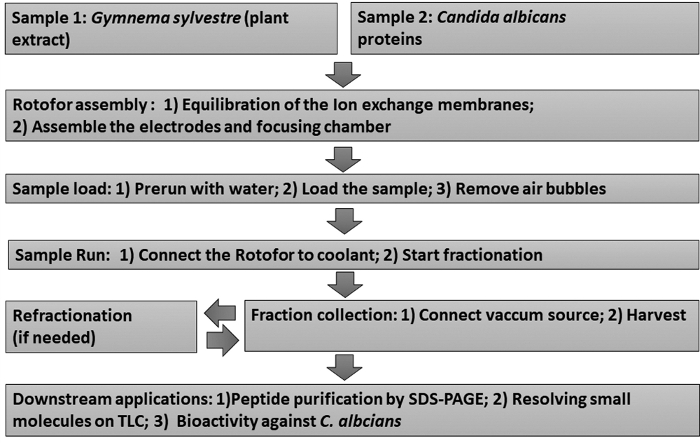
Abbildung 1: Flussdiagramm mit dem experimentellen Workflow. Stufenweise Flüssigphasen-IEF-Fraktionierungsverfahren und nachfolgende nachgeschaltete Assays werden dargestellt. Zu den Proben gehören Gymnema sylvestre Blattextrakt (Probe 1) und Candida albicans non-glucan attached hefe proteine (Probe 2). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Aufbau von Flüssigphasen-IEF-Geräten und Fraktionierung des G. sylvestre Pflanzenextrakts. (A) Während des Laufs, (B) während der Bruchaufnahme, (C) nach Bruchaufnahme und (D) Flüssigphasen-IEF-Geräteteile, 1) Ionenaustauschmembranen, 2) Fokussierkammer und Membrankern, 3) Elektrodenbaugruppe (negativ), 4) Elektrodenbaugruppe (positiv). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: SDS-PAGE-Trennungen der IEF-fokussierten Pflanzenextraktfraktionen. L- Leiter, PC- Positive Steuerung (Peptid), 0 - Eingangsprobe, 1-20 getrennte Fraktionen. SDS-PAGE (15% Auflösungsgel) wurde von Coomassie blauer Farbstoff gefärbt, um die gelösten Peptide (ca. 5 kDa) aus den Fraktionen 1-20 zu visualisieren. Die Fraktionen 1-3 enthalten kleine Moleküle (Fraktion 1 hat eine dunklere Farbe, die angereicherte Verbindungen anzeigt), die von Coomassie blue farbstoff nicht gebeizt/detektiert werden können. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
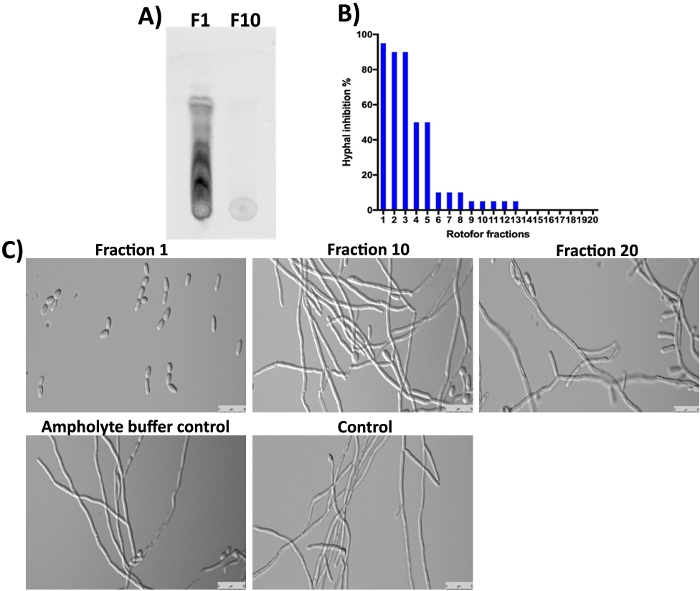
Abbildung 4: Analyse von IEF fraktionierten kleinen Molekülen durch TLC und Bestimmung der Bioaktivität gegen C. Albicans. (A) Zeigt die TLC-Analyse kleiner Moleküle aus #1 und #10. Aktivierte Kieselgelplatte wurde verwendet, um Proben zu erkennen und lief mit Toluol: Chloroform: Methanol-Lösungsmittel (5:8:3-Verhältnis), bis die Lösungsmittelfront den Rand erreichte. TLC-getrennte Verbindungen wurden unter einem Epifluoreszenz-UV-Licht (310 nm) nachgewiesen. (B) Zeigt die % Hemmung der C. albicans Hefe-zu-Hyphen-Umwandlung durch verschiedene Fraktionen. (C) Demonstriert die Zellmorphologie von C. albicans unter Hypha-induzierenden Bedingungen. Anteil #1 zeigt maximal (98%) Hemmung der Hefe-zu-Hyphen-Umwandlung. Andere Fraktionen und Kontrollen zeigen keine Hemmung des Hyphalwachstums von C. albicans nach 12 Stunden Inkubation bei 37 °C. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 5: SDS-PAGE-Analyse von C. albicans Zelloberflächenproteinen (nicht glucan angehängt). L- Leiter, 0 - Eingangsprobe, 1-18 Fraktionen, die nach IEF in einer Standard-Flüssigphasen-IEF-Zelle mit einem schmalen Bereich (pH 5-8) Ampholyt gesammelt wurden. Das Bild zeigt SDS-PAGE (12.5%) gelöste Proteine nach der Färbung mit Coomassie blauer Farbstoff. Mehrere Proteine wurden in bestimmten Fraktionen (Pfeile) angereichert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Kleine Moleküle aus natürlichen Produktquellen (z. B. Pflanzen) umfassen komplexe sekundäre Metaboliten, die in der chemischen Struktur sehr unterschiedlich sind. Es wird angenommen, dass sie an Pflanzenabwehrmechanismen beteiligt sind. Darüber hinaus sind Polypeptide auch in Pflanzengeweben22vorhanden. Diese natürlichen Produkt kleine Moleküle sind reiche Quellen von Testmolekülen für die Entdeckung und Entwicklung von Medikamenten. Die schwierigen und mühsamen Methoden, die für ihre Isolierung und Reinigung erforderlich sind, schränken jedoch ihre Verwendung für therapeutische Anwendungen ein. Der in diesem Bericht verwendete IEF-Ansatz der Flüssigphase unterstreicht die Fähigkeit, diese kleinen Moleküle und Polypeptide zu trennen, ohne ihre Bioaktivitäten zu beeinträchtigen.
Diese IEF-basierte Methode bietet mehrere Vorteile bei der Trennung biologischer Moleküle, einschließlich der Konzentration von gereinigten Proteinen aus einem komplexen Gemisch, der Aufrechterhaltung der nativen Konformation während und nach ihrer Fokussierung und der Entnahme von Proben als einzelne gereinigte Fraktionen ohne Kreuzkontamination. Bei Bedarf können Proben mit einem engen pH-Bereich neu fokussiert werden, um Proteinisoformen zu reinigen. Da eine Miniatur-IEF-Fokussierungszelle (ca. 15 ml) zur Verfügung steht, kann sie auch für kleinere Probenmengen verwendet werden. Die neue Erkenntnis aus diesem Bericht ist, dass organische kleine Moleküle und Peptide von einem komplexen Pflanzenextrakt getrennt werden können. Obwohl es schwierig ist, sich darauf zu einigen, dass kleine Moleküle von natürlichen Produktextrakten durch IEF getrennt werden können, ist es plausibel für die Verbindungen, die amphoter sind. Die Gymnemsäuren, die vom Gurmarin-Peptid im G. sylvestre Extrakt getrennt wurden, scheinen amphoter zu sein, da sie eine Carbonsäuregruppe enthalten oder sich zumindest in Gegenwart der verwendeten Ampholyt verhalten. Da Glykoside bioaktive natürliche Moleküle sind, die Gymnansäuren ähneln, kann die IEF-Methode verwendet werden, um sie von komplexen natürlichen Quellen zu trennen. In ähnlicher Weise können Peptide aus natürlichen Produkten auch mit diesem Flüssigphasen-IEF-Ansatz isoliert werden.
Einige der Einschränkungen in diesem Ansatz sind, dass nicht alle kleinen Moleküle durch die IEF-Methode fraktioniert werden können, da sie wasserlöslich und schwach amphoter sein müssen, zumindest. Der hier verwendete Extrakt wurde durch eine 50%ige Methanolextraktion von getrocknetem Pflanzenmaterial hergestellt, ist aber wasserlöslich. Die Verwendung des IEF-Verfahrens für lösungsmittellösliche und amphotere Verbindungen bleibt zu sehen, da einige der organischen Lösungsmittel mit den Flüssigphasen-IEF-Instrumentenkomponenten nicht kompatibel sind. Die Tendenz von Proteinen, an ihren isoelektrischen Punkten (pI) in Lösungen mit niedriger Ionenstärke auszubrechen, ist bekannt. In einem rotierenden IEF-System wird die Proteinfällung jedoch reduziert, da die fokussierten Proteine an ihrem pI-Punkt im Umlauf bleiben.
Wenn man bei dieser IEF-Trennung eine hohe Konzentration von Proteinen verwendet, kann es zu Fällungen kommen. Um die Proteinausfällung zu minimieren und die Proteinfokussierung zu verbessern, kann Harnstoff bis zu 3-5 M verwendet werden. Nichtionische Reinigungsmittel wie CHAPS, Digitonin und niedrige Konzentration von Reinigungsmitteln (0,1-1%) kann auch verwendet werden, um die Proteinaggregation während der IEF zu reduzieren. Harnstoff und Reinigungsmittel müssen jedoch entfernt werden, bevor die Proteine auf ihre Aktivität analysiert werden, und in einigen Fällen können diese Wirkstoffe die Proteinfunktionen beeinträchtigen. Zu den kritischen Schritten, die während eines IEF-Laufs in der Flüssigphase zu berücksichtigen sind, gehören das Laden der IEF-Fokussiierungszelle ohne Luftblasen, das Ersetzen der Ionenaustauschmembranen, wenn sie beschädigt wurden, und das Ersetzen der Entlüftungstasten nach einer bestimmten Anzahl wiederholter Verwendungen.
Zusammenfassend haben wir mit der Flüssigphasen-IEF-Methode die Trennung von bioaktiven Gymnansäuren und Gurmarin-Polypeptid aus dem G. sylvestre Blattextrakt gezeigt. Darüber hinaus kann flüssige Phase IEF nützlich sein, um selektive Proteine aus den komplexen Rohextrakten pathogener Mikroben anzureichern.
Offenlegungen
Die Autoren möchten keine konkurrierenden finanziellen Interessen erklären.
Danksagungen
Wir sind dankbar für die Finanzierungsquellen der Division of Biology und des Johnson Cancer Research Center für BRIEF- und IRA-Auszeichnungen bzw. an GV. Wir danken auch dem K-INBRE Postdoktorandenpreis an RV. Diese Arbeit wurde teilweise durch den Institutional Development Award (IDeA) des National Institute of General Medical Sciences der National Institutes of Health unter der Fördernummer P20 GM103418 unterstützt. Der Inhalt liegt allein in der Verantwortung der Autoren und stellt nicht unbedingt die offizielle Meinung des National Institute of General Medical Sciences oder der National Institutes of Health dar. Wir danken den anonymen Rezensenten für ihre hilfreichen Kommentare.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.45 µm syringe filter | Fisher scientfic | 09-720-004 | |
| 2-Mercaptoethanol | Sigma | M3148 | |
| Ammonium carbonate | Sigma-Aldrich | 207861-500 | |
| Bio-Lyte 3/10 Ampholyte | Bio-Rad | 163-1113 | |
| Bio-Lyte 5/8 Ampholyte | Bio-Rad | 163-1192 | |
| Compact low temperature thermostat | Lauda -Brinkmann | RM 6T | Set water cooling to 4 oC and it can be run even at 0 oC as when it passes through the Rotofor cooling core, the circulating water temperature will be around 5 or more depending on the voltage. |
| Coomassie Brilliant Blue R | Sigma-Aldrich | B7920 | |
| Dialysis tubing (3,500 MWCO) | Spectrum Spectra/Por | 132112T | |
| Gymnema plant leaf extract powder (>25% Gymnemic acids) | Suan Farma, NJ USA | ||
| Incubator | Lab companion | SI 300R | |
| Microscope | Leica | DM 6B | |
| Mini protean electrophoresis | Bio-Rad | ||
| pH meter | Mettler Toledo | S20 | Useful to determine the pH of the Rotofor (liquid-phase IEF) fractions |
| Rotofor | Bio-Rad | 170-2972 | http://www.bio-rad.com/webroot/web/pdf/lsr/literature/M1702950E.pdf (Rotofor Instruction manual for assembling the unit) |
| RPMI-1640 Medium | HyClone | DH30255.01 | |
| Sealing tape | Bio-Rad | 170-2960 | Scotch tape may also be used. |
| Sorvall legend micro 17 centrifuge | Thermo scientific | 75002432 | |
| TPP tissue culture plate -96 well flat bottom | TPP | TP92696 |
Referenzen
- Jankowska, U., et al. Optimized procedure of extraction, purification and proteomic analysis of nuclear proteins from mouse brain. Journal of Neuroscience Methods. 261, 1-9 (2016).
- Pergande, M. R., Cologna, S. M. Isoelectric Point Separations of Peptides and Proteins. Proteomes. 5 (1), (2017).
- Stoyanov, A. IEF-based multidimensional applications in proteomics: toward higher resolution. Electrophoresis. 33 (22), 3281-3290 (2012).
- Vesterberg, O. A. Y. Method of Isoelectric Fractionation. , US3485736A (1964).
- Vesterberg, O., Svensson, H. Isoelectric fractionation, analysis, and characterization of ampholytes in natural pH gradients. IV. Further studies on the resolving power in connection with separation of myoglobins. Acta Chemica Scandinavica. 20 (3), 820-834 (1966).
- Righetti, P. G. Isoelectric Focusing: Theory, Methodology and Applications. , Elsevier Science. 1(1983).
- Vesterberg, O. Synthesis and Isoelectric Fractionation of Carrier Ampholytes. Acta Chemica Scandinavica. 23, 2653-2666 (1969).
- Bier, M. Recycling isoelectric focusing and isotachophoresis. Electrophoresis. 19 (7), 1057-1063 (1998).
- Bier, M., Palusinski, O. A., Mosher, R. A., Saville, D. A. Electrophoresis: mathematical modeling and computer simulation. Science. 219 (4590), 1281-1287 (1983).
- Ayala, A., Parrado, J., Machado, A. Use of Rotofor preparative isoelectrofocusing cell in protein purification procedure. Applied Biochemistry and Biotechnology. 69 (1), 11-16 (1998).
- Wagner, L., et al. Isolation of dipeptidyl peptidase IV (DP 4) isoforms from porcine kidney by preparative isoelectric focusing to improve crystallization. Biological Chemistry. 392 (7), 665-677 (2011).
- Hosken, B. D., Li, C., Mullappally, B., Co, C., Zhang, B. Isolation and Characterization of Monoclonal Antibody Charge Variants by Free Flow Isoelectric Focusing. Analytical Chemistry. 88 (11), 5662-5669 (2016).
- Yu, J. J., et al. Francisella tularensis T-cell antigen identification using humanized HLA-DR4 transgenic mice. Clinical Vaccine Immunology. 17 (2), 215-222 (2010).
- Riyong, D., et al. Size and charge antigens of Dirofilaria immitis adult worm for IgG-ELISA diagnosis of bancroftian filariasis. Southeast Asian Journal of Tropical Medicine and Public Health. 41 (2), 285-297 (2010).
- Vediyappan, G., Bikandi, J., Braley, R., Chaffin, W. L. Cell surface proteins of Candida albicans: preparation of extracts and improved detection of proteins. Electrophoresis. 21 (5), 956-961 (2000).
- Vediyappan, G., Dumontet, V., Pelissier, F., d'Enfert, C. Gymnemic acids inhibit hyphal growth and virulence in Candida albicans. PLoS One. 8 (9), 74189(2013).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry. 72, 248-254 (1976).
- Laemmli, U. K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 227 (5259), 680-685 (1970).
- Riazi, S., Dover, S., Turovskiy, Y., Chikindas, M. L. Commercial ampholytes used for isoelectric focusing may interfere with bioactivity based purification of antimicrobial peptides. Journal of Microbiological Methods. 71 (1), 87-89 (2007).
- Kamei, K., Takano, R., Miyasaka, A., Imoto, T., Hara, S. Amino-Acid-Sequence of Sweet-Taste-Suppressing Peptide (Gurmarin) from the Leaves of Gymnema-Sylvestre. Journal of Biochemistry. 111 (1), 109-112 (1992).
- Craik, D. J. Chemistry. Seamless proteins tie up their loose ends. Science. 311 (5767), 1563-1564 (2006).
- Craik, D. J., Daly, N. L., Bond, T., Waine, C. Plant cyclotides: A unique family of cyclic and knotted proteins that defines the cyclic cystine knot structural motif. Journal of Molecular Biology. 294 (5), 1327-1336 (1999).
- Stoecklin, W. Chemistry and physiological properties of gymnemic acid, the antisaccharine principle of the leaves of Gymnema sylvestre. Journal of Agricultural and Food Chemistry. 17 (4), 704-708 (1969).
- Liu, H. M., Kiuchi, F., Tsuda, Y. Isolation and structure elucidation of gymnemic acids, antisweet principles of Gymnema sylvestre. Chemical & Pharmaceutical Bulletin (Tokyo). 40 (6), 1366-1375 (1992).
- Veerapandian, R., Vediyappan, G. Gymnemic Acids Inhibit Adhesive Nanofibrillar Mediated Streptococcus gordonii-Candida albicans Mono-Species and Dual-Species Biofilms. Frontiers in Microbiology. 10, 2328(2019).
- Chaffin, W. L. Candida albicans cell wall proteins. Microbiology and Molecular Biology Reviews. 72 (3), 495-544 (2008).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten