Method Article
Hastalık Modellerinde Hematopoetik Hücrelerin İncelemi için Lentiviral CRISPR/Cas9-Aracılı Genom Düzenleme
Bu Makalede
Özet
Hematopoetik kök ve ata hücrelerinin (HSPC) CRISPR/Cas9 sistemi tarafından hematopoetik sisteme özgü gen modifikasyonları ile fare model sistemlerini hızla geliştirmek için yüksek verimli genom düzenlemesi için protokoller tanımlanmıştır.
Özet
Konvansiyonel transgenez yaklaşımları kullanarak hematopoetik kök hücrelerde genlerin manipüle edilmesi zaman alıcı, pahalı ve zorlu olabilir. Genom düzenleme teknolojisindeki gelişmelerden ve lentivirus aracılı transgen dağıtım sistemlerinden yararlanan, genlerin özellikle hematopoetik kök hücrelerde manipüle edildiği fareleri oluşturan etkili ve ekonomik bir yöntem burada tanımlanmıştır. Lentivirüsler, Cas9-ifade eden soyu negatif kemik iliği hücrelerini belirli genleri ve kırmızı floresan muhabiri geni (RFP) hedefleyen bir kılavuz RNA (gRNA) ile nakletmek için kullanılır, daha sonra bu hücreler ölümcül ışınlanmış C57BL/6 farelere nakledilir. Mercekleyici olmayan gRNA'yı ifade eden lentivirus ile nakledilen fareler kontrol olarak kullanılır. Transekte hematopoetik kök hücrelerin engreftlemesi periferik kanın RFP-pozitif lökositlerinin akış sitometrik analizi ile değerlendirilir. Bu yöntemle transplantasyondan 4 hafta sonra miyeloid hücrelerin ~%90 transdüksiyonu ve lenfoid hücrelerin ~%70'i elde edilebilir. Genomik DNA RFP-pozitif kan hücrelerinden izole edilir ve hedeflenen alan DNA'sının bazı bölümleri genom düzenlemesini doğrulamak için PCR tarafından yükseltilir. Bu protokol hematopoyonis düzenleyici genlerin yüksek iş bölümü değerlendirmesini sağlar ve hematopoetik hücre tutulumu olan çeşitli fare hastalığı modellerine genişletilebilir.
Giriş
Hematoloji ve immünoloji deki birçok çalışma, Mx1-Cre, Vav-Cre ve diğerleri gibi hematopoetik sisteme özgü Cre sürücülerini kullanan konvansiyonel ve koşullu transgenik/nakavt fareler de dahil olmak üzere genetiği değiştirilmiş farelerin bulunabilirliğine dayanır. 1,2,3,4,5. Bu stratejiler, zaman alıcı ve mali açıdan yük oluşturabilecek yeni fare suşlarının kurulmasını gerektirir. Genom düzenleme teknolojisindeki devrim niteliğindeki gelişmeler, uygun teknik uzmanlık6,7,8,9 ile 3-4 ay gibi az bir sürede yeni fare suşlarının oluşmasını sağlarken , deneyler takip edilmeden önce fare kolonisini güçlendirmek için çok daha fazla zaman gereklidir. Buna ek olarak, bu yordamlar pahalıya mal olur. Örneğin Jackson Laboratory, nakavt fare üretim hizmetlerinin geçerli fiyatını suuş başına 16.845 ABD doları olarak listelemaktadır (Aralık 2018 itibariyle). Böylece geleneksel murine transgenik yaklaşımlara göre daha ekonomik ve verimli yöntemler daha avantajlıdır.
Kümelenmiş düzenli olarak uzaya açık kısa palindromik tekrarlar/CRISPR ilişkili protein 9 (CRISPR/Cas9) teknolojisi, hızlı ve verimli RNA tabanlı, diziye özgü genom düzenlemesi için yeni araçların geliştirilmesine yol açmıştır. Başlangıçta istilacı patojen DNA yok etmek için bir bakteriyel adaptif bağışıklık mekanizması olarak keşfedilen, CRISPR / Cas9 sistemi ökaryotik hücreler ve hayvan modellerinde genom düzenleme etkinliğini artırmak için bir araç olarak kullanılmıştır. CRISPR/Cas9 makinelerinin hematopoetik kök hücrelere (elektroporasyon, nükleofection, lipofection, viral doğum ve diğerleri) iletilmesi için bir dizi yaklaşım kullanılmıştır.
Burada, cas9 ifade eden murine hematopoetik kök hücreleri etkili bir şekilde bulaştırabilme ve rna ifade yapısını, organizatörleri, düzenleyici dizileri ve kodlayan genleri bir araya getirebilme yeteneği nden dolayı hücreleri nakletmek için bir lentivirus sistemi kullanılmaktadır. floresan muhabir proteinler (yani, GFP, RFP). Bu yöntemle fare hematopoetik kök hücrelerinin ex vivo gen düzenlemesi sağlanmış, ardından ölümcül ışınlanmış farelerde kemik iliğin başarılı bir şekilde yeniden yapılandırılması10. Bu çalışma için kullanılan lentivirus vektörü, ortak çekirdek EF1a promotöründen Cas9 ve GFP muhabiri genlerini, muhabir geninden yukarı doğru bir iç ribozomal giriş alanı ile ifade eder. Kılavuz RNA dizisi ayrı bir U6 organizatöründen ifade edilir. Bu sistem daha sonra aday klonal hematopoiesis sürücü genleri Tet2 ve Dnmt3a10ekleme ve silme mutasyonları oluşturmak için kullanılır. Ancak, bu yöntemle transdüksiyon verimliliği nispeten düşüktür (~%5-%10) transdüksiyon verimliliğini sınırlayan ve üretim sırasında virüs titreğini azaltan vektör kesici ucun (13 Kbp) büyük boyutu nedeniyle.
Diğer çalışmalarda, daha büyük viral RNA boyutunun hem virüs üretimini hem de transdüksiyon verimliliğini olumsuz etkilediği gösterilmiştir. Örneğin, kesici uç boyutunda 1 kb'lik bir artışın virüs üretimini ~%50 oranında azalttığı ve fare hematopoetik kök hücrelerinde transdüksiyon verimliliğinin %50'den fazla azalacağı bildirilmiştir11. Böylece, mümkün olduğunca sistemin verimliliğini artırmak için viral eklemek boyutunu azaltmak için avantajlıdır.
Bu eksiklik Cas9 transgenik fareler istihdam ile aşılabilir, hangi Cas9 proteini ya bir kurucu veya indüklenebilir şekilde ifade edilir12. Kurucu CRISPR /Cas9 knock-in fareler cas9 enonuklezaz ve EGFP Rosa26 locus de CAG organizatörü her yerde bir şekilde ifade eder. Böylece, çekirdek EF1a organizatörü kontrolü altında U6 organizatörü ve RFP muhabiri gen kontrolü altında sgRNA ile bir yapı genom düzenleme elde etmek için lentivirus vektör kullanılarak teslim edilebilir. Bu sistemle hematopoetik kök hücrelerin genleri başarılı bir şekilde düzenlendi ve ~%90 transdüksiyon verimi gösterdi. Böylece bu protokol, hedeflenen gen mutasyonlarının hematopoetik sisteme girdiği farelerin yaratılması için hızlı ve etkili bir yöntem sağlamaktadır. Laboratuvarımız ağırlıklı olarak kardiyovasküler hastalık süreçlerinde klonal hematopoyis rolünü incelemek için bu tür teknolojiyi kullanırken13,14,15, aynı zamanda hematolojik çalışmalar için de geçerlidir malignite16. Ayrıca, bu protokol, HSPC'deki DNA mutasyonlarının hematopoetik sistemdeki diğer hastalıkları veya gelişimsel süreçleri nasıl etkilediğinin analizine kadar genişletilebilir.
Sağlam bir lentivirus vektör sistemi kurmak için, hematopoetik hücrelerin transdüksiyonve nakli için yüksek titre viral stoklar ve optimize edilmiş koşullar gereklidir. Protokolde, bölüm 1'de yüksek bir titreviral stoğun hazırlanması, bölüm 2'de murine hematopoetik kök hücrelerin kültür koşullarının optimize edilebisi, bölüm 3'te kemik iliği nakli için yöntemler ve bölüm 4'te engraftment.
Protokol
Hayvan denekleri ile ilgili tüm prosedürler Virginia Üniversitesi Kurumsal Hayvan Bakım ve Kullanım Komitesi (IACUC) tarafından onaylanmıştır.
1. Lentivirüs partiküllerinin üretimi ve saflaştırılması
NOT: Optimize edilmiş kılavuz RNA'yı içeren Lentivirus partikülleri Addgene tarafından sağlanan ayrıntılı protokollerle üretilebilir: . Yüksek titrelentivirus hazırlık ve depolama için optimize edilmiş yöntemler başka bir yerde tartışılır17,18. Kısaca, lentivirüsler hek 293T hücrelerine lentivirus vektör plazmid, psPAX2 ve pMD2.G'nin birlikte transfeksiyonu ile üretilir. Kültür supernatant 48 saat post-transfection toplanır ve ultracentrifugation tarafından yoğunlaşmıştır. Lentiviral titre ticari olarak mevcut qPCR tabanlı bir test ile belirlenir. Bu işlem biyogüvenlik sınıfı II kabinede yapılmalıdır.
- Kollajen in 1:200 çözeltisi hazırlayın (%0.0005) 1x PBS olarak.
- Coat 6 kuyulu kollajen solüsyonu ile ve 37 °C'de kuluçka, ~30 dk için %5 CO2.
- Tohum 293T hücreleri kuyu başına 1 x 106 hücre yoğunluğunda ve 37 °C'de kuluçkaya yatırın, ~2 saat için %5 CO2.
- Üç transfeksiyon plazmidinin karışımını bir kuyu için hazırlamak için, 0,9 g lentivirus vektörünü, 0,6 g psPAX2'yi ve 0,3 g pMD2.G'yi birleştirin, ardından deiyonize su ekleyerek toplam 10 μL'lik bir hacim elde edin. Kuyu sayısına bağlı olarak miktarları buna göre ayarlayın. Her plazmidin miktarı ve oranının araştırmacıların ihtiyaçlarına uyacak şekilde daha da optimize edilmesi gerekebilir.
- Plazmid karışımına 50 μL 1x PBS ve seyreltilmiş PEI MAX'in (1,0 mg/mL) 5 000'ini dikkatlice ekleyin ve oda sıcaklığında 15 dakika kuluçkaya yatırın(TABLO 1).
- Karışıma 1 mL DMEM ekleyin.
- 6 kuyu plakasından aspire ortamı, 1 mL plazmid karışımı ekleyin ve 37 °C'de %5 CO2~3 saat için kuluçkaya yatırın.
- Ortamı 2 mL taze DMEM ile değiştirin ve 37 °C'de %5 CO2 ila 24 saat kuluçkaya yatırın.
- 37 °C'de 1 mL taze DMEM ve inkübat, ek 24 saat için %5 CO2 ekleyin (toplam kuluçka süresi 48 saattir).
- Herhangi bir serbest yüzen hücreleri kaldırmak için 15 dakika için 3.000 x g bir 50 mL tüp ve santrifüj kültür supernatant aktarın.
- Supernatant'ı 0,45 m'lik bir filtreden filtreleyin.
- Filtrat'ı polipropilen santrifüj tüplerine aktarın.
- Ultracentrifuge 4 °C ve 72.100 x g rmax 3 saat.
- Dikkatle supernatant aspire, beyaz pelet geride bırakarak.
- 100 μL serumsuz hematopoetik hücre genişletme aracı ile peleti havalandırma olmadan yeniden askıya alın.
- Viral titreyi ölçmek için 10 μL aliquot tutun ve kalan tüm aliquotları -80 °C'de gerekli olana kadar saklayın.
- 10 μL viral aliquot kullanarak üreticinin talimatlarına göre bir qPCR tabanlı test ile virüs titrat.
2. Fare kemik iliğinden soy-negatif hücrelerin izolasyonu ve transdüksiyonu (Şekil 1A)
NOT: Tipik olarak, yeterli hücreleri izole etmek için, tibias çiftleri, uyluk ve humeri her fareden hasat edilir. Pelvik ve spinal kemikler de soy-negatif hücrelerin kaynağı olarak hasat edilebilir.
- Kemik iliği hücrelerinin izolasyonu
- Ötanazi 8-10 haftalık erkek CRISPR/Cas9 knock-in fareler tarafından 5% izofluran servikal dislokasyon takip, sonra% 70 etanol ile cilt dezenfekte.
- Diseksiyon makası kullanarak, göğüs kafesinin hemen altındaki deride enine bir kesi yapın ve bacakları ve kolları ortaya çıkarmak için cildi her iki yönde de distal olarak soyun.
- Kalça eklemini yerinden çıkararak alt ekstremiteleri kalça kemiğinden dikkatlice ayırın. Kalça tamamen femur kaldırmak için femur baş boyunca kesin. Diz yerinden çıkarmak ve femur ve tibia ayırmak için eklemde kesilmiş, kemik epifizi sağlam tutarken. Ayak bileği eklemi çıkarmak ve ayak ve ekstra kas soyma.
- Kesme makası kullanarak, üst ekstremiteleri ayırmak için omzundan kesilmiş. Omuz çıkarmak, sonra humerus kemik hasat için dirsek ekleminde kesti.
- Dikkatle femurlar, tibias ve humeri kasları kaldırmak için selüloz-fiber mendil kullanın. Bu işlem sırasında kemiklerin kırılmadığından emin olmak için ekstra önlem alın.
- İzole kemikleri RPMI içeren 50 mL konik bir tüpe yerleştirin ve buza yerleştirin.
NOT: Aşağıdaki adımlar bir biyogüvenlik sınıfı II kabine yapılmalıdır. - Kemikleri steril, 100 mm kültür çanağı içine aktarın.
- Künt forseps ile kemik kavramak ve kesme makas kullanarak, dikkatle her iki epifiz kesti.
NOT: Yetersiz bir kesim kemik iliği eksik bir floş yol açacaktır, aşırı agresif kesim hücre kaybına neden olurken. - 10 mL'lik bir şırıngayı buz gibi RPMI ile doldurun ve 22 G iğne kullanarak kemik iliğini şafttan 100 mm'lik yeni bir kültür kabına boşaltın.
NOT: Kemik şaftı iyi temizlenmişse kemikler beyaz ve yarı saydam hale gelir. Değilse, kemik uçlarını yeniden kesin ve tekrar sifonu çek. - Tüm kemik iliği toplandıktan sonra, 18 G iğne ile 10 mL şırınga ile kemik iliği birkaç kez geçerek tek hücreli süspansiyon yapmak. Tek hücreli süspansiyon sağlamak için 10x'i tekrarlayın.
- Hücre süspansiyonuna 70 m'lik bir hücre süzgeciaracılığıyla 50 mL konik bir tüpe filtre uygulayın.
- Santrifüj 310 x g için 10 dakika 4 °C'de.
- Supernatant aspirate ve aşağıdaki hücre ayırma işlemi için optimize ayırma tampon uygun bir hacimde hücre pelet resuspend.
- Soy-negatif hücrelerin izolasyonu ve lentivirüs transdüksiyonu
NOT: Fare soy-negatif hücreleri, üreticinin talimatlarına göre bir soy tükenme kiti kullanılarak Cas9 transgenik fareler3veya diğer fare suşlarının kemik iliğinden izole edilir. Tipik olarak, soy-negatif hücreler tüm kemik iliği çekirdekli hücrelerin% 2-5'ini oluşturur ve saflık genellikle izolasyon dan sonra% 90'dan fazladır. İzole soy-negatif hücreler 20 ng/mL rekombinant murine TPO ve 50 ng/mL rekombinant murine SCF ile desteklenen serumsuz hematopoetik hücre genişletme ortamında kültürlenir, daha sonra 16 saat boyunca lentivirus vektörü ile enfeksiyon (MOI) = 100.- Soy-negatif hücreleri izole etmek için, üreticinin talimatlarına göre soy hücresi tükenme kitikullanın.
- İzolasyon dan sonra serumsuz hematopoetik hücre genişletme aracının 1 mL'sinde soy-negatif hücreleri askıya alın.
- Hücreleri 1,5 x 106 hücre/mL yoğunlukta 6 kuyuplakasına yerleştirin (5 x 105 soy-negatif hücre/fare.)
- Rekombinant murine TPO ve SCF'yi sırasıyla 20 ng/mL ve 50 ng/mL'lik son konsantrasyonlarda kuyulara ekleyin.
- 37 °C'de %5 CO2'de ~2 saat için kuluçka öncesi hücreler.
- MoI = 100, 4 μg/mL polibrene ve penisilin/streptomisin kuyulara lentivirus ekleyin ve 37 °C'de kuluçka, 16-20 saat için %5 CO2 (Şekil 1B).
- Ertesi gün, 15 mL konik tüp ve santrifüj içine lentivirus transduced hücreleri toplamak 300 g 10 dakika için.
- Supernatant'ı dikkatlice aspire edin ve fare başına 200°L RPMI'de peleti yeniden askıya alın. Hücreleri farelere nakledilene kadar RT'de tutun (bölüm 3).
3. Transeksed hücrelerin ölümcül ışınlanmış fareleriçine nakli
- Kemik iliği nakli gününde, alıcı fareleri sekiz dilimlik bir pasta kafesine yerleştirin ve her ışınlama seansı arasında yaklaşık 4 saat olmak üzere tüm vücut ışınlaması (550 Rad/doz, toplam doz = 1100 Rad) iki dozmaruz bırakın.
- İkinci ışınlama seansından sonra, bir insülin şırıngası kullanarak retro-orbital ven pleksus (toplam 200°L) ile her anestezili alıcı fareye transekse line-negatif hücreleri enjekte ediniz(Şekil 1C).
- Işınlama sonra, fareler steril kafeslerde barındırılan ve yumuşak bir diyet ve içme suyu 14 d için antibiyotik ile takviye sağlanmalıdır.
- Kemik iliği naklinden 3-4 hafta sonra, transekte donör hücrelerin ingreftasyon kontrol etmek için periferik kan analiz (bölüm 4).
4. Periferik kanın kimerizminin değerlendirilmesi
- % 5 izofluran ile fareler anestezik ve kapiller tüpler kullanarak retro-orbital ven bir kan örneği almak, ve K içine toplamak2EDTA tüpleri (bir kılcal tüp hacmi aşağıdaki tahse için yeterlidir).
- K2EDTA tüplerinden 20 μL'lik kanı 5 mL yuvarlak alt polistiren test tüplerine aktarın ve buza koyun.
- Kırmızı kan hücrelerini lyse için RBC lysis tampon 1.5 mL ekleyin. Buz üzerinde 5 dakika kuluçka.
- Lysis tamponu nötralize etmek için, facs arabellek (1.5 mL/örnek) ile yıkama örnekleri.
- Santrifüj 609 x g rmax 4 °C'de 5 dakika. Supernatant atın.
- Hücreleri, karanlıkta 20 dakika boyunca RT'de monoklonal antikorlardan oluşan bir kokteylle (100°L FACS tamponu/numunede seyreltilmiş) kuluçkaya yatırın. Yukarıdaki Malzemeler bölümünde antikorların tam bir listesi verilmiştir.
- Hücreleri FACS arabelleğiyle (2 mL/örnek) bir kez yıkayın. Santrifüj 609 x g rmax (1.800 rpm) 4 °C'de 5 dakika için. Supernatant'ı tamamen atın.
- 4 °C'de 10 dakika boyunca fiksasyon tamponu (100 μL/tüp) içeren paraformaldehit içeren hücreleri düzeltin.
- Hücreleri FACS arabelleğiyle (3 mL/örnek) bir kez yıkayın. Santrifüj 609 x g rmax (1.800 rpm) 4 °C'de 5 dakika için. Supernatant'ı tamamen atın.
- 400 μL FACS arabelleğindeki peleti askıya alın.
- Numuneleri akış sitometrisi ile analiz edinceye kadar 4 °C'de tutun.
Sonuçlar
Yukarıda açıklanan protokol kullanılarak fare başına yaklaşık 0.8-1.0 x 108 kemik iliği hücresi elde edilmiştir. Elde ettiğimiz soy-negatif hücre sayısı fare başına yaklaşık 3 x 106 hücredir. Tipik olarak, kemik iliği soy-negatif hücrelerin verimi toplam kemik iliği nükleer hücrelerinin% 4-5'tir.
Transeksif hücrelerin kimerizmi (RFP-pozitif) periferik kanın akış sitometrisi ile değerlendirilir (Şekil 2A,B). Kan retro-orbital ven izole ve uygun belirteçleri her hematopoetik hücre popülasyonunun kimliğini belirlemek için kullanılır (yani, nötrofiller, monositler, T hücreleri, vb) (Şekil 3A,B). Genomik DNA RFP-pozitif kan hücrelerinden izole edilebilir ve hedeflenen alan DNA bölümleri PCR tarafından güçlendirilebilir ve dizi analizi için TA klonlama vektörlerine daldırılabilir. Bu plazmidler E. coli'ye dönüştürülür ve hedef alan dizileri Sanger dizilimi ile belirlenir (Şekil 4). Alternatif olarak, hedef site dizileri, havuzlu genomun Sanger dizilenmesi ve indels'in ayrışma (TIDE) analizi10ile izlenmesi gibi diğer yöntemlerle belirlenebilir. Kontrol durumu için, fareler genellikle olmayan hedefleme kılavuzu RNA ifade bir lentivirus ile transdükse hücreleri ile nakledilir.
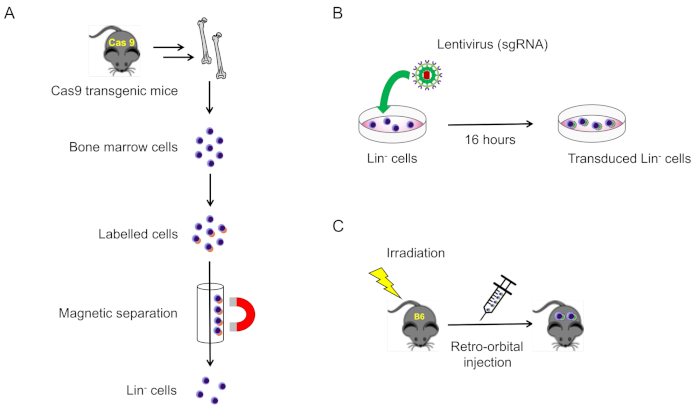
Şekil 1: Bu protokolün şematik illüstrasyonu. (A) Cas9 ifade eden farelerden soy-negatif kemik iliği hücrelerinin izolasyonu (bölüm 2.1). (B) Soy-negatif hücrelerin lentivirüs transdüksiyonu (bölüm 2.2). (C) Transektil hücrelerin öldürücü ışınlanmış yabani tip farelere retro-orbital enjeksiyonu (bölüm 3). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
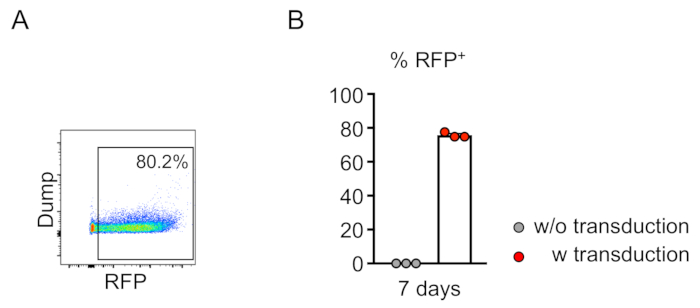
Şekil 2: Fare kemik iliği soy-negatif hücrelerin in vitro verimli lentiviral transdüksiyon. (A) Akış sitometri analizi, soy-negatif hücrelerin başarılı transdüksiyonu ortaya koymaktadır. 7 günlük in vitro kültürden sonra analiz yapıldı. (B) Bu töbede hücrelerin ortalama %75.7'si transeneden çıkarıldı (n = 3). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
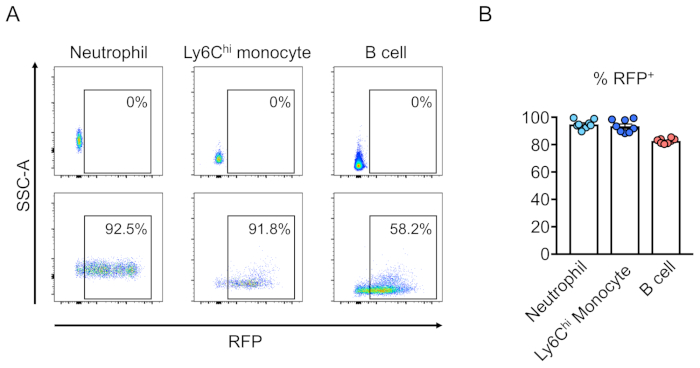
Şekil 3:Öldürücü ışınlanmış fare kemik iliği transekçi soy-negatif hücreler tarafından yeniden yapılandırılması. (A) Fare periferik kanının hematopoetik kök hücreler tarafından yeniden yapılandırılarak (altta) veya (üstte) lentivirus ile transetik olmayan rekontetrik kanlarının akış sitometri analizi RFP'yi ifade eden lentivirus ile transetik olarak. Nötrofiller Ly6G+ ve Ly6Chi monositler Ly6G olarak tanımlanır- ve Ly6C+ve CD45R+olarak B hücreleri . (B) Bu tahlillerde, hücrelerin ortalama %94.8, %93.5 ve %82.7'si nötrofil, Ly6Chi monosit ve B hücre popülasyonlarında sırasıyla RFP+ ve B hücre popülasyonlarıdır (n = 8). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
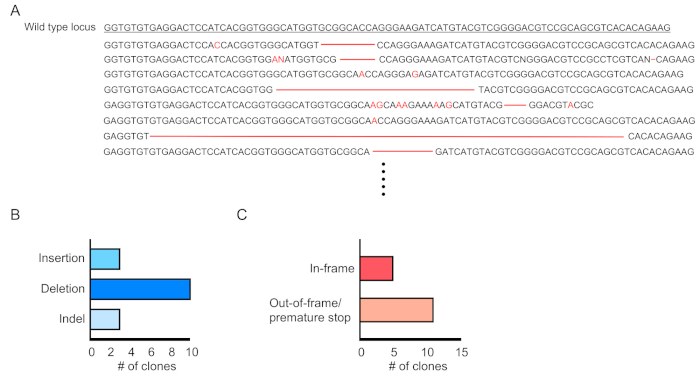
Şekil 4:Transekin kan hücrelerinde gen düzenlemesinin değerlendirilmesi. (A) RPF-pozitif kan hücrelerinde mutasyona uğramış Dnmt3a çekirge dizileme sonuçlarını gösteren gen düzenleme örneği. Silmeler kırmızı tire olarak gösterilir ve eklemeler kırmızı harflerle gösterilir. (B) Tespit edilen mutasyonların özeti. (C) %69'u (11/16 klon) çerçeve dışı/erken dur mutasyonları gösterdi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Plasmid | Boyut (bp) | Kuyu başına miktar (μg) | Oranı |
| pLKO5.0 | 7700 | 0.9 | 2 |
| psPAX2 | 10668 | 0.6 | 1 |
| pMD2.G | 5822 | 0.3 | 1 |
| PEI-max (stok: 100 mg/mL) | 5 μL/kuyu | ||
Tablo 1: Transfeksiyon için kullanılan plazmid ve PEI-max miktarları.
Tartışmalar
Bu protokolün avantajı, geleneksel fare transgenik yaklaşımlarına kıyasla hematopoetik hücrelerde spesifik mutasyonları barındıran hayvan modellerinin hızlı ve yüksek maliyetli bir şekilde oluşturulmasıdır. Bu metodolojinin 1 ay içinde hematopoetik hücre gen manipülasyonu yapan farelerin oluşumunu sağladığı bulunmuştur. Bu protokolde daha fazla dikkate alınması gereken birkaç kritik adım vardır.
gRNA dizisinin taranması
Vivo deneyleri gerçekleştirmeden önce düzenleme verimliliğini değerlendirmek için gRNA'ların in vitro olarak test edilmesi önerilir. GRNA'ların etkinliği hücre içermeyen in vitro transkripsiyon ve tarama sistemi kullanılarak test edilir. Transkripsiyonlu gRNA, agarose jel elektroforezi kullanılarak rekombinant Cas9 proteini varlığında şablon DNA'nın ayrılmasındaki etkinliğini ölçerek doğrulanır. Bu amaçla ticari olarak kullanılabilen kitler mevcuttur.
Burada, indel mutasyonları düzenlenmiş bölgeden güçlendirilmiş PCR ürünlerinin TA klonlanması, bu plazmidlerle bakteri hücrelerinin dönüştürülmesi ve Sanger dizilimi için tek tek kolonilerin toplanması ile karakterizedir. Ancak, bu yöntem zahmetli ve zaman alıcıdır. Alternatif olarak, yeni nesil sıralama (NGS) veya havuzlu DNA dizilemesi ve ardından TIDE analiziyapılabilir 19. TIDE algoritması karmaşık örneklerden oluşturulan Sanger dizi izlerini analiz etmek için oluşturuldu. Tide ile indel tahminleri genellikle bu off-targeted NGS20ile tutarlı olduğu gösterilmiştir. Analitik yazılım online olarak adresinden edinilebilir.
Yüksek titreci lentivirüs parçacıklarının üretimi
Hücre enfeksiyonu için gerekli olan viral vesiküler stomatit virüsü G-proteini, pH'ya son derece duyarlıdır. Bu nedenle, kabul edilebilir bir pH aralığında kültür ortamı tutmak önemlidir, ve sarımsı bir görünüm geliştirmek gerekir. Virüs üretimi için kollajen kaplı yemekler, HEK293T hücrelerinin bağlanmasını hızlandırdığı ve bir gecede beklemek yerine birkaç saat içinde transfeksiyon un performansını sağladığı için kullanılır. Ancak, deneysel programa bağlı olarak, gece kuluçka da düşünülebilir.
Lentivirüs partiküllerinin saflaştırılması
Hematopoetik kök hücrelerin verimli transdüksiyon elde etmek için, yüksek titreci lentivirus oluşturmak için gereklidir. Santrifüj hızının optimizasyonu önemli bir özelliktir. Lentivirus konsantrasyonu genellikle 90.000 x gyapılır iken, malzeme 20.000 x g18daha düşük hızda santrifüj ise çeşitli raporlar virüs kurtarma artar göstermiştir . Ultracentrifugation olmadan yüksek titreci lentivirus hazırlık üretimi de17önerilmiştir. Bu havalandırma en aza indirmek ve virüs bütünlüğünü korumak için güçlü pipetleme kaçınArak virüs santrifüj pelet askıya almak için önemli olduğu unutulmamalıdır. Yüksek titrelentivirüs parçacıkları hematopoetik kök hücrelerin verimli transdüksiyon için gereklidir11. Pilot deneyler, 100 moi transdüksiyon verimliliği ve hücre canlılığı açısından en uygun olduğunu ortaya koymuştur. Lentivirus stoklarının hücre canlılığı ve transdüksiyon verimliliği temelinde değerlendirilmesi tavsiye edilir.
Lentivirüs partiküllerinin depolanması
Lentivirus titresi sıcaklığa karşı son derece hassastır ve titre uygunsuz depolama koşulları ve tekrarlanan donma-çözülme döngüleri ile büyük ölçüde azaltılabilir. Lentivirüsün transdüksiyon veriminin 4 °C [t(1/2) = 1,3 gün] depolandığında veya birden fazla donma-çözülme döngüsüne [t(1/2) = 1,1 mermi] maruz kaldığında hızla azaldığı bulunmuştur. Virüs preparatlarının, virüs peleti askıya alındıktan kısa bir süre sonra sıvı nitrojen veya ezilmiş kuru buzda çabuk dondurulması önerilir. Viral stoklar -80 °C'de muhafaza edilmeli ve buzüzerinde eriymeli ve rt'ye sadece dengelenmeden önce ve11kullanmalıdır.
Çeşitli potansiyel sınırlamalar belirtilmelidir. İlk olarak, CRISPR/Cas9 tarafından hedef dışı indel mutasyonlarının ortaya çıkması uzun zamandır takdir edilmiştir. Ayrıca CRISPR/Cas9'un vivo21'dehedef dışı mutasyonlara neden olabileceği gösterilmiştir. Uygulamada, hedef dışı indel mutasyonları, hedef genom bölgeleriyle yakından eşleşen ve tahmin edilen ikincil bölgelerle dörtten fazla uyuşmazlığı olan gRNA dizileri kullanılarak önlenebilir. Bu tür tasarım silico araçları mevcut ile yapılabilir22. En aza indirgenen hedef dışı eylemlerle gRNA'yı tahmin etmek için diğer hesaplama araçları mevcuttur ( veya ). Ayrıca fenotip onaylamak ve gözlenen fenotip belirli bir gRNA bir off-hedef etkisi aracılık olasılığını en aza indirmek için iki veya daha fazla farklı gRNA kullanarak bir hayvan modeli analiz etmek yararlı olabilir.
CRISPR/Cas9 tarafından oluşturulan konvansiyonel indel mutasyonlarına ek olarak, kilobazların ötesine uzanan daha büyük silmeler rapor edilmiştir. Bu çalışmaları şaşırtmak olabilir; ancak, bu büyük silme indels23göre çok daha düşük sıklıkta olduğu bildirilmiştir. Bir diğer potansiyel sorun genetik tazminat. Bu erken sonlandırma codon ile mutant RNA bildirilmiştir (PTC) transkripsiyon PUSULA karmaşık aracılı aktivasyonu ile dizi benzerliği ile ilgili genlerin yükseltilmesi neden olabilir24,25. Bu olayın gen ablasyonunun nakavt ve nakavt yaklaşımları arasında henotipik farklılıklara yol açabilecek bir mekanizma olduğu ileri sürülmüştür. CRISPR/Cas9 aracılı genom düzenlemesi, PTC üretimine yol açan kare-shift mutasyonlarının stochastic girişine dayandığından, genetik kompanseler fenotipi değiştirebilir. Genetik telafiyi önlemek için, bir genin düzenleyici dizilerinin CRISPR/Cas9 tarafından hedeflendiği veya Cas9'un RNA güdümlü DNA tanıma platformu olarak kullanılmasıyla ilgili deneyler düşünülebilir.
Son olarak, öldürücü ışınlanmış farelere engretlenmiş hücrelerden hematopoezis hematopoezisin doğal koşullarından farklı olabileceği kabul edilmelidir. Ayrıca, ışınlama nın hematopoetik hücrelerdeki gen mutasyonlarının sonuçlarını inceleyen deneylerin yorumlanmasını sarsabilecek organizma üzerinde sistemik etkileri olabilir.
Araştırmacılar katalitik inaktif Cas9 (dCas9) proteinlerinden "RNA güdümlü DNA tanıma platformu" olarak yararlandılar ve efektör etki alanlarını belirli DNA dizilerine lokalize etmek için dCas9 füzyon proteinlerini kullanarak ya bastırmak için (CRISPRi) ya da etkinleştirin (CRISPRa) transkripsiyon off-hedef genler26,27. Bu protokol genomik DNA dizisinde dsDNA dekoltesini tanıtmak için katalitik olarak aktif Cas9 transgenik fareler kullanırken, dCas9'un kromatin değiştirici etki alanları yla kaynaşması yla spesifik genleri bastırmak veya etkinleştirmek için epigenetik modifikasyon uygulanabilir. sırasıyla dCas9-KRAB veya dCas9-VP64. Alternatif olarak, dCas9 gen siteye erişmek için transkripsiyonel makine engelleyerek, kendi gibi bir transkripsiyonel repressor olarak kullanılabilir27. Daha yakın zamanda, Zhou ve ark. dCas9-SunTag-p65-HSF1 (SPH) transgenik fareler dCas9 ile erimiş bir epigenetik aktivatör değiştirilmiş bir sürümünü ifade kurulan ve bu CRISPRa sistemi in vivo fonksiyonel olduğunu gösterdi28.
Laboratuvarımız bu teknolojiyi ağırlıklı olarak kardiyovasküler hastalık süreçlerinde klonal hematopoezisin rolünü incelemek için kullanmaktadır. Çoğalan dokuda, kanser sürücü genlerinde somatik mutasyonlar hücresel büyüme avantajı verebilir ve anormal klonal genişlemelere yol açabilir. Hematopoetik sistemde bu süreç "klonal hematopoezis" olarak bilinir ve bireyin lökositlerinin önemli bir kısmının mutant klonlarla değiştirildiği durumlarda sonuçlanır. Anormal klonal genişlemeler kardiyovasküler hastalığı hızlandırmak, ateroskleroz ve kalp yetmezliği gibi büyüyen bir takdir var, ve morbidite ve all-cause mortalite katkıda15,29.
Son zamanlarda, bu somatik mutasyonlar ve kardiyovasküler hastalık birkaç arasında nedensel bir bağlantı belgelenmiştir, ve altta yatan mekanizmaların yönleri açıklanmıştır10,13,14. Ancak, bu somatik mutasyonlar muhtemelen "buzdağının ucu"nu temsil eder, epidemiyolojik çalışmalar birçok aday genin klonal hematopozi ile ilişkili olduğunu ve potansiyel olarak kardiyovasküler hastalık mortalitesi arttığını göstermiştir. Bu nedenle, klonal hematopoiesis sürücü genlerinin sistematik, daha yüksek iş gücü değerlendirmesi gereklidir. Klonal hematopoyonis ve kardiyovasküler hastalığın nedensel bağlantısı ile ilgili güncel çalışmalar, kemik iliği nakli sonrası hematopoetik sisteme özgü koşullu transgenik (Mx1-Cre, Vav-Cre, vb.) veya farelerin analizine dayanmaktadır. Ancak bu stratejilerin yeni fare kolonileri oluşturması gerekir ve araştırmacılar için finansal ve fiziksel bir yük haline gelebilir. Böylece, geçmişte kullanılan geleneksel murine transgenik /nakavt yaklaşımından daha ucuz ve daha hızlı bir yöntem garanti edilmektedir. Bu el yazmasında açıklandığı gibi mutasyonları tasarlamak için HSPC ve CRISPR teknolojilerini nakletmek için lentiviral vektörler, klonal hematopoyis ve kardiyovasküler hastalıkların incelenmesini kolaylaştırmaktadır.
Konvansiyonel knock-out locus üreten ek olarak, bu yöntem kesilmiş mutasyona uğramış proteinlerin üretimi için geçerlidir. Örneğin, araştırmacılar başarıyla bir hematopoetik-Ppm1d kesilme üretti, klonal hematopoezis olan hastalarda sık görülür, ppm1d gen exon 6 hedefleyen bir gRNA ile frameshift mutasyonlar tanıtarak30.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
S. S. bir Amerikan Kalp Derneği doktora sonrası burs 17POST33670076 tarafından desteklendi. K. W. NIH hiber01 HL138014, R01 HL141256 ve R01 HL139819 tarafından desteklendi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| RPMI Medium 1640 (1X) | Gibco | 11875-093 | Medium |
| Sulfamethoxazole and Trimethoprim injection | TEVA | 0703-9526-01 | |
| 1/2 cc LO-DOSE INSULIN SYRINGE | EXELINT | 26028 | general supply |
| 293T cells | ATCC | CRL-3216-- | Cell line |
| APC-anti-mouse Ly6C (Clone AL-21) | BD Biosciences | 560599 | Antibodies |
| APC-Cy7-anti-mouse CD45R (RA3-6B2) | BD Biosciences | 552094 | Antibodies |
| BD Luer-Lok disposable syringes, 10 ml | BD | 309604 | general supply |
| BD Microtainer blood collection tubes, K2EDTA added | BD Bioscience | 365974 | general supply |
| BD Precisionglide needle, 18 G | BD | 305195 | general supply |
| BD Precisionglide needle, 22 G | BD | 305155 | general supply |
| BV510-anti-mouse CD8a (Clone 53-6.7) | Biolegend | 100752 | Antibodies |
| BV711-anti-mouse CD3e (Clone 145-2C11) | Biolegend | 100349 | Antibodies |
| Collagen from calf skin | Sigma-Aldrich | 9007-34-5 | general supply |
| Corning Costar Ultra-Low Attachment Multiple Well Plate, 6 well | Millipore Sigma | CLS3471 | general supply |
| CRISPR/Cas9 knock-in mice | The Jackson Laboratory | 028555 | mouse |
| DietGel 76A | Clear H2O | 70-01-5022 | general supply |
| Dulbecco’s Modified Eagle’s Medium (DMEM) - high glucose | Sigma Aldrich | D6429 | Medium |
| eBioscience 1X RBC Lysis Buffer | Thermo fisher Scientific | 00-4333-57 | Solution |
| Falcon 100 mm TC-Treated Cell Culture Dish | Life Sciences | 353003 | general supply |
| Falcon 5 mL round bottom polystyrene test tube | Life Sciences | 352054 | general supply |
| Falcon 50 mL Conical Centrifuge Tubes | Fisher Scientific | 352098 | general supply |
| Falcon 6 Well Clear Flat Bottom TC-Treated Multiwell Cell Culture Plate | Life Science | 353046 | general supply |
| Fisherbrand microhematocrit capillary tubes | Thermo Fisher Scientific | 22-362566 | general supply |
| Fisherbrand sterile cell strainers, 70 μm | Fisher Scientific | 22363548 | general supply |
| FITC-anti-mouse CD4 (Clone RM4-5) | Invitrogen | 11-0042-85 | Antibodies |
| Fixation Buffer | BD Bioscience | 554655 | Solution |
| Guide-it Compete sgRNA Screening Systems | Clontech | 632636 | Kit |
| Isothesia (Isoflurane) solution | Henry Schein | 29404 | Solution |
| Lenti-X qRT-PCR Titration Kit | Takara | 631235 | Kit |
| Lineage Cell Depletion Kit, mouse | Miltenyi Biotec | 130-090-858 | Kit |
| Millex-HV Syringe Filter Unit, 0.45 mm | Millipore Sigma | SLHV004SL | general supply |
| PBS pH7.4 (1X) | Gibco | 10010023 | Solution |
| PE-Cy7-anti-mouse CD115 (Clone AFS98) | eBioscience | 25-1152-82 | Antibodies |
| PEI MAX | Polysciences | 24765-1 | Solution |
| Penicillin-Streptomycin Mixture | Lonza | 17-602F | Solution |
| PerCP-Cy5.5-anti-mouse Ly6G (Clone 1A8) | BD Biosciences | 560602 | Antibodies |
| pLKO5.sgRNA.EFS.tRFP | Addgene | 57823 | Plasmid |
| pMG2D | Addgene | 12259 | Plasmid |
| Polybrene Infection/Transfection Reagent | Sigma Aldrich | TR-1003-G | Solution |
| Polypropylene Centrifuge Tubes | BECKMAN COULTER | 326823 | general supply |
| psPAX2 | Addgene | 12260 | Plasmid |
| RadDisk – Rodent Irradiator Disk | Braintree Scientific | IRD-P M | general supply |
| Recombinant Murine SCF | Peprotech | 250-03 | Solution |
| Recombinant Murine TPO | Peprotech | 315-14 | Solution |
| StemSpan SFEM | STEMCELL Technologies | 09600 | Solution |
| TOPO TA cloning kit for sequencing with One Shot TOP10 Chemically Competent E.coli | Thermo fisher Scientific | K457501 | Kit |
| Zombie Aqua Fixable Viability Kit | BioLegend | 423102 | Solution |
Referanslar
- Sasaki, Y., et al. Defective immune responses in mice lacking LUBAC-mediated linear ubiquitination in B cells. EMBO Journal. 32, 2463-2476 (2013).
- Ogilvy, S., et al. Transcriptional regulation of vav, a gene expressed throughout the hematopoietic compartment. Blood. 91, 419-430 (1998).
- Meyer, S. E., et al. DNMT3A Haploinsufficiency Transforms FLT3ITD Myeloproliferative Disease into a Rapid, Spontaneous, and Fully Penetrant Acute Myeloid Leukemia. Cancer Discovery. 6, 501-515 (2016).
- Kuhn, R., Schwenk, F., Aguet, M., Rajewsky, K. Inducible gene targeting in mice. Science. 269, 1427-1429 (1995).
- Cole, C. B., et al. PML-RARA requires DNA methyltransferase 3A to initiate acute promyelocytic leukemia. Journal of Clinical Investigation. 126, 85-98 (2016).
- Yang, H., et al. One-step generation of mice carrying reporter and conditional alleles by CRISPR/Cas-mediated genome engineering. Cell. 154, 1370-1379 (2013).
- Wang, H., et al. One-step generation of mice carrying mutations in multiple genes by CRISPR/Cas-mediated genome engineering. Cell. 153, 910-918 (2013).
- Quadros, R. M., et al. Easi-CRISPR: a robust method for one-step generation of mice carrying conditional and insertion alleles using long ssDNA donors and CRISPR ribonucleoproteins. Genome Biology. 18, 92 (2017).
- Miura, H., Quadros, R. M., Gurumurthy, C. B., Ohtsuka, M. Easi-CRISPR for creating knock-in and conditional knock-out mouse models using long ssDNA donors. Nature Protocols. 13, 195-215 (2018).
- Sano, S., et al. CRISPR-Mediated Gene Editing to Assess the Roles of Tet2 and Dnmt3a in Clonal Hematopoiesis and Cardiovascular Disease. Circulation Research. 123, 335-341 (2018).
- Cante-Barrett, K., et al. Lentiviral gene transfer into human and murine hematopoietic stem cells: size matters. BMC Research Notes. 9 (312), (2016).
- Chu, V. T., et al. Efficient CRISPR-mediated mutagenesis in primary immune cells using CrispRGold and a C57BL/6 Cas9 transgenic mouse line. Proceedings of the National Academy of Sciences of the United States of America. 113, 12514-12519 (2016).
- Fuster, J. J., et al. Clonal hematopoiesis associated with TET2 deficiency accelerates atherosclerosis development in mice. Science. 355, 842-847 (2017).
- Sano, S., et al. Tet2-Mediated Clonal Hematopoiesis Accelerates Heart Failure Through a Mechanism Involving the IL-1beta/NLRP3 Inflammasome. Journal of the American College of Cardiology. 71, 875-886 (2018).
- Sano, S., Wang, Y., Walsh, K. Clonal Hematopoiesis and Its Impact on Cardiovascular Disease. Circulatory Journal. 71, 875-886 (2018).
- Heckl, D., et al. Generation of mouse models of myeloid malignancy with combinatorial genetic lesions using CRISPR-Cas9 genome editing. Nature Biotechnology. 32, 941-946 (2014).
- Jiang, W., et al. An optimized method for high-titer lentivirus preparations without ultracentrifugation. Scientific Reports. 5, 13875 (2015).
- Cribbs, A. P., Kennedy, A., Gregory, B., Brennan, F. M. Simplified production and concentration of lentiviral vectors to achieve high transduction in primary human T cells. BMC Biotechnology. 13, 98 (2013).
- Brinkman, E. K., Chen, T., Amendola, M., van Steensel, B. Easy quantitative assessment of genome editing by sequence trace decomposition. Nucleic Acids Research. 42, e168 (2014).
- Sentmanat, M. F., Peters, S. T., Florian, C. P., Connelly, J. P., Pruett-Miller, S. M. A Survey of Validation Strategies for CRISPR-Cas9 Editing. Scientific Reports. 8, 888 (2018).
- Akcakaya, P., et al. In vivo CRISPR editing with no detectable genome-wide off-target mutations. Nature. 561, 416-419 (2018).
- Bae, S., Park, J., Kim, J. S. Cas-OFFinder: a fast and versatile algorithm that searches for potential off-target sites of Cas9 RNA-guided endonucleases. Bioinformatics. 30, 1473-1475 (2014).
- Kosicki, M., Tomberg, K., Bradley, A. Repair of double-strand breaks induced by CRISPR-Cas9 leads to large deletions and complex rearrangements. Nature Biotechnology. 36, 765-771 (2018).
- El-Brolosy, M. A., et al. Genetic compensation triggered by mutant mRNA degradation. Nature. 568, 193-197 (2019).
- Ma, Z., et al. PTC-bearing mRNA elicits a genetic compensation response via Upf3a and COMPASS components. Nature. 568, 259-263 (2019).
- Gilbert, L. A., et al. CRISPR-mediated modular RNA-guided regulation of transcription in eukaryotes. Cell. 154, 442-451 (2013).
- Qi, L. S., et al. Repurposing CRISPR as an RNA-guided platform for sequence-specific control of gene expression. Cell. 152, 1173-1183 (2013).
- Zhou, H., et al. In vivo simultaneous transcriptional activation of multiple genes in the brain using CRISPR-dCas9-activator transgenic mice. Nature Neuroscience. 21, 440-446 (2018).
- Fuster, J. J., Walsh, K. Somatic Mutations and Clonal Hematopoiesis: Unexpected Potential New Drivers of Age-Related Cardiovascular Disease. Circulatory Research. 122, 523-532 (2018).
- Kahn, J. D., et al. PPM1D truncating mutations confer resistance to chemotherapy and sensitivity to PPM1D inhibition in hematopoietic cells. Blood. , (2018).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır