Method Article
Лентивирный CRISPR/Cas9-Опосредованный геном Редактирование для изучения гематоподетические клетки в модели болезней
В этой статье
Резюме
Описаны протоколы для высокоэффективного редактирования генома гематопоатического стебля и клеток-прародителей (HSPC) системой CRISPR/Cas9 для быстрого развития систем мышиной модели с гематопоиетической системой конкретных модификаций генов.
Аннотация
Манипулирование генами в гематопоитических стволовых клетках с использованием традиционных подходов к трансгенезу может быть трудоемким, дорогостоящим и сложным. Извлекая выгоду из достижений в технологии редактирования генома и опосредованных трансгенных систем трансгена, здесь описан эффективный и экономичный метод, который устанавливает мышей, в которых гены манипулируются именно в гематопоитических стволовых клетках. Лентивирусы используются для преобразовывания Cas9-выражения линии отрицательных клеток костного мозга с руководством РНК (gRNA) ориентации конкретных генов и красный ген репортера флуоресценции (RFP), то эти клетки пересаживаются в смертельно облученных C57BL/6 мышей. Мыши, пересаженные с лентивирусом, выражающим нецелевую гРНК, используются в качестве средств контроля. Прививка трансумированных гематопоиетических стволовых клеток оценивается по течению цитометрического анализа ППП-положительных лейкоцитов периферической крови. Используя этот метод, 90% трансдукции миелоидных клеток и 70% лимфоидных клеток в течение 4 недель после трансплантации может быть достигнуто. Геномная ДНК изолирована от RFP-положительных кровяных клеток, и части целевого участка ДНК усиливаются ПЦР для проверки редактирования генома. Этот протокол обеспечивает высокую пропускную стоимость генов гематопойеза и может быть распространен на различные модели заболеваний мышей с участием гематопоитических клеток.
Введение
Многие исследования в области гематологии и иммунологии полагаются на наличие генетически модифицированных мышей, в том числе обычных и условных трансгенных / нокаут мышей, которые используют гематопоиетической системы конкретных Cre драйверов, таких как Mx1-Cre, Vav-Cre, и другие 1,2,3,4,5. Эти стратегии требуют создания новых штаммов мыши, которые могут быть трудоемкими и финансово обременительными. В то время как революционные достижения в технологии редактирования генома позволили генерации новых штаммов мыши всего за 3-4 месяца с соответствующими техническими знаниями6,7,8,9 , гораздо больше времени требуется, чтобы усилить колонию мыши, прежде чем эксперименты проводятся. Кроме того, эти процедуры являются дорогостоящими. Например, в Jackson Laboratory указана текущая цена услуг по генерации выбивачий мышей в $16 845 за штамм (по состоянию на декабрь 2018 года). Таким образом, более выгодными являются более экономичные и эффективные методы, чем обычные трансгенные подходы мурина.
Кластерные регулярно interspaced короткие палиндромные повторы / CRISPR связанных белков 9 (CRISPR/Cas9) технология привела к разработке новых инструментов для быстрого и эффективного РНК основе, последовательность конкретных редактирования генома. Первоначально обнаруженный как бактериальный адаптивный иммунный механизм для уничтожения вторгающихся патогенных ДНК, система CRISPR/Cas9 была использована в качестве инструмента для повышения эффективности редактирования генома в эукариотических клетках и животных моделях. Для передачи оборудования CRISPR/Cas9 в гематопоитические стволовые клетки (напротив, электропорация, нуклеофекция, липофектация, вирусная доставка и другие) использовался ряд подходов.
Здесь, лентивирусная система используется для преобразовать клетки из-за его способности эффективно заражать Cas9-выражения мурин гематопоиетических стволовых клеток и упаковать вместе руководство РНК экспрессии построить, промоутеры, нормативные последовательности, и гены, которые кодируют флуоресцентные белки репортера (т.е. GFP, RFP). Используя этот метод, ex vivo редактирование гена мыши гематопоатические стволовые клетки была достигнута, а затем успешное восстановление костного мозга в смертельно облученных мышей10. Вектор лентивирусов, используемых для этого исследования выражает Cas9 и GFP репортер генов от общего ядра EF1a промоутер с внутренней рибосомной вступления сайта вверх по течению от гена репортера. Последовательность НАправляющей РНК выражается от отдельного промоутера U6. Эта система затем используется для создания вставки и удаления мутаций в кандидат клональных hematopoiesis драйвер генов Tet2 и Dnmt3a10. Тем не менее, эффективность трансдукции с помощью этого метода является относительно низкой (5%-10%) из-за большого размера векторной вставки (13 Кбит/с), что ограничивает эффективность трансдукции и уменьшает вирус титер во время производства.
В других исследованиях было показано, что больший размер вирусной РНК негативно влияет как на производство вируса, так и на эффективность трансдукции. Например, 1 кб увеличение размера вставки, как сообщается, уменьшить производство вируса на 50%, и эффективность трансдукции снизится до более чем 50% в мыши гематопоитических стволовых клеток11. Таким образом, для повышения эффективности системы выгодно максимально уменьшить размер вирусной вставки.
Этот недостаток можно преодолеть, используя Cas9 трансгенных мышей, в которых белок Cas9 выражается либо в составной или индуцируемой образом12. Составные CRISPR/Cas9 стук-в мышей выражает Cas9 эндонуклеазы и EGFP от промоутера CAG на Rosa26 локус в повсеместной манере. Таким образом, конструкция с sgRNA под контролем промоутера U6 и гена репортера RFP под контролем основного промоутера EF1a может быть доставлена с помощью лентивирусного вектора для достижения редактирования генома. С помощью этой системы, гены гематопоитических стволовых клеток были успешно отредактированы, показывая эффективность трансдукции 90%. Таким образом, этот протокол обеспечивает быстрый и эффективный метод создания мышей, в которых целевые генные мутации вводятся в гематопоитической системы. В то время как наша лаборатория в основном использует этот тип технологии для изучения роли клонального гематопоеза в сердечно-сосудистых процессах13,14,15, это также применимо к исследованиям гематологических злокачественности16. Кроме того, этот протокол может быть распространен на анализ того, как мутации ДНК в HSPC влияют на другие заболевания или процессы развития в гематопойтической системе.
Для создания надежной системы вектора лентивирусного вектора необходимы высокие вирусные запасы титра и оптимизированные условия для трансдукции и трансплантации гематопоитических клеток. В протоколе предусмотрены инструкции по подготовке высокотиере вирусного запаса в разделе 1, оптимизации культурных условий гематопоатических стволовых клеток в разделе 2, методах трансплантации костного мозга в разделе 3, а также оценке Прививка в разделе 4.
протокол
Все процедуры, касающиеся животных, были одобрены Институциональным комитетом по уходу за животными и использованию (IACUC) при Университете Вирджинии.
1. Генерация и очистка частиц лентивирусного имеет
ПРИМЕЧАНИЕ: Частицы лентивирусного содержащего оптимизированную НАправляемую РНК могут быть получены по подробным протоколам, предоставленным Addgene: slt;https://media.addgene.org/cms/files/Чжан-лаб-ЛентиCRISPР-library-protocol.pdf.pdf.gt.; Оптимизированные методы подготовки и хранения высокотиевого лентивирусного препарата обсуждаются в другом месте17,18. Короче говоря, лентивирусы производятся путем со-трансфекции лентивирусного переносчика плазмиды, psPAX2 и pMD2.G в клетки HEK 293T. Культура супернатант собирается на 48 ч после трансфекции и сосредоточены ультрацентрифугации. Лентивирный титр определяется на основе коммерческих qPCR-аналитического ониска. Эта процедура должна быть выполнена в кабинете класса биобезопасности II.
- Подготовка раствора коллагена 1:200 (0.0005%) в 1x PBS.
- Пальто 6 хорошо пластины с коллагена раствор и инкубировать при 37 градусах Цельсия, 5% CO2 в течение 30 мин.
- Семена 293T клеток при плотности 1 х 106 клеток на скважину и инкубировать при 37 градусах Цельсия, 5% CO2 для 2 ч.
- Чтобы подготовить смесь из трех трансфекционных плазмидов для одной скважины, смешайте 0,9 мкг лентивирусного вектора, 0,6 мкг psPAX2 и 0,3 мкг pMD2.G, затем добьетесь общего объема в 10 л, добавив деионизированную воду. Отрегулируйте суммы соответственно в зависимости от количества скважин. Количество и соотношение каждой плазмиды, возможно, потребуется дополнительно оптимизировать в соответствии с потребностями исследователей.
- Аккуратно добавьте 50 кл. 1x PBS и 5 л разбавленного PEI MAX (1,0 мг/мл) в плазмидную смесь и инкубируйте в течение 15 мин при комнатной температуре (RT) (таблица 1).
- Добавьте в смесь 1 мл DMEM.
- Аспирные носители из 6 хорошо пластины, добавить 1 мл плазмидной смеси, и инкубировать при 37 кв С, 5% CO2 для 3 ч.
- Замените носители на 2 мл свежего DMEM и инкубировать при 37 градусах Цельсия, 5% CO2 на 24 ч.
- Добавьте 1 мл свежего DMEM и инкубируют при 37 градусах Цельсия, 5% CO2 для дополнительных 24 ч (общее время инкубации 48 ч).
- Перенесите культурный супернатант в трубку 50 мл и центрифугу на 3000 х г в течение 15 минут, чтобы удалить любые свободно плавающие клетки.
- Фильтр супернатант через фильтр 0,45 мкм.
- Перенесите фильтрат в полипропиленовые центрифуги.
- Ультрацентрифуге при 4 градусах по Цельсию и 72 100 х г при rmax в течение 3 ч.
- Тщательно аспирируйте супернатант, оставляя за собой белые гранулы.
- Приостановите гранулы с 100 зл сыворотки без гематопоатической среды расширения клеток без аэрации.
- Держите аликвот 10 qL для измерения вирусного титра и хранить все оставшиеся aliquots на -80 градусов по Цельсию до тех пор, пока требуется.
- Титрат вирус с qPCR основе ассе в соответствии с инструкциями производителя с использованием 10 qL вирусных aliquot.
2. Изоляция и трансдукция линий отрицательных клеток из костного мозга мыши(рисунок 1A)
ПРИМЕЧАНИЕ: Как правило, для изоляции достаточно клеток, пары tibias, бедренной кости, и humeri собирают сявки из каждой мыши. Тазовые и спинномозговые кости также могут быть собраны в качестве источника линии отрицательных клеток.
- Изоляция клеток костного мозга
- Эвтаназия 8-10 недель мужчин CRISPR / Cas9 стук в мышах на 5% изофлуран с последующим вывихом шейки матки, а затем дезинфицировать кожу с 70% этанола.
- Используя вскрытия ножницы, сделать поперечный разрез в коже чуть ниже грудной клетки и очистить кожу дистически в обоих направлениях, чтобы разоблачить ноги и руки.
- Тщательно отделите нижние конечности от тазобедренной кости, вывихнув тазобедренный сустав. Вырезать вдоль бедренной кости голову, чтобы удалить бедренную кейд полностью из бедра. Вывихнуть колено и вырезать на суставе, чтобы отделить бедренной кости и голени, сохраняя при этом эпифиз кости нетронутыми. Вывихните голеностопный сустав и отслаить стопу и дополнительные мышцы.
- Используя рассекающие ножницы, вырежьте через плечо, чтобы отсоединить верхние конечности. Вывихните плечо, а затем вырезать на локтевом суставе для сбора плечевой кости.
- Используйте целлюлозно-волоконные салфетки, чтобы тщательно удалить мышцы из бедренной кости, tibias, и humeri. Примите дополнительные меры предосторожности, чтобы убедиться, что кости не ломаются во время этого процесса.
- Поместите изолированные кости в коническую трубку 50 мл, содержащую RPMI, и поместите на лед.
ПРИМЕЧАНИЕ: Следующие шаги должны быть выполнены в кабинете класса биобезопасности II. - Перенесите кости в стерильное, 100-мм культурное блюдо.
- Возьмитеке кость тупыми щипками и с помощью рассеченных ножниц, аккуратно вырежьте обе эпифиза.
ПРИМЕЧАНИЕ: Недостаточная резка приведет к неполному флеш костному мозгу, в то время как чрезмерно агрессивная резка приведет к потере клеток. - Заполните 10 мл шприц с ледяной RPMI, и с помощью 22 G иглы, промыть костный мозг из вала в новый 100 мм культуры блюдо.
ПРИМЕЧАНИЕ: Кости станут белыми и полупрозрачными, если костной вал был хорошо покраснел. Если нет, повторно вырезать концы костей и флеш снова. - После того, как все костного мозга был собран, сделать одноклеточную подвеску, проходя костного мозга несколько раз через 10 мл шприц с 18 G иглы. Повторите 10x, чтобы обеспечить одноклеточную подвеску.
- Подвеска фильтра ячейки через 70 мкм ячейки ситечко в 50 мл конической трубки.
- Центрифуга при 310 х г в течение 10 мин при 4 градусах По цельсию.
- Придя в супернатант и повторите клеточные гранулы в соответствующем объеме оптимизированного буфера разделения для следующего процесса разделения клеток.
- Изоляция и трансдукция линий отрицательных клеток
ПРИМЕЧАНИЕ: Мышь линии отрицательных клеток изолированы от костного мозга Cas9 трансгенных мышей3, или других штаммов мышей, используя комплект истощения линии в соответствии с инструкциями производителя. Как правило, линии отрицательных клеток составляют 2%-5% от целых клеток костного мозга, и чистота, как правило, больше, чем 90% после изоляции. Изолированные линии отрицательных клеток культивируются в сыворотке свободной гематопоатической клеточной экспансии среднего дополнены 20 нг /мл рекомбинантный мурновый TPO и 50 нг/мл рекомбинантный мурин SCF, а затем трансцируется с лентивирусным вектором для 16 ч при многообразии инфекции (МВД) No 100.- Чтобы изолировать линии отрицательных клеток, используйте комплект истощения линейных клеток в соответствии с инструкциями производителя.
- После изоляции повторно ещих линий отрицательных клеток в 1 мл безсыворотки гематопоитической клеточной среды расширения.
- Семя клетки в 6 хорошо пластины при плотности 1,5 х 106 клеток / мл (5 х 105 линии отрицательных клеток / мыши.)
- Добавьте рекомбинантный murine TPO и SCF в скважины при конечной концентрации 20 нг/мл и 50 нг/мл, соответственно.
- Предварительно инкубировать клетки при 37 градусах Цельсия в 5% CO2 для 2 ч.
- Добавить лецивирус в МВД 100, 4 мкг/мл полибрена, и пенициллин / стрептомицин в скважины и инкубировать при 37 градусах Цельсия, 5% CO2 для 16-20 ч (Рисунок 1B).
- На следующий день соберите лентивирус, передаваемые клетки в коническую трубку 15 мл и центрифугу при 300 г в течение 10 мин.
- Тщательно аспирируйте супернатант и resuspend гранулы в 200 Зл RPMI на мышь. Держите клетки на RT до трансплантации на мышей (раздел 3).
3. Трансплантация передаваемых клеток в смертельно облученных мышей
- В день трансплантации костного мозга, место реципиента мышей в восьмисрезной клетке пирог и подвергать их в двух дозах всего облучения тела (550 Rad/доза, общая доза 1100 Rad), с примерно 4 ч между каждой сессии облучения.
- После второй сессии облучения, вводить транс-линии отрицательных клеток для каждой анестезирующей мыши получателя через ретро-орбитальной вены сплетение (200 л в общей сложности) с помощью инсулина шприц(Рисунок 1C).
- После облучения мышей следует разместить в стерилизованных клетках и обеспечить мягкой диетой и питьевой водой, дополненной антибиотиками на 14 г.
- Через 3-4 недели после трансплантации костного мозга проанализируйте периферийную кровь, чтобы проверить на наличие трансплантата трансиндуцированных донорских клеток (раздел 4).
4. Оценка химеризма периферической крови
- Анестезируйские мыши с 5% изолюран и получить образец крови из ретро-орбитальной вены с помощью капиллярных труб, и собрать его в K2EDTA труб (объем в одной капиллярной трубке достаточно для следующего анализа).
- Передача 20 л крови из трубK2EDTA в 5 мл круглых нижних пробирки полистирола, и положить на лед.
- Добавьте 1,5 мл буфера лиза РБК в лиза эритроциты. Инкубировать в течение 5 мин на льду.
- Чтобы нейтрализовать буфер лизиса, промойте образцы буфером FACS (1,5 мл/образец).
- Центрифуга при 609 х г при rmax в течение 5 мин при 4 градусах По цельсию. Отбросьте супернатант.
- Инкубировать клетки коктейлем из моноклональных антител (разбавленных в 100 л буфера/образца FACS) на RT в течение 20 минут в темноте. Полный список антител приведен в разделе Материалы выше.
- Вымойте ячейки один раз с буфером FACS (2 мл/образец). Центрифуга при 609 х г приr max (1800 об/мин) в течение 5 мин при 4 градусах Цельсия. Откажитесь от супернатанта полностью.
- Исправьте клетки параформальдегидом, содержащим буфер фиксации (100 л/трубка) в течение 10 минут при 4 градусах Цельсия.
- Вымойте клетки один раз с буфером FACS (3 мл/образец). Центрифуга при 609 х г приr max (1800 об/мин) в течение 5 мин при 4 градусах Цельсия. Откажитесь от супернатанта полностью.
- Приостановить гранулы в 400 qL буфера FACS.
- Держите образцы при 4 градусах Цельсия до анализа цитометрией потока.
Результаты
Используя описанный выше протокол, было получено примерно 0,8-1,0 х 108 клеток костного мозга на мышь. Количество линейных отрицательных ячеек, которые мы получаем, составляет примерно 3 х 106 ячеек на мышь. Как правило, урожайность линий костного мозга отрицательных клеток составляет 4%-5% от общего числа ячеек костного мозга.
Химеризм трансиндуцированных клеток (RFP-положительный) оценивается по течению цитометрии периферической крови(рисунок 2A,B). Кровь изолирована от ретроорбитальной вены, и соответствующие маркеры используются для определения идентичности каждой популяции гематопоиетических клеток (т.е. нейтрофилов, моноцитов, Т-клеток и т.д.) (Рисунок 3A,B). Геномная ДНК может быть изолирована от RFP-положительных кровяных клеток, а участки целевого участка ДНК могут быть усилены ПЦР и подклонированы в векторы клонирования TA для анализа последовательности. Эти плазмиды трансцмируются в кишечную палочку, и последовательности целевого участка определяются секвенированием Sanger(рисунок 4). Кроме того, последовательности целевых участков могут быть определены другими методами, такими как секвенирование Сэнгера объединенного генома с последующим отслеживанием индель с помощью анализа разложения (TIDE)10. Для контроля условие, мышей, как правило, пересаживаются с клетками, которые трансумции с лентивирусом, выражающим нетаргетинг руководство РНК.
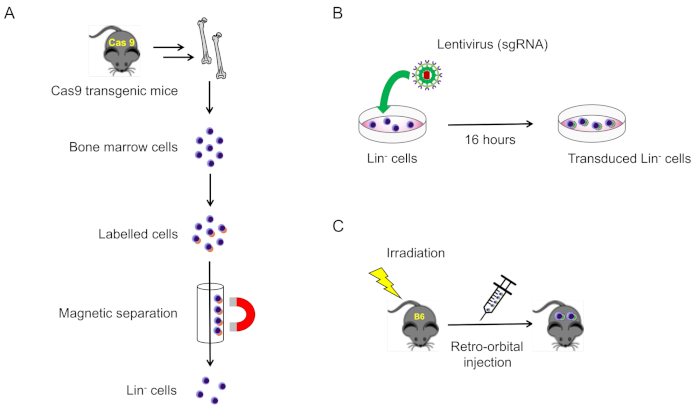
Рисунок 1: Схематическая иллюстрация этого протокола. (A) Изоляция линейных отрицательных клеток костного мозга от cas9-выражающих мышей (раздел 2.1). (B) Трансдукция лентивирусной линии отрицательных клеток (раздел 2.2). (C) Ретроорбитальная инъекция передаваемых клеток в смертельно облученных мышей дикого типа (раздел 3). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
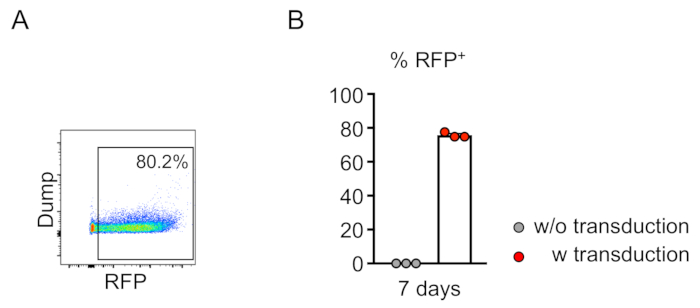
Рисунок 2: Эффективная лентивирная трансдукция линии костного мозга мыши-отрицательных клеток in vitro. (A) Анализ цитометрии потока показывает успешную трансдукцию линейных отрицательных клеток. Анализ проводился после 7 дней культуры in vitro. (B) В среднем, 75,7% клеток были трансумированы в этом ассее (n No 3). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
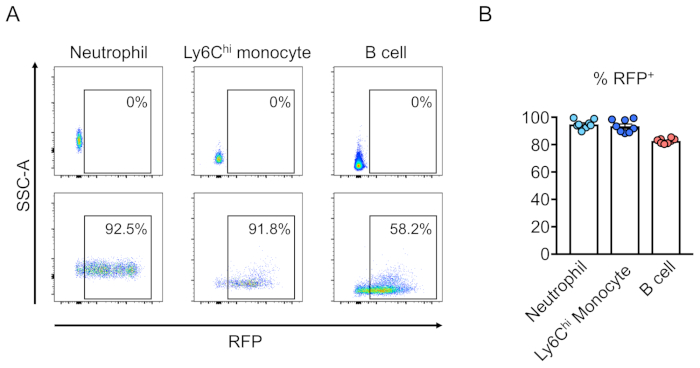
Рисунок 3:Восстановлениесмертельно облученного костного мозга мыши трансумированными линиями отрицательных клеток. (A) Анализ цитометрии потока периферической крови мыши после восстановления гематопоиэтичными стволовыми клетками, которые были (внизу) или не были (сверху) трансумцированные с лентивирусом, выражающим RFP. Нейтрофилы определяются как Ly6Gи Ly6Cпривет моноцитов, как Ly6G- и Ly6C,и В-клеток, как CD45R. (B) В этих анализах, в среднем 94,8%, 93,5%, и 82,7% клеток RFP- в нейтрофила, Ly6Cпривет моноцитов, и B-клеток населения, соответственно (n No 8). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
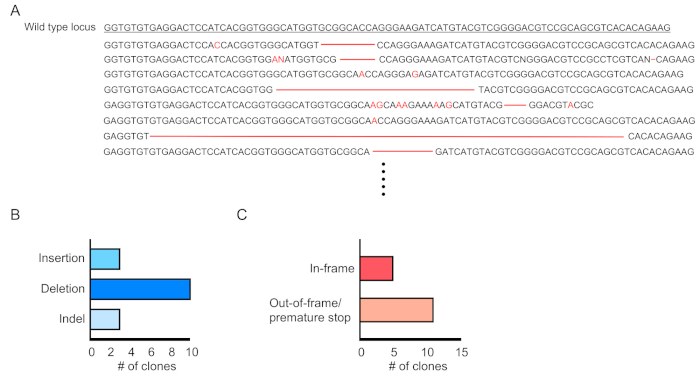
Рисунок 4:Оценка редактирования генов в трансиндуцированных клетках крови. (A) Пример редактирования генов, показывающий результаты секвенирования мутировавших локуса Dnmt3a в ПФР-положительных кровяных клетках. Удаления отображаются как красные тире, а вставки обозначаются красными буквами. (B) Резюме обнаруженных мутаций. (C) 69% (11/16 клонов) показали вне кадра / преждевременной остановки мутаций. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
| Плазмидные | Размер (bp) | Количество на скважину (мкг) | Соотношение |
| pLKO5.0 | 7700 | 0.9 | 2 |
| psPAX2 | 10668 | 0.6 | 1 |
| pMD2.G | 5822 | 0.3 | 1 |
| PEI-макс (запас: 100 мг/мл) | 5 л/ну | ||
Таблица 1: Количество плазмида и PEI-max, используемого для трансфекции.
Обсуждение
Преимуществом этого протокола является создание моделей животных, укрывающих специфические мутации в гематоподетические клетки быстрым и высокорентабельным образом по сравнению с обычными трансгенными подходами мыши. Было установлено, что эта методология позволяет поколения мышей с гематопоиетических клеточных генных манипуляций в течение 1 месяца. В этом протоколе есть несколько важных шагов, которые требуют дальнейшего рассмотрения.
Скрининг последовательности gRNA
Рекомендуется тестировать gRNAs in vitro для оценки эффективности редактирования до проведения экспериментов in vivo. Эффективность GRNA проверяется с помощью бесклеточной системы транскрипции и скрининга. Транскрибированная гРНК проверяется путем измерения ее эффективности при расщевиде испуге ДНК шаблона в присутствии рекомбинантного белка Cas9, с использованием электрофорасиса геля агарозы. Для этой цели имеются коммерчески доступные комплекты.
Здесь, indel мутации характеризуются tA клонирования ПЦР продуктов усиливается из редактируемой области, преобразование бактериальных клеток с этими плазмиды, и собирание отдельных колоний для секвенирования Сэнгера. Однако этот метод трудоемкий и отнимает много времени. Кроме того, секвенирование следующего поколения (NGS) или объединенное секвенирование ДНК с последующим анализом TIDE может быть выполнено19. Алгоритм TIDE был создан для анализа следов последовательности Sanger, генерируемых из сложных образцов. Было показано, что indel оценки с TIDE, как правило, в соответствии с теми, вне целевых NGS20. Аналитическое программное обеспечение доступно в Режиме онлайн по адресу: zlt;http://tide.nki.nl.gt;.
Поколение высокотизерных лентивирусных частиц
Вирусный везикулярный стоматит вирус G-белок, который имеет важное значение для клеточной инфекции, является высоко рН чувствительным. Таким образом, важно держать среду культуры в приемлемом диапазоне рН, и она не должна развивать желтоватый вид. Коллагеновпокрытиех блюд для генерации вируса используются, потому что это ускоряет крепление клеток HEK293T и позволяет производительность трансфекции в течение нескольких часов, а не ждать всю ночь. Однако, в зависимости от экспериментального графика, можно также рассмотреть возможность ночной инкубации.
Очистка частиц лентивирусной системы
Для достижения эффективной трансдукции гематопоитических стволовых клеток, необходимо генерировать высокотизерный лентивирус. Оптимизация скорости центрифугирования является ключевой особенностью. Хотя концентрация лентивирус, как правило, выполняется на 90000 х г, несколько докладов показали, что восстановление вируса увеличивается, если материал центрифугируется с меньшей скоростью 20000 х г18. Производство высокотитра лентивирусного препарата без ультрацентрифугации также было предложено17. Следует отметить, что важно приостановить вирус центрифугации гранулы, избегая при этом энергичные пипетки, чтобы свести к минимуму аэрации и сохранить целостность вируса. Высокотизерные лецивирусные частицы необходимы для эффективного трансдукции гематопогетических стволовых клеток11. Экспериментальные эксперименты показали, что МВД 100 является оптимальным с точки зрения эффективности трансдукции и жизнеспособности клеток. Рекомендуется оценивать запасы лентивирусного сырья на основе жизнеспособности клеток и эффективности трансдукции.
Хранение лентивирусных частиц
Титер лентивирусов очень чувствителен к температуре, а титер может быть резко уменьшен из-за ненадлежащих условий хранения и повторных циклов замораживания-оттепели. Было установлено, что эффективность трансдукции лентивируса быстро снижается при хранении на 4 градусах По области (1/2) и 1,3 дня или подвергается множественным циклам замораживания оттепели (т(1/2) и 1,1 патрона. Препараты вируса рекомендуется заморозить в жидком азоте или дробленом сухом льду вскоре после того, как вирусная гранулы будет приостановлена. Вирусные запасы должны быть сохранены на уровне -80 градусов и оттаяли на льду, чтобы RT непосредственно перед эквилибрией и использовать11.
Следует отметить ряд потенциальных ограничений. Во-первых, внедрение внецелевых индельных мутаций CRISPR/Cas9 уже давно ценится. Также было показано, что CRISPR/Cas9 может вызывать внецелевые мутации in vivo21. На практике, вне целевых indel мутаций можно избежать с помощью последовательностей gRNA, которые тесно совпадают с целевыми участками генома и имеют более четырех несоответствий предсказанным вторичным участкам. Такая конструкция может быть сделано с существующими в silico инструментов22. Доступны и другие вычислительные инструменты для прогнозирования gRNA с минимизацией внецелевых действий (злт;http://portals.broadinstitute.org/gpp/public/analysis-tools/sgrna-design) или lt;http:///www.Benchling.com.com.gt;). Это также может быть полезно проанализировать модель животных с помощью двух или более различных gRNAs для подтверждения фенотипа и свести к минимуму возможность того, что наблюдаемый фенотип опосредовано вне целевого эффекта конкретного gRNA.
В дополнение к обычным индель мутации, созданные CRISPR / Cas9, большие удаления, которые выходят за километры были зарегистрированы. Это может смутить исследования; однако, эти большие удаления, как сообщается, гораздо меньше частоты по сравнению с indels23. Еще одной потенциальной проблемой является генетическая компенсация. Сообщалось, что мутант РНК с преждевременным прекращением кодон (PTC) может привести к upregulation связанных генов с последовательностью сходство COMPASS комплексно-опосредованной активации транскрипции24,25. Это событие было предложено быть механизмом, который может привести к фенотипическим различиям между нокаутом и нокдаун подходов абляции генов. Поскольку редактирование генома опосредованного CRISPR/Cas9 в значительной степени зависит от стохастического внедрения мутаций, которые приводят к генерации PTC, генетическая компенсация может изменить фенотип. Чтобы избежать генетической компенсации, можно рассматривать эксперименты, в которых регулятивные последовательности гена нацелены на CRISPR/Cas9 или введением эпигенетических модификаторов с использованием Cas9 в качестве платформы распознавания ДНК с рнковой наведением.
Наконец, следует признать, что гематопоез из клеток, привяженных в смертельно облученных мышей может отличаться от местных условий hematopoiesis. Кроме того, облучение может иметь системное воздействие на организм, что может затруднить интерпретацию экспериментов, исследующих последствия генных мутаций в гематопоиетических клетках.
Исследователи воспользовались каталитически неактивными белками Cas9 (dCas9) в качестве "платформы распознавания ДНК, управляемой РНК" и использовали белки синтеза dCas9 для локализации доменов эффекторов в конкретных последовательностях ДНК для либо репрессии (CRISPRi), либо активации (CRISPRa) транскрипция вне цели генов26,27. В то время как этот протокол использует каталиталически активных трансгенных мышей Cas9 для введения расщепления dsDNA в последовательности геномной ДНК, эпигенетическая модификация для подавления или активации конкретных генов применима путем сплавления dCas9 с доменами-модификаторами хроматина, такими как dCas9-KRAB или dCas9-VP64, соответственно. Кроме того, dCas9 может быть использован в качестве транскрипционного репрессора как свой собственный, блокируя транскрипционные механизмы для доступа к гену сайта27. Совсем недавно, Чжоу и др. создана dCas9-SunTag-p65-HSF1 (SPH) трансгенных мышей, которые выражают модифицированную версию эпигенетического активатора, слитого с dCas9 и показали, что эта система CRISPRa функционирует в vivo28.
Наша лаборатория в основном использует эту технологию для изучения роли клонального гематопоеза в процессах сердечно-сосудистых заболеваний. В размножающейся ткани, соматические мутации в генах драйвера рака могут предоставить клеточное преимущество роста и привести к аномальным клональным расширениям. В гематопойетической системе этот процесс известен как "клональный гематопоезии", и он приводит к ситуациям, когда значительная часть лейкоцитов человека заменяется клонами-мутантами. Существует растущее понимание того, что аномальные клональные расширения ускоряют сердечно-сосудистые заболевания, такие как атеросклероз и сердечная недостаточность, и способствуют заболеваемости и смертности от всех причин15,29.
В последнее время причинно-следственная связь между несколькими из этих соматических мутаций и сердечно-сосудистых заболеваний была документально подтверждена, и аспекты основных механизмов были выяснены10,13,14. Тем не менее, эти соматические мутации, вероятно, представляют собой "верхушку айсберга", так как эпидемиологические исследования показали, что многие дополнительные гены кандидатов связаны с клональным гематопоезом и, потенциально, повышенной смертностью от сердечно-сосудистых заболеваний. Таким образом, требуется систематическая, более высокая пропускная оценка клональных генов гематопоеза. Текущие исследования причинно-следственной связи клональных гематопоези и сердечно-сосудистых заболеваний основаны на анализе мышей с гематопоиетической системой специфических условных трансгенных (Mx1-Cre, Vav-Cre и т.д.) или мышей после пересадки костного мозга. Эти стратегии, однако, необходимо создать новые колонии мыши и может стать финансовым и физическим бременем для исследователей. Таким образом, оправдан более дешевый и быстрый метод, чем обычный подход к трансгении/нокауту, применяемый в прошлом. Лентивирные векторы для преобразовывания технологий HSPC и CRISPR для разработки мутаций, как описано в данной рукописи, облегчают изучение клональных гематопоези и сердечно-сосудистых заболеваний.
В дополнение к созданию обычного выбивания локуса, этот метод применим к производству усеченных мутировавших белков. Например, исследователи успешно создали гематопоитического Ppm1d усечение, которое часто наблюдается у пациентов с клональным hematopoiesis, путем введения кадрового смещения мутаций с gRNA ориентации экзон 6 гена Ppm1d30.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
S. S. была поддержана Американской ассоциацией сердца постдокторской стипендий 17POST33670076. К.В. был поддержан грантами NIH R01 HL138014, R01 HL141256 и R01 HL139819.
Материалы
| Name | Company | Catalog Number | Comments |
| RPMI Medium 1640 (1X) | Gibco | 11875-093 | Medium |
| Sulfamethoxazole and Trimethoprim injection | TEVA | 0703-9526-01 | |
| 1/2 cc LO-DOSE INSULIN SYRINGE | EXELINT | 26028 | general supply |
| 293T cells | ATCC | CRL-3216-- | Cell line |
| APC-anti-mouse Ly6C (Clone AL-21) | BD Biosciences | 560599 | Antibodies |
| APC-Cy7-anti-mouse CD45R (RA3-6B2) | BD Biosciences | 552094 | Antibodies |
| BD Luer-Lok disposable syringes, 10 ml | BD | 309604 | general supply |
| BD Microtainer blood collection tubes, K2EDTA added | BD Bioscience | 365974 | general supply |
| BD Precisionglide needle, 18 G | BD | 305195 | general supply |
| BD Precisionglide needle, 22 G | BD | 305155 | general supply |
| BV510-anti-mouse CD8a (Clone 53-6.7) | Biolegend | 100752 | Antibodies |
| BV711-anti-mouse CD3e (Clone 145-2C11) | Biolegend | 100349 | Antibodies |
| Collagen from calf skin | Sigma-Aldrich | 9007-34-5 | general supply |
| Corning Costar Ultra-Low Attachment Multiple Well Plate, 6 well | Millipore Sigma | CLS3471 | general supply |
| CRISPR/Cas9 knock-in mice | The Jackson Laboratory | 028555 | mouse |
| DietGel 76A | Clear H2O | 70-01-5022 | general supply |
| Dulbecco’s Modified Eagle’s Medium (DMEM) - high glucose | Sigma Aldrich | D6429 | Medium |
| eBioscience 1X RBC Lysis Buffer | Thermo fisher Scientific | 00-4333-57 | Solution |
| Falcon 100 mm TC-Treated Cell Culture Dish | Life Sciences | 353003 | general supply |
| Falcon 5 mL round bottom polystyrene test tube | Life Sciences | 352054 | general supply |
| Falcon 50 mL Conical Centrifuge Tubes | Fisher Scientific | 352098 | general supply |
| Falcon 6 Well Clear Flat Bottom TC-Treated Multiwell Cell Culture Plate | Life Science | 353046 | general supply |
| Fisherbrand microhematocrit capillary tubes | Thermo Fisher Scientific | 22-362566 | general supply |
| Fisherbrand sterile cell strainers, 70 μm | Fisher Scientific | 22363548 | general supply |
| FITC-anti-mouse CD4 (Clone RM4-5) | Invitrogen | 11-0042-85 | Antibodies |
| Fixation Buffer | BD Bioscience | 554655 | Solution |
| Guide-it Compete sgRNA Screening Systems | Clontech | 632636 | Kit |
| Isothesia (Isoflurane) solution | Henry Schein | 29404 | Solution |
| Lenti-X qRT-PCR Titration Kit | Takara | 631235 | Kit |
| Lineage Cell Depletion Kit, mouse | Miltenyi Biotec | 130-090-858 | Kit |
| Millex-HV Syringe Filter Unit, 0.45 mm | Millipore Sigma | SLHV004SL | general supply |
| PBS pH7.4 (1X) | Gibco | 10010023 | Solution |
| PE-Cy7-anti-mouse CD115 (Clone AFS98) | eBioscience | 25-1152-82 | Antibodies |
| PEI MAX | Polysciences | 24765-1 | Solution |
| Penicillin-Streptomycin Mixture | Lonza | 17-602F | Solution |
| PerCP-Cy5.5-anti-mouse Ly6G (Clone 1A8) | BD Biosciences | 560602 | Antibodies |
| pLKO5.sgRNA.EFS.tRFP | Addgene | 57823 | Plasmid |
| pMG2D | Addgene | 12259 | Plasmid |
| Polybrene Infection/Transfection Reagent | Sigma Aldrich | TR-1003-G | Solution |
| Polypropylene Centrifuge Tubes | BECKMAN COULTER | 326823 | general supply |
| psPAX2 | Addgene | 12260 | Plasmid |
| RadDisk – Rodent Irradiator Disk | Braintree Scientific | IRD-P M | general supply |
| Recombinant Murine SCF | Peprotech | 250-03 | Solution |
| Recombinant Murine TPO | Peprotech | 315-14 | Solution |
| StemSpan SFEM | STEMCELL Technologies | 09600 | Solution |
| TOPO TA cloning kit for sequencing with One Shot TOP10 Chemically Competent E.coli | Thermo fisher Scientific | K457501 | Kit |
| Zombie Aqua Fixable Viability Kit | BioLegend | 423102 | Solution |
Ссылки
- Sasaki, Y., et al. Defective immune responses in mice lacking LUBAC-mediated linear ubiquitination in B cells. EMBO Journal. 32, 2463-2476 (2013).
- Ogilvy, S., et al. Transcriptional regulation of vav, a gene expressed throughout the hematopoietic compartment. Blood. 91, 419-430 (1998).
- Meyer, S. E., et al. DNMT3A Haploinsufficiency Transforms FLT3ITD Myeloproliferative Disease into a Rapid, Spontaneous, and Fully Penetrant Acute Myeloid Leukemia. Cancer Discovery. 6, 501-515 (2016).
- Kuhn, R., Schwenk, F., Aguet, M., Rajewsky, K. Inducible gene targeting in mice. Science. 269, 1427-1429 (1995).
- Cole, C. B., et al. PML-RARA requires DNA methyltransferase 3A to initiate acute promyelocytic leukemia. Journal of Clinical Investigation. 126, 85-98 (2016).
- Yang, H., et al. One-step generation of mice carrying reporter and conditional alleles by CRISPR/Cas-mediated genome engineering. Cell. 154, 1370-1379 (2013).
- Wang, H., et al. One-step generation of mice carrying mutations in multiple genes by CRISPR/Cas-mediated genome engineering. Cell. 153, 910-918 (2013).
- Quadros, R. M., et al. Easi-CRISPR: a robust method for one-step generation of mice carrying conditional and insertion alleles using long ssDNA donors and CRISPR ribonucleoproteins. Genome Biology. 18, 92 (2017).
- Miura, H., Quadros, R. M., Gurumurthy, C. B., Ohtsuka, M. Easi-CRISPR for creating knock-in and conditional knock-out mouse models using long ssDNA donors. Nature Protocols. 13, 195-215 (2018).
- Sano, S., et al. CRISPR-Mediated Gene Editing to Assess the Roles of Tet2 and Dnmt3a in Clonal Hematopoiesis and Cardiovascular Disease. Circulation Research. 123, 335-341 (2018).
- Cante-Barrett, K., et al. Lentiviral gene transfer into human and murine hematopoietic stem cells: size matters. BMC Research Notes. 9 (312), (2016).
- Chu, V. T., et al. Efficient CRISPR-mediated mutagenesis in primary immune cells using CrispRGold and a C57BL/6 Cas9 transgenic mouse line. Proceedings of the National Academy of Sciences of the United States of America. 113, 12514-12519 (2016).
- Fuster, J. J., et al. Clonal hematopoiesis associated with TET2 deficiency accelerates atherosclerosis development in mice. Science. 355, 842-847 (2017).
- Sano, S., et al. Tet2-Mediated Clonal Hematopoiesis Accelerates Heart Failure Through a Mechanism Involving the IL-1beta/NLRP3 Inflammasome. Journal of the American College of Cardiology. 71, 875-886 (2018).
- Sano, S., Wang, Y., Walsh, K. Clonal Hematopoiesis and Its Impact on Cardiovascular Disease. Circulatory Journal. 71, 875-886 (2018).
- Heckl, D., et al. Generation of mouse models of myeloid malignancy with combinatorial genetic lesions using CRISPR-Cas9 genome editing. Nature Biotechnology. 32, 941-946 (2014).
- Jiang, W., et al. An optimized method for high-titer lentivirus preparations without ultracentrifugation. Scientific Reports. 5, 13875 (2015).
- Cribbs, A. P., Kennedy, A., Gregory, B., Brennan, F. M. Simplified production and concentration of lentiviral vectors to achieve high transduction in primary human T cells. BMC Biotechnology. 13, 98 (2013).
- Brinkman, E. K., Chen, T., Amendola, M., van Steensel, B. Easy quantitative assessment of genome editing by sequence trace decomposition. Nucleic Acids Research. 42, e168 (2014).
- Sentmanat, M. F., Peters, S. T., Florian, C. P., Connelly, J. P., Pruett-Miller, S. M. A Survey of Validation Strategies for CRISPR-Cas9 Editing. Scientific Reports. 8, 888 (2018).
- Akcakaya, P., et al. In vivo CRISPR editing with no detectable genome-wide off-target mutations. Nature. 561, 416-419 (2018).
- Bae, S., Park, J., Kim, J. S. Cas-OFFinder: a fast and versatile algorithm that searches for potential off-target sites of Cas9 RNA-guided endonucleases. Bioinformatics. 30, 1473-1475 (2014).
- Kosicki, M., Tomberg, K., Bradley, A. Repair of double-strand breaks induced by CRISPR-Cas9 leads to large deletions and complex rearrangements. Nature Biotechnology. 36, 765-771 (2018).
- El-Brolosy, M. A., et al. Genetic compensation triggered by mutant mRNA degradation. Nature. 568, 193-197 (2019).
- Ma, Z., et al. PTC-bearing mRNA elicits a genetic compensation response via Upf3a and COMPASS components. Nature. 568, 259-263 (2019).
- Gilbert, L. A., et al. CRISPR-mediated modular RNA-guided regulation of transcription in eukaryotes. Cell. 154, 442-451 (2013).
- Qi, L. S., et al. Repurposing CRISPR as an RNA-guided platform for sequence-specific control of gene expression. Cell. 152, 1173-1183 (2013).
- Zhou, H., et al. In vivo simultaneous transcriptional activation of multiple genes in the brain using CRISPR-dCas9-activator transgenic mice. Nature Neuroscience. 21, 440-446 (2018).
- Fuster, J. J., Walsh, K. Somatic Mutations and Clonal Hematopoiesis: Unexpected Potential New Drivers of Age-Related Cardiovascular Disease. Circulatory Research. 122, 523-532 (2018).
- Kahn, J. D., et al. PPM1D truncating mutations confer resistance to chemotherapy and sensitivity to PPM1D inhibition in hematopoietic cells. Blood. , (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены