Method Article
질병 모델에서 조혈 세포의 연구를 위한 렌티바이러스 CRISPR/Cas9 매개 게놈 편집
요약
설명된 것은 CRISPR/Cas9 시스템에 의한 뮤린 조혈 줄기 및 전구 세포(HSPC)의 고효율 게놈 편집을 위한 프로토콜로 조혈 시스템 별 유전자 수정을 통해 마우스 모델 시스템을 신속하게 개발합니다.
초록
기존의 종족 형성 접근법을 사용하여 조혈 줄기 세포에서 유전자를 조작하는 것은 시간이 많이 걸리고 비용이 많이 들며 도전적일 수 있습니다. 게놈 편집 기술 및 렌티바이러스 매개 이식 유전자 전달 시스템의 발전으로부터 이익을 얻는 효율적이고 경제적인 방법은 조혈 줄기 세포에서 유전자가 특별히 조작되는 마우스를 확립하는 데 설명되어 있습니다. 렌티바이러스는 Cas9 발현 계보 음성 골수 세포를 특정 유전자 및 적색 형광 리포터 유전자(RFP)를 표적으로 하는 가이드 RNA(gRNA)로 트랜스듀싱한 다음, 이들 세포는 Lethally-조사된 C57BL/6 마우스로 이식됩니다. 비표적GRNA를 발현하는 렌티바이러스로 이식된 마우스는 대조군으로 사용된다. 형질전환된 조혈 줄기 세포의 생착은 말초 혈액의 RFP 양성 백혈구의 유세포 분석으로 평가된다. 이 방법을 사용하여 이식 후 4 주에 골수성 세포의 ~ 90 % 이식 및 ~ 70 %의 림프세포를 달성 할 수 있습니다. 게놈 DNA는 RFP 양성 혈액 세포로부터 분리되고, 표적 부위 DNA의 일부는 게놈 편집을 검증하기 위해 PCR에 의해 증폭된다. 이 프로토콜은 조혈-조절 유전자의 높은 처리량 평가를 제공하고 조혈 세포 침범을 가진 다양한 마우스 질환 모델로 확장될 수 있다.
서문
혈액학 및 면역학에 있는 많은 연구 결과는 Mx1-Cre, Vav-Cre 및 그 외와 같은 조혈 계통 특정 Cre 드라이버를 이용하는 종래의 조건부 형질전환/녹아웃 마우스를 포함하여 유전자 변형마우스의 가용성에 의존합니다 1,2,3,4,5. 이러한 전략은 시간이 많이 걸리고 재정적으로 부담이 될 수있는 새로운 마우스 균주의 설립을 필요로한다. 게놈 편집 기술의 혁명적 인 발전은 적절한 기술 전문 지식으로 3-4 개월 만에 새로운 마우스 균주의 생성을 가능하게하는 동안6,7,8,9 실험을 추구하기 전에 마우스 콜로니를 증폭하는 데 훨씬 더 많은 시간이 필요합니다. 또한 이러한 절차는 비용이 많이 듭니다. 예를 들어, 잭슨 연구소는 균주당 $16,845(2018년 12월 현재)에 녹아웃 마우스 생성 서비스의 현재 가격을 나열합니다. 따라서, 종래의 뮤린 형질전환 접근법보다 더 경제적이고 효율적인 방법이 더 유리하다.
정기적으로 간격을 두는 짧은 palindromic 반복 /CRISPR 관련 단백질 9 (CRISPR / Cas9) 기술은 신속하고 효율적인 RNA 기반, 서열 특정 게놈 편집을위한 새로운 도구의 개발을 주도하고있다. 원래 침입 병원체 DNA를 파괴하는 세균 적응 면역 메커니즘으로 발견, CRISPR / Cas9 시스템은 진핵 세포와 동물 모델에서 게놈 편집의 효과를 높이기 위해 도구로 사용되어왔다. 다양 한 접근 조혈 줄기 세포에 CRISPR/Cas9 기계를 전송 하는 데 사용 되었습니다 (즉, 전기 천 공, 핵, lipofection, 바이러스 전달, 그리고 다른 사람).
여기서, 렌티바이러스 시스템은 Cas9 발현 뮤린 조혈 줄기 세포를 효과적으로 감염시키고 가이드 RNA 발현 구조, 프로모터, 조절 서열 및 인코딩하는 유전자를 함께 포장하는 능력으로 인해 세포를 트랜스듀싱하는 데 사용된다. 형광 리포터 단백질 (즉, GFP, RFP). 이 방법을 사용하여, 마우스 조혈 줄기 세포의 생체 내 유전자 편집이 달성되었으며, 그 다음으로 조사된 마우스10에서골수의 성공적인 재구성이 이루어졌다. 본 연구에 채택된 렌티바이러스 벡터는 리포터 유전자로부터 상류에 내부 리보좀 진입 부위를 가진 공통 코어 EF1a 프로모터로부터 Cas9 및 GFP 리포터 유전자를 발현한다. 가이드 RNA 서열은 별도의 U6 프로모터로부터 발현된다. 이 시스템은 후보 클론 조혈 드라이버 유전자 Tet2 및 Dnmt3a10에서삽입 및 결실 돌연변이를 생성하는 데 사용된다. 그러나,이 방법에 의한 환전 효율은 상대적으로 낮다 (~5%-10%) 벡터 인서트(13Kbp)의 크기가 커서 변환 효율을 제한하고 생산 중 바이러스 역가를 줄입니다.
다른 연구에서는, 더 큰 바이러스 RNA 크기가 바이러스 생산 및 전염 효율 모두에 부정적인 영향을 미친다는 것을 보여주었습니다. 예를 들어, 삽입 크기의 1kb 증가는 바이러스 생산을 ~50% 감소시키는 것으로 보고되고, 형질전환 효율은 마우스 조혈 줄기세포(11)에서50% 이상으로 감소할 것이다. 따라서, 시스템의 효율을 향상시키기 위해 바이러스 삽입물의 크기를 가능한 한 많이 줄이는 것이 유리하다.
이러한 단점은 Cas9 단백질이 구성적 또는 유도성 방식으로 발현되는 Cas9 형질전환 마우스를 채택함으로써 극복될 수 있다12. 구성CRISPR/Cas9 노크인 마우스는 유비쿼터스 방식으로 Rosa26 궤양에서 CAG 프로모터로부터 Cas9 엔도뉴클레아제 및 EGFP를 표현한다. 따라서, 코어 EF1a 프로모터의 제어 하에 U6 프로모터 및 RFP 리포터 유전자의 제어 하에 sgRNA를 이용한 컨스트럭트는 렌티바이러스 벡터를 이용하여 게놈 편집을 달성할 수 있다. 이 시스템으로, 조혈 줄기 세포의 유전자는 성공적으로 편집되었습니다, ~ 90% 형질 전환 효율을 보여주는. 따라서, 이 프로토콜은 표적 유전자 돌연변이가 조혈 계통내로 도입되는 마우스를 만드는 신속하고 효과적인 방법을 제공한다. 우리의 실험실은 주로 심혈 관 질환 과정에서 클론 조혈의 역할을 연구하기 위해 기술의이 유형을 사용하는 동안13,14,15,그것은 또한 혈액학의 연구에 적용 악성16. 더욱이, 이 프로토콜은 HSPC에 있는 DNA 돌연변이가 조혈 계통에 있는 그밖 질병 또는 발달 프로세스에 어떻게 영향을 미치는지의 분석으로 확장될 수 있습니다.
견고한 렌티바이러스 벡터 시스템을 확립하기 위해서는 조혈 세포의 전염 및 이식에 대한 높은 역가 바이러스 성 주식 및 최적화된 조건이 필요합니다. 프로토콜에서, 지침은 섹션 1에서 높은 역가 바이러스 주식의 제조에 제공되며, 섹션 2에서 뮤린 조혈 줄기 세포의 배양 조건을 최적화하고, 섹션 3에서 골수 이식 방법을 평가하고, 평가합니다. 섹션 4의 접착.
프로토콜
동물 과목과 관련된 모든 절차는 버지니아 대학의 기관 동물 관리 및 사용위원회 (IACUC)에 의해 승인되었습니다.
1. 렌티바이러스 입자의 생성 및 정제
참고 : 최적화 된 가이드 RNA를 포함하는 렌티 바이러스 입자는 Addgene에서 제공하는 자세한 프로토콜에 의해 생성 될 수있다: 고티터 렌티바이러스 준비 및 저장을 위한 최적화된 방법은다른 곳에서 17,18에대해 논의된다. 간단히 말해서, 렌티바이러스는 HEK 293T 세포내로 렌티바이러스 벡터 플라스미드, psPAX2 및 pMD2.G의 공동 형질감염에 의해 생성된다. 배양 상급제는 48 시간 후 형질 감염에서 수집되고 초원심분리에 의해 농축된다. 렌티바이러스 적전기는 시판되는 qPCR 기반 분석법에 의해 결정된다. 이 절차는 생체 안전 등급 II 캐비닛에서 수행해야합니다.
- 콜라겐 1:200 용액 준비 (0.0005%) 1x PBS에서.
- 6개의 웰 플레이트를 콜라겐 용액으로 코팅하고 37°C에서 배양하고, 5%CO2를 ~30분 동안 배양한다.
- 종자 293T 세포는 웰당 1 x 106 세포의 밀도로 37°C에서 배양하고, 5%CO2를 ~2시간 동안 배양한다.
- 1개의 우물을 위한 3개의 형질감염 플라스미드의 혼합물을 준비하기 위하여는, 렌티바이러스 벡터의 0.9 μg, psPAX2의 0.6 μg 및 pMD2.G의 0.3 μg를 결합하고, 그 다음 탈이온수를 추가하여 10 μL의 총 부피를 달성한다. 웰 수에 따라 양을 조정합니다. 각 플라스미드의 양과 비율은 연구자의 요구에 맞게 더욱 최적화되어야 할 수도 있습니다.
- 1x PBS 50 μL과 희석된 PEI MAX(1.0 mg/mL)를 플라스미드 혼합물에 조심스럽게 넣고 실온에서 15분 동안 배양합니다(표1).
- 혼합물에 DMEM 1 mL을 추가합니다.
- 6웰 플레이트로부터 의 매질, 플라스미드 혼합물 1 mL을 첨가하고, 37°C에서 배양하고, 5%CO2를 ~3시간 동안 배양한다.
- 미디어를 신선한 DMEM 2 mL로 교체하고 37°C에서 배양하고 24시간 동안 5%CO2를 배양합니다.
- 신선한 DMEM 1 mL을 추가하고 37 °C에서 배양하고 추가 24 시간 동안 5 % CO2를 배양하십시오 (총 배양 시간은 48 시간).
- 배양 상급체를 3,000 x g에서 3,000 x g에서 15분 동안 원심분리기로 옮기고 자유 부동 세포를 제거한다.
- 0.45 μm 필터를 통해 상급체를 걸.입니다.
- 여과액을 폴리프로필렌 원심분리기로 옮김을 옮김.
- 4 °C에서 72,100 x g의 초원심 분리기는 3 시간 동안 r최대값으로.
- 조심스럽게 상류를 흡인, 흰색 펠릿 뒤에 떠나.
- 폭기 없이 혈청이 없는 조혈 세포 팽창 배지의 100 μL로 펠릿을 다시 일시 중단합니다.
- 10 μL aliquot를 유지하여 바이러스 성기를 측정하고 필요한 때까지 나머지 모든 알리쿼트(aliquots)를 -80°C에서 저장합니다.
- 10 μL 바이러스 성 aliquot를 사용하여 제조자의 지시에 따라 qPCR 기반 분석법으로 바이러스를 적정화.
2. 마우스 골수에서 계보 음성 세포의 격리 및 변환(그림 1A)
참고 : 일반적으로 충분한 세포를 분리하기 위해 각 마우스에서 경골, 대퇴골 및 휴머니 쌍을 수확합니다. 골반과 척추 뼈는 또한 계보 음성 세포의 근원으로 수확될 수 있습니다.
- 골수 세포의 격리
- 8-10주 된 수컷 CRISPR/Cas9 노크인 마우스를 5% 이소플루란에 의해 자궁 경부 탈구를 한 다음 70% 에탄올로 피부를 소독합니다.
- 해부 가위를 사용하여 흉곽 바로 아래의 피부에 가로 절개를하고 다리와 팔을 노출하기 위해 양방향으로 피부를 벗겨냅니다.
- 엉덩이 관절을 분리하여 엉덩이 뼈에서 하반신을 조심스럽게 분리하십시오. 대퇴골 머리를 따라 잘라 엉덩이에서 대퇴골을 완전히 제거합니다. 뼈 골피를 그대로 유지하면서, 대퇴골과 경골을 분리하기 위해 관절에서 무릎을 탈구하고 잘라. 발목 관절을 탈구하고 발과 여분의 근육을 벗겨냅니다.
- 해부 가위를 사용하여 어깨 위로 잘라 상지분리합니다. 어깨를 탈구한 다음 팔꿈치 관절을 잘라 상완골 뼈를 수확합니다.
- 셀룰로오스 섬유 물티슈를 사용하여 대퇴골, 경골 및 후머리에서 근육을 조심스럽게 제거하십시오. 이 과정에서 뼈가 부러지지 않도록 추가 예방 조치를 취하십시오.
- 분리된 뼈를 RPMI가 들어 있는 50mL 원추형 튜브에 넣고 얼음 위에 놓습니다.
참고: 다음 단계는 생체 안전 등급 II 캐비닛에서 수행해야 합니다. - 뼈를 멸균 된 100mm 배양 접시로 옮니다.
- 무딘 집게로 뼈를 잡고 해부 가위를 사용하여 조심스럽게 두 골피를 잘라냅니다.
참고 : 부족한 절단은 골수의 불완전한 플러시로 이어질 것입니다, 지나치게 공격적인 절단은 세포 손실의 결과로. - 얼음처럼 차가운 RPMI로 10 mL 주사기를 채우고 22G 바늘을 사용하여 샤프트의 골수를 새로운 100mm 배양 접시로 씻어 내보웁니다.
참고: 뼈 샤프트가 잘 플러시된 경우 골격은 흰색과 반투명이 됩니다. 그렇지 않은 경우 뼈 끝을 다시 자르고 다시 플러시하십시오. - 모든 골수가 수집된 후, 18G 바늘로 10 mL 주사기를 통해 골수를 여러 번 통과시킴으로써 단세포 현탁액을 만든다. 10x를 반복하여 단일 셀 현탁액을 확인합니다.
- 70 μm 세포 스트레이너를 통해 50 mL 원엽 튜브로 세포 현탁액을 필터링합니다.
- 310 x g에서 4 °C에서 10 분 동안 원심 분리기.
- 상판액을 흡인하고 다음 세포 분리 공정을 위해 최적화된 분리 버퍼의 적절한 부피에서 세포 펠릿을 재중단한다.
- 계보 음성 세포의 격리 및 렌티바이러스 전염
참고: 마우스 계보 음성 세포는 Cas9 형질전환 마우스3,또는 마우스의 다른 변종으로부터 분리되어, 제조사의 지침에 따라 계보 고갈 키트를 사용한다. 전형적으로, 계보 음성 세포는 전체 골수 핵세포의 2%-5%를 차지하고, 순도는 일반적으로 격리 다음 90% 이상입니다. 분리된 계보-음성 세포는 20 ng/mL 재조합 murine TPO 및 50 ng/mL 재조합 뮤린 SCF로 보충된 혈청 없는 조혈 세포 확장 배지에서 배양된 다음, 16시간 동안 렌티바이러스 벡터로 트랜스듀에 감염 (MOI) = 100.- 계보 음성 세포를 분리하려면 제조업체의 지침에 따라 리니지 셀 고갈 키트를 사용하십시오.
- 격리 후 혈청없는 조혈 세포 확장 배지의 1 mL에서 계보 음성 세포를 다시 중단합니다.
- 1.5 x 106 셀 / mL (5 x 105 계보 음성 세포 / 마우스)의 밀도에서 6 개의 웰 플레이트로 세포를 시드하십시오.
- 재조합 뮤린 TPO와 SCF를 각각 20 ng/mL 및 50 ng/mL의 최종 농도로 우물에 추가합니다.
- 37°C에서 5%CO2에서 ~2시간 동안 사전 배양된 세포.
- MOI = 100, 4 μg/mL 폴리브렌, 페니실린/스트렙토마이신을 웰에 넣고 37°C에서 배양하고, 16-20h에 대해 5%CO2를 배양한다(그림1B).
- 다음 날, 렌티바이러스 를 15 mL 원추형 튜브로 수혈하고 10 분 동안 300g에서 원심 분리기를 수집합니다.
- 조심스럽게 상판을 흡인하고 마우스 당 RPMI의 200 μL에서 펠릿을 다시 중단하십시오. 쥐로 이식 될 때까지 RT에서 세포를 유지 (섹션 3).
3. 의도적으로 조사 된 마우스로 변환 된 세포의 이식
- 골수 이식의 날에, 8 슬라이스 파이 케이지에 받는 마우스를 놓고 전신 조사의 두 복용량에 노출 (550 Rad/dose, 총 복용량 = 1100 Rad), 각 조사 세션 사이 약 4 시간.
- 두 번째 조사 세션 후, 인슐린 주사기를 사용하여 레트로 궤도 정맥 신경총 (총 200 μL)을 통해 각 마취 된 수용자 마우스에 형질 전환 계보 음성 세포를 주입합니다(그림 1C).
- 조사 후, 마우스는 살균 케이지에 보관하고 14 d에 대한 항생제로 보충 부드러운 식단과 식수를 제공해야합니다.
- 골수 이식 후 3-4 주에서 말초 혈액을 분석하여 형질 전환 된 기증자 세포의 생착을 확인하십시오 (섹션 4).
4. 말초 혈액의 키메라증 평가
- 5% 이소플루란으로 마우스를 마취시키고 모세관을 사용하여 레트로 궤도 정맥에서 혈액 샘플을 얻고K2EDTA 튜브로 수집합니다(모세관 의 부피는 다음 분석에 충분합니다).
- K2EDTA 튜브에서 20 μL의 혈액을 5 mL 둥근 바닥 폴리스티렌 시험관으로 옮기고 얼음위에 올려 놓습니다.
- 적혈구를 lyseRBC 라시스 버퍼의 1.5 mL를 추가합니다. 얼음에 5 분 동안 배양.
- 라시스 버퍼를 중화하려면 FACS 버퍼(1.5 mL/샘플)로 샘플을 세척합니다.
- 4 °C에서 5 분 동안 r최대에서 609 x g의 원심 분리기. 상급제는 버리십시오.
- 어둠 속에서 20 분 동안 RT에서 단일 클론 항체 (100 μL FACS 버퍼 / 샘플에서 희석)의 칵테일로 세포를 배양하십시오. 항체의 전체 목록은 위의 재료 섹션에 제공됩니다.
- FACS 버퍼 (2 mL / 샘플)로 세포를 한 번 씻으하십시오. 4 °C에서 5 분 동안 r최대 (1,800 rpm)에서 609 x g의 원심 분리기. 상급체를 완전히 버리십시오.
- 4 °C에서 10 분 동안 고정 버퍼 (100 μL / 튜브)를 포함하는 파라 포름 알데히드로 세포를 고정하십시오.
- FACS 버퍼 (3 mL / 샘플)로 세포를 한 번 씻으하십시오. 4 °C에서 5 분 동안 r최대 (1,800 rpm)에서 609 x g의 원심 분리기. 상급체를 완전히 버리십시오.
- FACS 버퍼의 400 μL에서 펠릿을 일시 중단합니다.
- 유세포 분석에 의한 분석까지 시료를 4°C로 유지합니다.
결과
전술한 프로토콜을 사용하여, 마우스당 약 0.8-1.0 x 108개의 골수 세포를 수득하였다. 우리가 얻는 계보 음성 세포의 수는 마우스 당 대략 3 x 106 세포입니다. 전형적으로, 골수 계보-음성 세포의 수율은 총 골수 핵 세포의 4%-5%입니다.
형질전환된 세포의 키메리즘(RFP-양성)은 말초 혈액의 유세포측정에 의해 평가된다(도2A,B). 혈액은 레트로 궤도 정맥으로부터 분리되고 적절한 마커는 각 조혈 세포 집단(즉, 호중구, 단핵구, T 세포 등)의 정체성을 결정하는 데 사용됩니다. (그림3A,B). 게놈 DNA는 RFP 양성 혈액 세포로부터 분리될 수 있고, 표적 부위 DNA의 단면도는 PCR에 의해 증폭되고 서열 분석을 위한 TA 복제 벡터로 잠식될 수 있다. 이들 플라스미드는 대장균으로 변환되고 표적 부위 서열은 Sanger 시퀀싱에 의해 결정된다(도4). 대안적으로, 표적 부위 서열은 풀링된 게놈의 Sanger 시퀀싱과 같은 다른 방법에 의해 결정될 수 있고, 이어서 분해(TIDE)분석에의한 인델의 추적이 뒤따른다. 대조군 조건에 대해, 마우스는 전형적으로 비표적화 가이드 RNA를 발현하는 렌티바이러스로 변환되는 세포로 이식된다.
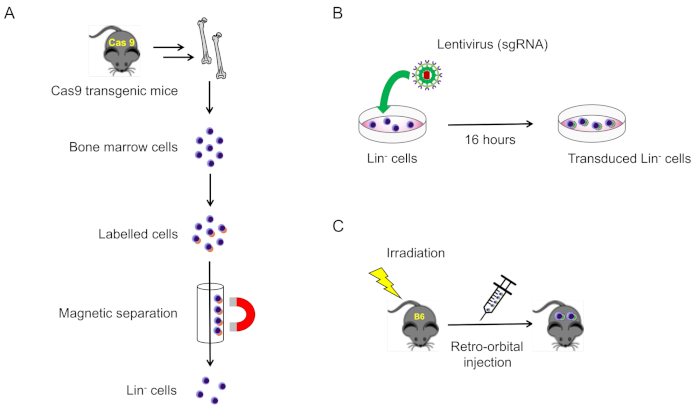
그림 1: 이 프로토콜의 개략적 예. (A) Cas9 발현 마우스로부터계선-음성 골수 세포의 분리(섹션 2.1). (B) 린티 바이러스 세포 -음성 세포의 전염 (섹션 2.2). (C) 의도적으로 조사 된 야생 형 마우스로 변환 된 세포의 복고풍 궤도 주입 (섹션 3). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
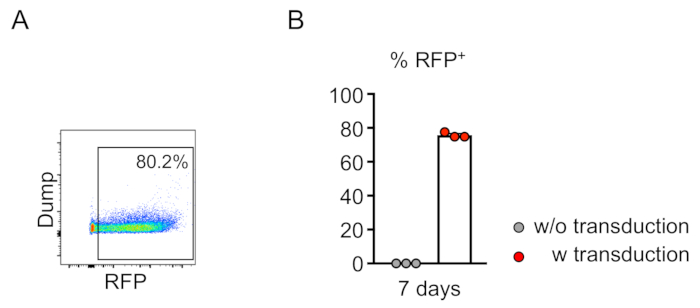
그림 2: 생체 외에서 마우스 골수 계보 - 음성 세포의 효율적인 렌티 바이러스 성 전환. (A) 유동 세포 분석결과 계보 음성 세포의 성공적인 전염이 밝혀졌습니다. 분석은 시험관 내 배양 7일 후에 수행되었다. (b) 평균적으로, 세포의 75.7%가 이 분석(n=3)에서 트랜스듀시되었다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
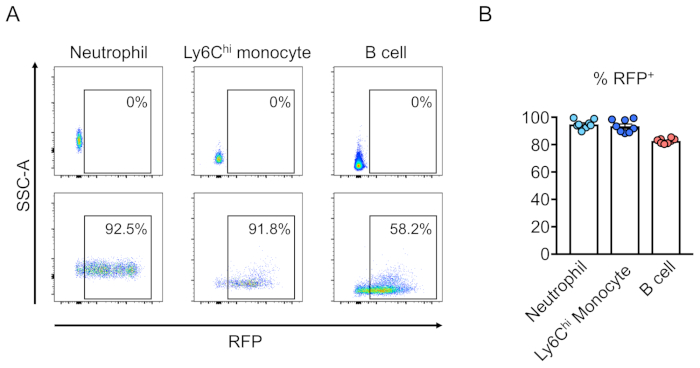
그림 3:혈통 음성세포를 변환하여 lethally 조사 된 마우스 골수의 재구성. (a) RFP를 발현하는 렌티바이러스로 변형되거나(상단) 조혈 줄기세포에 의한 재구성에 따른 마우스 말초 혈액의 유동 세포분석 분석. 호중구는 Ly6G+ 및 Ly6Chi 단핵구로 정의되며Ly6C +및 B 세포는 CD45R+로정의됩니다. (b) 이들 어설종에서, 세포의 평균 94.8%, 93.5%, 및 82.7%는 호중구에서RFP+이고, Ly6Chi 단핵구 및 B 세포 집단은 각각 (n=8)이다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
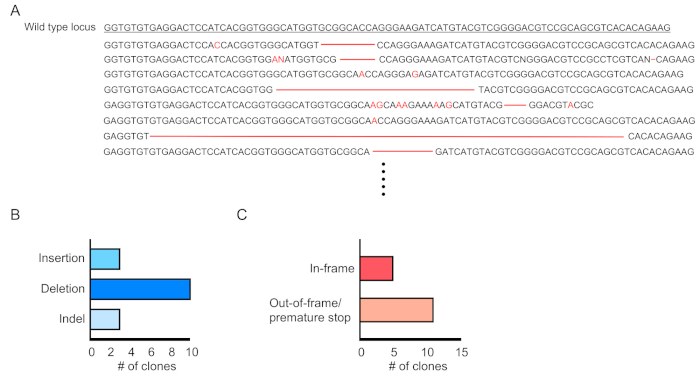
그림 4:형질전환 된 혈액 세포에서 유전자 편집평가. (a) RPF 양성 혈액 세포에서 돌연변이된 Dnmt3a 궤적의 시퀀싱 결과를 나타내는 유전자 편집의 예. 삭제는 빨간색 대시로 표시되고 삽입은 빨간색 문자로 표시됩니다. (b) 검출된 돌연변이의 요약. (C) 69% (11/16 클론) 프레임 외/조기 정지 돌연변이를 보였다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 플라스 미드 | 크기(bp) | 웰당 양(μg) | 비율 |
| pLKO5.0 | 7700 | 0.9 | 2 |
| psPAX2 | 10668 | 0.6 | 1 |
| pMD2.G | 5822 | 0.3 | 1 |
| PEI 최대 (재고: 100 mg/mL) | 5 μL/웰 | ||
표 1: 형질감염에 사용되는 플라스미드 및 PEI-max의 양.
토론
이 프로토콜의 장점은 기존의 마우스 형질전환 접근법에 비해 신속하고 매우 비용 효율적인 방식으로 조혈 세포에서 특정 돌연변이를 수용하는 동물 모델을 생성한다는 것입니다. 이 방법론은 조혈 세포 유전자 조작을 가진 마우스의 생성을 1 달 안에 가능하게 한다는 것을 것을을 발견되었습니다. 이 프로토콜에는 추가 고려가 필요한 몇 가지 중요한 단계가 있습니다.
gRNA 서열의 스크리닝
생체 외에서 gRNAs를 테스트하여 생체 내 실험을 수행하기 전에 편집 효율성을 평가하는 것이 좋습니다. gRNA의 효율은 무세포 생체외 전사 및 스크리닝 시스템을 사용하여 시험됩니다. 전사된 gRNA는 아가로즈 겔 전기동동을 사용하여 재조합 Cas9 단백질이 있는 템플릿 DNA를 분리할 때의 효율성을 측정함으로써 검증된다. 시판되는 키트는 이러한 목적으로 사용할 수 있습니다.
여기에서, indel 돌연변이는 편집된 지역에서 증폭된 PCR 제품의 TA 복제, 그 플라스미드를 가진 세균성 세포를 변환하고, Sanger 시퀀싱을 위한 개별 적인 식민지를 따기특징으로 합니다. 그러나 이 방법은 힘들고 시간이 많이 걸립니다. 대안적으로, 차세대 염기서열 분석(NGS) 또는 풀링된 DNA 시퀀싱 다음에 TIDE 분석을 수행할 수있다 19. TIDE 알고리즘은 복잡한 샘플에서 생성된 Sanger 시퀀스 트레이스를 분석하기 위해 만들어졌습니다. TIDE를 가진 인델 추정치는 일반적으로 그 오프 타겟 NGS20와일치한다는 것을 보여주었습니다. 분석 소프트웨어는 온라인에서 사용할 수 있습니다.http://tide.nki.nl>.
고티터 렌티바이러스 입자 생성
세포 감염에 필수적인 바이러스성 성포성 구내염 바이러스 G 단백질은 매우 pH 에 민감합니다. 따라서, 배양 배지를 허용 가능한 pH 범위 내에서 유지하는 것이 중요하며, 황색의 외관을 개발해서는 안된다. 바이러스 생성을 위한 콜라겐 코팅 접시는 HEK293T 세포의 부착을 가속화하고 하룻밤을 기다리는 대신 몇 시간 이내에 형질전환의 성능을 허용하기 때문에 사용됩니다. 그러나, 실험 일정에 따라, 하룻밤 배양도 고려될 수 있다.
렌티 바이러스 입자의 정화
조혈 줄기 세포의 효율적인 환전을 달성하기 위해서는 고티터 렌티 바이러스를 생성해야합니다. 원심분리 속도의 최적화가 핵심 기능입니다. 렌티 바이러스의 농도는 일반적으로 90,000 x g에서수행되지만, 여러 보고서에 따르면 물질이 20,000 x g18의낮은 속도로 원심 분리되면 바이러스 회복이 증가하는 것으로 나타났습니다. 초원심분리가 없는 고티터 렌티바이러스 제제의 생산도17건의제안되었다. 폭기를 최소화하고 바이러스 무결성을 유지하기 위해 활발한 파이펫팅을 피하면서 바이러스 원심 분리 펠릿을 중단하는 것이 중요하다는 점에 유의해야합니다. 고-티터 렌티바이러스 입자는조혈줄기세포(11)의효율적인 혈전을 위해 요구된다. 파일럿 실험에 따르면 100의 MOI가 전이 효율 및 세포 생존가능성과 관련하여 최적임을 밝혔습니다. 세포 생존력과 전염 효율을 기준으로 렌티바이러스 주식을 평가하는 것이 좋습니다.
렌티 바이러스 입자의 저장
렌티바이러스 적시하는 온도에 매우 민감하며, 부적절한 보관 조건과 반복되는 동결 해동 주기로 인해 적시를 크게 줄일 수 있습니다. 렌티바이러스의 환전 효율은 4°C[t(1/2) = 1.3일] 또는 다중 동결 해동 사이클[t(1/2) = 1.1라운드]에 저장될 때 급격히 감소하는 것으로 밝혀졌다. 바이러스 펠릿이 일시 중단된 직후 액체 질소 또는 분쇄된 드라이 아이스에서 바이러스 제제를 스냅 냉동하는 것이 좋습니다. 바이러스 성 주식은 -80 °C에서 유지하고 바로 전에 RT에 얼음에 해동하고11을사용해야합니다.
몇 가지 잠재적인 제한 사항에 유의 해야 합니다. 첫째, CRISPR/Cas9에 의한 오프 타겟 인델 돌연변이의 도입은 오랫동안 인정되어 왔습니다. 또한 CRISPR/Cas9가 생체 내 표적 돌연변이를 유도할 수 있는 것으로나타났다(21). 실제로, 오프 타겟 인델 돌연변이는 표적 게놈 사이트에 밀접하게 일치하고 예측된 이차 사이트에 4개 이상의 불일치가 있는 gRNA 서열을 사용하여 피할 수 있습니다. 이러한 디자인은 실리코 도구(22)에기존으로 수행 할 수 있습니다. 대상 외 작업을 최소화하여 gRNA를 예측하는 다른 계산 도구를 사용할 수 있습니다(http://http://portals.broadinstitute.org/gpp/public/analysis-tools/sgrna-design> 또는 ). 또한 2개 이상의 상이한 gRNA를 사용하여 동물 모델을 분석하여 표현형을 확인하고 관찰된 표현형이 특정 gRNA의 오프 타겟 효과에 의해 매개될 가능성을 최소화하는 것이 유익할 수 있다.
CRISPR/Cas9에 의해 생성된 전통적인 인델 돌연변이 이외에, 킬로베이스를 넘어 확장하는 더 큰 삭제가 보고되었습니다. 이 연구를 혼동 수 있습니다.; 그러나, 그 더 큰 삭제는 indels23에비해 훨씬 낮은 주파수로 보고된다. 또 다른 잠재적인 문제는 유전 적 보상입니다. 조기 종단 코돈(PTC)을 가진 돌연변이 RNA는 COMPASS 복합 매개 전사 활성화에 의해 서열 유사성을 가진 관련 유전자의 업조절을 초래할 수 있다는 보고가24,25. 이 이벤트는 유전자 절제의 녹아웃과 녹다운 접근 사이 표현형 다름으로 이끌어 낼 수 있는 기계장치로 제안되었습니다. CRISPR/Cas9 매개 게놈 편집은 PTC의 생성으로 이어지는 프레임 시프트 돌연변이의 스토스 도입에 크게 의존하기 때문에 유전 적 보상은 표현형을 수정할 수 있습니다. 유전 적 보상을 피하기 위해, 실험은 유전자의 규제 서열이 CRISPR / Cas9에 의해 또는 RNA 유도 DNA 인식 플랫폼으로 Cas9를 사용하여 후성 유전학 적 수정자의 도입에 의해 표적으로하는 것으로 간주 될 수 있습니다.
마지막으로, lethally 조사 된 마우스로 이식 된 세포에서 조혈은 조혈의 기본 조건과 다를 수 있음을 인정해야합니다. 게다가, 조사는 조혈 세포에 있는 결과 유전자 돌연변이를 검토하는 실험의 해석을 혼동할 수 있는 유기체에 대한 전신 효력이 있을 수 있습니다.
연구원은 촉매 비활성 Cas9 (dCas9) 단백질을 "RNA 유도 DNA 인식 플랫폼"으로 활용하고 dCas9 융합 단백질을 사용하여 특정 DNA 서열에 이펙터 도메인을 국소화하여 억압 (CRISPRi) 또는 활성화 (CRISPRa)했습니다. 전사 오프 타겟 유전자26,27. 이 프로토콜은 촉매 활성 Cas9 형질전환 마우스를 사용하여 게놈 DNA 서열에 dsDNA 절단을 소개하는 동안, 특정 유전자를 억압하거나 활성화하는 후생유전학적 변형은 dCas9와 크로마틴 개질도메인을 융합하여 적용가능하다. dCas9-KRAB 또는 dCas9-VP64는 각각 대안적으로, dCas9는 유전자부위(27)에접근하는 전사 기계를 차단함으로써 자체적으로 전사 억제제로서 사용될 수 있다. 보다 최근에는 dCas9-SunTag-p65-HSF1(SPH) 형질전환 마우스를 dCas9와 융합한 후생유전학 활성제의 변형된 버전을 발현하고 이러한 CRISPRa 시스템이 생체내에서기능성임을 보여주었다.
우리의 실험실은 주로 심혈관 질환 과정에서 클론 조혈의 역할을 연구하기 위해이 기술을 사용합니다. 증식 조직에서, 암 드라이버 유전자에 있는 체세포 돌연변이는 세포 성장 이점을 부여하고 비정상적인 클론 확장으로 이끌어 낼 수 있습니다. 조혈 시스템에서이 과정은 "클로날 조혈"으로 알려져 있으며, 개인의 백혈구의 상당 부분이 돌연변이 클론으로 대체되는 상황을 초래합니다. 비정상적인 클론 확장이 동맥 경화증 및 심부전과 같은 심혈관 질환을 가속화하고 사망률 및 모든 원인 사망률15,29에기여한다는 인식이 커지고 있다.
최근, 이러한 체세포 돌연변이와 심혈관 질환 의 몇몇 사이의 인과 관계가 문서화되었으며, 기본 기전의 양상이10,13,14로해명되었다. 그러나, 이 체세포 돌연변이는 역학 연구 결과 많은 추가 후보 유전자가 클론 조혈과 연관되고, 잠재적으로, 증가한 심장 혈관 질병 사망과 연관된다는 것을 보여주었기 때문에, 아마 "빙산의 끝"을 나타냅니다. 따라서, 클론 조혈 드라이버 유전자의 체계적이고 높은 처리량 평가가 요구된다. 클로날 조혈 및 심혈관 질환의 인과 연결에 대한 현재 연구는 골수 이식 후 조혈 계별 조건부 트랜스제닉(Mx1-Cre, Vav-Cre 등) 또는 마우스를 대상으로 한 마우스의 분석을 기반으로 합니다. 그러나 이러한 전략은 새로운 마우스 식민지를 확립해야 하며 연구자에게 재정적, 신체적 부담이 될 수 있습니다. 따라서, 과거에 채택된 기존의 뮤린 트랜스제닉/녹아웃 접근법보다 저렴하고 더 빠른 방법이 보증된다. 이 원고에 기술된 바와 같이, 돌연변이를 설계하기 위해 HSPC 및 CRISPR 기술을 변환하는 렌티바이러스 벡터는 클로날 조혈 및 심혈관 질환의 연구를 용이하게 한다.
종래의 녹아웃 궤적을 생성하는 것 외에도, 이 방법은 잘린 돌연변이 단백질의 생산에 적용 가능하다. 예를 들어, 연구자들은 Ppm1d 유전자30의gRNA 표적화 엑슨 6를 가진 프레임 시프트 돌연변이를 도입함으로써 클로날 조혈 환자에서 자주 볼 수 있는 조혈-Ppm1d 잘림을 성공적으로 생성하였다.
공개
저자는 공개 할 것이 없다.
감사의 말
S. S. 미국 심장 협회 박사 후 펠로우십 17POST33670076에 의해 지원되었다. K. W.는 NIH 보조금 R01 HL138014, R01 HL141256 및 R01 HL139819에 의해 지원되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| RPMI Medium 1640 (1X) | Gibco | 11875-093 | Medium |
| Sulfamethoxazole and Trimethoprim injection | TEVA | 0703-9526-01 | |
| 1/2 cc LO-DOSE INSULIN SYRINGE | EXELINT | 26028 | general supply |
| 293T cells | ATCC | CRL-3216-- | Cell line |
| APC-anti-mouse Ly6C (Clone AL-21) | BD Biosciences | 560599 | Antibodies |
| APC-Cy7-anti-mouse CD45R (RA3-6B2) | BD Biosciences | 552094 | Antibodies |
| BD Luer-Lok disposable syringes, 10 ml | BD | 309604 | general supply |
| BD Microtainer blood collection tubes, K2EDTA added | BD Bioscience | 365974 | general supply |
| BD Precisionglide needle, 18 G | BD | 305195 | general supply |
| BD Precisionglide needle, 22 G | BD | 305155 | general supply |
| BV510-anti-mouse CD8a (Clone 53-6.7) | Biolegend | 100752 | Antibodies |
| BV711-anti-mouse CD3e (Clone 145-2C11) | Biolegend | 100349 | Antibodies |
| Collagen from calf skin | Sigma-Aldrich | 9007-34-5 | general supply |
| Corning Costar Ultra-Low Attachment Multiple Well Plate, 6 well | Millipore Sigma | CLS3471 | general supply |
| CRISPR/Cas9 knock-in mice | The Jackson Laboratory | 028555 | mouse |
| DietGel 76A | Clear H2O | 70-01-5022 | general supply |
| Dulbecco’s Modified Eagle’s Medium (DMEM) - high glucose | Sigma Aldrich | D6429 | Medium |
| eBioscience 1X RBC Lysis Buffer | Thermo fisher Scientific | 00-4333-57 | Solution |
| Falcon 100 mm TC-Treated Cell Culture Dish | Life Sciences | 353003 | general supply |
| Falcon 5 mL round bottom polystyrene test tube | Life Sciences | 352054 | general supply |
| Falcon 50 mL Conical Centrifuge Tubes | Fisher Scientific | 352098 | general supply |
| Falcon 6 Well Clear Flat Bottom TC-Treated Multiwell Cell Culture Plate | Life Science | 353046 | general supply |
| Fisherbrand microhematocrit capillary tubes | Thermo Fisher Scientific | 22-362566 | general supply |
| Fisherbrand sterile cell strainers, 70 μm | Fisher Scientific | 22363548 | general supply |
| FITC-anti-mouse CD4 (Clone RM4-5) | Invitrogen | 11-0042-85 | Antibodies |
| Fixation Buffer | BD Bioscience | 554655 | Solution |
| Guide-it Compete sgRNA Screening Systems | Clontech | 632636 | Kit |
| Isothesia (Isoflurane) solution | Henry Schein | 29404 | Solution |
| Lenti-X qRT-PCR Titration Kit | Takara | 631235 | Kit |
| Lineage Cell Depletion Kit, mouse | Miltenyi Biotec | 130-090-858 | Kit |
| Millex-HV Syringe Filter Unit, 0.45 mm | Millipore Sigma | SLHV004SL | general supply |
| PBS pH7.4 (1X) | Gibco | 10010023 | Solution |
| PE-Cy7-anti-mouse CD115 (Clone AFS98) | eBioscience | 25-1152-82 | Antibodies |
| PEI MAX | Polysciences | 24765-1 | Solution |
| Penicillin-Streptomycin Mixture | Lonza | 17-602F | Solution |
| PerCP-Cy5.5-anti-mouse Ly6G (Clone 1A8) | BD Biosciences | 560602 | Antibodies |
| pLKO5.sgRNA.EFS.tRFP | Addgene | 57823 | Plasmid |
| pMG2D | Addgene | 12259 | Plasmid |
| Polybrene Infection/Transfection Reagent | Sigma Aldrich | TR-1003-G | Solution |
| Polypropylene Centrifuge Tubes | BECKMAN COULTER | 326823 | general supply |
| psPAX2 | Addgene | 12260 | Plasmid |
| RadDisk – Rodent Irradiator Disk | Braintree Scientific | IRD-P M | general supply |
| Recombinant Murine SCF | Peprotech | 250-03 | Solution |
| Recombinant Murine TPO | Peprotech | 315-14 | Solution |
| StemSpan SFEM | STEMCELL Technologies | 09600 | Solution |
| TOPO TA cloning kit for sequencing with One Shot TOP10 Chemically Competent E.coli | Thermo fisher Scientific | K457501 | Kit |
| Zombie Aqua Fixable Viability Kit | BioLegend | 423102 | Solution |
참고문헌
- Sasaki, Y., et al. Defective immune responses in mice lacking LUBAC-mediated linear ubiquitination in B cells. EMBO Journal. 32, 2463-2476 (2013).
- Ogilvy, S., et al. Transcriptional regulation of vav, a gene expressed throughout the hematopoietic compartment. Blood. 91, 419-430 (1998).
- Meyer, S. E., et al. DNMT3A Haploinsufficiency Transforms FLT3ITD Myeloproliferative Disease into a Rapid, Spontaneous, and Fully Penetrant Acute Myeloid Leukemia. Cancer Discovery. 6, 501-515 (2016).
- Kuhn, R., Schwenk, F., Aguet, M., Rajewsky, K. Inducible gene targeting in mice. Science. 269, 1427-1429 (1995).
- Cole, C. B., et al. PML-RARA requires DNA methyltransferase 3A to initiate acute promyelocytic leukemia. Journal of Clinical Investigation. 126, 85-98 (2016).
- Yang, H., et al. One-step generation of mice carrying reporter and conditional alleles by CRISPR/Cas-mediated genome engineering. Cell. 154, 1370-1379 (2013).
- Wang, H., et al. One-step generation of mice carrying mutations in multiple genes by CRISPR/Cas-mediated genome engineering. Cell. 153, 910-918 (2013).
- Quadros, R. M., et al. Easi-CRISPR: a robust method for one-step generation of mice carrying conditional and insertion alleles using long ssDNA donors and CRISPR ribonucleoproteins. Genome Biology. 18, 92 (2017).
- Miura, H., Quadros, R. M., Gurumurthy, C. B., Ohtsuka, M. Easi-CRISPR for creating knock-in and conditional knock-out mouse models using long ssDNA donors. Nature Protocols. 13, 195-215 (2018).
- Sano, S., et al. CRISPR-Mediated Gene Editing to Assess the Roles of Tet2 and Dnmt3a in Clonal Hematopoiesis and Cardiovascular Disease. Circulation Research. 123, 335-341 (2018).
- Cante-Barrett, K., et al. Lentiviral gene transfer into human and murine hematopoietic stem cells: size matters. BMC Research Notes. 9 (312), (2016).
- Chu, V. T., et al. Efficient CRISPR-mediated mutagenesis in primary immune cells using CrispRGold and a C57BL/6 Cas9 transgenic mouse line. Proceedings of the National Academy of Sciences of the United States of America. 113, 12514-12519 (2016).
- Fuster, J. J., et al. Clonal hematopoiesis associated with TET2 deficiency accelerates atherosclerosis development in mice. Science. 355, 842-847 (2017).
- Sano, S., et al. Tet2-Mediated Clonal Hematopoiesis Accelerates Heart Failure Through a Mechanism Involving the IL-1beta/NLRP3 Inflammasome. Journal of the American College of Cardiology. 71, 875-886 (2018).
- Sano, S., Wang, Y., Walsh, K. Clonal Hematopoiesis and Its Impact on Cardiovascular Disease. Circulatory Journal. 71, 875-886 (2018).
- Heckl, D., et al. Generation of mouse models of myeloid malignancy with combinatorial genetic lesions using CRISPR-Cas9 genome editing. Nature Biotechnology. 32, 941-946 (2014).
- Jiang, W., et al. An optimized method for high-titer lentivirus preparations without ultracentrifugation. Scientific Reports. 5, 13875 (2015).
- Cribbs, A. P., Kennedy, A., Gregory, B., Brennan, F. M. Simplified production and concentration of lentiviral vectors to achieve high transduction in primary human T cells. BMC Biotechnology. 13, 98 (2013).
- Brinkman, E. K., Chen, T., Amendola, M., van Steensel, B. Easy quantitative assessment of genome editing by sequence trace decomposition. Nucleic Acids Research. 42, e168 (2014).
- Sentmanat, M. F., Peters, S. T., Florian, C. P., Connelly, J. P., Pruett-Miller, S. M. A Survey of Validation Strategies for CRISPR-Cas9 Editing. Scientific Reports. 8, 888 (2018).
- Akcakaya, P., et al. In vivo CRISPR editing with no detectable genome-wide off-target mutations. Nature. 561, 416-419 (2018).
- Bae, S., Park, J., Kim, J. S. Cas-OFFinder: a fast and versatile algorithm that searches for potential off-target sites of Cas9 RNA-guided endonucleases. Bioinformatics. 30, 1473-1475 (2014).
- Kosicki, M., Tomberg, K., Bradley, A. Repair of double-strand breaks induced by CRISPR-Cas9 leads to large deletions and complex rearrangements. Nature Biotechnology. 36, 765-771 (2018).
- El-Brolosy, M. A., et al. Genetic compensation triggered by mutant mRNA degradation. Nature. 568, 193-197 (2019).
- Ma, Z., et al. PTC-bearing mRNA elicits a genetic compensation response via Upf3a and COMPASS components. Nature. 568, 259-263 (2019).
- Gilbert, L. A., et al. CRISPR-mediated modular RNA-guided regulation of transcription in eukaryotes. Cell. 154, 442-451 (2013).
- Qi, L. S., et al. Repurposing CRISPR as an RNA-guided platform for sequence-specific control of gene expression. Cell. 152, 1173-1183 (2013).
- Zhou, H., et al. In vivo simultaneous transcriptional activation of multiple genes in the brain using CRISPR-dCas9-activator transgenic mice. Nature Neuroscience. 21, 440-446 (2018).
- Fuster, J. J., Walsh, K. Somatic Mutations and Clonal Hematopoiesis: Unexpected Potential New Drivers of Age-Related Cardiovascular Disease. Circulatory Research. 122, 523-532 (2018).
- Kahn, J. D., et al. PPM1D truncating mutations confer resistance to chemotherapy and sensitivity to PPM1D inhibition in hematopoietic cells. Blood. , (2018).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유