Method Article
لينتيفيرال CRISPR/كاس 9-بوساطة الجينوم التحرير لدراسة خلايا الدم في نماذج الامراض
In This Article
Summary
ويرد وصفها بروتوكولات لتحرير الجينوم عاليه الكفاءة من الجذعية التي تكون الدم murine والخلايا سلف (hspc) من قبل نظام crispr/كاس 9 لتطوير بسرعة أنظمه نموذج الماوس مع التعديلات الجينية الخاصة بالنظام التي تكون الدم.
Abstract
يمكن ان يكون التلاعب بالجينات في الخلايا الجذعية للدم باستخدام مقاربات التكوين التقليدية مضيعه للوقت ومكلفه وصعبه. الاستفادة من التقدم المحرز في تكنولوجيا تحرير الجينوم ونظم إيصال الجينات عبر اللينتيفيروس ، فان طريقه فعاله واقتصاديه توصف هنا بأنها تنشئ فئران يتم فيها التلاعب بالجينات علي وجه التحديد في الخلايا الجذعية للدم. وتستخدم لينتيفيروسيس لنقل كاس 9-التعبير عن خلايا نخاع العظم السالبة مع دليل RNA (gRNA) استهداف جينات محدده والجينات مراسل الأحمر الفلورية (المناقصة) ، ثم يتم زرع هذه الخلايا في قاتل المشع C57BL/6 الفئران. تستخدم الفئران المزروعة باللينتيفيروس التي تعبر عن عدم استهداف gRNA كعناصر تحكم. يتم تقييم الخلايا الجذعية التي يتم توصيلها بالدم من خلال تحليل تدفق الكريات البيضاء الايجابيه لعروض العروض الدموية للدم المحيطي. باستخدام هذه الطريقة ، ~ 90 ٪ محول الخلايا النخاعية و ~ 70 ٪ من الخلايا اللمفاوية في 4 أسابيع بعد زرع يمكن ان يتحقق. يتم عزل الحمض النووي الجيني من خلايا الدم الايجابيه لعروض العروض ، ويتم تضخيم أجزاء من الحمض النووي للموقع المستهدف من قبل PCR للتحقق من تحرير الجينوم. يوفر هذا البروتوكول تقييما عالي الانتاجيه للجينات التنظيمية للدم ويمكن توسيعه ليشمل مجموعه متنوعة من نماذج امراض الفئران مع مشاركه خلايا الدم.
Introduction
العديد من الدراسات في امراض الدم والمناعة تعتمد علي توافر الفئران المعدلة وراثيا, بما في ذلك التقليدية والشرطية الوراثية/ضرب الخروج الفئران التي تستخدم البرامج الغذائية الخاصة بنظام Cre السائقين مثل Mx1, Vav-Cre, وغيرها 1،2،3،4،5. وتتطلب هذه الاستراتيجيات إنشاء سلالات فاره جديده ، يمكن ان تستغرق وقتا طويلا وتثقل كاهل المالية. في حين ان التقدم الثوري في تكنولوجيا التحرير الجينوم مكنت توليد سلالات الماوس جديده في عدد قليل من 3-4 أشهر مع الخبرة التقنية المناسبة6,7,8,9 ، يلزم المزيد من الوقت لتضخيم مستعمره الماوس قبل متابعه التجارب. الاضافه إلى ذلك ، فان هذه الإجراءات مكلفه. فعلي سبيل المثال ، يسرد مختبر جاكسون السعر الحالي لخدمات جيل الفئران التي تبلغ $16,845 لكل سلاله (اعتبارا من كانون الأول/ديسمبر 2018). التالي ، فان الأساليب الأكثر اقتصادا وكفاءه من النهج الوراثية التقليدية لmurine هي أكثر فائده.
متفاوتة المسافات بانتظام متباعدة المتقاربة متكررة/CRISPR البروتين المرتبطة 9 (CRISPR/كاس 9) التكنولوجيا قد أدت إلى تطوير أدوات جديده لسرعه وكفاءه المستندة إلى RNA ، تسلسل الجينوم الخاصة التحرير. اكتشف أصلا كاليه مناعية بكتيرية متكيفة لتدمير الحمض النووي المسبب للمرض الغازي ، وقد استخدم نظام CRISPR/كاس 9 كاداه لزيادة فعاليه تحرير الجينوم في الخلايا النواة والنماذج الحيوانية. وقد استخدم عدد من النهج لنقل آلات CRISPR/كاس 9 إلى الخلايا الجذعية التي تكون الدم (اي ، الكهربية ، النيوفيكشن ، ليبوكشن ، والولادة الفيروسية ، وغيرها).
هنا ، يتم استخدام نظام لينتيفيروس لتحويل الخلايا بسبب قدرتها علي الاصابه بشكل فعال كاس 9-التعبير عن الخلايا الجذعية التي تكون الدم murine وحزمه معا دليل الحمض الريبي النيبالي بناء ، والمروجين ، وتسلسل التنظيمية ، والجينات التي ترميز البروتينات الفلورية مراسل (اي ، GFP ، وعروض العروض). باستخدام هذه الطريقة ، وقد تم السابقة الجسم الفيفو التحرير من الخلايا الجذعية الماوس الدم التي تم تحقيقها ، تليها أعاده ناجحه من نخاع العظم في الفئران قاتل المشع10. ويعبر الناقل اللينتيفيروس المستخدم لهذه الدراسة عن جينات مراسل كاس 9 و GFP من المروج EF1a الأساسي المشترك مع موقع دخول ريبوسومال داخلي من الجينات المراسلة. يتم التعبير عن تسلسل الدليل RNA من مروج U6 منفصل. ويستخدم هذا النظام بعد ذلك لخلق طفرات الادراج والحذف في المرشح التي تكون الدم المورثات سائق الجينات Tet2 و Dnmt3a10. ومع ذلك ، فان كفاءه المحولات بهذه الطريقة منخفضه نسبيا (~ 5 ٪-10 ٪) بسبب الحجم الكبير للمتجه ادراج (13 Kbp) الذي يحد من كفاءه المحول ويقلل من الفيروسات اثناء الإنتاج.
وفي دراسات أخرى ، تبين ان حجم الحمض الريبي الفيروسي الأكبر يؤثر سلبا علي كل من إنتاج الفيروس وكفاءه المحول. علي سبيل المثال ، يتم الإبلاغ عن زيادة 1 كيلوبايت في حجم الادراج لإنقاص إنتاج الفيروسات بنسبه ~ 50% ، ستنخفض كفاءه التوصيل إلى أكثر من 50% في الخلايا الجذعية للدم التي تكون الخلية11. التالي ، فانه من المفيد للحد من حجم ادراج الفيروسية قدر الإمكان لتحسين كفاءه النظام.
ويمكن التغلب علي هذا القصور عن طريق استخدام كاس 9 الفئران المحورة وراثيا ، والتي يتم التعبير عن بروتين كاس 9 في اما بطريقه تاسيسيه أو محرض12. التاسيسيه CRISPR/كاس 9 تدق في الفئران يعبر عن كاس 9 كريات الوحيدة النوى و EGFP من المروج CAG في Rosa26 موضع في كل مكان. التالي ، يمكن تسليم بناء مع sgRNA تحت سيطرة U6 المروج والجينات مراسل تقديم العروض تحت سيطرة المروج EF1a الاساسيه باستخدام ناقل اللينتيفيروس لتحقيق تحرير الجينوم. مع هذا النظام ، تم تحرير جينات الخلايا الجذعية التي تكون الدم بنجاح ، والتي تبين كفاءه المحولة ~ 90 ٪. التالي ، فان هذا البروتوكول يوفر طريقه سريعة وفعاله لإنشاء الفئران التي يتم إدخال طفرات الجينات المستهدفة في نظام التي تكون الدم. في حين ان لدينا مختبر يستخدم في الغالب هذا النوع من التكنولوجيا لدراسة دور تكون الدم النسيلي في عمليات امراض القلب والاوعيه الدموية13,14,15, وهو ينطبق أيضا علي دراسات الدموية الأورام الخبيثة16. وعلاوة علي ذلك ، يمكن توسيع هذا البروتوكول ليشمل تحليل كيفيه تاثير طفرات الحمض النووي في HSPC علي الامراض الأخرى أو العمليات التنموية في النظام الغذائي.
لإنشاء نظام ناقلات لينتيفيروس قويه, المخزونات الفيروسية عيار عاليه والظروف الأمثل لنقل وزرع الخلايا التي تكون الدم مطلوبه. وفي البروتوكول ، تقدم التعليمات بشان اعداد المخزون الفيروسي العالي الارتفاع في القسم 1 ، بما يحسن الظروف الثقافية للخلايا الجذعية التي تشكل الدم في المادة 2 ، وأساليب زرع نخاع العظم في القسم 3 ، وتقييم في القسم 4.
Protocol
وقد تمت الموافقة علي جميع الإجراءات المتعلقة بالمواد الحيوانية من قبل لجنه الرعاية الحيوانية المؤسسية والاستخدام (IACUC) في جامعه فيرجينيا.
1-توليد وتنقيه الجزيئات اللينتيفيروسه
ملاحظه: يمكن ان تنتج جزيئات لينتيفيروس التي تحتوي علي الدليل الأمثل RNA بواسطة البروتوكولات المفصلة المقدمة من Addgene: ال< https://media.addgene.org/cms/files/Zhang_lab_LentiCRISPR_library_protocol.pdf) >. تناقشت طرق محسنه ل [هيغ-تيتر] لينتيفيروس تحضير وتخزين في مكان آخر17,18. وباختصار ، يتم إنتاج لينتيفيروسيس بواسطة النقل المشترك من plasmid لينتيفيروس متجهة ، psPAX2 ، و pMD2 في الخلايا يشيك 293T. يتم جمع الثقافة سوبرناتانت في 48 h بعد النقل العابر وتتركز بواسطة ultracentrifugation حلول. يتم تحديد لينتيفيرال عيار بواسطة فحص المستندة إلى qpcr المتاحة تجاريا. وينبغي تنفيذ هذا الاجراء في مجلس الوزراء من الفئة الثانية للسلامة البيولوجية.
- اعداد حل 1:200 من الكولاجين (0.0005%) في 1x تلفزيوني.
- معطف 6 لوحه جيدا مع محلول الكولاجين واحتضان في 37 درجه مئوية ، 5 ٪ CO2 ل ~ 30 دقيقه.
- البذور 293T الخلايا في كثافة 1 × 106 خلايا في بئر واحتضان في 37 درجه مئوية ، 5 ٪ CO2 ل ~ 2 h.
- لاعداد خليط من ثلاثه البلازميدات الانتقال لبئر واحد ، والجمع بين 0.9 ميكروغرام من ناقلات لينتيفيروس ، 0.6 ميكروغرام من psPAX2 ، و 0.3 ميكروغرام من pMD2 ، ثم تحقيق حجم إجمالي من 10 μL عن طريق أضافه المياه منزوعة الأيونات. ضبط المبالغ تبعا لعدد الآبار. كميه ونسبه كل البلازميد قد تحتاج إلى مزيد من الأمثل لتتناسب مع احتياجات الباحثين.
- بعناية أضافه 50 μl من 1x تلفزيوني و 5 μl من المخفف PEI MAX (1.0 mg/mL) إلى الخليط البلازميد واحتضان لمده 15 دقيقه في درجه حرارة الغرفة (RT) (الجدول 1).
- أضف 1 مل من DMEM إلى الخليط.
- الشفط وسائل الاعلام من لوحه 6 جيدا ، أضافه 1 مل من الخليط البلازميد ، واحتضان في 37 درجه مئوية ، 5 ٪ CO2 ل ~ 3 h.
- استبدال وسائل الاعلام مع 2 مل من DMEM الطازجة واحتضان في 37 درجه مئوية ، 5 ٪ CO2 لمده 24 ساعة.
- أضافه 1 مل من DMEM الطازجة واحتضانها في 37 درجه مئوية ، 5 ٪ CO2 لمده 24 ساعة اضافيه (مجموع وقت الحضانة هو 48 h).
- نقل الثقافة ماده طافي إلى أنبوب 50 mL والطرد المركزي في 3,000 x g لمده 15 دقيقه لأزاله اي الخلايا العائمة الحرة.
- تصفيه ماده طافي من خلال فلتر 0.45 μm.
- نقل الترشيح إلى أنابيب الطرد المركزي البولي بروبيلين.
- Ultracentrifuge في 4 درجه مئوية و 72,100 x g في rماكس ل 3 ح.
- يستنشق بعناية supernatant ، تاركا وراءه بيليه بيضاء.
- أعاده تعليق بيليه مع 100 μL من المصل خاليه من الخلايا العضوية توسيع المتوسطة دون تهويه.
- الحفاظ علي 10 μl قسامه لقياس عيار الفيروسية وتخزين جميع قسامه المتبقية في-80 درجه مئوية حتى المطلوبة.
- معايره الفيروس مع فحص المستندة إلى qPCR وفقا لتعليمات الشركة المصنعة باستخدام 10 μL الفيروسية aliquot.
2. العزلة والتوصيل من الخلايا السالبة النسب من نخاع العظم الماوس (الشكل 1A)
ملاحظه: عاده ، لعزل الخلايا بما فيه الكفاية ، يتم حصاد أزواج من tibias ، femurs ، و العضد من كل ماوس. ويمكن أيضا حصاد عظام الحوض والعمود الفقري كمصدر للخلايا السالبة لنسب.
- عزل خلايا نخاع العظم
- موت ببطء 8-10 الأسبوع القديمة الذكور CRISPR/كاس 9 تدق في الفئران بنسبه 5 ٪ ايزوفلوراني تليها خلع عنق الرحم ، ثم تطهير بشرتهم مع الايثانول 70 ٪.
- باستخدام مقص تشريح ، وجعل شق عرضيه في الجلد تحت القفص الصدري مباشره وقشر الجلد بشكل منتفخ في كلا الاتجاهين لفضح الساقين والذراعين.
- افصل الأطراف السفلية بعناية عن عظم الورك عن طريق فصل مفصل الورك. قطع علي طول راس عظم الفخذ لأزاله عظم الفخذ تماما من الورك. فك الركبة وقطع في المفصل لفصل عظم الفخذ والساق ، مع الحفاظ علي العظم الخلوي سليمه. تفكيك مفصل الكاحل وقشر بعيدا القدم والعضلات الاضافيه.
- باستخدام مقص تشريح ، وقطع علي الكتف لفصل الأطراف العليا. فك الكتف ، ثم قطع في مفصل الكوع لحصاد عظم العضد.
- استخدام مناديل السليلوز ألياف لأزاله العضلات بعناية من الإناث ، التحيز ، و humeri. اتخاذ احتياطات اضافيه للتاكد من ان العظام لا كسر اثناء هذه العملية.
- وضع العظام المعزولة في أنبوب مخروطي 50 mL التي تحتوي علي RPMI ، ومكان علي الجليد.
ملاحظه: يجب تنفيذ الخطوات التالية في خزانه الفئة الثانية للسلامة البيولوجية. - انقل العظام إلى طبق ثقافة معقم 100 ملم.
- فهم العظم مع ملقط حاده ، واستخدام مقص تشريح ، وقطع بعناية علي حد سواء ابيهيسيس.
ملاحظه: سيؤدي القطع غير كافيه إلى تدفق غير مكتملة من نخاع العظم ، في حين ان القطع العدوانية بشكل مفرط سيؤدي إلى فقدان الخلايا. - ملء حقنه 10 مل مع RPMI الجليد الباردة, وباستخدام ابره 22 G, مسح نخاع العظم من رمح إلى جديد 100 mm الثقافة طبق.
ملاحظه: العظام سوف تصبح بيضاء وشفافة إذا كان رمح العظام تم مسح جيدا. إذا لم يكن كذلك ، وأعاده قطع العظام ينتهي ودافق مره أخرى. - بعد كل نخاع العظم قد تم جمعها ، وجعل تعليق خليه واحده عن طريق تمرير نخاع العظم عده مرات من خلال حقنه 10 مل مع ابره 18 ز. كرر 10x لضمان تعليق خليه واحده.
- تصفيه تعليق الخلية من خلال مصفاه الخلية 70 μm في أنبوب مخروطي 50 mL.
- جهاز الطرد المركزي في 310 x g ل 10 دقيقه في 4 °c.
- يستنشق ماده طافي وأعاده التعليق الكريات الخلية في حجم مناسب من العازلة الفصل الأمثل لعمليه فصل الخلية التالية.
- العزلة واللينتيفيروسه من الخلايا السالبة لنسب
ملاحظه: يتم عزل الفئران النسب-الخلايا السالبة من نخاع العظم من كاس 9 الماوس المحورة وراثيا3، أو سلالات أخرى من الفئران ، وذلك باستخدام مجموعه استنزاف النسب وفقا لتعليمات الشركة المصنعة. عاده ، تمثل الخلايا السالبة للنسب 2%-5% من خلايا نواه النخاع العظمي الكاملة ، والنقاء عاده أكبر من 90% بعد العزلة. يتم استزراع الخلايا المعزولة النسب السلبية في مصل خاليه من الدم الخلايا العضوية توسيع المتوسطة تستكمل مع 20 نانوغرام/مل المؤتلف murine TPO و 50 ng/mL المؤتلف murine ، ثم محوله مع ناقل لينتيفيروس ل 16 ح في تعدد العدوى (وزاره الداخلية) = 100.- لعزل الخلايا السالبة للسلالة ، استخدم مجموعه استنفاد خلايا النسب وفقا لإرشادات الشركة المصنعة.
- بعد العزلة أعاده تعليق الخلايا السالبة النسب في 1 مل من المصل خاليه من الدم توسيع الخلية المتوسطة.
- بذور الخلايا في 6 لوحه جيدا في كثافة 1.5 x 106 خلايا/مل (5 × 105 نسب-الخلايا السالبة/الماوس.)
- أضافه المؤتلف murine TPO والصندوق الدائم في الآبار في التركيزات النهائية من 20 نانوغرام/مل و 50 ng/mL ، علي التوالي.
- قبل احتضان الخلايا في 37 درجه مئوية في 5 ٪ CO2 ل ~ 2 h.
- أضافه لينتيفيروس في موي = 100 ، 4 ميكروغرام/مل بوليبيرين ، والبنسلين/ستربتوميسين إلى الآبار واحتضان في 37 درجه مئوية ، 5 ٪ CO2 ل 16-20 h (الشكل 1b).
- في اليوم التالي ، وجمع الخلايا لينتيفيروس محوله إلى أنبوب مخروطي 15 مل والطرد المركزي في 300 g لمده 10 دقيقه.
- يستنشق بعناية ماده طافي وأعاده تعليق بيليه في 200 μl من rpmi لكل ماوس. الحفاظ علي الخلايا في RT حتى زرع في الفئران (القسم 3).
3-زرع الخلايا المحولة في الفئران المشعة قاتل
- في يوم من زرع نخاع العظم, مكان الفئران المتلقي في قفص فطيره ثمانيه شريحة وتعريضهم لجرعين من تشعيع الجسم كله (550 راد/الجرعة, الجرعة الاجماليه = 1100 راد), مع ما يقرب من 4 ساعة بين كل جلسة التشعيع.
- بعد الجلسة التشعيع الثانية ، حقن الخلايا السالبة النسب المحولة إلى كل الفئران المتلقي التخدير عن طريق الضفيرة الوريد المداري الرجعية (200 μL في المجموع) باستخدام حقنه الانسولين (الشكل 1C).
- بعد التشعيع ، يجب ان تكون الفئران موجودة في أقفاص معقمه ومزوده بنظام غذائي لين ومياه الشرب تستكمل بالمضادات الحيوية ل 14 د.
- في 3-4 أسابيع بعد زرع نخاع العظم ، وتحليل الدم المحيطي للتحقق من الفحص من الخلايا المتبرعة محوله (القسم 4).
4. تقييم تشيميريسم الدم المحيطي
- تخدير الفئران مع 5 ٪ ايزوفلوان والحصول علي عينه الدم من الوريد الرجعية المدارية باستخدام أنابيب الشعرية ، وجمعها في K2أنابيب أدتا (حجم في أنبوب واحد الشعرية كافيه لمقايسة التالية).
- نقل 20 μL من الدم من أنابيب K2EDTA في 5 مل جولة أسفل أنابيب البوليسترين اختبار ، ووضعت علي الجليد.
- أضافه 1.5 mL من المخزن المؤقت تحلل إلى خلايا الدم الحمراء lyse. احتضان لمده 5 دقائق علي الجليد.
- لتحييد العازلة تحلل ، وغسل العينات مع العازلة FACS (1.5 mL/عينه).
- جهاز الطرد المركزي في 609 x g في rماكس لمده 5 دقائق في 4 ° c. تجاهل الخارقة.
- احتضان الخلايا مع كوكتيل من الأجسام المضادة الاحاديه (المخفف في 100 μL FACS العازلة/عينه) في RT لمده 20 دقيقه في الظلام. يتم توفير قائمه كامله من الأجسام المضادة في قسم المواد أعلاه.
- غسل الخلايا مره واحده مع العازلة FACS (2 مل/عينه). جهاز الطرد المركزي في 609 x g في rماكس (1,800 دوره في الدقيقة) لمده 5 دقائق في 4 ° c. تجاهل الخارقة تماما.
- إصلاح الخلايا مع بارافورمالدهيد التي تحتوي علي تثبيت العازلة (100 μL/tube) لمده 10 دقيقه في 4 ° c.
- اغسل الخلايا مره واحده مع العازلة FACS (3 مل/عينه). جهاز الطرد المركزي في 609 x g في rماكس (1,800 دوره في الدقيقة) لمده 5 دقائق في 4 ° c. تجاهل الخارقة تماما.
- تعليق بيليه في 400 μL من المخزن المؤقت FACS.
- الحفاظ علي العينات في 4 درجه مئوية حتى التحليل عن طريق تدفق الخلوي.
النتائج
باستخدام البروتوكول المذكور أعلاه ، تم الحصول علي ما يقرب من 0.8-1.0 x 108 خلايا نخاع العظم لكل ماوس. عدد الخلايا السالبة النسب نحصل علي ما يقرب من 3 × 106 خلايا لكل ماوس. عاده ، الغلة من نخاع العظم سلاله-الخلايا السالبة هي 4 ٪-5 ٪ من تلك الخلايا النووية نخاع العظم الكلي.
يتم تقييم تشيميريسم الخلايا المحولة (الايجابيه لعروض العروض) من خلال قياس التدفق الخلوي للدم المحيطي (الشكل 2 ا،ب). ويتم عزل الدم من الوريد المداري الرجعي وتستخدم العلامات المناسبة لتحديد هويه كل خليه من الخلايا التي يمكن ان تكون للدم (اي العدلات والخلايا الاحاديه والكريات التائية وغيرها). (الشكل 3 ا،ب). يمكن عزل الحمض النووي الجيني من خلايا الدم الايجابيه لعروض العروض ، ويمكن تضخيم أجزاء من الحمض النووي للموقع المستهدف من قبل PCR والمستنسخة في ناقلات الاستنساخ TA لتحليل التسلسل. يتم توصيل هذه البلازميدات إلى e. كولاي ويتم تحديد تسلسل الموقع الهدف بواسطة sanger التسلسل (الشكل 4). بدلا من ذلك ، يمكن تحديد تسلسلات المواقع المستهدفة بواسطة أساليب أخرى ، مثل تسلسل Sanger للجيجين المجمع متبوعا بتتبع التحليلات المتسلسلة (TIDE) للتحليل10. بالنسبة لشرط التحكم ، يتم عاده زرع الفئران مع الخلايا التي يتم محولها مع لينتيفيروس التعبير عن عدم استهداف الحمض الريبي النيبالي.
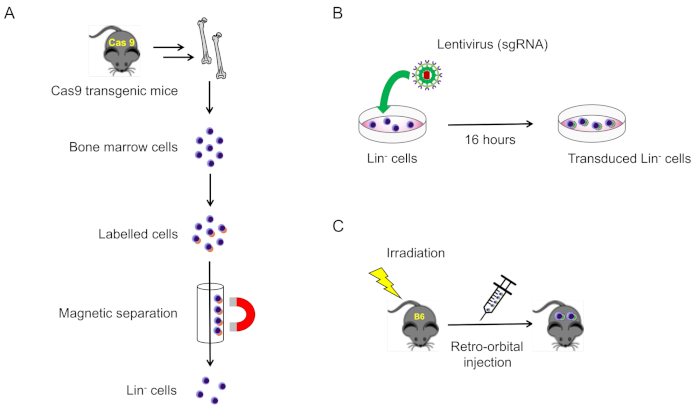
الشكل 1: توضيح تخطيطي لهذا البروتوكول. (ا) عزل خلايا نخاع العظم السالبة لنسب الفئران الكاس 9ه (القسم 2.1). (ب) لينتيفيروس الخلايا السالبة لنسب (القسم 2.2). (ج) الحقن المداري للخلايا المحولة لقاتل في فئران الأنواع البرية المشعة (القسم 3). يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
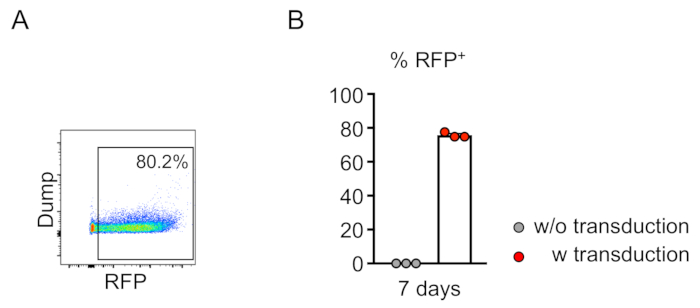
الشكل 2: كفاءه لينتيفيرال محول نخاع عظم الفئران-الخلايا السالبة في المختبر. (ا) تحليل قياس التدفق الخلوي يكشف عن التوصيل الناجح للخلايا السالبة لنسب الخلايا. تم اجراء التحليل بعد 7 أيام من الثقافة في المختبر. (ب) في المتوسط ، تم توصيل 75.7 في المائة من الخلايا في هذا الفحص (ن = 3). يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
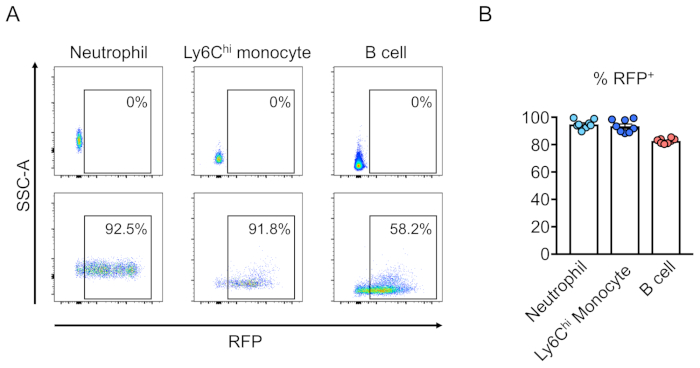
الشكل 3:أعادهتشكيل قاتل-نخاع العظم المشع بالماوس بواسطة خلايا سالبه النسب. (ا) تحليل التدفق الخلوي للدم الطرفي للماوس بعد أعاده الخلايا الجذعية للدم التي كانت (القاع) أو لم تكن (اعلي) محوله مع لينتيفيروس التعبير عن عروض العروض. يتم تعريف العدلات علي انهاLy6G + و Ly6Chi الخلايا الاحاديه كما Ly6G- وLY6C +، وخليه B كماCD45R +. (ب) في هذه المقايسات ، في المتوسط 94.8 ٪ ، 93.5 ٪ ، و 82.7 ٪ من الخلايا هي عروضالعروض + في العدلات ، Ly6Chi البويضة ، والسكان خليه B ، علي التوالي (ن = 8). يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
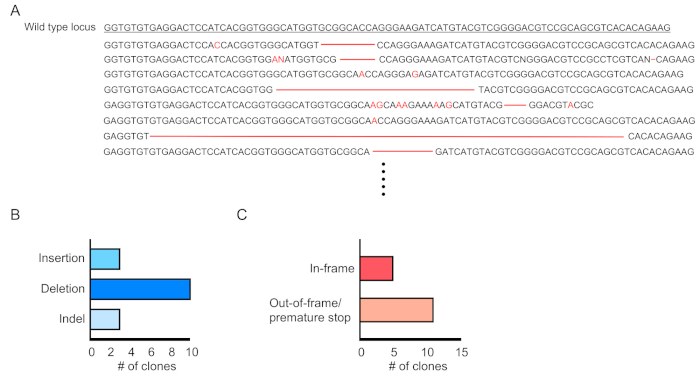
الشكل 4:تقييم تحرير الجينات في خلايا الدم المحولة. (ا) مثال علي تحرير الجينات التي تبين نتائج التسلسل لموضع Dnmt3a المتحول في خلايا الدم الايجابيه للجبهة الرواندية. يتم إظهار الحذف كشرطات حمراء ويتم الرمز الادراج مع أحرف حمراء. (ب) ملخص الطفرات التي تم اكتشافها. (ج) 69 ٪ (11/16 استنساخ) أظهرت الطفرات خارج الإطار/التوقف المبكر. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
| البلازميد | الحجم (bp) | المبلغ لكل بئر (ميكروغرام) | نسبه |
| pLKO 5.0 | 7700 | 0.9 | 2 |
| psPAX2 | 10668 | 0.6 | 1 |
| pMD2 | 5822 | 0.3 | 1 |
| PEI-ماكس (الأسهم: 100 ملغ/مل) | 5 ميكرولتر/بئر | ||
الجدول 1: كميات البلازميد و PEI-ماكس المستخدمة للتحويل.
Discussion
وتتمثل ميزه هذا البروتوكول في إنشاء نماذج حيوانيه تاوي طفرات محدده في الخلايا التي تكون فيها الدم بطريقه سريعة وفعاله من حيث التكلفة مقارنه بالنهج المعدلة وراثيا للماوس التقليدي. وقد وجد ان هذه المنهجية تمكن جيل من الفئران مع التلاعب الجينات الخلية التي تكون الدم في غضون 1 شهر. وهناك عده خطوات حاسمه في هذا البروتوكول تتطلب مزيدا من الدراسة.
عرض تسلسل gRNA
فمن المستحسن لاختبار gRNAs في المختبر لتقييم كفاءه التحرير قبل السلوك في التجارب المجرية. يتم اختبار كفاءه gRNAs باستخدام نظام النسخ والفرز الخالي من الخلايا في المختبر. ويتم التحقق من التصديق علي gRNA المنسوخة من خلال قياس كفاءتها في الشق الحمض النووي القالب في وجود المؤتلف كاس 9 البروتين ، وذلك باستخدام الكهربائي هلام اجنشا. وتتوفر مجموعات متاحه تجاريا لهذا الغرض.
هنا ، تتميز الطفرات سياحه من قبل الاستنساخ TA من منتجات PCR تضخيمها من المنطقة المحررة ، وتحويل الخلايا البكتيرية مع تلك البلازميدات ، والتقاط مستعمرات الفردية للتسلسل sanger. ومع ذلك ، هذه الطريقة شاقه وتستغرق وقتا طويلا. وبدلا من ذلك ، يمكن تنفيذ تسلسل الجيل التالي (خ ع و) أو تسلسل الحمض النووي المجمع متبوعا بتحليل المد والجزر19. تم إنشاء خوارزميه تايد لتحليل اثار تسلسل Sanger التي تم إنشاؤها من العينات المعقدة. وقد تبين ان التقديرات المتعلقة بالمد والجزر تتسق عاده مع البلدان غير المستهدفة من هذه الفئة20. البرنامج التحليلي هو متاح علي الإنترنت في < http://tide.nki.nl >.
جيل من جسيمات لينتيفيروس عاليه الارتفاع
فيروس التهاب الفم الفيروسي الحويصلة G-البروتين ، وهو أمر ضروري للعدوى الخلوية ، هو حساس للغاية لدرجه الحموضة. التالي ، فمن المهم للحفاظ علي الثقافة المتوسطة ضمن نطاق الحموضة مقبوله ، وانه لا ينبغي تطوير مظهر مصفر. يتم استخدام الاطباق المغلفة بالكولاجين لتوليد الفيروسات لأنه يسرع المرفق من خلايا HEK293T ويسمح بأداء الانتقال في غضون ساعات قليله ، بدلا من الانتظار بين عشيه وضحيها. ومع ذلك ، اعتمادا علي الجدول الزمني التجريبي ، يمكن أيضا النظر في الحضانة بين عشيه وضحيها.
تنقيه جزيئات لينتيفيروس
لتحقيق الكفاءة في توصيل الخلايا الجذعية التي تكون الدم ، فمن الضروري لتوليد لينتيفيروس عاليه titer. الأمثل للسرعة طرد هو ميزه رئيسيه. في حين يتم عاده تنفيذ تركيز لينتيفيروس في 90,000 x g, وقد أظهرت عده تقارير ان الفيروس الانتعاش يزيد إذا كانت المادة طرد في سرعه اقل من 20,000 x ز18. وقد اقترح أيضا إنتاج اللينتيفيروس العالية التحضير بدون الحلول العليا17. وتجدر الاشاره إلى انه من المهم تعليق الفيروس طرد بيليه مع تجنب الأنابيب القوية للحد من التهوية والحفاظ علي سلامه الفيروسات. مطلوب جسيمات لينتيفيروس عاليه المستوي لتوصيل فعال للخلايا الجذعية التي تكون الدم11. وكشفت التجارب التجريبية ان وزاره الداخلية ال100ه هي الأمثل فيما يتعلق بكفاءة الطاقة وقابليه الخلية للاستمرار. فمن المستحسن لتقييم لينتيفيروس المخزونات علي أساس سلامه الخلية وكفاءه المحولات.
تخزين الجزيئات اللينتيفيروسه
لينتيفيروس عيار حساسة للغاية لدرجه الحرارة ، ويمكن خفض عيار بشكل كبير عن طريق ظروف التخزين غير المناسبة ومتكررة تجميد ذوبان دورات. وقد تبين ان كفاءه اللينتيفيروس تنخفض بسرعة عند تخزينها في 4 درجات مئوية [t (1/2) = 1.3 أيام] أو تخضع لدورات تجميد وذوبان متعددة [t (1/2) = 1.1 طلقه]. فمن المستحسن ان الاستعدادات الفيروس تكون المفاجئة المجمدة في النيتروجين السائل أو الجليد الجاف المسحوق قريبا بعد ان يتم تعليق بيليه الفيروس. وينبغي الحفاظ علي المخزونات الفيروسية في-80 درجه مئوية وأذابها علي الجليد إلى RT قبل تاخيرمن فقط واستخدام11.
وينبغي الاشاره إلى عده قيود محتمله. أولا ، وقد تم تقديم الطفرات سياحه خارج الهدف من قبل crispr/كاس 9 منذ فتره طويلة موضع تقدير. وقد ثبت أيضا ان CRISPR/كاس 9 يمكن ان تحفز الطفرات خارج الهدف في الجسم المجري21. في الممارسة العملية ، يمكن تجنب الطفرات سياحه خارج الهدف باستخدام تسلسل grna التي تتطابق بشكل وثيق مع مواقع الجينوم المستهدفة ولها أكثر من أربعه عدم التطابق إلى المواقع الثانوية المتوقعة. ويمكن ان يتم هذا التصميم مع القائمة في أدوات سيليكو22. تتوفر الاداات الحسابية الأخرى للتنبؤ ب gRNA مع الإجراءات غير المستهدفة المصغرة (< http://portals.broadinstitute.org/gpp/public/analysis-tools/sgrna-design > أو < http://www.Benchling.com >). قد يكون مفيدا أيضا لتحليل نموذج الحيوانية باستخدام اثنين أو أكثر من gRNAs مختلفه لتاكيد النمط الظاهري وتقليل احتمال ان يتم توسط النمط الظاهري لوحظ بواسطة تاثير خارج الهدف من Grnas محدده.
بالاضافه إلى الطفرات سياحه التقليدية التي تم إنشاؤها بواسطة crispr/كاس 9 ، تم الإبلاغ عن الحذف الأكبر التي تمتد إلى ما وراء كيلواسيس. هذا يستطيع [كنترد] دراسات; ومع ذلك ، يتم الإبلاغ عن تلك المحذوفات الأكبر ان تردد اقل بكثير مقارنه مع indels23. ومن المشاكل المحتملة الأخرى التعويض الجيني. هو يتلقى يكون أفادت ان متحولة [رنا] مع [بربريايشن] إنهاء [كودون] ([فب]) يستطيع نتجت في الحامل من مورثات متصلة مع تسلسل تشابه ببوصله مجمعه-توسط تنشيط من نسخ24,25. وقد اقترح هذا الحدث لتكون اليه التي يمكن ان تؤدي إلى الاختلافات الظاهرية بين الطرق الخروج والنهج الضربة القاضية لاستئصال الجينات. لان CRISPR/كاس 9-بوساطة الجينوم التحرير يعتمد بشكل كبير علي الإدخال العشوائي للتحولات الإطار التحول التي تؤدي إلى توليد المعهد الخاص للاتصالات ، والتعويض الوراثي يمكن تعديل النمط الظاهري. لتجنب التعويض الوراثي ، يمكن النظر في التجارب التي تستهدف تسلسل الجينات التنظيمية من قبل CRISPR/كاس 9 أو عن طريق إدخال المعدلات الكتابية باستخدام كاس 9 كمنصة التعرف علي الحمض النووي الريبي التي تسترشد.
وأخيرا ، ينبغي الاعتراف بان تكون الدم من الخلايا المغلفة في الفئران قاتل المشعة قد تختلف عن الظروف الاصليه لتكون الدم. وعلاوة علي ذلك ، يمكن ان يكون للإشعاع اثار جهازيه علي الكائن الحي الذي قد يثبت تفسير التجارب التي تفحص الآثار الجينية الطفرات في الخلايا التي تكون الدم.
وقد استفاد الباحثون من البروتينات غير النشطة المحفزة لكاس 9 (dCas9) باعتبارها "منصة التعرف علي الحمض النووي الريبي التي تسترشد بها الجيش الثوري النيبالي" واستخدموا dCas9 بروتينات الانصهار لتعريب المجالات العاكسة لتسلسلات DNA محدده لقمع (CRISPRi) أو تنشيط النسخ خارج الهدف الجينات26،27. في حين يستخدم هذا البروتوكول الفئران المعدلة وراثيا كاس 9 النشطة لإدخال dsDNA الانقسام في تسلسل الحمض النووي الجيني ، والتعديل الوراثي لقمع أو تنشيط جينات محدده قابله للتطبيق عن طريق الصهر dCas9 مع مجالات التغير الكروماتين مثل dCas9-KRAB أو dCas9-VP64 ، علي التوالي. وبدلا من ذلك ، يمكن استخدام dCas9 كجهاز لقمع النقل العابر باعتباره جهازا خاصا به ، عن طريق حجب آلات الناقلة للوصول إلى موقع الجينات27. وفي الاونه الاخيره ، إنشا تشو وآخرون الفئران المعدلة وراثيا dCas9-SunTag-p65 (SPH) التي تعبر عن النسخة تعديل من المنشط الجيني تنصهر مع dCas9 وأظهرت ان هذا النظام CRISPRa يعمل في فيفو28.
مختبرنا يستخدم في الغالب هذه التكنولوجيا لدراسة دور الدم الإكليلي في عمليات امراض القلب والاوعيه الدموية. في الانسجه المنتشرة ، يمكن ان تضفي الطفرات الجسدية في جينات السائقين السرطانية ميزه نمو خلوي وتؤدي إلى توسعات النسيلي منحرفة. في نظام الجهاز الغذائي ، تعرف هذه العملية باسم "تكون الدم الاكليليه" ، وينتج عنها حالات يتم فيها استبدال جزء كبير من الكريات البيضاء للفرد بالمستنسخات المتحولة. وهناك تقدير متزايد ان التوسعات المنحرفة الشاذة تسريع امراض القلب والاوعيه الدموية ، مثل تصلب الشرايين وفشل القلب ، والمساهمة في المراضه والوفاات جميع الأسباب15،29.
في الاونه الاخيره ، تم توثيق علاقة سببيه بين العديد من هذه الطفرات الجسدية وامراض القلب والاوعيه الدموية ، وتم توضيح جوانب من أليات الاساسيه10،13،14. ومع ذلك ، فان هذه الطفرات الجسدية علي الأرجح تمثل "غيض من فيض" ، كما أظهرت الدراسات الوبائية ان العديد من الجينات المرشحة الاضافيه ترتبط مع تكون الدم الاكليليه ، وربما ، وزيادة وفيات امراض القلب والاوعيه الدموية. التالي ، مطلوب تقييم الانتاجيه المنتظمة والعالية من الجينات سائق تكون الدم. وتستند الدراسات الحالية للاتصال السببية من الدم الاكليليه وامراض القلب والاوعيه الدموية علي تحليل الفئران مع النظام الغذائي الوراثي المشروط الخاص بالدم (Mx1 ، Vav-Cre ، الخ) أو الفئران بعد زرع نخاع العظم. غير ان هذه الاستراتيجيات تحتاج إلى إنشاء مستعمرات فارهة جديده وقد تصبح عبئا ماليا وماديا علي الباحثين. التالي ، فان الطريقة الأرخص والأسرع من النهج التقليدي الذي استخدم في الماضي والتي كانت تستخدم في السابق ، لها ما يبررها. المتجات لينتيفيرال لنقل تقنيات HSPC و CRISPR لهندسه الطفرات ، كما هو موضح في هذه المخطوطة ، تسهل دراسة الدم الإكليلي وامراض القلب والاوعيه الدموية.
بالاضافه إلى توليد التقليدية ضرب الخروج الموضع ، وهذا الأسلوب ينطبق علي إنتاج البروتينات المتحولة المقتطعة. علي سبيل المثال, الباحثين قد ولدت بنجاح اقتطاع Ppm1d الدم, الذي ينظر اليه في كثير من الأحيان في المرضي الذين يعانون من الدم الكلوي, عن طريق إدخال طفرات تعالج مع grna استهداف اكسون 6 من الجينات Ppm1d30.
Disclosures
وليس لدي المؤلفين ما يفصحون عنه.
Acknowledgements
[س. س.] كان ساندت بامريكيه قلب جمعيه دكتوراه زمالة [17 بوس33670076]. تم دعم k. w. من قبل المعاهد القومية للصحة المنح R01 HL138014 ، R01 HL141256 ، و R01 HL139819.
Materials
| Name | Company | Catalog Number | Comments |
| RPMI Medium 1640 (1X) | Gibco | 11875-093 | Medium |
| Sulfamethoxazole and Trimethoprim injection | TEVA | 0703-9526-01 | |
| 1/2 cc LO-DOSE INSULIN SYRINGE | EXELINT | 26028 | general supply |
| 293T cells | ATCC | CRL-3216-- | Cell line |
| APC-anti-mouse Ly6C (Clone AL-21) | BD Biosciences | 560599 | Antibodies |
| APC-Cy7-anti-mouse CD45R (RA3-6B2) | BD Biosciences | 552094 | Antibodies |
| BD Luer-Lok disposable syringes, 10 ml | BD | 309604 | general supply |
| BD Microtainer blood collection tubes, K2EDTA added | BD Bioscience | 365974 | general supply |
| BD Precisionglide needle, 18 G | BD | 305195 | general supply |
| BD Precisionglide needle, 22 G | BD | 305155 | general supply |
| BV510-anti-mouse CD8a (Clone 53-6.7) | Biolegend | 100752 | Antibodies |
| BV711-anti-mouse CD3e (Clone 145-2C11) | Biolegend | 100349 | Antibodies |
| Collagen from calf skin | Sigma-Aldrich | 9007-34-5 | general supply |
| Corning Costar Ultra-Low Attachment Multiple Well Plate, 6 well | Millipore Sigma | CLS3471 | general supply |
| CRISPR/Cas9 knock-in mice | The Jackson Laboratory | 028555 | mouse |
| DietGel 76A | Clear H2O | 70-01-5022 | general supply |
| Dulbecco’s Modified Eagle’s Medium (DMEM) - high glucose | Sigma Aldrich | D6429 | Medium |
| eBioscience 1X RBC Lysis Buffer | Thermo fisher Scientific | 00-4333-57 | Solution |
| Falcon 100 mm TC-Treated Cell Culture Dish | Life Sciences | 353003 | general supply |
| Falcon 5 mL round bottom polystyrene test tube | Life Sciences | 352054 | general supply |
| Falcon 50 mL Conical Centrifuge Tubes | Fisher Scientific | 352098 | general supply |
| Falcon 6 Well Clear Flat Bottom TC-Treated Multiwell Cell Culture Plate | Life Science | 353046 | general supply |
| Fisherbrand microhematocrit capillary tubes | Thermo Fisher Scientific | 22-362566 | general supply |
| Fisherbrand sterile cell strainers, 70 μm | Fisher Scientific | 22363548 | general supply |
| FITC-anti-mouse CD4 (Clone RM4-5) | Invitrogen | 11-0042-85 | Antibodies |
| Fixation Buffer | BD Bioscience | 554655 | Solution |
| Guide-it Compete sgRNA Screening Systems | Clontech | 632636 | Kit |
| Isothesia (Isoflurane) solution | Henry Schein | 29404 | Solution |
| Lenti-X qRT-PCR Titration Kit | Takara | 631235 | Kit |
| Lineage Cell Depletion Kit, mouse | Miltenyi Biotec | 130-090-858 | Kit |
| Millex-HV Syringe Filter Unit, 0.45 mm | Millipore Sigma | SLHV004SL | general supply |
| PBS pH7.4 (1X) | Gibco | 10010023 | Solution |
| PE-Cy7-anti-mouse CD115 (Clone AFS98) | eBioscience | 25-1152-82 | Antibodies |
| PEI MAX | Polysciences | 24765-1 | Solution |
| Penicillin-Streptomycin Mixture | Lonza | 17-602F | Solution |
| PerCP-Cy5.5-anti-mouse Ly6G (Clone 1A8) | BD Biosciences | 560602 | Antibodies |
| pLKO5.sgRNA.EFS.tRFP | Addgene | 57823 | Plasmid |
| pMG2D | Addgene | 12259 | Plasmid |
| Polybrene Infection/Transfection Reagent | Sigma Aldrich | TR-1003-G | Solution |
| Polypropylene Centrifuge Tubes | BECKMAN COULTER | 326823 | general supply |
| psPAX2 | Addgene | 12260 | Plasmid |
| RadDisk – Rodent Irradiator Disk | Braintree Scientific | IRD-P M | general supply |
| Recombinant Murine SCF | Peprotech | 250-03 | Solution |
| Recombinant Murine TPO | Peprotech | 315-14 | Solution |
| StemSpan SFEM | STEMCELL Technologies | 09600 | Solution |
| TOPO TA cloning kit for sequencing with One Shot TOP10 Chemically Competent E.coli | Thermo fisher Scientific | K457501 | Kit |
| Zombie Aqua Fixable Viability Kit | BioLegend | 423102 | Solution |
References
- Sasaki, Y., et al. Defective immune responses in mice lacking LUBAC-mediated linear ubiquitination in B cells. EMBO Journal. 32, 2463-2476 (2013).
- Ogilvy, S., et al. Transcriptional regulation of vav, a gene expressed throughout the hematopoietic compartment. Blood. 91, 419-430 (1998).
- Meyer, S. E., et al. DNMT3A Haploinsufficiency Transforms FLT3ITD Myeloproliferative Disease into a Rapid, Spontaneous, and Fully Penetrant Acute Myeloid Leukemia. Cancer Discovery. 6, 501-515 (2016).
- Kuhn, R., Schwenk, F., Aguet, M., Rajewsky, K. Inducible gene targeting in mice. Science. 269, 1427-1429 (1995).
- Cole, C. B., et al. PML-RARA requires DNA methyltransferase 3A to initiate acute promyelocytic leukemia. Journal of Clinical Investigation. 126, 85-98 (2016).
- Yang, H., et al. One-step generation of mice carrying reporter and conditional alleles by CRISPR/Cas-mediated genome engineering. Cell. 154, 1370-1379 (2013).
- Wang, H., et al. One-step generation of mice carrying mutations in multiple genes by CRISPR/Cas-mediated genome engineering. Cell. 153, 910-918 (2013).
- Quadros, R. M., et al. Easi-CRISPR: a robust method for one-step generation of mice carrying conditional and insertion alleles using long ssDNA donors and CRISPR ribonucleoproteins. Genome Biology. 18, 92 (2017).
- Miura, H., Quadros, R. M., Gurumurthy, C. B., Ohtsuka, M. Easi-CRISPR for creating knock-in and conditional knock-out mouse models using long ssDNA donors. Nature Protocols. 13, 195-215 (2018).
- Sano, S., et al. CRISPR-Mediated Gene Editing to Assess the Roles of Tet2 and Dnmt3a in Clonal Hematopoiesis and Cardiovascular Disease. Circulation Research. 123, 335-341 (2018).
- Cante-Barrett, K., et al. Lentiviral gene transfer into human and murine hematopoietic stem cells: size matters. BMC Research Notes. 9 (312), (2016).
- Chu, V. T., et al. Efficient CRISPR-mediated mutagenesis in primary immune cells using CrispRGold and a C57BL/6 Cas9 transgenic mouse line. Proceedings of the National Academy of Sciences of the United States of America. 113, 12514-12519 (2016).
- Fuster, J. J., et al. Clonal hematopoiesis associated with TET2 deficiency accelerates atherosclerosis development in mice. Science. 355, 842-847 (2017).
- Sano, S., et al. Tet2-Mediated Clonal Hematopoiesis Accelerates Heart Failure Through a Mechanism Involving the IL-1beta/NLRP3 Inflammasome. Journal of the American College of Cardiology. 71, 875-886 (2018).
- Sano, S., Wang, Y., Walsh, K. Clonal Hematopoiesis and Its Impact on Cardiovascular Disease. Circulatory Journal. 71, 875-886 (2018).
- Heckl, D., et al. Generation of mouse models of myeloid malignancy with combinatorial genetic lesions using CRISPR-Cas9 genome editing. Nature Biotechnology. 32, 941-946 (2014).
- Jiang, W., et al. An optimized method for high-titer lentivirus preparations without ultracentrifugation. Scientific Reports. 5, 13875 (2015).
- Cribbs, A. P., Kennedy, A., Gregory, B., Brennan, F. M. Simplified production and concentration of lentiviral vectors to achieve high transduction in primary human T cells. BMC Biotechnology. 13, 98 (2013).
- Brinkman, E. K., Chen, T., Amendola, M., van Steensel, B. Easy quantitative assessment of genome editing by sequence trace decomposition. Nucleic Acids Research. 42, e168 (2014).
- Sentmanat, M. F., Peters, S. T., Florian, C. P., Connelly, J. P., Pruett-Miller, S. M. A Survey of Validation Strategies for CRISPR-Cas9 Editing. Scientific Reports. 8, 888 (2018).
- Akcakaya, P., et al. In vivo CRISPR editing with no detectable genome-wide off-target mutations. Nature. 561, 416-419 (2018).
- Bae, S., Park, J., Kim, J. S. Cas-OFFinder: a fast and versatile algorithm that searches for potential off-target sites of Cas9 RNA-guided endonucleases. Bioinformatics. 30, 1473-1475 (2014).
- Kosicki, M., Tomberg, K., Bradley, A. Repair of double-strand breaks induced by CRISPR-Cas9 leads to large deletions and complex rearrangements. Nature Biotechnology. 36, 765-771 (2018).
- El-Brolosy, M. A., et al. Genetic compensation triggered by mutant mRNA degradation. Nature. 568, 193-197 (2019).
- Ma, Z., et al. PTC-bearing mRNA elicits a genetic compensation response via Upf3a and COMPASS components. Nature. 568, 259-263 (2019).
- Gilbert, L. A., et al. CRISPR-mediated modular RNA-guided regulation of transcription in eukaryotes. Cell. 154, 442-451 (2013).
- Qi, L. S., et al. Repurposing CRISPR as an RNA-guided platform for sequence-specific control of gene expression. Cell. 152, 1173-1183 (2013).
- Zhou, H., et al. In vivo simultaneous transcriptional activation of multiple genes in the brain using CRISPR-dCas9-activator transgenic mice. Nature Neuroscience. 21, 440-446 (2018).
- Fuster, J. J., Walsh, K. Somatic Mutations and Clonal Hematopoiesis: Unexpected Potential New Drivers of Age-Related Cardiovascular Disease. Circulatory Research. 122, 523-532 (2018).
- Kahn, J. D., et al. PPM1D truncating mutations confer resistance to chemotherapy and sensitivity to PPM1D inhibition in hematopoietic cells. Blood. , (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved