Method Article
Lentiviral CRISPR/Cas9介导基因组编辑,用于疾病模型中造血细胞的研究
摘要
本文介绍了CRISPR/Cas9系统对鼠血干细胞和祖细胞(HSPC)进行高效基因组编辑的协议,以快速开发具有造血系统特异性基因修饰的小鼠模型系统。
摘要
使用传统的转基因方法在造血干细胞中操作基因可能非常耗时、昂贵且具有挑战性。得益于基因组编辑技术和慢病毒介导的转基因传递系统的进步,这里描述了一种高效、经济的方法,用于建立在造血干细胞中专门操作基因的小鼠。Lenti病毒用于转导Cas9表达的纯骨髓细胞,用引导RNA(gRNA)靶向特定基因和红色荧光报告基因(RFP),然后将这些细胞移植到致命辐照的C57BL/6小鼠中。移植了表达非靶向gRNA的慢病毒的小鼠作为对照。通过对外周血的RFP阳性白细胞的流式细胞分析,对转导造血干细胞的移植进行评价。使用这种方法,在移植后4周内,可以实现骨髓细胞+90%的转导和+70%的淋巴细胞转导。基因组DNA从RFP阳性血细胞中分离出来,目标位点DNA的某些部分被PCR扩增,以验证基因组编辑。该协议提供对造血调控基因的高通量评估,并可扩展到与造血细胞参与的各种小鼠疾病模型。
引言
血液学和免疫学的许多研究都依赖于转基因小鼠的可用性,包括利用造血系统特异性Cre驱动器的常规和有条件的转基因/敲除小鼠,如Mx1-Cre、Vav-Cre等1,2,3,4,5。这些战略要求建立新的小鼠菌株,这可能既费时又造成财政负担。虽然基因组编辑技术的革命性进展使新的小鼠菌株在3-4个月内产生,并具备了适当的技术专长6,7,8,9,在进行实验之前,需要更多的时间来放大小鼠群。此外,这些程序成本高昂。例如,杰克逊实验室列出了目前每株16,845美元的淘汰小鼠发电服务价格(截至2018年12月)。因此,比传统的鼠转基因方法更经济、更高效的方法更有利。
定期聚集的短片段短回溯重复/CRISPR相关蛋白9(CRISPR/Cas9)技术已导致开发新的工具,用于快速和高效的基于RNA的序列特异性基因组编辑。CRISPR/Cas9系统最初被发现为一种细菌适应性免疫机制,用于摧毁入侵的病原体DNA,它被用作提高真核细胞和动物模型中基因组编辑有效性的工具。已采用多种方法将CRISPR/Cas9机械输送到造血干细胞(即电穿孔、核化、脂肪化、病毒传递等)。
在这里,利用慢病毒系统来转化细胞,因为该系统能够有效感染Cas9表达的小鼠造血干细胞,并将指导RNA表达结构、启动子、调控序列和编码基因打包在一起荧光报告蛋白(即GFP、RFP)。利用这种方法,小鼠造血干细胞的体外基因编辑已经实现,随后在致命辐照小鼠中成功重组骨髓10。本研究使用的慢病毒载体表达来自共同核心EF1a启动子的Cas9和GFP报告基因,其内部核糖体进入位点从报告基因上游。导引RNA序列由单独的U6启动子表达。该系统然后用于在候选克隆血泊驱动基因Tet2和Dnmt3a10中创建插入和删除突变。然而,该方法的转导效率相对较低(±5%-10%)由于载体插入(13 Kbp)的尺寸大,限制了转导效率,并减少了生产过程中的病毒性粒度。
在其他研究中,已经表明,更大的病毒RNA大小对病毒的产生和转导效率都有负面影响。例如,据报道,插入尺寸增加1 kb可使病毒产生量减少±50%,小鼠造血干细胞11的转导效率将降至50%以上。因此,尽可能减小病毒插入的大小,以提高系统的效率是有利的。
这一缺陷可以通过采用Cas9转基因小鼠来克服,其中Cas9蛋白以构成性或诱导方式表达12。构成性CRISPR/Cas9敲鼠以无处不在的方式表达来自CaG启动子的Cas9内分酶和EGFP。因此,在核心EF1a启动子控制下,在U6启动子和RFP检测器基因控制下,使用慢病毒载体进行sgRNA构建,实现基因组编辑。通过该系统,成功编辑了造血干细胞的基因,显示转导效率为+90%。因此,该协议提供了一种快速有效的方法来创建小鼠,其中靶向基因突变被引入造血系统。我们的实验室主要使用这种类型的技术来研究克隆血型在心血管疾病过程13、14、15中的作用,但它也适用于血液学的研究恶性肿瘤16.此外,该协议可扩展到分析HSPC中的DNA突变如何影响造血系统的其他疾病或发育过程。
为了建立一个强大的慢病毒载体系统,需要高端点病毒储存和优化条件,以转导和移植造血细胞。在协议中,在第1节中提供了关于制备高丁酸病毒的指令,在第2节中优化了鼠造造干细胞的培养条件,第3节中的骨髓移植方法,以及评估第4节的补体。
研究方案
弗吉尼亚大学机构动物护理和使用委员会(IACUC)已批准所有涉及动物受试者的程序。
1. 慢病毒颗粒的生成和纯化
注: 含有优化导引RNA的Lenti病毒颗粒可以通过Addgene提供的详细协议产生:。关于高蒂特扁豆病毒制备和储存的优化方法,讨论在其他地方17,18。简而言之,慢病毒是通过将慢病毒载体质粒、psPAX2和pMD2.G联合转染到HEK 293T细胞中产生的。文化上清液在转染后48小时收集,并通过超离心浓缩。伦蒂病毒定位由市售qPCR测定决定。此过程应在生物安全 II 类机柜中执行。
- 准备1:200胶原蛋白溶液(0.0005%)在1xPBS。
- 用胶原蛋白溶液涂覆6孔板,在37°C、5%CO2孵育30分钟。
- 种子293T细胞密度为每井1 x 106个细胞,在37°C下孵育,5%CO2为±2小时。
- 要为一口井制备三个转染质粒的混合物,将0.9微克的慢病毒载体、0.6微克的psPAX2和0.3 μg的pMD2.G混合在一起,然后通过加入去离子水达到10μL的总体积。根据井数相应地调整数量。可能需要进一步优化每个质粒的数量和比例,以满足研究人员的需求。
- 小心地将50μL的1x PBS和5μL的稀释PEI MAX(1.0mg/mL)加入质粒混合物中,并在室温(RT)下孵育15分钟(表1)。
- 在混合物中加入 1 mL 的 DMEM。
- 从6孔板吸气介质中,加入1 mL的质粒混合物,并在37°C下孵育,5%CO2为±3小时。
- 用 2 mL 新鲜 DMEM 更换介质,并在 37°C、5% CO2下孵育 24 小时。
- 加入1 mL新鲜DMEM,在37°C下孵育,5%CO2再孵育24小时(总孵育时间为48小时)。
- 将培养液转移到50 mL管中,在3000 x g下将离心机转移15分钟,以去除任何自由漂浮的细胞。
- 通过 0.45 μm 过滤器过滤上清液。
- 将滤液转移到聚丙烯离心管。
- 4 °C 时超离心,r 最大 72,100 x g时超离心,为 3 小时。
- 小心吸出上清液,留下白色颗粒。
- 用100μL无血清造血细胞扩张培养基重新悬浮颗粒,无需曝气。
- 保持10μL等分以测量病毒性分度,并将所有剩余的等分在-80°C,直到需要为止。
- 根据制造商的说明,使用10μL病毒等分使用qPCR检测,用qPCR检测对病毒进行分量。
2. 小鼠骨髓中系质阴性细胞的分离和转导(图1A)
注:通常,为了分离足够的细胞,从每只小鼠中采集一对tibias、股骨和胡美里。骨盆和脊柱骨也可以作为系骨阴性细胞的来源进行采集。
- 骨髓细胞的分离
- 安乐死8-10周大的雄性CRISPR/Cas9敲鼠5%异二苯,然后宫颈脱位,然后用70%乙醇消毒他们的皮肤。
- 使用解剖剪刀,在肋骨正下方的皮肤上进行横向切口,然后朝两个方向剥落皮肤,露出腿部和手臂。
- 通过使髋关节脱位,小心地将下肢与髋骨分开。沿着股骨头切开,从臀部完全取出股骨。脱位膝盖,在关节处切开,以分离股骨和骨质,同时保持骨外皮完好无损。脱位脚踝关节,剥离脚和额外的肌肉。
- 使用解剖剪刀,切过肩膀,以分离上肢。脱位的肩膀,然后在肘关节处切开,以收获腐殖质骨骼。
- 使用纤维素纤维湿巾小心地从股骨、脂肪和胡美里去除肌肉。格外小心,确保骨骼在此过程中不会断裂。
- 将分离的骨头放入含有 RPMI 的 50 mL 锥形管中,并放置在冰上。
注:以下步骤应在生物安全 II 类机柜中执行。 - 将骨骼转移到无菌的 100 mm 培养盘中。
- 用钝钳抓住骨头,用解剖剪刀,小心地切下两个表皮。
注:切割不足会导致骨髓的不完全冲洗,而过度积极的切割将导致细胞损失。 - 用冰冷的 RPMI 填充 10 mL 注射器,并使用 22 G 针头将骨髓从轴冲洗到新的 100 mm 培养盘中。
注:如果骨轴被充分冲洗,骨骼将变为白色和半透明。如果没有,请重新切割骨骼末端并再次冲洗。 - 采集完所有骨髓后,通过10 mL注射器用18G针头多次传递骨髓,使单细胞悬浮。重复 10 倍以确保单细胞悬架。
- 通过70μm细胞过滤器将细胞悬浮液过滤到50 mL锥形管中。
- 在 310 x g下在 4°C 下离心 10 分钟。
- 吸出上清液,将细胞颗粒重新悬浮在适当体积的优化分离缓冲液中,用于以下细胞分离过程。
- 系状阴性细胞的分离和慢病毒转导
注:小鼠系阴性细胞是从Cas9转基因小鼠3的骨髓中分离出的,或其他小鼠菌株,根据制造商的说明使用系骨消耗试剂盒。通常,系骨阴性细胞占整个骨髓成核细胞的2%-5%,分离后纯度通常大于90%。分离的系骨阴性细胞在无血清造血细胞扩张培养中培养,辅以20纳克/mL重组小鼠TPO和50纳克/mL重组小鼠SCF,然后与慢病毒载体转导16小时,在多重感染 (MOI) = 100。- 要分离系骨阴性细胞,请使用根据制造商说明的系外细胞耗尽套件。
- 分离后,在1mL无血清造血细胞扩张培养基中重新悬浮系带阴性细胞。
- 以 1.5 x 106细胞/mL(5 x10 5 系带负细胞/小鼠)的密度将细胞播种到 6 孔板中。
- 将重组鼠TPO和SCF分别加入最终浓度为20纳克/mL和50纳克/mL的孔中。
- 在37°C的5%CO2中预孵化细胞,为期±2小时。
- 在 MOI = 100、4 μg/mL 聚苯乙烯和青霉素/链霉素处向井中加入慢病毒,并在 37°C 下孵育,5% CO2为 16-20 h (图 1B)。
- 第二天,将慢病毒转导细胞收集到15mL锥形管中,以300克离心10分钟。
- 小心地吸出上清液,并在每只小鼠的 200 μL RPMI 中重新悬浮颗粒。将细胞保持在RT,直到移植到小鼠中(第3节)。
3. 将转导细胞移植到致命辐照小鼠体内
- 在骨髓移植当天,将受体小鼠放入八片馅饼笼中,使其暴露于两剂全身照射(550 Rad/dose,总剂量 = 1100 Rad),每次照射之间约4小时。
- 第二次照射后,使用胰岛素注射器(图1C)通过回溯性静脉丛(共200μL)将转导的系带阴性细胞注射到每个麻醉受体小鼠。
- 辐照后,小鼠应被安置在消毒的笼子里,并提供柔软的饮食和饮用水,并辅以抗生素14d。
- 在骨髓移植后3-4周,分析外周血以检查转导供体细胞的移植情况(第4节)。
4. 评估外周血的嗜血性
- 用5%的等值鲁兰麻醉小鼠,并使用毛细管从逆轨静脉获得血液样本,并将其收集到K2EDTA管中(一个毛细管的体积足以进行以下测定)。
- 将 20 μL 的血液从 K2EDTA 管转移到 5 mL 圆形底部聚苯乙烯试管中,并放入冰上。
- 加入1.5 mL的RBC酶液缓冲液,以脂质红血球。在冰上孵育5分钟。
- 要中和莱沙缓冲液,请用FACS缓冲液(1.5 mL/样品)清洗样品。
- 在 4°C 下以 609 x g的r 最大值离心 5 分钟。丢弃上清液。
- 在黑暗中用单克隆抗体(在100μL FACS缓冲液/样品中稀释)在RT孵育细胞20分钟。上述材料部分提供了完整的抗体列表。
- 使用 FACS 缓冲液(2 mL/样品)清洗细胞一次。在 r 最大值(1,800 rpm)下以 609 x g离心 5 分钟,在 4°C 下。完全丢弃上清液。
- 在4°C下用含甲醛(100 μL/管)固定细胞10分钟。
- 使用 FACS 缓冲液(3 mL/样品)清洗细胞一次。在 r 最大值(1,800 rpm)下以 609 x g离心 5 分钟,在 4°C 下。完全丢弃上清液。
- 将颗粒悬浮在 400 μL 的 FACS 缓冲液中。
- 将样品保持在4°C,直到通过流式细胞测定分析。
结果
使用上述协议,每只小鼠获得大约0.8-1.0 x 108个骨髓细胞。我们获得的系系阴性细胞数量约为每只鼠标3 x 106个细胞。通常,骨髓系阴性细胞的产量是骨髓核细胞总数的4%-5%。
转导细胞(RFP阳性)的奇血性通过外周血的流式细胞测定(图2A,B)。血液从逆轨静脉中分离出来,并采用适当的标记来确定每个造血细胞群(即嗜中性粒细胞、单核细胞、T细胞等)的身份。(图3A,B)。基因组DNA可以从RFP阳性血细胞中分离出来,目标位点DNA的片段可以通过PCR扩增,并分克隆到TA克隆载体中进行序列分析。这些质粒被转导成大肠杆菌,目标位点序列通过桑格测序确定(图4)。或者,目标位点序列可以通过其他方法确定,例如Sanger测序的池基因组,然后通过分解(TIDE)分析10跟踪indels。对于控制条件,小鼠通常移植与表达非靶向引导RNA的慢病毒转导的细胞。
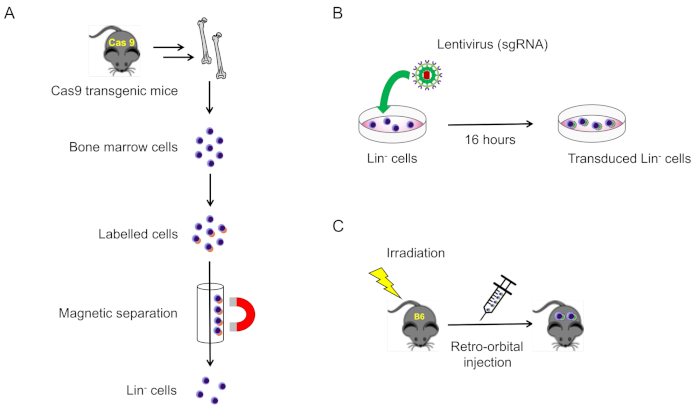
图1:本协议图解说明.(A)从Cas9表达小鼠中分离系带阴性骨髓细胞(第2.1节)。(B)系状阴性细胞的Lenti病毒转导(第2.2节)。(C)将转导细胞的逆轨注入致命辐照的野生型小鼠(第3节)。请点击此处查看此图的较大版本。
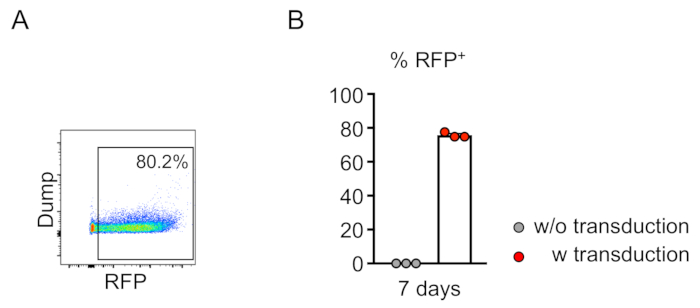
图2:小鼠骨髓系阴性细胞在体外的有效慢病毒转导。(A)流式细胞学分析表明,系型阴性细胞的转导成功。分析是在7天的体外培养后进行的。(B)平均而言,75.7%的细胞在本次测定中转导(n = 3)。请点击此处查看此图的较大版本。
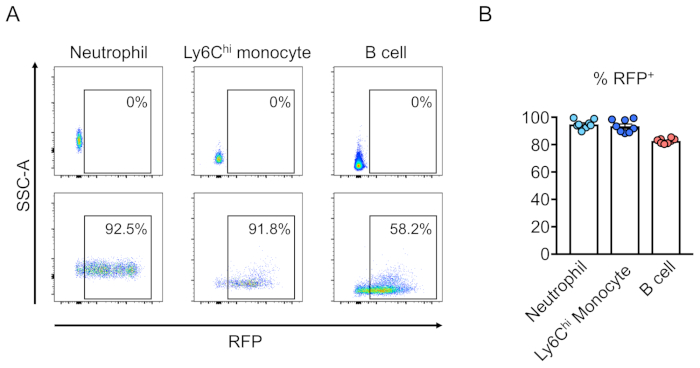
图3:通过转导的系带阴性细胞重组致命辐照小鼠骨髓。(A)小鼠外周血的流动细胞测定分析,在造血干细胞重组后,这些造血干细胞是(底部)或非(顶部)转导与表达RFP的慢病毒。嗜中性粒细胞被定义为Ly6G+和Ly6CHi单核细胞为Ly6G-和Ly6C+,B细胞定义为CD45R+。(B)在这些测定中,平均94.8%、93.5%和82.7%的细胞是RFP——在嗜中性粒细胞、Ly6CHi单细胞和B细胞群中分别为RFP(n = 8)。请点击此处查看此图的较大版本。
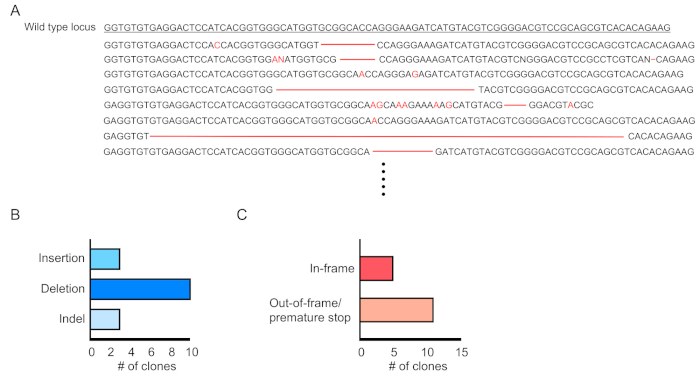
图4:转导血细胞基因编辑评价。(A)基因编辑示例,显示RPF阳性血细胞中突变的Dnmt3a位点的测序结果。删除显示为红色破折号,插入用红色字母表示。(B)检测到的突变摘要。(C) 69%(11/16个克隆)显示帧外/过早停止突变。请点击此处查看此图的较大版本。
| 质 粒 | 尺寸(bp) | 每口井的量(μg) | 比 |
| pLKO5.0 | 7700 | 0.9 | 2 |
| 普斯帕克2 | 10668 | 0.6 | 1 |
| pMD2.G | 5822 | 0.3 | 1 |
| PEI-max (库存: 100 毫克/升) | 5 μL/井 | ||
表1:用于转染的质粒和PEI-max量。
讨论
与传统的小鼠转基因方法相比,该协议的优点是以快速且高成本效益的方式创建动物模型,以快速且极具成本效益的方式在造血细胞中预感特定突变。结果发现,这种方法使小鼠在1个月内进行造血细胞基因操作。此协议中有几个关键步骤需要进一步考虑。
gRNA序列的筛选
建议在体外测试gRNA,以评估在体内实验前的编辑效率。使用无细胞体外转录和筛选系统测试gRNA的效率。转录的gRNA通过测量其在重组Cas9蛋白存在的情况下,使用阿加糖凝胶电泳测定在模板DNA的分块效率进行验证。商业上可用的套件可用于此目的。
在这里,indel突变的特点是从编辑区域扩增的PCR产物的TA克隆,用这些质粒转化细菌细胞,并拾取单个菌落进行桑格测序。但是,此方法既费时又费时。或者,下一代测序(NGS)或集合DNA测序,然后TIDE分析可以执行19。TIDE 算法的创建是为了分析从复杂样本生成的 Sanger 序列跟踪。已经表明,TIDE的indel估计值通常与那些偏离目标的NGS20一致。分析软件可在 上在线获取。
高蒂特慢病毒颗粒的生成
病毒性眼口腔炎病毒G蛋白是细胞感染所必需的,对pH敏感。因此,将培养基培养基保持在可接受的pH范围内非常重要,并且不应出现黄色外观。使用胶原蛋白涂层的病毒生成皿,因为它加速了HEK293T细胞的附着,并允许在几个小时内进行转染,而不是一夜之间等待。然而,根据实验时间表,隔夜孵化也可以考虑。
扁豆病毒颗粒的纯化
为了实现造血干细胞的有效转导,必须生成高提尔慢病毒。离心速度的优化是一个关键特征。虽然扁豆病毒的浓度通常在90,000 x g执行,但一些报告显示,如果以20,000 x g18的较低速度离心,病毒的恢复就会增加。生产高蒂特扁豆病毒制剂,无超离心剂也建议17。应该注意的是,重要的是暂停病毒离心颗粒,同时避免剧烈移液,以尽量减少曝气,保持病毒的完整性。高提尔慢病毒颗粒是血细胞干细胞有效转导所需的11。试验实验表明,在转导效率和细胞存活方面,MOI为100是最佳的。建议根据细胞活力和转导效率对扁豆病毒种群进行评估。
扁豆病毒颗粒的储存
慢病毒定度对温度高度敏感,由于储存条件不当和反复的冷冻-解冻周期,可大幅减少该度。研究发现,当储存在4°C[t(1/2)]=1.3天或受多次冻融周期[t(1/2)= 1.1发]时,扁豆病毒的转导效率会迅速降低。建议在病毒颗粒悬浮后不久,将病毒制剂在液氮或粉碎的干冰中快速冷冻。病毒储存应维持在-80°C,并在冰上解冻至RT,只需事先平衡并使用11。
应注意几个潜在的限制。首先,CRISPR/Cas9引入脱靶位印体突变一直受到人们早就赞赏。还表明CRISPR/Cas9可以诱导体内21的脱靶突变。在实践中,通过使用与目标基因组位点紧密匹配且与预测二次位点有四个以上不匹配的 gRNA 序列可以避免脱靶内突变。这种设计可以与现有的硅胶工具22完成。提供其他计算工具,以最小化非目标操作来预测 gRNA(或)。使用两个或两个以上不同的 gRNA 分析动物模型,以确认表型并尽可能减少观察到的表型由特定 gRNA 的离目标效应介导的可能性,可能也是有益的。
除了由CRISPR/Cas9创建的常规印德尔突变外,还报告了超出千碱基的较大缺失。这可能混淆研究;然而,这些较大的删除报告是低得多的频率相比,indels23。另一个潜在的问题是遗传补偿。据报道,具有早期终止密码素(PTC)的突变RNA可以通过COMPASS复杂介导的转录活化24、25,导致序列相似性的相关基因的调节。这一事件被建议是一种机制,可以导致基因消融的敲除和敲除方法之间的异型差异。由于CRISPR/Cas9介导的基因组编辑严重依赖随机引入帧移突变,导致PTC的产生,基因补偿可以修改表型。为了避免基因补偿,可以考虑使用CAS9作为RNA引导DNA识别平台的表观遗传修饰剂来考虑由CRISPR/Cas9靶向基因的调控序列的实验。
最后,应该承认,从移植到致命辐照小鼠的细胞的造血物可能不同于造血的本地条件。此外,辐照可能对生物体产生系统性影响,这可能混淆了研究造血细胞基因突变后果的实验解释。
研究人员利用催化性不活性Cas9(dCas9)蛋白质作为"RNA引导DNA识别平台",并使用dCas9融合蛋白将效应器域本地化为特定的DNA序列,以抑制(CRISPRi)或激活(CRISPRa)转录偏离目标的基因26,27。虽然该协议使用催化活性Cas9转基因小鼠在基因组DNA序列中引入dsDNA裂解,但表观遗传修饰以抑制或激活特定基因,通过将dCas9与染色质修饰剂域(如dCas9-KRAB 或 dCas9-VP64。或者,dCas9可以用作转录抑制器作为自己的,通过阻止转录机制访问基因位点27。最近,周等人建立了dCas9-SunTag-p65-HSF1(SPH)转基因小鼠,表达与dCas9融合的表观遗传活化剂的改良版本,并表明这种CRISPRa系统在体内功能正常。
我们的实验室主要使用这项技术来研究克隆血造血在心血管疾病过程中的作用。在增殖组织中,癌症驱动基因的体细胞突变可以赋予细胞生长优势,并导致异常的克隆扩张。在造血系统中,这个过程被称为"克隆造血症",它导致一个个体的白细胞的很大一部分被突变克隆所取代的情况。人们越来越认识到,异常的克隆扩张加速心血管疾病,如动脉粥样硬化和心力衰竭,并造成发病率和全因死亡率15,29。
最近,这些躯体突变和心血管疾病之间的因果关系已被记录在案,并且基本机制的各个方面已被阐明10,13,14。然而,这些体细胞突变可能代表"冰山一角",因为流行病学研究表明,许多额外的候选基因与克隆血吸血有关,并可能增加心血管疾病死亡率。因此,需要对克隆血脂驱动基因进行系统、更高的通量评估。目前对克隆血肿和心血管疾病因果联系的研究是基于对血泊系统特异性条件转基因小鼠(Mx1-Cre、Vav-Cre等)或骨髓移植后小鼠的分析。然而,这些策略需要建立新的小鼠群落,并可能成为研究人员的财政和物质负担。因此,与过去采用的传统鼠/敲除方法相比,有必要采用一种更便宜、更快速的方法。如本手稿所述,用于转导HSPC和CRISPR技术以设计突变的Lentiviral载体有助于克隆血肿和心血管疾病的研究。
除了产生传统的敲除位点外,该方法还适用于截断突变蛋白的产生。例如,研究人员已经成功地产生了血肿-Ppm1d截断,这是经常见于克隆血型患者,通过引入框架移位突变与gRNA靶向外大子6的Ppm1d基因30。
披露声明
作者没有什么可透露的。
致谢
S.S.得到了美国心脏协会博士后奖学金17POST33670076的支持。K. W. 得到 NIH 授予 R01 HL138014、R01 HL141256 和 R01 HL139819 的支持。
材料
| Name | Company | Catalog Number | Comments |
| RPMI Medium 1640 (1X) | Gibco | 11875-093 | Medium |
| Sulfamethoxazole and Trimethoprim injection | TEVA | 0703-9526-01 | |
| 1/2 cc LO-DOSE INSULIN SYRINGE | EXELINT | 26028 | general supply |
| 293T cells | ATCC | CRL-3216-- | Cell line |
| APC-anti-mouse Ly6C (Clone AL-21) | BD Biosciences | 560599 | Antibodies |
| APC-Cy7-anti-mouse CD45R (RA3-6B2) | BD Biosciences | 552094 | Antibodies |
| BD Luer-Lok disposable syringes, 10 ml | BD | 309604 | general supply |
| BD Microtainer blood collection tubes, K2EDTA added | BD Bioscience | 365974 | general supply |
| BD Precisionglide needle, 18 G | BD | 305195 | general supply |
| BD Precisionglide needle, 22 G | BD | 305155 | general supply |
| BV510-anti-mouse CD8a (Clone 53-6.7) | Biolegend | 100752 | Antibodies |
| BV711-anti-mouse CD3e (Clone 145-2C11) | Biolegend | 100349 | Antibodies |
| Collagen from calf skin | Sigma-Aldrich | 9007-34-5 | general supply |
| Corning Costar Ultra-Low Attachment Multiple Well Plate, 6 well | Millipore Sigma | CLS3471 | general supply |
| CRISPR/Cas9 knock-in mice | The Jackson Laboratory | 028555 | mouse |
| DietGel 76A | Clear H2O | 70-01-5022 | general supply |
| Dulbecco’s Modified Eagle’s Medium (DMEM) - high glucose | Sigma Aldrich | D6429 | Medium |
| eBioscience 1X RBC Lysis Buffer | Thermo fisher Scientific | 00-4333-57 | Solution |
| Falcon 100 mm TC-Treated Cell Culture Dish | Life Sciences | 353003 | general supply |
| Falcon 5 mL round bottom polystyrene test tube | Life Sciences | 352054 | general supply |
| Falcon 50 mL Conical Centrifuge Tubes | Fisher Scientific | 352098 | general supply |
| Falcon 6 Well Clear Flat Bottom TC-Treated Multiwell Cell Culture Plate | Life Science | 353046 | general supply |
| Fisherbrand microhematocrit capillary tubes | Thermo Fisher Scientific | 22-362566 | general supply |
| Fisherbrand sterile cell strainers, 70 μm | Fisher Scientific | 22363548 | general supply |
| FITC-anti-mouse CD4 (Clone RM4-5) | Invitrogen | 11-0042-85 | Antibodies |
| Fixation Buffer | BD Bioscience | 554655 | Solution |
| Guide-it Compete sgRNA Screening Systems | Clontech | 632636 | Kit |
| Isothesia (Isoflurane) solution | Henry Schein | 29404 | Solution |
| Lenti-X qRT-PCR Titration Kit | Takara | 631235 | Kit |
| Lineage Cell Depletion Kit, mouse | Miltenyi Biotec | 130-090-858 | Kit |
| Millex-HV Syringe Filter Unit, 0.45 mm | Millipore Sigma | SLHV004SL | general supply |
| PBS pH7.4 (1X) | Gibco | 10010023 | Solution |
| PE-Cy7-anti-mouse CD115 (Clone AFS98) | eBioscience | 25-1152-82 | Antibodies |
| PEI MAX | Polysciences | 24765-1 | Solution |
| Penicillin-Streptomycin Mixture | Lonza | 17-602F | Solution |
| PerCP-Cy5.5-anti-mouse Ly6G (Clone 1A8) | BD Biosciences | 560602 | Antibodies |
| pLKO5.sgRNA.EFS.tRFP | Addgene | 57823 | Plasmid |
| pMG2D | Addgene | 12259 | Plasmid |
| Polybrene Infection/Transfection Reagent | Sigma Aldrich | TR-1003-G | Solution |
| Polypropylene Centrifuge Tubes | BECKMAN COULTER | 326823 | general supply |
| psPAX2 | Addgene | 12260 | Plasmid |
| RadDisk – Rodent Irradiator Disk | Braintree Scientific | IRD-P M | general supply |
| Recombinant Murine SCF | Peprotech | 250-03 | Solution |
| Recombinant Murine TPO | Peprotech | 315-14 | Solution |
| StemSpan SFEM | STEMCELL Technologies | 09600 | Solution |
| TOPO TA cloning kit for sequencing with One Shot TOP10 Chemically Competent E.coli | Thermo fisher Scientific | K457501 | Kit |
| Zombie Aqua Fixable Viability Kit | BioLegend | 423102 | Solution |
参考文献
- Sasaki, Y., et al. Defective immune responses in mice lacking LUBAC-mediated linear ubiquitination in B cells. EMBO Journal. 32, 2463-2476 (2013).
- Ogilvy, S., et al. Transcriptional regulation of vav, a gene expressed throughout the hematopoietic compartment. Blood. 91, 419-430 (1998).
- Meyer, S. E., et al. DNMT3A Haploinsufficiency Transforms FLT3ITD Myeloproliferative Disease into a Rapid, Spontaneous, and Fully Penetrant Acute Myeloid Leukemia. Cancer Discovery. 6, 501-515 (2016).
- Kuhn, R., Schwenk, F., Aguet, M., Rajewsky, K. Inducible gene targeting in mice. Science. 269, 1427-1429 (1995).
- Cole, C. B., et al. PML-RARA requires DNA methyltransferase 3A to initiate acute promyelocytic leukemia. Journal of Clinical Investigation. 126, 85-98 (2016).
- Yang, H., et al. One-step generation of mice carrying reporter and conditional alleles by CRISPR/Cas-mediated genome engineering. Cell. 154, 1370-1379 (2013).
- Wang, H., et al. One-step generation of mice carrying mutations in multiple genes by CRISPR/Cas-mediated genome engineering. Cell. 153, 910-918 (2013).
- Quadros, R. M., et al. Easi-CRISPR: a robust method for one-step generation of mice carrying conditional and insertion alleles using long ssDNA donors and CRISPR ribonucleoproteins. Genome Biology. 18, 92 (2017).
- Miura, H., Quadros, R. M., Gurumurthy, C. B., Ohtsuka, M. Easi-CRISPR for creating knock-in and conditional knock-out mouse models using long ssDNA donors. Nature Protocols. 13, 195-215 (2018).
- Sano, S., et al. CRISPR-Mediated Gene Editing to Assess the Roles of Tet2 and Dnmt3a in Clonal Hematopoiesis and Cardiovascular Disease. Circulation Research. 123, 335-341 (2018).
- Cante-Barrett, K., et al. Lentiviral gene transfer into human and murine hematopoietic stem cells: size matters. BMC Research Notes. 9 (312), (2016).
- Chu, V. T., et al. Efficient CRISPR-mediated mutagenesis in primary immune cells using CrispRGold and a C57BL/6 Cas9 transgenic mouse line. Proceedings of the National Academy of Sciences of the United States of America. 113, 12514-12519 (2016).
- Fuster, J. J., et al. Clonal hematopoiesis associated with TET2 deficiency accelerates atherosclerosis development in mice. Science. 355, 842-847 (2017).
- Sano, S., et al. Tet2-Mediated Clonal Hematopoiesis Accelerates Heart Failure Through a Mechanism Involving the IL-1beta/NLRP3 Inflammasome. Journal of the American College of Cardiology. 71, 875-886 (2018).
- Sano, S., Wang, Y., Walsh, K. Clonal Hematopoiesis and Its Impact on Cardiovascular Disease. Circulatory Journal. 71, 875-886 (2018).
- Heckl, D., et al. Generation of mouse models of myeloid malignancy with combinatorial genetic lesions using CRISPR-Cas9 genome editing. Nature Biotechnology. 32, 941-946 (2014).
- Jiang, W., et al. An optimized method for high-titer lentivirus preparations without ultracentrifugation. Scientific Reports. 5, 13875 (2015).
- Cribbs, A. P., Kennedy, A., Gregory, B., Brennan, F. M. Simplified production and concentration of lentiviral vectors to achieve high transduction in primary human T cells. BMC Biotechnology. 13, 98 (2013).
- Brinkman, E. K., Chen, T., Amendola, M., van Steensel, B. Easy quantitative assessment of genome editing by sequence trace decomposition. Nucleic Acids Research. 42, e168 (2014).
- Sentmanat, M. F., Peters, S. T., Florian, C. P., Connelly, J. P., Pruett-Miller, S. M. A Survey of Validation Strategies for CRISPR-Cas9 Editing. Scientific Reports. 8, 888 (2018).
- Akcakaya, P., et al. In vivo CRISPR editing with no detectable genome-wide off-target mutations. Nature. 561, 416-419 (2018).
- Bae, S., Park, J., Kim, J. S. Cas-OFFinder: a fast and versatile algorithm that searches for potential off-target sites of Cas9 RNA-guided endonucleases. Bioinformatics. 30, 1473-1475 (2014).
- Kosicki, M., Tomberg, K., Bradley, A. Repair of double-strand breaks induced by CRISPR-Cas9 leads to large deletions and complex rearrangements. Nature Biotechnology. 36, 765-771 (2018).
- El-Brolosy, M. A., et al. Genetic compensation triggered by mutant mRNA degradation. Nature. 568, 193-197 (2019).
- Ma, Z., et al. PTC-bearing mRNA elicits a genetic compensation response via Upf3a and COMPASS components. Nature. 568, 259-263 (2019).
- Gilbert, L. A., et al. CRISPR-mediated modular RNA-guided regulation of transcription in eukaryotes. Cell. 154, 442-451 (2013).
- Qi, L. S., et al. Repurposing CRISPR as an RNA-guided platform for sequence-specific control of gene expression. Cell. 152, 1173-1183 (2013).
- Zhou, H., et al. In vivo simultaneous transcriptional activation of multiple genes in the brain using CRISPR-dCas9-activator transgenic mice. Nature Neuroscience. 21, 440-446 (2018).
- Fuster, J. J., Walsh, K. Somatic Mutations and Clonal Hematopoiesis: Unexpected Potential New Drivers of Age-Related Cardiovascular Disease. Circulatory Research. 122, 523-532 (2018).
- Kahn, J. D., et al. PPM1D truncating mutations confer resistance to chemotherapy and sensitivity to PPM1D inhibition in hematopoietic cells. Blood. , (2018).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。