Method Article
疾患モデルにおける血化細胞の研究のためのレンチウイルスCRISPR/Cas9媒介ゲノム編集
要約
CRISPR/Cas9システムによるマウス造血幹細胞および前駆細胞(HSPC)の高効率ゲノム編集のためのプロトコルは、造血系特異的遺伝子改変を用いたマウスモデルシステムを迅速に開発する。
要約
従来のトランスジェネシスアプローチを使用して造血幹細胞の遺伝子を操作することは、時間がかかり、コストがかかり、困難な場合があります。ゲノム編集技術とレンチウイルス媒介トランスジーン送達システムの進歩の恩恵を受け、造血幹細胞で遺伝子が特異的に操作されるマウスを確立する効率的かつ経済的な方法がここに記載されています。レンチウイルスは、特定の遺伝子と赤色蛍光レポーター遺伝子(RFP)を標的とするガイドRNA(gRNA)を用いてCas9発現系統陰性骨髄細胞をトランスデュースするために使用され、次いでこれらの細胞を致死照照照射C57BL/6マウスに移植する。非標的gRNAを発現するレンチウイルスで移植されたマウスは、対照として使用される。トランスプリエド造血幹細胞の移植は、末梢血のRFP陽性白血病のフローサイトメトリック解析により評価される。この方法を用いて、移植後4週間でミエロイド細胞の約90%、リンパ球細胞の約70%のトランスダクションを達成することができる。ゲノムDNAはRFP陽性血液細胞から単離され、標的部位DNAの一部をPCRによって増幅してゲノム編集を検証します。このプロトコルは、血化調節遺伝子のハイスループット評価を提供し、血化細胞関与を有する様々なマウス疾患モデルに拡張することができる。
概要
血液学と免疫学の多くの研究は、Mx1-Cre、Vav-Creなどの血液系特異的なCreドライバを利用する従来および条件付きトランスジェニック/ノックアウトマウスを含む遺伝子組み換えマウスの利用可能性に依存しています。1,2,3,4,5.これらの戦略は、時間がかかり、財政的負担になる可能性があり、新しいマウス株の確立を必要とします。ゲノム編集技術の革命的な進歩は、適切な技術的専門知識6、7、8、9とわずか3〜4ヶ月で新しいマウス株の生成を可能にしました、実験を追求する前にマウスのコロニーを増幅するためにはるかに多くの時間が必要です。さらに、これらの手順はコストがかかります。例えば、ジャクソン研究所は、ノックアウトマウス生成サービスの現在の価格を1株当たり16,845ドル(2018年12月現在)でリストしています。したがって、従来のマウストランスジェニックアプローチよりも経済的かつ効率的な方法がより有利である。
クラスター化された定期的に間隔をあけた短いパリンドロミックリピート/CRISPR関連タンパク質9(CRISPR/Cas9)技術は、迅速かつ効率的なRNAベースの配列特異的ゲノム編集のための新しいツールの開発につながっています。もともと侵入病原体DNAを破壊する細菌適応免疫機構として発見されたCRISPR/Cas9システムは、真核細胞および動物モデルにおけるゲノム編集の有効性を高めるためのツールとして使用されてきた。CRISPR/Cas9機械を造血幹細胞(例えば、エレクトロポレーション、核産生、脂肪減少、ウイルス送達など)に送達するアプローチが数多く採用されています。
ここでは、Cas9発現マウス造血幹細胞に効果的に感染し、ガイドRNA発現構造、プロモーター、調節配列、およびコードする遺伝子を一緒にパッケージ化する能力のために細胞をトランスデュースするためにレンチウイルスシステムが採用されています。蛍光レポータータンパク質(すなわち、GFP、RFP)。この方法を用いて、マウス造血幹細胞のex vivo遺伝子編集が達成され、続いて致死的に照射されたマウス10における骨髄の再構成に成功した。本研究に用いられるレンチウイルスベクターは、レポーター遺伝子から上流に上流の内部リボソーム入口部位を持つ共通コアEF1aプロモーターからのCas9およびGFPレポーター遺伝子を発現する。ガイドRNA配列は、別個のU6プロモーターから発現される。このシステムは、次いで、候補クローン無毛症ドライバ遺伝子Tet2およびDnmt3a10における挿入および欠失変異を作成するために使用される。しかし、この方法による経流効率は比較的低い(~5%-10%)。伝達効率を制限し、生産中にウイルス力を減少させるベクター挿入物(13 Kbp)の大きさのために。
他の研究では、より大きなウイルスRNAサイズがウイルス産生とトランスダクション効率の両方に悪影響を及ぼすことが示されている。例えば、挿入サイズの1kbの増加は、ウイルス産生を〜50%減少させることが報告され、および経転移効率はマウス造血幹細胞11において50%以上に減少する。したがって、システムの効率を向上させるためにウイルスインサートのサイズを可能な限り小さくすることが有利である。
この欠点は、Cas9トランスジェニックマウスを採用することによって克服することができ、Cas9タンパク質は構成的または誘導可能な方法12のいずれかで発現される。構成的なCRISPR/Cas9ノックインマウスは、ローザ26遺伝子座のCAGプロモーターからCas9エンドヌクレアーゼおよびEGFPをユビキタスな方法で発現する。これにより、コアEF1aプロモーターの制御下にあるU6プロモーターおよびRFPレポーター遺伝子の制御下でsgRNAを用いて構築し、レンチウイルスベクターを用いてゲノム編集を達成することができる。このシステムにより、造血幹細胞の遺伝子の編集に成功し、約90%の経流効率を示しました。したがって、このプロトコルは、標的遺伝子変異が人工系に導入されるマウスを迅速かつ効果的に作成する方法を提供する。私たちの研究室は、主に心血管疾患プロセス13、14、15におけるクローンヘマチオピスの役割を研究するために、このタイプの技術を使用していますが、それはまた、血液学の研究に適用可能です悪性腫瘍16.さらに、このプロトコルは、HSPCにおけるDNA突然変異が、人工システムにおける他の疾患または発達過程にどのように影響するかの分析に拡張することができる。
堅牢なレンチウイルスベクターシステムを確立するためには、高価気力ウイルスストックと血行細胞の移植および移植のための最適化された条件が必要とされる。プロトコルでは、セクション1の高チテーターウイルスストックの調製に関する指示が提供され、セクション2におけるマウス造血幹細胞の培養条件を最適化し、セクション3における骨髄移植の方法、および評価を行う。セクション4の移植。
プロトコル
動物の被験者を含むすべての手順は、バージニア大学の機関動物ケアおよび使用委員会(IACUC)によって承認されています。
1. レンチウイルス粒子の生成と精製
注:最適化されたガイドRNAを含むレンチウイルス粒子は、Addgeneによって提供される詳細なプロトコルによって生成することができます: 。高チターレンチウイルスの調製および貯蔵のための最適化された方法は、他の場所で議論されています 17,18.簡単に言えば、レンチウイルスは、レンチウイルスベクタープラスミド、psPAX2、およびpMD2.GをHEK 293T細胞に共トランスフェクションすることによって産生される。培養上清は48時間後トランスフェクションで採取し、超遠心分離によって濃縮される。レンチウイルス力価は、市販のqPCRベースのアッセイによって決定される。この手順は、バイオセーフティクラスIIキャビネットで実行する必要があります。
- コラーゲンの1:200溶液を調作する(0.0005%)1x PBSで。
- 6ウェルプレートにコラーゲン溶液を塗り、37°C、5%CO2~30分間インキュベートします。
- 種子293T細胞をウェル当たり1x106細胞の密度で、37°C、5%CO2〜2hでインキュベートする。
- 3つのトランスフェクションプラスミドを1つのウェルに対して調製するには、レンチウイルスベクターの0.9 μg、psPAX2の0.6 μg、pMD2.Gの0.3 μgを組み合わせ、脱イオン水を加えて10μLの総体積を達成します。井戸の数に応じて、それに応じて量を調整します。各プラスミドの量と比率は、研究者のニーズに合わせてさらに最適化する必要があります。.
- 希釈されたPEI MAX(1.0mg/mL)の1x PBSの50 μLと5μLをプラスミド混合物に慎重に加え、室温(RT)で15分間インキュベートします(表1)。
- 混合物にDMEMの1 mLを追加します。
- 6ウェルプレートから吸引培地を、プラスミド混合物の1mLを加え、37°C、5%CO2〜3時間でインキュベートする。
- 新鮮なDMEMの2 mLでメディアを交換し、37 °C、24時間のCO25%でインキュベートします。
- 新鮮なDMEMを1mL加え、37°Cでインキュベートし、さらに24時間(合計インキュベーション時間は48時間)の場合は5%CO2をインキュベートします。
- 培養上清を50mLチューブに移し、遠心分離機を3,000 x gで15分間移し、自由浮動細胞を除去します。
- 0.45 μm フィルターを通して上清をフィルター処理します。
- 濾液をポリプロピレン遠心管に移します。
- 4 °Cおよび72,100 x gのr最高で3時間の超遠心分離機。
- 慎重に上清を吸引し、白いペレットの後ろに残します。
- 無血清無血質細胞膨張培地の100μLを通気なしでペレットを再中断する。
- 10 μLのアリコートを保持してウイルスの定量を測定し、必要になるまで-80 °Cで残りのアリコートをすべて保存します。
- 10 μLウイルスアリコートを使用して、製造元の指示に従ってqPCRベースのアッセイでウイルスを刺激します。
2. マウス骨髄からの系統陰性細胞の単離と伝達 (図1A)
注:通常、十分な細胞を単離するために、脛骨、大腿骨、およびフエリのペアは、各マウスから収穫される。骨盤および脊柱の骨はまた系統陰性細胞の源として収穫されてもよい。
- 骨髄細胞の分離
- 8-10週齢の雄CRISPR/Cas9ノックインマウスを5%イソフランで安楽死させ、続いて子宮頸部脱臼を行い、70%のエタノールで皮膚を消毒する。
- 解剖はさみを使用して、胸部のすぐ下の皮膚に横切開を行い、脚と腕を露出させるために両方向に皮膚を遠離して剥離します。
- 股関節を脱臼して下肢を股関節から慎重に分離します。大腿骨の頭部に沿って切断し、股関節から大腿骨を完全に取り除きます。膝を外し、骨のエピフィシスをそのままにしながら、大腿骨と脛骨を分離するために関節で切断します。足首関節を外し、足と余分な筋肉を剥離します。
- 解剖はさみを使用して、上肢を切り離すために肩の上にカットします。肩を外し、肘関節で切断して骨を採取する。
- セルロース繊維ワイプを使用して、大腿骨、脛骨、フセリから筋肉を慎重に除去します。このプロセス中に骨が壊れないように特別な予防措置を講じてください。
- 分離した骨をRPMIを含む50mLの円錐形チューブに入れ、氷の上に置きます。
注:バイオセーフティクラスIIキャビネットでは、以下の手順を実行する必要があります。 - 無菌の100mm培養皿に骨を移します。
- 鈍い鉗子で骨をつかみ、解剖はさみを使用して、慎重に両方のエピフィスをカットします。
注:切断が不十分になると骨髄のフラッシュが不完全になりますが、過度に積極的な切断は細胞喪失につながります。 - 10 mL注射器を氷冷RPMIで充填し、22Gの針を使用して、シャフトから骨髄を新しい100mm培養皿に洗い流します。
注: ボーン シャフトが十分にフラッシュされている場合、ボーンは白く半透明になります。そうでない場合は、骨の端部を再切断し、再びフラッシュします。 - すべての骨髄が収集された後、18 G針で10 mL注射器を通して骨髄を数回通過させることによって単細胞懸濁液を作る。10x を繰り返して、単一セルの懸濁液を確保します。
- 70 μmの細胞ストレーナーを通して50 mL円錐管に細胞懸濁液をフィルターする。
- 4 °Cで10分のための310 x gの遠心分離機。
- 上清を吸引し、次の細胞分離プロセスに最適化された分離バッファーの適切なボリュームで細胞ペレットを再中断します。
- 系統陰性細胞の単離とレンチウイルスの伝導
注:マウス系統陰性細胞は、Cas9トランスジェニックマウス3、またはマウスの他の株の骨髄から単離され、製造業者の指示に従って系統枯渇キットを使用する。典型的には、系統陰性細胞は骨髄核細胞全体の2%~5%を占め、純度は通常、単離後の90%を超える。単離された系統陰性細胞は、20 ng/mL組換えマウスTPOおよび50 ng/mL組換えマウスSCFを補充した無血清無血性血化細胞拡張培地で培養され、その後、多重性で16時間レンチウイルスベクターでトランスメアリングされる。感染 (MOI) = 100。- 系統陰性細胞を単離するには、製造元の指示に従って系統細胞枯渇キットを使用してください。
- 単離後、血清フリー血統細胞膨張培地の1mLで系統陰性細胞を再中断した。
- 1.5 x 106細胞/mL(5 x 105系統陰性細胞/マウス)の密度で6ウェルプレートに細胞をシードします。
- 組換えマウス TPO と SCF をそれぞれ 20 ng/mL および 50 ng/mL の最終濃度でウェルに追加します。
- 37°Cで細胞を5%CO2~2hの予備インキュベートする。
- MOI=100、4 μg/mLポリブレン、ペニシリン/ストレプトマイシンをウェルに加え、37°Cでインキュベートし、16-20h(図1B)に5%CO2を加えます。
- 翌日、レンチウイルス変換細胞を15mL円錐管に集め、遠心分離機を300gで10分間集める。
- 上清を注意深く吸引し、マウス当たり200μLのRPMIでペレットを再中断します。マウスに移植されるまでRTで細胞を保つ(セクション3)。
3. 細胞を照射したマウスへの移植
- 骨髄移植の日に、レシピエントマウスを8スライスパイケージに入れ、全身照射(550 Rad/dose、総用量=1100 Rad)の2回の投与量にさらし、各照射セッションの間に約4時間を投与する。
- 2回目の照射セッションの後、インスリン注射器を用いてレトロ軌道静脈神経叢(合計200μL)を介して各麻酔レシピエントマウスに系統陰性細胞を注入する(図1C)。
- 照射後、マウスは殺菌ケージに収容され、14dの抗生物質を補充した柔らかい食事と飲料水を提供する必要があります。
- 骨髄移植後3~4週間で末梢血を分析し、トランスメーションドナー細胞の生着を確認する(セクション4)。
4. 末梢血のキメラを評価する
- 5%イソファルランでマウスを麻酔し、毛細管を用いてレトロ軌道静脈から血液サンプルを採取し、K2EDTAチューブに集める(1つの毛細管内の体積は、以下のアッセイに対して十分である)。
- K2EDTAチューブから20μLの血液を5mL丸底ポリスチレン試験管に移し、氷の上に置きます。
- 赤血球をlyseするためにRBCリシスバッファーの1.5 mLを追加します。氷の上で5分間インキュベートします。
- ライシスバッファーを中和するには、FACSバッファー(1.5 mL/サンプル)でサンプルを洗浄します。
- 4 °Cで5分間rの最高で609 x gの遠心分離機。上清を捨てます。
- モノクローナル抗体のカクテルで細胞をインキュベート(100 μL FACSバッファー/サンプルで希釈)を暗闇の中で20分間RTでインキュベートします。抗体の完全なリストは、上記の材料セクションで提供されています。
- FACSバッファ(2 mL/サンプル)で細胞を1回洗浄します。609 x gの r最大(1,800 rpm) で、4 °C で 5 分間遠心分離機。上清を完全に廃棄します。
- 4°Cで10分間、固定バッファー(100μL/チューブ)を含むパラホルムアルデヒドで細胞を固定します。
- FACSバッファー(3 mL/サンプル)で細胞を1回洗浄します。609 x gの r最大(1,800 rpm) で、4 °C で 5 分間遠心分離機。上清を完全に廃棄します。
- FACSバッファーの400 μLでペレットを中断します。
- フローサイトメトリーによる分析まで4°Cでサンプルを保管してください。
結果
上記のプロトコルを用いて、マウス当たり約0.8〜1.0 x 108個の骨髄細胞が得られた。我々が得る系統陰性細胞の数は、マウスあたり約3 x 106細胞である。典型的には、骨髄系統陰性細胞の収率は、全骨髄核細胞の4%〜5%である。
トランスメ因細胞のキメラ(RFP陽性)は、末梢血の流れサイトメトリーによって評価される(図2A、B)。血液は、レトロ軌道静脈から単離され、適切なマーカーは、各血統細胞集団(すなわち、好中球、単球、T細胞など)のアイデンティティを決定するために使用されます。(図3A、B)。ゲノムDNAはRFP陽性血液細胞から単離することができ、標的部位DNAの切片をPCRで増幅し、配列分析のためにTAクローニングベクターにサブクローニングすることができます。これらのプラスミドは大腸菌に移圧され、標的部位配列はサンガー配列決定によって決定される(図4)。あるいは、標的部位配列は、プールされたゲノムのサンガーシーケンシングなどの他の方法によって決定することができ、続いて分解(TIDE)分析10によるインデルの追跡を行う。対照条件について、マウスは典型的に、非標的誘導RNAを発現するレンチウイルスで移植される細胞で移植される。
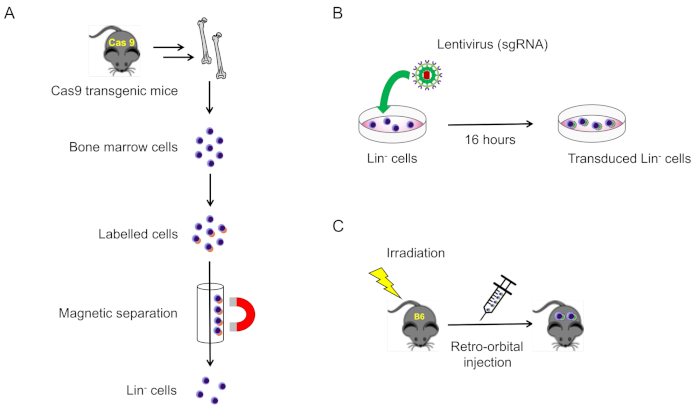
図1:このプロトコルの概略図.(A)Cas9発現マウスからの系統陰性骨髄細胞の単離(セクション2.1)。(B)系統陰性細胞のレンチウイルス伝達(セクション2.2)。(C)細胞を無死照射野生型マウスに対するレトロ軌道注入(セクション3)。この図のより大きなバージョンを表示するには、ここをクリックしてください。
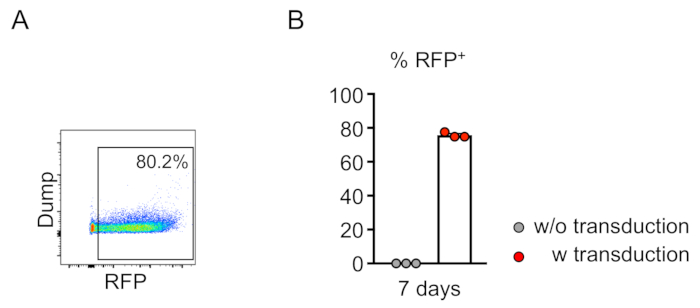
図2:インビトロにおけるマウス骨髄系統陰性細胞の効率的なレンチウイルス伝達。(A)フローサイトメトリー解析は、系統陰性細胞の伝達に成功することを明らかにする。分析は、インビトロ培養の7日後に行った。(B)平均して、このアッセイで75.7%の細胞を移植した(n=3)。この図のより大きなバージョンを表示するには、ここをクリックしてください。
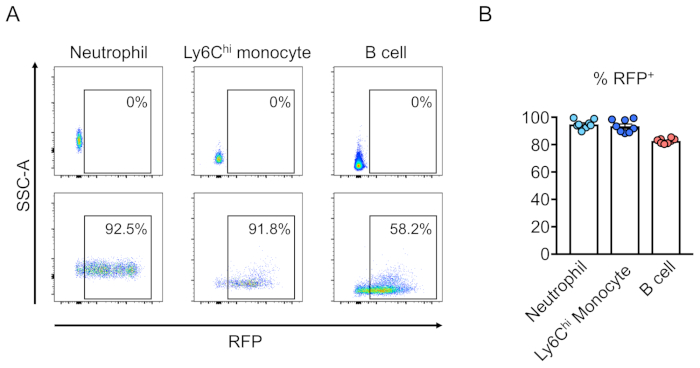
図3:系統陰性細胞の移植による致死照照性マウス骨髄の再構成。(A)造血幹細胞による再構成後のマウス末梢血のフローサイトメトリー分析(下)またはRFPを発現するレンチウイルスで(上)を経子に換移しなかった。好中球は、Ly6G+およびLy6Cハイ単球としてLy6G-およびLy6C+、およびCd45R+としてB細胞として定義される。(B)これらのアッセイでは、平均94.8%、93.5%、および82.7%の細胞が好中球、Ly6Cハイ単球、およびB細胞集団においてそれぞれRFP+である(n=8)。この図のより大きなバージョンを表示するには、ここをクリックしてください。
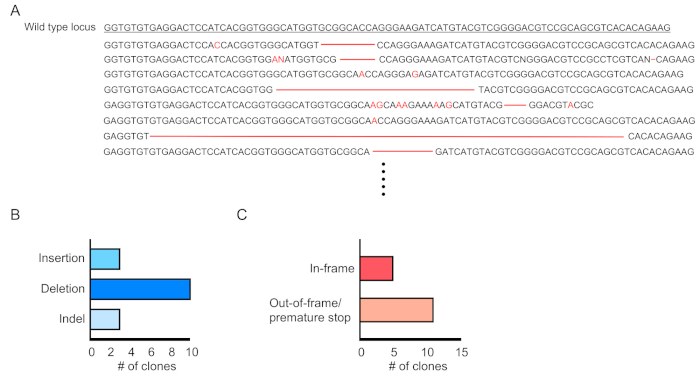
図4:トランスネジン血球における遺伝子編集の評価(A)RPF陽性血液細胞における変異Dnmt3a遺伝子座の配列決定結果を示す遺伝子編集の例。削除は赤い破線で表示され、挿入は赤い文字で示されます。(B)検出された変異の概要。(C) 69%(11/16クローン)は、フレーム外/早期停止変異を示した。この図のより大きなバージョンを表示するには、ここをクリックしてください。
| プラスミッド | サイズ (bp) | 井戸当たりの量(μg) | 比 |
| pLKO5.0 | 7700 | 0.9 | 2 |
| psPAX2 | 10668 | 0.6 | 1 |
| pMD2.G | 5822 | 0.3 | 1 |
| PEI-max (在庫: 100 mg/mL) | 5 μL/ウェル | ||
表1:トランスフェクションに使用されるプラスミドおよびPEI-maxの量。
ディスカッション
このプロトコルの利点は、従来のマウストランスジェニックアプローチと比較して、迅速かつ非常に費用対効果の高い方法で血化細胞の特定の変異を収容する動物モデルの作成です。この方法論により、造血細胞遺伝子操作を1ヶ月以内にマウスの生成が可能となることがわかった。このプロトコルには、さらに検討が必要な重要な手順がいくつかあります。
gRNA配列のスクリーニング
生体内実験を行う前に編集効率を評価するために、インビトロでgRNAをテストすることをお勧めします。gRNAの効率は、無細胞インビトロ転写およびスクリーニングシステムを用いて試験される。転写されたgRNAは、アガロースゲル電気泳動を用いて、組換えCas9タンパク質の存在下でテンプレートDNAを切断する場合の効率を測定することによって検証される。市販のキットは、この目的のために利用可能です。
ここで、インデル変異は、編集された領域から増幅されたPCR産物のTAクローニング、それらのプラスミドで細菌細胞を形質転換し、サンガーシーケンシングのための個々のコロニーをピックアップすることによって特徴付けされる。ただし、この方法は手間がかかり、時間がかかります。あるいは、次世代シーケンシング(NGS)またはプールDNAシーケンシングに続いてTIDE解析を行うことができる19.TIDEアルゴリズムは、複雑なサンプルから生成されたサンガーシーケンストレースを分析するために作成されました。TIDEとのインデル推定値は、通常、ターゲット外のNGS20と一致していることが示されています。分析ソフトウェアは、オンラインで入手できます。;http://tide.nki.nl>。
高チターレンチウイルス粒子の生成
細胞感染に不可欠なウイルス小胞性内炎ウイルスGタンパク質は、非常にpH感受性である。したがって、培養培地を許容可能なpH範囲内に保つことが重要であり、黄色がかった外観を現するべきではない。ウイルス生成用のコラーゲンコーティングされた皿は、HEK293T細胞の付着を加速し、一晩待つのではなく、数時間以内にトランスフェクションの性能を可能にするので採用されています。しかし、実験スケジュールによっては、一晩のインキュベーションも考慮できる。
レンチウイルス粒子の精製
造血幹細胞の効率的な伝達を達成するためには、高価気力レンチウイルスを生成する必要があります。遠心分離速度の最適化は重要な機能です。レンチウイルスの濃度は通常90,000 x gで行われますが、材料が20,000 x g18の低速で遠心分離されるとウイルス回復が増加することを示す報告がいくつかあります。超遠心分離を行わずに高チテーターレンチウイルス製剤の製造も示唆されている17.気取りを最小限に抑え、ウイルスの完全性を維持するために活発なピペッティングを避けながら、ウイルス遠心ペレットを中断することが重要であることに留意すべきである。造血幹細胞11の効率的な伝達のために高力価レンチウイルス粒子が必要である。パイロット実験では、100のMOIが経流効率と細胞生存率に関して最適であることを明らかにしました。細胞の生存率と伝達効率に基づいてレンチウイルス株を評価することをお勧めします。
レンチウイルス粒子の貯蔵
レンチウイルス力価は温度に対して非常に敏感であり、不適切な貯蔵条件および繰り返される凍結融解周期によって力価を劇的に減らすことができる。レンチウイルスの経度効率は、4°C[t(1/2)=1.3日]または複数の凍結融解サイクルを行うと急速に低下することが分かっています[t(1/2)= 1.1ラウンド]。ウイルスの調製物は、ウイルスペレットが懸濁した直後に液体窒素中でスナップ冷凍または破砕ドライアイスであることがお勧めします。ウイルス株は-80°Cで維持され、ちょうど前の平衡化に氷の上で解凍し、11を使用する必要があります。
いくつかの潜在的な制限に注意する必要があります。第一に、CRISPR/Cas9によるオフターゲットインデル変異の導入は、長い間高く評価されてきました。また、CRISPR/Cas9が生体内21でオフターゲット変異を誘導できることも示されている。実際には、標的外のインデル変異は、標的ゲノム部位に密接に一致し、予測された二次部位に対して4つ以上のミスマッチを有するgRNA配列を使用することによって回避することができる。このような設計は、silicoツール22に既存で行うことができます。ターゲット外のアクションを最小限に抑えて gRNA を予測するその他の計算ツールも用意されています ( または )。また、2つ以上の異なるgRNAを用いて動物モデルを分析して表現型を確認し、観察された表現型が特定のgRNAのオフターゲット効果によって媒介される可能性を最小限に抑えることも有益である。
CRISPR/Cas9によって作成された従来のインデル変異に加えて、キロベースを超える大きな欠損が報告されています。これは研究を混乱させる可能性があります。しかし、これらの大きな欠損は、indels23に比べてはるかに低い頻度であると報告されています。もう一つの潜在的な問題は、遺伝的補償です。早期終了コドン(PTC)を有する変異型RNAは、COMPASS複合媒介活性化による配列類似性を有する関連遺伝子のアップレギュレーションをもたらし得る24,25と報告されている。この事象は、遺伝子アブレーションのノックアウトとノックダウンアプローチの間に意味的な違いにつながるメカニズムであることが示唆されている。CRISPR/Cas9媒介ゲノム編集は、PTCの生成につながるフレームシフト変異の確率的導入に大きく依存しているため、遺伝的補償は表現型を変更することができます。遺伝的補償を避けるために、遺伝子の調節配列がCRISPR/Cas9によって標的とされるか、またはRNA誘導DNA認識プラットフォームとしてCas9を使用するエピジェネティック修飾子の導入によって実験が考えられる。
最後に、致死的に照射されたマウスに移植された細胞からの血化症が、血化症のネイティブ条件と異なる可能性があることを認めるべきである。さらに、照射は生物に全身的な影響を及ぼし、造血細胞における遺伝子変異の結果を調べる実験の解釈を混乱させる可能性がある。
研究者は、触媒的に不活性なCas9(dCas9)タンパク質を「RNA誘導DNA認識プラットフォーム」として利用し、dCas9融合タンパク質を使用して、エフェクタードメインを特定のDNA配列に局在化させ(CRISPRi)または活性化(CRISPRa)。転写オフターゲット遺伝子26,27.このプロトコルは、ゲノムDNA配列にdsDNA切断を導入するために触媒活性Cas9トランスジェニックマウスを使用するが、特定の遺伝子を抑圧または活性化するためのエピジェネティック修飾は、dCas9をクロマチン修飾ドメインと融合することによって適用可能であるdCas9-KRAB または dCas9-VP64 がそれぞれ。あるいは、dCas9は、それ自身として転写リプレッサーとして使用することができ、遺伝子部位27にアクセスする転写機械を遮断することによって。さらに最近では、ZhouらはdCas9と融合したエピジェネティック活性化剤の改変バージョンを発現するdCas9-SunTag-p65-HSF1(SPH)トランスジェニックマウスを確立し、このCRISPRaシステムが生体内28で機能することを示した。
私たちの研究室は、主に心血管疾患プロセスにおけるクローンヘマチ症の役割を研究するために、この技術を使用しています。増殖組織では、癌ドライバ遺伝子の体細胞変異は、細胞増殖の利点を与え、異常なクローンの拡張につながる可能性があります。無毛系では、このプロセスは「クローン無菌症」として知られており、個々の白血病のかなりの部分が変異クローンに置き換えられる状況になります。異常なクローン拡張は、アテローム性動脈硬化症や心不全などの心血管疾患を加速し、罹患率および全原因死亡率15,29に寄与するという評価が高まっている。
最近、これらの体細胞変異と心血管疾患のいくつかとの因果関係が文書化され、基礎となるメカニズムの態様が10、13、14で解明されている。しかし、これらの体細胞変異はおそらく「氷山の先端」を表し、疫学研究は、多くの追加候補遺伝子がクローン性無毛症に関連し、潜在的に心血管疾患死亡率の増加に関連していることを示している。したがって、クローンヘマトポイシスドライバ遺伝子の系統的、より高いスループット評価が必要とされる。クローン血素症と心血管疾患の因果関係に関する現在の研究は、血化系特異的な条件トランスジェニック(Mx1-Cre、Vav-Creなど)または骨髄移植後のマウスの分析に基づいている。しかし、これらの戦略は、新しいマウスコロニーを確立する必要があり、研究者にとって財政的および物理的な負担になる可能性があります。したがって、従来のマウストランスジェニック/ノックアウトアプローチよりも安価で迅速な方法が保証される。この原稿に記載されているように、HSPCおよびCRISPR技術をトランスデュースするレンチウイルスベクターは、クローン血症および心血管疾患の研究を容易にする。
従来のノックアウト遺伝子座の生成に加えて、この方法は切り捨てられた変異タンパク質の産生に適用可能である。例えば、研究者は、Ppm1d遺伝子30のgRNA標的エキソン6を用いたフレームシフト変異を導入することにより、クローン造来患者によく見られる造来性Ppm1d切り捨てを生成することに成功した。
開示事項
著者は何も開示していない。
謝辞
S.S.は、アメリカ心臓協会のポスドク・フェローシップ17POST33670076によって支援されました。K. W. は、NIH 助成金 R01 HL138014、R01 HL141256、および R01 HL139819 によってサポートされました。
資料
| Name | Company | Catalog Number | Comments |
| RPMI Medium 1640 (1X) | Gibco | 11875-093 | Medium |
| Sulfamethoxazole and Trimethoprim injection | TEVA | 0703-9526-01 | |
| 1/2 cc LO-DOSE INSULIN SYRINGE | EXELINT | 26028 | general supply |
| 293T cells | ATCC | CRL-3216-- | Cell line |
| APC-anti-mouse Ly6C (Clone AL-21) | BD Biosciences | 560599 | Antibodies |
| APC-Cy7-anti-mouse CD45R (RA3-6B2) | BD Biosciences | 552094 | Antibodies |
| BD Luer-Lok disposable syringes, 10 ml | BD | 309604 | general supply |
| BD Microtainer blood collection tubes, K2EDTA added | BD Bioscience | 365974 | general supply |
| BD Precisionglide needle, 18 G | BD | 305195 | general supply |
| BD Precisionglide needle, 22 G | BD | 305155 | general supply |
| BV510-anti-mouse CD8a (Clone 53-6.7) | Biolegend | 100752 | Antibodies |
| BV711-anti-mouse CD3e (Clone 145-2C11) | Biolegend | 100349 | Antibodies |
| Collagen from calf skin | Sigma-Aldrich | 9007-34-5 | general supply |
| Corning Costar Ultra-Low Attachment Multiple Well Plate, 6 well | Millipore Sigma | CLS3471 | general supply |
| CRISPR/Cas9 knock-in mice | The Jackson Laboratory | 028555 | mouse |
| DietGel 76A | Clear H2O | 70-01-5022 | general supply |
| Dulbecco’s Modified Eagle’s Medium (DMEM) - high glucose | Sigma Aldrich | D6429 | Medium |
| eBioscience 1X RBC Lysis Buffer | Thermo fisher Scientific | 00-4333-57 | Solution |
| Falcon 100 mm TC-Treated Cell Culture Dish | Life Sciences | 353003 | general supply |
| Falcon 5 mL round bottom polystyrene test tube | Life Sciences | 352054 | general supply |
| Falcon 50 mL Conical Centrifuge Tubes | Fisher Scientific | 352098 | general supply |
| Falcon 6 Well Clear Flat Bottom TC-Treated Multiwell Cell Culture Plate | Life Science | 353046 | general supply |
| Fisherbrand microhematocrit capillary tubes | Thermo Fisher Scientific | 22-362566 | general supply |
| Fisherbrand sterile cell strainers, 70 μm | Fisher Scientific | 22363548 | general supply |
| FITC-anti-mouse CD4 (Clone RM4-5) | Invitrogen | 11-0042-85 | Antibodies |
| Fixation Buffer | BD Bioscience | 554655 | Solution |
| Guide-it Compete sgRNA Screening Systems | Clontech | 632636 | Kit |
| Isothesia (Isoflurane) solution | Henry Schein | 29404 | Solution |
| Lenti-X qRT-PCR Titration Kit | Takara | 631235 | Kit |
| Lineage Cell Depletion Kit, mouse | Miltenyi Biotec | 130-090-858 | Kit |
| Millex-HV Syringe Filter Unit, 0.45 mm | Millipore Sigma | SLHV004SL | general supply |
| PBS pH7.4 (1X) | Gibco | 10010023 | Solution |
| PE-Cy7-anti-mouse CD115 (Clone AFS98) | eBioscience | 25-1152-82 | Antibodies |
| PEI MAX | Polysciences | 24765-1 | Solution |
| Penicillin-Streptomycin Mixture | Lonza | 17-602F | Solution |
| PerCP-Cy5.5-anti-mouse Ly6G (Clone 1A8) | BD Biosciences | 560602 | Antibodies |
| pLKO5.sgRNA.EFS.tRFP | Addgene | 57823 | Plasmid |
| pMG2D | Addgene | 12259 | Plasmid |
| Polybrene Infection/Transfection Reagent | Sigma Aldrich | TR-1003-G | Solution |
| Polypropylene Centrifuge Tubes | BECKMAN COULTER | 326823 | general supply |
| psPAX2 | Addgene | 12260 | Plasmid |
| RadDisk – Rodent Irradiator Disk | Braintree Scientific | IRD-P M | general supply |
| Recombinant Murine SCF | Peprotech | 250-03 | Solution |
| Recombinant Murine TPO | Peprotech | 315-14 | Solution |
| StemSpan SFEM | STEMCELL Technologies | 09600 | Solution |
| TOPO TA cloning kit for sequencing with One Shot TOP10 Chemically Competent E.coli | Thermo fisher Scientific | K457501 | Kit |
| Zombie Aqua Fixable Viability Kit | BioLegend | 423102 | Solution |
参考文献
- Sasaki, Y., et al. Defective immune responses in mice lacking LUBAC-mediated linear ubiquitination in B cells. EMBO Journal. 32, 2463-2476 (2013).
- Ogilvy, S., et al. Transcriptional regulation of vav, a gene expressed throughout the hematopoietic compartment. Blood. 91, 419-430 (1998).
- Meyer, S. E., et al. DNMT3A Haploinsufficiency Transforms FLT3ITD Myeloproliferative Disease into a Rapid, Spontaneous, and Fully Penetrant Acute Myeloid Leukemia. Cancer Discovery. 6, 501-515 (2016).
- Kuhn, R., Schwenk, F., Aguet, M., Rajewsky, K. Inducible gene targeting in mice. Science. 269, 1427-1429 (1995).
- Cole, C. B., et al. PML-RARA requires DNA methyltransferase 3A to initiate acute promyelocytic leukemia. Journal of Clinical Investigation. 126, 85-98 (2016).
- Yang, H., et al. One-step generation of mice carrying reporter and conditional alleles by CRISPR/Cas-mediated genome engineering. Cell. 154, 1370-1379 (2013).
- Wang, H., et al. One-step generation of mice carrying mutations in multiple genes by CRISPR/Cas-mediated genome engineering. Cell. 153, 910-918 (2013).
- Quadros, R. M., et al. Easi-CRISPR: a robust method for one-step generation of mice carrying conditional and insertion alleles using long ssDNA donors and CRISPR ribonucleoproteins. Genome Biology. 18, 92 (2017).
- Miura, H., Quadros, R. M., Gurumurthy, C. B., Ohtsuka, M. Easi-CRISPR for creating knock-in and conditional knock-out mouse models using long ssDNA donors. Nature Protocols. 13, 195-215 (2018).
- Sano, S., et al. CRISPR-Mediated Gene Editing to Assess the Roles of Tet2 and Dnmt3a in Clonal Hematopoiesis and Cardiovascular Disease. Circulation Research. 123, 335-341 (2018).
- Cante-Barrett, K., et al. Lentiviral gene transfer into human and murine hematopoietic stem cells: size matters. BMC Research Notes. 9 (312), (2016).
- Chu, V. T., et al. Efficient CRISPR-mediated mutagenesis in primary immune cells using CrispRGold and a C57BL/6 Cas9 transgenic mouse line. Proceedings of the National Academy of Sciences of the United States of America. 113, 12514-12519 (2016).
- Fuster, J. J., et al. Clonal hematopoiesis associated with TET2 deficiency accelerates atherosclerosis development in mice. Science. 355, 842-847 (2017).
- Sano, S., et al. Tet2-Mediated Clonal Hematopoiesis Accelerates Heart Failure Through a Mechanism Involving the IL-1beta/NLRP3 Inflammasome. Journal of the American College of Cardiology. 71, 875-886 (2018).
- Sano, S., Wang, Y., Walsh, K. Clonal Hematopoiesis and Its Impact on Cardiovascular Disease. Circulatory Journal. 71, 875-886 (2018).
- Heckl, D., et al. Generation of mouse models of myeloid malignancy with combinatorial genetic lesions using CRISPR-Cas9 genome editing. Nature Biotechnology. 32, 941-946 (2014).
- Jiang, W., et al. An optimized method for high-titer lentivirus preparations without ultracentrifugation. Scientific Reports. 5, 13875 (2015).
- Cribbs, A. P., Kennedy, A., Gregory, B., Brennan, F. M. Simplified production and concentration of lentiviral vectors to achieve high transduction in primary human T cells. BMC Biotechnology. 13, 98 (2013).
- Brinkman, E. K., Chen, T., Amendola, M., van Steensel, B. Easy quantitative assessment of genome editing by sequence trace decomposition. Nucleic Acids Research. 42, e168 (2014).
- Sentmanat, M. F., Peters, S. T., Florian, C. P., Connelly, J. P., Pruett-Miller, S. M. A Survey of Validation Strategies for CRISPR-Cas9 Editing. Scientific Reports. 8, 888 (2018).
- Akcakaya, P., et al. In vivo CRISPR editing with no detectable genome-wide off-target mutations. Nature. 561, 416-419 (2018).
- Bae, S., Park, J., Kim, J. S. Cas-OFFinder: a fast and versatile algorithm that searches for potential off-target sites of Cas9 RNA-guided endonucleases. Bioinformatics. 30, 1473-1475 (2014).
- Kosicki, M., Tomberg, K., Bradley, A. Repair of double-strand breaks induced by CRISPR-Cas9 leads to large deletions and complex rearrangements. Nature Biotechnology. 36, 765-771 (2018).
- El-Brolosy, M. A., et al. Genetic compensation triggered by mutant mRNA degradation. Nature. 568, 193-197 (2019).
- Ma, Z., et al. PTC-bearing mRNA elicits a genetic compensation response via Upf3a and COMPASS components. Nature. 568, 259-263 (2019).
- Gilbert, L. A., et al. CRISPR-mediated modular RNA-guided regulation of transcription in eukaryotes. Cell. 154, 442-451 (2013).
- Qi, L. S., et al. Repurposing CRISPR as an RNA-guided platform for sequence-specific control of gene expression. Cell. 152, 1173-1183 (2013).
- Zhou, H., et al. In vivo simultaneous transcriptional activation of multiple genes in the brain using CRISPR-dCas9-activator transgenic mice. Nature Neuroscience. 21, 440-446 (2018).
- Fuster, J. J., Walsh, K. Somatic Mutations and Clonal Hematopoiesis: Unexpected Potential New Drivers of Age-Related Cardiovascular Disease. Circulatory Research. 122, 523-532 (2018).
- Kahn, J. D., et al. PPM1D truncating mutations confer resistance to chemotherapy and sensitivity to PPM1D inhibition in hematopoietic cells. Blood. , (2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved