Method Article
Edición del genoma mediado por CRISPR/Cas9 para el estudio de células hematopoyéticas en modelos de enfermedades
En este artículo
Resumen
Se describen protocolos para la edición del genoma altamente eficiente de células madre hematopoyéticas murinas (HSPC) por el sistema CRISPR/Cas9 para desarrollar rápidamente sistemas de modelos de ratón con modificaciones genéticas específicas del sistema hematopoyético.
Resumen
Manipular genes en células madre hematopoyéticas utilizando enfoques de transgénesis convencionales puede llevar mucho tiempo, ser costoso y desafiante. Beneficiándose de los avances en la tecnología de edición del genoma y los sistemas de administración de transgenes mediados por lentivirus, aquí se describe un método eficiente y económico que establece ratones en los que los genes se manipulan específicamente en células madre hematopoyéticas. Los lentivirus se utilizan para transducir células de médula ósea negativas al linaje Cas9 con un ARN guía (GRNA) dirigido a genes específicos y un gen reportero de fluorescencia roja (RFP), luego estas células se trasplantan en ratones C57BL/6 irradiados letalmente. Los ratones trasplantados con lentivirus que expresan un gRNA no objetivo se utilizan como controles. El injerto de células madre hematopoyéticas transducidas se evalúa mediante el análisis citométrico de flujo de leucocitos rFP positivos de sangre periférica. Usando este método, se puede lograr una transducción del 90 % de células mieloides y un 70 % de las células linfoides a las 4 semanas después del trasplante. El ADN genómico está aislado de las células sanguíneas positivas para rFP, y partes del ADN del sitio objetivo son amplificadas por PCR para validar la edición del genoma. Este protocolo proporciona una evaluación de alto rendimiento de los genes reguladores de la hematopoyesis y se puede extender a una variedad de modelos de enfermedad esratonera con afectación de células hematopoyéticas.
Introducción
Muchos estudios en hematología e inmunología se basan en la disponibilidad de ratones modificados genéticamente, incluyendo ratones transgénicos/knock-out convencionales y condicionales que utilizan controladores Cre específicos del sistema hematopoyético como Mx1-Cre, Vav-Cre, y otros 1,2,3,4,5. Estas estrategias requieren el establecimiento de nuevas cepas de ratón, que pueden ser lentas y económicamente pesadas. Si bien los avances revolucionarios en la tecnología de edición del genoma han permitido la generación de nuevas cepas de ratón en tan solo 3-4 meses con la experiencia técnica adecuada6,7,8,9 , se requiere mucho más tiempo para amplificar la colonia de ratones antes de que se lleven a cabo los experimentos. Además, estos procedimientos son costosos. Por ejemplo, Jackson Laboratory enumera el precio actual de los servicios de generación de ratones noqueados en $16,845 por cepa (a diciembre de 2018). Por lo tanto, los métodos que son más económicos y eficientes que los enfoques transgénicos murinos convencionales son más ventajosos.
La tecnología de repeticiones palindrómicas cortas interespaciadas regularmente interesmadas/proteína asociada CRISPR 9 (CRISPR/Cas9) ha llevado al desarrollo de nuevas herramientas para la edición rápida y eficiente del genoma específico de la secuencia basada en ARN. Originalmente descubierto como un mecanismo inmune adaptativo bacteriano para destruir el ADN patógeno invasor, el sistema CRISPR/Cas9 se ha utilizado como una herramienta para aumentar la eficacia de la edición del genoma en células eucariotas y modelos animales. Se han empleado varios enfoques para transmitir maquinaria CRISPR/Cas9 a células madre hematopoyéticas (es decir, electroporación, nucleofección, lipofección, parto viral y otros).
Aquí, se emplea un sistema de lentivirus para transducir las células debido a su capacidad para infectar eficazmente las células madre hematopoyéticas murinas que expresan Cas9 y empaquetar la construcción guía de la expresión de ARN, promotores, secuencias reguladoras y genes que codifican proteínas fluorescentes (es decir, GFP, RFP). Usando este método, se ha logrado la edición genética ex vivo de células madre hematopoyéticas de ratón, seguida de una reconstitución exitosa de la médula ósea en ratones irradiados letalmente10. El vector de lentivirus empleado para este estudio expresa los genes reporteros Cas9 y GFP del promotor de EF1a de núcleo común con un sitio de entrada ribosomal interno aguas arriba del gen del reportero. La secuencia de ARN guía se expresa desde un promotor U6 separado. Este sistema se utiliza entonces para crear mutaciones de inserción y eliminación en los genes conductores de hematopoyesis clonal candidatas Tet2 y Dnmt3a10. Sin embargo, la eficiencia de transducción por este método es relativamente baja (-5%-10%) debido al gran tamaño de la plaquita vectorial (13 Kbps) que limita la eficiencia de transducción y reduce el ticter del virus durante la producción.
En otros estudios, se ha demostrado que un mayor tamaño de ARN viral afecta negativamente tanto a la producción de virus como a la eficiencia de transducción. Por ejemplo, se ha informado de un aumento de 1 kb en el tamaño de la plaquita para disminuir la producción de virus en un 50 %, y la eficiencia de transducción disminuirá a más del 50 % en las células madre hematopoyéticas del ratón11. Por lo tanto, es ventajoso reducir el tamaño del inserto viral tanto como sea posible para mejorar la eficiencia del sistema.
Esta deficiencia puede superarse empleando ratones transgénicos Cas9, en los que la proteína Cas9 se expresa de manera constitutiva o inductible12. Los constitutivos ratones knock-in CRISPR/Cas9 expresan la endonucleasa Cas9 y el EGFP del promotor CAG en el locus Rosa26 de una manera omnipresente. Por lo tanto, una construcción con sgRNA bajo el control del gen promotor U6 y reportero RFP bajo el control del promotor central EF1a puede ser entregada usando el vector lentivirus para lograr la edición del genoma. Con este sistema, los genes de las células madre hematopoyéticas han sido editados con éxito, mostrando una eficiencia de transducción del 90%. Por lo tanto, este protocolo proporciona un método rápido y eficaz para crear ratones en los que se introducen mutaciones genéticas dirigidas en el sistema hematopoyético. Mientras que nuestro laboratorio está utilizando predominantemente este tipo de tecnología para estudiar el papel de la hematopoyesis clonal en los procesos de enfermedades cardiovasculares13,14,15, también es aplicable a los estudios de hematológico neoplasia maligna16. Además, este protocolo puede extenderse al análisis de cómo las mutaciones de ADN en HSPC afectan a otras enfermedades o procesos de desarrollo en el sistema hematopoyético.
Para establecer un sistema de vectores de lentivirus robusto, se requieren existencias virales de alta titer y condiciones optimizadas para la transducción y el trasplante de células hematopoyéticas. En el protocolo, se proporcionan instrucciones sobre la preparación de un stock viral de alto títer en la sección 1, optimizando las condiciones de cultivo de las células madre hematopoyéticas murinas en la sección 2, los métodos para el trasplante de médula ósea en la sección 3, y la evaluación de las injerto en la sección 4.
Protocolo
Todos los procedimientos relacionados con sujetos de animales han sido aprobados por el Comité Institucional de Cuidado y Uso de Animales (IACUC) de la Universidad de Virginia.
1. Generación y purificación de partículas de lentivirus
NOTA: Las partículas de Lentivirus que contienen el ARN guía optimizado pueden ser producidas por los protocolos detallados proporcionados por Addgene: . Los métodos optimizados para la preparación y almacenamiento de lentivirus de alto valor se discuten en otros lugares17,18. En resumen, los lentivirus se producen mediante la co-transfección de un plásmido vectorial de lentivirus, psPAX2 y pMD2.G en células HEK 293T. El sobrenadante de cultivo se recoge a 48 h después de la transfección y se concentra por ultracentrifugación. El titador lentiviral está determinado por un ensayo basado en qPCR disponible comercialmente. Este procedimiento debe realizarse en un armario de bioseguridad clase II.
- Preparar una solución de colágeno 1:200 (0.0005%) en 1x PBS.
- Recubrir una placa de 6 pocillos con solución de colágeno e incubar a 37oC, 5%CO2 durante 30 min.
- Semilla 293T células a una densidad de 1 x 106 células por pozo e incubar a 37 oC, 5% CO2 para 2 h.
- Para preparar la mezcla de tres plásmidos de transfección para un pozo, combine 0,9 g de vector de lentivirus, 0,6 g de psPAX2 y 0,3 g de pMD2.G, luego alcance un volumen total de 10 s l añadiendo agua desionizada. Ajuste las cantidades en consecuencia dependiendo del número de pozos. Es posible que sea necesario optimizar aún más la cantidad y la proporción de cada plásmido para adaptarse a las necesidades de los investigadores.
- Añadir con cuidado 50 ml de 1x PBS y 5 l del PEI MAX diluido (1,0 mg/ml) a la mezcla de plásmido e incubar durante 15 minutos a temperatura ambiente (RT)(Tabla 1).
- Añadir 1 ml de DMEM a la mezcla.
- Aspirar los medios de la placa de 6 pozos, añadir 1 ml de mezcla de plásmido, e incubar a 37 oC, 5% CO2 durante 3 h.
- Sustituya el soporte por 2 ml de DMEM fresco e incubar a 37oC, 5%CO2 durante 24 h.
- Añadir 1 mL de DMEM fresco e incubar a 37oC, 5%CO2 por 24 h adicionales (el tiempo total de incubación es de 48 h).
- Transfiera el sobrenadante de cultivo a un tubo de 50 ml y centrífuga a 3.000 x g durante 15 minutos para eliminar las células flotantes.
- Filtrar el sobrenadante a través de un filtro de 0,45 m.
- Transfiera el filtrado a tubos centrífugos de polipropileno.
- Ultracentrifugar a 4oC y 72.100 x g a rmáx. durante 3 h.
- Aspirar cuidadosamente el sobrenadante, dejando atrás el pellet blanco.
- Resuspende el pellet con 100 ml de medio de expansión de células hematopoyéticas sin suero sin aireación.
- Mantener una alícuota de 10 l para medir el rumbo viral y almacenar todas las alícuotas restantes a -80 oC hasta que sea necesario.
- Valorar el virus con un ensayo basado en qPCR de acuerdo con las instrucciones del fabricante utilizando la alícuota viral de 10 L.
2. Aislamiento y transducción de células negativas al linaje de la médula ósea del ratón(Figura 1A)
NOTA: Por lo general, para aislar suficientes células, se cosechan pares de tibias, fémures y humeri de cada ratón. Los huesos pélvico y espinal también se pueden cosechar como una fuente de células negativas al linaje.
- Aislamiento de células de médula ósea
- Euthanize 8-10 semanas macho CRISPR/Cas9 knock-in ratones por 5% de isoflurano seguido de luxación cervical, luego desinfectar su piel con 70% de etanol.
- Usando tijeras discortezantes, haz una incisión transversal en la piel justo debajo de la caja torácica y pela la piel discada en ambas direcciones para exponer las piernas y los brazos.
- Separe cuidadosamente las extremidades inferiores del hueso de la cadera dislocando la articulación de la cadera. Corte a lo largo de la cabeza del fémur para eliminar el fémur completamente de la cadera. Disloque la rodilla y corte en la articulación para separar el fémur y la tibia, manteniendo intacta la epífisis ósea. Disloque la articulación del tobillo y despegue el pie y el músculo extra.
- Usando tijeras dislindantes, corta sobre el hombro para separar las extremidades superiores. Disloque el hombro, luego corte en la articulación del codo para cosechar el hueso del húmero.
- Use toallitas de fibra de celulosa para eliminar cuidadosamente los músculos de los fémures, tibias y humeri. Tome precauciones adicionales para asegurarse de que los huesos no se rompan durante este proceso.
- Coloque los huesos aislados en un tubo cónico de 50 ml que contenga RPMI y colóquelos sobre hielo.
NOTA: Los siguientes pasos deben llevarse a cabo en un armario de clase II de bioseguridad. - Transfiera los huesos a un plato de cultivo estéril de 100 mm.
- Agarre el hueso con fórceps contundentes y, usando tijeras disincrustadoras, corte cuidadosamente ambas epífisis.
NOTA: Un corte insuficiente conducirá a un lavado incompleto de la médula ósea, mientras que el corte demasiado agresivo resultará en la pérdida de células. - Llene una jeringa de 10 ml con RPMI helada, y con una aguja de 22 G, enjuague la médula ósea del eje en un nuevo plato de cultivo de 100 mm.
NOTA: Los huesos se volverán blancos y translúcidos si el eje óseo ha sido bien enrojecido. Si no es así, vuelva a cortar los extremos del hueso y vuelva a lancarlo. - Después de recoger toda la médula ósea, haga una suspensión de una sola célula pasando la médula ósea varias veces a través de una jeringa de 10 ml con una aguja de 18 G. Repita 10x para asegurar una suspensión de una sola célula.
- Filtrar la suspensión celular a través de un colador de células de 70 m en un tubo cónico de 50 ml.
- Centrífuga a 310 x g durante 10 min a 4oC.
- Aspirar el sobrenadante y resuspender los pellets celulares en un volumen adecuado de búfer de separación optimizado para el siguiente proceso de separación celular.
- Aislamiento y transducción de lentivirus de células negativas al linaje
NOTA: Las células negativas al linaje del ratón se aíslan de la médula ósea de los ratones transgénicos Cas93,u otras cepas de ratones, utilizando un kit de agotamiento del linaje de acuerdo con las instrucciones del fabricante. Típicamente, las células negativas al linaje representan entre el 2% y el 5% de las células nucleadas de la médula ósea entera, y la pureza suele ser superior al 90% después del aislamiento. Las células negativas de linaje aisladas se cultivan en un medio de expansión de células hematopoyéticas sin suero complementado con TPO murino recombinante de 20 ng/ml y SCF murino recombinante de 50 ng/ml, luego transducido con el vector de lentivirus durante 16 h a una multiplicidad de (MOI) a 100.- Para aislar las células negativas del linaje, utilice el kit de agotamiento de la célula de linaje de acuerdo con las instrucciones del fabricante.
- Después del aislamiento, resuspenda las células negativas al linaje en 1 ml de medio de expansión de células hematopoyéticas sin suero.
- Sembrar las células en una placa de 6 pozos a una densidad de 1,5 x 106 celdas/ml (5 x 105 celdas negativas de linaje/ratón.)
- Añadir TPO murino recombinante y SCF en pozos a concentraciones finales de 20 ng/ml y 50 ng/mL, respectivamente.
- Preincubar células a 37oC en 5%CO2 durante 2 h.
- Añadir el lentivirus a MOI a 100, 4 g/ml de polibreno y penicilina/estreptomicina a los pozos e incubar a 37oC, 5%CO2 para 16-20 h(Figura 1B).
- Al día siguiente, recoger las células transducidas por lentivirus en un tubo cónico de 15 ml y centrífuga a 300 g durante 10 min.
- Aspirar cuidadosamente el sobrenadante y resuspender el pellet en 200 l de RPMI por ratón. Mantenga las células en RT hasta que se transcriban en ratones (sección 3).
3. Trasplante de células transducidas en ratones irradiados letalmente
- El día del trasplante de médula ósea, coloque los ratones receptores en una jaula de ocho rebanadas y expongalos a dos dosis de irradiación de todo el cuerpo (550 Rad/dosis, dosis total de 1100 Rad), con aproximadamente 4 horas entre cada sesión de irradiación.
- Después de la segunda sesión de irradiación, inyectar células negativas de linaje transducido a cada ratón receptor anestesiado a través del plexo de vena retroorbital (200 l en total) utilizando una jeringa de insulina(Figura 1C).
- Después de la irradiación, los ratones deben ser alojados en jaulas esterilizadas y provistos de una dieta blanda y agua potable suplementada con antibióticos durante 14 d.
- A las 3-4 semanas después del trasplante de médula ósea, analice la sangre periférica para comprobar si hay injerto de células de donantes transducidas (sección 4).
4. Evaluar el chimerismo de la sangre periférica
- Anestetizar ratones con 5% de isoflurano y obtener una muestra de sangre de una vena retro-orbital utilizando tubos capilares, y recogerlo en tubos K2EDTA (el volumen en un tubo capilar es suficiente para el siguiente ensayo).
- Transfiera 20 ml de sangre de los tubos K2EDTA a los tubos de ensayo de poliestireno de fondo redondo de 5 ml y colóquelo en hielo.
- Añadir 1,5 ml de tampón de lisis RBC a los glóbulos rojos de la lyse. Incubar durante 5 minutos sobre hielo.
- Para neutralizar el tampón de lisis, lave las muestras con el tampón FACS (1,5 ml/muestra).
- Centrífuga a 609 x g a rmáx. durante 5 min a 4oC. Descarta el sobrenadante.
- Incubar las células con un cóctel de anticuerpos monoclonales (diluidos en 100 l de tampón/muestra FACS) a RT durante 20 minutos en la oscuridad. Se proporciona una lista completa de anticuerpos en la sección Materiales anterior.
- Lave las células una vez con el búfer FACS (2 mL/muestra). Centrífuga a 609 x g a rmáx (1.800 rpm) durante 5 min a 4oC. Deseche el sobrenadante por completo.
- Fijar las celdas con paraformaldehído que contiene tampón de fijación (100 l/tubo) durante 10 minutos a 4 oC.
- Lave las células una vez con el búfer FACS (3 ml/muestra). Centrífuga a 609 x g a rmáx (1.800 rpm) durante 5 min a 4oC. Deseche el sobrenadante por completo.
- Suspenda el pellet en 400 l de búfer FACS.
- Mantener las muestras a 4 oC hasta el análisis por citometría de flujo.
Resultados
Utilizando el protocolo descrito anteriormente, se han obtenido aproximadamente 0.8-1.0 x 108 células de médula ósea por ratón. El número de celdas negativas de linaje que obtenemos es de aproximadamente 3 x 106 celdas por ratón. Típicamente, el rendimiento de las células negativas del linaje de la médula ósea es del 4%-5% del total de las células nucleares de la médula ósea.
El chimerismo de las células transducidas (RFP-positivo) se evalúa mediante citometría de flujo de la sangre periférica(Figura 2A,B). La sangre se aísla de la vena retroorbital y se utilizan marcadores apropiados para determinar la identidad de cada población celular hematopoyética (es decir, neutrófilos, monocitos, células T, etc.) (Figura 3A,B). El ADN genómico se puede aislar de las células sanguíneas positivas para RFP, y las secciones del ADN del sitio objetivo pueden ser amplificadas por PCR y subclonadas en vectores de clonación TA para el análisis de secuencia. Estos plásmidos son transducidos a E. coli y las secuencias del sitio de destino se determinan mediante la secuenciación de Sanger(Figura 4). Alternativamente, las secuencias de sitios de destino se pueden determinar mediante otros métodos, como la secuenciación de Sanger del genoma agrupado seguido de un seguimiento de las indels mediante el análisis de descomposición (TIDE)10. Para la condición de control, los ratones suelen ser trasplantados con células que se transduplanden con un lentivirus que expresa ARN guía no objetivo.
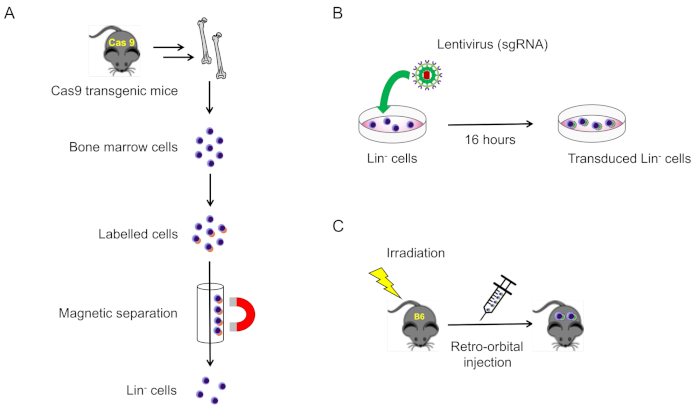
Figura 1: Ilustración esquemática de este protocolo. (A) Aislamiento de células de médula ósea negativas al linaje de ratones que expresan Cas9 (sección 2.1). (B) Transducción lentivirus de células negativas al linaje (sección 2.2). (C) Inyección retro-orbital de células transducidas en ratones de tipo salvaje irradiados letalmente (sección 3). Haga clic aquí para ver una versión más grande de esta figura.
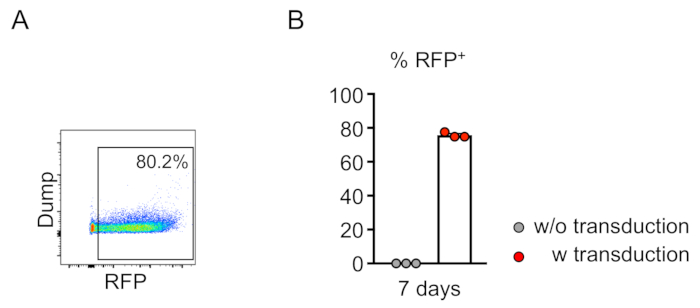
Figura 2: Transducción lentiviral eficiente de células negativas de linaje de médula ósea de ratón in vitro. (A) El análisis de citometría de flujo revela una transducción exitosa de células negativas al linaje. El análisis se realizó después de 7 días de cultivo in vitro. (B) En promedio, el 75,7% de las células fueron transducidas en este ensayo (n.o 3). Haga clic aquí para ver una versión más grande de esta figura.
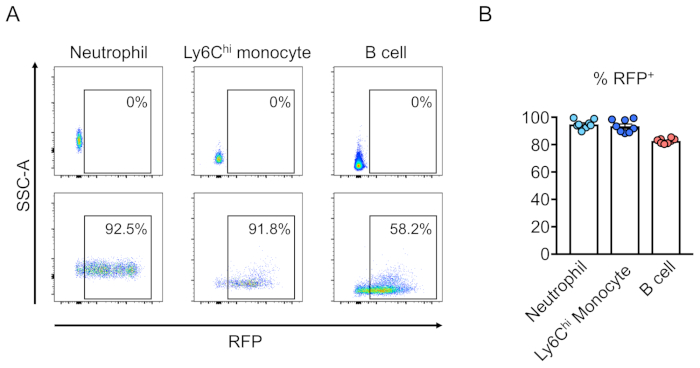
Figura 3:Reconstitución de médula ósea deratón irradiada letalmente por células negativas de linaje transducido. (A) Análisis de citometría de flujo de sangre periférica del ratón tras la reconstitución por células madre hematopoyéticas que fueron (abajo) o no fueron transducidas con lentivirus que expresan RFP. Los neutrófilos se definen como Ly6G+ y Ly6Chi monocitos como Ly6G- y Ly6C+, y células B como CD45R+. (B) En estos ensayos, un promedio del 94,8%, 93,5% y 82,7% de las células son RFP+ en las poblaciones de neutrófilos,himonocitos Ly6C y células B, respectivamente (n.o 8). Haga clic aquí para ver una versión más grande de esta figura.
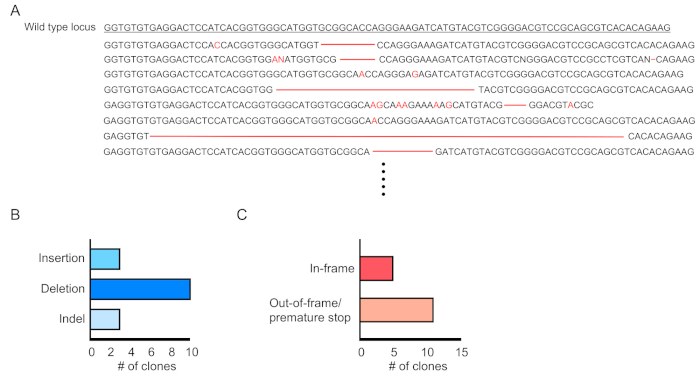
Figura 4:Evaluación de laedición génica en células sanguíneas transducidas. (A) Ejemplo de edición genética que muestra los resultados de secuenciación del locus Mutado De Dnmt3a en células sanguíneas positivas para RPF. Las eliminaciones se muestran como guiones rojos y las inserciones se indican con letras rojas. (B) Resumen de las mutaciones detectadas. (C) El 69% (11/16 clones) mostraron mutaciones de parada prematuras/fuera de trama. Haga clic aquí para ver una versión más grande de esta figura.
| Plásmido | Tamaño (bp) | Cantidad por pozo (g) | Cociente |
| pLKO5.0 | 7700 | 0.9 | 2 |
| psPAX2 | 10668 | 0.6 | 1 |
| pMD2.G | 5822 | 0.3 | 1 |
| PEI-max (stock: 100 mg/mL) | 5 L/pozo | ||
Tabla 1: Cantidades de plásmido y PEI-max utilizadas para la transfección.
Discusión
La ventaja de este protocolo es la creación de modelos animales que albergan mutaciones específicas en células hematopoyéticas de una manera rápida y altamente rentable en comparación con los enfoques transgénicos de ratón convencionales. Se encontró que esta metodología permite la generación de ratones con manipulaciones genéticas de células hematopoyéticas dentro de 1 mes. Hay varios pasos críticos en este protocolo que requieren una consideración adicional.
Examen de la secuencia del GRNA
Se recomienda probar los ARNNm in vitro para evaluar la eficiencia de edición antes de realizar experimentos in vivo. La eficiencia de los gRNAs se prueba utilizando un sistema de transcripción y cribado in vitro sin células. El gRNA transcrito se valida midiendo su eficiencia al cortar el ADN de la plantilla en presencia de proteína Cas9 recombinante, utilizando electroforesis de gel de agarosa. Los kits disponibles en el comercial están disponibles para este propósito.
Aquí, las mutaciones indel se caracterizan por la clonación TA de productos de PCR amplificados de la región editada, transformando las células bacterianas con esos plásmidos y recogiendo colonias individuales para la secuenciación de Sanger. Sin embargo, este método es laborioso y requiere mucho tiempo. Alternativamente, la secuenciación de próxima generación (NGS) o la secuenciación de ADN agrupada seguida de un análisis TIDE se pueden realizar19. El algoritmo TIDE se creó para analizar las trazas de secuencia de Sanger generadas a partir de muestras complejas. Se ha demostrado que las estimaciones de indel con TIDE suelen ser coherentes con las NGS20fuera de destino. El software analítico está disponible en línea en .
Generación de partículas lentivirus de alto titer
La proteína G del virus de la estomatitis vesicular viral, que es esencial para la infección celular, es altamente sensible al pH. Por lo tanto, es importante mantener el medio de cultivo dentro de un rango de pH aceptable, y no debe desarrollar una apariencia amarillento. Se emplean platos recubiertos de colágeno para la generación de virus porque acelera la fijación de las células HEK293T y permite el rendimiento de la transfección en pocas horas, en lugar de esperar durante la noche. Sin embargo, dependiendo del horario experimental, también se puede considerar la incubación durante la noche.
Purificación de partículas de lentivirus
Para lograr una transducción eficiente de células madre hematopoyéticas, es necesario generar lentivirus de alto titer. La optimización de la velocidad de centrifugación es una característica clave. Mientras que la concentración de lentivirus se realiza generalmente a 90.000 x g,varios informes han demostrado que la recuperación del virus aumenta si el material se centrifuga a la velocidad más baja de 20.000 x g18. También se ha sugerido la producción de una preparación de lentivirus de alto valor sin ultracentrifugación17. Cabe señalar que es importante suspender el pellet de centrifugación del virus evitando la pipeteo vigorosa para minimizar la aireación y mantener la integridad del virus. Se requieren partículas de lentivirus de alta titulación para la transducción eficiente de células madre hematopoyéticas11. Los experimentos piloto revelaron que un MOI de 100 es óptimo con respecto a la eficiencia de transducción y la viabilidad celular. Se recomienda evaluar las existencias de lentivirus sobre la base de la viabilidad celular y la eficiencia de transducción.
Almacenamiento de partículas de lentivirus
El titer de lentivirus es muy sensible a la temperatura, y el diezmo se puede reducir drásticamente por condiciones de almacenamiento inadecuadas y ciclos de congelación-descongelación repetidos. Se ha encontrado que la eficiencia de transducción del lentivirus disminuye rápidamente cuando se almacena a 4 oC [t(1/2) a 1,3 días] o se somete a múltiples ciclos de congelación-descongelación [t(1/2) a 1,1 rondas]. Se recomienda que las preparaciones del virus se congelen a presión en nitrógeno líquido o hielo seco triturado poco después de suspender el pellet del virus. Las existencias virales deben mantenerse a -80 oC y descongelarse sobre hielo a RT justo antes de la equilibrada y utilizar11.
Deben tenerse en cuenta varias limitaciones potenciales. En primer lugar, se ha apreciado la introducción de mutaciones indel fuera del objetivo por CRISPR/Cas9. También se ha demostrado que CRISPR/Cas9 puede inducir mutaciones fuera del objetivo in vivo21. En la práctica, las mutaciones indel fuera de destino se pueden evitar mediante el uso de secuencias de ARNG que están estrechamente emparejadas con los sitios del genoma objetivo y tienen más de cuatro desajustes a los sitios secundarios predichos. Dicho diseño se puede hacer con las herramientas de silico existentes22. Otras herramientas computacionales para predecir el gRNA con acciones minimizadas fuera de destino están disponibles ( o ). También puede ser beneficioso analizar un modelo animal utilizando dos o más gRNAs diferentes para confirmar el fenotipo y minimizar la posibilidad de que el fenotipo observado esté mediado por un efecto fuera de destino de un gRNA específico.
Además de las mutaciones indel convencionales creadas por CRISPR/Cas9, se han notificado deleciones más grandes que se extienden más allá de las kilobases. Esto puede confundir estudios; sin embargo, esas eliminaciones más grandes se divulgan para ser mucho menor frecuencia en comparación con indels23. Otro problema potencial es la compensación genética. Se ha informado de que el ARN mutante con un codón de terminación prematura (PTC) puede dar lugar a la regulación ascendente de genes relacionados con la similitud de secuencia por la activación mediada compleja por COMPASS de la transcripción24,25. Se ha sugerido que este evento es un mecanismo que puede conducir a diferencias fenotípicas entre los enfoques de eliminación y derribo de la ablación génica. Debido a que la edición del genoma mediado por CRISPR/Cas9 depende en gran medida de la introducción estocástica de mutaciones de cambio de marco que conducen a la generación de PTC, la compensación genética puede modificar el fenotipo. Para evitar la compensación genética, se pueden considerar experimentos en los que las secuencias reguladoras de un gen son atacadas por CRISPR/Cas9 o mediante la introducción de modificadores epigenéticos utilizando Cas9 como plataforma de reconocimiento de ADN guiada por ARN.
Por último, debe reconocerse que la hematopoyesis de las células injertadas en ratones irradiados letalmente puede diferir de las condiciones nativas de la hematopoyesis. Además, la irradiación puede tener efectos sistémicos en el organismo que pueden confundir la interpretación de experimentos que examinan las mutaciones genéticas de las consecuencias en las células hematopoyéticas.
Los investigadores han aprovechado las proteínas Cas9 (dCas9) catalíticamente inactivas como una "plataforma de reconocimiento de ADN guiada por ARN" y han utilizado proteínas de fusión dCas9 para localizar dominios de efectores en secuencias de ADN específicas para reprimir (CRISPRi) o activar (CRISPRa) transcripción fuera del objetivogenes 26,27. Si bien este protocolo utiliza ratones transgénicos Cas9 catalíticamente activos para introducir la escisión dsDNA en la secuencia genómica del ADN, la modificación epigenética para reprimir o activar genes específicos es aplicable mediante la fusión de dCas9 con dominios modificadores de cromatina como dCas9-KRAB o dCas9-VP64, respectivamente. Alternativamente, dCas9 puede ser utilizado como un represor transcripcional como propio, bloqueando la maquinaria transcripcional para acceder al sitio genético27. Más recientemente, Zhou y otros establecieron ratones transgénicos dCas9-SunTag-p65-HSF1 (SPH) que expresan una versión modificada de un activador epigenético fusionado con dCas9 y demostraron que este sistema CRISPRa es funcional in vivo28.
Nuestro laboratorio utiliza predominantemente esta tecnología para estudiar el papel de la hematopoyesis clonal en los procesos de enfermedades cardiovasculares. En el tejido proliferante, las mutaciones somáticas en los genes del controlador del cáncer pueden conferir una ventaja de crecimiento celular y conducir a expansiones clonales aberrantes. En el sistema hematopoyético, este proceso se conoce como "hematopoyesis clonal", y resulta en situaciones en las que una fracción sustancial de los leucocitos de un individuo son reemplazados por clones mutantes. Cada vez se aprecia cada vez más que las expansiones clonales aberrantes aceleran las enfermedades cardiovasculares, como la aterosclerosis y la insuficiencia cardíaca, y contribuyen a la morbilidad y mortalidad por todas las causas15,29.
Recientemente, se ha documentado una conexión causal entre varias de estas mutaciones somáticas y enfermedades cardiovasculares, y se han aclarado aspectos de los mecanismos subyacentes10,13,14. Sin embargo, estas mutaciones somáticas probablemente representan la "punta del iceberg", ya que los estudios epidemiológicos han demostrado que muchos genes candidatos adicionales están asociados con la hematopoyesis clonal y, potencialmente, el aumento de la mortalidad por enfermedades cardiovasculares. Por lo tanto, se requiere una evaluación sistemática y de mayor rendimiento de los genes del controlador de hematopoyesis clonal. Los estudios actuales de la conexión causal de la hematopoyesis clonal y las enfermedades cardiovasculares se basan en el análisis de ratones con transgénicos condicionales específicos del sistema hematopoyético (Mx1-Cre, Vav-Cre, etc.) o ratones después del trasplante de médula ósea. Estas estrategias, sin embargo, necesitan establecer nuevas colonias de ratones y pueden convertirse en una carga financiera y física para los investigadores. Por lo tanto, se justifica un método más barato y rápido que el enfoque transgénico/knock-out murino convencional empleado en el pasado. Los vectores lentivirales para transducir las tecnologías HSPC y CRISPR para diseñar mutaciones, como se describe en este manuscrito, facilitan el estudio de la hematopoyesis clonal y las enfermedades cardiovasculares.
Además de generar locus de knock-out convencional, este método es aplicable a la producción de proteínas mutadas truncadas. Por ejemplo, los investigadores han generado con éxito un truncamiento hematopoyético-Ppm1d, que se ve con frecuencia en pacientes con hematopoyesis clonal, mediante la introducción de mutaciones de cambio de marco con un ARNm dirigido al exón 6 del gen Ppm1d30.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
S. S. fue apoyado por una beca postdoctoral de la Asociación Americana del Corazón 17POST33670076. K. W. fue apoyado por las subvenciones NIH R01 HL138014, R01 HL141256 y R01 HL139819.
Materiales
| Name | Company | Catalog Number | Comments |
| RPMI Medium 1640 (1X) | Gibco | 11875-093 | Medium |
| Sulfamethoxazole and Trimethoprim injection | TEVA | 0703-9526-01 | |
| 1/2 cc LO-DOSE INSULIN SYRINGE | EXELINT | 26028 | general supply |
| 293T cells | ATCC | CRL-3216-- | Cell line |
| APC-anti-mouse Ly6C (Clone AL-21) | BD Biosciences | 560599 | Antibodies |
| APC-Cy7-anti-mouse CD45R (RA3-6B2) | BD Biosciences | 552094 | Antibodies |
| BD Luer-Lok disposable syringes, 10 ml | BD | 309604 | general supply |
| BD Microtainer blood collection tubes, K2EDTA added | BD Bioscience | 365974 | general supply |
| BD Precisionglide needle, 18 G | BD | 305195 | general supply |
| BD Precisionglide needle, 22 G | BD | 305155 | general supply |
| BV510-anti-mouse CD8a (Clone 53-6.7) | Biolegend | 100752 | Antibodies |
| BV711-anti-mouse CD3e (Clone 145-2C11) | Biolegend | 100349 | Antibodies |
| Collagen from calf skin | Sigma-Aldrich | 9007-34-5 | general supply |
| Corning Costar Ultra-Low Attachment Multiple Well Plate, 6 well | Millipore Sigma | CLS3471 | general supply |
| CRISPR/Cas9 knock-in mice | The Jackson Laboratory | 028555 | mouse |
| DietGel 76A | Clear H2O | 70-01-5022 | general supply |
| Dulbecco’s Modified Eagle’s Medium (DMEM) - high glucose | Sigma Aldrich | D6429 | Medium |
| eBioscience 1X RBC Lysis Buffer | Thermo fisher Scientific | 00-4333-57 | Solution |
| Falcon 100 mm TC-Treated Cell Culture Dish | Life Sciences | 353003 | general supply |
| Falcon 5 mL round bottom polystyrene test tube | Life Sciences | 352054 | general supply |
| Falcon 50 mL Conical Centrifuge Tubes | Fisher Scientific | 352098 | general supply |
| Falcon 6 Well Clear Flat Bottom TC-Treated Multiwell Cell Culture Plate | Life Science | 353046 | general supply |
| Fisherbrand microhematocrit capillary tubes | Thermo Fisher Scientific | 22-362566 | general supply |
| Fisherbrand sterile cell strainers, 70 μm | Fisher Scientific | 22363548 | general supply |
| FITC-anti-mouse CD4 (Clone RM4-5) | Invitrogen | 11-0042-85 | Antibodies |
| Fixation Buffer | BD Bioscience | 554655 | Solution |
| Guide-it Compete sgRNA Screening Systems | Clontech | 632636 | Kit |
| Isothesia (Isoflurane) solution | Henry Schein | 29404 | Solution |
| Lenti-X qRT-PCR Titration Kit | Takara | 631235 | Kit |
| Lineage Cell Depletion Kit, mouse | Miltenyi Biotec | 130-090-858 | Kit |
| Millex-HV Syringe Filter Unit, 0.45 mm | Millipore Sigma | SLHV004SL | general supply |
| PBS pH7.4 (1X) | Gibco | 10010023 | Solution |
| PE-Cy7-anti-mouse CD115 (Clone AFS98) | eBioscience | 25-1152-82 | Antibodies |
| PEI MAX | Polysciences | 24765-1 | Solution |
| Penicillin-Streptomycin Mixture | Lonza | 17-602F | Solution |
| PerCP-Cy5.5-anti-mouse Ly6G (Clone 1A8) | BD Biosciences | 560602 | Antibodies |
| pLKO5.sgRNA.EFS.tRFP | Addgene | 57823 | Plasmid |
| pMG2D | Addgene | 12259 | Plasmid |
| Polybrene Infection/Transfection Reagent | Sigma Aldrich | TR-1003-G | Solution |
| Polypropylene Centrifuge Tubes | BECKMAN COULTER | 326823 | general supply |
| psPAX2 | Addgene | 12260 | Plasmid |
| RadDisk – Rodent Irradiator Disk | Braintree Scientific | IRD-P M | general supply |
| Recombinant Murine SCF | Peprotech | 250-03 | Solution |
| Recombinant Murine TPO | Peprotech | 315-14 | Solution |
| StemSpan SFEM | STEMCELL Technologies | 09600 | Solution |
| TOPO TA cloning kit for sequencing with One Shot TOP10 Chemically Competent E.coli | Thermo fisher Scientific | K457501 | Kit |
| Zombie Aqua Fixable Viability Kit | BioLegend | 423102 | Solution |
Referencias
- Sasaki, Y., et al. Defective immune responses in mice lacking LUBAC-mediated linear ubiquitination in B cells. EMBO Journal. 32, 2463-2476 (2013).
- Ogilvy, S., et al. Transcriptional regulation of vav, a gene expressed throughout the hematopoietic compartment. Blood. 91, 419-430 (1998).
- Meyer, S. E., et al. DNMT3A Haploinsufficiency Transforms FLT3ITD Myeloproliferative Disease into a Rapid, Spontaneous, and Fully Penetrant Acute Myeloid Leukemia. Cancer Discovery. 6, 501-515 (2016).
- Kuhn, R., Schwenk, F., Aguet, M., Rajewsky, K. Inducible gene targeting in mice. Science. 269, 1427-1429 (1995).
- Cole, C. B., et al. PML-RARA requires DNA methyltransferase 3A to initiate acute promyelocytic leukemia. Journal of Clinical Investigation. 126, 85-98 (2016).
- Yang, H., et al. One-step generation of mice carrying reporter and conditional alleles by CRISPR/Cas-mediated genome engineering. Cell. 154, 1370-1379 (2013).
- Wang, H., et al. One-step generation of mice carrying mutations in multiple genes by CRISPR/Cas-mediated genome engineering. Cell. 153, 910-918 (2013).
- Quadros, R. M., et al. Easi-CRISPR: a robust method for one-step generation of mice carrying conditional and insertion alleles using long ssDNA donors and CRISPR ribonucleoproteins. Genome Biology. 18, 92 (2017).
- Miura, H., Quadros, R. M., Gurumurthy, C. B., Ohtsuka, M. Easi-CRISPR for creating knock-in and conditional knock-out mouse models using long ssDNA donors. Nature Protocols. 13, 195-215 (2018).
- Sano, S., et al. CRISPR-Mediated Gene Editing to Assess the Roles of Tet2 and Dnmt3a in Clonal Hematopoiesis and Cardiovascular Disease. Circulation Research. 123, 335-341 (2018).
- Cante-Barrett, K., et al. Lentiviral gene transfer into human and murine hematopoietic stem cells: size matters. BMC Research Notes. 9 (312), (2016).
- Chu, V. T., et al. Efficient CRISPR-mediated mutagenesis in primary immune cells using CrispRGold and a C57BL/6 Cas9 transgenic mouse line. Proceedings of the National Academy of Sciences of the United States of America. 113, 12514-12519 (2016).
- Fuster, J. J., et al. Clonal hematopoiesis associated with TET2 deficiency accelerates atherosclerosis development in mice. Science. 355, 842-847 (2017).
- Sano, S., et al. Tet2-Mediated Clonal Hematopoiesis Accelerates Heart Failure Through a Mechanism Involving the IL-1beta/NLRP3 Inflammasome. Journal of the American College of Cardiology. 71, 875-886 (2018).
- Sano, S., Wang, Y., Walsh, K. Clonal Hematopoiesis and Its Impact on Cardiovascular Disease. Circulatory Journal. 71, 875-886 (2018).
- Heckl, D., et al. Generation of mouse models of myeloid malignancy with combinatorial genetic lesions using CRISPR-Cas9 genome editing. Nature Biotechnology. 32, 941-946 (2014).
- Jiang, W., et al. An optimized method for high-titer lentivirus preparations without ultracentrifugation. Scientific Reports. 5, 13875 (2015).
- Cribbs, A. P., Kennedy, A., Gregory, B., Brennan, F. M. Simplified production and concentration of lentiviral vectors to achieve high transduction in primary human T cells. BMC Biotechnology. 13, 98 (2013).
- Brinkman, E. K., Chen, T., Amendola, M., van Steensel, B. Easy quantitative assessment of genome editing by sequence trace decomposition. Nucleic Acids Research. 42, e168 (2014).
- Sentmanat, M. F., Peters, S. T., Florian, C. P., Connelly, J. P., Pruett-Miller, S. M. A Survey of Validation Strategies for CRISPR-Cas9 Editing. Scientific Reports. 8, 888 (2018).
- Akcakaya, P., et al. In vivo CRISPR editing with no detectable genome-wide off-target mutations. Nature. 561, 416-419 (2018).
- Bae, S., Park, J., Kim, J. S. Cas-OFFinder: a fast and versatile algorithm that searches for potential off-target sites of Cas9 RNA-guided endonucleases. Bioinformatics. 30, 1473-1475 (2014).
- Kosicki, M., Tomberg, K., Bradley, A. Repair of double-strand breaks induced by CRISPR-Cas9 leads to large deletions and complex rearrangements. Nature Biotechnology. 36, 765-771 (2018).
- El-Brolosy, M. A., et al. Genetic compensation triggered by mutant mRNA degradation. Nature. 568, 193-197 (2019).
- Ma, Z., et al. PTC-bearing mRNA elicits a genetic compensation response via Upf3a and COMPASS components. Nature. 568, 259-263 (2019).
- Gilbert, L. A., et al. CRISPR-mediated modular RNA-guided regulation of transcription in eukaryotes. Cell. 154, 442-451 (2013).
- Qi, L. S., et al. Repurposing CRISPR as an RNA-guided platform for sequence-specific control of gene expression. Cell. 152, 1173-1183 (2013).
- Zhou, H., et al. In vivo simultaneous transcriptional activation of multiple genes in the brain using CRISPR-dCas9-activator transgenic mice. Nature Neuroscience. 21, 440-446 (2018).
- Fuster, J. J., Walsh, K. Somatic Mutations and Clonal Hematopoiesis: Unexpected Potential New Drivers of Age-Related Cardiovascular Disease. Circulatory Research. 122, 523-532 (2018).
- Kahn, J. D., et al. PPM1D truncating mutations confer resistance to chemotherapy and sensitivity to PPM1D inhibition in hematopoietic cells. Blood. , (2018).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados