Method Article
Modifica del genoma mediato da Lentiviral/Cas9 per lo studio delle cellule ematopoietiche nei modelli di malattia
In questo articolo
Riepilogo
Descritto sono protocolli per l'editing genomico altamente efficiente di cellule staminali e progenitrici (HSPC) murine (HSPC) dal sistema CRISPR/Cas9 per sviluppare rapidamente sistemi di modelli murini con modifiche genetiche specifiche del sistema ematopoietico.
Abstract
La manipolazione dei geni nelle cellule staminali ematopoietiche utilizzando approcci convenzionali di transgenesi può essere dispendiosa in termini di tempo, costi e impegnativi. Approfittando dei progressi nella tecnologia di editing del genoma e nei sistemi di erogazione transgenici mediati da lentivirus, è descritto un metodo efficiente ed economico che stabilisce topi in cui i geni vengono manipolati specificamente nelle cellule staminali ematopoietiche. I lentivirus vengono utilizzati per trasdurre le cellule del midollo osseo con un'RNA guida (gRNA) mirato a geni specifici e a un gene di segnalazione della fluorescenza rossa (RFP), quindi queste cellule vengono trapiantate in topi C57BL/6 irradiati letale. I topi trapiantati con lentivirus che esprimono gRNA non mirati vengono utilizzati come controlli. L'innesto di cellule staminali ematopoietiche trasdotte viene valutato mediante analisi citometrica del flusso di leucociti RFP positivi al sangue periferico. Utilizzando questo metodo, è possibile ottenere la trasduzione di cellule mieloidi e il 70% delle cellule linfoidi a 4 settimane dopo il trapianto. Il DNA genomico è isolato dalle cellule del sangue RFP-positive e parti del DNA del sito mirato sono amplificate dalla PCR per convalidare l'editing del genoma. Questo protocollo fornisce una valutazione ad alto throughput dei geni regolatori dell'ematopoiesi e può essere esteso a una varietà di modelli di malattia dei topi con coinvolgimento delle cellule ematopoietiche.
Introduzione
Molti studi in ematologia e immunologia si basano sulla disponibilità di topi geneticamente modificati, tra cui topi transgenici/knock-out convenzionali e condizionali che utilizzano driver Cre specifici del sistema ematopoietico come Mx1-Cre, Vav-Cre e altri 1,2,3,4,5. Queste strategie richiedono la creazione di nuovi ceppi di topi, che possono richiedere molto tempo e gravare finanziariamente. Mentre i progressi rivoluzionari nella tecnologia di editing del genoma hanno permesso la generazione di nuovi ceppi di topi in appena 3-4 mesi con l'adeguata competenza tecnica6,7,8,9 , è necessario molto più tempo per amplificare la colonia di topi prima di condurre esperimenti. Inoltre, queste procedure sono costose. Ad esempio, Jackson Laboratory elenca il prezzo attuale dei servizi di generazione di topi knock-out a 16.845 dollari per ceppo (a partire da dicembre 2018). Pertanto, i metodi più economici ed efficienti rispetto agli approcci transgenici murini convenzionali sono più vantaggiosi.
La tecnologia CRISPR/Cas9, regolarmente interspaziata, ripete a breve ad occhiindromici/proteina CRISPR associata a ROF (CRISPR/Cas9) ha portato allo sviluppo di nuovi strumenti per un rapido ed efficiente editing del genoma basato su RNA e sequenza. Originariamente scoperto come meccanismo immunitario adattativo batterico per distruggere il DNA patogeno invasore, il sistema CRISPR/Cas9 è stato utilizzato come strumento per aumentare l'efficacia dell'editing del genoma nelle cellule eucariotiche e nei modelli animali. Sono stati adottati diversi approcci per trasmettere macchinari CRISPR/Cas9 in cellule staminali ematopoietiche (ad esempio, elettroporazione, nucleofezione, lipofezione, esodo virale e altri).
Qui, un sistema di lentivirus viene impiegato per traducire le cellule grazie alla sua capacità di infettare efficacemente le cellule staminali murine ematopoietiche di Cas9 e di confezionare insieme il costrutto guida per l'espressione dell'RNA, i promotori, le sequenze regolatorie e i geni che codificano proteine reporter fluorescenti (ad esempio, GFP, RFP). Utilizzando questo metodo, è stata ottenuta l'editing genico ex vivo delle cellule staminali ematopoietiche del topo, seguita da una ricostituzione di successo del midollo osseo in topi letali irradiati10. Il vettore lentivirus impiegato per questo studio esprime i geni dei reporter Cas9 e GFP del comune promotore di EF1a con un sito di ingresso ribosomico interno a monte del gene del reporter. La sequenza di RNA guida è espressa da un promotore U6 separato. Questo sistema viene quindi utilizzato per creare mutazioni di inserimento e delezione nei geni del driver di ematopoiesi clonale candidati Tet2 e Dnmt3a10. Tuttavia, l'efficienza della trasduzione con questo metodo è relativamente bassa (-5%-10%) a causa delle grandi dimensioni dell'inserto vettoriale (13 Kbp) che limita l'efficienza della trasduzione e riduce il titro del virus durante la produzione.
In altri studi, è stato dimostrato che la dimensione più grande dell'RNA virale influisce negativamente sia sulla produzione di virus che sull'efficienza della trasduzione. Ad esempio, un aumento di 1 kb nella dimensione dell'inserto è segnalato per ridurre la produzione di virus del 50%, e l'efficienza della trasduzione diminuirà a più del 50% nelle cellule staminali ematopoietiche del topo11. Pertanto, è vantaggioso ridurre il più possibile le dimensioni dell'inserto virale per migliorare l'efficienza del sistema.
Questa lacuna può essere superata impiegando topi transgenici Cas9, in cui la proteina Cas9 è espressa in modo flessibile o inducibile12. I topi knock-in CRISPR/Cas9 di tipo constitutivo escludano Cas9 endonuclease ed EGFP dal promotore CAG presso il locus Rosa26 in modo onnipresente. Così, un costrutto con sgRNA sotto il controllo del promotore U6 e del gene reporter RFP sotto il controllo del promotore core EF1a può essere consegnato utilizzando il vettore lentivirus per ottenere l'editing del genoma. Con questo sistema, i geni delle cellule staminali ematopoietiche sono stati modificati con successo, mostrando un'efficienza di trasduzione del 90%. Pertanto, questo protocollo fornisce un metodo rapido ed efficace per creare topi in cui nel sistema ematopoietico mirate vengono introdotte mutazioni genetiche mirate. Mentre il nostro laboratorio utilizza prevalentemente questo tipo di tecnologia per studiare il ruolo dell'ematopoiesi clonale nei processi di malattia cardiovascolare13,14,15, è applicabile anche agli studi di ematologica malignità16. Inoltre, questo protocollo può essere esteso all'analisi di come le mutazioni del DNA nell'HSPC influiscono su altri processi di malattia o di sviluppo nel sistema ematopoietico.
Per stabilire un robusto sistema vettoriale di lentivirus, sono necessari elevati titoli virali di titro e condizioni ottimizzate per la trasduzione e il trapianto di cellule ematopoietiche. Nel protocollo vengono fornite istruzioni sulla preparazione di uno stock virale ad alto titolo titer nella sezione 1, ottimizzando le condizioni di coltura delle cellule staminali ematopoietiche murine nel paragrafo 2, i metodi per il trapianto di midollo osseo nella sezione 3 e la valutazione l'innesto nella sezione 4.
Protocollo
Tutte le procedure che coinvolgono soggetti animali sono state approvate dal Comitato istituzionale per la cura e l'uso degli animali (IACUC) dell'Università della Virginia.
1. Generazione e purificazione delle particelle di lentivirus
NOTA: Le particelle di Lentivirus contenenti la guida ottimizzata RNA possono essere prodotte dai protocolli dettagliati forniti da Addgene: . I metodi ottimizzati per la preparazione e lo stoccaggio del lentivirus ad alto titro sono discussi altrove17,18. In breve, i lentivirus sono prodotti dalla co-trasfezione di un plasmide vettoriale di lentivirus, psPAX2 e pMD2.G nelle cellule HEK 293T. Il supernatante culturale viene raccolto a 48 h dopo la trasfezione e concentrato dall'ultracentrifugazione. Il titro lentivirale è determinato da un saggio basato su qPCR disponibile in commercio. Questa procedura deve essere eseguita in un mobile di classe biosafety II.
- Preparare una soluzione 1:200 di collagene (0,0005%) in 1x PBS.
- Rivestire un piatto 6 con soluzione di collagene e incubare a 37 gradi centigradi, 5% CO2 per 30 min.
- Seme 293T cellule ad una densità di 1 x 106 cellule per pozzo e incubare a 37 C, 5% CO2 per 2 h.
- Per preparare la miscela di tre plasmidi di trasfezione per un pozzo, unire 0,9 g di vettore di lentivirus, 0,6 g di psPAX2 e 0,3 g di pMD2.G, quindi raggiungere un volume totale di 10 gradi aggiungendo acqua deionizzata. Regolare gli importi di conseguenza a seconda del numero di pozzi. La quantità e il rapporto di ogni plasmide potrebbe essere necessario ulteriormente ottimizzato per soddisfare le esigenze dei ricercatori.
- Aggiungere con attenzione 50 gradi l di 1x PBS e 5 -L del PEI MAX diluito (1,0 mg/mL) alla miscela di plasmide e incubare per 15 min a temperatura ambiente (RT) (Tabella 1).
- Aggiungere 1 mL di DMEM alla miscela.
- Aspirare i supporti della piastra 6, aggiungere 1 mL di miscela di plasmide, e incubare a 37 c, 5% CO2 per 3 h.
- Sostituire i supporti con 2 mL di DMEM fresco e incubare a 37 , 5% CO2 per 24 h.
- Aggiungere 1 mL di DMEM fresco e incubare a 37 c, 5% CO2 per un ulteriore 24 h (il tempo totale di incubazione è 48 h).
- Trasferire il supernatante di coltura in un tubo da 50 mL e centrifugare a 3.000 x g per 15 min per rimuovere eventuali cellule galleggianti libere.
- Filtrare il supernatante con un filtro da 0,45 m.
- Trasferire il filtrato in tubi di centrifuga di polipropilene.
- Ultracentrifuga a 4 gradi centigradi e 72.100 x g almassimo r per 3 h.
- Aspirare con cura il supernatante, lasciando dietro di sé il pellet bianco.
- Risospendere il pellet con 100 l di mezzo di espansione delle cellule ematopoietiche senza sèiliasenza di aerazione.
- Mantenere un'aliquota di 10 l- per misurare il titro virale e conservare tutti gli aliquote rimanenti a -80 gradi fino a quando richiesto.
- Dititta il virus con un saggio basato su qPCR secondo le istruzioni del produttore usando l'aliquota virale da 10 l.
2. Isolamento e trasduzione delle cellule lignaggio-negativo dal midollo osseo del topo (Figura 1A)
NOTA: In genere, per isolare un numero sufficiente di cellule, coppie di tibi, femore e humeri vengono raccolti da ogni mouse. Le ossa pelviche e spinali possono anche essere raccolte come fonte di cellule lignaggio-negative.
- Isolamento delle cellule del midollo osseo
- Eutanasia 8-10 settimana maschio CRISPR / Cas9 knock-in topi da 5% isoflurane seguiti da lussazione cervicale, quindi disinfettare la loro pelle con 70% etanolo.
- Utilizzando forbici dissettive, fare un'incisione trasversale nella pelle appena sotto la gabbia toracica e sbucciare la pelle distay in entrambe le direzioni per esporre le gambe e le braccia.
- Separare con cura gli arti inferiori dall'osso dell'anca dislocando l'articolazione dell'anca. Tagliare lungo la testa del femore per rimuovere completamente il femore dall'anca. Slocare il ginocchio e tagliare l'articolazione per separare il femore e la tibia, mantenendo intatta l'epifisi ossea. Dislocare l'articolazione della caviglia e staccare il piede e il muscolo in più.
- Utilizzando forbici dissecipanti, tagliare sopra la spalla per staccare gli arti superiori. Slocare la spalla, quindi tagliare l'articolazione del gomito per raccogliere l'osso omero.
- Utilizzare salviette di cellulosa-fibra per rimuovere con attenzione i muscoli dai femore, tibie, e humeri. Prendere ulteriori precauzioni per assicurarsi che le ossa non si rompano durante questo processo.
- Collocare le ossa isolate in un tubo conico da 50 mL contenente RPMI e metterle sul ghiaccio.
NOTA: i seguenti passaggi devono essere effettuati in un mobile di classe biosafety II. - Trasferire le ossa in un piatto sterile di 100 mm.
- Afferra l'osso con pinze smussate e usando forbici dissetanti, taglia con cura entrambe le epifisi.
NOTA: Un taglio insufficiente porterà ad un colore incompleto del midollo osseo, mentre il taglio eccessivamente aggressivo comporterà la perdita di cellule. - Riempire una siringa da 10 mL con RPMI ghiacciata e, utilizzando un ago da 22 G, lavare il midollo osseo dall'albero in un nuovo piatto di coltura da 100 mm.
NOTA: Le ossa diventeranno bianche e traslucide se l'albero osseo è stato ben lavato. In caso contrario, ri-tagliare le estremità dell'osso e lavare di nuovo. - Dopo che tutto il midollo osseo è stato raccolto, effettuare una sospensione a singola cella passando il midollo osseo più volte attraverso una siringa da 10 mL con un ago da 18 G. Ripetere 10 volte per garantire una sospensione a cella singola.
- Filtrare la sospensione cellulare attraverso un colino cellulare da 70 m in un tubo conico da 50 mL.
- Centrifuga a 310 x g per 10 min a 4 gradi centigradi.
- Aspirare il supernatante e risospendere i pellet cellulari in un volume appropriato di buffer di separazione ottimizzato per il seguente processo di separazione cellulare.
- Isolamento e trasduzione di lentivirus delle cellule lignaggio-negative
NOTA: Le cellule lignaggio-negative del topo sono isolate dal midollo osseo dei topi transgeniciCas9 3o da altri ceppi di topi, utilizzando un kit di deplezione del lignaggio secondo le istruzioni del produttore. Tipicamente, le cellule lignaggio-negativo rappresentano il 2%-5% delle cellule nucleate del midollo osseo intero, e la purezza è di solito maggiore del 90% dopo l'isolamento. Le cellule lignaggio-negativi isolate sono coltivate in misura di espansione delle cellule ematopoietiche senza siero, integrata con 20 ng/mL ricombinante murine TPO e 50 ng/mL ricombinante murine SCF, poi tradusse con il vettore lentivirus per 16 h ad una molteplicità di infezione (MOI) - 100.- Per isolare le cellule lignaggio-negative, utilizzare il kit di esaurimento delle cellule di lignaggio secondo le istruzioni del produttore.
- Dopo l'isolamento rimettere in sospensione le cellule lignaggio-negativo in 1 mL di mezzo di espansione delle cellule ematopoietiche senza siero.
- Semina le cellule in una piastra di 6 pozze a una densità di 1,5 x 106 cellule / mL (5 x 105 cellule negative di lignaggio / mouse.)
- Aggiungere murine TPO e SCF ricombinanti in pozzi a concentrazioni finali di 20 ng/mL e 50 ng/mL, rispettivamente.
- Cellule pre-incubate a 37 gradi centigradi nel 5% di CO2 per 2 h.
- Aggiungete la lentivirus a MOI: 100, 4 g/mL di polibrene e penicillina/streptomicina ai pozze e incubate a 37 gradi centigradi, 5% di CO2 per 16-20 h (Figura 1B).
- Il giorno seguente, raccogliere le cellule trandotte dal lentivirus in un tubo conico da 15 mL e centrifugare a 300 g per 10 min.
- Aspirare con attenzione il supernatante e risospendere il pellet in 200 -L di RPMI per mouse. Mantenere le cellule a RT fino al trapianto nei topi (sezione 3).
3. Trapianto di cellule trasdotte in topi immalari
- Il giorno del trapianto di midollo osseo, mettere i topi riceventi in una gabbia a torta a otto fette ed esporli a due dosi di irradiazione dell'intero corpo (550 Rad/dose, dose totale 1100 Rad), con circa 4 h tra ogni sessione di irradiazione.
- Dopo la seconda sessione di irradiazione, iniettare cellule transdotte dal lignaggio negativo a ciascun topo ricevente acuitotizzato tramite il plesso della vena retroorbitale (200 - L in totale) utilizzando una siringa di insulina (Figura 1C).
- Dopo l'irradiazione, i topi devono essere alloggiati in gabbie sterilizzate e dotati di una dieta morbida e acqua potabile integrata con antibiotici per 14 d.
- A 3-4 settimane dopo il trapianto di midollo osseo, analizzare il sangue periferico per verificare l'innesto di cellule donatrici trasdotte (sezione 4).
4. Valutare il chimerismo del sangue periferico
- Anestesizza i topi con il 5% di isoflurane e ottieni un campione di sangue da una vena retroorbitale usando tubi capillari e raccoglilo in tubi EdTA K2(il volume in un tubo capillare è sufficiente per il seguente assay).
- Trasferire 20 litri di sangue dai tubi K2EDTA nelle provette in polistirolo rotondo da 5 mL e mettere sul ghiaccio.
- Aggiungere 1,5 mL di tampone di lisi RBC per lise i globuli rossi. Incubare per 5 min sul ghiaccio.
- Per neutralizzare il buffer di lisi, lavare i campioni con buffer FACS (1,5 mL/campione).
- Centrifuga a 609 x g a rmax per 5 min a 4 gradi centigradi. Scartare il super-attardato.
- Incubare le cellule con un cocktail di anticorpi monoclonali (diluiti in 100 tamponati/campioni FACS) a RT per 20 min al buio. Un elenco completo degli anticorpi è disponibile nella sezione Materiali sopra riportata.
- Lavare le cellule una volta con buffer FACS (2 mL/campione). Centrifuga a 609 x g almassimo r (1.800 giri/ massimi) per 5 min a 4 gradi centigradi. Scarta reati il super-natante.
- Fissare le cellule con paraformaldeide contenente tampone di fissaggio (100 l/tubo) per 10 min a 4 gradi centigradi.
- Lavare le cellule una volta con il buffer FACS (3 mL/campione). Centrifuga a 609 x g almassimo r (1.800 giri/ massimi) per 5 min a 4 gradi centigradi. Scarta reati il super-natante.
- Sospendere il pellet in 400 l di buffer FACS.
- Conservare i campioni a 4 gradi centigradi fino all'analisi per citometria di flusso.
Risultati
Utilizzando il protocollo sopra descritto, sono stati ottenuti circa 0,8-1,0 x 108 cellule del midollo osseo per topo. Il numero di cellule lignaggio-negativo che otteniamo è di circa 3 x 106 celle per mouse. Tipicamente, la resa delle cellule del lingaggio-negativo del midollo osseo è del 4%-5% di quella delle cellule nucleari totali del midollo osseo.
Il chimerismo delle cellule trasdotte (RFP-positivo) è valutato dalla citometria di flusso del sangue periferico (Figura 2A,B). Il sangue è isolato dalla vena retroorbitale e vengono utilizzati marcatori appropriati per determinare l'identità di ogni popolazione di cellule ematopoietiche (ad esempio, neutrofili, monociti, cellule T, ecc.) (Figura 3A,B). Il DNA genomico può essere isolato dalle cellule del sangue positive RFP e sezioni del DNA del sito mirato possono essere amplificate dalla PCR e sottoclonate in vettori di clonazione TA per l'analisi della sequenza. Questi plasmidi sono tradotti in E. coli e le sequenze del sito di destinazione sono determinate dal sequenziamento di Sanger (Figura 4). In alternativa, le sequenze del sito di destinazione possono essere determinate con altri metodi, come il sequenziamento di Sanger del genoma raggruppato seguito dal monitoraggio degli indels mediante analisi di decomposizione (TIDE)10. Per la condizione di controllo, i topi vengono in genere trapiantati con cellule trasdotte con un lentivirus che esprime RNA guida non mirante.
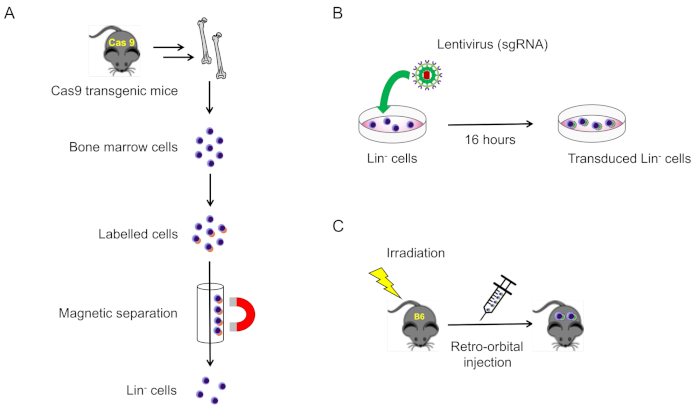
Figura 1: Illustrazione schematica di questo protocollo. (A) Isolamento delle cellule del midollo osseo-negativo di lignaggio da topi che esprimono Cas9 (sezione 2.1). (B) Trasduzione del lentivirus delle cellule lignaggio-negative (sezione 2.2). (C) L'iniezione retroorbitale di cellule transdotte in topi selvatici irradiati letale (sezione 3). Fare clic qui per visualizzare una versione più grande di questa figura.
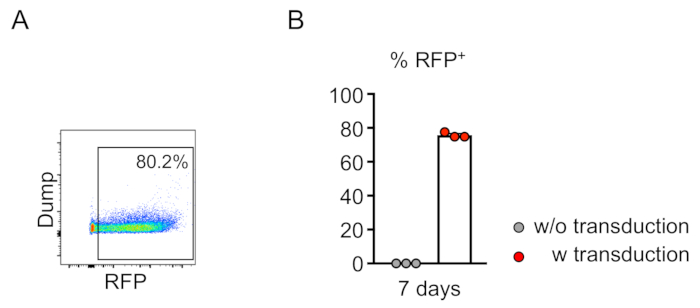
Figura 2: Trasduzione lentivirale efficiente delle cellule viloni-negative del vilingo del midollo osseo del topo in vitro. (A) L'analisi della citometria di flusso rivela la trasduzione riuscita delle cellule lignaggio-negative. L'analisi è stata eseguita dopo 7 giorni di cultura in vitro. (B) In media, il 75,7% delle cellule è stato transdotto in questo saggio (n - 3). Fare clic qui per visualizzare una versione più grande di questa figura.
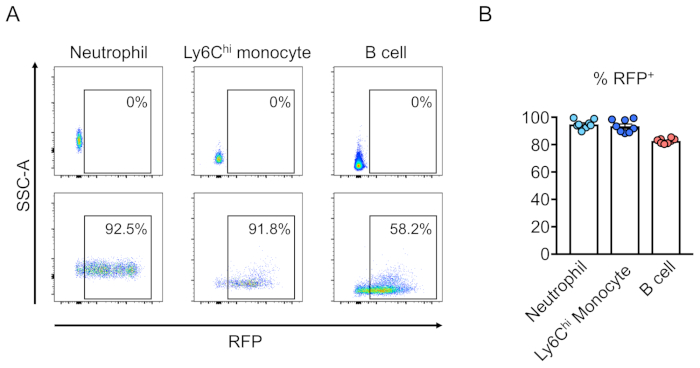
Figura 3:Ricostituzione del midollo osseo del topo irradiato letale da cellule transdotte di lignaggio-negativo. (A) Analisi della citometria di flusso del sangue periferico del topo dopo la ricostituzione da parte di cellule staminali ematopoietiche che erano (in basso) o non erano (in alto) trasdotte con lentivirus che esprimeva RFP. Neutrophils sono definiti come Ly6Ge Ly6Chi monociti come Ly6G- e Ly6C,e B cellule come CD45R. (B) In questi saggi, una media del 94,8%, 93,5% e 82,7% delle cellule sono RFP- nel neutrofilo, Ly6Chi monociti, e popolazioni di cellule B, rispettivamente (n . 8). Fare clic qui per visualizzare una versione più grande di questa figura.
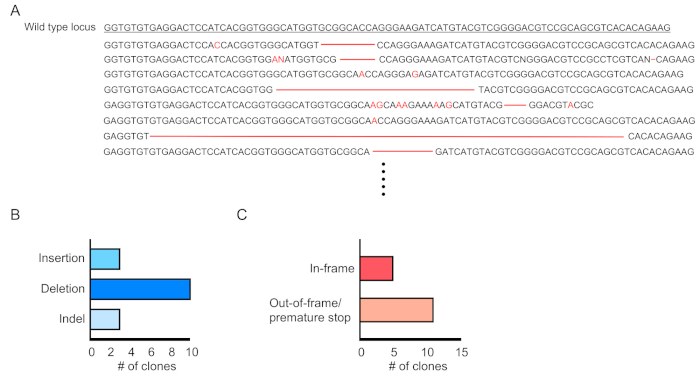
Figura 4:Valutazione dell'editing genico nelle cellule del sangue trasdotte. (A) Esempio di editing genico che mostra i risultati di sequenziamento del locus Dnmt3a mutato nelle cellule del sangue RPF-positive. Le eliminazioni vengono visualizzate come trattini rossi e gli inserimenti sono indicati con lettere rosse. (B) Riepilogo delle mutazioni rilevate. (C) Il 69% (11/16 cloni) ha mostrato mutazioni di arresto fuori fotogramma/arresto prematuro. Fare clic qui per visualizzare una versione più grande di questa figura.
| Plasmide | Dimensioni (bp) | Importo per pozzo (g) | rapporto |
| POTECNICO5.0 | 7700 | 0.9 | 2 |
| psPAX2 (in base al sistema psPAX2) | 10668 | 0.6 | 1 |
| pMD2.G | 5822 | 0.3 | 1 |
| PEI-max (magazzino: 100 mg/mL) | 5 L/pozzo | ||
Tabella 1: Quantità di plasmide e PEI-max utilizzate per la trasfezione.
Discussione
Il vantaggio di questo protocollo è la creazione di modelli animali che ospitano mutazioni specifiche nelle cellule ematopoietiche in modo rapido e altamente economico rispetto agli approcci transgenici murini convenzionali. Si è scoperto che questa metodologia consente la generazione di topi con manipolazioni geniche delle cellule ematopoietiche entro 1 mese. Ci sono diversi passaggi critici in questo protocollo che richiedono ulteriore considerazione.
Screening della sequenza di gRNA
Si raccomanda di testare i gRNA in vitro per valutare l'efficienza di editing prima di condurre esperimenti in vivo. L'efficienza dei gRNA viene testata utilizzando un sistema di trascrizione e screening in vitro senza cellule. Il gRNA trascritto viene convalidato misurandone l'efficienza nel fendere il DNA del modello in presenza di proteina Cas9 ricombinante, utilizzando l'elettroforesi del gel di agarose. I kit disponibili in commercio sono disponibili a questo scopo.
Qui, le mutazioni indel sono caratterizzate dalla clonazione TA di prodotti PCR amplificata dalla regione modificata, dalla trasformazione delle cellule batteriche con questi plasmidi e dalla raccolta di colonie individuali per il sequenziamento di Sanger. Tuttavia, questo metodo è laborioso e richiede molto tempo. In alternativa, il sequenziamento di nuova generazione (NGS) o il sequenziamento del DNA in pool seguito dall'analisi TIDE può essere eseguito19. L'algoritmo TIDE è stato creato per analizzare le tracce di sequenza Sanger generate da campioni complessi. È stato dimostrato che le stime indel con TIDE sono tipicamente coerenti con quelle NGS20off-targeted . Il software analitico è disponibile online all'indirizzo .
Generazione di particelle di lentivirus ad alto livello
La proteina G del virus della stomatite vesicolare virale, che è essenziale per l'infezione cellulare, è altamente sensibile al pH. Pertanto, è importante mantenere il mezzo di coltura all'interno di un intervallo di pH accettabile e non dovrebbe sviluppare un aspetto giallastro. I piatti rivestiti di collagene per la generazione di virus sono impiegati perché accelera l'attaccamento delle cellule HEK293T e consente le prestazioni di trasfezione entro poche ore, piuttosto che aspettare durante la notte. Tuttavia, a seconda del programma sperimentale, può anche essere considerata l'incubazione notturna.
Purificazione delle particelle di lentivirus
Per ottenere una trasduzione efficiente delle cellule staminali ematopoietiche, è necessario generare lentivirus ad alto tipo. L'ottimizzazione della velocità di centrifugazione è una caratteristica chiave. Mentre la concentrazione di lentivirus è di solito eseguita a 90.000 x g, diversi rapporti hanno dimostrato che il recupero del virus aumenta se il materiale è centrifuso alla velocità inferiore di 20.000 x g18. La produzione di preparazione di lentivirus ad alto titro senza ultracentrifugation è stato suggerito anche17. Va notato che è importante sospendere il pellet di centrifugazione virus evitando pipettaggio vigoroso per ridurre al minimo l'aerazione e mantenere l'integrità del virus. Le particelle di lentivirus ad alto titro sono necessarie per una trasduzione efficiente delle cellule staminali ematopoietiche11. Gli esperimenti pilota hanno rivelato che un MOI di 100 è ottimale per quanto riguarda l'efficienza della trasduzione e la vitalità cellulare. Si raccomanda di valutare le scorte di lentivirus sulla base della vitalità cellulare e dell'efficienza della trasduzione.
Immagazzinamento di particelle di lentivirus
Il titro del lentivirus è altamente sensibile alla temperatura e il tibieto può essere drasticamente ridotto da condizioni di conservazione inadeguate e cicli di congelamento-disgelo ripetuti. È stato riscontrato che l'efficienza di trasduzione del lentivirus diminuisce rapidamente se immagazzinata a 4 gradi centigradi [t(1/2) - 1,3 giorni] o sottoposta a più cicli di congelamento del congelamento [t(1/2) - 1,1 colpi]. Si raccomanda che i preparati del virus siano congelati a scatto in azoto liquido o ghiaccio secco tritato subito dopo la sospensione del pellet del virus. Gli stock virali devono essere mantenuti a -80 gradi centigradi e scongelati sul ghiaccio a RT appena prima dell'equilibratità e utilizzare11.
Si devono notare diverse limitazioni potenziali. In primo luogo, l'introduzione di mutazioni indel off-target da parte di CRISPR/Cas9 è stata a lungo apprezzata. È stato anche dimostrato che CRISPR/Cas9 può indurre mutazioni off-target in vivo21. In pratica, le mutazioni nell'interno fuori bersaglio possono essere evitate utilizzando sequenze di gRNA che sono strettamente corrispondenti ai siti del genoma bersaglio e hanno più di quattro disallineamenti rispetto ai siti secondari previsti. Tale disegno può essere fatto con esistente in strumenti in silico22. Sono disponibili altri strumenti di calcolo per prevedere il gRNA con azioni off-target ridotte al minimo ( o ). Può anche essere utile analizzare un modello animale utilizzando due o più gRNA diversi per confermare il fenotipo e ridurre al minimo la possibilità che il fenotipo osservato sia mediato da un effetto off-target di uno specifico gRNA.
Oltre alle mutazioni indel convenzionali create da CRISPR/Cas9, sono state segnalate delezioni più grandi che si estendono oltre i kilobase. Questo può confondere gli studi; tuttavia, queste eliminazioni più grandi sono segnalati per essere frequenza molto più bassa rispetto a indels23. Un altro potenziale problema è la compensazione genetica. È stato riferito che l'RNA mutante con un codone di terminazione prematura (PTC) può provocare l'upregolazione di geni correlati con somiglianza di sequenza da COMPASS complesso-mediato di trascrizione24,25. Questo evento è stato suggerito come un meccanismo che può portare a differenze fenotipiche tra approcci knock-out e knockdown di ablazione genica. Poiché l'editing del genoma mediato da CRISPR/Cas9 si basa fortemente sull'introduzione stocastica di mutazioni frame-shift che portano alla generazione di PTC, la compensazione genetica può modificare il fenotipo. Per evitare la compensazione genetica, si possono considerare esperimenti in cui le sequenze regolatorie di un gene sono prese di mira da CRISPR/Cas9 o dall'introduzione di modificatori epigenetici che utilizzano Cas9 come piattaforma di riconoscimento del DNA guidata dall'RNA.
Infine, va riconosciuto che l'ematopoiesi proveniente da cellule innevate in topi irradiati letale può differire dalle condizioni native dell'ematopoiesi. Inoltre, l'irradiazione può avere effetti sistemici sull'organismo che possono confondere l'interpretazione di esperimenti che esaminano le conseguenze delle mutazioni genetiche nelle cellule ematopoietiche.
I ricercatori hanno approfittato delle proteine Cas9 (dCas9) cataliticamente inattive come una "piattaforma di riconoscimento del DNA guidata dall'RNA" e hanno usato proteine di fusione dCas9 per localizzare i domini degli effetti in sequenze di DNA specifiche per reprimere (CRISPRi) o attivare (CRISPRa CRISPRa) trascrizione dei geni fuori bersaglio26,27. Mentre questo protocollo utilizza topi transgenici Cas9 catalmente attivi per introdurre la scissione del dsDNA nella sequenza genomica del DNA, la modifica epigenetica per reprimere o attivare geni specifici è applicabile fondendo dCas9 con domini modificatori di cromatina come dCas9-KRAB o dCas9-VP64, rispettivamente. In alternativa, dCas9 può essere utilizzato come repressore trascrizionale come proprio, bloccando i macchinari trascrizionali per l'accesso al sito genetico27. Più di recente, ha istituito i topi transgenici dCas9-SunTag-p65-HSF1 (SPH) che esprimono una versione modificata di un attivatore epigenetico fuso con dCas9 e hanno dimostrato che questo sistema CRISPRa è funzionale in vivo28.
Il nostro laboratorio utilizza principalmente questa tecnologia per studiare il ruolo dell'ematopoiesi clonale nei processi delle malattie cardiovascolari. Nel tessuto che prolifera, le mutazioni somatiche nei geni del conducente del cancro possono conferire un vantaggio di crescita cellulare e portare ad espansioni clonali aberranti. Nel sistema ematopoietico, questo processo è noto come "ematopoiesi clonale", e si traduce in situazioni in cui una frazione sostanziale dei leucociti di un individuo sono sostituiti da cloni mutanti. C'è un crescente apprezzamento del fatto che le espansioni clonali aberranti accelerano le malattie cardiovascolari, come l'aterosclerosi e l'insufficienza cardiaca, e contribuiscono alla morbilità e alla mortalità per tutte le cause15,29.
Recentemente, è stata documentata una connessione causale tra molte di queste mutazioni somatiche e malattie cardiovascolari, e gli aspetti dei meccanismi sottostanti sono stati chiariti10,13,14. Tuttavia, queste mutazioni somatiche rappresentano probabilmente la "punta dell'iceberg", poiché gli studi epidemiologici hanno dimostrato che molti geni candidati aggiuntivi sono associati all'ematopoiesi clonale e, potenzialmente, all'aumento della mortalità per le malattie cardiovascolari. Pertanto, è necessaria una valutazione sistematica e più elevata della velocità effettiva dei geni del driver dell'ematopoiesi clonale. Gli studi attuali sulla connessione causale dell'ematopoiesi clonale e delle malattie cardiovascolari si basano sull'analisi di topi con trapianto di midollo osseo specifico del sistema ematopoietico (Mx1-Cre, Vav-Cre, ecc.) o di topi dopo il trapianto di midollo osseo. Queste strategie, tuttavia, devono stabilire nuove colonie di topi e possono diventare un onere finanziario e fisico per i ricercatori. Pertanto, è giustificato un metodo più economico e più rapido rispetto all'approccio tradizionale murino transgenico/knock-out impiegato in passato. I vettori lentivirali per la traducimento delle tecnologie HSPC e CRISPR per ingegnerizzare le mutazioni, come descritto in questo manoscritto, facilitano lo studio dell'ematopoiesi clonale e delle malattie cardiovascolari.
Oltre a generare locus knock-out convenzionale, questo metodo è applicabile alla produzione di proteine mutate troncate. Ad esempio, i ricercatori hanno generato con successo un troncamento ematopoietico-Ppm1d, che è spesso visto in pazienti con ematopoiesi clonale, introducendo mutazioni frameshift con un esoscheletro di destinazione gRNA 6 del gene Ppm1d30.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
S. S. è stato sostenuto da una borsa di studio post-dottorato dell'American Heart Association 17POST33670076. K. W. era supportato dalle sovvenzioni NIH R01 HL138014, R01 HL141256 e R01 HL139819.
Materiali
| Name | Company | Catalog Number | Comments |
| RPMI Medium 1640 (1X) | Gibco | 11875-093 | Medium |
| Sulfamethoxazole and Trimethoprim injection | TEVA | 0703-9526-01 | |
| 1/2 cc LO-DOSE INSULIN SYRINGE | EXELINT | 26028 | general supply |
| 293T cells | ATCC | CRL-3216-- | Cell line |
| APC-anti-mouse Ly6C (Clone AL-21) | BD Biosciences | 560599 | Antibodies |
| APC-Cy7-anti-mouse CD45R (RA3-6B2) | BD Biosciences | 552094 | Antibodies |
| BD Luer-Lok disposable syringes, 10 ml | BD | 309604 | general supply |
| BD Microtainer blood collection tubes, K2EDTA added | BD Bioscience | 365974 | general supply |
| BD Precisionglide needle, 18 G | BD | 305195 | general supply |
| BD Precisionglide needle, 22 G | BD | 305155 | general supply |
| BV510-anti-mouse CD8a (Clone 53-6.7) | Biolegend | 100752 | Antibodies |
| BV711-anti-mouse CD3e (Clone 145-2C11) | Biolegend | 100349 | Antibodies |
| Collagen from calf skin | Sigma-Aldrich | 9007-34-5 | general supply |
| Corning Costar Ultra-Low Attachment Multiple Well Plate, 6 well | Millipore Sigma | CLS3471 | general supply |
| CRISPR/Cas9 knock-in mice | The Jackson Laboratory | 028555 | mouse |
| DietGel 76A | Clear H2O | 70-01-5022 | general supply |
| Dulbecco’s Modified Eagle’s Medium (DMEM) - high glucose | Sigma Aldrich | D6429 | Medium |
| eBioscience 1X RBC Lysis Buffer | Thermo fisher Scientific | 00-4333-57 | Solution |
| Falcon 100 mm TC-Treated Cell Culture Dish | Life Sciences | 353003 | general supply |
| Falcon 5 mL round bottom polystyrene test tube | Life Sciences | 352054 | general supply |
| Falcon 50 mL Conical Centrifuge Tubes | Fisher Scientific | 352098 | general supply |
| Falcon 6 Well Clear Flat Bottom TC-Treated Multiwell Cell Culture Plate | Life Science | 353046 | general supply |
| Fisherbrand microhematocrit capillary tubes | Thermo Fisher Scientific | 22-362566 | general supply |
| Fisherbrand sterile cell strainers, 70 μm | Fisher Scientific | 22363548 | general supply |
| FITC-anti-mouse CD4 (Clone RM4-5) | Invitrogen | 11-0042-85 | Antibodies |
| Fixation Buffer | BD Bioscience | 554655 | Solution |
| Guide-it Compete sgRNA Screening Systems | Clontech | 632636 | Kit |
| Isothesia (Isoflurane) solution | Henry Schein | 29404 | Solution |
| Lenti-X qRT-PCR Titration Kit | Takara | 631235 | Kit |
| Lineage Cell Depletion Kit, mouse | Miltenyi Biotec | 130-090-858 | Kit |
| Millex-HV Syringe Filter Unit, 0.45 mm | Millipore Sigma | SLHV004SL | general supply |
| PBS pH7.4 (1X) | Gibco | 10010023 | Solution |
| PE-Cy7-anti-mouse CD115 (Clone AFS98) | eBioscience | 25-1152-82 | Antibodies |
| PEI MAX | Polysciences | 24765-1 | Solution |
| Penicillin-Streptomycin Mixture | Lonza | 17-602F | Solution |
| PerCP-Cy5.5-anti-mouse Ly6G (Clone 1A8) | BD Biosciences | 560602 | Antibodies |
| pLKO5.sgRNA.EFS.tRFP | Addgene | 57823 | Plasmid |
| pMG2D | Addgene | 12259 | Plasmid |
| Polybrene Infection/Transfection Reagent | Sigma Aldrich | TR-1003-G | Solution |
| Polypropylene Centrifuge Tubes | BECKMAN COULTER | 326823 | general supply |
| psPAX2 | Addgene | 12260 | Plasmid |
| RadDisk – Rodent Irradiator Disk | Braintree Scientific | IRD-P M | general supply |
| Recombinant Murine SCF | Peprotech | 250-03 | Solution |
| Recombinant Murine TPO | Peprotech | 315-14 | Solution |
| StemSpan SFEM | STEMCELL Technologies | 09600 | Solution |
| TOPO TA cloning kit for sequencing with One Shot TOP10 Chemically Competent E.coli | Thermo fisher Scientific | K457501 | Kit |
| Zombie Aqua Fixable Viability Kit | BioLegend | 423102 | Solution |
Riferimenti
- Sasaki, Y., et al. Defective immune responses in mice lacking LUBAC-mediated linear ubiquitination in B cells. EMBO Journal. 32, 2463-2476 (2013).
- Ogilvy, S., et al. Transcriptional regulation of vav, a gene expressed throughout the hematopoietic compartment. Blood. 91, 419-430 (1998).
- Meyer, S. E., et al. DNMT3A Haploinsufficiency Transforms FLT3ITD Myeloproliferative Disease into a Rapid, Spontaneous, and Fully Penetrant Acute Myeloid Leukemia. Cancer Discovery. 6, 501-515 (2016).
- Kuhn, R., Schwenk, F., Aguet, M., Rajewsky, K. Inducible gene targeting in mice. Science. 269, 1427-1429 (1995).
- Cole, C. B., et al. PML-RARA requires DNA methyltransferase 3A to initiate acute promyelocytic leukemia. Journal of Clinical Investigation. 126, 85-98 (2016).
- Yang, H., et al. One-step generation of mice carrying reporter and conditional alleles by CRISPR/Cas-mediated genome engineering. Cell. 154, 1370-1379 (2013).
- Wang, H., et al. One-step generation of mice carrying mutations in multiple genes by CRISPR/Cas-mediated genome engineering. Cell. 153, 910-918 (2013).
- Quadros, R. M., et al. Easi-CRISPR: a robust method for one-step generation of mice carrying conditional and insertion alleles using long ssDNA donors and CRISPR ribonucleoproteins. Genome Biology. 18, 92 (2017).
- Miura, H., Quadros, R. M., Gurumurthy, C. B., Ohtsuka, M. Easi-CRISPR for creating knock-in and conditional knock-out mouse models using long ssDNA donors. Nature Protocols. 13, 195-215 (2018).
- Sano, S., et al. CRISPR-Mediated Gene Editing to Assess the Roles of Tet2 and Dnmt3a in Clonal Hematopoiesis and Cardiovascular Disease. Circulation Research. 123, 335-341 (2018).
- Cante-Barrett, K., et al. Lentiviral gene transfer into human and murine hematopoietic stem cells: size matters. BMC Research Notes. 9 (312), (2016).
- Chu, V. T., et al. Efficient CRISPR-mediated mutagenesis in primary immune cells using CrispRGold and a C57BL/6 Cas9 transgenic mouse line. Proceedings of the National Academy of Sciences of the United States of America. 113, 12514-12519 (2016).
- Fuster, J. J., et al. Clonal hematopoiesis associated with TET2 deficiency accelerates atherosclerosis development in mice. Science. 355, 842-847 (2017).
- Sano, S., et al. Tet2-Mediated Clonal Hematopoiesis Accelerates Heart Failure Through a Mechanism Involving the IL-1beta/NLRP3 Inflammasome. Journal of the American College of Cardiology. 71, 875-886 (2018).
- Sano, S., Wang, Y., Walsh, K. Clonal Hematopoiesis and Its Impact on Cardiovascular Disease. Circulatory Journal. 71, 875-886 (2018).
- Heckl, D., et al. Generation of mouse models of myeloid malignancy with combinatorial genetic lesions using CRISPR-Cas9 genome editing. Nature Biotechnology. 32, 941-946 (2014).
- Jiang, W., et al. An optimized method for high-titer lentivirus preparations without ultracentrifugation. Scientific Reports. 5, 13875 (2015).
- Cribbs, A. P., Kennedy, A., Gregory, B., Brennan, F. M. Simplified production and concentration of lentiviral vectors to achieve high transduction in primary human T cells. BMC Biotechnology. 13, 98 (2013).
- Brinkman, E. K., Chen, T., Amendola, M., van Steensel, B. Easy quantitative assessment of genome editing by sequence trace decomposition. Nucleic Acids Research. 42, e168 (2014).
- Sentmanat, M. F., Peters, S. T., Florian, C. P., Connelly, J. P., Pruett-Miller, S. M. A Survey of Validation Strategies for CRISPR-Cas9 Editing. Scientific Reports. 8, 888 (2018).
- Akcakaya, P., et al. In vivo CRISPR editing with no detectable genome-wide off-target mutations. Nature. 561, 416-419 (2018).
- Bae, S., Park, J., Kim, J. S. Cas-OFFinder: a fast and versatile algorithm that searches for potential off-target sites of Cas9 RNA-guided endonucleases. Bioinformatics. 30, 1473-1475 (2014).
- Kosicki, M., Tomberg, K., Bradley, A. Repair of double-strand breaks induced by CRISPR-Cas9 leads to large deletions and complex rearrangements. Nature Biotechnology. 36, 765-771 (2018).
- El-Brolosy, M. A., et al. Genetic compensation triggered by mutant mRNA degradation. Nature. 568, 193-197 (2019).
- Ma, Z., et al. PTC-bearing mRNA elicits a genetic compensation response via Upf3a and COMPASS components. Nature. 568, 259-263 (2019).
- Gilbert, L. A., et al. CRISPR-mediated modular RNA-guided regulation of transcription in eukaryotes. Cell. 154, 442-451 (2013).
- Qi, L. S., et al. Repurposing CRISPR as an RNA-guided platform for sequence-specific control of gene expression. Cell. 152, 1173-1183 (2013).
- Zhou, H., et al. In vivo simultaneous transcriptional activation of multiple genes in the brain using CRISPR-dCas9-activator transgenic mice. Nature Neuroscience. 21, 440-446 (2018).
- Fuster, J. J., Walsh, K. Somatic Mutations and Clonal Hematopoiesis: Unexpected Potential New Drivers of Age-Related Cardiovascular Disease. Circulatory Research. 122, 523-532 (2018).
- Kahn, J. D., et al. PPM1D truncating mutations confer resistance to chemotherapy and sensitivity to PPM1D inhibition in hematopoietic cells. Blood. , (2018).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon