Method Article
לנטינגיו CRISPR/Cas9 בתיווך הגנום עריכה לחקר התאים המטפאות במודלים למחלות
In This Article
Summary
תיאר הם פרוטוקולים עבור עריכת הגנום יעיל מאוד של גזע המטפאות מורקיים ומחולל קדמון (HSPC) על ידי מערכת CRISPR/Cas9 כדי לפתח במהירות מערכות מודל העכבר עם המטפאות ספציפיים שינויים גנים.
Abstract
מניפולציה גנים בתאי גזע המטבטיים באמצעות גישות הטרנסגנזה קונבנציונאלי יכול לגזול זמן רב, יקר, ומאתגר. נהנה מהתקדמות בטכנולוגיה לעריכת הגנום, מערכות משלוח וירוסים-מתווכת טרנסגנטית, שיטה יעילה וחסכונית מתוארת כאן כי קובע עכברים שבו הגנים מניפולציות במיוחד בתאי גזע המטפאות. השימוש בווירוסים משמשים כדי להפוך את Cas9-הביטוי השושלת-שלילי בתאי מח עצם עם מדריך RNA (gRNA) מיקוד גנים ספציפיים גן כתבת הקרינה האדומה (RFP), אז תאים אלה הם מושתלים לתוך לC57BL/6 עכברים. עכברים המושתלים עם הבעת וירוס לבטא gRNA לא המיקוד משמשים כפקדים. בתאום מראש של תאי גזע המטבטיים מוערכים על-ידי ניתוח ציטומטלי של דם היקפי של RFP-חיוביים. באמצעות שיטה זו, ~ 90% התמרה של תאים מיאלואיד ו ~ 70% של תאי הלימפה ב 4 שבועות לאחר ההשתלה ניתן להשיג. דנ א גנומית מבודדת מתאי דם RFP-חיוביים, וחלקים של ה-DNA באתר ממוקד מוגברת על ידי PCR כדי לאמת את עריכת הגנום. פרוטוקול זה מספק הערכה של תפוקה גבוהה של גנים המטפאות-רגולציה וניתן להרחיב למגוון מודלים של מחלת העכבר עם מעורבות תא המטפאות.
Introduction
מחקרים רבים ב המטולוגיה ואימונולוגיה להסתמך על הזמינות של עכברים מהונדסים גנטית, כולל עכברים קונבנציונאלי ומותנה/להקיש החוצה להשתמש בעכבר מערכת ספציפיים מנהלי המערכת כגון Mx1-היצור, ו-מונה, ואחרים . אחת,שתיים, שלוש,ארבע,חמש אסטרטגיות אלה דורשות הקמתה של זנים העכבר החדש, אשר יכול להיות זמן רב והורדה פיננסית. בעוד ההתקדמות המהפכנית בטכנולוגיית עריכת הגנום אפשרו את הדור של זנים העכבר החדש כמה ש3-4 חודשים עם המומחיות הטכנית המתאימה6,7,8,9 , הרבה יותר זמן נדרש כדי להגביר את מושבת העכבר לפני ניסויים רודפים. בנוסף, הליכים אלה יקרים. לדוגמה, מעבדת ג'קסון מפרטת את המחיר הנוכחי של שירותי הדור של עכברים שיצאו לשלב ב-$16,845 לכל מאמץ (כמו בדצמבר 2018). לכן, שיטות חסכוניות יותר ויעילות יותר מאשר גישות קונבנציונאלי מורגניים הינה יתרון רב יותר.
באשכולות באופן קבוע הכולל מרווח קצר הכולל/החלבון CRISPR המשויך החלבונים 9 (CRISPR/Cas9) הטכנולוגיה הובילה לפיתוח כלים חדשים עבור מהירה ויעילה RNA מבוססי, רצף ספציפי הגנום עריכה. התגלתה במקור כמנגנון החיסון בקטריאלי אדפטיבית להרוס את ה-DNA הפתוגן הפולש, crispr/Cas9 מערכת שימש ככלי כדי להגדיל את האפקטיביות של עריכת הגנום בתאים איקריוטית ודגמי בעלי חיים. מספר גישות המועסקים לשדר CRISPR/Cas9 מכונות לתאי גזע המטפאות (כלומר, אלקטרופורציה, נוקלאופיקציה, ליפופה, משלוח נגיפי, ועוד).
כאן, מערכת הנגיף מועסק כדי לשנות את התאים בשל יכולתה להדביק ביעילות Cas9-הבעת הפנים מורה בתאי גזע וחבילה יחד מדריך RNA ביטוי בונה, היזמים, רצפי רגולציה, וגנים לקודד חלבונים של כתב פלורסנט (כלומר, GFP, RFP). באמצעות שיטה זו, vivo gene לשעבר לעריכה של תאי גזע העכבר המטפאות הושג, ואחריו החוקה מוצלחת של מח עצם בעכברים לקרינה לעבר לבידוד10. וקטור לווירוס מועסק עבור מחקר זה מבטא את Cas9 ו GFP הכתב גנים מן היזם ליבה משותפת EF1a עם הכניסה הפנימי ריבוזומזיט במעלה מהגן העיתונאי. רצף ה-RNA המנחה מתבטא מיזם U6 נפרד. מערכת זו משמשת לאחר מכן כדי ליצור מוטציות הכניסה והמחיקה של המועמד השבטיים גנים מנהלי התקן Tet2 ו Dnmt3a10. עם זאת, יעילות התמרה באמצעות שיטה זו נמוכה יחסית (~ 5%-10%) בשל גודל גדול של הוספת וקטור (13 kbp) כי מגביל את היעילות התמרה ומפחית סיכוייו וירוס במהלך הייצור.
במחקרים אחרים, זה הוכח כי גודל גדול יותר של רנ א ויראלי שלילית משפיע על ייצור וירוס ויעילות התמרה. לדוגמה, גידול של 1 kb בגודל ההכנסה מדווח כדי להקטין את ייצור וירוסים על-ידי ~ 50%, ואת יעילות התמרה תפחית ליותר מ 50% בתאי גזע המטפאות11. לכן, זה יתרון כדי להקטין את הגודל של הכנס ויראלי ככל האפשר כדי לשפר את היעילות של המערכת.
הגרעון הזה יכול להתגבר על ידי שימוש בעכברים Cas9 טרנסגניים, שבו החלבון Cas9 מתבטא בצורה חוקתית או inducible בדרך12. העכברים כמובן/Cas9 טוק-in העכבר מבטא Cas9 endonuclease ו-EGFP מן היזם הקאג ב Rosa26 לוקוס באופן מקום. Thus, בונה עם sgRNA תחת השליטה של היזם U6 ו RFP גן העיתונאי תחת השליטה של היזם הליבה EF1a ניתן להעביר באמצעות וקטור הווירוס כדי להשיג את עריכת הגנום. בעזרת מערכת זו, הגנים של תאי גזע המטבטיים נערכו בהצלחה, מראה היעילות של ~ 90% התמרה. כך, פרוטוקול זה מספק שיטה מהירה ואפקטיבית ליצור עכברים שבו מוטציות גנים ממוקדות מוצגים לתוך המערכת המטתית. בעוד המעבדה שלנו היא בעיקר באמצעות סוג זה של טכנולוגיה כדי ללמוד את התפקיד של המטופאות שבטיים בתהליכי מחלות לב וכלי דם13,14,15, זה חל גם על מחקרים של המטולוגית ממאירות16. יתר על כן, פרוטוקול זה ניתן להרחיב לניתוח של איך מוטציות DNA ב HSPC השפעה מחלות אחרות או תהליכים התפתחותיים במערכת המטפאות.
כדי להקים מערכת חזקה וקטורית וקטורי, סיכוייו גבוהה ויראלי מניות ותנאים אופטימיזציה עבור התמרה והשתלת תאים המטפאות נדרשים. בפרוטוקול, הוראות מסופקות על הכנת מניות סיכוייו גבוהה ויראלי בסעיף 1, אופטימיזציה של תנאי התרבות של תאי גזע המטפי מורטין בסעיף 2, שיטות השתלת מח עצם בסעיף 3, והערכה בתיאום מקטע 4.
Protocol
כל ההליכים הכרוכים בנושאי בעלי חיים אושרו על-ידי הוועדה המוסדית לטיפול בבעלי חיים (IACUC) באוניברסיטת וירג.
1. יצירה וטיהור של חלקיקי וירוס
הערה: לאחר חלקיקי וירוס המכילים את מדריך מיטבי RNA ניתן לייצר על ידי הפרוטוקולים המפורטים המסופקים על ידי Addgene: < https://media.addgene.org/cms/files/Zhang_lab_LentiCRISPR_library_protocol.pdf) >. שיטות מיטוב להכנה גבוהה ולאחסון של וירוסים, נדונים במקום אחר17,18. בקצרה, הנגיף מופק על ידי שיתוף משותף של וקטור בינוני וקטורי psPAX2, ו-pMD2. G לתוך התאים HEK 293T. התרבות הסופרנטאנט נאסף ב-48 h לאחר ההעברה ומרוכז על ידי מעבר-החצייה. סיכוייו של הנגיף נקבע על-ידי שיטת המבוסס על qpcr הזמינה באופן מסחרי. הליך זה צריך להתבצע בקבינט השני של מחלקת הבטיחות.
- הכינו פתרון 1:200 של קולגן (0.0005%) ב-1x PBS.
- מעיל לוחית 6 היטב עם פתרון קולגן ו דגירה ב 37 ° צ', 5% CO2 עבור ~ 30 דקות.
- 293T בתאי הזרע בצפיפות של 1 x 106 תאים לכל טוב ומודטה ב 37 ° c, 5% CO2 עבור ~ 2 h.
- כדי להכין את התערובת של שלוש מפלסי הפלסטיק עבור אחד היטב, לשלב 0.9 μg של וקטור לווירוס, 0.6 μg של psPAX2, ו 0.3 μg של pMD2. G, לאחר מכן להשיג נפח כולל של 10 μL על ידי הוספת מים מיובים. התאם סכומים בהתאם למספר הבארות. הכמות והיחס של כל פלסמיד צריך להיות ממוטבת יותר כדי להתאים את צורכי החוקרים.
- בקפידה להוסיף 50 μL של 1 x PBS ו 5 μL של מדולל פיי מקסימום (1.0 mg/mL) כדי התערובת הפלבאמצע ו הדגירה של 15 דקות בטמפרטורת החדר (RT) (טבלה 1).
- הוסף 1 mL של DMEM לתערובת.
- מוסיף מדיה מ 6 צלחת הבאר, להוסיף 1 מ ל של תערובת פלביניים, ו דגירה ב 37 ° צ', 5% CO2 עבור ~ 3 h.
- החלף את המדיה עם 2 מ ל של DMEM טרי ו-הדגירה ב 37 ° c, 5% CO2 עבור 24 שעות.
- הוסף 1 מ ל של DMEM טרי ו-הדגירה ב 37 ° צ', 5% CO2 עבור 24 שעות נוספות (הזמן הדגירה הכולל הוא 48 h).
- העבר את התרבות supernatant לצינור 50 mL ו צנטריפוגה ב 3,000 x g עבור 15 דקות כדי להסיר את כל התאים צף בחינם.
- סנן את הסופרנטנט באמצעות מסנן של 0.45 יקרומטר.
- העבר את הפילטרט לצינורות צנטריפוגה פוליפרופילן.
- Ultracentrifuge ב 4 ° צ' ו 72,100 x g ב rמקסימום עבור 3 h.
- . משאיר מאחורי הגלולה הלבנה
- השהה מחדש את הגלולה עם 100 μL של מדיום הרחבת תא המטפאות ללא האנטנה.
- לשמור על 10 μl סדרת מחלקים כדי למדוד את סיכוייו נגיפי ולאחסן את כל סדרת מחלקים הנותרים בשעה-80 ° צ' עד הנדרש.
- Titrate את הווירוס עם שיטת qPCR מבוסס על פי הוראות היצרן באמצעות 10 μL ויראלי ויראלית.
2. בידוד והתמרה של שושלת היוחסין-תאים שליליים מתוך מח עצם העכבר (איור 1A)
הערה: בדרך כלל, כדי לבודד מספיק תאים, זוגות של הטיה, femurs, ו humeri הם קוצרים מכל עכבר. ניתן גם לקצור את עצמות האגן והשדרה כמקור לתאים שליליים.
- בידוד תאי מח עצם
- המתת חסד 8-10 שבוע הזכר CRISPR/Cas9 טוק-בעכברים על ידי 5% isof ane ואחריו פריקה צוואר הרחם, ואז לחטא את העור שלהם עם 70% אתנול.
- באמצעות ניתוח מספריים, לעשות חתך רוחבי בעור ממש מתחת לצלעות ולקלף את העור בשני הכיוונים כדי לחשוף את הרגליים והזרועות.
- הפרד בזהירות את הגפיים התחתונות מעצם הירך על ידי הפסקת המפרק הירך. חותכים לאורך ראש הירך כדי להסיר את עצם הירך לחלוטין מהמותן. לנתק את הברך ולחתוך במפרק כדי להפריד את עצם הירך ואת השוקה, תוך שמירה על עצמות העצם ללא פגע. להסיר את מפרק הקרסול ולקלף את הרגל ואת השריר המיותר.
- משתמש בחתך מספריים, לחתוך מעבר לכתף כדי לנתק את הגפיים העליונות. וחותכים במפרק המרפק. כדי לקצור את עצם הזרוע
- השתמש במגבונים תאית-סיבים כדי להסיר בזהירות את השרירים מן העצמות, הטייה, ו humeri. נקוט באמצעי זהירות נוספים כדי להבטיח שהעצמות לא ישברו במהלך תהליך זה.
- 50 מניחים את העצמות הבודדות לתוך צינורית RPMI mL בעלת מיקום מקומי, ומניחים על קרח.
הערה: יש לבצע את השלבים הבאים בארון ברמה של בטיחות II. - להעביר את העצמות לתוך מאכל סטרילי, 100 מ"מ התרבות.
- אחוז את העצם עם מלקחיים קהה, ושימוש במספריים לבתר, לחתוך בזהירות את שני האפיסים.
הערה: חיתוך מספיק יוביל לריקון לא שלם של מח עצם, בעוד חיתוך אגרסיבי מדי יגרום לאובדן תאים. - מילוי מזרק של 10 מ ל עם קרח קר RPMI, ושימוש 22 גרם מחט, לשטוף את מח העצם מן הפיר לתוך צלחת חדשה 100 mm התרבות.
הערה: עצמות יהפכו ללבנים ושקופים אם פיר העצם התרוקן היטב. אם לא, לחתוך מחדש את קצות העצם ולשטוף שוב. - לאחר כל מח העצם נאסף, לעשות השעיה תא יחיד על ידי העברת מח העצם מספר פעמים דרך מזרק 10 מ ל עם מחט 18 G. חזור על 10x כדי להבטיח השעיה לתא בודד.
- מסנן תא מושעה דרך מסננת תא 70 יקרומטר לתוך צינורית חרוט 50 mL.
- צנטריפוגה ב 310 x g עבור 10 דקות ב 4 ° c.
- לאחר מכן, השאר את הסופרנטאנט והשהה מחדש את כדוריות התאים בנפח מתאים של מאגר הפרדות ממוטב עבור תהליך הפרדת התא הבא.
- בידוד והתמרה וירוס של תאים שליליים
הערה: השושלת העכבר-תאים שליליים מבודדים במח העצם של עכברים Cas9 טרנסגניים3, או זנים אחרים של עכברים, באמצעות ערכת המחסור השושלת על פי הוראות היצרן. בדרך כלל, שלילי-תאים שליליים חשבון עבור 2%-5% של התאים השלמה של מח עצם, ואת הטוהר הוא בדרך כלל גדול יותר מ 90% בעקבות בידוד. השושלת המבודדת-תאים שליליים הם מתורבתים ללא סרום-בינונית הרחבת התא בינוני שיושלם עם 20 ng/mL רקומביננטי murine TPO ו 50 ng/mL רקומביננטי murine SCF, אז התמרה עם וקטור לווירוס עבור 16 h בריבוי של זיהום (מע) = 100.- לבידוד תאים שליליים של השושלת, השתמש בערכת המחסור בתא היוחסין לפי הוראות היצרן.
- לאחר בידוד להשהות את שושלת היוחסין-תאים שליליים 1 מ ל של סרום ללא ההטיות הרחבת התא בינוני.
- הזרע את התאים לתוך 6 צלחת הבאר בצפיפות של 1.5 x 106 תאים/mL (5 x 105 השושלת-תאים שליליים/עכבר.)
- הוסף רקומביננטי murine TPO ו SCF לתוך בארות בריכוזים הסופיים של 20 ng/mL ו 50 ng/mL, בהתאמה.
- התאים טרום הדגירה ב 37 ° צ' ב 5% CO2 עבור ~ 2 h.
- הוסף להוסיף וירוס ב-מוי = 100, 4 μg/mL polybrene, ו פניצילין/סטרפטומיצין כדי בארות ו-דגירה ב 37 ° צ', 5% CO2 עבור 16-20 h (איור 1b).
- ביום למחרת, לאסוף את התאים המתמרים לתוך 15 מ"ל שפופרת חרוטי ו צנטריפוגה ב 300 g עבור 10 דקות.
- והשהה מחדש את הגלולה ב-200 μL של RPMI לכל עכבר. שמור את התאים ב-RT עד השתלת לתוך עכברים (סעיף 3).
3. השתלת תאים שעברו התמרה לעכברים שעברו הקרינה
- ביום של השתלת מח עצם, הנמען במקום עכברים לתוך כלוב עוגה של שמונה פרוסות ולחשוף אותם לשתי מינונים של הקרנה הגוף כולו (550 Rad/מינון, סה כ המינון = 1100 Rad), עם כ 4 h בין הפעלה הקרנה.
- לאחר המפגש ההקרנה השני, הכנס התמרה שושלת-תאים שליליים לכל עכבר הנמען מורדם דרך מקלעת רטרו מסלולית וריד (200 μL בסך הכל) באמצעות מזרק אינסולין (איור 1C).
- לאחר הקרנה, עכברים צריכים להיות שוכנו בכלובים מעוקר וסיפק עם תזונה רכה ושתיית מים שנוספו עם אנטיביוטיקה עבור 14 ד.
- ב 3-4 שבועות לאחר השתלת מח עצם, לנתח דם היקפי כדי לבדוק את החרט של תאי תורם התמרה (סעיף 4).
4. הערכת כימנות של דם היקפי
- עכברים מורדם עם 5% isofלינה ולקבל דגימת דם מווריד מסלולית רטרו באמצעות צינורות קפילר, ולאסוף אותו לצינורות K2edta (הנפח בצינור נימי אחד מספיקה לצורך הבאות).
- העברה 20 μL של דם מצינורות K2EDTA לתוך 5 מ"ל התחתון עגול פוליסטירן מבחנות, ולשים על קרח.
- הוסף 1.5 mL של מאגר לפירוק RBC כדי לסדר כדוריות דם אדומות. מודקון למשך 5 דקות על הקרח.
- כדי לנטרל את מאגר הליזה, לשטוף דגימות עם מאגר FACS (1.5 mL/לדוגמה).
- צנטריפוגה ב 609 x g ב rמקסימום עבור 5 דקות ב 4 ° c. . מחק את הסופרנטאנט
- מודלת את התאים עם קוקטייל של נוגדנים חד שבטיים (מדולל ב-100 μL FACS מאגר/דגימה) ב RT עבור 20 דקות בחושך. רשימה מלאה של נוגדנים מסופקת בסעיף החומרים לעיל.
- שטוף את התאים פעם אחת עם מאגר FACS (2 mL/דוגמה). צנטריפוגה ב 609 x g ב rmax (1,800 rpm) עבור 5 דקות ב 4 ° c. . מחק את הסופרנטנט לחלוטין
- תקן את התאים עם פאראפורמלדהיד המכיל מאגר קיבעון (100 μL/tube) עבור 10 דקות ב-4 ° c.
- שטוף את התאים פעם אחת עם מאגר FACS (3 מ ל/דגימה). צנטריפוגה ב 609 x g ב rmax (1,800 rpm) עבור 5 דקות ב 4 ° c. . מחק את הסופרנטנט לחלוטין
- להשעות את הגלולה ב 400 μL של מאגר FACS.
- שמרו את הדגימות ב -4 ° צ' עד לניתוח על ידי שטהזרימה.
תוצאות
באמצעות הפרוטוקול המתואר לעיל, כ 0.8-1.0 x 108 תאים מח עצם לכל עכבר הושגו. מספר שושלת היוחסין-תאים שליליים שאנו משיגים הוא כ 3 x 106 תאים לכל עכבר. בדרך כלל, התשואה של שושלת מח העצם-תאים שליליים הוא 4%-5% מזה של תאים גרעיניים מח העצם הכולל.
כימריזם של תאי התמרה (RFP-חיובי) מוערך על ידי הסיילנסות של דם היקפי (איור 2A,B). בלאד מבודד מווריד רטרו-מסלולית וסמנים מתאימים משמשים כדי לקבוע את זהותו של כל האוכלוסייה תא המטפיאה (כלומר, נויטרופילים, מונוציטים, T תאים, וכו ') (איור 3 א,ב). דנ א גנומית יכול להיות מבודד מתאי דם RFP-חיוביים, וסעיפים של ה-DNA אתר ממוקד יכול להיות מוגבר על ידי PCR ו משוכפל לתוך וקטורים שיבוט TA עבור ניתוח רצף. הפלמידים הללו מיותמרים לתוך E. coli ורצפי אתר היעד נקבעים על-ידי רצף הרצפים של סאנגר (איור 4). לחילופין, היעד רצפי אתר יכול להיקבע על ידי שיטות אחרות, כגון רצף Sanger של הגנום במאגר ואחריו על ידי מעקב אחר הריקבון (הגאות) ניתוח10. עבור מצב הפקד, עכברים הם בדרך כלל מושתלים עם תאים המותמרים עם וירוס לבטא לא מיקוד מדריך RNA.
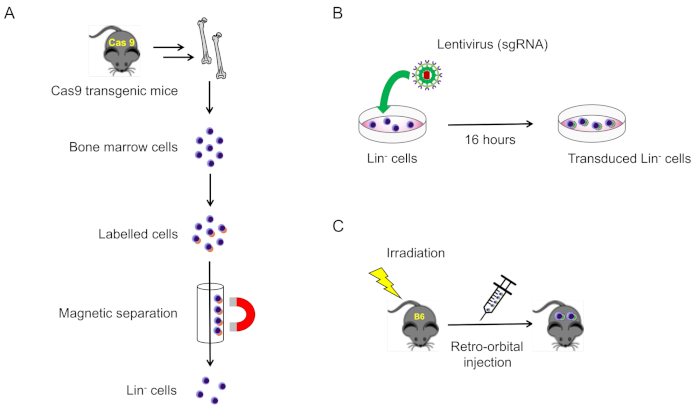
איור 1: איור סכמטי של פרוטוקול זה. (א) בידוד של שושלת היוחסין-תאים מח עצם שליליים מ Cas9-הבעת עכברים (סעיף 2.1). (ב) התמרה וירוס של שושלת היוחסין-תאים שליליים (סעיף 2.2). (ג) רטרו-הזרקה מסלולית של תאים מתתמרים לתוך עכברים מסוג פראי לקרינה הוקרן (סעיף 3). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
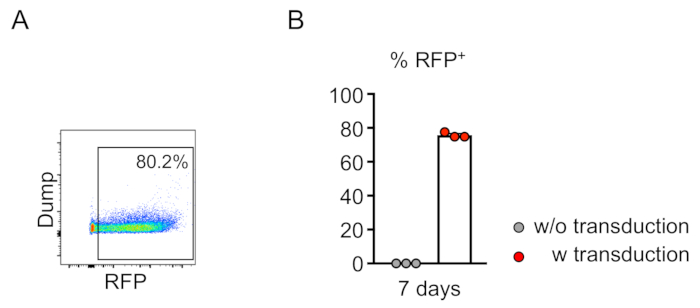
איור 2: התמרה ויראלית יעילה של מח עצם העכבר היוחסין-תאים שליליים בתוך מבחנה. (א) הזרימה הניתוח cy, מגלה התמרה מוצלחת של שושלת היוחסין-תאים שליליים. הניתוח נערך לאחר 7 ימים בתרבות החוץ-גופית. (ב) בממוצע, 75.7% מהתאים התעברו בתוך שיטת הפעולה (n = 3). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
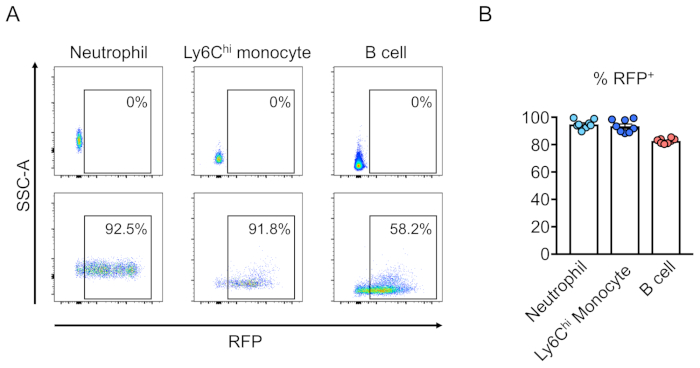
איור 3:החוקה של מח עצם העכבר שטרם הוקרן על ידי שושלת היוחסין-תאים שליליים. (א) זרימה cy, ניתוח של דם היקפי של העכבר לאחר החוקה על ידי תאי גזע המטפאות שהיו (למטה) או לא היו (למעלה) התמרה עם וירוס המבטא rfp. נויטרופילים מוגדרים כ Ly6G+ ו Ly6Chi מונוציטים כמו Ly6G- ו Ly6C+, ו B תאים כמו CD45R+. (ב) אלה מספר, ממוצע של 94.8%, 93.5%, ו 82.7% של תאים הם rfp+ ב נויטרופילים, Ly6Chi מונוציט, ו B אוכלוסיות תאים, בהתאמה (n = 8). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
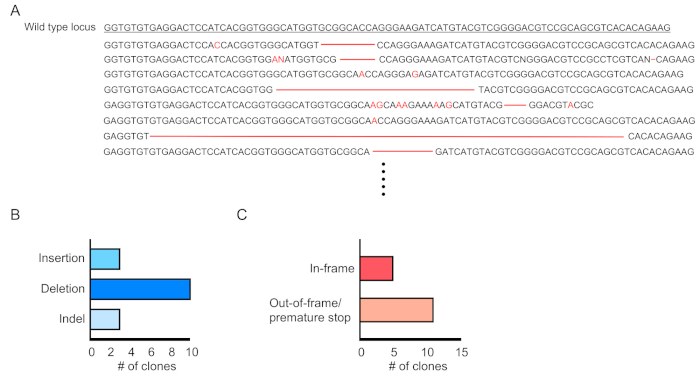
איור 4:הערכה של עריכת גנים בתאי דם מתתמרים. (א) דוגמה לעריכת גנים המציגה תוצאות ברצף של לוקוס Dnmt3a מוטציה בתאי דם rpf-חיוביים. מחיקות מוצגות כמקפים אדומים והוספות מסומנים באותיות אדומות. (ב) סיכום מוטציות שזוהו. (ג) 69% (11/16 שיבוטים) הראה מוטציות להפסיק מראש/מוקדם. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
| פלסמיד | גודל (bp) | סכום לכל באר (μg) | יחס |
| pLKO 5.0 | 7700 | 0.9 | 2 |
| psPAX2 | 10668 | 0.6 | 1 |
| pMD2. ג'י | 5822 | 0.3 | 1 |
| פיי-מקס (מניות: 100 מ"ג/mL) | 5 μL/ובכן | ||
שולחן 1: כמויות של פלביניים ו פיי מקס משמש לזיהום.
Discussion
היתרון של פרוטוקול זה הוא יצירת מודלים בעלי חיים מחסה מוטציות ספציפיות בתאי המטפאות באופן מהיר וחסכוני מאוד בהשוואה לגישות העכבר הקונבנציונלי הטרנסגניים. נמצא כי מתודולוגיה זו מאפשרת את הדור של עכברים עם תא המטפאות מניפולציות גנים בתוך חודש 1. בפרוטוקול זה קיימים מספר שלבים קריטיים המחייבים שיקולים נוספים.
הקרנת רצף gRNA
מומלץ לבדוק gRNAs ב מבחנה כדי להעריך את יעילות העריכה לפני התנהלות בניסויים vivo. היעילות של gRNAs נבדק באמצעות תא ללא שעתוק מבחנה ומערכת סינון. Grna שנוצר מאומת על ידי מדידת היעילות שלה ב-יקוע לעזוב את ה-DNA תבנית בנוכחות של חלבון רקומביננטי Cas9, באמצעות אגבה ג'ל אלקטרופורזה. ערכות מסחריות זמינות למטרה זו.
כאן, מוטציות indel מאופיינים על ידי שיבוט ה-TA של מוצרי ה-PCR מוגבר באזור ערוך, הפיכת תאים חיידקיים עם הפלמידים האלה, ולאסוף מושבות בודדות עבור רצף שלנגר. עם זאת, שיטה זו היא מפרך וגוזלת זמן. לחילופין, רצף הדור הבא (NGS) או רצפי DNA במאגר ואחריו ניתוח הגאות יכול להתבצע19. אלגוריתם הגאות נוצר כדי לנתח את העקבות רצף של סאנגר שנוצרו מדגימות מורכבות. זה הוכח כי indel הערכות עם הגאות הם בדרך כלל עקביים עם אלה מחוץ למוקד NGS20. התוכנה האנליטית זמינה באופן מקוון ב< http://tide.nki.nl >.
יצירת חלקיקי וירוס באיכות גבוהה
הווירוס stomatitis vesicular וירוס G-חלבון, אשר חיוני לזיהום התא, הוא מאוד רגיש pH. לכן, חשוב לשמור על מדיום התרבות בתוך טווח pH מקובל, ואין לפתח מראה צהבהב. מנות קולגן מצופה לדור וירוס מועסקים משום שהוא מאיץ את ההחזקה של תאים HEK293T ומאפשר ביצועים של העברה תוך כמה שעות, ולא מחכה לילה. עם זאת, בהתאם ללוח הזמנים הניסיוני, ניתן לראות גם דגירה של לילה.
טיהור חלקיקי הנגיף
כדי להשיג התמרה יעילה של תאי גזע המטבטיים, יש צורך לייצר וירוס מהיר-titer. אופטימיזציה של מהירות צנטריפוגה היא תכונה מפתח. בעוד ריכוז של הנגיף מבוצע בדרך כלל ב 90,000 x g, דיווחים מספר הראו כי שחזור וירוס מגביר אם החומר הוא centrifuged במהירות הנמוכה יותר של 20,000 x g18. הייצור של הכנה גבוהה-titer וירוס ללא מעבר הציע גם17. יש לציין כי חשוב להשעות את צנטריפוגה גלולה וירוס תוך הימנעות pipetting נמרץ כדי למזער את האנטנה ולשמור על שלמות וירוס. הרבה חלקיקי וירוס הגבוהה נדרשים עבור התמרה יעילה של תאי גזע המטפאות11. ניסויי הפיילוט התגלו כי משרד ה100 הינו אופטימלי ביחס ליעילות התמרה והכדאיות התאית. מומלץ להעריך את המניות של הנגיף על בסיס הכדאיות של התא ויעילות התמרה.
אחסנה של חלקיקי עדשה
סיכוייו הנגיף הוא רגיש מאוד לטמפרטורה, ואת סיכוייו ניתן לצמצם באופן דרסטי על ידי תנאי אחסון לא הולמים וחוזר על הקפאת ההקפאה מחזורים. זה נמצא כי יעילות התמרה של הנגיף מקטין במהירות כאשר מאוחסן ב 4 ° צ' [t (1/2) = 1.3 ימים] או נתון מחזורי הקפאת הקפאה מרובים [t (1/2) = 1.1 סיבובים]. מומלץ כי ההכנות וירוס להיות מוקפא בחנקן נוזלי או קרח יבש כתוש בזמן קצר לאחר גלולה וירוס מושעה. המניות ויראלי יש לשמור ב-80 ° צ' והופקר על קרח כדי RT רק לפני השפה הקודמת ולהשתמש11.
יש לציין מספר מגבלות פוטנציאליות. ראשית, המבוא של מוטציות indel מחוץ ליעד על ידי CRISPR/Cas9 כבר מוערך. זה גם הוכח כי CRISPR/Cas9 יכול לגרום מוטציות מחוץ למטרה ב vivo21. בפועל, מוטציות מחוץ למטרה ניתן להימנע באמצעות רצפי gRNA כי הם מתאימים היטב לאתרי הגנום היעד ויש להם יותר מארבעה אי התאמה לאתרים המשניים החזוי. עיצוב כזה יכול להיעשות עם הקיים כלים סיליקו22. כלים חישוביים אחרים לחיזוי gRNA עם ממוזער פעולות מחוץ ליעד זמינים (< http://portals.broadinstitute.org/gpp/public/analysis-tools/sgrna-design > או < http://www.Benchling.com >). זה עשוי גם להועיל לנתח מודל בעלי חיים באמצעות שניים או יותר gRNAs שונים כדי לאשר את הפנוטיפ ולמזער את האפשרות כי פנוטיפ נצפתה מתווכת על ידי השפעה מחוץ למטרה של Grnas ספציפי.
בנוסף מוטציות indel קונבנציונאלי שנוצרו על ידי CRISPR/Cas9, מחיקות גדולות יותר להאריך מעבר kb דווחו. זה יכול לבלבל את הלימודים; עם זאת, מחיקות גדולות אלה מדווחות בתדירות נמוכה בהרבה לעומת indels23. עוד בעיה פוטנציאלית. היא פיצוי גנטי זה דווח כי RNA מוטציה עם הסיום מוקדמת קודון (ptc) יכול לגרום לupregulation של גנים קשורים עם דמיון רצף על ידי מצפן קומפלקס בתיווך הפעלה של תמלול24,25. אירוע זה הוצע להיות מנגנון שיכול להוביל הבדלים פנוטימית בין להוריד את הגישות של אבלציה גנים. בגלל CRISPR/Cas9-תיווך הגנום עריכה בכבדות מסתמך על הקדמה סטוכסטי של מוטציות משמרת מסגרת שמובילה לדור של PTC, פיצוי גנטי יכול לשנות את הפנוטיפים. כדי להימנע מפיצוי גנטי, ניתן לראות ניסויים בהם רצפי הרגולציה של הגן מיועדים על ידי CRISPR/Cas9 או על ידי המבוא של מכפילי אפיגנטיים באמצעות Cas9 כפלטפורמה זיהוי DNA מונחה RNA.
לבסוף, יש להכיר בכך שהמטפיאה מתאים הנחלבת לתוך עכברים הניתנים לקרינה עשויה להיות שונה מהתנאים המקוריים של המטפיאה. יתר על כן, הקרנה יכולה להיות השפעות מערכתיות על האורגניזם שעשוי לבלבל את הפרשנות של ניסויים לבחון את ההשלכות גנים מוטציות בתאי המטפאות.
החוקרים לנצל את היתרונות של Cas9 בלתי פעיל מזרז (dCas9) חלבונים כמו "מונחה RNA זיהוי DNA פלטפורמת" ומשמש dCas9 היתוך חלבונים כדי להתאים את התחומים מחשבים כדי רצפי DNA ספציפיים כדי לדכא (CRISPRi) או להפעיל (Crispri) .שעתוק גנים מכוונים 26,27 בעוד פרוטוקול זה משתמש מזרז פעיל Cas9 העכברים הטרנסגניים להחדיר מחשוף dsDNA ברצף DNA גנומית, שינוי אפיגנטי לדכא או להפעיל גנים ספציפיים ישימה על ידי החדרת dCas9 עם תחומים כרומטין משנה כגון dCas9-KRAB או dCas9-VP64, בהתאמה. לחילופין, dCas9 יכול לשמש כדיכוי מדומה משלו, על ידי חסימת מכונות ההמרה לגישה לאתר הגן27. לאחרונה, ג'ואו ואח ' נוסדה dCas9-SunTag-p65-HSF1 (SPH) העכברים הטרנסגניים כי לבטא גרסה משתנה של אפיגנטי activator התמזגו עם dCas9 והראה כי מערכת CRISPRa זו תפקודית ב vivo28.
המעבדה שלנו משתמשת בעיקר בטכנולוגיה זו כדי ללמוד את התפקיד של המטפיאה שבטיים בתהליכי מחלות לב וכלי דם. ברקמה מתרבים, מוטציות סומטיים בגנים הנהג סרטן יכול להעניק יתרון הצמיחה הסלולר ולהוביל הרחבות שבטית חריגה. במערכת המטטית, תהליך זה ידוע בשם "המטופיאה שבטים", והוא יוצר במצבים בהם חלק ניכר מהלוציטים של האדם מוחלפים על ידי שיבוטים מוטציה. יש הערכה הולכת וגוברת כי הרחבות שבטים חריג להאיץ מחלות לב וכלי דם, כגון טרשת עורקים ואי ספיקת לב, ולתרום לתחלואה ואת כל גורם התמותה15,29.
לאחרונה תועד קשר סיבתי בין כמה מוטציות סומריות ומחלות לב וכלי דם, והיבטים של המנגנונים הבסיסיים הובהר מתאריך10,13,14. עם זאת, מוטציות אלה הסומטיים כנראה מייצגים את "קצה הקרחון", כמו מחקרים אפידמיולוגיים הראו כי רבים הגנים המועמדים הנוספים משויכים המטפיאה שבטיים, פוטנציאל, מוגבר תמותה מחלות לב וכלי דם. לכן, נדרש הערכת תפוקה שיטתית וגבוהה יותר של גנים של מנהלי התקן שבטיים. המחקרים הנוכחיים של הקשר הסיבתי של המטפיאה השפתית ומחלות לב וכלי דם מבוססים על ניתוח של עכברים עם מערכת מותנית ספציפית המטגניים מותנה (Mx1-היצור, ו-ויין, וכו ') או עכברים לאחר השתלת מח עצם. אסטרטגיות אלה, עם זאת, צריך להקים מושבות העכבר החדש עשוי להיות נטל פיננסי ופיזי עבור חוקרים. לפיכך, שיטה זולה ומהירה יותר מהגישה המקובלת והמעוברת של murine המועסקים בעבר מוצדקת. וקטורים מונגיריים כדי לשנות את טכנולוגיות HSPC ו CRISPR כדי מוטציות מהנדס, כפי שמתואר בכתב יד זה, להקל על המחקר של המטפיאה שבטיים ומחלות לב וכלי דם.
בנוסף ליצירת מקום היציאה הרגיל, שיטה זו ישימה לייצור חלבונים מוטציה חתוכים. לדוגמה, החוקרים יצרו בהצלחה לחיתוך המטכיפת-Ppm1d, הנתפסת לעתים קרובות בחולים עם המטופאות שבטיים, על-ידי החדרת מוטציות frameshift עם מיקוד של grna לאקסון 6 של הגן Ppm1d30.
Disclosures
. למחברים אין מה לגלות
Acknowledgements
S. S. היה נתמך על ידי האגודה האמריקנית לצדק בתר-דוקטורט 17POST33670076. ק. ו. נתמך על ידי NIH מענקים R01 HL138014, R01 HL141256, ו R01 HL139819.
Materials
| Name | Company | Catalog Number | Comments |
| RPMI Medium 1640 (1X) | Gibco | 11875-093 | Medium |
| Sulfamethoxazole and Trimethoprim injection | TEVA | 0703-9526-01 | |
| 1/2 cc LO-DOSE INSULIN SYRINGE | EXELINT | 26028 | general supply |
| 293T cells | ATCC | CRL-3216-- | Cell line |
| APC-anti-mouse Ly6C (Clone AL-21) | BD Biosciences | 560599 | Antibodies |
| APC-Cy7-anti-mouse CD45R (RA3-6B2) | BD Biosciences | 552094 | Antibodies |
| BD Luer-Lok disposable syringes, 10 ml | BD | 309604 | general supply |
| BD Microtainer blood collection tubes, K2EDTA added | BD Bioscience | 365974 | general supply |
| BD Precisionglide needle, 18 G | BD | 305195 | general supply |
| BD Precisionglide needle, 22 G | BD | 305155 | general supply |
| BV510-anti-mouse CD8a (Clone 53-6.7) | Biolegend | 100752 | Antibodies |
| BV711-anti-mouse CD3e (Clone 145-2C11) | Biolegend | 100349 | Antibodies |
| Collagen from calf skin | Sigma-Aldrich | 9007-34-5 | general supply |
| Corning Costar Ultra-Low Attachment Multiple Well Plate, 6 well | Millipore Sigma | CLS3471 | general supply |
| CRISPR/Cas9 knock-in mice | The Jackson Laboratory | 028555 | mouse |
| DietGel 76A | Clear H2O | 70-01-5022 | general supply |
| Dulbecco’s Modified Eagle’s Medium (DMEM) - high glucose | Sigma Aldrich | D6429 | Medium |
| eBioscience 1X RBC Lysis Buffer | Thermo fisher Scientific | 00-4333-57 | Solution |
| Falcon 100 mm TC-Treated Cell Culture Dish | Life Sciences | 353003 | general supply |
| Falcon 5 mL round bottom polystyrene test tube | Life Sciences | 352054 | general supply |
| Falcon 50 mL Conical Centrifuge Tubes | Fisher Scientific | 352098 | general supply |
| Falcon 6 Well Clear Flat Bottom TC-Treated Multiwell Cell Culture Plate | Life Science | 353046 | general supply |
| Fisherbrand microhematocrit capillary tubes | Thermo Fisher Scientific | 22-362566 | general supply |
| Fisherbrand sterile cell strainers, 70 μm | Fisher Scientific | 22363548 | general supply |
| FITC-anti-mouse CD4 (Clone RM4-5) | Invitrogen | 11-0042-85 | Antibodies |
| Fixation Buffer | BD Bioscience | 554655 | Solution |
| Guide-it Compete sgRNA Screening Systems | Clontech | 632636 | Kit |
| Isothesia (Isoflurane) solution | Henry Schein | 29404 | Solution |
| Lenti-X qRT-PCR Titration Kit | Takara | 631235 | Kit |
| Lineage Cell Depletion Kit, mouse | Miltenyi Biotec | 130-090-858 | Kit |
| Millex-HV Syringe Filter Unit, 0.45 mm | Millipore Sigma | SLHV004SL | general supply |
| PBS pH7.4 (1X) | Gibco | 10010023 | Solution |
| PE-Cy7-anti-mouse CD115 (Clone AFS98) | eBioscience | 25-1152-82 | Antibodies |
| PEI MAX | Polysciences | 24765-1 | Solution |
| Penicillin-Streptomycin Mixture | Lonza | 17-602F | Solution |
| PerCP-Cy5.5-anti-mouse Ly6G (Clone 1A8) | BD Biosciences | 560602 | Antibodies |
| pLKO5.sgRNA.EFS.tRFP | Addgene | 57823 | Plasmid |
| pMG2D | Addgene | 12259 | Plasmid |
| Polybrene Infection/Transfection Reagent | Sigma Aldrich | TR-1003-G | Solution |
| Polypropylene Centrifuge Tubes | BECKMAN COULTER | 326823 | general supply |
| psPAX2 | Addgene | 12260 | Plasmid |
| RadDisk – Rodent Irradiator Disk | Braintree Scientific | IRD-P M | general supply |
| Recombinant Murine SCF | Peprotech | 250-03 | Solution |
| Recombinant Murine TPO | Peprotech | 315-14 | Solution |
| StemSpan SFEM | STEMCELL Technologies | 09600 | Solution |
| TOPO TA cloning kit for sequencing with One Shot TOP10 Chemically Competent E.coli | Thermo fisher Scientific | K457501 | Kit |
| Zombie Aqua Fixable Viability Kit | BioLegend | 423102 | Solution |
References
- Sasaki, Y., et al. Defective immune responses in mice lacking LUBAC-mediated linear ubiquitination in B cells. EMBO Journal. 32, 2463-2476 (2013).
- Ogilvy, S., et al. Transcriptional regulation of vav, a gene expressed throughout the hematopoietic compartment. Blood. 91, 419-430 (1998).
- Meyer, S. E., et al. DNMT3A Haploinsufficiency Transforms FLT3ITD Myeloproliferative Disease into a Rapid, Spontaneous, and Fully Penetrant Acute Myeloid Leukemia. Cancer Discovery. 6, 501-515 (2016).
- Kuhn, R., Schwenk, F., Aguet, M., Rajewsky, K. Inducible gene targeting in mice. Science. 269, 1427-1429 (1995).
- Cole, C. B., et al. PML-RARA requires DNA methyltransferase 3A to initiate acute promyelocytic leukemia. Journal of Clinical Investigation. 126, 85-98 (2016).
- Yang, H., et al. One-step generation of mice carrying reporter and conditional alleles by CRISPR/Cas-mediated genome engineering. Cell. 154, 1370-1379 (2013).
- Wang, H., et al. One-step generation of mice carrying mutations in multiple genes by CRISPR/Cas-mediated genome engineering. Cell. 153, 910-918 (2013).
- Quadros, R. M., et al. Easi-CRISPR: a robust method for one-step generation of mice carrying conditional and insertion alleles using long ssDNA donors and CRISPR ribonucleoproteins. Genome Biology. 18, 92 (2017).
- Miura, H., Quadros, R. M., Gurumurthy, C. B., Ohtsuka, M. Easi-CRISPR for creating knock-in and conditional knock-out mouse models using long ssDNA donors. Nature Protocols. 13, 195-215 (2018).
- Sano, S., et al. CRISPR-Mediated Gene Editing to Assess the Roles of Tet2 and Dnmt3a in Clonal Hematopoiesis and Cardiovascular Disease. Circulation Research. 123, 335-341 (2018).
- Cante-Barrett, K., et al. Lentiviral gene transfer into human and murine hematopoietic stem cells: size matters. BMC Research Notes. 9 (312), (2016).
- Chu, V. T., et al. Efficient CRISPR-mediated mutagenesis in primary immune cells using CrispRGold and a C57BL/6 Cas9 transgenic mouse line. Proceedings of the National Academy of Sciences of the United States of America. 113, 12514-12519 (2016).
- Fuster, J. J., et al. Clonal hematopoiesis associated with TET2 deficiency accelerates atherosclerosis development in mice. Science. 355, 842-847 (2017).
- Sano, S., et al. Tet2-Mediated Clonal Hematopoiesis Accelerates Heart Failure Through a Mechanism Involving the IL-1beta/NLRP3 Inflammasome. Journal of the American College of Cardiology. 71, 875-886 (2018).
- Sano, S., Wang, Y., Walsh, K. Clonal Hematopoiesis and Its Impact on Cardiovascular Disease. Circulatory Journal. 71, 875-886 (2018).
- Heckl, D., et al. Generation of mouse models of myeloid malignancy with combinatorial genetic lesions using CRISPR-Cas9 genome editing. Nature Biotechnology. 32, 941-946 (2014).
- Jiang, W., et al. An optimized method for high-titer lentivirus preparations without ultracentrifugation. Scientific Reports. 5, 13875 (2015).
- Cribbs, A. P., Kennedy, A., Gregory, B., Brennan, F. M. Simplified production and concentration of lentiviral vectors to achieve high transduction in primary human T cells. BMC Biotechnology. 13, 98 (2013).
- Brinkman, E. K., Chen, T., Amendola, M., van Steensel, B. Easy quantitative assessment of genome editing by sequence trace decomposition. Nucleic Acids Research. 42, e168 (2014).
- Sentmanat, M. F., Peters, S. T., Florian, C. P., Connelly, J. P., Pruett-Miller, S. M. A Survey of Validation Strategies for CRISPR-Cas9 Editing. Scientific Reports. 8, 888 (2018).
- Akcakaya, P., et al. In vivo CRISPR editing with no detectable genome-wide off-target mutations. Nature. 561, 416-419 (2018).
- Bae, S., Park, J., Kim, J. S. Cas-OFFinder: a fast and versatile algorithm that searches for potential off-target sites of Cas9 RNA-guided endonucleases. Bioinformatics. 30, 1473-1475 (2014).
- Kosicki, M., Tomberg, K., Bradley, A. Repair of double-strand breaks induced by CRISPR-Cas9 leads to large deletions and complex rearrangements. Nature Biotechnology. 36, 765-771 (2018).
- El-Brolosy, M. A., et al. Genetic compensation triggered by mutant mRNA degradation. Nature. 568, 193-197 (2019).
- Ma, Z., et al. PTC-bearing mRNA elicits a genetic compensation response via Upf3a and COMPASS components. Nature. 568, 259-263 (2019).
- Gilbert, L. A., et al. CRISPR-mediated modular RNA-guided regulation of transcription in eukaryotes. Cell. 154, 442-451 (2013).
- Qi, L. S., et al. Repurposing CRISPR as an RNA-guided platform for sequence-specific control of gene expression. Cell. 152, 1173-1183 (2013).
- Zhou, H., et al. In vivo simultaneous transcriptional activation of multiple genes in the brain using CRISPR-dCas9-activator transgenic mice. Nature Neuroscience. 21, 440-446 (2018).
- Fuster, J. J., Walsh, K. Somatic Mutations and Clonal Hematopoiesis: Unexpected Potential New Drivers of Age-Related Cardiovascular Disease. Circulatory Research. 122, 523-532 (2018).
- Kahn, J. D., et al. PPM1D truncating mutations confer resistance to chemotherapy and sensitivity to PPM1D inhibition in hematopoietic cells. Blood. , (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved