Method Article
Ciliopathy Fare Mutant Kohlea Planar-Hücre-Polarite fenotipleri Değerlendirilmesi
Bu Makalede
Özet
Primary cilia influence various signaling pathways. The mammalian cochlea is ideal for examining planar cell polarity (PCP) signaling. Cilia dysfunction affects cochlear outgrowth, cellular patterning and hair cell orientation, readouts of PCP. Our goal is to analyze PCP signaling in mouse cochlea via phenotypic analysis, immunohistochemistry and scanning electron microscopy.
Özet
In recent years, primary cilia have emerged as key regulators in development and disease by influencing numerous signaling pathways. One of the earliest signaling pathways shown to be associated with ciliary function was the non-canonical Wnt signaling pathway, also referred to as planar cell polarity (PCP) signaling. One of the best places in which to study the effects of planar cell polarity (PCP) signaling during vertebrate development is the mammalian cochlea. PCP signaling disruption in the mouse cochlea disrupts cochlear outgrowth, cellular patterning and hair cell orientation, all of which are affected by cilia dysfunction. The goal of this protocol is to describe the analysis of PCP signaling in the developing mammalian cochlea via phenotypic analysis, immunohistochemistry and scanning electron microscopy. Defects in convergence and extension are manifested as a shortening of the cochlear duct and/or changes in cellular patterning, which can be quantified following dissection from developing mouse mutants. Changes in stereociliary bundle orientation and kinocilia length or positioning can be observed and quantitated using either immunofluorescence or scanning electron microscopy (SEM). A deeper insight into the role of ciliary proteins in cellular signaling pathways and other biological phenomena is crucial for our understanding of cellular and developmental biology, as well as for the development of targeted treatment strategies.
Giriş
Birincil kirpikler birçok memeli hücre yüzeyinden uzanan uzun bir mikrotübül göre uzantıları vardır. Birincil kirpikler sıklıkla hangi zaman hücre başına birden fazla var, hareketli kirpikler ile karıştırılmamalıdır ve Amacı membran yüzeyleri boyunca sıvıyı taşımak için vardır. Birincil sil, aksine, duyu rol kabul eder ve buna bağlı olarak aynı zamanda, duyusal kirpikler adlandırılır. Bir kez çoktan unutulmuş, bu organel son zamanlarda insan genetik hastalıklar 1 çok sayıda ile dernek sonucunda 'yeniden keşfedilen' olmuştur. İdeal bir sinyal organel olarak konumlandırılmış, birincil kirpik sayısız sinyal doku homeostazında ve hastalık değil, sadece önemli olan birçok yollar, aynı zamanda gelişim 2 sırasında düzenleyen gösterilmiştir.
kirpikler fonksiyon bozukluğu ile bağlantılı olduğu gösterilmiştir birinci sinyal yollarının bir düzlemsel hücre polarite (PCP) yol olarak da bilinen standart olmayan Wnt oldu > 3. Başlangıçta Drosophila tanımlanan bu sinyal çağlayan, embriyogenez için kritik öneme sahiptir; yakınsama ve uzatma işlemleri için özellikle ve epitel 4 düzleminde hücrelerin doğru yönlendirmesi için. Düzenleyici proteinler kümesi çekirdeğin sıralı sinyal sonuçta hücre iskeleti düzenlenmeleri yol açabilir ve bir düzlemde 5 epitel hücrelerinin koordine polarizasyon neden yönlü ipuçları çevirir. Yakınsama ve uzatma işlemi kesinlikle uzamasına koklear kanal ve doğru hücresel desenlendirme 6 için gereklidir. Bu PCP yolunun aktivasyonu yoluyla düzenlenir olarak, koklea PCP mutantlar en çarpıcı fenotipleri bir dağınık duyusal epitel 7 kısaltılmış koklear kanal olduğunu. Düzenlenir bu aydınlatılamamıştır gerekmektedir tam olarak nasıl olsa Benzer şekilde, aynı zamanda, kirpikler eksikliği fare mutantlar, böyle bir yakınsama ve uzatma fenotip 8,9 sergilerler.
yakınsama ve uzatma işlemleri koklear kanalın akıbet ve koklear kanal içinde duyusal epitel hücre desenlendirme için kritik olduğundan ve_content ">, gelişmekte olan koklea omurgalı gelişimi sırasında PCP sinyalizasyon incelemek için ideal bir organdır. organı Corti, koklear kanal, muntazam 10 çalışması kokleadaki için yönelik olmalıdır olmayan duyu destek hücreleri ve mechanosensory saç hücrelerinin oluşur hatları uzman duyusal epiteline verilen terim. mechanosensory saç hücreleri yani çünkü denir cuticular plaka uzanan stereociliary demetleri her duyusal saç hücre 11 (apikal yüzeyi). mechanosensation ve stereocilia olarak adlandırılması rağmen birincil dönüştürücüler gibi bu hareket, aslında modifiye aktin filament esaslı mikrovilluslar oluşmaktadır. her zikzak şeklinde saçlar içinde demet, stereocilia üç satır bir çok sipariş edilen ve düzenli pa düzenlenirBir merdiven durumda benzeri şekilde ttern. Gerçek mikrotübül göre sil, olarak adlandırılan kinocilia, stereociliary demetlerin 12 geliştirilmesi ve yönlendirme için gereklidir. her hücre üzerine tek kinocilium fiziksel stereocilia uzun satıra merkezi bitişik olarak bulunur stereocilia demetine takılır. Kinocilium kesin işlevi belirsizdir ve bir hipotez onlar mikrovillus 12 olgun olarak kinocilium şekle stereocilia 'çeker' olmasıdır. Omurgalılarda, koklea kinocilia geçici de yer alır ve 11,13,14 işitme başlangıcından önce farelerde saç hücrelerden geri.Ciddi kısaltılmış koklear kanallarda gelişen koklea sonuçlarında kirpikler tamamen kaybedilmesi yanlış oluşmuş ve stereociliary demetleri yanı sıra yanlış yerleştirilmiş bazal organları 8,9 mis odaklı. Fonksiyonel kirpik sadece siliyer aksonem oluşan değildir. cilia ile ilgili birçok proteinfonksiyonu, bazal vücut geçiş bölgesi ya da silier aksonem 15 olarak kirpikler-ilişkili alt etki alanları lokalize kompleksleri meydana gelir. sentrozom annesi centriole türetilen bazal vücut, hücre vücuda uzak cilium uzanan mikrotübüller için mikrotübül organize merkezidir ve hücre içi ticaretini yanı sıra siliyer ticaretini düzenleyen. Siliyer geçiş zonu siliyer fonksiyon siliyer bileşiklerinin 16 ithalat ve ihracat organize bakımından düzenlenmiştir başka bölgedir.
Kesin mekanizması 17 belirsiz olmasına rağmen birçok çalışma, kirpikler ve kurallı olmayan Wnt (PCP sinyal) arasında bir bağlantı tespit ettik. Silier ve PCP genlerinin yedekleme ve genelleştirilmiş hücresel anormallikler hücre polarite duyarlılığı, zor doğrudan PCP özgü açıkları bir mutasyon bağlantı yapmak. PCP sinyalizasyon okuma çıkışları biri bazal vücut ve Primar konumlandırma olduğunuy kirpik, bu nedenle ikincil kusurları birincil yavru zordur. Zebra balığı ve fare mutantlar Bazı çalışmalar 18-20 sinyalizasyon kirpikler ve Wnt arasında bir bağlantı olduğunu ileri sürmüştür. verilerdeki Farklılıklar türler, doku ya da Wnt sinyal yolunda siliyer katkıları temporal bağımlı farklılıkları yansıtıyor olabilir. bazal organları işlevsel kalır Ayrıca, eğer normal bir Wnt yanıt muhafaza edilebilir. hücresel sinyal yolları ve diğer biyolojik olayların içinde siliyer proteinlerinin rolü daha derin bir anlayış bizim hücresel ve gelişimsel biyoloji anlayışı yanı sıra hedeflenen tedavi stratejilerinin geliştirilmesi için için çok önemlidir.
Protokol
Kullanın ve en yaygın CO 2 inhalasyon ve servikal dislokasyon yoluyla kurumsal ve toplum kurallarına ve yönetmeliklere uygun olarak tüm hayvanları euthanize.
Reaktiflerin 1. Hazırlık
NOT: Ön başına, analitik dereceli kimyasallar kullanarak tüm reaktifler hazırlamak. Aksi belirtilmediği sürece distile moleküler sınıf ve deiyonize su kullanarak çözümler olun.
- Fosfat tamponlu tuzlu su (1 x PBS): H2O, 1 L PO 4 8g NaCI, 0.2 g KCI, 1.44 g Na 2 HPO 4 ve 0.24 g KH 2 eritilerek 1x PBS 1 L yapmak HCI ile pH 7.4 ayarlayın. PBS steril olması gerekmez ve oda sıcaklığında saklanabilir. Bu tampon CaCI2 ya MgCl2 olmadan unutmayın.
- Paraformaldehit (% 4 PFA) bir havalandırılan bir duman başlığı içinde 1x PBS PFA bir% 4 çözelti hazırlayın. 1x PBS 1 L paraformaldehid tozu 40g ekleyin. C yaklaşık 60 °, heyecan ve ısı çözmek için,ve yavaş yavaş NaOH pH değerini yükseltmek için damla damla ekleyin. Toz çözündükten sonra, HCI ile pH 7.4 yeniden ayarlayın. 0.45 um'lik bir filtreden filtre edin ve alikotları dondurma. her bir deney için taze bir kısım defrost.
- Triton tamponu: 0.1 M Tris-HCl hazırlama (pH 7.5), 0.15 M NaCl, 0.1 M Tris-HCI (pH 7.5), 1 L 8.77 g NaCl çözülmesiyle% 0.1 Triton X-100 çözeltisi. 1 ml Triton X-100 ilave edin. eritmek için karıştırın. Oda sıcaklığında saklayın Triton tampon.
- Triton bloğu: Triton tamponu 9 ml keçi serumu ile 1 ml ekleyerek Triton tamponu içinde% 10 keçi serumu hazırlayın. 4 ° C'de saklayın. engelleme adım için Triton bloğu 200'de 1 dilusyondaki anti-fare IgG Fab parçalayan keçi ekleyin fare kaldırdı birincil antikorlar kullanılarak edin.
NOT: planlama taramalı elektron mikroskobu (SEM) için örnekler kullanmak durumunda aşağıda listelendiği gibi ek reaktifler hazırlamak. - kalsiyum ve magnezyum ile Hanks Dengeli Tuz Çözeltisi (HBSS), bir stok çözeltiden seyreltilmesi ile HBSS 1x çözeltisi yapmaksteril damıtılmış H2O içinde HBSS tampon yapmak için karmaşık ve riskleri vardır gibi, bir premade 10x stok solüsyonu sipariş tavsiye edilir. Rutin olarak kullanılan tampon HBBS nihai konsantrasyonu, aşağıdaki gibidir: 1.26 mM CaCl2, 0.49 mM MgCl2 -6H2O, 0.41 mM MgSO 4 -7H2O, 5.33 mM KCI, 0.44 mM KH 2 PO 4, 4.17 mM NaHCO 3, 137,93 mM NaCI , 0.34 mM Na 2 HPO 4, 5.56 mM dekstroz.
- Hepes tamponu: 1 L 1 x HBSS tamponu içinde 23.8 g HEPES çözülmesiyle, 1x HBSS 0.1 M Hepes çözeltisi hazırlayın.
- Taramalı elektron mikroskopisi fiksatif (SEM ayarı): Hepes tampon maddesi içinde elektron mikroskobu notu glutaraldehit (% 2.5) ve paraformaldehit (% 4) seyreltilmesi ile SEM fiksatif hazırlayın. 10 mM'lik nihai bir konsantrasyona kadar CaCl2 ekleyin.
- % 1 osmiyum tetroksit (OsO 4) Hepes tampon içinde; % 1 osmiyum tetroksit su: Hepes tampon maddesi içinde ozmiyum tetroksit stok çözeltisi ile seyreltilir ve separatelSteril y% 1 bir son konsantrasyona kadar, O H2 damıtıldı. Osmiyum tetroksit çok zehirlidir ve en yaygın olarak% 4 çözeltisi olarak satılmaktadır.
- (Ağırlık / hacim) tannik asit,% 1: 50 ml 0.5 g tannik asit çözündürülür steril damıtılmış H2O Filtre 0.45 gözenek boyutu filtre içinden filtre ederek sterilize edin.
- Dereceli etanol çözeltisi seriye ait: 30, 50, 70, 90 ve% 95 etanol solüsyonlar yapmak üzere steril damıtık H2O ile 200 derece etanol ile seyreltilir. son etanol durulama için,% 100 etanol 200 derece gereklidir. Nihai durulama için 200 derece etanol taze açılmış şişe kullanın.
Doku 2. Choice
- İdeal olarak, embriyonik gün 16.5 (E16.5) ve doğum sonrası 3. günde (P3) yaşları arasındaki embriyo ya da genç yavrular inceleyin.
NOT: kemikli labirent ve temporal kemiklerin kemikleşme fareler olgun olarak diseksiyonu giderek daha zorlu hale getirir. Ayrıca kinocilia, tek gerçek mikrotübül tabanlı kirpik, koklear saç hücreleri üzerinde bulunangelişimi sırasında geri çekilir ve bundan sonra, yetişkin farelerde bulunur. - Tespit edildikten sonra, decalcify yetişkin cochleae. Dönme 4 gün - 3 mikrosantrifüj tüpü içinde, 2 ml EDTA (PBS içinde% 4.13), pH 7.3 içinde (bölüm 3) kemik labirenti, kesilerek bir yer. Günlük EDTA yenileyin. dokular yumuşatılmış sonra artan çalkalama ile nutator 5 dakika boyunca 1.5 ml ya da daha fazla PBS 3 kez yıkayın.
3. Cochlea Diseksiyon
- Servikal dislokasyon veya CO 2 inhalasyon yoluyla Gönder euthanization (% 100 CO 2), baş kaldırmak. burun başlayan ve kaudal uzanan sagital orta hat boyunca baş incelemek için, hayvanın büyüklüğüne bağlı olarak, bir makas neşter bıçak ya da küçük bir çift kullanın. Forseps bir çift ile kafatası her yarısından itibaren beyin çıkarın. Iç kulağın gelişen kemik labirentler ihtiva zamansal kemikler, tespit (Şekil 1A ok bakınız).
- için bir çift kullanınceps dikkatlice kafatası (temporal kemik) den kemik labirentler izole etmek. bir mikroskop altında bunu yapın. kemik labirentler altında hafifçe forseps çalıştırarak kafatası kemik doku uzak bastırınız. yukarı P4 hayvanlarda kemik labirentler hala kıkırdak ve kolayca bozmadan çıkartılabilir.
- diseksiyon ardından, oval ve yuvarlak pencereler temizlemek ve koklear spiral tepesinde küçük bir delik yapmak için diseksiyon forseps ucunu kullanın. Koklear kanal daha diseksiyonu önce kemik labirentler sabitleyin. (3.7 bakınız) örtü oluşturan membran kolay çıkartılması için izin vermek için, buz üzerinde 5 dakika boyunca 1.5 ml% 4 PFA kemik labirentler düzeltin.
NOT: örtü oluşturan membranın çıkarılması gerekli değilse, daha uzun fiksasyon (bakınız 4.1 - 4.3) tavsiye edilir. önce koklear kanal diseksiyon temporal kemiklerin kısa sabitleme diseksiyonu süreci ve örtü oluşturan membran kaldırılmasını yardımcı olur. Mesaj diseksiyon ve Corti organı maruz kalma, furtOnun tespit gereklidir. - Dahası aşağıdaki gibi koklear duyusal epitel maruz kemik labirentler teşrih. diseksiyon kolaylaştırmak için PBS içeren siyah silikon Elastomer kaplı diseksiyon çanak kemik labirentler yerleştirin. Gerekirse doku hareketsiz kılınması için minutien işaretçilerini kullanın. minutien işaretçilerine kullanmak için, yukarı bakacak şekilde koklear spiral ventral yönü ile kemik labirentler vestibüler bölümü boyunca koyun.
NOT: Siyah silikon Elastomer çanak: opak siyah renk elde etmek için toz kömür ile silikon Elastomer taban bileşeni karıştırın. sertleştiriciyi ve bir ya da daha fazla Petri kutularına (cam veya plastik) dökün. vakum altında kuru hava kabarcığı kaldırmak için. Kuru yemekler kullanımı tamamen önce. - ince forseps (# 5) koklear kanal açığa dış kıkırdak kaldırmak için kullanın. oval pencereye başlayın; oval pencere içine forseps alt ucu yerleştirin ve yavaşça yavaşça doğru yukarı hareket, kıkırdak açmak gözetlemektepesi.
- koklear kanalın maruz kaldıktan sonra, ventral yüzeyi, Reissner en membran kaldırmak. Koklear kanal dibinde Reissner en membran çimdik ve yukarı hareket onu kalkmasına forseps iyi bir çift kullanın. duyusal epiteli de dahil olmak üzere, koklear kanal dorsal yönünü gözünüzde canlandırın.
- (Isteğe bağlı), aşağıda tarif edildiği gibi örtü oluşturan membran çıkarın. SEM veya kinocilium bir immünohistokimya veya stereociliary demetleri örtü oluşturan membran kaldırmak.
- koklea dibinde örtü oluşturan membran çimdik ve apeks doğru yukarı soyma forseps (55. veya daha ince) bir çok ince çifti kullanın.
NOT: örtü oluşturan zar zor tespit kılan optik açıktır. Çoğu zaman daha fazla zar tek parça halinde çıkıyor ve kolayca görüntülenmiştir olmamasına rağmen o Corti maruz organ çıkardı olarak, bir direnç hissedebilirsiniz. - Corti organı açığa sonra, daha fazla d olarak doku çözmekAşağıda escribed. Dokuların daha fazla hazırlanmasına yardımcı olmak için vestibüler bölgeyi saklayın.
4. Sabitleme
- Düzenli immünohistokimya için 2 saat süreyle bir nutator 4 ° C'de 1.5 ml% 4 PFA disseke kemik labirentler düzeltmek.
NOT: uzunluk ve tespitin bileşimde antikor ve antijenler, varyasyonları, farklı hassasiyet gerekli olabilir ve her bir antikor için optimize edilmelidir. - Tespit edildikten sonra, yüksek çalkalama ile nutator 5 dakika boyunca 1.5 ml ya da daha fazla PBS 3 kez durulayarak örnekleri yıkayın. Örnekler işleme önce birkaç hafta boyunca 4 ° C'de PBS içinde saklanabilir.
- SEM için numune hazırlanması durumunda, oda sıcaklığında 2 saat (1.7 bakınız) SEM düzeltme zamansal kemikler disseke düzeltme. 1.5 ml ya da daha fazla Hepes tamponu artan çalkalama ile nutator 5 dakika boyunca 3 kez durulama ile yıkayın. daha sonra işlenene kadar 4 ° C'de Hepes tamponu içinde depolayın. Haftanın daha uzun bir çift için depolamas tavsiye edilmez.
5. İmmünhistokimya
- Düz dipli, 96 gözlü plakanın bir kuyuda parçalara örnekler üzerinde immünohistokimya gerçekleştirin. Alternatif olarak, bir PCR veya ependorf tüp kullanın. Işleme kolaylaştırmak için kemik labirent vestibüler bölümünü korumak için tavsiye edilir.
- yumuşak çalkalama ile nutator oda sıcaklığında 1 saat için 1.5 ml Triton tamponu içinde inkübe edilerek doku geçirgenliği.
- Oda sıcaklığında 1 saat, en az 0.5 ml Triton bloğunda inkübe edilerek doku bloğu. Fare büyüdü birincil antikorlar kullanılarak ise 200'de 1 dilusyondaki (bölüm 1.4) de blok anti-fare IgG Fab fragmanları ekleyin. Bu büyük ölçüde farede anti-fare IgG'nin spesifik olmayan bağlanmayı azaltır.
- yavaşça sallanarak 4 ° C'de Triton blok O / N seyreltilmiş primer antikorlar ile doku inkübe edin. Antikor seyreltme kullanılan antikorların (bakınız bölüm 6.1) bağlıdır. Alternatif birincil Antikorların inkübeOda sıcaklığında 2 saat süre ile s. İdeal olarak, 0.5 mi, birincil antikor seyreltme minimum hacmi kullanın. Antikor sınırlı ise, tamamen dokuyu saran antikor seyreltme küçük hacmi kullanın.
- artan çalkalama ile nutator, 1.5 ml ya da daha fazla Triton tamponu, 15 dakika boyunca 3 kez en az durulayarak doku yıkayın.
- üreticileri seyreltilmiş fluoresan boya-konjüge edilmiş ikincil antikor ile inkübe doku (tipik olarak 1: 200-1: 1000) konsantrasyonu tavsiye Triton blok bir nutator oda sıcaklığında 1 saat karıştırıldı. 0.5 mL ikincil antikor seyreltme minimum hacmi kullanın.
- 3 dakika önce ikincil antikor agrega spesifik olmayan bağlanmasını azaltmak için kullanmak için 13,000 xg seyreltilmiş sekonder antikor santrifüjleyin. floresan boyalar photobleaching önlemek için itibaren bu adımdan ışıktan doku koruyun.
- Aşama 5.5 gibi, üzerinde 15 dakika süre ile 1.5 ml ya da daha fazla Triton tamponu, 3 kez en az durulayarak doku yıkamayüksek çalkalama ile Nutator. hazır olana kadar 4 ° C'de PBS içinde mağazası örnekleri monte edin.
6. Antikor seçimi
NOT: Tavsiye edilen antikorlar ve bunların dilüsyonları kaynağı Özgü Malzeme ve Ekipman tabloda listelenmiştir. bölüm 5'de tarif edilen gibi antikor inkubasyon gerçekleştirin.
- ya da anti-asetillenmiş-α-tubulin (1: 800): mikrotübül göre kinocilium görselleştirmek için, örneğin anti-Arl13b (1.000 1) gibi bir siliyer aksonem işaretleyiciyi kullanın. (200 1) ya da başka bir centrosomal işaretleyici γ-tubulin karşı bir antikor kullanılarak bazal vücut görselleştirme.
- sekonder antikor inkübasyon için birkaç farklı fluorophores birine konjuge: - (1.000 300 1) aktin filament zengin stereociliary demetleri görselleştirmek için, Phalloidin ekleyin. Falloidin, her bir epitel kılı hücresinin çevresini çevreleyen kortikal aktin filamentler de dahil olmak üzere, diğer lifli aktin yapıları etiketler. Bu belirlemede yardımcı olurHer saç hücresinin anahat. Eğer gerekirse: anti-ZO-1 (1: 500) gibi alternatif bir membran işaretleyiciyi kullanın.
- veya Miyosin Vlla (1: 1000): Miyozin VI (1.000 1) karşı antikorlar kullanılarak koklear saç hücreleri etiketlemek. Bu koklea uzunluğu değerlendirilmesi durumunda kullanılabilir.
NOT: mikroskop gereksinimleri için optimize Kullanım uygun floresan boya-konjuge sekonder antikorlar.
7. Montaj ve Görüntüleme
- PBS içeren siyah silikon Elastomer çanak örnek yerleştirin. Ince forseps kullanarak, koklear spiral vestibüler bölgeyi kaldırın.
- Çok dikkatli koklear spiral altta yatan kıkırdak ve mezenşimi çıkarın. Kalan koklear spiral Corti ve dış sulkusta iç sulkus, org içerir.
- bir mikroskop lameli üzerine konularak PBS bir damla halinde koklear spiral aktarın. İstenirse, bir dönüşe eşdeğer parçalar halinde koklear spiral ayırın. Bu adım, ancak gerekli değildir, ve l yol açabilirdoku OSS. koklear saç hücrelerinin apikal yüzeyi (stereocilia tarafı) lamel doğru yukarı bakacak şekilde olmalıdır.
- epitel değiştirdi ve kendi üzerine örtüşür varsa Wick deplasmanda PBS filtre kağıdı bir adsorban doku veya parça ile ve yavaşça koklear spiral yeniden konumlandırmak.
- doğrudan koklea numune üzerine montaj medya bir damla ekleyin ve hafifçe hava kabarcıklarını önlemek için özen, üstüne bir lamel yerleştirin. Hiçbir aralama gereklidir; numunenin doğrudan lamel yerleştirin. yerine lamel tutmak için ek adımlar gerektirmez bir suda çözünür olmayan, fluoresan, yarı kalıcı montaj orta önerilir. Montaj medya ve lamel kalınlığı özelliklere mikroskop uyumlu olmalıdır.
- koklear saç hücresinin apikal yüzeyinde görüntülerini yakalamak için hedefleri -, yüksek sayısal açıklık (1.4 1.2) - yüksek büyütme (100X 63) ile donatılmış bir epifluorescent veya lazer tarama konfokal mikroskop kullanın. Kullanım lower hedefleri (5 - 20X) koklear kanal uzunluğunu ölçmek için koklear spiral görüntülerini üst üste çekmek için. ikincil antikorlar için kullanılan fluorophores için maç uyarma lazerler ve emisyon filtreler.
8. Taramalı Elektron Mikroskobu
- Bölüm 4.3 devam edin. Hepes tamponunda SEM sabit örnekleri yıkadıktan sonra, havalandırma altında aşağıdaki adımları uygulayın. Aşağıdaki protokol koklea doku için iyi çalışır ve iletken bir metal ile saçma ile kaplamanın kullanılmasını önler.
- Her biri 5 dakika için damıtılmış su, 1 ml 3 yıkama, ardından 1 saat Hepes tampon maddesi içinde% 1 OsO 4 sonrası düzeltme. Tamamen doku güzelinden OSO 4 küçük hacimli toksik atıkları en aza indirmek için kullanılmalıdır. Ajitasyon yok gereklidir.
- adımlar arasında her biri 5 dakika için 1 ml distile su ile 3 yıkama ile, 1 saat boyunca, aşağıdaki çözeltiler her oda sıcaklığında inkübe edin:% 1 tannik asit, taze su ve fil yapılankullanımdan önce kayıt olmuş; Su içinde% 1 OsO 4, su içinde% 1 tanik asit, su içinde% 1 OsO 4.
- 30, 50, 70, 90, ve% 95: Aşağıdaki seyreltileri, her 10 dakika için kuluçkalama ile sınıflandırılmış etanol serileri ile örnekleri kurutmak. Ajitasyon yok gereklidir.
- (200 proof etanol yeni açılmış şişe)% 100 etanol içinde üç değişiklik, her biri 5 dakika, boyunca Aktarım örnekleri.
- Üreticinin talimatları izleyerek kritik bir nokta kurutucu olsa örnekleri çalıştırın.
- Bir elektron mikroskobu ile görüntüleme öncesi bir SEM kütüğü üzerine iletken karbon yapıştırıcı kullanılarak örnekleri monte edin. Bir stereomikroskop altında, yavaşça koklear epiteli yukarı bakacak şekilde örnek yerleştirmek için ince forseps ve bir fırça bir çift kullanın. 'Çapa' saplama doku numunenin vestibüler bölümünü kullanın. görüntüleme kadar desikatör saklayın örnekleri. (2012) 21 Jones tarif edildiği gibi SEM görüntü alma gerçekleştirin.
9.Niceleme
- immünhistokimya hazırlanmasından sonra, bir epifluorescent veya lazer tarama konfokal mikroskop kullanılarak görüntüler elde. SEM için hazırlandıktan sonra, bir görüntü örnek için bir tarama elektron mikroskopu kullanın. Görüntü maruz koklear saç hücreleri ve araya destek hücreleri ile Corti organı apikal yüzey.
- Koklear kanal boyunca taban gibi, 25, 50 ve% 75 spesifik konumlarını tanımlamak ve mutant ve kontrol numuneleri arasındaki koklea bölgelerini karşılaştırmak için bu kullanımı. Genetik arka planda farklılıklar koklear fenotip değiştirebilirsiniz olarak, analiz etmek ve onların yavru kontroller ile kirpikler mutantlar karşılaştırın.
NOT: Corti organı apeks ve taban hem doğru orta tabanından uzanan bir degrade gelişir. Fare, gelişme P14 kadar tamamlanmış değil, bu yüzden benzer gelişim evreleri ve pozisyonlarda bölgeleri karşılaştırmak önemlidir. - allo mikroskop eşlik yazılımı kullanarak alın resimlerÖzellikle fenotip ölçümü için gerekli olan B (aşağıya bakınız). , Uzunlukları ölçmek hücrelerin sayısı ve aşağıda tarif edildiği gibi protein lokalizasyonu belirlemek için mikroskop eşlik böyle Görüntü J veya yazılım olarak görüntü analiz yazılımı kullanın. Grafik mutant vs kontrolü karşılaştıran bir çubuk grafik, scatter plot, kutu blot veya histogram gibi bu veriler.
- Koklear kanal (Şekil 3A) toplam uzunluğu:
- (Stereociliary demetleri işaretler) saç hücresi işaretleyici veya Phalloidin kullanarak, belirlemek ve duyusal epitel başlar ve biter nerede ölçün. koklear kanal uzunluğu genellikle kirpikler mutant kısaltılır.
- Stereociliary demeti anormallikleri (Şekil 3B, D, E, G):
- Demetin tepe ve Şekil 3G de gösterildiği gibi paket 'kol' her iki ucundan dışarıya uzanan çizgi arasındaki en kısa mesafe olarak paket konveksliğini (yükseklik) ölçün, sol. Alternatif olarak, bölgeyi ölçmekDoğru, Şekil 3G de gösterildiği gibi, dış saç hücre stereociliary demeti kolları tarafından kapsanan. tespit edilebilir dairesel stereociliary demetleri saç hücreleri, toplam saç hücrelerinin yüzdesi olarak, bu sayılırlar.
NOT: Birçok siliyer mutantlar ise paket anormallikler bağımsız paket yönlendirme görülebilir. Doğru stereociliary paket anormallikleri ölçmek zordur.
- Demetin tepe ve Şekil 3G de gösterildiği gibi paket 'kol' her iki ucundan dışarıya uzanan çizgi arasındaki en kısa mesafe olarak paket konveksliğini (yükseklik) ölçün, sol. Alternatif olarak, bölgeyi ölçmekDoğru, Şekil 3G de gösterildiği gibi, dış saç hücre stereociliary demeti kolları tarafından kapsanan. tespit edilebilir dairesel stereociliary demetleri saç hücreleri, toplam saç hücrelerinin yüzdesi olarak, bu sayılırlar.
- Stereociliary demetleri (Şekil 3B, C, G) yönelimi:
- İç ve dış saç hücrelerinin ayıran ayağı hücrelerinin üst üste dik olarak uzanan bir çizgiye, her bir demet nisbetle yönünü değerlendirmek. normal bir yönlendirmeyle olan hücreler, bu dik bir eksen boyunca hizalanır ve bu 0 ° 'lik bir rotasyon vardır. 0 ° ila 360 ° gösterim ya da mutlak sapmaları kullanılarak dönme açıları belirleyin.
- Kinocilia konumlandırma veya stereociliary paket konumlandırma (Şekil3B, K, H):
- kinocilia eksik olan hücrelerin yüzdesi sayın. paketin 'vertex' ya da merkeze kinocilium mesafeyi ölçün. paketin 'tepe' demetleri anormaldir ve böylece demetin orta yerine kullanılıp kullanılamayacağını belirlemek kolay olmayabilir.
- Her saç hücresinin üzerine bir pozisyonel ızgara kaplayan ve kinocilium tabanı veya stereociliary demetinin vertex / merkezinin ya yerini işaretleyerek, apikal saç hücre yüzeyinde kinocilia ve stereociliary demetleri konumunu sayısal olarak. ızgara, belirli bir bölge içinde yer her kategorinin bir yüzdesi olarak, ve bir pozisyon ızgara üzerine her işaretleme yerleri kaplayan verileri görüntüler.
Not: Kontrol dokularda kinocilia her stereociliary demetin tepe bağlıdırlar. kirpikler mutantlarında, kinocilia genellikle hala bağlı ya da hatta tamamen s kopuk yapılmamış mislocalized, eksiktereociliary paket. - Kinocilia uzunluğu (Şekil 3H):
- Bir siliyer aksonem işaretleyici ile etiketleme kinocilium uzunluğunu ölçün. Sadece 1.5 mikron konfokal düzlemi içinde düz yalan kinocilia ölçün. kirpikler taranan bir doku kesit görünüşünü gözlemleyerek düz yalan olduğunu onaylayın. kinocilium gelişimi sırasında geri çekilir beri Kokleanın aynı bölgeden yaşlı eşleştirilmiş örnekler karşılaştırın.
- kutup proteinlerinin mislocalization:
- Böyle Vangl2 ve Gαi3 olarak kutupluluk proteinlerine karşı antikorlar kullanılarak immünohistokimyasal ardından, görüntüleme yoluyla yerelleştirme belirler.
NOT: Bazı kirpikler mutantlar olarak, polarite proteinlerin lokalizasyonu bozulur. Bu Ift20, Bbs8 ve Bbs6 mutant koklea bozulduğu gösterilmiştir Vangl2 ve Gαi3 içerir.
Not: ölçmek ve ekran saç hücre polarit için nasıl diğer örnekleri,y şu kağıtları bulunabilir. Curtin, et al. (2003) Current Biology 22 Montcouquiol, et al. (2003) Nature 7, Wang ve arkadaşları (2006) ve diğerleri, Neuroscience 23, Montcouquiol, Journal of. Molecular Biology 24, Mayıs-SIMERA, et al (2008) Methods. Molecular Biology 25 (2012) Yöntemler, Yin ve arkadaşları (2012) PLoS bir 26.
Sonuçlar
Salyangoz Diseksiyon ve Doku Hazırlanması
Beynin çıkarılmasından sonra, (Şekil 1A, beyaz ok) görüntülenmiştir ve kaldırılabilir arkadan görülen bir P0 fare kafası, kemik labirent, post orta hat sagital diseksiyon. Şekil 1B koklear saçlı izole kemik labirentler gösterir yukarı, ventral (sol) ve arkasından bakan, dorsal (sağda). oval pencereye beyaz ok noktaları hangi bir dış kıkırdak çıkarmadan başlayabilirsiniz. Dış kıkırdak tamamen kaldırıldıktan sonra, maruz koklear kanal, hala bozulmamış, (Şekil 1C) görülebilir. diseksiyon yardımcı olmak için vestibüler bölgesinden geçen bir pimin Konumlandırma gösterilir. Farklı açılarda yerleştirilmiş iki pim de doku sabitlemek için kullanılabilir. Şekil 1D Reissner 'çıkarılmasından sonra koklear kanalını göstermektedirS membranı ve örtü oluşturan membran (sol) ve immünohistokimya (sağ) montajı için hazırlık vestibüler bölgesinden izole edilmiş bir kez izole koklear epitel spirali. Maruz koklear saç sağlam bir SEM hazırlık Şekil 1E gösterilmiştir, neye benzediğini genel bir fikir vermek için.
Kontrol Kohlea Morfoloji ve İmmünoflöresan
Koklear doku hazırlandıktan sonra, Corti organı içeren koklear kanal dorsal yüzeyi maruz ve SEM veya immunofluorescent boyama yoluyla incelendi olabilir. Bütün monte preparatı olarak bakıldığında, mechanosensory saç hücreleri (iç saç hücrelerinin bir satır ve dış saç hücrelerinin üç sıra) dört sıra ayırt edilebilir. Şekil 2A, bir embriyonik fare koklea bazal dönüş düşük bir büyütme görünümünü göstermektedir hazırlanabilir fSEM veya. aktin bazlı stereociliary demetlerinin düzgün yönelimini ve hizalanmasını not edin. Ayrıca stereociliary demetlerinin morfolojisi her paket şekli iç saç hücreleri üzerinde ( ")" klasik) veya) dış saç hücrelerinin üzerinde ( "W" var, tutarlıdır. Bu yaşta yakından büyütme üzerine ek mikrovilluslar sadece saç hücrelerinin apikal yüzeyinde görülen, ancak olabilir, aynı zamanda arada destek hücreleri (Şekil 2B) saç hücreleri. Bu dış saç hücrelerinin ve yetişkinlerde iç saç hücreleri üzerinde ikisine stereociliary demetleri sadece üç satır bırakarak geri plana geçecektir. Şekil 2C (beyaz ok) görülebileceği gibi, tek bir mikrotübül göre kinocilium (gerçek bir primer kirpik) Her stereociliary demetinin uç noktasında stereocilia yüksek satır bitişiğindedir. Bu kinocilia linkleri ile paket bağlanır.
Phalloidin, laboratuvar ile floresan etiketlemeELS aktin, kontrol dokusu (Şekil 2B) 'de demetleri düzgün yönelimini ve şekli dikkat çekmektedir. Kortikal aktin, her bir tek tek saç apikal hücre çevresi belirlemek için yararlı olan, etiketlenir. Falloidinle Co-etiketleme ve miyozin 7a (Şekil 2E) karşı bir antikor, bir saç hücre markörü, aynı zamanda saç hücreleri ve destek hücreleri arasında ayrım yapmak için yardımcı olur. Myosin 7a da koklear kanal uzantısı (Şekil 3A bakınız) ölçmek için yararlı bir belirteç olduğunu. Asetile-α-tubulin karşı bir antikor genel olarak mikrotübül göre kinocilium (Şekil 2F) tanımlamak için kullanılır. destek hücreleri de birincil kirpikler liman gibi, saç hücreleri kaynaklanan vs destek hücreleri interkalasyon silya ayırt etmek önemlidir. Böyle açıkça koklear kanalın apikal membran mozaik desenlendirme özetliyor ZO-1 (Zona occludens 1), karşı antikorlar gibi ilave bir membran işaretleyici, <(dolayısıyla yararlıstrong> Şekil 2F). Daha fazla dikkate asetillenmiş-α-tubulin karşı antikorlar ayrıca iç mikrotübül etiket ve böylece saç hücresi apikal yüzeye odaklanmak görüntüleme sırasında alınması gereken bakım olmasıdır. Sütun hücrelerinde mikrotübül özellikle yoğun (Şekil 2G, beyaz yıldız) vardır. Phalloidin ve anti-asetillenmiş-α-tübülin etiketleme bir arada sık sık eşzamanlı stereociliary demetleri ve komşu kinocilia (Şekil 2G, beyaz ok) tanımlamak için kullanılır.
Cilia Mutants Koklear Fenotip
Koklear kanal uzama yakınsama ve uzatma kusurlarının en iyi okuma çıkışları biridir ve kısaltılmış koklear kanalları genellikle klasik PCP mutantlar görülmektedir. Silier mutantlar koklea genellikle koklear kanalları kısaltılmış ve duyusal epithe belirgin bir genişletilmesi göstermek varkutu Ift20 CKO / görülmüştür şekilde tepesinde lia, fareler (Şekil 3A) CKO. - / - Farelerde immunohistokimyasal (Şekil 3B, sağ ok), hem SEM (Şekil 3C) ile Bbs8 de görülebileceği gibi, bir diğer klasik PCP kusur, koklear saç hücrelerinin düzgün yönelime bozulmasıdır. Yanlış yönlendirilmiş demetleri ek olarak, düzleştirilmiş ve şekilsiz demetleri de yaygın (Şekil 3B, orta ok Şekil 3D) görülmektedir. Kutu Şekil 3E görülmüştür şekilde Çoğu zaman dairesel demetleri, özellikle kinocilia tamamen yoksun saç hücreleri, mevcut bulunmaktadır. kinocilium mis-lokalizasyonu da yaygındır.
MIS-lokalize kinocilium olabilir veya stereociliary demet (Şekil 3B, sol ok Şekil 3F) bağlı olabilir. met ölçmek için nasıl örneklerndle yönlendirme ve kinocilia veya demet konumlandırma Şekil 3G ve 3H de gösterilmiştir. her bir demetin yönlendirilmesi daha sonra iç ve dış saç hücrelerinin ayıran ayağı hücrelerinin üst üste dik olarak uzanan bir çizgiye demeti nisbetle rotasyonunu saptanmasıyla değerlendirilebilir. Normal bir yönlendirme ile Hücreler bu dik eksende hizalanmış ve böylece 0 ° (Şekil 3G) bir rotasyon vardır. Kinocilium veya stereociliary demetinin merkezi konumu, saç hücrelerinin lümene yüzeyinde bir pozisyonel ızgara kaplayan ve daha sonra ızgara (Şekil 3H) bünyesinde kinocilia yerini belirleyen veya paket ile çizilebilir. kirpikler genlerdeki mutasyonlar çoğunlukla kirpikler uzunluğunu etkileyebilir ve böylece kinocilium uzunluğu değerlendirilebilir. Cep290 rd16 / rd16 mutantlarında, kinocilia kontrol (Şekil 3J) 'de daha uzundur. kirpik retraklar olarak,yaş eşleştirilmiş çöp arkadaşları var ve koklea aynı bölgeden ölçüm almak için çok önemlidir. Her iki İmmünohistokimyada ve SEM analiz ve ölçümü için iyi görüntü almak için, örtü oluşturan membran kaldırmak için kritik öneme sahiptir. Şekil 3F örtü oluşturan zar tamamen kaldırıldı henüz hangi bir SEM mikroskobu görüntüsüdür.
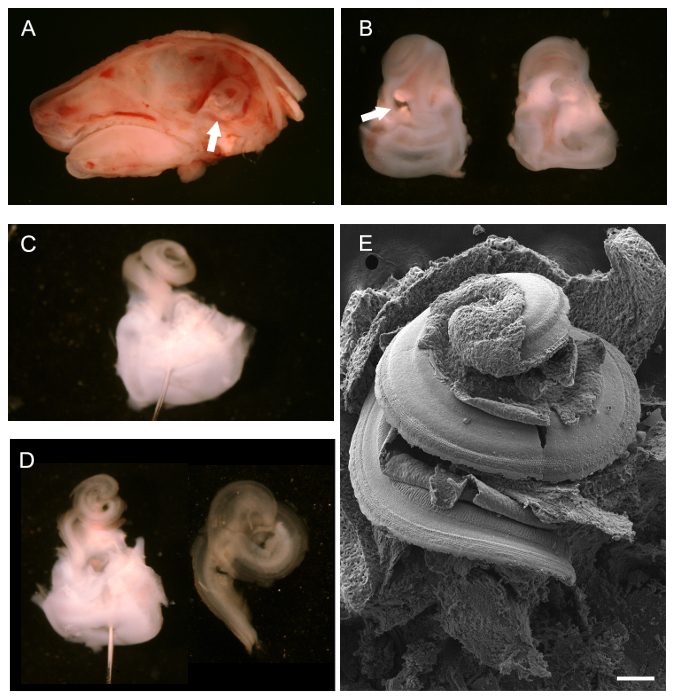
Gelişmekte Fare Kohlea (P0) Şekil 1. Diseksiyon. (A) P0 fare başın Orta hat sagital diseksiyon beyin kaldırıldı ile. kemik labirent konumuna beyaz ok işaret eder. Disseke kemik labirentler (B) Ventral (solda) ve dorsal (sağ) bakıldı. Cochlea oval pencereye alt Beyaz ok noktalarında vestibüler kısmı ile üst kısmına doğru yer alır. (C) kemikli labirent kıçkoklea dış kıkırdak er çıkarılması. Bir pin vestibüler sistemi aracılığıyla yerleştirildi. (D) Sol, Reissner membranı ve örtü oluşturan zar çıkarılmasından sonra C ile aynı görünüşüdür. Montaj için hazır Sağ, izole koklear kanal. Duyusal epitel içeren koklear kanalının kat, açığa dokunulmamış maruz koklear spiral (E) tarama elektron mikrografiğidir. Ölçek çubuğu 100 mm. . Mayıs-SIMERA ark adapte - (A D) 2012 25 Bu rakamın büyük halini görmek için buraya tıklayınız.

Kontrol Kohlea Şekil 2. Morfoloji ve İmmünoflöresan (A - C). Bazal Tur Taramalı elektron mikroskopn embriyonik (E18.5) yabani tip cochleae. İç saç hücreleri (altta) ve dış saç hücrelerinin (üstte) üç satır bir sıra ayrıldı ve destek hücreleri tarafından ardalanmalıdır. Chevron şeklindeki stereociliary demetleri eşit, her saç hücresinin (görüntünün üst kenarı) lateral kenarına doğru yönlendirin. E18.5 ek mikrovilluslar stereociliary demetleri altında saç hücrelerinin apikal yüzeyleri, ve eklenmiş destek hücreleri (B) kapsamaktadır. (C) tek bir mikrotübül göre kinocilium (beyaz ok) yanal kenarından Burada gösterilen paket tepe, yer almaktadır. Bazal dönüş doğum sonrası gün 1 (P1) vahşi tip cochleae Resimleri - (D G) immünofloresan boyama. Faloidin hücre çevre (D, E, G) de stereocilia ve kortikal aktin ipliksi aktin etiketler. 7a miyozin iç ve dış saç hücrelerinin (E) için bir göstergedir. Zo_1 hücre Bounda ayırt etmek için o büyük bir işaretleyici yapım-in arasındaki hücreleri sıkı kavşaklar etiketlerRies (F). Asetile α-tübülin demet (F, G beyaz ok) tepesindeki kinocilium için bir marker olarak kullanılmıştır. İç mikrotübül da ayağı hücrelerinde bol miktarda belli olan asetillenmiş α-tubulin, (G beyaz asterix) tarafından sınıflandırılmıştır. Ölçek bar A: 10 um, B: 5 um, C: 1 mikron, DG:. 5 mikron bu rakamın daha büyük bir versiyonunu görmek için lütfen buraya tıklayınız.
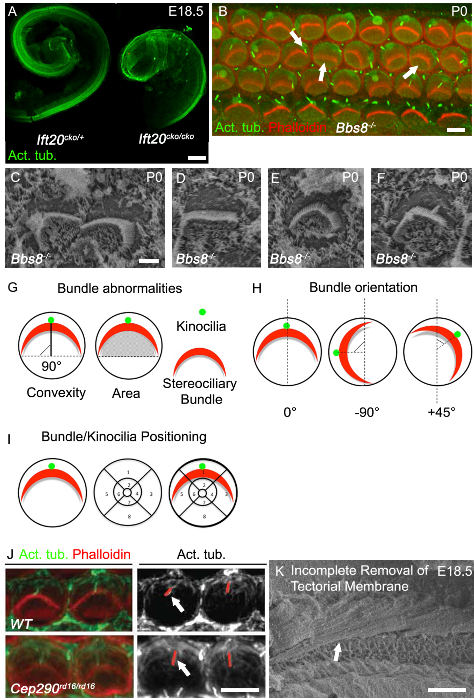
Cilia Mutants Şekil 3. Koklear Fenotip. (A) Ift20 CKO / bir Belirgin kısalma kontrole kıyasla koklear kanalları cko. E18.5 disseke koklear kanallar asetillenmiş tubulin ile boyandı. (B Bbs8 bazal koklear dönüş strong>) Tüm montaj görüntüleri - / - mutant (P0). Phalloidin etiketli ipliksi aktin, stereocilia (kırmızı), asetillenmiş tubulin, kinocilia (yeşil). / - - Bbs8 içinde Stereociliary demetleri cochleae değişken, (sağ ok) döndürülmüş basık ve / veya (orta ok) mislocalized edilir. Kinocilia mislocalized veya axonemes (sol ok) eksik. (C - F) Bbs8 içinde stereociliary demetleri ve kinocilia Yüksek büyütme SEM - / - OHCs. C, demetleri, D, E, dairesel demetleri, paket basık döndürülmüş ve F kinocilia mislocalized. (G - I) paket anormallik ölçümü şematik gösterimi. (G) Sol, konveksliği (yükseklik) paket; paket tepe ve paket 'silahların' iki ucunda uzanır hattı arasındaki en kısa mesafe. D olarakdüz siyah çizgi ile epicted. paket altında Sağ, alanı; alan. (H) stereociliary demetleri yönünü ölçmek için kullanılan kriterlerin şematik gösterimi. paket dönme açısı ayağı hücrelerinin üst üste dik olarak uzanan bir çizgiye göre hesaplanır. (I) 'in kinocilia ve stereociliary demetlerinin konumsal analizi için kriterler şematik temsili. Bir parçalı ızgara, saç hücresinin çevresi üzerine yatırılır ve pozisyon kaydetti. (J) Phalloidin etiketli stereocilia demetleri (kırmızı) ve P0 kokleadaki dış saç hücrelerinin asetillenmiş tubulin etiketli kinocilia (yeşil) Yüksek büyütmeli görüntü. Bitişik monokromatik panelinde, kırmızı çizgiler daha Cep29 rd16 / rd16 mutant kontrolü (beyaz oklar) göre olan kinocilia, tanımlar. Örtü oluşturan membran eksik kaldırılması ile embriyonik koklea (K) SEM mikrografı. ölçekbar A: 100 mikron, B: 5 um, C - F: 2.5 um, I: 5 um, J: 50 mikron. .. (A - F). Rachel ve arkadaşları, 2012 27 izniyle Mayıs-SIMERA vd, 2015 8, J Basım, modifiye bu rakamın daha büyük bir versiyonunu görmek için lütfen buraya tıklayınız.
Tartışmalar
analiz için koklear doku hazırlanırken, akılda tutulması gereken birkaç önemli nokta vardır. Birincisi, genetik arka planda farklılıklar gerekli analiz ve tek yavru kontrollerle karşılaştırılması hale koklear fenotip değiştirebilirsiniz. İkincisi, örtü oluşturan zarın tam olarak çıkarılması immünhistokimya ile en iyi görüntü elde etmek için gerekli ve SEM için gereklidir edilir. örtü oluşturan zar opak bir yapıdır ve görüntüleme daha zorlu hale altındaki doğrudan duyusal epitel hücreleri önünü kapatabilir. Bazen işlem sırasında, örtü oluşturan membran saç hücreleri ortaya çıkardı geri çekebilir. Hatta bu durumda kaldırma şiddetle tavsiye edilir. Bu adım sabır ve pratik gerektirir. Üçüncüsü, siliyer proteinler, yüksek oranda sıkıştırılmış bazal vücut için lokalize özellikle olanlara karşı antikorlar kullanılarak immünohistokimyasal zor olabilir ve optimizasyon gerektirebilir. permeabil yoğunlaştırılması, antijen alımı yapmayı düşününzasyon adımları veya konsantrasyonu veya fiksasyon süresini azaltarak. P1 itibaren bir taban-to-tepe degradedeki - kinocilium (koklear saç hücreleri üzerinde bulunan birincil kirpik) görüntüleme zaman P0 dan geri başlar nihayet, unutmayın. kinocilium uzunluğu ölçerken nedenle, koklea aynı bölgeden ve yaş eşleştirilmiş hayvanlarda kıl hücrelerinin karşılaştırmak için önemlidir. interkalar destek hücreleri de geri değil birincil kirpikler var. Bakım hücre kirpikler ve saç hücre kinocilia destek arasında ayrım yapmak için dikkat edilmelidir.
Fareler olgun gibi, temiz nedeniyle temporal kemiklerin ve kemik labirentler kalsifikasyon, koklear duyusal epitelyaya izole etmek gittikçe zorlaşmaktadır. doku yumuşatma zaman daha bağışık teknikleri ile uyumlu değildir, ancak büyük fenotip incelenmesi için izin verir ve aynı zamanda SEM hazırlanması ile uyumlu olan, gereklidir. Kendilenmiş fare strains nedeniyle sıklıkla bilinen işitsel genler veya düzenleyici genlerin mutasyona, saç hücre kaybı veya yüksek işitsel beyin sapı yanıtları (ABRS) olarak işitsel kusurları gösterirler. Nedenle alternatif bir genetik arka plan üzerine yaş eşleştirilmiş yavru kontrollerle karşılaştırılması veya üremek için esastır.
Bu analizin sınırlamalardan biri farelerde, kinocilium sonrası doğum geri başlar ve bundan sonra, yetişkin saç hücreleri üzerinde mevcut olan, olmasıdır. Bu nedenle kinocilia ölçümler sadece doku geliştirmek yapılabilir. Ayrıca dikkatle mutant ve kontrol örnekleri arasında karşılaştırmalar için aynı yaştaki kontrol seçmek gereklidir. Başka bir sınırlama siliyer mutant fareler ağır işitsel disfonksiyon görüntü yok şimdiye kadar analiz (yani., Işitsel beyin sapı cevapları, ABRS veya otoakustik emisyon, OAEs) koklear gelişme bozulur bile değildir. Bu tutarlı olarak, işitme kusurları, ortak bir insan ciliopathy fenotip değildir. duymaktan İstisnai olarak, kayıpg bazal vücut proteini ALMS1 28,29 mutasyonlardan kaynaklanır Alström sendromunun temel özelliklerinden biridir. Bu Vangl2 CKO mutantlar 30 için rapor edildiği gibi stereociliary demet morfolojisi mutlaka daha sonra gelişme demetleri olası nedeniyle düzeltici reorientation, kirpikler mutantlar işitsel fonksiyon bozukluğuna bağlı olmadığını göstermektedir. ciliopathy spektrum Usher Sendromu, sağır-körlüğün en sık görülen doğumsal nedeni kapsayacak şekilde genişletilmiştir ise, o zaman işitsel disfonksiyon son derece alakalı hale gelir. Son veriler sendromu Usher ile ilgili çeşitli proteinler de cilium lokalize olduğunu göstermiştir ve siliyer ile ilgili süreçlerde 31 katılmaktadırlar, ancak bu proteinler PCP sinyalizasyon ile ilgili olup olmadığını henüz incelenmiş değildir.
Kadar koklear PCP kusurları için analiz şimdi en siliyer fare mutantlar sadece belli belirsiz incelenmiştir. Bu yazıda anlatılan tekniklerin geniş detaylandırılması için izinşüphesiz omurgalı PCP sinyalizasyon kurulması siliyer katılımı daha kesin bir anlayışa yol açacaktır koklear fenotip. Mevcut ciliopathy fare modellerinde çok sayıda olmasına rağmen, şaşırtıcı birkaç koklear PCP kusurları açısından analiz edilmiştir. Bu modellerle ilgili ortak bir hatadır embriyonik öldürücü olduğunu. Gelişmekte olan koklea gelişmekte olan kulakta PCP embryonically kirpikler rolü incelenebilir Bununla birlikte, yine de araştırılmalıdır olabilir. Ayrıca, çok erken embriyonik öldürücülüğü koşullu Knockouts kullanılarak atlatılabilir. Foxg1 Cre JacksonLaboratories temin 32 fare, yaygın E8.To tarihten itibaren iç kulağı thedeveloping ilgi inactivategenes için kullanılan çabalar öncelikle hastalığa neden olan ciliopathy genleri inceleyerek odaklanmıştır diğer kirpikler ilgili proteinler ve nasıl ancak keşif bu cil içine daha fazla fikir sağlayabilir gelişim sırasında PCP sinyalizasyon etkileria biyoloji ve işlevi.
Işitsel bir fenotip analiz edilen fare modellerinde şüphesi varsa, olası başka analizler ABRS 33 veya OAEs 34 odyometrik testleri içerir. Koklear eksplant uzantısı deneyleri (Mayıs-SIMERA ve ark., De tarif edildiği gibi 2012, 25), aynı zamanda gerçekleştirilen ve önceki gelişim zaman noktalarında yakınsak uzantısı kusurların belirlenmesine olanak edilebilir. koklea eksplant kültür de böylece ilgili gelişimsel süreçlerinin mekanik anlayışına katkıda eksplant uzantısı değiştirebilirsiniz çeşitli sinyal aktivatörleri veya inhibitörleri ile tedavi sağlar. Bu kinocilium doğum 11,13,14 sonra geri çekilir bilinmektedir, ancak bu geri çekilme iyice siliyer mutantların bağlamında ele edilmemiştir. Bu mutants.Considering siliyalarda kinocilia ortaya çıkması ve geri çekme zamanı özgü ölçümler almak için ilgi olacağını siliyer pro için birincil rolüproteinlerinin proteinlerin de hücre iskeleti 35-37 boyunca hücre içi ticareti yönlerini düzenleyen olabilir kuvvetle muhtemeldir, mikrotübül boyunca kargo hareketidir. Kirpikler proteinlerinin bir alt kaçakçılığı ve PCP moleküllerinin 8 asimetrik lokalizasyonu etkilediği gösterilmiştir. PCP moleküllerinin immünohistokimyasal olarak yerinin tanımlanmasıyla bu Vangl2, Frz3 ve DSH özellikle zara bağlı proteinler, dolayısıyla PCP molekülleri mislocalized halinde oluşturulması önerilir. Kutupluluk kurulması çok yönlü bir mesele gibi görünüyor, ve aynı zamanda duyusal saç hücreleri 38 doğru PCP için gerekli olan ek bir hücre özerk yolunun, montaj kanıt yoktur. Son zamanlarda kağıt G-protein bağımlı sinyal bir hücre özerk bir şekilde 39 cilium göçünü kontrol gösterdi. kutup maddelerin yerini siliyer proteinleri için bir rolle tutarlı olarak, heterotrimerik G-protein alfa-I 3 (Gαi3) L alt birimindenocalization koklea 8,39 nakavt Bbs8 ve Bbs6 bozulur.
Bireysel siliyer bileşenleri ve PCP sinyalizasyon üzerindeki farklı etkilerinin rolünü ayırt bize kutupları doğru kurulmasında cilium rolüne daha fazla fikir verecektir. özel öneme sahip bir siliyer bağlamında işleyen siliyer proteinleri, vs gibi hücre içi ticareti ile ilgili olmayan ciliary düzenlenmesinde rolleri geleneksel olarak kabul siliyer proteinlerin olmayan siliyer fonksiyonlar, ayırt etmektir. Hücresel desen ve stereociliary paket yönü de dahil koklear yapının, birçok açıdan düzenlilik yüksek derecede mümkün kirpikler ilgili proteinlerin genetik ve moleküler tedirginlikler ya cevaben PCP gelişiminde ince değişiklikleri tespit etmek için yapar. Birçok siliyer fare modelleri mevcut olduğunu ve gelişmekte olan fare koklea PCP incelemek için en iyi yerlerden biri olduğunu göz önündesinyalizasyon, o ölçüde bireysel protein mutasyonları koklea gelişimini bozabilir ne öğrenmek için büyük ilgi olduğunu.
Açıklamalar
The author declares no competing financial interests.
Teşekkürler
Yazar yazının eleştirel değerlendirilmesi için Matthew Kelley, Tiziana Cogliati, Jessica Gumerson, Uwe Wolfrum, Rivka Levron, Viola Kretschmer ve Zoe Mann teşekkür etmek istiyorum. Bu çalışma Sofja Kovalevskaya Ödülü (Humbodlt Vakfı) ve Johannes-Gutenberg Üniversitesi, Mainz, Almanya tarafından finanse edildi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Tools/Equipment | |||
| Silicone elastomere - Sylgard 184 | Sigma-Aldrich | 761028-5EA | See Note 2 |
| Micro dissecting scissors-straight blade | Various | ||
| Fine forceps (no. 5 and 55) and blunt forceps | Various | ||
| Dissecting microscope. | Various | ||
| Uncoated glass microscope slides | Various | ||
| Microscope cover slips (22 mm × 40 mm × 0.15 mm) | Various | ||
| Transfer pipettes | Various | ||
| Minutien pins | Fine Science Tools | 26002-10 | |
| SEM sample holder | tousimis | 8762 | |
| Scanning electron microscopy studs | TED PELLA | 16111 | |
| PELCO Tabs: Carbon adhesive | TED PELLA | 16084-3 | |
| Fluorescent Microscope | Various | ||
| Critical Point Dryer | Various | ||
| Scanning Electron Microscope | Various | ||
| Glass microscope slides | Various | ||
| Glass coverslips | Various | ||
| Kimwipe Tissue | Various | ||
| Fine Paint Brush | |||
| Reagents | |||
| 1× Phosphate buffered saline (PBS) | Gibco/Life Technologies | 10010023 | |
| Paraformaldehyde (PFA) (EM Grade Required for EM) | Various | Prepare a 4% solution in 1× PBS made fresh each time. EM Grade Required for EM. | |
| 2.5% Glutaraldehyde Grade1 | Sigma-Aldrich | G5882 | |
| Tris-HCl (pH 7.5) | Various | ||
| NaCl | Various | ||
| CaCl 2 | Various | ||
| Triton X-100 | Various | ||
| Normal Goat Serum | Various | ||
| AffiniPure Fab Fragment Donkey Anti-Mouse IgG (H+L) | Jackson ImmunoResearch | 715-007-003 | |
| Fluoromount-G Mounting media | SouthernBiotech | 0100-01 | |
| 10× Hanks’ Balanced Salt Solution (HBSS) | Gibco/Life Technologies | 14065 | |
| Hepes | Gibco/Life Technologies | 15630-080 | |
| Osmium tetroxide (OsO4 ) | Sigma-Aldrich/Fluka Analytical | 75632 | |
| Tannic acid | Sigma-Aldrich | 403040 | |
| Ethanol 200 proof | Various | ||
| Antibodies | |||
| anti Arl13b | Protein Tech | 17711-1-AP | Suggested concentration 1:1,000 |
| anti acetylated tubulin (611-B1) | Sigma-Aldrich | T6793 | Suggested concentration 1:800 |
| anti gamma tubulin (GTU-88) | Sigma-Aldrich | T6557 | Suggested concentration 1:200 |
| anti Zo_1 | Invitrogen | 40-2300 | Suggested concentration 1:500 |
| Myosin VI | Proteus Biosciences | 25-6791 | Suggested concentration 1:1000 |
| Myosin VIIa | Proteus Biosciences | 25-6790 | Suggested concentration 1:1,000 |
| anti Vangl2 | Merk Millipore | ABN373 | Suggested concentration 1:250 |
| anti Gαi3 | Sigma-Aldrich | G4040 | Suggested concentration 1:250 |
| Alexa Fluor® 488 Phalloidin | Invitrogen/Life Technologies | A12379 | Suggested concentration 1:300 - 1,000 |
| Alexa Fluor® 568 Phalloidin | Invitrogen/Life Technologies | A12380 | Suggested concentration 1:300 - 1,000 |
Referanslar
- Waters, A. M., Beales, P. L. Ciliopathies: an expanding disease spectrum. Pediatr Nephrol. 26, 1039-1056 (2011).
- May-Simera, H. L., Kelley, M. W. Cilia, Wnt signaling, and the cytoskeleton. Cilia. 1, 7 (2012).
- Ross, A. J., et al. Disruption of Bardet-Biedl syndrome ciliary proteins perturbs planar cell polarity in vertebrates. Nat Genet. 37, 1135-1140 (2005).
- Ezan, J., Montcouquiol, M. Revisiting planar cell polarity in the inner ear. Seminars in cell & developmental biology. 24, 499-506 (2013).
- Semenov, M. V., Habas, R., Macdonald, B. T., He, X. SnapShot: Noncanonical Wnt Signaling Pathways. Cell. 131, 1378 (2007).
- Wang, J., et al. Regulation of polarized extension and planar cell polarity in the cochlea by the vertebrate PCP pathway. Nat Genet. 37, 980-985 (2005).
- Montcouquiol, M., et al. Identification of Vangl2 and Scrb1 as planar polarity genes in mammals. Nature. 423, 173-177 (2003).
- May-Simera, H. L., et al. Ciliary proteins Bbs8 and Ift20 promote planar cell polarity in the cochlea. Development. 142, 555-566 (2015).
- Jones, C., et al. Ciliary proteins link basal body polarization to planar cell polarity regulation. Nat Genet. 40, 69-77 (2008).
- Lim, D. J. Functional structure of the organ of Corti: a review. Hearing research. 22, 117-146 (1986).
- Nayak, G. D., Ratnayaka, H. S., Goodyear, R. J., Richardson, G. P. Development of the hair bundle and mechanotransduction. The International journal of developmental biology. 51, 597-608 (2007).
- Denman-Johnson, K., Forge, A. Establishment of hair bundle polarity and orientation in the deveoping vestibular system of the mouse. J. Neurocytol. , 821-835 (1999).
- Sobkowicz, H. M., Slapnick, S. M., August, B. K. The kinocilium of auditory hair cells and evidence for its morphogenetic role during the regeneration of stereocilia and cuticular plates. Journal of neurocytology. 24, 633-653 (1995).
- Denman-Johnson, K., Forge, A. Establishment of hair bundle polarity and orientation in the developing vestibular system of the mouse. Journal of neurocytology. 28, 821-835 (1999).
- van Dam, T. J., et al. The SYSCILIA gold standard (SCGSv1) of known ciliary components and its applications within a systems biology consortium. Cilia. 2, 7 (2013).
- Blacque, O. E., Sanders, A. A. Compartments within a compartment: what C. elegans can tell us about ciliary subdomain composition, biogenesis, function, and disease. Organogenesis. 10, 126-137 (2014).
- Wallingford, J. B., Mitchell, B. Strange as it may seem: the many links between Wnt signaling, planar cell polarity, and cilia. Genes & development. 25, 201-213 (2011).
- Borovina, A., Ciruna, B. IFT88 plays a cilia- and PCP-independent role in controlling oriented cell divisions during vertebrate embryonic development. Cell reports. 5, 37-43 (2013).
- Huang, P., Schier, A. F. Dampened Hedgehog signaling but normal Wnt signaling in zebrafish without cilia. Development. 136, 3089-3098 (2009).
- Ocbina, P. J., Tuson, M., Anderson, K. V. Primary cilia are not required for normal canonical Wnt signaling in the mouse embryo. PloS one. 4, e6839 (2009).
- Jones, C. G. Scanning electron microscopy: preparation and imaging for SEM. Methods Mol Biol. 915, 1-20 (2012).
- Curtin, J. A., et al. Mutation of Celsr1 disrupts planar polarity of inner ear hair cells and causes severe neural tube defects in the mouse. Current biology : CB. 13, 1129-1133 (2003).
- Wang, Y., Guo, N., Nathans, J. The role of Frizzled3 and Frizzled6 in neural tube closure and in the planar polarity of inner-ear sensory hair cells. The Journal of neuroscience : the official journal of the Society for Neuroscience. 26, 2147-2156 (2006).
- Montcouquiol, M., Jones, J. M., Sans, N. Detection of planar polarity proteins in mammalian cochlea. Methods Mol Biol. 468, 207-219 (2008).
- May-Simera, H., Kelley, M. W. Examining planar cell polarity in the mammalian cochlea. Methods Mol Biol. 839, 157-171 (2012).
- Yin, H., Copley, C. O., Goodrich, L. V., Deans, M. R. Comparison of phenotypes between different vangl2 mutants demonstrates dominant effects of the Looptail mutation during hair cell development. PloS one. 7, e31988 (2012).
- Rachel, R. A., et al. Combining Cep290 and Mkks ciliopathy alleles in mice rescues sensory defects and restores ciliogenesis. J Clin Invest. 122, 1233-1245 (2012).
- Jagger, D., et al. Alstrom Syndrome protein ALMS1 localizes to basal bodies of cochlear hair cells and regulates cilium-dependent planar cell polarity. Human molecular genetics. 20, 466-481 (2011).
- Collin, G. B., et al. The Alstrom Syndrome Protein, ALMS1, Interacts with alpha-Actinin and Components of the Endosome Recycling Pathway. PloS one. 7, e37925 (2012).
- Copley, C. O., Duncan, J. S., Liu, C., Cheng, H., Deans, M. R. Postnatal refinement of auditory hair cell planar polarity deficits occurs in the absence of Vangl2. The Journal of neuroscience : the official journal of the Society for Neuroscience. 33, 14001-14016 (2013).
- Sorusch, N., Wunderlich, K., Bauss, K., Nagel-Wolfrum, K., Wolfrum, U. Usher syndrome protein network functions in the retina and their relation to other retinal ciliopathies. Advances in experimental medicine and biology. 801, 527-533 (2014).
- Hebert, J. M., McConnell, S. K. Targeting of cre to the Foxg1 (BF-1) locus mediates loxP recombination in the telencephalon and other developing head structures. Dev Biol. 222, 296-306 (2000).
- Willott, J. F. Chapter 8, Measurement of the auditory brainstem response (ABR) to study auditory sensitivity in mice. Current protocols in neuroscience. , Unit8 21B (2006).
- Martin, G. K., Stagner, B. B., Lonsbury-Martin, B. L., et al. Chapter 8, Assessment of cochlear function in mice: distortion-product otoacoustic emissions. Current protocols in neuroscience. , Unit8 21C (2006).
- Finetti, F., et al. Intraflagellar transport is required for polarized recycling of the TCR/CD3 complex to the immune synapse. Nature cell biology. 11, 1332-1339 (2009).
- Sedmak, T., Wolfrum, U. Intraflagellar transport molecules in ciliary and nonciliary cells of the retina. J Cell Biol. 189, 171-186 (2010).
- Yuan, S., Sun, Z. Expanding horizons: ciliary proteins reach beyond cilia. Annual review of genetics. 47, 353-376 (2013).
- Tarchini, B., Jolicoeur, C., Cayouette, M. A molecular blueprint at the apical surface establishes planar asymmetry in cochlear hair cells. Developmental cell. 27, 88-102 (2013).
- Ezan, J., et al. Primary cilium migration depends on G-protein signalling control of subapical cytoskeleton. Nature cell biology. 15, 1107-1115 (2013).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır