Method Article
Avaliação da Planar-Cell-Polaridade fenótipos em Ciliopathy rato mutante cóclea
Neste Artigo
Resumo
Primary cilia influence various signaling pathways. The mammalian cochlea is ideal for examining planar cell polarity (PCP) signaling. Cilia dysfunction affects cochlear outgrowth, cellular patterning and hair cell orientation, readouts of PCP. Our goal is to analyze PCP signaling in mouse cochlea via phenotypic analysis, immunohistochemistry and scanning electron microscopy.
Resumo
In recent years, primary cilia have emerged as key regulators in development and disease by influencing numerous signaling pathways. One of the earliest signaling pathways shown to be associated with ciliary function was the non-canonical Wnt signaling pathway, also referred to as planar cell polarity (PCP) signaling. One of the best places in which to study the effects of planar cell polarity (PCP) signaling during vertebrate development is the mammalian cochlea. PCP signaling disruption in the mouse cochlea disrupts cochlear outgrowth, cellular patterning and hair cell orientation, all of which are affected by cilia dysfunction. The goal of this protocol is to describe the analysis of PCP signaling in the developing mammalian cochlea via phenotypic analysis, immunohistochemistry and scanning electron microscopy. Defects in convergence and extension are manifested as a shortening of the cochlear duct and/or changes in cellular patterning, which can be quantified following dissection from developing mouse mutants. Changes in stereociliary bundle orientation and kinocilia length or positioning can be observed and quantitated using either immunofluorescence or scanning electron microscopy (SEM). A deeper insight into the role of ciliary proteins in cellular signaling pathways and other biological phenomena is crucial for our understanding of cellular and developmental biology, as well as for the development of targeted treatment strategies.
Introdução
cílios são apêndices longos à base de microtúbulos que se estendem a partir da superfície da maioria das células de mamífero. cílios são muitas vezes confundidos com cílios móveis, dos quais há sempre múltiplas por célula, e cuja finalidade é mover o líquido através de superfícies de membranas. cílios, ao contrário, adotar papéis sensoriais e são, consequentemente, também referida como cílios sensorial. Uma vez que há muito esquecido, esta organela foi recentemente 'redescoberto' como resultado de sua associação com uma infinidade de doenças genéticas humanas 1. Idealmente posicionado como um organelo de sinalização, o cílio primário tem sido demonstrado que regulam numerosas vias de sinalização, muitas das quais são importantes, não só na homeostasia dos tecidos e doença, como também durante o desenvolvimento 2.
Uma das primeiras vias de sinalização mostrado estar associada com disfunção cílios foi a via de sinalização Wnt não canónicas, também conhecida como a polaridade celular planar (PCP) via > 3. Esta cascata de sinalização inicialmente identificado em Drosophila, é crítico para a embriogénese; em particular para os processos de convergência e de extensão e para a orientação correcta de células no plano de epitélios 4. A sinalização sequencial de um núcleo de um conjunto de proteínas reguladoras traduz sinais direccionais que em última análise levam a rearranjos do citoesqueleto e resultam na polarização coordenada de células epiteliais num plano 5. O processo de convergência e de extensão é absolutamente necessária para o ducto coclear para alongar e para a correcta modelação celular 6. Como este é regulado através da activação da via de PCP, um dos mais marcantes de fenótipos mutantes PCP cóclea é um ducto coclear encurtado com desorganizado epitélio sensorial 7. Da mesma forma, ratos mutantes, que não têm cílios, também apresentam como uma convergência e extensão fenótipo 8,9, embora precisamente como isso é regulado continua a ser elucidado.
ve_content "> Como os processos de convergência e de extensão são críticas para o crescimento do ducto coclear, e padronização celular do epitélio sensorial dentro do ducto coclear, na cóclea em desenvolvimento é um órgão ideal para analisar a sinalização PCP durante o desenvolvimento dos vertebrados. O órgão de Corti, o termo dado para o epitélio sensorial especializado que as linhas do ducto coclear, é constituído por células de suporte não-sensoriais e células ciliadas mecanosensorial que devem ser uniformemente orientada para a cóclea para funcionar 10. as células ciliadas mecanosensorial são assim chamados por causa da feixes stereociliary que se estendem a partir da placa cuticular (superfície apical) de cada uma das células pilosas sensitivas 11. Estes agem como transdutores primárias de mechanosensation e apesar da sua nomenclatura como estereocílios, são na verdade, composto de microvilosidades à base de filamentos de actina modificado. Dentro de cada cabelo em forma de viga pacote, três fileiras de estereocílios são organizados em uma pa altamente ordenada e regular,ttern em um caso semelhante a forma de escada. Cílios à base de microtúbulos real, kinocilia chamados, são necessários para o desenvolvimento e orientação dos feixes stereociliary 12. Em cima de cada célula de cabelo, um único cinocílio está fisicamente ligado ao pacote stereocilia, com localização central adjacente à linha mais alta de estereocílios. A função precisa da cinocílio não é clara, e uma hipótese é que a cinocílio 'puxa' estereocílios em forma à medida que amadurecem a partir microvilosidades 12. Nos vertebrados, kinocilia na cóclea estão presentes apenas transitoriamente e retrair a partir das células ciliadas em ratos antes do início da audição 11,13,14.Perda completa dos cílios na cóclea em desenvolvimento resulta em ductos cocleares severamente encurtado, mis-formados e mal-orientada feixes stereociliary, bem como corpos basais mis-posicionado 8,9. Um cílio funcional não é apenas composto pelo axonema ciliar. Muitas proteínas associadas com cíliosfunção ocorrem em complexos localizados para subdomínios cílios-relacionadas, como o corpo basal, zona de transição, ou axonema ciliar 15. O corpo basal, derivado do centriole mãe do centrossoma, é também um centro-organização de microtúbulos de microtúbulos que se estendem para longe do cílio para o corpo celular e pode regular o tráfico intracelular, bem como o tráfico ciliar. A zona de transição ciliar é outra região onde a função ciliar é regulada em termos de organização de importação e exportação de compostos ciliares 16.
Vários estudos têm identificado uma ligação entre os cílios e Wnt não canónicas (sinalização PCP), embora o mecanismo exacto é incerto 17. Redundância dos genes ciliares e do PCP e da sensibilidade da polaridade celular para anormalidades celulares generalizadas, tornam difícil ligar diretamente uma mutação a déficits específicos do PCP. Uma das saídas de leitura de sinalização PCP é o posicionamento do corpo basal e Primary cílio, portanto, segregando o principal dos defeitos secundários é um desafio. Alguns estudos em peixes-zebra e mouse mutantes sugeriram nenhuma conexão entre os cílios e sinalização Wnt 18-20. Discrepâncias nos dados podem refletir espécies, tecidos ou diferenças temporais dependentes das contribuições ciliares no sentido de sinalização Wnt. Além disso, a capacidade de resposta Wnt normal, pode ser mantido se os corpos basais permanecem funcionais. Uma visão mais profunda sobre o papel das proteínas ciliares em vias de sinalização celular e outros fenômenos biológicos é crucial para a nossa compreensão da biologia celular e de desenvolvimento, bem como para o desenvolvimento de estratégias de tratamento direcionados.
Protocolo
Use e sacrificar todos os animais de acordo com as diretrizes e regulamentos institucionais e governamentais, mais comumente através de inalação de CO 2 e deslocamento cervical.
1. Preparação dos Reagentes
NOTA: Antes de começar, prepare todos os reagentes utilizando reagentes de qualidade analítica. Faça soluções utilizando grau molecular água destilada e deionizada salvo indicação em contrário.
- Salina tamponada com fosfato (PBS 1x): Adicione 1 L de 1x PBS dissolvendo 8g de NaCl, 0,2 g de KCl, 1,44 g de Na 2 HPO 4 e 0,24 g de KH 2 PO 4 em 1 L de H 2 O. Ajustar o pH para 7,4 com HCl. O PBS não necessitar de ser estéreis e podem ser armazenados à temperatura ambiente. Note-se que esta reserva é feita sem CaCl2 ou MgCl2.
- Paraformaldeído (PFA a 4%): Prepara-se uma solução a 4% de PFA em PBS 1x numa hotte ventilada. Adicionar 40 g de pó de paraformaldeído a 1 L de 1x PBS. Para dissolver, agitar e aquecer até aproximadamente 60 ° C,e adiciona-se lentamente gota a gota de NaOH para aumentar o pH. Uma vez que o pó se dissolva, reajustar o pH para 7,4 com HCl. Filtrar através de um filtro de 0,45 um e congelar alíquotas. Descongelar uma nova porção para cada experimento.
- tampão Triton: Prepara-se uma M de Tris-HCl 0,1 M (pH 7,5), NaCl 0,15 M, 0,1% de Triton X-100 a solução através da dissolução de 8,77 g de NaCl em 1 L de Tris-HCl 0,1 M (pH 7,5). Adicionar 1 mL de Triton X-100. Agita-se para dissolver. Loja tampão Triton à TA.
- Triton bloco: preparar o soro de cabra a 10% em tampão Triton pela adição de 1 ml de soro de cabra a 9 ml de tampão Triton. Armazenar a 4 ° C. Se usando anticorpos primários produzidos em ratinhos, adicionar de cabra anti-IgG de ratinho fragmentos Fab a uma diluição de 1 em 200 para o bloco de Triton para o passo de bloqueio.
NOTA: Se pretende utilizar amostras para microscopia eletrônica de varredura (SEM), preparo de reagentes adicionais, conforme listado abaixo. - Solução Salina Equilibrada de Hanks (HBSS) com cálcio e magnésio: Adicione uma solução de HBSS 1x por diluição a partir de uma solução estoqueno estéril destilada H 2 O. Como tampão HBSS é complicado de fazer e há riscos envolvidos, é aconselhável pedir uma solução 10x estoque premade. A concentração final de HBBS tampão rotineiramente utilizados é a seguinte: 1,26 mM de CaCl 2, MgCl 2 0,49 -6H2O, 0,41 mM MgSO 4 -7H2O, KCl 5,33 mM, KH 0,44 mM 2 PO 4, 4,17 mM de NaHCO3, NaCl 137,93 mM , 0,34 mM de Na 2 HPO 4, dextrose 5,56 mM.
- tampão Hepes: Prepara-se uma solução 0,1 M de Hepes em 1X HBSS, por dissolução de 23,8 g de HEPES em 1 L de tampão 1x HBSS.
- Scanning fixador microscopia de electrões (SEM Fix): Preparar fixador para SEM por diluição de electrões glutaraldeído grau microscopia (2,5%) e paraformaldeído (4%) em tampão de Hepes. Adicionar CaCl2 até uma concentração final de 10 mM.
- 1% de tetróxido de ósmio (OsO4) em tampão de Hepes; 1% de tetróxido de ósmio em água: Dilui-se uma solução estoque de tetróxido de ósmio em tampão Hepes, e separately em estéril H2O destilada, a uma concentração final de 1%. Tetróxido de ósmio é altamente tóxico e é mais comumente vendido como uma solução a 4%.
- 1% (w / v) de ácido tânico: Dissolve-se 0,5 g de ácido tânico em 50 ml estéril H2O destilada Filtro de esterilizar por filtração através de um filtro de tamanho de poro de 0,45.
- Gradual etanol série solução: Diluir 200 proof de etanol com estéril H2O destilada para fazer soluções de 30, 50, 70, 90 e 95% de etanol. Para os enxaguamentos finais de etanol, com 100% de etanol 200 de prova é necessária. Use uma garrafa recém-inaugurado de 200 etanol de prova para as lavagens finais.
2. Escolha de Tissue
- Idealmente, examinar embriões ou filhotes jovens entre as idades de dia embrionário 16,5 (E16.5) e dia pós-natal 3 (P3).
NOTA: A ossificação do labirinto ósseo e ossos temporais torna a dissecção progressivamente mais desafiador como ratos amadurecer. Também kinocilia, o único verdadeiro cílio à base de microtúbulos encontrada nas células ciliadas da cóclea,retrai durante o desenvolvimento e não está mais presente em ratos adultos. - Após a fixação, descalcificação adulto cochleae. Coloque dissecados (ver secção 3) labirintos ósseas, em 2 ml de EDTA (4,13% em PBS), pH 7,3, num tubo de microcentrífuga durante 3 - 4 dias, com rotação. Reabastecer EDTA diária. Após os tecidos tem suavizado, lavar em 1,5 ml ou mais PBS 3 vezes durante 5 minutos em um nutator com o aumento da agitação.
3. cóclea Dissection
- Pós eutanásia através de deslocação cervical ou inalação de CO 2 (100% CO 2), remover a cabeça. Usar uma lâmina de bisturi ou tesoura pequena, dependendo do tamanho do animal, para dissecar a cabeça ao longo da linha média sagital começando no nariz e que se estende no sentido caudal. Remover o cérebro de cada metade do crânio com um par de pinças. Identificar os ossos temporais, que contêm os em desenvolvimento labirintos ósseas do ouvido interno (ver seta na Figura 1A).
- Use um par de paraceps para isolar cuidadosamente os labirintos ósseo do crânio (ossos temporais). Faça isso sob um microscópio de dissecação. Prise afastado o tecido ósseo do crânio, executando a pinça delicadamente debaixo dos labirintos ósseas. Em animais, até ao P4 os labirintos ósseas são ainda cartilaginoso e pode ser facilmente removido sem quebrar.
- Seguindo dissecção, use a ponta da pinça de dissecação para limpar a janelas oval e redonda e faça um pequeno furo no ápice da espiral coclear. Corrigir os labirintos ósseo antes de nova dissecção do ducto coclear. Para permitir a fácil remoção da membrana tectória (ver 3.7), corrigir os labirintos ósseo em 1,5 ml PFA 4% para 5 min em gelo.
NOTA: Se a remoção da membrana tectória não é necessário, mais fixação é aconselhada (ver 4,1-4,3). Breve fixação dos ossos temporais anteriores a dissecção do ducto coclear auxilia o processo de dissecção e a remoção da membrana tectória. dissecção pós e exposição do órgão de Corti, Furtsua fixação é necessária. - Além disso dissecar os labirintos ósseas para expor o epitélio sensorial da cóclea como se segue. Coloque os labirintos ósseo em um prato de dissecação revestido de espuma elastomérica de silicone preta contendo PBS para facilitar a dissecção. Usar pinos minutien para imobilizar o tecido, se necessário. Para usar pinos minutien, colocá-los através da porção vestibular dos labirintos ósseas com o aspecto ventral da espiral coclear virada para cima.
NOTA: Preto silicone elastómero prato: Mix componente base elastómero de silicone com carvão em pó para obter uma cor preta opaca. Adicionar o agente de cura e despeje em uma ou mais placas de petri (vidro ou plástico). Seca-se sob vácuo para remover as bolhas de ar aprisionadas. pratos secar completamente antes de usar. - Utilize uma pinça fina (# 5) para remover a cartilagem exterior expor o dueto coclear. Comece na janela oval; insira a ponta inferior do fórceps para a janela oval e com cuidado levante abrir a cartilagem, movendo-se lentamente para cima para oápice.
- Após a exposição do ducto coclear, remover a superfície ventral, a membrana de Reissner. Use um belo par de fórceps para beliscar a membrana de Reissner na base do ducto coclear e retire-a em um movimento ascendente. Visualizar o aspecto dorsal do ducto coclear, incluindo o epitélio sensorial.
- Remover a membrana tectória como descrito abaixo (opcional). Para SEM ou imuno-histoquímica da cinocílio ou feixes stereociliary remover a membrana tectória.
- Use um belo par de fórceps (# 55 ou mais fino) para comprimir a membrana tectória na base da cóclea e descascar para cima em direção ao ápice.
NOTA: A membrana tectória é opticamente clara o que torna difícil de identificar. Mais frequentemente do que não a membrana sai em uma parte e embora não seja facilmente visualizado, pode-se sentir a resistência, uma vez que é puxado para fora do órgão de Corti exposta. - Depois de expor o órgão de Corti, corrigir ainda mais o tecido como described abaixo. Reter a região vestibular para ajudar ainda mais a preparação dos tecidos.
4. Fixação
- Para imuno-histoquímica normal fixar os labirintos ósseas dissecados em 1,5 mL de PFA a 4% a 4 ° C num nutator durante 2 h.
NOTA: Devido à sensibilidade de diferentes anticorpos e antigénios, as variações no comprimento e composição de fixação pode não ser necessária e deve ser optimizada para cada anticorpo. - Após a fixação, lavar as amostras por lavagem em 1,5 ml ou mais de PBS 3 vezes durante 5 minutos em um nutator com agitação aumentada. As amostras podem ser armazenadas em PBS a 4 ° C, durante várias semanas antes de processar.
- Se preparando amostras para MEV, Fix dissecados ossos temporais em SEM correção (ver 1.7) durante 2 horas à temperatura ambiente. Lavar por lavagem em 1,5 ml de tampão HEPES ou mais 3 vezes durante 5 minutos em um nutator com agitação aumentada. Armazenar em tampão Hepes a 4 ° C até posterior processamento. Armazenamento por mais de um par de semanas não é recomendado.
5. A imuno-histoquímica
- Realizar imuno-histoquímica em amostras dissecados em um poço de uma placa de 96 poços de fundo plano. Em alternativa, usar uma PCR ou tubo de microcentrífuga. É aconselhável para reter a porção vestibular do labirinto ósseo para facilitar o processamento.
- Permeabilizar o tecido, por incubação em 1,5 mL de tampão Triton, durante 1 h à TA em uma nutator com agitação suave.
- Bloquear o tecido, por incubação em 0,5 ml de Triton bloco para um mínimo de 1 hora à TA. Se estiver usando anticorpos primários levantados no rato, adicionar fragmentos de anti-IgG Fab para o bloco a uma diluição de 1 em 200 (ver secção 1.4). Isto diminui grandemente a ligação não específica de IgG anti-ratinho de rato tecido.
- Incubar o tecido com anticorpos primários diluídos em Triton bloco de O / N a 4 ° C com agitação suave. diluição do anticorpo depende de anticorpos a ser utilizado (ver secção 6.1). Alternativamente incubar antibodie primárias durante 2 h à TA. Idealmente utilizar um volume mínimo de diluição de anticorpo primário ml 0,5. Se o anticorpo é limitado, utilizar o menor volume de diluição do anticorpo que envolve completamente o tecido.
- Lavar o tecido por enxaguamento com 1,5 mL de tampão Triton, ou mais, um mínimo de 3 vezes durante 15 min, em um nutator com agitação aumentada.
- Incubar o tecido com anticorpos secundários conjugados com corantes fluorescentes diluídas aos fabricantes concentração recomendada (tipicamente 1: 200-1: 1000) no bloco de Triton durante 1 h à TA em uma nutator. Utilizar um volume mínimo de diluição de anticorpo secundário a 0,5 ml.
- Centrifuga-se o anticorpo secundário diluído a 13.000 xg durante 3 min antes de usar para minimizar a ligação não específica do anticorpo secundário de agregados. Proteger o tecido da luz a partir deste passo em diante, a fim de evitar a fotodegradação dos corantes fluorescentes.
- Tal como na etapa 5.5, lavar o tecido por enxaguamento com 1,5 mL de tampão Triton ou mais, um mínimo de 3 vezes durante 15 min, numanutator com agitação aumentada. Armazenar as amostras em PBS a 4 ° C até estar pronto para montagem.
6. Selecção de Anticorpos
NOTA: A fonte de anticorpos recomendadas e seus diluições estão listados na tabela de materiais e equipamentos específicos. Realizar as incubações de anticorpos como descrito no capítulo 5.
- Para visualizar a cinocílio à base de microtúbulos, usar um marcador ciliar axoneme tais como anti-Arl13b (1: 1000) ou anti-acetilado-α-tubulina (1: 800). Visualizar a basal do corpo, utilizando um anticorpo contra γ-tubulina (1: 200) ou qualquer outro marcador centrosomal.
- Para visualizar os feixes de actina stereociliary rico em filamentos, adicionar faloidina (1: 300 - 1000) conjugado a um dos vários fluoróforos diferentes para a incubação do anticorpo secundário. Faloidina etiquetas também outras estruturas de actina filamentosa, incluindo os filamentos de actina corticais em torno da periferia de cada uma das células epiteliais do cabelo. Isso é útil na determinaçãoo contorno de cada célula de cabelo. Usar um marcador de membrana alternativa, tais como anti-ZO-1 (1: 500), se necessário.
- Rotular células ciliadas da cóclea, utilizando anticorpos contra a miosina VI (1: 1.000) ou miosina VIIa (1: 1.000). Estes podem ser usados se avaliar comprimento cóclea.
NOTA: Use anticorpos conjugado com corante fluorescente apropriados secundárias otimizadas para as exigências do microscópio.
7. Montagem e imagem
- Colocar a amostra em um prato de silicone elastómero preto contendo PBS. Usando uma pinça fina, retire a região vestibular da espiral coclear.
- Muito cuidadosamente remover a cartilagem subjacente e mesênquima da espiral coclear. A espiral coclear restante contém o sulco interior, órgão de Corti e sulco exterior.
- Transferir a espiral da cóclea em uma gota de PBS colocada numa lâmina de microscópio. Se desejado, separar a espiral da cóclea em partes equivalentes para um turno. Este passo não é necessário, no entanto, e pode levar a Loss do tecido. A superfície apical (lado stereocilia) das células ciliadas da cóclea deve estar voltado para cima em direção a lamela.
- Wick afastado o PBS com um tecido absorvente ou um pedaço de papel de filtro e gentilmente reposicionar a espiral da cóclea se o epitélio mudou e se sobrepõe sobre si mesmo.
- Adicionar uma gota de meio de montagem diretamente na amostra cóclea e coloque delicadamente uma lamela em cima, tomando cuidado para evitar bolhas de ar. Sem espaçadores são necessários; colocar a lamela directamente sobre a amostra. A, não-fluorescente solúvel em água, meio de montagem semi-permanentes, que não requer passos adicionais para manter a lamela em lugar é recomendado. meios de montagem e espessura de lamela deverão ser compatíveis para microscópio especificações.
- Usar um microscópio epifluorescente ou confocal de laser de varrimento equipado com ampliação elevada (63 - 100x), abertura numérica elevada (1,2 - 1.4) objectivos para capturar imagens da superfície apical das células ciliadas cocleares. Use loobjectivos WER (5 - 20X) para tomar várias imagens da espiral coclear para quantificar o comprimento do ducto coclear. lasers de excitação do fósforo e filtros de emissão para fluoróforos utilizados para anticorpos secundários.
8. Microscopia Eletrônica de Varredura
- Continue a partir da secção 4.3. Depois de lavar as amostras SEM fixos em tampão Hepes, execute os seguintes passos sob ventilação. O protocolo seguinte funciona bem para o tecido da cóclea e evita a utilização de revestimento por pulverização com um metal condutor.
- Pós-correcção em 1% de OsO 4 em tampão de Hepes, durante 1 h, seguida por 3 lavagens com 1 ml de água destilada durante 5 minutos cada. O menor volume de OsO 4, que envolve completamente o tecido deve ser usada para minimizar o desperdício tóxico. Não é necessário agitação.
- Incubar as amostras a temperatura ambiente em cada uma das seguintes soluções durante 1 hora com 3 lavagens com 1 ml de água destilada durante 5 min cada em entre os passos: 1% de ácido tânico recentemente feita em água e filtered antes da utilização; 1% de OsO 4 em água, ácido tânico 1% em água, 1% de OsO 4 em água.
- Desidratar as amostras através de uma série de etanol graduada por incubação durante 10 min em cada uma das seguintes diluições: 30, 50, 70, 90, e 95%. Não é necessário agitação.
- amostras de transferência através de três mudanças, 5 min cada, de 100% de etanol (de uma garrafa recém-inaugurado de 200 etanol de prova).
- Executar os exemplos que um secador de ponto crítico seguintes instruções do fabricante.
- Montar as amostras utilizando cola de carbono condutora na parte superior de um suporte de SEM antes da imagem de um microscópio electrónico. Sob um microscópio estereoscópico, usar um par de fórceps finos e de um pincel para posicionar cuidadosamente a amostra com o epitélio coclear voltado para cima. Utilizar a porção vestibular da amostra a "âncora" o tecido para o topo. Armazene as amostras em um dessecador até imagiologia. Realizar imagem SEM como descrito em Jones (2012) 21.
9.quantificação
- Após a preparação imuno-histoquímica, adquirir imagens usando um epifluorescência ou laser de varredura microscópio confocal. Após a preparação para a SEM, usar um microscópio eletrônico de varredura para a imagem dos espécimes. Imagem da superfície apical do órgão de Corti com as células ciliadas cocleares expostas e células de apoio intercalados.
- Definir posições específicas ao longo do ducto coclear, tais como 25, 50, e 75% a partir da base e usá-los para comparar regiões cóclea entre amostras mutante e de controlo. Analisar e comparar mutantes cílios com seus controles da mesma ninhada, como as diferenças de fundo genético pode modificar o fenótipo coclear.
NOTA: O órgão de Corti desenvolve-se em um gradiente que se estende a partir de meados da década de base na direcção tanto o vértice e a base. No rato, o desenvolvimento não está completo até P14, por isso é importante comparar regiões em estágios e posições de desenvolvimento semelhantes. - Tirar fotos usando o software que acompanha o microscópio que alloW para a quantificação do fenótipo particular, como requerido (ver abaixo). Use software de análise de imagem, como imagem de J ou software que acompanha o microscópio para medir comprimentos, contagem de células e determinar a localização da proteína como descrito abaixo. Gráfico esses dados como um gráfico de barras, gráfico de dispersão, a caixa blot ou histograma, comparando o controle vs. mutante.
- O comprimento total do ducto coclear (Figura 3A):
- Usando um marcador de células de cabelo ou phalloidin, (que marca os pacotes stereociliary), determinar e medir onde o epitélio sensorial começa e termina. O comprimento do ducto coclear é encurtado frequentemente em mutantes cílios.
- Anormalidades pacote Stereociliary (Figura 3B, D, E, G):
- Medir convexidade feixe (altura) como a menor distância entre o vértice do feixe e a linha que se estende através de ambas as extremidades do feixe de «braços» como se mostra na Figura 3G, à esquerda. Alternativamente, quantificar a áreaenglobadas pelos braços de feixe stereociliary das células ciliadas externas como se mostra na Figura 3G, direita. Se as células ciliadas com feixes stereociliary circulares podem ser identificados estes contam como uma percentagem do total de células capilares.
NOTA: Em muitos mutantes ciliares anormalidades pacote pode ser observado independentemente da orientação pacote. É difícil quantificar com precisão anormalidades pacote stereociliary.
- Medir convexidade feixe (altura) como a menor distância entre o vértice do feixe e a linha que se estende através de ambas as extremidades do feixe de «braços» como se mostra na Figura 3G, à esquerda. Alternativamente, quantificar a áreaenglobadas pelos braços de feixe stereociliary das células ciliadas externas como se mostra na Figura 3G, direita. Se as células ciliadas com feixes stereociliary circulares podem ser identificados estes contam como uma percentagem do total de células capilares.
- Orientação dos feixes stereociliary (Figura 3B, C, G):
- Avaliar a orientação de cada feixe indivíduo em relação a uma linha que se estende perpendicularmente à linha de células pilar que separa as células ciliadas externas e internas. As células com uma orientação normal estão alinhadas ao longo deste eixo perpendicular e por isso têm uma rotação de 0o. Determinar ângulos de rotação usando uma notação de 360 ° ou desvios absolutos de 0 °.
- Posicionamento Kinocilia ou posicionamento pacote stereociliary (Figura3B, F, H):
- Contagem de a percentagem de células nas quais kinocilia estão ausentes. Medir a distância do cinocílio ao "vértice" ou centro do feixe. O "vértice" do feixe pode não ser fácil de se definir feixes são anormais, e de modo que o centro do feixe pode ser usado em substituição.
- Quantificar a posição de kinocilia e feixes stereociliary na superfície apical das células ciliadas, por sobreposição de uma grade de posicionamento para cada célula de cabelo e que marca a posição de quer a base do cinocílio ou o vértice / centro do feixe stereociliary. Exibir os dados como uma porcentagem de cada categoria que se encontra dentro de uma região específica do grid, e sobrepondo os locais de cada marcação em uma grade de posição.
NOTA: Em tecidos de controle, kinocilia estão sempre ligados ao vértice do pacote stereociliary. Em mutantes cílios, kinocilia são muitas vezes ausente, ainda mislocalized ainda ligado, ou mesmo completamente separada das spacote tereociliary. - Kinocilia comprimento (Figura 3I):
- Medir o comprimento do cinocílio por marcação com um marcador axoneme ciliar. Apenas medir kinocilia que fiquem retos dentro de um plano confocal 1,5 mm. Confirmar que os cílios são deitado observando uma vista em corte transversal do tecido digitalizada. Comparar amostras emparelhadas com idade a partir da mesma região da cóclea desde o cinocílio retrai durante o desenvolvimento.
- Mislocalization de proteínas de polaridade:
- Seguindo imuno-histoquímica utilizando anticorpos contra as proteínas, tais como polaridade e Vangl2 Gαi3, determinar a localização por meio de imagiologia.
NOTA: Em alguns mutantes cílios, localização de proteínas de polaridade é interrompido. Estes incluem Vangl2 e Gαi3, que foram mostrados para ser interrompido em Ift20, Bbs8 e Bbs6 cóclea mutante.
NOTA: Mais exemplos de como quantificar e Polarit células ciliadas exibiçãoY pode ser encontrada nos seguintes documentos. Curtin, et ai. (2003) Current Biology 22, Montcouquiol, et ai. (2003) Nature 7, Wang, et al (2006) The Journal of Neuroscience 23, Montcouquiol, et ai. (2008) Methods in Molecular Biology 24, May-Simera, et al. (2012) Methods in Molecular Biology 25, Yin et al (2012) PLoS ONE 26.
Resultados
Cóclea Dissecção e Preparação de tecidos
Após remoção do cérebro, pós-linha média dissecção sagital de uma cabeça de rato P0, o labirinto ósseo, visto de trás, pode ser visualizado (Figura 1A, seta branca) e removido. A Figura 1B mostra os ósseas labirintos isolado com o cabelo coclear virados para cima, ventral, (à esquerda) e por trás, dorsal (direita). A seta aponta branco para a janela oval de onde se pode começar a remover a cartilagem exterior. Uma vez que a cartilagem exterior tenha sido completamente removido, o ducto coclear exposto, ainda intacta, pode ser observado (Figura 1C). Posicionamento de um alfinete através da região vestibular para ajudar dissecção é mostrado. Dois pinos, colocados em ângulos diferentes, também pode ser utilizado para ancorar o tecido. A Figura 1D mostra o ducto coclear após a remoção do Reissner '; S da membrana e a membrana tectória (esquerda) e da espiral coclear epitelial isolado uma vez que tenha sido isolado a partir da região vestibular em preparação para a montagem para imuno-histoquímica (à direita). Para dar uma idéia geral do que o cabelo coclear exposta parece, uma preparação SEM intacta é mostrado na Figura 1E.
Morfologia e Imunofluorescência no controle da cóclea
Após a preparação do tecido coclear, a superfície dorsal do ducto coclear contendo o órgão de Corti é exposta e pode foi visto por SEM ou através de coloração imunofluorescente. Visto como um todo de montagem em uma preparação, os quatro fileiras de células ciliadas mecanosensorial (uma linha de células ciliadas internas e três fileiras de células ciliadas externas) podem ser distinguidos. Figura 2A mostra uma vista em baixa ampliação do giro basal da cóclea embrionárias de rato , F preparadoou MEV. Observe a orientação uniforme e alinhamento dos feixes stereociliary à base de actina. Além disso, a morfologia dos feixes stereociliary é consistente, cada pacote tem a forma clássica ")" (em células capilares internas) ou "W" (em células ciliadas externas). Após a ampliação mais de perto esta idade microvilosidades adicionais pode ser visto, não só sobre a superfície apical das células ciliadas, mas também no meio das células ciliadas sobre as células de suporte (Figura 2B). Estes irão recuar deixando apenas três linhas de feixes stereociliary sobre as células ciliadas externas e dois nas células ciliadas internas em adultos. Como pode ser visto na Figura 2C (seta branca), um único cinocílio à base de microtúbulo (uma verdadeira cílio primária) está localizada adjacente à linha mais alta de estereocílios no vértice de cada feixe stereociliary. Estes estão ligados ao pacote através de links kinocilia.
etiquetagem fluorescente com faloidina, que laboratórioels actina, destaca a orientação uniforme e forma dos feixes em tecido de controlo (Figura 2D). actina cortical também é marcado, o que é útil para determinar a circunferência apical de cada célula individual do cabelo. Co-marcação com faloidina e um anticorpo contra miosina 7a (Figura 2E), um marcador de células de cabelo, também ajuda a diferenciar entre células ciliadas e células de suporte. Miosina 7a é também um marcador útil para a medição de extensão ducto coclear (ver Figura 3A). Um anticorpo contra acetilada-α-tubulina é comumente utilizado para identificar o cinocílio à base de microtúbulos (Figura 2F). Como as células de apoio também abrigam cílios, é importante distinguir entre os cílios que emanam de células ciliadas vs. intercalando células de suporte. Um marcador de membrana adicionais, tais como anticorpos contra ZO-1 (Zona occludens 1), que define claramente o padrão de mosaico da membrana apical do ducto coclear, é, portanto, útil ( Figura 2F). De outra consideração é que os anticorpos contra acetilado-α-tubulina também rotular os microtúbulos internos e por isso o cuidado deve ser tomado quando imagiologia para se concentrar na superfície apical da célula de cabelo. Os microtúbulos nas células pilares são particularmente densa (Figura 2G, asterisco branco). Uma combinação de phalloidin e rotulagem anti-acetilado-α tubulina é muitas vezes usado para identificar simultaneamente feixes stereociliary e kinocilia vizinhos (Figura 2G, seta branca).
Fenótipo coclear em Cilia Mutantes
Alongamento do ducto coclear é uma das melhores saídas de leitura de defeitos de convergência e de extensão, e ductos cocleares encurtados são comumente observados em mutantes PCP clássicos. A cóclea em mutantes ciliares muitas vezes ter encurtado ductos cocleares e mostrar um alargamento significativo do Epítetos sensoriallia no vértice, como pode ser visto na Ift20 CKO / CKO ratinhos (Figura 3A). Outro defeito PCP clássica é a perturbação da orientação uniforme das células ciliadas, como pode ser visto nas Bbs8 - / - ratos tanto com imuno-histoquímica (Figura 3B, a seta direita) e com o SEM (Figura 3C). Além de pacotes mis-oriented, achatado e feixes deformados também são frequentemente observados (Figura 3B, seta média; Figura 3D). Muitas vezes circulares feixes, tal como pode ser observado na Figura 3E, estão presentes, especialmente em células de cabelo completamente desprovido de kinocilia. Mis-localização do cinocílio também é comum.
O cinocílio localizada-mis pode ou não pode estar ligado ao feixe stereociliary (Figura 3B, seta para a esquerda; Figura 3F). Exemplos de como quantificar buorientação e posicionamento kinocilia ndle ou pacote são mostrados na Figura 3G e 3H. A orientação de cada feixe indivíduo pode então ser avaliada determinando a rotação do feixe de relativa a uma linha que se estende perpendicularmente à linha de células pilar que separa as células ciliadas externas e internas. As células com uma orientação normal estão alinhadas ao longo deste eixo perpendicular e por isso têm uma rotação de 0 ° (Figura 3G). A posição do cinocílio, ou o centro do feixe stereociliary, podem ser representados através da sobreposição de uma grade de posição sobre a superfície luminal das células ciliadas e, em seguida, determinar a localização dos kinocilia ou pacote dentro da grade (Figura 3I). Mutações em genes cílios afectam frequentemente comprimento cílios, e assim o comprimento do cinocílio pode ser avaliada. Em CEP290 mutantes rd16 / rd16, kinocilia são mais longos do que nos controles (Figura 3J). Como os retrai cilium,é crítico para ter em geral combinados companheiros de ninhada e para fazer as medições da mesma região da cóclea. Para obter boas imagens para análise e quantificação, tanto para imuno-histoquímica e SEM, é crítico para remover a membrana tectória. A Figura 3F mostra uma microfotografia SEM na qual a membrana tectória não tenha sido completamente removido.
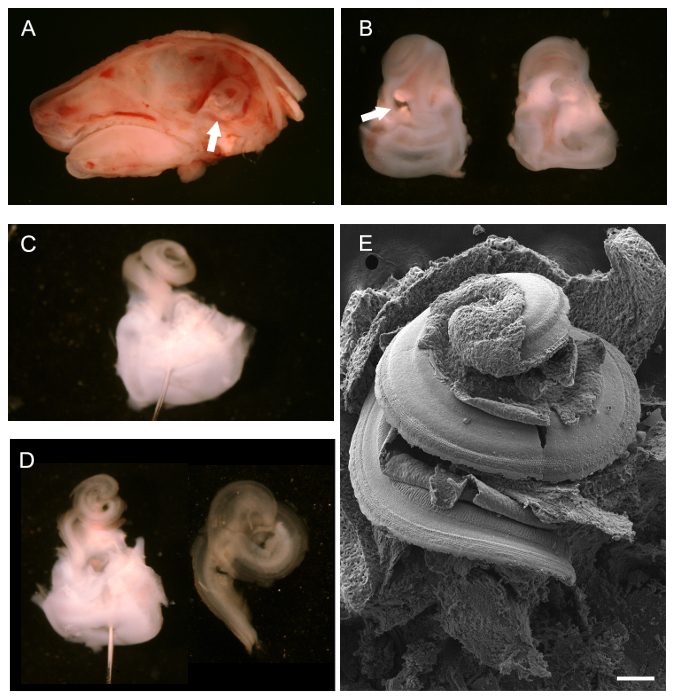
Figura 1. Dissecção de um rato cóclea Desenvolvimento (P0). (A) Mid-line dissecção sagital da cabeça P0 rato com cérebro removido. A seta aponta para a posição de branco do labirinto ósseo. (B) Ventral (esquerda) e dorsal (direita) pontos de vista dos labirintos ósseas dissecados. A cóclea está localizada na parte superior com a porção vestibular no fundo pontos seta branca para a janela oval. (C) A ré labirinto ósseoer remoção da cartilagem exterior da cóclea. Um pino foi colocado através do sistema vestibular. (D) a esquerda, a mesma vista como em C, após remoção da membrana de Reissner e a membrana tectória. Certo, ducto coclear isolado pronto para a montagem. Micrografia de electrões (E) Digitalização de, uma espiral coclear exposta intacta expondo o piso do ducto coclear, incluindo o epitélio sensorial. barra de escala é de 100 mm. . (A - D) adaptado de May-Simera et al, 2012 25 Por favor, clique aqui para ver uma versão maior desta figura.

Figura 2. Morfologia e Imunofluorescência no controle da cóclea (A - C). Micrografias Eletrônica de Varredura do tur basaln em embrionária (E18.5) Tipo cochleae selvagem. Uma fileira de células internas de cabelo (inferior) e três fileiras de células ciliadas externas (em cima) são separados e intercalados por células de apoio. stereociliary feixes em forma de viga de modo uniforme no sentido de orientar a borda lateral de cada célula de cabelo (bordo superior da imagem). Em E18.5 microvilosidades adicionais cobrir as superfícies apicais de células ciliadas, abaixo dos feixes stereociliary, e células de apoio intercalados (B). (C) Um único cinocílio à base de microtúbulos (seta branca), está localizado no vértice do feixe, mostrado aqui a partir do bordo lateral. (D - G) imunofluorescência coloração das basal sua vez dia pós-natal 1 (P1) do tipo selvagem cochleae. Faloidina etiquetas actina filamentosa em estereocílios e actina cortical na periferia da célula (D, E, G). Miosina 7a é um marcador para as células ciliadas externas e internas (E). Zo_1 rotula as junções apertadas em entre células, tornando-se um grande marcador para distinguir bounda celularRies (F). Acetilado α-tubulina é utilizado como um marcador para o cinocílio no vértice do feixe (F, G seta branca). Microtúbulos internos também são rotulados por acetilada α-tubulina, que são particulares abundante em células pilares (G asterix branco). Escala de barras A: 10 mm, B: 5 m, C: 1 mm, DG:. 5 mm Por favor clique aqui para ver uma versão maior desta figura.
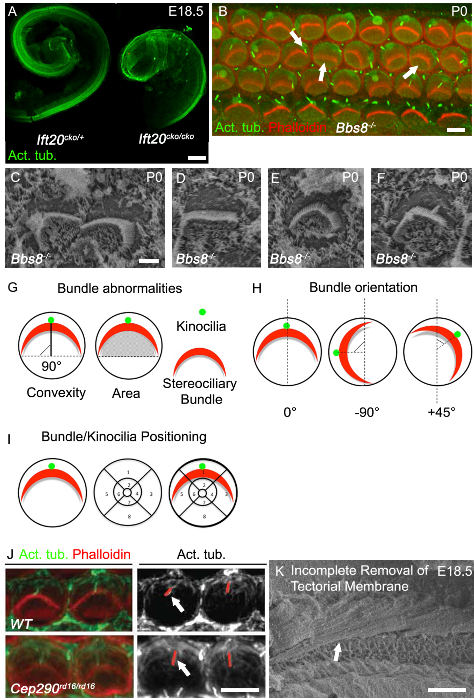
Figura 3. Coclear Fenótipo em Cilia Mutantes. (A) marcado encurtamento do Ift20 cko / CKO ductos cocleares em relação ao controle. Dissecados ductos cocleares em E18.5 corado com tubulina acetilada. (B ) imagens inteiras de montagem de espira basal em Bbs8 - / - mutante (P0). -Faloidina etiquetada actina filamentosa, estereocílios (vermelho), tubulina acetilada, kinocilia (verde). Feixes Stereociliary em Bbs8 - / - cochleae são variavelmente rodado (seta para a direita), achatado e / ou mislocalized (seta meio). Kinocilia são mislocalized ou axonemas estão faltando (seta para a esquerda). (C - F) Maior ampliação SEM de feixes stereociliary e kinocilia em Bbs8 - / - CCE. Em C, rodado bundles, em D, achatada pacote, em E, feixes circulares e F mislocalized kinocilia. (G - I) representações esquemáticas de quantificação anormalidade pacote. (G) Esquerda, agrupar convexidade (altura); a menor distância entre o vértice do feixe e a linha que se estende através de ambas as extremidades do feixe "braços". como depicted pela linha preta sólida. Direita, a área sob o pacote; a área. (H) representações esquemáticas dos critérios utilizados para quantificar a orientação de feixes stereociliary. O ângulo de rotação do feixe é calculada em relação a uma linha que se estende perpendicularmente à linha de células pilares. (I) Representação esquemática dos critérios para a análise de kinocilia posicional e feixes stereociliary. Uma grade segmentada é colocada sobre o perímetro da célula de cabelo e a posição observado. (J) imagem Superior ampliação de pacotes marcados com phalloidin estereocílios (vermelho) e kinocilia marcado com tubulina acetilados (verde) de células ciliadas externas na cóclea P0. No painel monocromático adjacente, linhas vermelhas identificar os kinocilia, que são mais em Cep29 mutantes rd16 / rd16 em relação ao controle (setas brancas). (K) SEM micrografia da cóclea embrionária com remoção incompleta de membrana tectória. EscalaBarras de A: 100 uM, B: 5 uM, C - F: 2,5 uM, I: 5 ^ M, J: 50? m. (A - F)... Modificado a partir de maio-Simera et al, 2015 8, J Reimpressão com permissão de Rachel et al, 2012 27 Por favor, clique aqui para ver uma versão maior desta figura.
Discussão
Ao preparar o tecido coclear para análise, existem alguns pontos-chave a ter em conta. Em primeiro lugar, as diferenças de fundo genético pode modificar o fenótipo coclear, tornando-se necessário analisar e comparar apenas os controlos da mesma ninhada. Em segundo lugar, a remoção completa da membrana tectória é necessário para obter as melhores imagens com imuno-histoquímica e é essencial para SEM. A membrana tectória é uma estrutura opaca e pode obscurecer as células do epitélio sensorial directamente por baixo, tornando mais difícil de imagem. Ocasionalmente, durante o processamento, a membrana tectória pode encolher para trás, descobrindo as células ciliadas. Mesmo nesses casos a remoção é altamente recomendável. Esta etapa requer paciência e prática. Em terceiro lugar, imuno-histoquímica utilizando anticorpos contra proteínas ciliares, particularmente os que localizam ao corpo basal altamente compactada, pode ser um desafio e requer otimização. Considerar a realização de recuperação antigênica, intensificando o permeabilização passos, ou a diminuição da concentração ou do tempo de fixação. Finalmente, quando imagiologia do cinocílio (o cílio primário encontrado nas células ciliadas da cóclea) ter em mente que ele começa a retrair a partir P0 - P1 em diante em um gradiente de base-ápice. Portanto, quando se mede o comprimento do cinocílio é importante para comparar as células ciliadas da mesma região da cóclea em animais e em geral combinados. As células de suporte intercalados também têm cílios, que não retrair. Cuidados devem ser tomados para distinguir entre apoiar os cílios das células e kinocilia células ciliadas.
Como ratos amadurecer, torna-se cada vez mais difícil para isolar limpa o epitélio sensorial coclear, devido à calcificação dos ossos temporais e labirintos ósseas. Descalcificação do tecido é necessário, o que nem sempre é compatível com outras técnicas de imunolocalização, mas não permite a análise do fenótipo bruta e também é compatível com a preparação de SEM. str inato do mouseains muitas vezes apresentam defeitos auditivos, como a perda de células ciliadas ou respostas auditivo de tronco cerebral elevadas (ABRs), devido a mutações em genes auditivos conhecidos ou genes modificadores. Por isso, é essencial comparar idade controles pareados mesma ninhada ou raça sobre um fundo genético alternativa.
Uma das limitações desta análise é que, em ratos, o cinocílio começa a retrair pós nascimento e não está mais presente nas células ciliadas adultos. Por esta razão as medições kinocilia só pode ser feito no desenvolvimento de tecido. Também é necessário escolher cuidadosamente controles pareados por idade para comparações entre amostras mutantes e controle. Outra limitação é que os ratos ciliares mutante analisados até agora não apresentam disfunção auditiva grave (ie., Respostas auditivas do tronco cerebral, ABRs ou emissão otoacústica, EOA), mesmo quando o desenvolvimento coclear é prejudicada. Coerente com isso, defeitos de audição não é um fenótipo comum ciliopathy humano. Excepcionalmente, a perda de hearing é uma das características principais da síndrome de Alström, causadas por mutações na proteína corporal basal ALMS1 28,29. Isto sugere que a morfologia pacote stereociliary não está necessariamente ligada à disfunção auditiva em mutantes cílios, provavelmente devido à reorientação corretiva de feixes mais tarde no desenvolvimento como foi relatado para os mutantes Vangl2 CKO 30. Se o espectro ciliopathy é ampliado para incluir Síndrome de Usher, a causa congênita mais comum de surdo-cegueira, em seguida, disfunção auditiva torna-se altamente relevante. Dados recentes têm mostrado que várias proteínas relacionadas com o síndrome de Usher também localizar a cílio e estão envolvidos em processos relacionados com a ciliares 31, mas se estas proteínas relacionadas com a sinalização PCP ainda não foi examinado.
Até agora a maioria dos ratos mutantes ciliar analisados por defeitos PCP cocleares apenas foram vagamente examinado. As técnicas descritas neste manuscrito para permitir que uma vasta detalhamento dafenótipo coclear, o que, sem dúvida, levar a uma compreensão mais precisa do envolvimento ciliar no estabelecimento de sinalização PCP vertebrados. Apesar do grande número de modelos de ratinhos ciliopathy disponíveis, surpreendentemente poucos foram analisados em termos de defeitos PCP cocleares. Uma armadilha comum associada a estes modelos é letalidade embrionária. No entanto, uma vez que a cóclea em desenvolvimento pode ser examinada embrionariamente o papel dos cílios em PCP no ouvido em desenvolvimento pode ser ainda ser investigada. Além disso, a letalidade embrionária muito precoce pode ser contornada utilizando knockouts condicionais. Foxg1 Cre 32 ratinhos, disponíveis a partir JacksonLaboratories, são comumente usados para inactivategenes de interesse em thedeveloping ouvido interno a partir da data E8.To, os esforços têm-se centrado principalmente na análise de genes causadores de doenças ciliopathy no entanto exploração de outras proteínas relacionadas com cílios e como estas afetam a sinalização PCP durante o desenvolvimento pode proporcionar um maior conhecimento sobre cilia biologia e função.
Se um fenótipo auditivo é suspeito nos modelos do rato que está sendo analisado, eventuais novas análises incluem testes audiométricos de ABRs 33 ou EOA 34. Ensaios de extensão de explante da cóclea (como descrito em Maio-Simera et al., 2012 25), pode também ser realizada e permitir a identificação de defeitos de extensão convergentes em pontos de tempo precoces do desenvolvimento. A cultura de explantes de cóclea também permite o tratamento com vários activadores ou inibidores de sinalização, que podem modificar a extensão explante, contribuindo assim para a compreensão mecanicista dos processos de desenvolvimento envolvidos. Embora se saiba que a cinocílio retrai após o nascimento 11,13,14, esta retracção não foi exaustivamente tratada no contexto de mutantes ciliares. Seria de interesse para tomar medidas específicas em tempo de surgimento kinocilia e retração na cílios mutants.Considering que um papel primordial para pro ciliarteínas é o movimento de carga ao longo dos microtúbulos, é altamente provável que estas proteínas também podem regular aspectos do tráfico intracelular ao longo do citoesqueleto 35-37. Um subconjunto de proteínas ciliares foram mostrados para afectar o tráfico e localização assimétrica de moléculas PCP 8. Localização por imuno-histoquímica das moléculas PCP, proteínas particularmente associada à membrana, como Vangl2, Frz3 e Dsh, é recomendado para estabelecer se as moléculas PCP são mislocalized. Estabelecimento de polaridade parece ser um assunto multifacetado, e há evidências de montagem para uma via autónoma celular adicional, que também é necessária para PCP correta em células sensoriais ciliadas 38. Um estudo recente mostrou que a sinalização dependente de proteína G controla a migração do cílio de forma autónoma de célula-39. Consistente com um papel para as proteínas ciliares na localização das moléculas de polaridade, alfa-I-G heterotrimérica proteína de subunidade 3 (Gαi3) localization é interrompido em Bbs8 e Bbs6 knockout cóclea 8,39.
Distinguindo o papel dos componentes ciliares individuais e seus efeitos distintos sobre a sinalização de PCP nos dará um maior conhecimento sobre o papel do cílio no estabelecimento de polaridade. De particular importância é a distinção entre proteínas ciliares funcionam num contexto ciliar, versus funções não ciliares de proteínas ciliares tradicionalmente considerados, como seu papel na regulação não ciliar relacionados com o tráfico intracelular. O elevado grau de regularidade em muitos aspectos da estrutura coclear, incluindo a modelação celular e orientação stereociliary feixe, faz com que seja possível detectar alterações subtis no desenvolvimento de PCP em resposta a qualquer perturbações genéticas ou moleculares em proteínas relacionadas com cílios. Considerando que existem muitos modelos de rato ciliar disponíveis, e que a cóclea do rato em desenvolvimento é um dos melhores lugares para examinar PCPsinalização, é de grande interesse para aprender até que ponto as mutações individuais de proteínas perturbar o desenvolvimento da cóclea.
Divulgações
The author declares no competing financial interests.
Agradecimentos
O autor gostaria de agradecer a Matthew Kelley, Tiziana Cogliati, Jessica Gumerson, Uwe Wolfrum, Rivka Levron, Viola Kretschmer e Zoe Mann e para a sua avaliação crítica do manuscrito. Este trabalho foi financiado pelo Prêmio Sofja Kovalevskaya (Humbodlt Foundation) e da Universidade Johannes-Gutenberg, Mainz, Alemanha.
Materiais
| Name | Company | Catalog Number | Comments |
| Tools/Equipment | |||
| Silicone elastomere - Sylgard 184 | Sigma-Aldrich | 761028-5EA | See Note 2 |
| Micro dissecting scissors-straight blade | Various | ||
| Fine forceps (no. 5 and 55) and blunt forceps | Various | ||
| Dissecting microscope. | Various | ||
| Uncoated glass microscope slides | Various | ||
| Microscope cover slips (22 mm × 40 mm × 0.15 mm) | Various | ||
| Transfer pipettes | Various | ||
| Minutien pins | Fine Science Tools | 26002-10 | |
| SEM sample holder | tousimis | 8762 | |
| Scanning electron microscopy studs | TED PELLA | 16111 | |
| PELCO Tabs: Carbon adhesive | TED PELLA | 16084-3 | |
| Fluorescent Microscope | Various | ||
| Critical Point Dryer | Various | ||
| Scanning Electron Microscope | Various | ||
| Glass microscope slides | Various | ||
| Glass coverslips | Various | ||
| Kimwipe Tissue | Various | ||
| Fine Paint Brush | |||
| Reagents | |||
| 1× Phosphate buffered saline (PBS) | Gibco/Life Technologies | 10010023 | |
| Paraformaldehyde (PFA) (EM Grade Required for EM) | Various | Prepare a 4% solution in 1× PBS made fresh each time. EM Grade Required for EM. | |
| 2.5% Glutaraldehyde Grade1 | Sigma-Aldrich | G5882 | |
| Tris-HCl (pH 7.5) | Various | ||
| NaCl | Various | ||
| CaCl 2 | Various | ||
| Triton X-100 | Various | ||
| Normal Goat Serum | Various | ||
| AffiniPure Fab Fragment Donkey Anti-Mouse IgG (H+L) | Jackson ImmunoResearch | 715-007-003 | |
| Fluoromount-G Mounting media | SouthernBiotech | 0100-01 | |
| 10× Hanks’ Balanced Salt Solution (HBSS) | Gibco/Life Technologies | 14065 | |
| Hepes | Gibco/Life Technologies | 15630-080 | |
| Osmium tetroxide (OsO4 ) | Sigma-Aldrich/Fluka Analytical | 75632 | |
| Tannic acid | Sigma-Aldrich | 403040 | |
| Ethanol 200 proof | Various | ||
| Antibodies | |||
| anti Arl13b | Protein Tech | 17711-1-AP | Suggested concentration 1:1,000 |
| anti acetylated tubulin (611-B1) | Sigma-Aldrich | T6793 | Suggested concentration 1:800 |
| anti gamma tubulin (GTU-88) | Sigma-Aldrich | T6557 | Suggested concentration 1:200 |
| anti Zo_1 | Invitrogen | 40-2300 | Suggested concentration 1:500 |
| Myosin VI | Proteus Biosciences | 25-6791 | Suggested concentration 1:1000 |
| Myosin VIIa | Proteus Biosciences | 25-6790 | Suggested concentration 1:1,000 |
| anti Vangl2 | Merk Millipore | ABN373 | Suggested concentration 1:250 |
| anti Gαi3 | Sigma-Aldrich | G4040 | Suggested concentration 1:250 |
| Alexa Fluor® 488 Phalloidin | Invitrogen/Life Technologies | A12379 | Suggested concentration 1:300 - 1,000 |
| Alexa Fluor® 568 Phalloidin | Invitrogen/Life Technologies | A12380 | Suggested concentration 1:300 - 1,000 |
Referências
- Waters, A. M., Beales, P. L. Ciliopathies: an expanding disease spectrum. Pediatr Nephrol. 26, 1039-1056 (2011).
- May-Simera, H. L., Kelley, M. W. Cilia, Wnt signaling, and the cytoskeleton. Cilia. 1, 7 (2012).
- Ross, A. J., et al. Disruption of Bardet-Biedl syndrome ciliary proteins perturbs planar cell polarity in vertebrates. Nat Genet. 37, 1135-1140 (2005).
- Ezan, J., Montcouquiol, M. Revisiting planar cell polarity in the inner ear. Seminars in cell & developmental biology. 24, 499-506 (2013).
- Semenov, M. V., Habas, R., Macdonald, B. T., He, X. SnapShot: Noncanonical Wnt Signaling Pathways. Cell. 131, 1378 (2007).
- Wang, J., et al. Regulation of polarized extension and planar cell polarity in the cochlea by the vertebrate PCP pathway. Nat Genet. 37, 980-985 (2005).
- Montcouquiol, M., et al. Identification of Vangl2 and Scrb1 as planar polarity genes in mammals. Nature. 423, 173-177 (2003).
- May-Simera, H. L., et al. Ciliary proteins Bbs8 and Ift20 promote planar cell polarity in the cochlea. Development. 142, 555-566 (2015).
- Jones, C., et al. Ciliary proteins link basal body polarization to planar cell polarity regulation. Nat Genet. 40, 69-77 (2008).
- Lim, D. J. Functional structure of the organ of Corti: a review. Hearing research. 22, 117-146 (1986).
- Nayak, G. D., Ratnayaka, H. S., Goodyear, R. J., Richardson, G. P. Development of the hair bundle and mechanotransduction. The International journal of developmental biology. 51, 597-608 (2007).
- Denman-Johnson, K., Forge, A. Establishment of hair bundle polarity and orientation in the deveoping vestibular system of the mouse. J. Neurocytol. , 821-835 (1999).
- Sobkowicz, H. M., Slapnick, S. M., August, B. K. The kinocilium of auditory hair cells and evidence for its morphogenetic role during the regeneration of stereocilia and cuticular plates. Journal of neurocytology. 24, 633-653 (1995).
- Denman-Johnson, K., Forge, A. Establishment of hair bundle polarity and orientation in the developing vestibular system of the mouse. Journal of neurocytology. 28, 821-835 (1999).
- van Dam, T. J., et al. The SYSCILIA gold standard (SCGSv1) of known ciliary components and its applications within a systems biology consortium. Cilia. 2, 7 (2013).
- Blacque, O. E., Sanders, A. A. Compartments within a compartment: what C. elegans can tell us about ciliary subdomain composition, biogenesis, function, and disease. Organogenesis. 10, 126-137 (2014).
- Wallingford, J. B., Mitchell, B. Strange as it may seem: the many links between Wnt signaling, planar cell polarity, and cilia. Genes & development. 25, 201-213 (2011).
- Borovina, A., Ciruna, B. IFT88 plays a cilia- and PCP-independent role in controlling oriented cell divisions during vertebrate embryonic development. Cell reports. 5, 37-43 (2013).
- Huang, P., Schier, A. F. Dampened Hedgehog signaling but normal Wnt signaling in zebrafish without cilia. Development. 136, 3089-3098 (2009).
- Ocbina, P. J., Tuson, M., Anderson, K. V. Primary cilia are not required for normal canonical Wnt signaling in the mouse embryo. PloS one. 4, e6839 (2009).
- Jones, C. G. Scanning electron microscopy: preparation and imaging for SEM. Methods Mol Biol. 915, 1-20 (2012).
- Curtin, J. A., et al. Mutation of Celsr1 disrupts planar polarity of inner ear hair cells and causes severe neural tube defects in the mouse. Current biology : CB. 13, 1129-1133 (2003).
- Wang, Y., Guo, N., Nathans, J. The role of Frizzled3 and Frizzled6 in neural tube closure and in the planar polarity of inner-ear sensory hair cells. The Journal of neuroscience : the official journal of the Society for Neuroscience. 26, 2147-2156 (2006).
- Montcouquiol, M., Jones, J. M., Sans, N. Detection of planar polarity proteins in mammalian cochlea. Methods Mol Biol. 468, 207-219 (2008).
- May-Simera, H., Kelley, M. W. Examining planar cell polarity in the mammalian cochlea. Methods Mol Biol. 839, 157-171 (2012).
- Yin, H., Copley, C. O., Goodrich, L. V., Deans, M. R. Comparison of phenotypes between different vangl2 mutants demonstrates dominant effects of the Looptail mutation during hair cell development. PloS one. 7, e31988 (2012).
- Rachel, R. A., et al. Combining Cep290 and Mkks ciliopathy alleles in mice rescues sensory defects and restores ciliogenesis. J Clin Invest. 122, 1233-1245 (2012).
- Jagger, D., et al. Alstrom Syndrome protein ALMS1 localizes to basal bodies of cochlear hair cells and regulates cilium-dependent planar cell polarity. Human molecular genetics. 20, 466-481 (2011).
- Collin, G. B., et al. The Alstrom Syndrome Protein, ALMS1, Interacts with alpha-Actinin and Components of the Endosome Recycling Pathway. PloS one. 7, e37925 (2012).
- Copley, C. O., Duncan, J. S., Liu, C., Cheng, H., Deans, M. R. Postnatal refinement of auditory hair cell planar polarity deficits occurs in the absence of Vangl2. The Journal of neuroscience : the official journal of the Society for Neuroscience. 33, 14001-14016 (2013).
- Sorusch, N., Wunderlich, K., Bauss, K., Nagel-Wolfrum, K., Wolfrum, U. Usher syndrome protein network functions in the retina and their relation to other retinal ciliopathies. Advances in experimental medicine and biology. 801, 527-533 (2014).
- Hebert, J. M., McConnell, S. K. Targeting of cre to the Foxg1 (BF-1) locus mediates loxP recombination in the telencephalon and other developing head structures. Dev Biol. 222, 296-306 (2000).
- Willott, J. F. Chapter 8, Measurement of the auditory brainstem response (ABR) to study auditory sensitivity in mice. Current protocols in neuroscience. , Unit8 21B (2006).
- Martin, G. K., Stagner, B. B., Lonsbury-Martin, B. L., et al. Chapter 8, Assessment of cochlear function in mice: distortion-product otoacoustic emissions. Current protocols in neuroscience. , Unit8 21C (2006).
- Finetti, F., et al. Intraflagellar transport is required for polarized recycling of the TCR/CD3 complex to the immune synapse. Nature cell biology. 11, 1332-1339 (2009).
- Sedmak, T., Wolfrum, U. Intraflagellar transport molecules in ciliary and nonciliary cells of the retina. J Cell Biol. 189, 171-186 (2010).
- Yuan, S., Sun, Z. Expanding horizons: ciliary proteins reach beyond cilia. Annual review of genetics. 47, 353-376 (2013).
- Tarchini, B., Jolicoeur, C., Cayouette, M. A molecular blueprint at the apical surface establishes planar asymmetry in cochlear hair cells. Developmental cell. 27, 88-102 (2013).
- Ezan, J., et al. Primary cilium migration depends on G-protein signalling control of subapical cytoskeleton. Nature cell biology. 15, 1107-1115 (2013).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados