Method Article
Оценка Planar-Cell-полярности фенотипов в цилиопатии Mouse Mutant улитки
В этой статье
Резюме
Primary cilia influence various signaling pathways. The mammalian cochlea is ideal for examining planar cell polarity (PCP) signaling. Cilia dysfunction affects cochlear outgrowth, cellular patterning and hair cell orientation, readouts of PCP. Our goal is to analyze PCP signaling in mouse cochlea via phenotypic analysis, immunohistochemistry and scanning electron microscopy.
Аннотация
In recent years, primary cilia have emerged as key regulators in development and disease by influencing numerous signaling pathways. One of the earliest signaling pathways shown to be associated with ciliary function was the non-canonical Wnt signaling pathway, also referred to as planar cell polarity (PCP) signaling. One of the best places in which to study the effects of planar cell polarity (PCP) signaling during vertebrate development is the mammalian cochlea. PCP signaling disruption in the mouse cochlea disrupts cochlear outgrowth, cellular patterning and hair cell orientation, all of which are affected by cilia dysfunction. The goal of this protocol is to describe the analysis of PCP signaling in the developing mammalian cochlea via phenotypic analysis, immunohistochemistry and scanning electron microscopy. Defects in convergence and extension are manifested as a shortening of the cochlear duct and/or changes in cellular patterning, which can be quantified following dissection from developing mouse mutants. Changes in stereociliary bundle orientation and kinocilia length or positioning can be observed and quantitated using either immunofluorescence or scanning electron microscopy (SEM). A deeper insight into the role of ciliary proteins in cellular signaling pathways and other biological phenomena is crucial for our understanding of cellular and developmental biology, as well as for the development of targeted treatment strategies.
Введение
Первичные реснички длинные микротрубочки основе придатки, которые простираются от поверхности большинства клеток млекопитающих. Первичная реснички часто путают с подвижных ресничек, из которых всегда много на одну ячейку, и цель которого заключается в переходе жидкость через поверхности мембран. Первичная реснички, напротив, принять сенсорные роли и, следовательно, также называют сенсорной ресничек. После давно забыли, это органеллы недавно был 'вновь' в результате его ассоциации с множеством генетических заболеваний человека 1. В идеале позиционируется как сигнальной органеллы, первичная ресничка было показано, чтобы регулировать многочисленные сигнальные пути, многие из которых имеют важное значение не только в тканевого гомеостаза и болезни, но также и во время развития 2.
Одним из первых сигнальных путей показано, что связано с ресничек дисфункции был неканонической сигнализации Wnt путь, известный также как полярность плоская клеток (PCP) пути > 3. Это сигнальный каскад первоначально определены у дрозофилы, имеет решающее значение для эмбриогенеза; в частности, для конвергенции и расширения процессов и для правильной ориентации клеток в плоскости эпителия 4. Последовательное сигнализация основного набора регуляторных белков переводит направленные сигналы, которые, в конечном счете привести к цитоскелета перестроек и приводят к согласованной поляризации эпителиальных клеток в плоскости 5. Процесс сближения и расширения абсолютно необходим для канала улитки, чтобы удлинить и для правильного клеточного паттерна 6. Как это регулируется с помощью активации PCP пути, один из самых ярких фенотипов улитки PCP мутантов является сокращенной канал улитки с неорганизованной сенсорного эпителия 7. Аналогичным образом, мутантные мыши, у которых нет реснички, также демонстрируют такую конвергенции и расширения фенотип 8,9, хотя как именно это регулируется еще предстоит выяснить.
ve_content "> Поскольку конвергентные и расширение процессов являются критическими для выроста канала улитки и сотовой паттерна сенсорного эпителия внутри канала улитки, развивающийся улитка является идеальным органом, в котором для изучения сигналов PCP во время развития позвоночных. Орган Корти, термин, данный специализированного сенсорного эпителия, что линии канал улитки, состоит из несенсорных опорных клеток и механосенсорных волосковых клеток, которые должны быть равномерно ориентированных на улитке функционировать 10. в механосенсорные волосковые клетки так называемый из-за stereociliary пучки, которые простираются от кутикулы пластины (апикальной поверхности) каждой сенсорной волосковых клеток 11. Они действуют как первичных преобразователей в mechanosensation и несмотря на их номенклатуре в качестве стереоцилиях, фактически состоит из модифицированного актиновых филаментов на основе микроворсинок. Внутри каждого шеврона-образной волос расслоение, три ряда стереоцилиях организованы в очень упорядоченной и регулярной годовыхttern в лестница манере. Реальный микротрубочек на основе реснички, называемые киноцилии, которые необходимы для развития и ориентации stereociliary пучков 12. По каждой ячейке волос, одна киноцилия физически подключен к стереоцилий расслоения, расположенный в центре рядом с самой высокой строки стереоцилий. Точная функция киноцилии неясно, и одна гипотеза, что Киноцилия 'тянет' Стереоцилии в форме, как они созревают с микроворсинок 12. У позвоночных киноцилии в улитке имеются только временно и убрать из волосковых клеток у мышей до начала слушания 11,13,14.Полная потеря ресничек в развивающихся результатов улитки сильно укороченных кохлеарных каналов, неправильно формируется и неправильно ориентированной stereociliary пучки, а также неправильно расположенные Кинетосомы 8,9. Функциональная ресничка не просто состоит из ресничного аксонемы. Многие белки, связанные с ресничкамиФункция происходят в комплексах локализованных в ресничками связанной поддоменов, таких как базального тельца, в переходной зоне, или мерцательной аксонемы 15. Базальное тельце, происходит от материнской центриоли из центросомы, также микротрубочки организационным центром для микротрубочек, проходящих от реснички в теле клетки и может регулировать внутриклеточный людьми, а также с торговлей ресничек. Зона цилиарного перехода является еще одним регионом, где функция цилиарной регулируется с точки зрения организации импорта и экспорта цилиарных соединений 16.
Многочисленные исследования выявили связь между ресничками и неканонической Wnt (РСР сигнализации), хотя точный механизм остается неясным 17. Избыточность цилиарных и PCP генов и чувствительность клеточной полярности к обобщенным клеточных нарушений, затрудняют напрямую связать мутацию в PCP конкретных дефицитов. Один из считанных выходы сигнализации PCP является расположение базальных тела и Primarу ресничка, поэтому разделения первичного от вторичных дефектов является сложной задачей. Некоторые исследования в данио и мыши мутантов не предложили никакой связи между ресничками и Wnt сигнализации 18-20. Расхождение в данных могут отражать виды, ткани или височно-зависимые различия в цилиарных взносов в Wnt сигнализации. Кроме того, нормальная Wnt отзывчивость может быть сохранена, если базальные тельца остаются функциональными. Более глубокое проникновение в роли цилиарных белков в клеточных сигнальных путей и других биологических явлений имеет решающее значение для нашего понимания сотовой биологии и биологии развития, а также для развития целевых стратегий лечения.
протокол
Использование и эвтаназии всех животных в соответствии с институциональными и правительственными нормами и правилами, обычно через СО 2 вдоха и цервикальной дислокации.
1. Подготовка реагентов
Примечание: Перед началом, подготовить все реагенты, используя аналитические химикаты класса. Сделать решения с использованием молекулярно-класс дистиллированную и деионизированную воду, если не указано иное.
- Фосфатным буфером физиологический раствор (PBS 1x): Make 1 л 1x PBS путем растворения 8g NaCl, 0,2 г KCl, 1,44 г Na 2 HPO 4 и 0,24 г KH 2 PO 4 в 1 л H 2 O. Доводят рН до 7,4 с помощью HCl. PBS не нужно быть стерильными и могут храниться при комнатной температуре. Обратите внимание, что этот буфер производится без CaCl 2 или MgCl 2.
- Параформальдегид (4% PFA): Подготовьте 4% -ный раствор PFA в 1x PBS в вентилируемом вытяжном шкафу. Добавить 40 г параформальдегида порошка до 1 л 1x PBS. Чтобы растворить, размешать и теплом около 60 ° C,и медленно добавить NaOH каплям для повышения рН. После того как порошок растворится, скорректировать рН до 7,4 с HCl. Смесь фильтруют через фильтр 0,45 мкм и заморозить аликвот. Размораживание свежий аликвоту для каждого эксперимента.
- Тритон буфера: Приготовить 0,1 М Трис-HCl (рН 7,5), 0,15 М NaCl, 0,1% Тритон Х-100 Раствор растворением 8,77 г NaCl в 1 л 0,1 М Трис-HCl (рН 7,5). Добавить 1 мл Тритон Х-100. Перемешать до растворения. Магазин Тритон буфера при комнатной температуре.
- Тритон блок: Подготовка 10% сыворотки козьего в буфере Triton добавлением 1 мл козьей сывороткой к 9 мл буфера Triton. Хранить при 4 ° С. При использовании первичных антител, затронутые в мыши, добавить антимышиного IgG Fab фрагментов при разведении 1 из 200 к блоку Triton для стадии блокирования.
Примечание: Если планируете использовать образцы для сканирующей электронной микроскопии (SEM), подготовить дополнительные реагенты, которые перечислены ниже. - Хэнкса сбалансированный солевой раствор (HBSS) с кальцием и магнием: Выполнить 1x раствор HBSS разбавлением из маточного растворав стерильной дистиллированной H 2 O. Как HBSS буфера сложно сделать и есть риски, желательно заказать Premade 10x маточного раствора. Конечная концентрация HBBS буфер обычно используемых заключается в следующем: 1,26 мМ CaCl 2, 0,49 мМ MgCl 2 -6H2O, 0,41 мМ MgSO 4 -7H2O, 5,33 мМ КСl, 0,44 мМ KH 2 PO 4, 4,17 мМ NaHCO 3, 137,93 мМ NaCl 0,34 мМ Na 2 HPO 4, 5,56 мМ декстроза.
- Hepes буфера: Приготовьте 0,1 М раствора Hepes в HBSS 1x, путем растворения 23,8 г HEPES в 1 л 1x HBSS буфера.
- Сканирующая электронная микроскопия фиксатор (СЭМ Фикс): Подготовьте фиксатором для SEM разбавлением электронной микроскопии класса глутаральдегид (2,5%) и параформальдегида (4%) в буфере Hepes. Добавить CaCl 2 до конечной концентрации 10 мМ.
- 1% четырехокиси осмия (OsO 4) в буфере Hepes; 1% четырехокиси осми в воде: Развести исходного раствора осмия в буфере Hepes, и separatelг в стерильную дистиллированную Н2О, до конечной концентрации 1%. Четырехокиси осми является высокотоксичным и наиболее часто продаются как 4% -ного раствора.
- 1% (вес / объем) Дубильная кислота: Растворить 0,5 г дубильной кислоты в 50 мл стерильной дистиллированной H 2 O. Фильтр стерилизовать путем фильтрования через фильтр с размером пор 0,45.
- Дифференцированный этанол серии раствор: Разведите этанола пробы 200. стерильной дистиллированной Н2О вносить решения 30, 50, 70, 90 и 95% этанола. В течение последних полосканий этанола, требуется 100% этанола 200 Доказательство. Используйте только что открытой бутылки этанола пробы 200. для окончательного полоскания.
2. Выбор ткани
- В идеале, изучить эмбрионов или молодых щенков в возрасте от эмбрионального день 16,5 (E16.5) и постнатальный день 3 (Р3).
Примечание: окостенение костного лабиринта и височных костей делает рассечение все более сложным, как мышей зрелые. Кроме киноцилии, единственный истинный микротрубочек на основе ресничка узнать на волосковых клеток улитки,втягивается в процессе разработки и больше не присутствует у взрослых мышей. - После фиксации ДЕКАЛЬЦ взрослых cochleae. Бесплатно разместить расчлененный (раздел 3) костные лабиринты, в 2 мл ЭДТА (4,13% в ПБС), рН 7,3, в микроцентрифужных трубки в течение 3 - 4 дней с вращением. Пополнение ЭДТА ежедневно. После того, как ткани смягчили, промыть в 1,5 мл или более PBS 3 раза в течение 5 мин на nutator с усиленной агитации.
3. улитка Препарирование
- Сообщение euthanization помощью смещения шейных позвонков или CO 2 ингаляции (100% СО 2), снять головку. Используйте лезвие скальпеля или небольшой ножницы, в зависимости от размера животного, чтобы рассекать головой вдоль сагиттальной средней линии, начиная с носа и расширение каудально. Удалить мозг от каждой половины черепа с парой щипцов. Определить височных костей, которые содержат развивающиеся костные лабиринты внутреннего уха (смотри стрелку на рисунке 1А).
- Используйте пару дляБелые грибы тщательно изолировать костные лабиринты из черепа (височной кости). Делайте это при вскрытии микроскопом. Ценовое расстояние костной ткани из черепа, запустив щипцы осторожно под костных лабиринтов. У животных до P4 костные лабиринты еще хрящевые и могут быть легко удалены, не нарушая.
- После вскрытия, используйте кончик рассекает щипцов, чтобы очистить Овальные и круглые окна и сделать небольшое отверстие в вершине улитки спирали. Закрепить костные лабиринты перед дальнейшей вскрытия канала улитки. Для обеспечения легкого удаления текториальной мембраны (см 3.7), зафиксировать костные лабиринты в 1,5 мл 4% PFA в течение 5 минут на льду.
Примечание: Если удаление текториальной мембраны не требуется, больше крепление рекомендуется (см 4.1 - 4.3). Краткая фиксация височных костей до вскрытия канала улитки помогает процессу рассечение и удаление текториальной мембраны. Сообщение рассечение и облучение органа Корти, Furtее крепление не требуется. - Далее рассекают костные лабиринты, чтобы выставить кохлеарный сенсорного эпителия следующим образом. Поместите костные лабиринты в черном силиконового эластомера покрытием рассекает блюдо с PBS, чтобы облегчить рассечение. Используйте minutien штифты для фиксации ткани при необходимости. Чтобы использовать minutien булавки, разместить их через вестибулярной части костных лабиринтов с вентральной улиткового спирали вверх.
Примечание: силиконовая эластомер блюдо: Смешайте силиконового эластомера базовый компонент с толченым древесным углем, чтобы получить непрозрачного черного цвета. Добавить отвердитель и вылить в одном или нескольких чашках Петри (стеклянные или пластиковые). Сухой под вакуумом для удаления захваченных пузырьков воздуха. Сухие блюда полностью перед использованием. - Используйте тонкий пинцет (# 5), чтобы удалить внешнюю хрящ подвергая канала улитки. Начало в овальное окно; вставьте нижнюю оконечность пинцетом в овальное окно и аккуратно откройте хрящ, медленно вверх по направлению кВершина.
- После экспозиции канала улитки, удалить вентральной, мембрана рейснерова. Используйте тонкую пару щипцов, чтобы зажать мембраны рейснерова у основания канала улитки и очистить его от в восходящем движении. Визуализация спинной части канала улитки, в том числе чувствительного эпителия.
- Удалить текториальной мембраны, как описано ниже (по желанию). Для SEM или иммуногистохимии киноцилии или stereociliary пучков удалить текториальной мембраны.
- Используйте очень тонкую пару щипцов (# 55 или тоньше), чтобы зажать текториальной мембраны у основания улитки и очистить вверх по направлению к вершине.
ВНИМАНИЕ: покровная мембрана оптически прозрачен, что делает его трудно определить. Чаще всего мембрана отрывается в одной части и хотя это не легко визуализировать, можно почувствовать сопротивление, как это снял с открытой органа Корти. - После разоблачения орган Корти, дополнительно зафиксировать ткани, как Dвневписанной ниже. Сохранил вестибулярный область облегчить дальнейшую подготовку тканей.
4. Фиксация
- Для регулярной иммуногистохимии исправить отсеченных костные лабиринты в 1,5 мл 4% PFA при 4 ° С на nutator в течение 2 часов.
Примечание: Из-за чувствительности отличающиеся антитела и антигены, вариации в длине и структуре фиксации может потребоваться и должен быть оптимизирован для каждого антитела. - После фиксации мыть образцы промывкой 1,5 мл или более PBS 3 раза в течение 5 мин на nutator с усиленной агитации. Образцы могут храниться в PBS при 4 ° С в течение нескольких недель перед обработкой.
- Если пробоподготовки для РЭМ, исправить расчлененный височных костей в SEM исправления (см 1.7) в течение 2 часов при комнатной температуре. Промыть ополаскиванием в 1,5 мл или более Hepes буфера 3 раза в течение 5 мин на nutator с усиленной агитации. Хранить в буфере Hepes при 4 ° С до дальнейшей переработки. Хранение дольше, чем на пару неделюы не рекомендуется.
5. Иммуногистохимия
- Выполните иммуногистохимии на расчлененных образцов в одну лунку плоским дном 96-луночного планшета. Вместо этого можно использовать ПЦР или микроцентрифужных трубку. Желательно, чтобы сохранить вестибулярную часть костного лабиринта, чтобы облегчить обработку.
- Проницаемыми ткани путем инкубирования в 1,5 мл Тритона буфере в течение 1 часа при комнатной температуре на nutator при легком помешивании.
- Блок ткани путем инкубирования в 0,5 мл Тритона блока в течение минимум 1 часа при комнатной температуре. При использовании первичных антител, затронутые в мыши, добавить анти-мышиного IgG Fab фрагменты к блоку при разведении 1 из 200 (смотри раздел 1.4). Это значительно снижает неспецифического связывания анти-IgG мыши, чтобы ткани мыши.
- Инкубируйте ткани с первичными антителами разводят в Triton блока O / N при 4 ° С при осторожном перемешивании. Антитела разведения зависит от антител используются (см раздел 6.1). В качестве альтернативы инкубировать первичную antibodieев в течение 2 ч при комнатной температуре. В идеале использовать минимальный объем 0,5 мл разбавления первичных антител. Если антитело является ограниченным, использовать наименьший объем разбавления антител, которые полностью обволакивает ткани.
- Промыть ткань промывкой 1,5 мл или более Тритон буферных, как минимум 3 раза в течение 15 мин, на nutator с усиленной агитации.
- Инкубируйте ткани с флуоресцентным красителем, конъюгированным вторичными антителами разбавленных на производителей рекомендуется концентрацию (обычно 1: 200-1: 1000) в Triton блока в течение 1 часа при комнатной температуре на nutator. Используйте минимальный объем 0,5 мл вторичного разведения антител.
- Центрифуга разбавленный вторичное антитело при 13000 х г в течение 3 мин перед использованием, чтобы свести к минимуму неспецифическое связывание агрегатов вторичных антител. Щит ткань от света от этого шага вперед, чтобы избежать фотообесцвечивания флуоресцентных красителей.
- Как и в шаге 5.5, мыть ткани путем промывки в 1,5 мл или более Triton буфера, минимум 3 раза в течение 15 мин, наnutator с усиленной агитации. Образцы Хранить в PBS при 4 ° С до готовности к монтажу.
6. Выбор антител
Примечание: Источником рекомендованных антител и их разведений перечислены в таблице конкретных материалов и оборудования. Выполните инкубацию антител, как описано в разделе 5.
- Для визуализации микротрубочек на основе Киноцилия, использовать мерцательной аксонему маркер, такой как анти-Arl13b (1: 1000) или анти-ацетилированный-альфа-тубулина (1: 800). Визуализация базальную тело, используя антитело против гамма-тубулина (1: 200) или любой другой центросомной маркера.
- Для визуализации актиновых филаментов богатых stereociliary пучки, добавить фаллоидина (1: 300 - 1000), конъюгированный с одним из нескольких различных флуорофоров к вторичной инкубации антител. Фаллоидином также этикетки других нитчатых актина структур, включая корковых актиновых филаментов, окружающих периферию каждого эпителиальной клетки волос. Это полезно при определенииконтур каждой ячейки волос. Используйте альтернативный мембранный маркер, такой как анти-ZO-1 (1: 500), если это необходимо.
- Добавьте волосковых клеток улитки, используя антитела против миозина VI (1: 1000) или миозина VIIa (1: 1000). Они могут быть использованы, если оценки длины улитки.
Примечание: Используйте подходящие флуоресцентный краситель-сопряженных вторичные антитела оптимизированные с требованиями микроскопом.
7. Монтаж и обработка изображений
- Поместите образец в черном силиконовые эластомеры блюдо с PBS. Использование тонких щипцов, удалить вестибулярный регион от кохлеарного спирали.
- Очень осторожно удалить основную хрящ и мезенхиму от кохлеарного спирали. Оставшийся кохлеарный спиральный содержит внутреннюю борозду, орган Корти и внешней борозды.
- Перенести кохлеарный спираль в каплю PBS размещены на предметное стекло микроскопа. При желании, отделить кохлеарный спираль на куски, эквивалентных одной очереди. Этот шаг не является необходимым, однако, и может привести к лOSS ткани. Апикальной поверхности (стереоцилии сторона) из волосковых клеток улитки должна быть обращена вверх по направлению к покровным.
- Вика прочь PBS с адсорбентом ткани или кусок фильтровальной бумаги и аккуратно переместить кохлеарный спираль, если эпителий сместился и перекрывает на себя.
- Добавить каплю монтажных СМИ непосредственно на образце улитки и аккуратно разместить покровное на вершине, заботясь, чтобы избежать воздушных пузырей. Нет проставки не требуется; разместить покровное непосредственно на образце. Водорастворимый, не флуоресцирующего, Полупостоянная монтажа носитель, который не требует дополнительных мер для привлечения покровное на месте рекомендуется. Монтажные средства массовой информации и толщина покровного должны быть согласованы с микроскопом спецификации.
- Используйте эпифлуоресцентной или лазерной сканирующей конфокальной микроскопии, оснащенный большим увеличением (63 - 100X), высокой числовой апертурой (1,2 - 1,4) целей для захвата изображений апикальной поверхности улитки волосковых клеток. Использование лоWER целей (5 - 20X) принимать перекрытия изображений кохлеарного спирали количественно длину канала улитки. Соответствие лазеры возбуждения и фильтры выбросов в флуорофоров, используемых для вторичных антител.
8. сканирующей электронной микроскопии
- Продолжить с разделом 4.3. После промывания SEM фиксированные образцы в буфере, Hepes, выполните следующие действия при хорошей вентиляции. Следующий протокол хорошо работает для улитки ткани и позволяет избежать использования покрыти распылением с проводящего металла.
- Сообщение затруднительного в 1% OSO 4 в Hepes буфере в течение 1 часа, затем 3 промывок 1 мл дистиллированной воды в течение 5 мин каждый. Наименьший объем OsO 4, который полностью обволакивает ткани должны быть использованы для минимизации токсичных отходов. Нет агитация не требуется.
- Инкубируйте образцы при комнатной температуре в каждой из следующих растворов в течение 1 ч с 3 промывок 1 мл дистиллированной воды в течение 5 мин каждый промежуточный шагов: 1% дубильных кислоты свежеприготовленные в воде и филубито до использования; 1% OsO 4 в воде, 1% дубильных кислоты в воде, 1% OsO 4 в воде.
- Высушить пробы через серии градуированных этанола путем инкубации в течение 10 мин в каждом из следующих разведений: 30, 50, 70, 90, и 95%. Нет агитация не требуется.
- Образцы Перенос через три смены, 5 мин каждый, 100% этанола (из недавно открытого бутылкой этанола пробы 200.).
- Запуск образцы, хотя критической точки сушилке следующие инструкции производителя.
- Установите образцы, используя проводящий клей углерода сверху СЭМ заглушки до визуализации на электронном микроскопе. Под стереомикроскопа, использовать пару тонких щипцов и кисти мягко позиционировать образца с кохлеарные эпителий вверх. Используйте вестибулярной части образца 'якоря' ткани на заглушку. Образцы Хранить в эксикаторе до визуализации. Выполните визуализацию SEM, как описано в Jones (2012) 21.
9.определение
- После подготовки иммуногистохимии, получать изображения с использованием эпифлуоресцентной или лазерной сканирующей конфокальной микроскопии. После подготовки к SEM, использовать сканирующий электронный микроскоп с изображением образцов. Изображение апикальной поверхности органа Корти с обнаженных волосковых клеток улитки и интеркалированных поддерживающих клеток.
- Определить конкретные позиции вдоль канала улитки, таких как 25, 50, и 75% от основания и используют их, чтобы сравнить улитки регионы между мутантных и контрольных проб. Анализировать и сравнивать реснички мутантов со своими контроля однопометница, а различия в генетическом фоне может изменить кохлеарный фенотип.
Примечание: Кортиев орган развивается в градиенте, который простирается от середины основания в направлении обоих вершине и основанию. У мышей, развитие не является полным, пока P14, поэтому важно, чтобы сравнить регионы на аналогичных этапах развития и позиций. - Снимайте с использованием программного обеспечения, сопровождающая микроскоп, который аллож для количественного определения конкретного фенотипа при необходимости (см ниже). Используйте программное обеспечение для анализа изображений, например Image J или программного обеспечения, сопровождающая микроскоп для измерения длины, рассчитывать клеток и определить локализацию белка, как описано ниже. График эти данные в виде гистограммы, диаграммы разброса, коробка-блоттинга или гистограммы, сравнивая мутантный контроль против.
- Общая длина канала улитки (3А):
- Используя маркер волосковых клеток или фаллоидина, (который отмечает stereociliary пучки), определить и измерить, где сенсорная эпителий начинается и заканчивается. Длина канала улитки часто сокращается в ресничек мутантов.
- Stereociliary аномалии расслоение (рис 3B, D, E, G):
- Измерьте расслоение выпуклость (по высоте) в качестве кратчайшего расстояния между вершиной пучка и линией, которая проходит через оба конца в комплект 'оружия', как показано на рисунке 3G, осталось. В качестве альтернативы, количественно площадьохватываются оружия космического волосковых клеток stereociliary расслоения, как показано на рисунке 3G, верно. Если клетки волос с круглыми пучками stereociliary могут быть идентифицированы учитывать их в качестве процентах от общего числа волосковых клеток.
Примечание: Во многих цилиарных мутантов расслоение аномалии могут наблюдаться независимо от расслоения ориентации. Трудно точно определить их stereociliary аномалии расслоение.
- Измерьте расслоение выпуклость (по высоте) в качестве кратчайшего расстояния между вершиной пучка и линией, которая проходит через оба конца в комплект 'оружия', как показано на рисунке 3G, осталось. В качестве альтернативы, количественно площадьохватываются оружия космического волосковых клеток stereociliary расслоения, как показано на рисунке 3G, верно. Если клетки волос с круглыми пучками stereociliary могут быть идентифицированы учитывать их в качестве процентах от общего числа волосковых клеток.
- Ориентация из stereociliary расслоений (фигура 3В, С, G):
- Оценивают ориентацию каждого отдельного пучка по отношению к линии, проходящей перпендикулярно к ряду столбов клеток, который отделяет внутреннюю и внешнюю волосковых клеток. Клетки с нормальной ориентацией выровнены вдоль этой оси, перпендикулярной и поэтому имеют вращение 0 °. Определить углы поворота с использованием либо 360 ° обозначения или в абсолютных отклонений от 0 °.
- Киноцилий позиционирования или stereociliary позиционирования расслоение (рис3B, F, H):
- Подсчитайте процент клеток, в которых киноцилии отсутствуют. Измерьте расстояние от киноцилии к «вершине» или центра пучка. 'Вершина' расслоения не может быть легко определить, если пучки являются аномальными, и поэтому центр пучка может быть использован вместо.
- Количественно положение киноцилий и stereociliary пучков на апикальной поверхности волосковых клеток, путем наложения позиционное сетку на каждой ячейке волос и маркировки местоположения либо основания киноцилии или вершины / центра stereociliary пучка. Отображение данных в виде процента от каждой категории, которая лежит в пределах конкретного региона сетки, и путем наложения местоположения друг маркировки на одном позиционном сетке.
Примечание: В тканях контрольных киноцилии всегда прикреплен к вершине stereociliary расслоения. В ресничек мутантов, киноцилии часто отсутствуют, mislocalized пока еще привязаны, или даже полностью отделены от Stereociliary расслоение. - Длина киноцилий (рис 3I):
- Измерьте длину киноцилии путем маркировки с мерцательной аксонемы маркера. Только измерить киноцилий которые лежат плоские пределах 1,5 мкм конфокальной плоскости в. Убедитесь, что реснички лежа наблюдая поперечное сечение отсканированной ткани. Сравнить возрасте подобранные образцы из той же области улитки так киноцилия втягивается в процессе разработки.
- Mislocalization из белков полярности:
- После иммуногистохимии с использованием антител против белков полярности, таких как Vangl2 и Gαi3, определить локализацию через визуализации.
Примечание: В некоторых ресничек мутантов, локализация белков полярности нарушается. К ним относятся Vangl2 и Gαi3, которые, как было показано, чтобы быть нарушена в Ift20, Bbs8 и Bbs6 мутантного улитки.
Примечание: Дальнейшие примеры, как количественно и Polarit дисплей волосковых клетоку может быть найден в следующих работах. Куртина, и др. (2003) Current Biology 22, Montcouquiol и др. (2003) Nature 7, Ван и др (2006) Журнал Neuroscience 23, Montcouquiol и др. (2008) Методы молекулярной биологии 24, май-Simera др. (2012) Методы молекулярной биологии 25, Инь и др (2012) PLoS One 26.
Результаты
Улитка Вскрытие и Подготовка ткани
После удаления мозга, после средней линии сагиттального рассечения головы P0 мыши, костного лабиринта, при взгляде сзади, и могут быть просмотрены (Фигура 1А, белая стрелка) и удаляют. 1В показаны отдельные костные лабиринты с кохлеарного волос вверх, брюшная, (слева) и сзади, спинной (справа). Белая стрелка указывает на овальное окно, из которого можно начать удаление внешний хрящ. После того, как внешняя хрящ был полностью удален, подвергается канал улитки, цела, может наблюдаться (фиг.1С). Позиционирование на булавку вестибулярного области оказания помощи рассечение показано. Два контакта, расположенные под разными углами, также может быть использован для закрепления ткани. Рисунок 1D показывает канал улитки после удаления Райснера '; S мембрана и мембрана текториальной (слева) и выделенный кохлеарный спиральный эпителиальной как только она была изолирована от вестибулярного области в рамках подготовки для монтажа для иммуногистохимии (справа). Чтобы дать общее представление о том, что подвергаются кохлеарный волосы похожи, неиспользованный препарат SEM показана на рисунке 1E.
Морфология и Иммунофлуоресценции в Control улитки
После подготовки кохлеарного ткани, спинной поверхности канала улитки, содержащей орган Корти подвергается и может рассматривалась с помощью SEM или иммунофлуоресцентного окрашивания. Рассматриваемый в целом монтажа подготовки, четыре ряда механосенсорных волосковых клеток (одного ряда внутренних волосковых клеток и тремя рядами наружных волосковых клеток) можно отличить. 2А показывает низкую вид увеличении базального оборота от эмбрионального улитки мыши , подготовленный еили SEM. Обратите внимание на однородной ориентации и выравнивание актина на основе пучков stereociliary. Кроме морфология stereociliary пучков согласуется, каждый пучок имеет классический ")" (на внутренних волосковых клеток) или "W" (на наружных волосковых клеток) форма. При ближайшем увеличении в этом возрасте дополнительные микроворсинки можно увидеть не только на апикальной поверхности волосковых клеток, но и в промежутках между волосковых клеток на опорных клеток (рис 2б). Они будут отступать оставив только три строки stereociliary пучков на наружных волосковых клеток и два на внутренних волосковых клеток у взрослых. Как можно видеть на фиг.2С (белая стрелка), один микротрубочек на основе Киноцилия (истинным первичная ресничка) находится рядом с самой высокой строки стереоцилий на вершине каждой stereociliary пучка. Они прикреплены к пучку с помощью киноцилий ссылкам.
Флуоресцентным с фаллоидином, который лабораторнойELS актина, подчеркивает единую ориентацию и форму пучков в контрольной ткани (рис 2D). Кортикальная актин также помечены, который полезен для определения апикального окружность каждой отдельной клетки волос. Со-мечение фаллоидином и антитела против Миозин 7а (рис 2Е), волосы клеточный маркер, также помогает различать волосковых клеток и поддерживающих клеток. Миозин 7а также является полезным маркером для измерения кохлеарный расширение протока (рис 3а). Антитела против ацетилированного-альфа-тубулина обычно используется для идентификации микротрубочек на основе Киноцилия (рис 2F). Как поддерживающие клетки также питают первичные реснички, важно различать ресничек, исходящих из волосковых клеток по сравнению интеркалированных поддерживающие клетки. Дополнительным мембрана маркер, такой как антитела против ZO-1 (Зона Occludens 1), который четко излагается мозаичную паттерна апикальной мембране улиткового протока, поэтому полезно (<сильный> Рисунок 2F). Из дальнейшего рассмотрения является то, что антитела против ацетилированного-альфа-тубулина также маркировать внутренние микротрубочки и так следует позаботиться при визуализации, чтобы сосредоточиться на апикальной поверхности волосковых клеток. Микротрубочки в столбе клеток особенно плотную (рис 2G, белый звездочка). Сочетание фаллоидином и анти-ацетилированный-альфа-тубулина маркировки часто используется для одновременного выявления stereociliary пучки и соседние киноцилий (рис 2G, белый стрелками).
Cochlear Фенотип в ресничек мутантов
Удлинение канала улитки является одним из лучших вывода данных и конвергенции удлинительных дефектов, и укороченные кохлеарные протоки обычно наблюдаются в классических мутантов PCP. Улитка в цилиарных мутантов часто сокращается кохлеарные протоки и показывают заметное расширение сенсорного epitheЛия на вершине, как это было видно в Ift20 СКО / СКО мышей (рис 3а). Другой классический дефект РСР нарушение равномерной ориентации волосковых клеток улитки, как можно видеть в Bbs8 - / - мышей как с иммуногистохимии (Рисунок 3B, Стрелка вправо) и SEM (рис 3C). В дополнение к MIS-ориентированных пучков, сплющенные и деформированные связки также обычно наблюдается (рис 3B, средний стрела, рис 3D). Часто круговые пучки, как это было показано на Рисунке 3Е, присутствуют, особенно в волосковых клеток полностью лишенных киноцилий. Mis-локализация киноцилии является обычным явлением.
Неправильно локализованы Киноцилия может или не может быть присоединен к stereociliary расслоения (рис 3В, левая стрелка; рис 3F). Примеры того, как количественно буndle ориентации и киноцилии или расслоение позиционирования показаны на рисунке 3G и 3Н. Данные об ориентации каждой индивидуальной пачке затем могут быть оценены путем определения вращение из расслоения по отношению к линии, проходящей перпендикулярно к ряду столбов клеток, который отделяет внутреннюю и внешнюю волосковых клеток. Клетки с нормальной ориентацией выровнены вдоль этой оси, перпендикулярной и поэтому имеют вращение 0 ° (рис 3G). Положение киноцилии или центра stereociliary пучка, могут быть построены путем наложения позиционное сетку на люменальной поверхности клеток волосяных а затем определения местоположения киноцилии или расслоение внутри сетки (рис 3I). Мутации в генах ресничек часто влияет длину ресничек, и поэтому длина киноцилии может быть оценена. В Cep290 RD16 / RD16 мутантов, киноцилии больше, чем в контрольной группе (рис 3J). Как реснички ретрактовважно иметь возрастных соответствием товарищей мусора и выполнять измерения в той же области улитки. Чтобы получить хорошие изображения для анализа и количественной для обоих иммуногистохимии и SEM, очень важно, чтобы удалить текториальной мембраны. Рисунок 3F показывает микрофотографии SEM, в котором покровная мембрана не была полностью удалена.
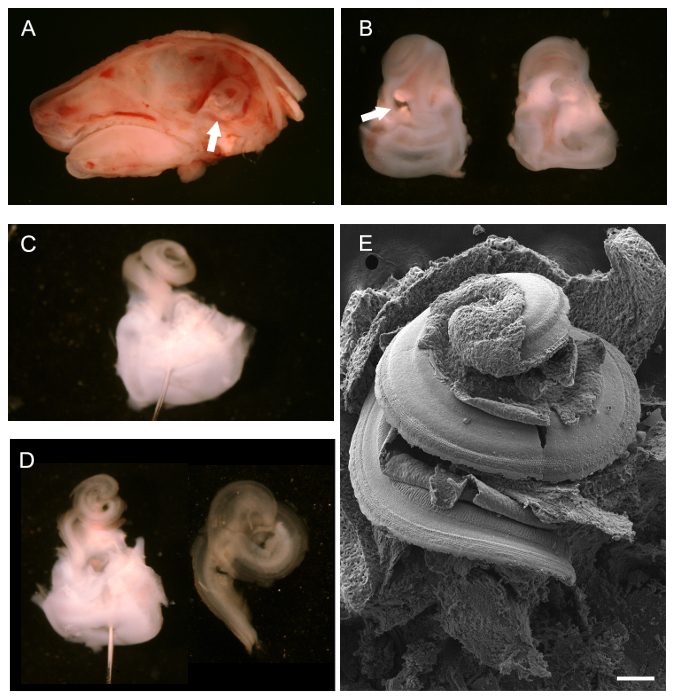
Рисунок 1. Препарирование развивающейся Mouse улитки (P0). (А) средней линии сагиттального рассечения головы P0 мыши со снятым мозга. Белая стрелка указывает на положение костного лабиринта. (B) Брюшной (слева) и спинной (справа) вид расчлененный костных лабиринтов. Улитка расположена ближе к вершине с вестибулярной части внизу Белые стрелка на овальное окно. (C) костный лабиринт кормовойУдаление э внешней хряща улитки. Булавка была помещена через вестибулярной системы. (D) слева, такой же вид, как и в C после удаления мембраны Рейсснера и покровная мембрана. Право, изолированных канал улитки готов к установке. (Е) сканирующего электронного микроскопа нетронутыми, подвергшихся кохлеарного спирали подвергая пол канала улитки, в том числе чувствительного эпителия. Измерительная линейка 100 мкм. . (А - Д), адаптированный с мая по Simera др, 2012 25 Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуре.

Рисунок 2. Морфология и Иммунофлуоресценции в Control улитки (А - С). Сканирование электронной микрофотографии базальной Turп в эмбриональном (E18.5) дикого типа cochleae. Одна строка внутренних волосковых клеток (внизу) и тремя рядами наружных волосковых клеток (вверху) разделяют и интеркалированных поддерживающих клеток. Шеврон-образные stereociliary пучки равномерно ориентировать в направлении бокового края каждой ячейки волос (верхняя кромка изображения). В E18.5 дополнительные микроворсинки покрытия апикальные поверхности волосковых клеток, под stereociliary пучков и интерка- поддерживающие клетки (б). (С) Один Киноцилия микротрубочек на основе (белые стрелки), расположен в вершине пучка, показанный здесь от бокового края. (D - G) Иммунофлуоресцентного окрашивание базальный оборот послеродовой день 1 (P1) дикого типа cochleae. Фаллоидином этикетки нитчатые актин в стереоцилиях и коркового актина на периферии клетки (D, E, G). Миозина 7а является маркером внутренней и наружной волосковых клеток (Е). Zo_1 этикетки плотных контактов в промежутках между клетками, что делает его отличным маркер отличить клеток boundaРайс (F). Ацетилированный α-тубулина используется в качестве маркера для киноцилии в вершине пучка (F, G белая стрелка). Внутренние микротрубочки также помечены ацетилированного альфа-тубулина, которые особенно распространены в столб клеток (G белый звездочка). Масштаб бары A: 10 мкм, B: 5 мкм, C: 1 мкм, ДГ:. 5 мкм Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуре.
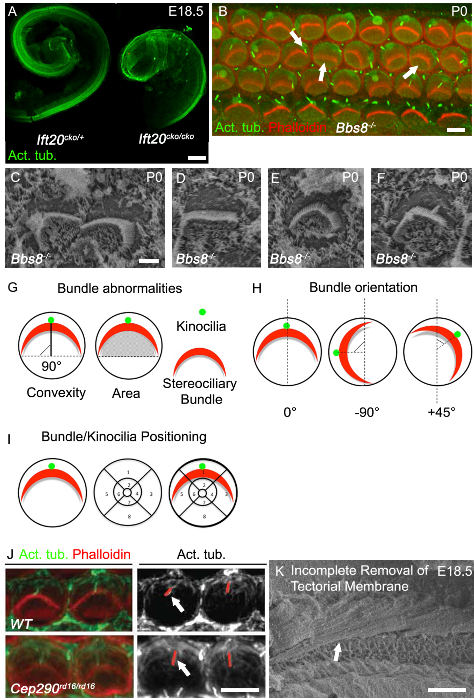
Рисунок 3. Cochlear Фенотип в ресничек мутантов. (А) Выраженное укорочение Ift20 СКО / СКО кохлеарные протоки по сравнению с контролем. Препарированные кохлеарные протоки на E18.5 окрашивали ацетилированного тубулина. (Б ) Всего подключать образы базальной кохлеарного свою очередь в Bbs8 - / - мутант (Р0). Фаллоидином меченных нитевидные актина, стереоцилии (красный), ацетилированный тубулина, киноцилии (зеленый). Stereociliary пучки в Bbs8 - / - cochleae переменно вращается (Стрелка вправо), сплющенные и / или mislocalized (средний стрелка). Киноцилий которые mislocalized или аксонем отсутствуют (стрелка влево). (C - F) Высшее увеличения СЭМ stereociliary расслоений и киноцилий в Bbs8 - / - OHCs. В C, поворачивается пучки в D, сплющенные расслоение, в Е, круглых пучков и F mislocalized киноцилий. (G - I) схематические представления расслоения аномалии количественного определения. (G) слева, расслоение выпуклость (по высоте); кратчайшее расстояние между вершиной пучка и линией, которая проходит через оба конца в комплект 'оружия'. Как гepicted сплошной черной линией. Право, площадь под расслоения; площадь. (Н) схематические представления критериев, используемых для количественной ориентации stereociliary пучков. Угол поворота пучка вычисляется относительно линии, проходящей перпендикулярно к ряду столбов клеток. (I) Схематическое представление критериев позиционной анализа киноцилий и stereociliary пучков. Сегментированный сетки укладывают по окружности клетки волос и положение отмечено. (J) Высшее увеличения изображения фаллоидином меченных стереоцилий пучков (красный) и ацетилированного тубулина меченных киноцилий (зеленый) наружных волосковых клеток в улитке P0. В соседнем монохроматического панели, красные линии определить киноцилий, которые дольше в Cep29 RD16 RD16 мутантов / по сравнению с контролем (белые стрелки). (К) СЭМ микрофотография эмбрионального улитки с неполным удалением текториальной мембраны. Масштаббары А: 100 мкм, B: 5 мкм, С - F: 2,5 мкм, I: 5 мкм, J: 50 мкм. (А - F)... Редактировался мае-Simera др 2015 8, J Перепечатка с разрешения Рэйчел др, 2012 27 Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуре.
Обсуждение
При подготовке кохлеарный ткани для анализа, есть несколько ключевых моментов, чтобы иметь в виду. Во-первых, различия в генетическом фоне может изменить кохлеарный фенотип, что делает необходимым для анализа и сравнения только элементы управления однопометница. Во-вторых, полное удаление текториальной мембраны требуется для получения наилучшего изображения с иммуногистохимии и имеет важное значение для SEM. Покровная мембрана является непрозрачной структурой и может скрыть клетки сенсорного эпителия непосредственно под ним, делая изображения более сложным. Иногда в процессе обработки, текториальная мембрана может сжиматься, раскрывая волосковых клеток. Даже в этих случаях удаление настоятельно рекомендуется. Этот шаг требует терпения и практики. В-третьих, иммуногистохимии с использованием антител против цилиарных белков, в частности тех, которые локализуются в спрессованный базального тельца, может быть сложным и требует оптимизации. Рассмотрим выполнение извлечение антиген, усиливая permeabilлизации шаги, или уменьшая концентрацию или время фиксации. Наконец, при визуализации Киноцилия (первичная ресничка найти на волосковых клеток улитки) иметь в виду, что он начинает втягиваться от P0 - P1 года в градиенте база-вершиной. Поэтому при измерении длины киноцилии важно, чтобы сравнить клетки волос от той же области улитки и в возрастных животных, сходных. Опорные клетки интеркалирован- также первичные реснички, которые не убирается. Необходимо соблюдать осторожность, чтобы различать поддержку клеток реснички и волосковых клеток киноцилий.
Как мышей зрелые, становится все труднее чисто изолировать кохлеарный сенсорного эпителия, из-за кальцификации височных костей и костных лабиринтов. Декальцификация ткани требуется, что не всегда совместимы с другими методами иммунолокализации но позволяет для обследования валового фенотипа, а также совместим с подготовкой SEM. Инбредных ул мышиAINS часто демонстрируют слуховые дефекты, такие как потеря волосковых клеток или повышенных слуховых реакций стволовых (ОБРС), из-за мутаций в известных слуховых генов или генов-модификаторов. Поэтому очень важно, чтобы сравнить возрастные контрольной группы однопометница или разводить на альтернативном генетическом фоне.
Одним из недостатков этого анализа состоит в том, у мышей, киноцилия начинает отвод сообщению рождение и больше не присутствует на волосковых клеток взрослых. По этой причине измерения киноцилий может быть сделано только в развивающихся ткани. Кроме того, необходимо тщательно выбирать возраста из контрольной группы для сравнения между мутантных и контрольных образцов. Другим ограничением является то, что ресничные мутантных мышей анализировали сих пор не проявляют серьезный слуховой дисфункции (т.е.., Слуховые ответов ствола мозга ОБРС или отоакустической эмиссии, OAEs) даже тогда, когда кохлеарный развитие нарушенной. В соответствии с этим, слуховые дефекты не обычная человеческая фенотип цилиопатии. В исключительных случаях, потеря hearinг является одним из главных признаков синдром альстрёма, вызванных мутациями в базальной тела белка ALMS1 28,29. Это говорит о том, что stereociliary морфология расслоение не обязательно связаны с слуховой дисфункции в ресничек мутантов, вероятно, из-за корректирующих переориентации пучков позже в развитии, как было сообщено на Vangl2 СКО мутантов 30. Если спектр цилиопатии расширяется, чтобы включить Usher синдром, наиболее распространенный врожденный причину глухого слепотой, то слуховой дисфункции становится весьма актуальным. Последние данные показывают, что некоторые белки, связанные с Usher синдром также локализуются в ресничку и участвуют в процессах 31 цилиарных связанных, но являются ли эти белки относятся к сигнализации PCP до сих пор не изучены.
До сих пор большинство мутантов цилиарного мыши анализировали на кохлеарные дефектов PCP не только были смутно исследовали. Методики, описанные в этой рукописи позволяют обширный детализациякохлеарный фенотип, который, несомненно, приведет к более точному пониманию участия мерцательной в установлении позвоночных сигнализацию PCP. Несмотря на большое количество моделей цилиопатии мыши доступных, на удивление немногие из них были проанализированы с точки зрения кохлеарных дефектов PCP. Типичной ошибкой, связанные с этими моделями эмбриональной летальности. Однако, поскольку проявляющее улитка может быть рассмотрен в зародыше роль ресничек в PCP в развивающемся ухе может быть еще предстоит исследовать. Кроме того, очень рано эмбриональной летальности можно обойти с помощью условных нокаутом. Foxg1 Cre 32 мышей, доступных из JacksonLaboratories, которые обычно используются для inactivategenes интересов в thedeveloping внутреннее ухо от даты E8.To, усилия были сосредоточены в основном на изучении болезнетворные гены цилиопатии однако исследование других связанных с ресничками белков и как они влияют на сигнализацию PCP во время развития может обеспечить более глубокое понимание КССIA биологии и функции.
Если слуховой фенотип подозревается в мышиных моделях анализируются возможные дальнейшие анализы включают аудиометрические тестирование ABR, 33 или OAEs 34. Кохлеарный удлинительные эксплантов анализы (как описано в мае-Simera и др., 2012 25), может также быть выполнена и позволяет идентифицировать конвергентных дефектов удлинение при ранних временных точках развития. Культивирование улитки эксплантов также позволяет обработки различными сигнальными активаторов или ингибиторов, которые могут изменить расширение эксплантов, способствуя тем самым механистического понимания процессов развития участвующих. Хотя известно, что киноцилия втягивается после рождения 11,13,14, это отвод не был тщательно рассмотрен в контексте цилиарных мутантов. Было бы интересно провести измерения киноцилий возникновения и втягивания в определенное время в ресничек mutants.Considering что основная роль для ресничного пробелки это перемещение груза вдоль микротрубочек, весьма вероятно, что эти белки могут также регулировать аспекты внутриклеточного транспорта вдоль цитоскелета 35-37. Подмножество ресничек белков было показано, влияют торговлей и асимметричный локализацию молекул PCP 8. Локализация с помощью иммуногистохимии молекул PCP, особенно ассоциированных с мембранами белки, такие как Vangl2, Frz3 и Dsh, поэтому рекомендуется установить, если молекулы PCP которые mislocalized. Установление полярности, как представляется, многогранное дело, и появляется все больше данных о дополнительном клеток автономной пути, который также необходим для правильного PCP в волосковых клеток 38. В недавней работе показал, что G белок-зависимой сигнализации контролирует миграцию реснички в клеточно-автономным образом 39. В соответствии с ролью для цилиарных белков в локализации молекул полярности, гетеротримерный G-белок альфа-я субъединицей 3 (Gαi3) Localization нарушается в Bbs8 и Bbs6 нокаутом улитки 8,39.
Отличительные роль отдельных компонентов ресничек и их отдельных эффектов на сигнализации PCP даст нам более полное представление о роли реснички в установлении полярность. Особое значение имеет различие между цилиарных белков, функционирующих в контексте мерцательной, против не-ресничные функций, которые традиционно считались цилиарных белков, такие как их роль в регулировании нон-цилиарного связанную внутриклеточного транспорта. Высокая степень регулярности во многих аспектах кохлеарного структуры, в том числе сотовой паттерна и stereociliary расслоения ориентации, позволяет выявить тонкие изменения в развитии PCP в ответ либо генетических или молекулярных возмущений в связанных с ресничками белков. Учитывая, что существует множество моделей цилиарного мыши доступны, и что развивающийся улитка мыши является одним из лучших мест в целях изучения PCPсигнализации, она представляет большой интерес, чтобы узнать, в какой степени отдельные белковые мутации нарушают развитие улитки.
Раскрытие информации
The author declares no competing financial interests.
Благодарности
Автор хотел бы поблагодарить Мэтью Келли, Тициана Cogliati, Джессика Gumerson Уве Вольфрума Ривка LEVRON, Виола Кречмер и Zoe Манн и их критической оценки рукописи. Эта работа была профинансирована Софья Ковалевская премии (Humbodlt Foundation) и Йоханнес-Университет Гутенберга, Майнц, Германия.
Материалы
| Name | Company | Catalog Number | Comments |
| Tools/Equipment | |||
| Silicone elastomere - Sylgard 184 | Sigma-Aldrich | 761028-5EA | See Note 2 |
| Micro dissecting scissors-straight blade | Various | ||
| Fine forceps (no. 5 and 55) and blunt forceps | Various | ||
| Dissecting microscope. | Various | ||
| Uncoated glass microscope slides | Various | ||
| Microscope cover slips (22 mm × 40 mm × 0.15 mm) | Various | ||
| Transfer pipettes | Various | ||
| Minutien pins | Fine Science Tools | 26002-10 | |
| SEM sample holder | tousimis | 8762 | |
| Scanning electron microscopy studs | TED PELLA | 16111 | |
| PELCO Tabs: Carbon adhesive | TED PELLA | 16084-3 | |
| Fluorescent Microscope | Various | ||
| Critical Point Dryer | Various | ||
| Scanning Electron Microscope | Various | ||
| Glass microscope slides | Various | ||
| Glass coverslips | Various | ||
| Kimwipe Tissue | Various | ||
| Fine Paint Brush | |||
| Reagents | |||
| 1× Phosphate buffered saline (PBS) | Gibco/Life Technologies | 10010023 | |
| Paraformaldehyde (PFA) (EM Grade Required for EM) | Various | Prepare a 4% solution in 1× PBS made fresh each time. EM Grade Required for EM. | |
| 2.5% Glutaraldehyde Grade1 | Sigma-Aldrich | G5882 | |
| Tris-HCl (pH 7.5) | Various | ||
| NaCl | Various | ||
| CaCl 2 | Various | ||
| Triton X-100 | Various | ||
| Normal Goat Serum | Various | ||
| AffiniPure Fab Fragment Donkey Anti-Mouse IgG (H+L) | Jackson ImmunoResearch | 715-007-003 | |
| Fluoromount-G Mounting media | SouthernBiotech | 0100-01 | |
| 10× Hanks’ Balanced Salt Solution (HBSS) | Gibco/Life Technologies | 14065 | |
| Hepes | Gibco/Life Technologies | 15630-080 | |
| Osmium tetroxide (OsO4 ) | Sigma-Aldrich/Fluka Analytical | 75632 | |
| Tannic acid | Sigma-Aldrich | 403040 | |
| Ethanol 200 proof | Various | ||
| Antibodies | |||
| anti Arl13b | Protein Tech | 17711-1-AP | Suggested concentration 1:1,000 |
| anti acetylated tubulin (611-B1) | Sigma-Aldrich | T6793 | Suggested concentration 1:800 |
| anti gamma tubulin (GTU-88) | Sigma-Aldrich | T6557 | Suggested concentration 1:200 |
| anti Zo_1 | Invitrogen | 40-2300 | Suggested concentration 1:500 |
| Myosin VI | Proteus Biosciences | 25-6791 | Suggested concentration 1:1000 |
| Myosin VIIa | Proteus Biosciences | 25-6790 | Suggested concentration 1:1,000 |
| anti Vangl2 | Merk Millipore | ABN373 | Suggested concentration 1:250 |
| anti Gαi3 | Sigma-Aldrich | G4040 | Suggested concentration 1:250 |
| Alexa Fluor® 488 Phalloidin | Invitrogen/Life Technologies | A12379 | Suggested concentration 1:300 - 1,000 |
| Alexa Fluor® 568 Phalloidin | Invitrogen/Life Technologies | A12380 | Suggested concentration 1:300 - 1,000 |
Ссылки
- Waters, A. M., Beales, P. L. Ciliopathies: an expanding disease spectrum. Pediatr Nephrol. 26, 1039-1056 (2011).
- May-Simera, H. L., Kelley, M. W. Cilia, Wnt signaling, and the cytoskeleton. Cilia. 1, 7 (2012).
- Ross, A. J., et al. Disruption of Bardet-Biedl syndrome ciliary proteins perturbs planar cell polarity in vertebrates. Nat Genet. 37, 1135-1140 (2005).
- Ezan, J., Montcouquiol, M. Revisiting planar cell polarity in the inner ear. Seminars in cell & developmental biology. 24, 499-506 (2013).
- Semenov, M. V., Habas, R., Macdonald, B. T., He, X. SnapShot: Noncanonical Wnt Signaling Pathways. Cell. 131, 1378 (2007).
- Wang, J., et al. Regulation of polarized extension and planar cell polarity in the cochlea by the vertebrate PCP pathway. Nat Genet. 37, 980-985 (2005).
- Montcouquiol, M., et al. Identification of Vangl2 and Scrb1 as planar polarity genes in mammals. Nature. 423, 173-177 (2003).
- May-Simera, H. L., et al. Ciliary proteins Bbs8 and Ift20 promote planar cell polarity in the cochlea. Development. 142, 555-566 (2015).
- Jones, C., et al. Ciliary proteins link basal body polarization to planar cell polarity regulation. Nat Genet. 40, 69-77 (2008).
- Lim, D. J. Functional structure of the organ of Corti: a review. Hearing research. 22, 117-146 (1986).
- Nayak, G. D., Ratnayaka, H. S., Goodyear, R. J., Richardson, G. P. Development of the hair bundle and mechanotransduction. The International journal of developmental biology. 51, 597-608 (2007).
- Denman-Johnson, K., Forge, A. Establishment of hair bundle polarity and orientation in the deveoping vestibular system of the mouse. J. Neurocytol. , 821-835 (1999).
- Sobkowicz, H. M., Slapnick, S. M., August, B. K. The kinocilium of auditory hair cells and evidence for its morphogenetic role during the regeneration of stereocilia and cuticular plates. Journal of neurocytology. 24, 633-653 (1995).
- Denman-Johnson, K., Forge, A. Establishment of hair bundle polarity and orientation in the developing vestibular system of the mouse. Journal of neurocytology. 28, 821-835 (1999).
- van Dam, T. J., et al. The SYSCILIA gold standard (SCGSv1) of known ciliary components and its applications within a systems biology consortium. Cilia. 2, 7 (2013).
- Blacque, O. E., Sanders, A. A. Compartments within a compartment: what C. elegans can tell us about ciliary subdomain composition, biogenesis, function, and disease. Organogenesis. 10, 126-137 (2014).
- Wallingford, J. B., Mitchell, B. Strange as it may seem: the many links between Wnt signaling, planar cell polarity, and cilia. Genes & development. 25, 201-213 (2011).
- Borovina, A., Ciruna, B. IFT88 plays a cilia- and PCP-independent role in controlling oriented cell divisions during vertebrate embryonic development. Cell reports. 5, 37-43 (2013).
- Huang, P., Schier, A. F. Dampened Hedgehog signaling but normal Wnt signaling in zebrafish without cilia. Development. 136, 3089-3098 (2009).
- Ocbina, P. J., Tuson, M., Anderson, K. V. Primary cilia are not required for normal canonical Wnt signaling in the mouse embryo. PloS one. 4, e6839 (2009).
- Jones, C. G. Scanning electron microscopy: preparation and imaging for SEM. Methods Mol Biol. 915, 1-20 (2012).
- Curtin, J. A., et al. Mutation of Celsr1 disrupts planar polarity of inner ear hair cells and causes severe neural tube defects in the mouse. Current biology : CB. 13, 1129-1133 (2003).
- Wang, Y., Guo, N., Nathans, J. The role of Frizzled3 and Frizzled6 in neural tube closure and in the planar polarity of inner-ear sensory hair cells. The Journal of neuroscience : the official journal of the Society for Neuroscience. 26, 2147-2156 (2006).
- Montcouquiol, M., Jones, J. M., Sans, N. Detection of planar polarity proteins in mammalian cochlea. Methods Mol Biol. 468, 207-219 (2008).
- May-Simera, H., Kelley, M. W. Examining planar cell polarity in the mammalian cochlea. Methods Mol Biol. 839, 157-171 (2012).
- Yin, H., Copley, C. O., Goodrich, L. V., Deans, M. R. Comparison of phenotypes between different vangl2 mutants demonstrates dominant effects of the Looptail mutation during hair cell development. PloS one. 7, e31988 (2012).
- Rachel, R. A., et al. Combining Cep290 and Mkks ciliopathy alleles in mice rescues sensory defects and restores ciliogenesis. J Clin Invest. 122, 1233-1245 (2012).
- Jagger, D., et al. Alstrom Syndrome protein ALMS1 localizes to basal bodies of cochlear hair cells and regulates cilium-dependent planar cell polarity. Human molecular genetics. 20, 466-481 (2011).
- Collin, G. B., et al. The Alstrom Syndrome Protein, ALMS1, Interacts with alpha-Actinin and Components of the Endosome Recycling Pathway. PloS one. 7, e37925 (2012).
- Copley, C. O., Duncan, J. S., Liu, C., Cheng, H., Deans, M. R. Postnatal refinement of auditory hair cell planar polarity deficits occurs in the absence of Vangl2. The Journal of neuroscience : the official journal of the Society for Neuroscience. 33, 14001-14016 (2013).
- Sorusch, N., Wunderlich, K., Bauss, K., Nagel-Wolfrum, K., Wolfrum, U. Usher syndrome protein network functions in the retina and their relation to other retinal ciliopathies. Advances in experimental medicine and biology. 801, 527-533 (2014).
- Hebert, J. M., McConnell, S. K. Targeting of cre to the Foxg1 (BF-1) locus mediates loxP recombination in the telencephalon and other developing head structures. Dev Biol. 222, 296-306 (2000).
- Willott, J. F. Chapter 8, Measurement of the auditory brainstem response (ABR) to study auditory sensitivity in mice. Current protocols in neuroscience. , Unit8 21B (2006).
- Martin, G. K., Stagner, B. B., Lonsbury-Martin, B. L., et al. Chapter 8, Assessment of cochlear function in mice: distortion-product otoacoustic emissions. Current protocols in neuroscience. , Unit8 21C (2006).
- Finetti, F., et al. Intraflagellar transport is required for polarized recycling of the TCR/CD3 complex to the immune synapse. Nature cell biology. 11, 1332-1339 (2009).
- Sedmak, T., Wolfrum, U. Intraflagellar transport molecules in ciliary and nonciliary cells of the retina. J Cell Biol. 189, 171-186 (2010).
- Yuan, S., Sun, Z. Expanding horizons: ciliary proteins reach beyond cilia. Annual review of genetics. 47, 353-376 (2013).
- Tarchini, B., Jolicoeur, C., Cayouette, M. A molecular blueprint at the apical surface establishes planar asymmetry in cochlear hair cells. Developmental cell. 27, 88-102 (2013).
- Ezan, J., et al. Primary cilium migration depends on G-protein signalling control of subapical cytoskeleton. Nature cell biology. 15, 1107-1115 (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены