Method Article
تقييم مستو خلية-التقاطب الظواهر في Ciliopathy ماوس المسخ القوقعة
In This Article
Summary
Primary cilia influence various signaling pathways. The mammalian cochlea is ideal for examining planar cell polarity (PCP) signaling. Cilia dysfunction affects cochlear outgrowth, cellular patterning and hair cell orientation, readouts of PCP. Our goal is to analyze PCP signaling in mouse cochlea via phenotypic analysis, immunohistochemistry and scanning electron microscopy.
Abstract
In recent years, primary cilia have emerged as key regulators in development and disease by influencing numerous signaling pathways. One of the earliest signaling pathways shown to be associated with ciliary function was the non-canonical Wnt signaling pathway, also referred to as planar cell polarity (PCP) signaling. One of the best places in which to study the effects of planar cell polarity (PCP) signaling during vertebrate development is the mammalian cochlea. PCP signaling disruption in the mouse cochlea disrupts cochlear outgrowth, cellular patterning and hair cell orientation, all of which are affected by cilia dysfunction. The goal of this protocol is to describe the analysis of PCP signaling in the developing mammalian cochlea via phenotypic analysis, immunohistochemistry and scanning electron microscopy. Defects in convergence and extension are manifested as a shortening of the cochlear duct and/or changes in cellular patterning, which can be quantified following dissection from developing mouse mutants. Changes in stereociliary bundle orientation and kinocilia length or positioning can be observed and quantitated using either immunofluorescence or scanning electron microscopy (SEM). A deeper insight into the role of ciliary proteins in cellular signaling pathways and other biological phenomena is crucial for our understanding of cellular and developmental biology, as well as for the development of targeted treatment strategies.
Introduction
أهداب الابتدائية طويلة الزوائد القائم على أنيبيب التي تمتد من سطح معظم خلايا الثدييات. وغالبا ما يتم الخلط بين أهداب الابتدائي مع أهداب متحركة، التي يوجد منها دائما متعددة في كل خلية، والذي يهدف إلى نقل السوائل عبر أسطح الأغشية. أهداب الابتدائي، في المقابل، تعتمد الأدوار الحسية، وبالتالي المشار إليها أهداب كما الحسي أيضا. مرة واحدة فترة طويلة طي النسيان، وهذا عضية في الآونة الأخيرة 'اكتشاف' نتيجة لارتباطه مع العديد من الأمراض الوراثية البشرية 1. موقع مثالي كما عضية الإشارات، وقد تبين من هدب الأساسي لتنظيم العديد من مسارات إشارات، وكثير منها هي مهمة ليس فقط في توازن الأنسجة والمرض، ولكن أيضا خلال تطوير 2.
كان واحدا من مسارات الإشارات الأولى تبين أن تترافق مع ضعف أهداب وغير متعارف عليه مسار إشارات Wnt، المعروف أيضا باسم قطبية خلية مستو (PCP) مسار > 3. هذه سلسلة الإشارات التي تم تحديدها في البداية في ذبابة الفاكهة، هو أمر حاسم لمرحلة التطور الجنيني. ولا سيما بالنسبة للعمليات التقارب والإرشاد والتوجيه الصحيح من الخلايا في الطائرة من ظهائر 4. إشارات متتابعة من مجموعة أساسية من البروتينات التنظيمية تترجم الإشارات الاتجاه الذي يؤدي في نهاية المطاف إلى إعادة ترتيب هيكل الخلية ويؤدي إلى الاستقطاب منسق الخلايا الظهارية في طائرة 5. مطلوب عملية التقارب والإرشاد للغاية لقناة القوقعة إلى استطال والصحيحة الزخرفة الخلوية 6. وبما أن هذا التنظيم عبر تفعيل المسار حزب المؤتمر الشعبي، واحدة من الظواهر الأكثر لفتا للطفرات PCP القوقعة هي القناة قوقعة تقصير مع غير منظمة ظهائر الحسية 7. وبالمثل، المسوخ الماوس، والتي تفتقر أهداب، كما يحمل هذا التقارب والإرشاد النمط الظاهري 8،9، على الرغم من بالضبط كيف ينظم يبقى أن توضيح.
ve_content "> لأن عمليات التقارب والإرشاد حاسمة للنمو من القناة القوقعة، والزخرفة الخلوية من ظهائر الحسية داخل القناة القوقعة، القوقعة النامية جهازا مثاليا لدراسة PCP الإشارات خلال تطوير الفقاريات.، وجهاز ويطلق على كورتي، مصطلح يطلق على ظهارة حسية متخصصة خطوط القناة قوقعة الأذن، ويتكون من خلايا دعم غير الحسية وخلايا الشعر ميكانيكية حسية التي يجب موحد الموجهة للالقوقعة للعمل 10. وخلايا الشعر ميكانيكية حسية ذلك بسبب حزم stereociliary التي تمتد من لوحة جليدية (السطح القمي) من كل خلية الشعر الحسية (11). وهذه بمثابة محولات الطاقة الأولية من mechanosensation وعلى الرغم من التسميات على النحو أهداب ساكنة، وتتألف في الواقع من الزغيبات الصغيرة المعتمدة على خيوط الأكتين المعدلة. وفي كل الشعر على شكل شيفرون حزمة، ويتم تنظيم ثلاثة صفوف من أهداب ساكنة في السلطة الفلسطينية أمر غاية والعاديةttern في درج بطريقة حالة شبيهة. ريال مدريد أهداب القائم على أنيبيب، الأهداب المحركة تسميته، مطلوبة من أجل تطوير وتوجيه حزم stereociliary 12. على كل خلية الشعر، ويرد الهدب المحرك واحد فعليا إلى حزمة أهداب ساكنة، ويقع بالقرب مركزيا لأطول صف من أهداب ساكنة. وظيفة دقيقة من الهدب المحرك غير واضحة، وفرضية واحدة هي أن الهدب المحرك "تسحب" على أهداب ساكنة في الشكل لأنها ناضجة من الزغيبات الصغيرة 12. في الفقاريات، الأهداب المحركة في القوقعة هي فقط موجودة عابر وتتراجع عن خلايا الشعر في الفئران قبل بداية سماع 11،13،14.فقدان كامل للأهداب في تطوير النتائج القوقعة في القنوات قوقعة تقصير شديد، والخطأ في تشكيل وحزم stereociliary، وكذلك الهيئات القاعدية وضعه سوء 8،9 سوء المنحى. لا يشتمل هدب وظيفية فقط من الخيط المحوري الهدبية. العديد من البروتينات المرتبطة أهدابتحدث وظيفة في المجمعات المحلية لالنطاقات الفرعية ذات الصلة أهداب مثل الجسم القاعدية، منطقة انتقالية، أو الهدبية الخيط المحوري 15. الجسم القاعدية، والمستمدة من المركزيه أم جسيم مركزي، هو أيضا مركزا لتنظيم أنيبيب لميكروتثبول مد بعيدا عن هدب في خلايا الجسم، ويمكن تنظيم الاتجار داخل الخلايا وكذلك الاتجار الهدبية. المنطقة الهدبية الانتقالية منطقة أخرى حيث يتم تنظيم وظيفة الهدبية من حيث تنظيم استيراد وتصدير مركبات الهدبية 16.
وقد حددت الدراسات متعددة اتصال بين أهداب وWNT غير متعارف عليه (PCP الإشارات)، على الرغم من أن الآلية الدقيقة غير واضحة (17). التكرار من الجينات الهدبية وحزب المؤتمر الشعبي وحساسية قطبية الخلية إلى التغيرات الخلوية المعمم، تجعل من الصعب ربط مباشرة طفرة إلى العجز في حزب المؤتمر الشعبي محددة. واحدة من الرافضة قراءة في إشارة PCP هو تحديد المواقع من الجسم القاعدية وPRIMARذ هدب، وبالتالي فصل المرحلة الابتدائية من العيوب الثانوية يمثل تحديا. وقد اقترحت بعض الدراسات في الزرد والفأر المسوخ لا علاقة بين أهداب وإشارات Wnt 18-20. قد تعكس تناقضات في البيانات الأنواع، الأنسجة، أو الاختلافات الزمنية التي تعتمد في المساهمات الهدبية نحو إشارات WNT. وعلاوة على ذلك، قد يتم الاحتفاظ الاستجابة WNT العادية إذا بقيت الهيئات القاعدية وظيفية. وفهم أعمق لدور البروتينات الهدبية في مسارات الإشارات الخلوية والظواهر البيولوجية الأخرى أمر حاسم لفهمنا لعلم الأحياء الخلوي والتنموي، فضلا عن تطوير استراتيجيات العلاج المستهدفة.
Protocol
استخدام والموت ببطء كل الحيوانات وفقا للمبادئ التوجيهية واللوائح المؤسسية والحكومية، والأكثر شيوعا عبر CO 2 الاستنشاق وخلع عنق الرحم.
1. إعداد الكواشف
ملاحظة: قبل بداية، وإعداد جميع الكواشف استخدام المواد الكيميائية الصف التحليلية. جعل الحلول باستخدام الصف الجزيئية المقطر والماء منزوع الأيونات ما لم ينص على خلاف ذلك.
- الفوسفات مخزنة المالحة (برنامج تلفزيوني 1X): إصنع 1 لتر من برنامج تلفزيوني 1X بحل 8G كلوريد الصوديوم، 0.2g بوكل، 1.44g نا 2 هبو 4 و 0.24g KH 2 PO 4 في 1 لتر من H 2 O. ضبط درجة الحموضة إلى 7.4 مع حمض الهيدروكلوريك. برنامج تلفزيوني لا تحتاج إلى أن تكون معقمة ويمكن تخزينها في RT. لاحظ أن يتم هذا المخزن المؤقت دون CaCl 2 أو MgCl 2.
- بارافورمالدهيد (4٪ PFA): إعداد حل 4٪ من منهاج العمل في برنامج تلفزيوني 1X في غطاء الدخان التهوية. إضافة 40G مسحوق امتصاص العرق إلى 1 لتر من برنامج تلفزيوني 1X. حل، وإثارة وحرارة إلى حوالي 60 درجة مئوية،وإضافة ببطء هيدروكسيد الصوديوم قطرة من الحكمة أن رفع درجة الحموضة. مرة واحدة قد حلت مسحوق، إعادة ضبط درجة الحموضة إلى 7.4 مع حمض الهيدروكلوريك. تصفية من خلال مرشح 0.45 ميكرومتر وتجميد قسامات. تذويب قسامة جديدة لكل تجربة.
- عازلة تريتون: إعداد 0.1 M تريس، حمض الهيدروكلوريك (7.5 درجة الحموضة)، 0.15 م كلوريد الصوديوم، 0.1٪ تريتون X-100 حل عن طريق إذابة 8.77 جم كلوريد الصوديوم في 1 لتر من 0.1 M تريس، حمض الهيدروكلوريك (7.5 درجة الحموضة). إضافة 1 مل تريتون X-100. يحرك المزيج حتى يذوب. عازلة تريتون مخزن في RT.
- تريتون كتلة: إعداد 10٪ مصل الماعز في المخزن تريتون بإضافة 1 مل من مصل الماعز إلى 9 مل من العازلة تريتون. تخزينها في 4 درجات مئوية. إذا باستخدام الأجسام المضادة الأولية التي أثيرت في الماوس، إضافة الماعز المضادة للماوس مفتش فاب شظايا في التخفيف من 1 في 200 إلى كتلة تريتون للخطوة الحجب.
ملاحظة: إذا كنت تخطط لاستخدام عينات للفحص المجهري الإلكتروني الماسح (SEM)، وإعداد الكواشف إضافية على النحو المبين أدناه. - هانكس "محلول الملح المتوازن (HBSS) مع الكالسيوم والمغنيسيوم: إصنع 1X حل HBSS عن طريق تمييع من محلول المخزونفي المعقم المقطر H 2 O. كما هو معقد عازلة HBSS لتقديم وهناك المخاطر التي تنطوي عليها، فإنه من المستحسن أن تأمر حل 10X الأسهم ولم يضف. التركيز النهائي من HBBS المخزن المؤقت تستخدم بشكل روتيني هو: 1.26 ملي CaCl 2، 0.49 ملي MgCl 2 -6H2O، 0.41 ملي MgSO 4 -7H2O، 5.33 ملي بوكل، 0.44 ملي KH 2 PO 4، 4.17 ملم NaHCO 3، 137.93 ملي كلوريد الصوديوم ، 0.34 ملي نا 2 هبو 4، 5.56 ملي سكر العنب.
- HEPES العازلة: يعد حل 0.1 M HEPES في 1X HBSS، عن طريق تذويب 23.8 غرام HEPES في 1 العازلة L 1X HBSS.
- المجهر الإلكتروني تثبيتي (SEM فيكس): إعداد تثبيتي لوزارة شؤون المرأة عن طريق تمييع الإلكترون المجهري الصف غلوتارالدهيد (2.5٪)، وامتصاص العرق (4٪) في HEPES العازلة. إضافة CaCl 2 إلى تركيز النهائي من 10 ملم.
- 1٪ الأزميوم رباعي أكسيد (أوسو 4) في HEPES العازلة. 1٪ الأزميوم رباعي أكسيد في الماء: تمييع الحل الأسهم من رباعي أكسيد الأوزميوم في HEPES العازلة، وseparatelذ في عقيمة المقطر H 2 O، إلى تركيز النهائي من 1٪. رباعي أكسيد الأوزميوم عالية السمية ويباع الأكثر شيوعا كحل 4٪.
- 1٪ (ث / ت) وحامض التانيك: حل 0.5 غرام حمض التانيك في 50 مل العقيمة H 2 O. المقطر فلتر تعقيم عن طريق الترشيح من خلال مرشح حجم 0.45 المسام.
- متدرج الإيثانول حل سلسلة: تمييع 200 الإيثانول واقية مع العقيمة H 2 O المقطر لجعل حلول 30، 50، 70، 90 و 95٪ من الإيثانول. ليشطف الإيثانول النهائية، مطلوب الإيثانول بنسبة 100٪ 200 دليل. استخدام زجاجة افتتح حديثا من 200 الإيثانول واقية لليشطف النهائية.
2. اختيار الأنسجة
- من الناحية المثالية، فحص الأجنة أو الجراء الصغار الذين تتراوح أعمارهم بين يوم الجنينية 16.5 (E16.5) ويوم ما بعد الولادة 3 (P3).
ملاحظة: التعظم من المتاهة العظمية والعظام الزمنية يجعل تشريح تدريجيا أكثر صعوبة عندما تنضج الفئران. أيضا الأهداب المحركة، وجد صحيحا هدب القائم على أنيبيب الوحيد على خلايا الشعر قوقعة،تتراجع خلال التنمية ولم تعد موجودة في فئران بالغة. - بعد التثبيت، ويزيل الكلس القوقعي الكبار. مكان تشريح (انظر القسم 3) المتاهات عظمي، في 2 مل EDTA (4.13٪ في برنامج تلفزيوني)، ودرجة الحموضة 7.3، في أنبوب microcentrifuge لمدة 3 - 4 أيام مع دوران. تجديد EDTA يوميا. بعد الأنسجة خففا، وشطف في 1.5 مل أو أكثر من برنامج تلفزيوني 3 مرات لمدة 5 دقائق على nutator مع زيادة الإثارة.
3. القوقعة تشريح
- euthanization بعد عن طريق خلع عنق الرحم أو CO 2 الاستنشاق (100٪ CO 2)، وإزالة الرأس. استخدام شفرة مشرط أو زوج من مقص صغير، اعتمادا على حجم الحيوان، لتشريح الرأس على طول خط منتصف سهمي ابتداء من الأنف وتوسيع caudally. إزالة الدماغ من كل شوط من الجمجمة مع زوج من الملقط. تحديد العظام الزمنية، والتي تحتوي على المتاهات العظمية النامية في الأذن الداخلية (انظر السهم في الشكل 1A).
- استخدام زوج من لالفطر الابيض لعزل بعناية متاهات عظمي من الجمجمة (عظم صدغي). هل هذا تحت المجهر تشريح. PRISE بعيدا الأنسجة العظمية من الجمجمة عن طريق تشغيل ملقط بلطف تحت المتاهات عظمي. في الحيوانات حتى P4 متاهات عظمي لا تزال الغضروفية، ويمكن إزالتها بسهولة دون كسر.
- وبعد تشريح، استخدم غيض من ملقط تشريح لمسح البيضاوي والنوافذ المستديرة وجعل ثقب صغير في قمة القوقعة الحلزونية. إصلاح المتاهات العظمية قبل مزيد من تشريح القناة القوقعة. للسماح لسهولة إزالة الغشاء السقفي (انظر 3.7)، وتحديد المتاهات عظمي في 1.5 مل PFA 4٪ لمدة 5 دقائق على الجليد.
ملاحظة: إذا لم يكن مطلوبا إزالة الغشاء السقفي، وينصح تثبيت أطول (انظر 4،1-4،3). تثبيت وجيزة من العظام الزمنية قبل تشريح القناة قوقعة الأذن يساعد في عملية تشريح وإزالة الغشاء السقفي. تشريح ما بعد والتعرض للجهاز كورتي، furtمطلوب تثبيت لها. - وعلاوة على ذلك تشريح المتاهات عظمي لفضح ظهارة حسية قوقعة على النحو التالي. وضع المتاهات عظمي في سيليكون أسود المغلفة الاستومر طبق تشريح تحتوي على برنامج تلفزيوني لتسهيل تشريح. استخدام الدبابيس minutien لشل حركة الأنسجة إذا لزم الأمر. لاستخدام الدبابيس minutien، ووضعها من خلال الجزء الدهليزي من المتاهات عظمي مع الجانب البطني من القوقعة الحلزونية التي تواجه صعودا.
ملاحظة: أسود سيليكون طبق الاستومر: مزيج سيليكون مكون أساسي الاستومر مع مسحوق الفحم للحصول على اللون الأسود معتم. إضافة كيل علاج وتصب في واحد أو أكثر من أطباق بتري (الزجاج أو البلاستيك). الجاف في ظل فراغ لإزالة فقاعات الهواء المحاصرين. أطباق الجافة قبل تماما للاستخدام. - استخدام ملقط غرامة (رقم 5) لإزالة الغضروف الخارجي تعريض القناة القوقعة. تبدأ في النافذة البيضوية. إدراج طرف السفلي من ملقط في إطار بيضاوي ونقب بلطف فتح الغضروف، تتحرك ببطء صعودا نحوقمة.
- بعد تعرض القناة القوقعة، وإزالة السطح البطني، غشاء رايسنر. استخدام زوج جيد من ملقط لقرصة غشاء رايسنر في قاعدة القناة القوقعة وقشر تشغيله في حركة تصاعدية. تصور الجانب الظهري للقناة القوقعة، بما في ذلك ظهارة حسية.
- إزالة الغشاء السقفي كما هو موضح أدناه (اختياري). لSEM أو المناعية من الهدب المحرك أو حزم stereociliary إزالة الغشاء السقفي.
- استخدام زوج جيد جدا من الملقط (رقم 55 أو أدق) لقرصة الغشاء السقفي في قاعدة القوقعة وقشر صعودا نحو قمة.
ملاحظة: الغشاء السقفي هو بصريا واضح مما يجعل من الصعب التعرف عليها. في كثير من الأحيان لا غشاء يأتي قبالة في قطعة واحدة، وعلى الرغم من أنها لا تصور بسهولة، ويمكن للمرء أن يشعر المقاومة كما يتم سحبها تشغيله من الجهاز يتعرض كورتي. - بعد تعريض جهاز كورتي، ومواصلة إصلاح الأنسجة كما دescribed أدناه. الإبقاء على المنطقة الدهليزي لمساعدة المزيد من إعداد الأنسجة.
4. التثبيت
- لالمناعية العادية إصلاح المتاهات العظمية تشريح في 1.5 مل PFA 4٪ في 4 درجات مئوية على nutator لمدة 2 ساعة.
ملاحظة: نظرا لحساسية الأجسام المضادة ومولدات المضادات، والاختلافات اختلاف في طول وتكوين التثبيت قد تكون مطلوبة ويجب أن يكون الأمثل لكل الأجسام المضادة. - بعد التثبيت، وغسل العينات من قبل الشطف في 1.5 مل أو أكثر من برنامج تلفزيوني 3 مرات لمدة 5 دقائق على nutator مع زيادة الإثارة. عينات يمكن تخزينها في برنامج تلفزيوني في 4 درجات مئوية لعدة أسابيع قبل المعالجة.
- إذا إعداد عينات للوزارة شؤون المرأة، وتحديد تشريح عظم صدغي في الإصلاح ووزارة شؤون المرأة (انظر 1.7) لمدة 2 ساعة على RT. غسل الشطف في 1.5 مل أو أكثر HEPES العازلة 3 مرات لمدة 5 دقائق على nutator مع زيادة الإثارة. مخزن في المخزن HEPES في 4 درجات مئوية حتى مزيد من المعالجة. التخزين لمدة أطول من بضعة أسابيعلا ينصح الصورة.
5. المناعية
- أداء المناعية على عينات تشريح في بئر واحدة من 96 لوحة جيدا مسطحة القاع. بدلا من ذلك، استخدام PCR أو أنبوب microcentrifuge. فإنه من المستحسن أن الإبقاء على جزء الدهليزي من المتاهة عظمي لتسهيل المعالجة.
- Permeabilize الأنسجة التي يحتضنها في 1.5 مل العازلة تريتون لمدة 1 ساعة على RT على nutator مع الإثارة لطيف.
- منع الأنسجة التي يحتضنها في 0.5 مل كتلة تريتون مدة لا تقل عن 1 ساعة على RT. إذا باستخدام الأجسام المضادة الأولية التي أثيرت في الماوس، إضافة شظايا المضادة للماوس مفتش فاب للكتلة في التخفيف من 1 في 200 (انظر القسم 1.4). هذا يقلل إلى حد كبير غير محددة ملزمة المضادة للمفتش الماوس إلى الأنسجة الماوس.
- احتضان الأنسجة مع الأجسام المضادة الأولية مخففة في تريتون كتلة O / N عند 4 درجات مئوية مع الإثارة لطيف. تخفيف الأجسام المضادة يعتمد على الأجسام المضادة المستخدمة (انظر القسم 6.1). وبدلا من احتضان antibodie الأساسيالصورة لمدة 2 ساعة على RT. من الناحية المثالية استخدام حجم الحد الأدنى من 0.5 مل تمييع الأجسام المضادة الأولية. إذا الأجسام المضادة لعدد محدود من استخدام أصغر حجم التخفيف الأجسام المضادة التي تحيط تماما الأنسجة.
- غسل الأنسجة بشطفها في 1.5 مل أو أكثر تريتون العازلة، ما لا يقل عن 3 مرات لمدة 15 دقيقة، على nutator مع زيادة الإثارة.
- احتضان الأنسجة مع الأجسام المضادة الثانوية صبغ مترافق فلوري المخفف على الشركات المصنعة للتركيز موصى بها (عادة 1: 200-1: 1000) في كتلة تريتون لمدة 1 ساعة على RT على nutator. استخدام حجم الحد الأدنى من 0.5 مل التخفيف الضد الثانوية.
- أجهزة الطرد المركزي الأجسام المضادة الثانوية المخفف في 13000 x ج لمدة 3 دقائق قبل استخدامها للحد غير محددة وملزمة من المجاميع الضد الثانوية. حماية الأنسجة من الضوء من هذه الخطوة فصاعدا لتجنب photobleaching من الأصباغ الفلورية.
- كما في الخطوة 5.5، وغسل الأنسجة بشطفها في 1.5 مل أو أكثر عازلة تريتون، ما لا يقل عن 3 مرات لمدة 15 دقيقة، علىnutator مع زيادة الإثارة. تخزين العينات في برنامج تلفزيوني في 4 درجات مئوية حتى جاهزة للتحميل.
6. الأجسام المضادة اختيار
ملاحظة: مصدر الأجسام المضادة الموصى بها والتخفيفات التي يتم سردها في جدول المواد المحددة والمعدات. أداء حضانات الضد كما هو موضح في المادة 5.
- لتصور الهدب المحرك القائم على أنيبيب، واستخدام الخيط المحوري الهدبية علامة مثل مكافحة Arl13b (1: 1000) أو مكافحة الأسيتيل-α تويولين (1: 800). تصور الجسم القاعدية باستخدام الأجسام المضادة ضد γ تويولين (1: 200) أو أي علامة centrosomal أخرى.
- لتصور الأكتين خيوط غنية حزم stereociliary، إضافة phalloidin (1: 300 - 1000) مترافق إلى واحدة من عدة fluorophores مختلفة لحضانة الأجسام المضادة الثانوية. أيضا تسميات Phalloidin هياكل الأكتين الخيطية أخرى بما في ذلك خيوط الأكتين القشرية المحيطة محيط كل خلية الشعر الظهارية. وهذا مفيد في تحديدالخطوط العريضة للكل خلية الشعر. استخدام علامة غشاء بديلة مثل مكافحة زوي-1 (1: 500) إذا لزم الأمر.
- تسمية خلايا الشعر قوقعة باستخدام أجسام مضادة ضد الميوسين السادس (1: 1000) أو الميوسين السابع-أ (1: 1000). ويمكن استخدام هذه إذا تقييم طول القوقعة.
ملاحظة: استخدام الأجسام المضادة الفلورسنت المناسبة صبغ مترافق الثانوية الأمثل لمتطلبات المجهر.
7. تركيب والتصوير
- وضع العينة في طبق سيليكون الاستومر السوداء تحتوي على برنامج تلفزيوني. باستخدام ملقط غرامة، وإزالة المنطقة الدهليزي من القوقعة الحلزونية.
- جدا إزالة بعناية الغضروف الأساسي واللحمة المتوسطة من القوقعة الحلزونية. تحتوي القوقعة الحلزونية المتبقية تلم الداخلي، جهاز كورتي وتلم الخارجي.
- نقل القوقعة الحلزونية إلى قطرة من برنامج تلفزيوني وضعها على شريحة المجهر. إذا رغبت في ذلك، فصل القوقعة الحلزونية إلى قطع أي ما يعادل واحد بدوره. هذه الخطوة ليست ضرورية ولكن، ويمكن أن تؤدي إلى lتابعنا من الأنسجة. السطح القمي (الجانب أهداب ساكنة) من خلايا الشعر القوقعة يجب أن تواجه صعودا نحو ساترة.
- الفتيل بعيدا برنامج تلفزيوني مع الأنسجة مكثف أو قطعة من ورق الترشيح وبلطف إعادة القوقعة الحلزونية إذا فقد تحول ظهائر والتداخلات على نفسها.
- إضافة قطرة من وسائل الاعلام تركيب مباشرة على العينة القوقعة ووضع بلطف ساترة على القمة، مع الحرص على تجنب فقاعات الهواء. وهناك حاجة إلى الفواصل. وضع ساترة مباشرة على العينة. ويوصى، غير الاستشعاع للذوبان في الماء، المتوسطة المتزايدة شبه الدائمة التي لا تتطلب خطوات إضافية لعقد ساترة في المكان. تركيب وسائل الإعلام وسمك ساترة ينبغي أن تكون مطابقة لمواصفات المجهر.
- استخدام المجهر epifluorescent أو الليزر مسح متحد البؤر مجهزة التكبير عالية (63 - 100X)، وارتفاع الفتحة العددية (1،2-1،4) أهداف لالتقاط الصور من سطح قمية للخلية الشعر القوقعة. استخدام الصغرىأهداف ور (5 - 20X) لاتخاذ تداخل الصور من القوقعة الحلزونية لتحديد طول القناة القوقعة. الليزر الإثارة مباراة والمرشحات الانبعاثات إلى fluorophores استخدام الأجسام المضادة الثانوية.
8. المجهر الإلكتروني
- تواصل من القسم 4.3. بعد غسل عينات SEM الثابتة في HEPES العازلة، نفذ الخطوات التالية تحت التهوية. بروتوكول التالية يعمل بشكل جيد للأنسجة القوقعة والابتعاد عن استخدام طلاء بالرش مع معدن موصل.
- ما بعد الإصلاح في 1٪ أوسو 4 في HEPES العازلة لمدة 1 ساعة، تليها 3 غسلات مع 1 مل من الماء المقطر لمدة 5 دقائق لكل منهما. وينبغي استخدام أصغر حجم أوسو 4 التي تحيط تماما الأنسجة للتقليل من النفايات السامة. لا يلزم الانفعالات.
- احتضان عينات في RT في كل من الحلول التالية لمدة 1 ساعة مع 3 يغسل مع 1 مل من الماء المقطر لمدة 5 دقائق في كل من بين الخطوات التالية: حمض التانيك 1٪ طازجة في الماء وفيلمحله قبل استخدامها. 1٪ أوسو 4 في الماء، حمض التانيك 1٪ في الماء، 1٪ أوسو 4 في الماء.
- يذوى العينات من خلال سلسلة الإيثانول متدرج من الحضانة لمدة 10 دقيقة في كل من التخفيفات التالية: 30، 50، 70، 90، و 95٪. لا يلزم الانفعالات.
- بنقل العينات من خلال ثلاثة تغييرات، 5 دقائق لكل منهما، من الإيثانول بنسبة 100٪ (من زجاجة افتتح حديثا من 200 الإيثانول برهان).
- تشغيل عينات على الرغم من أكثر جفافا نقطة حرجة بعد تعليمات الشركة الصانعة.
- تركيب العينات باستخدام لاصق الكربون موصل على قمة كعب SEM قبل التصوير على المجهر الالكتروني. تحت مجهر تشريحي، استخدام زوج من ملقط غرامة والفرشاة لوضع بلطف العينة مع ظهائر قوقعة مواجهة. استخدام الجزء الدهليزي من العينة إلى 'مرساة' الأنسجة للقاعدة. تخزين العينات في مجفف حتى التصوير. أداء SEM التصوير كما هو موضح في جونز (2012) 21.
9.تحديد الكمية
- بعد إعداد المناعية، والحصول على الصور باستخدام epifluorescent أو الليزر مسح متحد البؤر المجهر. بعد إعداد لوزارة شؤون المرأة، واستخدام المجهر الإلكتروني لصورة العينات. صورة السطح القمي من جهاز كورتي مع خلايا الشعر قوقعة المكشوفة وخلايا الدعم مقحم.
- تحديد مواقع معينة على طول القناة القوقعة، مثل 25، 50، و 75٪ من القاعدة واستخدام هذه لمقارنة المناطق القوقعة بين عينات متحولة والسيطرة. تحليل ومقارنة المسوخ أهداب مع الضوابط littermate، وعن الاختلافات في الخلفية الوراثية يمكن تعديل النمط الظاهري القوقعة.
ملاحظة: جهاز كورتي يتطور في التدرج الذي يمتد من منتصف القاعدة تجاه كل قمة وقاعدة. في الماوس، والتنمية ليست كاملة حتى P14، ولذلك فمن المهم للمقارنة بين المناطق في مراحل ومواقف التنموية مماثلة. - التقاط الصور باستخدام برنامج المرافقة المجهر أن ألوث لتقدير حجم النمط الظاهري معين كما هو مطلوب (أنظر أدناه). استخدام صورة برامج التحليل مثل J صورة أو البرامج المصاحبة المجهر لقياس الأطوال، عد الخلايا وتحديد توطين البروتين كما هو موضح أدناه. الرسم البياني هذه البيانات كما هو مخطط بار، مؤامرة مبعثر، مربع لطخة أو الرسم البياني، مقارنة السيطرة مقابل متحولة.
- يبلغ طول القناة القوقعة (الشكل 3A):
- باستخدام علامة الخلية الشعر أو phalloidin، (الذي يصادف حزم stereociliary)، وتحديد وقياس حيث تبدأ الظهارة الحسية والغايات. في كثير من الأحيان تقصير طول القناة القوقعة في المسوخ أهداب.
- تشوهات حزمة Stereociliary (الشكل 3B، D، E، G):
- قياس تحدب الرزمة (الارتفاع)، وأقصر مسافة بين قمة الرأس من حزمة والخط الذي يمتد من خلال طرفي باقة "الأسلحة" كما هو مبين في الشكل الجيل الثالث 3G، غادر. بدلا من ذلك، تحديد المنطقةتشملها أحضان الخارجية خلية الشعر حزمة stereociliary كما هو مبين في الشكل الجيل الثالث 3G، والحق. إذا خلايا الشعر مع ويمكن تحديد حزم stereociliary دائرية تحسب هذه كنسبة مئوية من مجموع خلايا الشعر.
ملاحظة: في العديد من المسوخ الهدبية يمكن ملاحظة تشوهات الباقة بغض النظر عن التوجه ربطة. ومن الصعب تحديد بدقة تشوهات حزمة stereociliary.
- قياس تحدب الرزمة (الارتفاع)، وأقصر مسافة بين قمة الرأس من حزمة والخط الذي يمتد من خلال طرفي باقة "الأسلحة" كما هو مبين في الشكل الجيل الثالث 3G، غادر. بدلا من ذلك، تحديد المنطقةتشملها أحضان الخارجية خلية الشعر حزمة stereociliary كما هو مبين في الشكل الجيل الثالث 3G، والحق. إذا خلايا الشعر مع ويمكن تحديد حزم stereociliary دائرية تحسب هذه كنسبة مئوية من مجموع خلايا الشعر.
- توجيه حزم stereociliary (الشكل 3B، C، G):
- تقييم توجه كل حزمة الفردية نسبة إلى الخط يمتد عموديا على صف من خلايا عمود الذي يفصل بين خلايا الشعر الداخلية والخارجية. يتم محاذاة الخلايا مع التوجه الطبيعي على طول هذا المحور العمودي وهكذا يكون دوران 0 درجة. تحديد زوايا الدوران باستخدام إما تدوين 360 درجة أو الانحرافات المطلقة من 0 درجة.
- الأهداب المحركة لتحديد المواقع أو stereociliary المواقع حزمة (الشكل3B، F، H):
- حساب النسبة المئوية للخلايا التي الأهداب المحركة مفقودة. قياس المسافة من الهدب المحرك إلى "قمة" أو مركز للحزمة. في 'قمة' من حزمة قد لا يكون من السهل تحديد إذا حزم غير طبيعية، وذلك وسط حزمة يمكن أن تستخدم بدلا من ذلك.
- تحديد موقف الأهداب المحركة وحزم stereociliary على سطح الخلية الشعر القمي، عن طريق تغطية شبكة الموضعية على كل خلية الشعر وبمناسبة موقع أي قاعدة الهدب المحرك أو قمة الرأس / وسط حزمة stereociliary. عرض البيانات كنسبة مئوية من كل فئة التي تقع ضمن منطقة محددة من الشبكة، وتتراكب مواقع كل علامات على شبكة الموضعية واحدة.
ملاحظة: في الأنسجة السيطرة، الأهداب المحركة دائما تعلق على الرأس من حزمة stereociliary. في المسوخ أهداب، الأهداب المحركة في كثير من الأحيان في عداد المفقودين، mislocalized حتى الآن لا تزال تعلق، أو حتى منفصلة تماما عن الصورةحزمة tereociliary. - طول الأهداب المحركة (الشكل 3I):
- قياس طول الهدب المحرك عن طريق وضع العلامات مع علامة الهدبية الخيط المحوري. قياس فقط الأهداب المحركة التي تكمن شقة ضمن 1.5 ميكرون الطائرة مبائر. تأكد من أن أهداب يكذبون شقة من خلال مراقبة وجهة نظر مستعرضة من الأنسجة الممسوحة ضوئيا. مقارنة عينات مطابقة تتراوح أعمارهن بين نفس المنطقة من القوقعة منذ الهدب المحرك تتراجع خلال التنمية.
- Mislocalization من البروتينات القطبية:
- بعد المناعية باستخدام أجسام مضادة ضد بروتينات القطبية مثل Vangl2 وGαi3، وتحديد التعريب عن طريق التصوير.
ملاحظة: في بعض المسوخ أهداب، وتعطلت توطين البروتينات القطبية. وتشمل هذه Vangl2 وGαi3، والتي ثبت أن تعطلت في Ift20، Bbs8 وBbs6 القوقعة متحولة.
ملاحظة: أمثلة أخرى لكيفية تحديد وpolarit خلية شاشة الشعرذ يمكن العثور عليها في الأوراق التالية. كورتين، وآخرون. (2003) علم الأحياء الحالي 22، Montcouquiol، وآخرون. (2003) الطبيعة 7، وانغ، وآخرون (2006) مجلة العلوم العصبية 23، Montcouquiol، وآخرون. (2008) طرق في البيولوجيا الجزيئية 24، مايو Simera، وآخرون. (2012) طرق في علم الأحياء الجزيئي 25، يين وآخرون (2012) بلوس واحد 26.
النتائج
القوقعة تشريح والأنسجة التحضير
بعد إزالة الدماغ، ما بعد خط منتصف تشريح سهمي من رئيس P0 الماوس، والتيه العظمي، وينظر من وراء، يمكن تصور (الشكل 1A، السهم الأبيض) وإزالتها. ويبين الشكل 1B متاهات عظمي معزولة مع الشعر القوقعة تواجه صعودا، بطني، (يسار) ومن وراء، ظهري (يمين). يشير السهم البيضاء إلى النافذة البيضوية من أي واحد يمكن أن تبدأ إزالة الغضروف الخارجي. مرة واحدة تمت إزالة الغضروف الخارجي تماما، القناة قوقعة الأذن المكشوفة، سليمة من ذلك، يمكن ملاحظة (الشكل 1C). ويرد تحديد المواقع دبوس من خلال المنطقة الدهليزي لمساعدة تشريح. ويمكن أيضا أن اثنين من المسامير، وضعت في زوايا مختلفة يمكن استخدامها لترسيخ الأنسجة. ويبين الشكل 1D القناة القوقعة بعد إزالة رايسنر "؛ ق غشاء والغشاء السقفي (يسار) ومعزولة دوامة الظهارية قوقعة مرة واحدة وقد تم عزلها عن المنطقة الدهليزي استعدادا لتركيب لالمناعية (يمين). لإعطاء فكرة عامة عن ما يبدو الشعر قوقعة تتعرض مثل، يظهر استعدادا SEM سليمة في الشكل 1E.
مورفولوجيا والمناعي في القوقعة تحكم
بعد إعداد الأنسجة قوقعة، يتعرض السطح الظهري للقناة القوقعة تحتوي على جهاز كورتي ويمكن تم الاطلاع عبر SEM أو تلطيخ مناعي. ينظر إليها على أنها إعداد كامل جبل، وأربعة صفوف من خلايا الشعر ميكانيكية حسية (صف واحد من خلايا الشعر الداخلية وثلاثة صفوف من خلايا الشعر الخارجي) يمكن تمييزها. ويبين الشكل 2A وجهة نظر التكبير المنخفض للبدوره القاعدية من القوقعة الماوس الجنينية أعدت وأو SEM. لاحظ توجه موحد والمواءمة بين حزم stereociliary القائم الأكتين. وبالإضافة إلى ذلك التشكل من حزم stereociliary هو ثابت، كل حزمة لديها شكل الكلاسيكية ")" (على خلايا الشعر الداخلية) أو "W" (على خلايا الشعر الخارجي). على التكبير فاحصة على هذا العصر زغيبات إضافية يمكن أن ينظر إليه ليس فقط على السطح القمي للخلايا الشعر، ولكن أيضا في الفترات الفاصلة بين خلايا الشعر على الخلايا الداعمة (الشكل 2B). وهذه تنحسر ترك ثلاثة فقط صفوف من حزم stereociliary على خلايا الشعر الخارجي واثنين على خلايا الشعر الداخلية في البالغين. كما يمكن أن يرى في الشكل 2C (السهم الأبيض)، ويقع الهدب المحرك القائم على أنيبيب واحد (أ هدب الأساسي صحيح) المتاخمة لأطول صف من أهداب ساكنة في قمة الرأس من كل حزمة stereociliary. وترد هذه لحزمة عبر وصلات الأهداب المحركة.
وضع العلامات الفلورية مع phalloidin، الذي مختبرإلس الأكتين، يسلط الضوء على توجه موحد وشكل حزم في الأنسجة التحكم (الشكل 2D). يسمى الأكتين القشرية أيضا، وهو أمر مفيد لتحديد محيط قمية كل خلية الشعر الفردية. شارك في وضع العلامات مع phalloidin والأجسام المضادة ضد الميوسين 7A (الشكل 2E)، وهو علامة الخلية الشعر، كما يساعد على التفريق بين خلايا الشعر وخلايا الدعم. الميوسين 7A هو أيضا علامة مفيدة لقياس تمديد أنابيب القوقعة (انظر الشكل 3A). يتم استخدام الأجسام المضادة ضد الأسيتيل-α تويولين عادة لتحديد الهدب المحرك القائم على أنيبيب (الشكل 2F). كما أيضا تؤوي خلايا الدعم أهداب الابتدائي، فمن المهم أن نميز بين أهداب المنبثقة عن خلايا الشعر مقابل الإقحام خلايا الدعم. علامة غشاء إضافية مثل الأجسام المضادة ضد ZO-1 (زونا النطيقة 1)، والذي يحدد بوضوح الزخرفة الفسيفساء من الغشاء القمي من القناة القوقعة، لذلك من المفيد (<قوي> الشكل 2F). المزيد من الدراسة هو أن الأجسام المضادة ضد الأسيتيل-α تويولين أيضا تسمية الأنابيب الدقيقة الداخلية ولذا يجب اتخاذها عند التصوير للتركيز على السطح القمي خلية العناية بالشعر. ميكروتثبول في الخلايا عمود هي كثيفة بشكل خاص (الشكل 2G، النجمة البيضاء). وكثيرا ما يستخدم مزيج من phalloidin ووضع العلامات مكافحة الأسيتيل-α-تويولين لتحديد وقت واحد حزم stereociliary والأهداب المحركة المجاورة (الشكل 2G، السهم الأبيض).
النمط الظاهري القوقعة في سيليا المسوخ
استطالة من القناة القوقعة هي واحدة من أفضل الرافضة قراءة من العيوب التقارب والإرشاد، ولوحظ القنوات قوقعة الشائع اختصارها في المسوخ PCP الكلاسيكية. القوقعة في المسوخ الهدبية غالبا ما يكون تقصير قنوات القوقعة وتظهر توسعا ملحوظا من epithe الحسيةليا في ذروة، كما كان ينظر يمكن في Ift20 CKO / CKO الفئران (الشكل 3A). عيب PCP الكلاسيكية آخر هو اضطراب في التوجه موحد للخلايا الشعر القوقعة، كما يمكن أن يرى في Bbs8 - / - الفئران على حد سواء مع المناعية (الشكل 3B، السهم الأيمن) ومع SEM (الشكل 3C). بالإضافة إلى حزم الموجهة سوء، بالارض وحزم ممسوخ كما لوحظ عموما (الشكل 3B، السهم المتوسط؛ الشكل 3D). في كثير من الأحيان دائرية حزم، كما كان ينظر يمكن في الشكل 3E، موجودة، خصوصا في خلايا الشعر خالية تماما من الأهداب المحركة. سوء توطين الهدب المحرك هي أيضا شائعة.
يجوز للالهدب المحرك مترجمة سوء أو قد لا تكون محجوزة لحزمة stereociliary (الشكل 3B، السهم الأيسر. الشكل 3F). أمثلة على كيفية تحديد بووتظهر التوجيه والأهداب المحركة ndle أو المواقع الرزمة في الشكل الجيل الثالث 3G و3H. توجه كل حزمة الفردية ويمكن بعد ذلك يتم تقييم عن طريق تحديد دوران من قريب الرزمة إلى خط يمتد عموديا على صف من خلايا عمود الذي يفصل بين خلايا الشعر الداخلية والخارجية. يتم محاذاة الخلايا مع التوجه الطبيعي على طول هذا المحور العمودي وهكذا يكون دوران 0 درجة (الشكل 3G). موقف الهدب المحرك، أو وسط حزمة stereociliary، يمكن رسم طريق تغطية شبكة الموضعية على سطح lumenal من خلايا الشعر ومن ثم تحديد موقع الأهداب المحركة أو حزمة ضمن الشبكة (الشكل 3I). غالبا ما تؤثر الطفرات في الجينات أهداب طول الأهداب، وهكذا طول الهدب المحرك يمكن تقييم. في Cep290 المسوخ rd16 / rd16، الأهداب المحركة هي أطول من الضوابط (الشكل 3J). وبما أن تتراجع هدب،فمن الأهمية بمكان أن يكون سن يقابل الاصحاب القمامة ولأخذ القياسات من نفس المنطقة من القوقعة. للحصول على صور جيدة للتحليل وتقدير لكل من المناعية ووزارة شؤون المرأة، فمن الأهمية بمكان أن إزالة الغشاء السقفي. الشكل 3F يظهر صورة مجهرية ووزارة شؤون المرأة التي لم يتم إزالة الغشاء السقفي تماما.
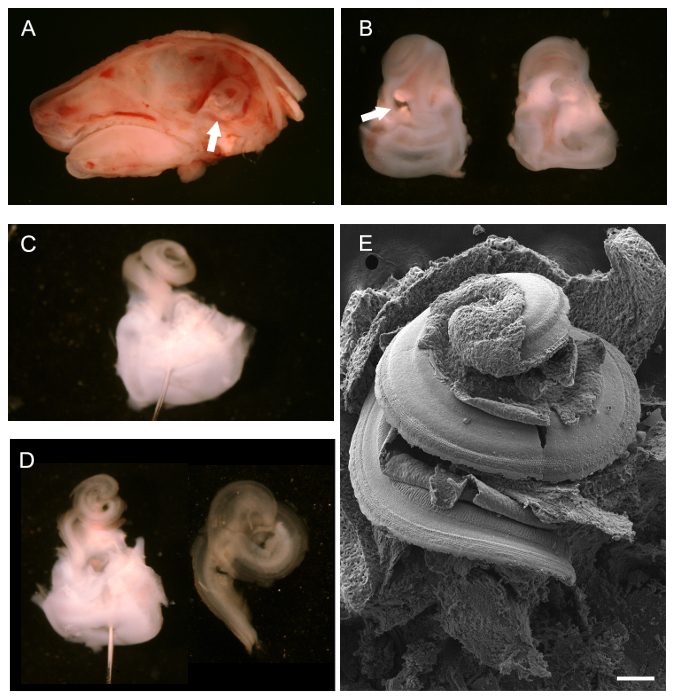
الشكل 1. تشريح ماوس القوقعة النامية (P0). (A) منتصف خط تشريح سهمي من رئيس P0 الفأر مع الدماغ إزالتها. يشير السهم البيضاء إلى الموقف من المتاهة عظمي. (ب) بطني (يسار) والظهرية (يمين) آراء المتاهات عظمي تشريح. يقع القوقعة نحو الأعلى مع الجزء الدهليزي عند نقاط السهم الأبيض أسفل إلى إطار بيضاوي. (ج) متاهة الخلف العظميةإزالة إيه من الغضروف الخارجي من القوقعة. تم وضع دبوس من خلال نظام الدهليزي. (D) يسار، نفس وجهة النظر كما في C بعد إزالة غشاء رايسنر والغشاء السقفي. الصحيح، قناة قوقعة معزولة جاهزة للتركيب. (E) المسح صورة مجهرية الإلكترون ل، القوقعة الحلزونية سليمة يتعرض فضح الكلمة من القناة القوقعة، بما في ذلك ظهارة حسية. شريط المقياس هو 100 ميكرون. . (A - D) مقتبس من مايو Simera وآخرون، 2012 25 الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2. مورفولوجيا والمناعي في القوقعة التحكم (A - C). الميكروسكوب الضوئي الإلكترون من الطور القاعديةن في الجنينية (E18.5) البرية نوع القوقعة. يتم فصل صف واحد من الخلايا الداخلية الشعر (القاع) وثلاثة صفوف من خلايا الشعر الخارجي (أعلى) ومقحم من قبل خلايا الدعم. حزم stereociliary شكل شيفرون ستوجه بشكل موحد نحو الحافة الجانبية من كل خلية الشعر (الحافة العلوية من الصورة). في E18.5 تغطي زغيبات إضافية السطوح قمية من خلايا الشعر، دون حزم stereociliary، وخلايا الدعم مقحم (B). (ج) والهدب المحرك القائم على أنيبيب واحد (السهم الأبيض)، ويقع في قمة الرأس من حزمة، كما هو موضح هنا من الحافة الجانبية. (D - G) مناعي تلطيخ القاعدية آخر بدوره الولادة يوم 1 (P1) النوع البري للقوقعة. Phalloidin تسميات الأكتين الخيطية في أهداب ساكنة والأكتين القشرية في محيط الخلية (D، E، G). الميوسين 7A هو علامة للحصول على خلايا الشعر الداخلية والخارجية (E). Zo_1 التسميات منعطفات ضيقة في الفترات الفاصلة بين الخلايا، مما يجعلها علامة كبيرة على التمييز بوندا خليةريس (F). يستخدم الأسيتيل α تويولين كعلامة للالهدب المحرك في قمة الرأس من حزمة (F، G السهم الأبيض). وصفت الأنابيب الدقيقة الداخلية أيضا الأسيتيل α تويولين، والتي هي على وجه الخصوص وفرة في خلايا عمود (G أستريكس الأبيض). يمنع على نطاق وج: 10 ميكرون، B: 5 ميكرون، C: 1 ميكرون، DG: 5 ميكرون الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
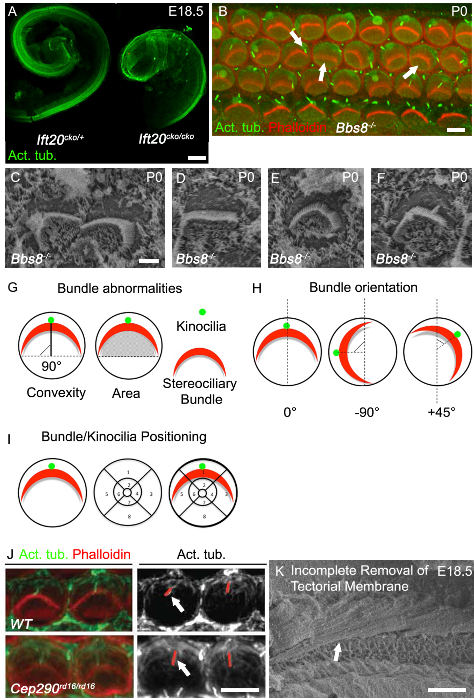
الشكل 3. القوقعة النمط الظاهري في سيليا المسوخ. (A) تقصير ملحوظ من Ift20 CKO / CKO القنوات قوقعة مقارنة مع الشاهد. تشريح القنوات قوقعة في E18.5 ملطخة تويولين الأسيتيل. (ب ) كامل الصور جبل بدوره قوقعة القاعدية في Bbs8 - / - متحولة (P0). وصفت Phalloidin الأكتين الخيطية، أهداب ساكنة (الحمراء)، تويولين الأسيتيل، الأهداب المحركة (الخضراء). حزم Stereociliary في Bbs8 - / - القوقعة يتم تناوب بنسب مختلفة (السهم الأيمن)، بالارض و / أو mislocalized (السهم الأوسط). وmislocalized الأهداب المحركة أو axonemes مفقودة (السهم الأيسر). (C - F) التكبير العالي ووزارة شؤون المرأة حزم stereociliary والأهداب المحركة في Bbs8 - / - OHCs. في C، استدارة حزم، في D، بالارض حزمة، في E، حزم الدائرية وفي F mislocalized الأهداب المحركة. (G - I) تمثيل تخطيطي الكمي شذوذ ربطة. (G) اليسار، حزمة التحدب (الارتفاع). أقصر مسافة بين قمة الرأس من حزمة والخط الذي يمتد من خلال طرفي "الأسلحة" حزمة. كما دepicted بخط أسود خالص. الحق، ومنطقة تحت حزمة. المنطقة. (H) تمثيل تخطيطي من المعايير المستخدمة لتحديد اتجاه حزم stereociliary. يتم حساب زاوية دوران حزمة النسبي إلى الخط يمتد عموديا على صف من خلايا عمود. (I) تمثيل تخطيطي للمعايير تحليل الموضعية من الأهداب المحركة وحزم stereociliary. وضعت وشبكة مجزأة على محيط الخلية الشعر، وأشار إلى الموقف. (J) صورة التكبير العالي للحزم المسمى phalloidin أهداب ساكنة (الحمراء)، والأسيتيل الأهداب المحركة المسمى تويولين (الخضراء) من خلايا الشعر الخارجي في القوقعة P0. في لوحة أحادية اللون المجاورة، خطوط حمراء تحدد الأهداب المحركة، وهي تعد في Cep29 المسوخ rd16 / rd16 مقارنة مع الشاهد (السهام البيضاء). (K) ووزارة شؤون المرأة مجهرية من القوقعة الجنينية مع إزالة كاملة من الغشاء السقفي. مقياسيحظر ج: 100 ميكرون، B: 5 ميكرون، C - F: 2.5 ميكرون، و: 5 ميكرون، J: 50 ميكرون. (A - F).. معدلة من مايو Simera وآخرون، 2015 8، J طبع بإذن من راشيل وآخرون، 2012 27 الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
عند إعداد الأنسجة قوقعة للتحليل، هناك عدد قليل من النقاط الرئيسية أن نأخذ في الاعتبار. أولا، يمكن أن الاختلافات في الخلفية الوراثية تعديل النمط الظاهري قوقعة الأذن، مما يجعل من الضروري تحليل ومقارنة الضوابط littermate فقط. ثانيا، يتعين إزالة كاملة من الغشاء السقفي للحصول على أفضل الصور مع المناعية وضروري لوزارة شؤون المرأة. الغشاء السقفي هو هيكل مبهمة ويمكن أن تحجب خلايا ظهارة حسية مباشرة تحتها، مما يجعل التصوير أكثر تحديا. أحيانا أثناء المعالجة، الغشاء السقفي قد ينكمش مرة أخرى، والكشف عن خلايا الشعر. حتى في هذه الحالات ينصح بقوة الإزالة. هذه الخطوة تتطلب الصبر والممارسة. ثالثا، المناعية باستخدام أجسام مضادة ضد بروتينات الهدبية، وخاصة تلك التي توطين للجسم القاعدية مضغوط للغاية، يمكن أن يكون تحديا وتتطلب التحسين. النظر في أداء استرجاع مستضد، تكثيف permeabilسعودة الخطوات، أو تقليل تركيز أو وقت التثبيت. وأخيرا، عندما التصوير الهدب المحرك (في هدب الأساسي وجدت في خلايا الشعر القوقعة) نضع في اعتبارنا أن يبدأ في التراجع عن P0 - P1 فصاعدا في التدرج قاعدة إلى قمة. ولذلك، عند قياس طول الهدب المحرك المهم للمقارنة بين خلايا الشعر من نفس المنطقة من القوقعة وفي سن يقابل الحيوانات. لديها خلايا دعم مقحم أيضا أهداب الابتدائي، الذي لا يتراجع. يجب الحرص على التمييز بين دعم أهداب الخلايا والأهداب المحركة خلية الشعر.
مع نضوج الفئران، يصبح من الصعب على نحو متزايد لعزل نظيف وظهائر الحسية قوقعة، وذلك بسبب تكلس في عظام الزمنية والمتاهات العظمية. مطلوب زوال الكلس للأنسجة، وهي ليست دائما متوافقة مع مزيد من التقنيات immunolocalization ولكن لا تسمح لفحص النمط الظاهري الإجمالي وهو أيضا متوافقة مع إعداد ووزارة شؤون المرأة. الفطرية شارع الماوساهلية ت غالبا ما تظهر العيوب السمعية مثل فقدان الخلية الشعر أو مرتفعة استجابات الدماغ السمعية (ABRs)، وذلك بسبب طفرات في الجينات السمعية المعروفة أو الجينات التعديل. لذلك لا بد من مقارنة سن يقابل الضوابط littermate أو تولد على خلفية وراثية بديلة.
واحد من أوجه القصور في هذا التحليل هو أنه، في الفئران، والهدب المحرك يبدأ في التراجع بعد الولادة ولم يعد موجودا على خلايا الشعر الكبار. لهذا السبب القياسات الأهداب المحركة يمكن أن يتم إلا في تطوير الأنسجة. كما أنه من الضروري اختيار بعناية العمر كعينة ضابطة للمقارنة بين عينات متحولة والسيطرة. الحد الآخر هو أن الهدبية متحولة الفئران تحليلها حتى الآن لم يتم عرض ضعف السمع الشديد (أي، استجابات الدماغ السمعية، ABRs أو انبعاثات أذنية سمعية، OAEs) حتى عندما تنخفض قيمة تنمية القوقعة. واتساقا مع ذلك، عيوب السمع ليست النمط الظاهري المشترك ciliopathy البشري. بشكل استثنائي، وفقدان hearinز هي واحدة من السمات الرئيسية لمتلازمة Alström، التي تسببها طفرات في بروتين الجسم القاعدية ALMS1 28،29. هذا يشير إلى أن stereociliary التشكل حزمة ليست مرتبطة بالضرورة إلى خلل وظيفي السمعي في المسوخ أهداب، من المحتمل بسبب إعادة توجيه التصحيحية حزم في وقت لاحق في التنمية كما تم الإبلاغ عن المسوخ Vangl2 CKO 30. إذا تم توسيع الطيف ciliopathy لتشمل حاجب متلازمة، والسبب الخلقية الأكثر شيوعا من الصم والعمى، ثم يصبح ضعف السمع ذات أهمية كبيرة. وقد أظهرت البيانات الأخيرة أن العديد من البروتينات ذات الصلة للدخول متلازمة توطين أيضا إلى هدب وتشارك في العمليات المتعلقة الهدبية 31، ولكن إذا كانت هذه البروتينات ترتبط الإشارات PCP لم يتم فحصها.
حتى الآن معظم المسوخ الهدبية الماوس تحليلها لعيوب PCP قوقعة يكون فقط تم فحصها بشكل غامض. التقنيات الموضحة في هذه المخطوطة تسمح لتفاصيل واسعة النطاق للالنمط الظاهري قوقعة الأذن، الأمر الذي سيؤدي بلا شك إلى فهم أكثر دقة للمشاركة الهدبية في إنشاء الفقارية إشارات حزب المؤتمر الشعبي. وعلى الرغم من وجود عدد كبير من نماذج ciliopathy الماوس المتاحة، وقد تم تحليل عدد قليل من المستغرب من حيث العيوب PCP القوقعة. وشرك شائعة مرتبطة مع هذه النماذج هو الفتك الجنينية. ومع ذلك، منذ القوقعة وضع يمكن فحص embryonically دور أهداب في حزب المؤتمر الشعبي في الأذن وضع يمكن لا يزال التحقيق فيها. وعلاوة على ذلك، يمكن التحايل عليها في وقت مبكر جدا الفتك الجنينية باستخدام بالضربة القاضية المشروطة. Foxg1 لجنة المساواة العرقية 32 الفئران، المتاحة من JacksonLaboratories، وتستخدم عادة لinactivategenes الاهتمام thedeveloping الأذن الداخلية من تاريخ E8.To، تركزت الجهود في المقام الأول على دراسة الجينات ciliopathy المسببة للأمراض ولكن التنقيب عن البروتينات الأخرى ذات الصلة أهداب وكيف يمكن لهذه تؤثر PCP الإشارات أثناء التطور قد توفر مزيد من التبصر في CILالجيش العراقي البيولوجيا وظيفة.
في حال الاشتباه في النمط الظاهري السمعي في نماذج الفئران التي يجري تحليلها، وتشمل التحليلات الأخرى الممكنة اختبار قياس قوة السمع من ABRs 33 أو OAEs 34. فحوصات تمديد يزدرع القوقعة (كما هو موضح في مايو Simera وآخرون، 2012 25)، ويمكن أيضا أن يؤديها، والسماح لتحديد العيوب تمديد متقاربة في نقطة زمنية التنموية السابقة. زراعة القوقعة من إإكسبلنتس يسمح أيضا للعلاج مع مجموعة مختلفة من المنشطات أو مثبطات الإشارة، والتي يمكن تعديل تمديد يزدرع، مما يسهم في فهم الآلية من العمليات التنموية المعنية. على الرغم من أنه من المعروف أن الهدب المحرك تتراجع بعد الولادة 11،13،14، لم يتم معالجة هذا التراجع تماما في سياق المسوخ الهدبية. وسيكون من مصلحة لأخذ القياسات في الوقت المحدد لظهور الأهداب المحركة وتراجع في أهداب mutants.Considering أن الدور الأساسي للالهدبية المواليةالبروتينات هي حركة نقل البضائع على طول الأنابيب الدقيقة، فمن المحتمل جدا أن هذه البروتينات يمكن أيضا تنظيم جوانب الاتجار داخل الخلايا على طول الهيكل الخلوي 35-37. وقد تبين أن مجموعة فرعية من البروتينات أهداب أن تؤثر على الاتجار وتوطين غير المتماثلة من جزيئات PCP 8. الترجمة من قبل المناعية للجزيئات PCP والبروتينات وخاصة المصاحبة للغشاء مثل Vangl2، Frz3 وDSH، ولذلك أوصت لتحديد ما إذا تم mislocalized جزيئات حزب المؤتمر الشعبي. يبدو إنشاء الأقطاب لتكون شأنا متعددة الأوجه، وهناك أدلة متزايدة لخلية مسار مستقل إضافي، وهو مطلوب أيضا لحزب المؤتمر الشعبي الصحيح في خلايا الشعر الحسية 38. وأظهرت دراسة حديثة أن مجموعة تعتمد على البروتين إشارات تسيطر على الهجرة من هدب بطريقة خلية مستقلة 39. وانسجاما مع دور للبروتينات الهدبية في توطين الجزيئات القطبية، heterotrimeric G-بروتين ألفا-ط فرعية 3 (Gαi3) لوتعطلت ocalization في Bbs8 وBbs6 خروج المغلوب القوقعة 8،39.
والتمييز بين دور مكونات الهدبية الفردية والآثار واضحة على إشارات PCP تعطينا مزيد من التبصر في دور هدب في إنشاء القطبية الصحيحة. أهمية خاصة هو أن نميز بين البروتينات الهدبية تعمل في سياق الهدبية، مقابل وظائف غير الهدبية من البروتينات الهدبية التي تعتبر تقليديا، مثل دورها في تنظيم غير الهدبية المتعلقة الاتجار داخل الخلايا. درجة عالية من الانتظام في كثير من جوانب بنية القوقعة، بما في ذلك الزخرفة الخلوية والتوجه الرزمة stereociliary، يجعل من الممكن للكشف عن التغييرات الطفيفة في تطوير PCP في الاستجابة إلى أي اضطرابات وراثية أو الجزيئية في البروتينات المرتبطة أهداب. وبالنظر إلى أن هناك العديد من النماذج الهدبية الماوس المتاحة، والتي القوقعة الماوس النامي هي واحدة من أفضل الأماكن لدراسة PCPإشارة، فإن من مصلحة كبيرة للتعلم لماذا تعطيل مدى الطفرات البروتين الفردية تنمية القوقعة.
Disclosures
The author declares no competing financial interests.
Acknowledgements
يود الكاتب أن أشكر ماثيو كيلي، تيزيانا Cogliati، جيسيكا Gumerson، أوفي ولفروم، ريفكا Levron، فيولا كريتشمير وزوي مان ولتقييم ينتقدون فيها المخطوطة. وقد تم تمويل هذا العمل من قبل جائزة Sofja كوفاليفسكايا (مؤسسة Humbodlt) وجامعة يوهانس غوتنبرغ،، ماينز، ألمانيا.
Materials
| Name | Company | Catalog Number | Comments |
| Tools/Equipment | |||
| Silicone elastomere - Sylgard 184 | Sigma-Aldrich | 761028-5EA | See Note 2 |
| Micro dissecting scissors-straight blade | Various | ||
| Fine forceps (no. 5 and 55) and blunt forceps | Various | ||
| Dissecting microscope. | Various | ||
| Uncoated glass microscope slides | Various | ||
| Microscope cover slips (22 mm × 40 mm × 0.15 mm) | Various | ||
| Transfer pipettes | Various | ||
| Minutien pins | Fine Science Tools | 26002-10 | |
| SEM sample holder | tousimis | 8762 | |
| Scanning electron microscopy studs | TED PELLA | 16111 | |
| PELCO Tabs: Carbon adhesive | TED PELLA | 16084-3 | |
| Fluorescent Microscope | Various | ||
| Critical Point Dryer | Various | ||
| Scanning Electron Microscope | Various | ||
| Glass microscope slides | Various | ||
| Glass coverslips | Various | ||
| Kimwipe Tissue | Various | ||
| Fine Paint Brush | |||
| Reagents | |||
| 1× Phosphate buffered saline (PBS) | Gibco/Life Technologies | 10010023 | |
| Paraformaldehyde (PFA) (EM Grade Required for EM) | Various | Prepare a 4% solution in 1× PBS made fresh each time. EM Grade Required for EM. | |
| 2.5% Glutaraldehyde Grade1 | Sigma-Aldrich | G5882 | |
| Tris-HCl (pH 7.5) | Various | ||
| NaCl | Various | ||
| CaCl 2 | Various | ||
| Triton X-100 | Various | ||
| Normal Goat Serum | Various | ||
| AffiniPure Fab Fragment Donkey Anti-Mouse IgG (H+L) | Jackson ImmunoResearch | 715-007-003 | |
| Fluoromount-G Mounting media | SouthernBiotech | 0100-01 | |
| 10× Hanks’ Balanced Salt Solution (HBSS) | Gibco/Life Technologies | 14065 | |
| Hepes | Gibco/Life Technologies | 15630-080 | |
| Osmium tetroxide (OsO4 ) | Sigma-Aldrich/Fluka Analytical | 75632 | |
| Tannic acid | Sigma-Aldrich | 403040 | |
| Ethanol 200 proof | Various | ||
| Antibodies | |||
| anti Arl13b | Protein Tech | 17711-1-AP | Suggested concentration 1:1,000 |
| anti acetylated tubulin (611-B1) | Sigma-Aldrich | T6793 | Suggested concentration 1:800 |
| anti gamma tubulin (GTU-88) | Sigma-Aldrich | T6557 | Suggested concentration 1:200 |
| anti Zo_1 | Invitrogen | 40-2300 | Suggested concentration 1:500 |
| Myosin VI | Proteus Biosciences | 25-6791 | Suggested concentration 1:1000 |
| Myosin VIIa | Proteus Biosciences | 25-6790 | Suggested concentration 1:1,000 |
| anti Vangl2 | Merk Millipore | ABN373 | Suggested concentration 1:250 |
| anti Gαi3 | Sigma-Aldrich | G4040 | Suggested concentration 1:250 |
| Alexa Fluor® 488 Phalloidin | Invitrogen/Life Technologies | A12379 | Suggested concentration 1:300 - 1,000 |
| Alexa Fluor® 568 Phalloidin | Invitrogen/Life Technologies | A12380 | Suggested concentration 1:300 - 1,000 |
References
- Waters, A. M., Beales, P. L. Ciliopathies: an expanding disease spectrum. Pediatr Nephrol. 26, 1039-1056 (2011).
- May-Simera, H. L., Kelley, M. W. Cilia, Wnt signaling, and the cytoskeleton. Cilia. 1, 7 (2012).
- Ross, A. J., et al. Disruption of Bardet-Biedl syndrome ciliary proteins perturbs planar cell polarity in vertebrates. Nat Genet. 37, 1135-1140 (2005).
- Ezan, J., Montcouquiol, M. Revisiting planar cell polarity in the inner ear. Seminars in cell & developmental biology. 24, 499-506 (2013).
- Semenov, M. V., Habas, R., Macdonald, B. T., He, X. SnapShot: Noncanonical Wnt Signaling Pathways. Cell. 131, 1378 (2007).
- Wang, J., et al. Regulation of polarized extension and planar cell polarity in the cochlea by the vertebrate PCP pathway. Nat Genet. 37, 980-985 (2005).
- Montcouquiol, M., et al. Identification of Vangl2 and Scrb1 as planar polarity genes in mammals. Nature. 423, 173-177 (2003).
- May-Simera, H. L., et al. Ciliary proteins Bbs8 and Ift20 promote planar cell polarity in the cochlea. Development. 142, 555-566 (2015).
- Jones, C., et al. Ciliary proteins link basal body polarization to planar cell polarity regulation. Nat Genet. 40, 69-77 (2008).
- Lim, D. J. Functional structure of the organ of Corti: a review. Hearing research. 22, 117-146 (1986).
- Nayak, G. D., Ratnayaka, H. S., Goodyear, R. J., Richardson, G. P. Development of the hair bundle and mechanotransduction. The International journal of developmental biology. 51, 597-608 (2007).
- Denman-Johnson, K., Forge, A. Establishment of hair bundle polarity and orientation in the deveoping vestibular system of the mouse. J. Neurocytol. , 821-835 (1999).
- Sobkowicz, H. M., Slapnick, S. M., August, B. K. The kinocilium of auditory hair cells and evidence for its morphogenetic role during the regeneration of stereocilia and cuticular plates. Journal of neurocytology. 24, 633-653 (1995).
- Denman-Johnson, K., Forge, A. Establishment of hair bundle polarity and orientation in the developing vestibular system of the mouse. Journal of neurocytology. 28, 821-835 (1999).
- van Dam, T. J., et al. The SYSCILIA gold standard (SCGSv1) of known ciliary components and its applications within a systems biology consortium. Cilia. 2, 7 (2013).
- Blacque, O. E., Sanders, A. A. Compartments within a compartment: what C. elegans can tell us about ciliary subdomain composition, biogenesis, function, and disease. Organogenesis. 10, 126-137 (2014).
- Wallingford, J. B., Mitchell, B. Strange as it may seem: the many links between Wnt signaling, planar cell polarity, and cilia. Genes & development. 25, 201-213 (2011).
- Borovina, A., Ciruna, B. IFT88 plays a cilia- and PCP-independent role in controlling oriented cell divisions during vertebrate embryonic development. Cell reports. 5, 37-43 (2013).
- Huang, P., Schier, A. F. Dampened Hedgehog signaling but normal Wnt signaling in zebrafish without cilia. Development. 136, 3089-3098 (2009).
- Ocbina, P. J., Tuson, M., Anderson, K. V. Primary cilia are not required for normal canonical Wnt signaling in the mouse embryo. PloS one. 4, e6839 (2009).
- Jones, C. G. Scanning electron microscopy: preparation and imaging for SEM. Methods Mol Biol. 915, 1-20 (2012).
- Curtin, J. A., et al. Mutation of Celsr1 disrupts planar polarity of inner ear hair cells and causes severe neural tube defects in the mouse. Current biology : CB. 13, 1129-1133 (2003).
- Wang, Y., Guo, N., Nathans, J. The role of Frizzled3 and Frizzled6 in neural tube closure and in the planar polarity of inner-ear sensory hair cells. The Journal of neuroscience : the official journal of the Society for Neuroscience. 26, 2147-2156 (2006).
- Montcouquiol, M., Jones, J. M., Sans, N. Detection of planar polarity proteins in mammalian cochlea. Methods Mol Biol. 468, 207-219 (2008).
- May-Simera, H., Kelley, M. W. Examining planar cell polarity in the mammalian cochlea. Methods Mol Biol. 839, 157-171 (2012).
- Yin, H., Copley, C. O., Goodrich, L. V., Deans, M. R. Comparison of phenotypes between different vangl2 mutants demonstrates dominant effects of the Looptail mutation during hair cell development. PloS one. 7, e31988 (2012).
- Rachel, R. A., et al. Combining Cep290 and Mkks ciliopathy alleles in mice rescues sensory defects and restores ciliogenesis. J Clin Invest. 122, 1233-1245 (2012).
- Jagger, D., et al. Alstrom Syndrome protein ALMS1 localizes to basal bodies of cochlear hair cells and regulates cilium-dependent planar cell polarity. Human molecular genetics. 20, 466-481 (2011).
- Collin, G. B., et al. The Alstrom Syndrome Protein, ALMS1, Interacts with alpha-Actinin and Components of the Endosome Recycling Pathway. PloS one. 7, e37925 (2012).
- Copley, C. O., Duncan, J. S., Liu, C., Cheng, H., Deans, M. R. Postnatal refinement of auditory hair cell planar polarity deficits occurs in the absence of Vangl2. The Journal of neuroscience : the official journal of the Society for Neuroscience. 33, 14001-14016 (2013).
- Sorusch, N., Wunderlich, K., Bauss, K., Nagel-Wolfrum, K., Wolfrum, U. Usher syndrome protein network functions in the retina and their relation to other retinal ciliopathies. Advances in experimental medicine and biology. 801, 527-533 (2014).
- Hebert, J. M., McConnell, S. K. Targeting of cre to the Foxg1 (BF-1) locus mediates loxP recombination in the telencephalon and other developing head structures. Dev Biol. 222, 296-306 (2000).
- Willott, J. F. Chapter 8, Measurement of the auditory brainstem response (ABR) to study auditory sensitivity in mice. Current protocols in neuroscience. , Unit8 21B (2006).
- Martin, G. K., Stagner, B. B., Lonsbury-Martin, B. L., et al. Chapter 8, Assessment of cochlear function in mice: distortion-product otoacoustic emissions. Current protocols in neuroscience. , Unit8 21C (2006).
- Finetti, F., et al. Intraflagellar transport is required for polarized recycling of the TCR/CD3 complex to the immune synapse. Nature cell biology. 11, 1332-1339 (2009).
- Sedmak, T., Wolfrum, U. Intraflagellar transport molecules in ciliary and nonciliary cells of the retina. J Cell Biol. 189, 171-186 (2010).
- Yuan, S., Sun, Z. Expanding horizons: ciliary proteins reach beyond cilia. Annual review of genetics. 47, 353-376 (2013).
- Tarchini, B., Jolicoeur, C., Cayouette, M. A molecular blueprint at the apical surface establishes planar asymmetry in cochlear hair cells. Developmental cell. 27, 88-102 (2013).
- Ezan, J., et al. Primary cilium migration depends on G-protein signalling control of subapical cytoskeleton. Nature cell biology. 15, 1107-1115 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved