Method Article
Évaluation de Planar-Cell-polarité phénotypes dans ciliopathie souris mutante cochlée
Dans cet article
Résumé
Primary cilia influence various signaling pathways. The mammalian cochlea is ideal for examining planar cell polarity (PCP) signaling. Cilia dysfunction affects cochlear outgrowth, cellular patterning and hair cell orientation, readouts of PCP. Our goal is to analyze PCP signaling in mouse cochlea via phenotypic analysis, immunohistochemistry and scanning electron microscopy.
Résumé
In recent years, primary cilia have emerged as key regulators in development and disease by influencing numerous signaling pathways. One of the earliest signaling pathways shown to be associated with ciliary function was the non-canonical Wnt signaling pathway, also referred to as planar cell polarity (PCP) signaling. One of the best places in which to study the effects of planar cell polarity (PCP) signaling during vertebrate development is the mammalian cochlea. PCP signaling disruption in the mouse cochlea disrupts cochlear outgrowth, cellular patterning and hair cell orientation, all of which are affected by cilia dysfunction. The goal of this protocol is to describe the analysis of PCP signaling in the developing mammalian cochlea via phenotypic analysis, immunohistochemistry and scanning electron microscopy. Defects in convergence and extension are manifested as a shortening of the cochlear duct and/or changes in cellular patterning, which can be quantified following dissection from developing mouse mutants. Changes in stereociliary bundle orientation and kinocilia length or positioning can be observed and quantitated using either immunofluorescence or scanning electron microscopy (SEM). A deeper insight into the role of ciliary proteins in cellular signaling pathways and other biological phenomena is crucial for our understanding of cellular and developmental biology, as well as for the development of targeted treatment strategies.
Introduction
cils primaires sont des appendices en fonction de microtubules longues qui se prolongent à partir de la surface de la plupart des cellules de mammifères. cils primaires sont souvent confondus avec des cils mobiles, dont il existe toujours multiples par cellule, et dont le but est de déplacer le fluide à travers les surfaces de la membrane. cils primaires, en revanche, adopter des rôles sensoriels et sont par conséquent également désignée comme les cils sensorielle. Une fois oublié depuis longtemps, cet organite a récemment été "redécouvert" en raison de son association avec une multitude de maladies génétiques humaines 1. Idéalement positionné comme un organite de signalisation, le cil primaire a été montré pour réguler de nombreuses voies de signalisation, dont beaucoup sont importantes non seulement dans l'homéostasie tissulaire et les maladies, mais également au cours du développement 2.
L'une des premières voies de signalisation est prouvé qu'ils sont associés à un dysfonctionnement des cils est la voie de signalisation Wnt non canonique, connu également que la polarité cellulaire planaire (PCP) voie > 3. Cette cascade de signalisation initialement identifié chez la drosophile, est essentiel pour l'embryogenèse; en particulier pour les processus de convergence et d'extension et pour l'orientation correcte de cellules dans le plan de l'épithélium 4. La signalisation séquentielle d'un ensemble de base de protéines régulatrices traduit indications directionnelles qui conduisent finalement à des réarrangements du cytosquelette et se traduisent par la polarisation coordonnée des cellules épithéliales dans un plan 5. Le processus de convergence et l'extension est absolument nécessaire pour le canal cochléaire pour allonger et de structuration cellulaire correcte 6. Comme il est régulée par activation de la voie de PCP, l'un des phénotypes les plus frappants de mutants PCP cochlée est un canal cochléaire raccourci avec l'épithélium sensoriel désorganisé 7. De même, les mutants de souris, qui manquent de cils, présentent également une telle convergence et l'extension phénotype 8,9, mais précisément comment cela est réglementé reste à élucider.
ve_content "> Parce que les processus de convergence et de vulgarisation sont essentiels pour l'excroissance du canal cochléaire, et la structuration cellulaire de l'épithélium sensoriel dans le canal cochléaire, le développement de la cochlée est un organe idéal pour examiner la signalisation PCP au cours du développement des vertébrés. L'organe de Corti, le terme donné à l'épithélium sensoriel spécialisé qui tapisse le canal cochléaire, est composé de cellules de soutien non-sensorielles et les cellules ciliées mécano qui doivent être uniformément orientés pour la cochlée pour fonctionner 10. les cellules ciliées mécano sont appelés ainsi en raison de la faisceaux stéréocils qui se prolongent à partir de la plaque cuticulaire (de surface apicale) de chaque cellule sensorielle de cheveux 11. Ceux-ci agissent comme des transducteurs primaires de mécanosensibilité et en dépit de leur nomenclature comme stereocilia, sont en fait constituées de microvillosités sur la base de filaments d'actine modifié. de chaque poil en forme de chevron bundle, trois rangées de stéréocils sont organisées dans un pa très ordonnée et régulièrettern dans un cas comme manière d'escalier. Réel cils base microtubules, kinocilia appelés, sont nécessaires pour le développement et l'orientation des faisceaux stéréocils 12. A chaque cellule de cheveux, un seul kinocil est physiquement attaché à la touffe ciliaire, adjacent au centre de la rangée la plus haute des stéréocils. La fonction précise de la kinocil est pas claire, et une hypothèse est que le kinocil 'tire' stéréocils en forme à leur échéance de microvillosités 12. Chez les vertébrés, kinocilia dans la cochlée ne sont présentes que de façon transitoire et se rétractent à partir des cellules ciliées chez les souris avant le début de l'audition 11,13,14.Perte complète de cils dans les résultats de la cochlée en développement dans les conduits cochléaires sévèrement raccourcies, mal formée et mal orienté paquets stéréocils, ainsi que mis-positionnés organes de base 8,9. Un cil fonctionnelle est non seulement composé de l'axonème ciliaire. Beaucoup de protéines associées aux cilsfonction se produire dans des complexes localisés dans les sous-domaines connexes cils tels que le corps de base, zone de transition, ou ciliaire axonème 15. Le corps de base, provenant de la centriole mère du centrosome, est également un centre de microtubules organisation pour les microtubules étendant depuis le cil dans le corps cellulaire et peut réguler le trafic intracellulaire, ainsi que le trafic de ciliaire. La zone de transition ciliaire est une autre région où la fonction ciliaire est réglementé en termes d'organisation importation et l'exportation de composés ciliaires 16.
De multiples études ont identifié un lien entre les cils et Wnt non canonique (signalisation PCP), bien que le mécanisme précis est difficile 17. Redondance de gènes ciliaires et le PCP et la sensibilité de la polarité cellulaire à des anomalies cellulaires généralisées, il est difficile de relier directement une mutation à des déficits spécifiques PCP. L'une des sorties de lecture de la signalisation de PCP est le positionnement du corps de base et primary cil donc séparer le primaire à partir des défauts secondaires est difficile. Certaines études de mutants de poisson zèbre et la souris ont suggéré aucun lien entre les cils et de signalisation Wnt 18-20. Les écarts dans les données peuvent refléter des espèces, des tissus ou des différences temporelles dépendantes des cotisations ciliaires vers la signalisation Wnt. En outre, la réactivité Wnt normale pourrait être retenue si les organes de base restent fonctionnelles. Une connaissance plus approfondie le rôle des protéines ciliaires dans les voies de signalisation cellulaire et d'autres phénomènes biologiques est cruciale pour notre compréhension de la biologie cellulaire et du développement, ainsi que pour le développement de stratégies thérapeutiques ciblées.
Protocole
Utiliser et euthanasier tous les animaux conformément aux directives et réglementations institutionnelles et gouvernementales, le plus souvent par inhalation de CO 2 et la dislocation cervicale.
1. Préparation des réactifs
NOTE: Avant de commencer, préparer tous les réactifs à l'aide de produits chimiques de qualité analytique. Faire des solutions utilisant la biologie moléculaire distillée et de l'eau déminéralisée, sauf indication contraire.
- Tampon phosphate salin (PBS 1x): Faire 1 L de PBS 1x en dissolvant 8 g de NaCl, 0,2 g de KCl, 1,44 g de Na 2 HPO 4 et 0,24 g de KH 2 PO 4 dans 1 litre de H 2 O. Ajuster le pH à 7,4 avec du HCl. PBS n'a pas besoin d'être stérile et peut être stocké à température ambiante. Notez que ce tampon est faite sans CaCl 2 ou MgCl 2.
- Paraformaldéhyde (PFA 4%): Préparer une solution à 4% de PFA dans 1x PBS dans une hotte ventilée. Ajouter 40 g de poudre de paraformaldehyde à 1 litre de PBS 1x. Pour dissoudre, mélanger et chauffer à environ 60 ° C,et ajouter lentement goutte à goutte NaOH pour élever le pH. Une fois que la poudre soit dissoute, réajuster le pH à 7,4 avec HCl. Filtrer à travers un filtre de 0,45 uM et congeler des aliquotes. Décongeler un aliquote fraîche pour chaque expérience.
- tampon Triton: préparer un M de Tris-HCl 0,1 (pH 7,5), 0,15 M de NaCl, 0,1% de Triton X-100 solution en dissolvant 8,77 g de NaCl dans 1 litre de 0,1 M Tris-HCl (pH 7,5). Ajouter 1 ml de Triton X-100. Remuez pour dissoudre. Magasin tampon Triton à température ambiante.
- Triton bloc: Préparation du sérum de chèvre à 10% dans un tampon Triton en ajoutant 1 ml de sérum de chèvre à 9 ml de tampon Triton. Conserver à 4 ° C. Si l'on utilise des anticorps primaires soulevées chez la souris, ajouter de chèvre anti-souris fragments Fab d'IgG à une dilution de 1 dans 200 au bloc Triton pour l'étape de blocage.
NOTE: Si vous prévoyez d'utiliser des échantillons pour la microscopie électronique à balayage (MEB), préparer des réactifs supplémentaires, tel qu'indiqué ci-dessous. - Solution saline équilibrée de Hank (HBSS) avec du calcium et du magnésium: Faire une solution de HBSS 1x par dilution d'une solution mèreen distillée stérile H 2 O. Comme tampon HBSS est compliqué à faire et il y a des risques, il est conseillé de commander une solution 10x boursier premade. La concentration finale de tampon de HBBS couramment utilisés est la suivante: 1,26 mM de CaCl2, 0,49 mM de MgCl2 -6H2O, 0,41 mM de MgSO 4 -7H2O mM, KCl 5,33 mM, KH 2 PO 4 0,44, NaHCO 3 4,17 mM, NaCl 137,93 mM , 0,34 mM Na 2 HPO 4, mM dextrose 5,56.
- tampon Hepes: Préparer une solution Hepes 0,1 M en 1x HBSS, en dissolvant 23,8 g HEPES dans 1 tampon L 1x HBSS.
- Microscopie électronique à balayage fixateur (SEM Fix): Préparation de fixateur pour SEM électrons en diluant du glutaraldéhyde à niveau microscopique (2,5%) et du paraformaldehyde (4%) dans du tampon Hepes. Ajouter CaCl 2 à une concentration finale de 10 mM.
- 1% tétroxyde d'osmium (OSO 4) dans un tampon Hepes; 1% tétroxyde d'osmium dans l'eau: Diluer une solution mère de tétroxyde d'osmium dans du tampon Hepes et separately dans stérile distillée H 2 O, à une concentration finale de 1%. Tétroxyde d'osmium est hautement toxique et est le plus souvent vendu comme une solution à 4%.
- 1% (p / v) d'acide tannique: Dissoudre 0,5 g d'acide tannique dans 50 ml d'eau distillée stérile 2 O. Filtre stériliser par filtration à travers un filtre de taille de pore de 0,45.
- Graduée éthanol série de solution: Diluer 200 éthanol preuve avec stérile distillée H 2 O pour rendre les solutions 30, 50, 70, 90 et 95% d'éthanol. Pour les rinçages de finale en éthanol, éthanol à 100% 200 preuve est exigée. Utilisez une bouteille fraîchement ouvert de 200 éthanol preuve pour les derniers rinçages.
2. Choix de tissus
- Idéalement, examiner des embryons ou des jeunes chiots âgés de jour embryonnaire 16,5 (de E16,5) et jour postnatal 3 (P3).
NOTE: L'ossification du labyrinthe osseux et os temporaux fait dissection progressivement plus difficile que les souris matures. Aussi kinocilia, le seul vrai cil base microtubules trouvé sur les cellules ciliées de la cochlée,rétracte au cours du développement et ne sont plus présents dans les souris adultes. - Après fixation, détartrer cochlée adulte. Placez disséqué (voir section 3) labyrinthes osseux, dans 2 ml d'EDTA (4,13% dans PBS), pH 7,3, dans un tube de microcentrifugeuse pendant 3 - 4 jours avec rotation. Reconstituer EDTA quotidienne. Une fois que les tissus ont ramolli, rincer dans 1,5 ml de PBS ou plus de 3 fois pendant 5 minutes sur un nutator à une augmentation de l'agitation.
3. cochlée Dissection
- Euthanasie poste par dislocation cervicale ou inhalation de CO 2 (100% de CO 2), enlever la tête. Utilisez une lame de scalpel ou une petite paire de ciseaux, en fonction de la taille de l'animal, de disséquer la tête le long de la ligne médiane sagittale en commençant par le nez et étendant caudale. Retirer le cerveau de chaque moitié du crâne avec une paire de forceps. Identifier les os temporaux, qui contiennent les labyrinthes osseux développement de l'oreille interne (voir la flèche sur la figure 1A).
- Utilisez une paire de pourcèpes pour isoler soigneusement les labyrinthes osseuses du crâne (os temporal). Pour ce faire, sous un microscope de dissection. Prise de distance le tissu osseux du crâne en exécutant la pince doucement sous les labyrinthes osseux. Chez les animaux jusqu'à P4 les labyrinthes osseuses sont encore cartilagineux et peuvent être facilement enlevés sans se rompre.
- À la suite de la dissection, utilisez la pointe de la pince à disséquer pour effacer l'ovale et fenêtres rondes et faire un petit trou dans le sommet de la spirale cochléaire. Fixer les labyrinthes osseux avant de poursuivre la dissection du canal cochléaire. Pour permettre un retrait facile de la membrane de Corti (voir 3.7), fixer les labyrinthes osseux dans 1,5 ml de 4% PFA pendant 5 minutes sur de la glace.
NOTE: Si le retrait de la membrane de Corti est pas nécessaire, plus la fixation est recommandée (voir 04/01 au 04/03). Brève fixation des os temporaux avant la dissection du canal cochléaire facilite le processus de dissection et l'enlèvement de la membrane de Corti. dissection poste et l'exposition de l'organe de Corti, Furtsa fixation est nécessaire. - disséquer les labyrinthes osseux pour exposer l'épithélium sensoriel cochléaire comme suit. Placez les labyrinthes osseux dans un plat de dissection d'élastomère enduit silicone noir contenant du PBS pour faciliter la dissection. Utilisez des épingles minuties pour immobiliser le tissu si nécessaire. Pour utiliser des épingles minuties, placez-les à travers la partie vestibulaire des labyrinthes osseux à la face ventrale de la spirale cochléaire vers le haut.
NOTE: Noir plat en élastomère de silicone: composant de base en élastomère de silicone Mélanger avec du charbon en poudre pour obtenir une couleur noire opaque. Ajouter l'agent de durcissement et verser dans une ou plusieurs boîtes de Pétri (verre ou plastique). À sec sous vide pour éliminer les bulles d'air emprisonnées. vaisselle sèche complètement avant de l'utiliser. - Utilisez une pince fine (# 5) pour enlever le cartilage externe exposer le canal cochléaire. Commencez par la fenêtre ovale; insérer l'extrémité inférieure de la pince dans la fenêtre ovale et levier doucement pour ouvrir le cartilage, se déplaçant lentement vers le haut vers lesommet.
- Après l'exposition du canal cochléaire, retirez la face ventrale, la membrane de Reissner. Utilisez une belle paire de pinces pour pincer la membrane de Reissner à la base du canal cochléaire et le retirer dans un mouvement ascendant. Visualiser la face dorsale du conduit cochléaire, y compris l'épithélium sensoriel.
- Retirer la membrane recouvrante, comme décrit ci-dessous (en option). Pour SEM ou immunohistochimie de la kinocil ou liasses stéréocils retirer la membrane de Corti.
- Utilisez une paire très fine de forceps (N ° 55 ou plus fin) pour pincer la membrane de Corti à la base de la cochlée et éplucher vers le haut vers le sommet.
NOTE: La membrane de Corti est optiquement clair qui rend difficile à identifier. Plus souvent qu'autrement, la membrane se détache en un seul morceau et bien qu'il ne soit pas facilement visualisé, on peut sentir la résistance comme il est retiré de l'organe de Corti exposée. - Après avoir exposé l'organe de Corti, fixer davantage le tissu que described ci-dessous. Conserver la région vestibulaire pour faciliter les opérations de préparation des tissus.
4. Fixation
- Pour immunohistochimie régulière fixer les labyrinthes osseux disséqués dans 1,5 ml de 4% PFA à 4 ° C sur un nutator pendant 2 heures.
NOTE: En raison de la sensibilité de différents anticorps et antigènes, les variations de la longueur et de la composition de fixation peut être nécessaire et doit être optimisé pour chaque anticorps. - Après fixation, les échantillons de lavage de rinçage dans 1,5 ml de PBS ou plus de 3 fois pendant 5 minutes sur un nutator à une augmentation de l'agitation. Les échantillons peuvent être stockés dans du PBS à 4 ° C pendant plusieurs semaines avant le traitement.
- Si la préparation des échantillons pour les SEM, Fix disséqué os temporaux dans SEM fix (voir 1.7) pendant 2 heures à la température ambiante. Laver par rinçage dans 1,5 ml ou plusieurs tampons Hepes 3 fois pendant 5 min sur un nutator avec agitation accrue. Magasin à tampon Hepes à 4 ° C jusqu'à traitement ultérieur. Stockage supérieur à un couple de la semaines est pas recommandée.
5. L'immunohistochimie
- Effectuer immunohistochimie sur des échantillons disséqués dans un puits d'une plaque à 96 puits à fond plat. Sinon, utilisez un PCR ou microtube. Il est conseillé de conserver la partie vestibulaire du labyrinthe osseux pour faciliter le traitement.
- Perméabiliser tissu par incubation dans 1,5 ml de tampon Triton pendant 1 heure à température ambiante sur une nutator sous agitation douce.
- Bloquer le tissu par incubation dans 0,5 ml de Triton bloc pendant au moins une heure à température ambiante. Si en utilisant des anticorps primaires soulevées dans la souris, ajouter des fragments IgG anti-souris Fab au bloc à une dilution de 1 pour 200 (voir section 1.4). Cela diminue grandement la liaison non spécifique de l'IgG anti-souris de tissu de souris.
- Incuber le tissu avec des anticorps primaires dilués dans Triton bloc O / N à 4 ° C sous agitation douce. dilution anticorps dépend anticorps utilisés (voir section 6.1). Alternativement incuber antibodie primaires pendant 2 heures à température ambiante. Idéalement utiliser un volume minimal de 0,5 ml de dilution de l'anticorps primaire. Si l'anticorps est limitée, utiliser la plus petite quantité d'anticorps dilution qui enveloppe complètement le tissu.
- Laver le tissu par rinçage dans 1,5 ml ou plusieurs tampons Triton, un minimum de 3 fois pendant 15 minutes, sur un nutator avec agitation accrue.
- Incuber le tissu avec des anticorps secondaires conjugués à des colorants fluorescents dilué aux fabricants concentration recommandée (typiquement 1: 200 à 1: 1000) dans le bloc Triton pendant 1 heure à température ambiante sur une nutator. Utiliser un volume minimal de dilution d'anticorps secondaire de 0,5.
- Centrifuger l'anticorps secondaire dilué à 13 000 g pendant 3 min avant l'utilisation pour réduire au minimum la liaison non spécifique des agrégats d'anticorps secondaire. Protéger le tissu de la lumière à partir de cette étape en avant pour éviter photoblanchiment les colorants fluorescents.
- Comme à l'étape 5.5, laver les tissus par rinçage dans 1,5 ml de tampon Triton ou plus, au moins 3 fois pendant 15 minutes, sur unenutator avec agitation accrue. Conserver les échantillons dans du PBS à 4 ° C jusqu'au moment de monter.
6. Sélection Anticorps
NOTE: La source d'anticorps recommandées et leurs dilutions sont indiquées dans la Table des matières et équipements spécifiques. Effectuer incubations d'anticorps comme décrit au chapitre 5.
- Pour visualiser le kinocil base microtubules, utiliser un ciliaire axonème marqueur tel que anti-Arl13b (1: 1000) ou anti-acétyle-α-tubuline (1: 800). Visualiser le corps de base en utilisant un anticorps contre la γ-tubuline (1: 200) ou tout autre marqueur centrosomale.
- Pour visualiser les filaments d'actine faisceaux stéréocils riche, ajouter phalloïdine (1: 300 - 1 000), conjugué à une ou plusieurs fluorophores différents de l'incubation de l'anticorps secondaire. Phalloïdine étiquettes également d'autres structures d'actine filamenteuse dont les filaments d'actine corticale autour de la périphérie de chaque cellule épithéliale cheveux. Ceci est utile pour déterminerle contour de chaque cellule de cheveux. Utilisez un marqueur membranaire alternative comme anti-Zo-1 (1: 500), si nécessaire.
- Marquer les cellules ciliées de la cochlée en utilisant des anticorps contre la myosine VI (1: 1000) ou la myosine VIIa (1: 1000). Ceux-ci peuvent être utilisés si l'évaluation de la longueur de la cochlée.
REMARQUE: utiliser des anticorps secondaires appropriés colorant fluorescent conjugué optimisé pour les exigences de microscope.
7. Montage et imagerie
- Placer l'échantillon dans un plat à base de silicone élastomère noir contenant du PBS. En utilisant des pinces fines, retirez la région vestibulaire de la spirale cochléaire.
- Très retirer délicatement le cartilage sous-jacent et le mésenchyme de la spirale cochléaire. La spirale cochléaire restant contient le sillon interne, organe de Corti et sillon externe.
- Transférer la spirale cochléaire dans une goutte de PBS placé sur une lame de microscope. Si on le désire, séparer la spirale cochléaire en morceaux équivalents à un tour. Cette étape est inutile cependant, et peut conduire à loss du tissu. La surface apicale (côté stéréocils) des cellules ciliées de la cochlée doit être orientée vers le haut en direction de la lamelle.
- Évacuer la PBS avec un tissu absorbant ou un morceau de papier filtre et doucement repositionner la spirale cochléaire si l'épithélium a changé et chevauche sur lui-même.
- Ajouter une goutte de milieu de montage directement sur l'échantillon de cochlée et placer délicatement une lamelle sur le dessus, en prenant soin d'éviter les bulles d'air. Aucun entretoises sont nécessaires; placer la lamelle directement sur l'échantillon. A, non-fluorescent soluble dans l'eau, milieu de montage semi-permanent qui ne nécessite pas des mesures supplémentaires pour maintenir la lamelle en place est recommandée. Milieu de montage et l'épaisseur de la lamelle doivent être adaptés aux spécifications microscope.
- Utiliser un microscope à épifluorescence ou à balayage laser à foyer commun équipé d'un fort grossissement (63 - 100X), l'ouverture numérique élevée (1.2 - 1.4) des objectifs pour capturer des images de la surface apicale de la cellule capillaire cochléaire. Utilisez loobjectifs wer (5 - 20X) pour prendre des images se chevauchant de la spirale cochléaire pour quantifier la longueur du conduit cochléaire. Correspondre lasers d'excitation et des filtres d'émission aux fluorophores utilisés pour des anticorps secondaires.
8. microscopie électronique à balayage
- Continuer à partir de la section 4.3. Après avoir lavé les échantillons SEM fixes dans un tampon Hepes, effectuez les étapes suivantes sous ventilation. Le protocole suivant fonctionne bien pour les tissus cochlée et évite l'utilisation d'un revêtement par pulvérisation cathodique d'un métal conducteur.
- Post-correction dans une OsO 4% dans un tampon HEPES pendant 1 heure, suivi de 3 lavages avec 1 ml d'eau distillée pendant 5 minutes à chaque fois. Le plus petit volume de OsO 4 qui enveloppe complètement le tissu doit être utilisé pour réduire les déchets toxiques. Aucune agitation est nécessaire.
- Incuber les échantillons à la température ambiante dans chacune des solutions suivantes pendant 1 heure avec 3 lavages avec 1 ml d'eau distillée pendant 5 minutes à chaque fois entre les deux étapes: l'acide tannique à 1% fraîchement préparé dans de l'eau et de filnominatives avant utilisation; 1% OsO 4 dans l'eau, de l'acide tannique à 1% dans l'eau, 1% de OsO 4 dans l'eau.
- Déshydrater les échantillons à travers un bains successifs d'éthanol par mise en incubation pendant 10 min dans chacune des dilutions suivantes: 30, 50, 70, 90 et 95%. Aucune agitation est nécessaire.
- échantillons de transfert à travers trois changements, 5 minutes chacun, de 100% d'éthanol (à partir d'une bouteille récemment ouvert de 200 éthanol preuve).
- Exécutez les échantillons par un point critique plus sec en suivant les instructions du fabricant.
- Monter les échantillons en utilisant un adhésif de carbone conducteur au-dessus d'un tronçon avant SEM imagerie sur un microscope électronique. Sous un stéréomicroscope, utiliser une paire de pinces fines et un pinceau pour placer doucement l'échantillon avec les épithéliums cochléaires vers le haut. Utiliser la partie vestibulaire de l'échantillon à «ancre» les tissus à l'embout. Conserver les échantillons dans un dessiccateur jusqu'à imagerie. Effectuer imagerie SEM comme décrit dans Jones (2012) 21.
9.Quantification
- Après la préparation de l'immunohistochimie, acquérir des images en utilisant une épifluorescence ou à balayage laser confocal microscope. Après la préparation de SEM, utiliser un microscope électronique à balayage à l'image des spécimens. L'image de la surface apicale de l'organe de Corti avec les cellules ciliées de la cochlée exposées et les cellules de soutien intercalées.
- Définir des positions spécifiques le long du canal cochléaire, telles que 25, 50, et 75% de la base et les utiliser pour comparer les régions cochléaires entre les échantillons de mutants et de contrôle. Analyser et comparer les mutants cils avec leurs contrôles même portée, que les différences de fond génétique peuvent modifier le phénotype cochléaire.
NOTE: L'organe de Corti se développe dans un gradient qui va du milieu de la base à la fois vers le sommet et la base. Chez la souris, le développement est pas complète tant que P14, il est donc important de comparer les régions à des stades et des postes de perfectionnement similaires. - Prenez des photos en utilisant le logiciel accompagnant le microscope qui allow pour la quantification du phénotype particulier selon les besoins (voir ci-dessous). Utilisez un logiciel d'analyse d'image tels que Image J ou le logiciel qui accompagne le microscope pour mesurer des longueurs, compter les cellules et de déterminer la localisation des protéines comme décrit ci-dessous. Graphique ces données sous forme de graphique à barres, diagramme de dispersion, boîte blot ou histogramme, comparant le contrôle de contre mutant.
- La longueur totale du canal cochléaire (figure 3A):
- L'utilisation d'un marqueur de cellule de cheveux ou phalloïdine, (qui marque les faisceaux stéréocils), de déterminer et de mesurer où l'épithélium sensoriel commence et se termine. La longueur du conduit cochléaire est souvent abrégé en mutants cils.
- Anomalies des faisceaux stéréocils (Figure 3B, D, E, G):
- Mesurer convexité faisceau (la hauteur) que la plus courte distance entre le sommet de la botte et la ligne qui traverse les deux extrémités du faisceau «bras» comme illustré sur la figure 3G, à gauche. Sinon, quantifier la zoneentouré par les bras de faisceau externe stéréocils des cellules ciliées comme le montre la Figure 3G, à droite. Si les cellules ciliées des faisceaux stéréocils circulaires peuvent être identifiés comptent ceux-ci en tant que pourcentage du total des cellules ciliées.
NOTE: Dans de nombreux mutants ciliaires anomalies bundle peuvent être observés indépendamment de l'orientation bundle. Il est difficile de quantifier avec précision les anomalies bundle stéréocils.
- Mesurer convexité faisceau (la hauteur) que la plus courte distance entre le sommet de la botte et la ligne qui traverse les deux extrémités du faisceau «bras» comme illustré sur la figure 3G, à gauche. Sinon, quantifier la zoneentouré par les bras de faisceau externe stéréocils des cellules ciliées comme le montre la Figure 3G, à droite. Si les cellules ciliées des faisceaux stéréocils circulaires peuvent être identifiés comptent ceux-ci en tant que pourcentage du total des cellules ciliées.
- L'orientation des faisceaux stéréocils (Figure 3B, C, G):
- Évaluer l'orientation de chaque faisceau individuel par rapport à une ligne perpendiculaire à la ligne de cellules de pilier qui sépare les cellules ciliées internes et externes. Les cellules avec une orientation normale sont alignées le long de cet axe perpendiculaire, et ils ont donc une rotation de 0 °. Déterminer les angles de rotation en utilisant soit une notation de 360 ° ou des écarts absolus de 0 °.
- Positionnement Kinocilia ou de positionnement de faisceau stéréocils (Figure3B, F, H):
- Compter le pourcentage de cellules dans lesquelles kinocilia sont manquants. Mesurer la distance entre le kinocil au «sommet» ou centre du faisceau. Le «sommet» du faisceau peut ne pas être facile de définir si les faisceaux sont anormaux, et donc le centre du faisceau peuvent être utilisés à la place.
- Quantifier la position de kinocilia stéréocils et faisceaux sur la surface des cellules ciliées apicale, en superposant une grille de positionnement sur chaque cellule de cheveux et le marquage de l'emplacement de la base soit de la kinétocil ou le sommet / centre du faisceau stéréocils. Afficher les données en pourcentage de chaque catégorie qui se trouve dans une région particulière de la grille, et en recouvrant les emplacements de chaque marquage sur une grille de positionnement.
REMARQUE: Dans les tissus de contrôle, kinocilia sont toujours attaché au sommet du faisceau stéréocils. Dans mutants cils, kinocilia sont souvent absents, encore mislocalized encore attaché, ou même complètement détaché des sbundle tereociliary. - Longueur Kinocilia (figure 3I):
- Mesurer la longueur de la kinocil par marquage avec un marqueur ciliaire axonème. mesurer que kinocilia qui reposent à plat dans un plan confocal 1,5 um. Confirment que les cils sont allongés à plat par l'observation d'une vue en coupe transversale du tissu analysé. Comparer les échantillons appariés âgés de la même région de la cochlée depuis le kinétocil se rétracte au cours du développement.
- Mauvaise localisation des protéines de polarité:
- Suite à l'immunohistochimie en utilisant des anticorps contre les protéines de polarité tels que Vangl2 et Gai3, déterminer la localisation via l'imagerie.
NOTE: Dans certains mutants cils, localisation des protéines de polarité est perturbé. Ceux-ci comprennent Vangl2 et Gai3, qui se sont révélés être perturbé dans Ift20, Bbs8 et BBS6 cochlée mutant.
NOTE: D'autres exemples de la façon de quantifier et de cheveux d'affichage cellule Polarity peuvent être trouvés dans les documents suivants. Curtin, et al. (2003) Current Biology 22, Montcouquiol, et al. (2003) Nature 7, Wang, et al (2006) The Journal of Neuroscience 23, Montcouquiol, et al. (2008) Methods in Molecular Biology 24, mai-Simera, et al. (2012) Methods in Molecular Biology 25, Yin et al (2012) PloS One 26.
Résultats
Cochlée Dissection et de tissus Préparation
Après l'élimination du cerveau, après la mi-ligne dissection sagittal d'une tête P0 de la souris, le labyrinthe osseux, vu de derrière, peut être visualisée (Figure 1A, flèche blanche) et enlevé. Figure 1B montre les labyrinthes osseuses isolées avec les cheveux cochléaire vers le haut, ventrale, (à gauche) et de l'arrière, dorsale (à droite). La flèche blanche à la fenêtre ovale à partir de laquelle on peut commencer à enlever le cartilage externe. Une fois que le cartilage externe a été complètement enlevé, le canal cochléaire exposé, encore intact, peut être observé (figure 1C). Positionnement d'une aiguille à travers la région vestibulaire pour aider dissection est affiché. Deux broches placées à des angles différents peuvent également être utilisés pour ancrer le tissu. La figure 1D montre le conduit cochléaire après élimination du Reissner '; De la membrane et la membrane recouvrante (à gauche) et de la spirale cochléaire épithéliale isolé une fois qu'il a été isolé à partir de la région vestibulaire, dans la préparation pour le montage pour l'immunohistochimie (à droite). Pour donner une idée générale de ce que les cheveux cochléaire exposé ressemble, une préparation SEM intacte est illustré à la figure 1E.
Morphologie et immunofluorescence dans le contrôle cochlée
Après la préparation du tissu cochléaire, la face dorsale du conduit cochléaire contenant l'organe de Corti est exposée et peut a été regardé par SEM ou coloration immunofluorescente. Considérée dans son ensemble, monter une préparation, les quatre rangées de cellules ciliées mécano (une rangée de cellules ciliées internes et trois rangées de cellules ciliées externes) peuvent être distingués. Figure 2A montre une vue à faible grossissement de la tour basal d'une cochlée de souris embryonnaires , préparée fou SEM. Notez l'orientation uniforme et l'alignement des faisceaux de stéréocils base actine. En outre, la morphologie des faisceaux stéréocils est cohérent, chaque faisceau a le classique ")" (sur les cellules ciliées internes) ou "W" (sur les cellules ciliées externes) forme. Sur un grossissement plus proche de cet âge microvillosités supplémentaires peuvent être considérés non seulement sur la surface apicale des cellules ciliées mais aussi entre les cellules ciliées sur les cellules de soutien (figure 2B). Ceux-ci seront repoussées laissant seulement trois rangées de faisceaux stéréocils des cellules ciliées externes et deux sur les cellules ciliées internes chez les adultes. Comme on peut le voir sur la figure 2C (flèche blanche), une seule kinocil base microtubules (un vrai cil primaire) est situé à côté de la rangée la plus haute des stéréocils au sommet de chaque faisceau stéréocils. Ceux-ci sont fixés sur le paquet via des liaisons kinocilia.
marquage fluorescent avec phalloïdine, quel laboratoireEls actine, met en évidence l'orientation uniforme et la forme des faisceaux dans le tissu de contrôle (figure 2D). actine corticale est également marqué, qui est utile pour déterminer la circonférence apicale de chaque cellule individuelle de cheveux. Co-marquage avec la phalloïdine et un anticorps dirigé contre la myosine 7a (figure 2E), un marqueur de cellules ciliées, permet également de différencier les cellules ciliées et les cellules de soutien. Myosine 7a est également un marqueur utile pour mesurer l'extension de canal cochléaire (voir la figure 3A). Un anticorps dirigé contre-acétylée α-tubuline est couramment utilisé pour identifier le kinétocil basé microtubules (figure 2F). Comme les cellules de soutien hébergent également cils primaires, il est important de faire la distinction entre les franges sont issues les cellules ciliées intercalation contre des cellules de soutien. Un marqueur membranaire supplémentaires telles que des anticorps contre ZO-1 (Zona occludens 1), ce qui indique clairement le motif mosaïque de la membrane apicale de la cochlée, est par conséquent utile ( Figure 2F). D'un examen plus approfondi est que les anticorps contre acétyle-α-tubuline étiqueter également microtubules internes et les soins devraient donc être prises lors de l'imagerie de se concentrer sur la surface apicale des cellules ciliées. Les microtubules dans les cellules des piliers sont particulièrement dense (Figure 2G, astérisque blanc). Une combinaison de la phalloïdine et anti-acétylé-α-tubuline marquage est souvent utilisée pour identifier simultanément des faisceaux stéréocils et kinocilia voisins (figure 2G, flèche blanche).
Phénotype cochléaire dans les cils Mutants
Allongement du canal cochléaire est l'une des meilleures sorties de lecture de convergence et de vulgarisation des défauts, et conduits cochléaires raccourcies sont couramment observées chez les mutants PCP classiques. La cochlée chez les mutants ciliaires ont souvent abrégé conduits cochléaires et de montrer un élargissement notable de la épithélium sensoriellia au sommet, comme on peut le voir dans Ift20 cko / cko souris (figure 3A). Un autre défaut de PCP est classique perturbation de l'orientation uniforme des cellules ciliées de la cochlée, comme on peut le voir dans les Bbs8 - / - souris à la fois par immunohistochimie (Figure 3B, flèches de droite) et SEM (figure 3C). En plus de mis-orientés paquets, aplaties et faisceaux difformes sont aussi couramment observés (figure 3B, flèche du milieu; Figure 3D). Souvent circulaires faisceaux, comme on peut le voir sur la figure 3E, sont présents, en particulier dans les cellules ciliées complètement dépourvues de kinocilia. Mis-localisation de l'kinocil est également fréquente.
Le kinocil de mal localisée peut ou ne peut pas être attaché à l'ensemble des stéréocils (figure 3B, flèche gauche, figure 3F). Des exemples de la façon de quantifier buorientation et positionnement kinocilia NDLE ou faisceau sont présentés sur la figure 3G et 3H. L'orientation de chaque faisceau individuel peut ensuite être évaluée en déterminant la rotation du faisceau de rapport à une ligne perpendiculaire à la ligne de cellules de pilier qui sépare les cellules ciliées internes et externes. Les cellules avec une orientation normale sont alignés le long de cet axe perpendiculaire et ainsi avoir une rotation de 0 ° (Figure 3G). La position de la kinétocil ou au centre du faisceau stéréocils, peut être tracée en superposant une grille de positionnement sur la surface luminale des cellules ciliées, puis en déterminant l'emplacement des kinocilia ou du faisceau à l'intérieur de la grille (figure 3I). Des mutations dans les gènes de cils affectent souvent la longueur des cils, et ainsi la longueur de la kinocil peuvent être évalués. Dans mutants RD16 / RD16 de CEP290, kinocilia sont plus longues que chez les témoins (Figure 3J). Comme les rétracte cil,il est essentiel d'avoir l'âge appariés compagnons de portée et de prendre des mesures à partir de la même région de la cochlée. Pour obtenir de bonnes images pour l'analyse et la quantification, à la fois pour l'immunohistochimie et SEM, il est essentiel de retirer la membrane de Corti. Figure 3F montre une micrographie SEM dans lequel la membrane de Corti n'a pas été complètement enlevé.
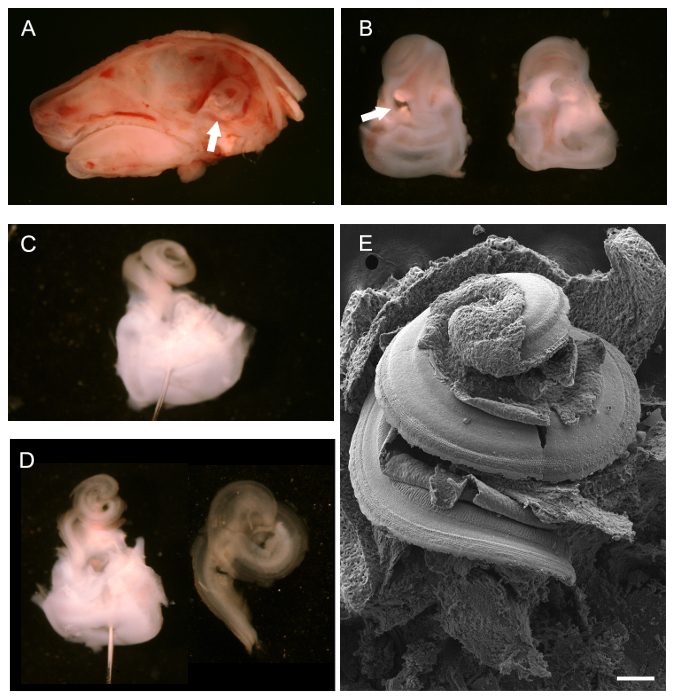
Figure 1. Dissection d'une souris développement de la cochlée (P0). (A) à mi-ligne dissection sagittal de la tête P0 souris avec le cerveau enlevé. La flèche blanche à la position du labyrinthe osseux. (B) ventrale (à gauche) et dorsale (à droite) vues de labyrinthes osseux disséqués. La cochlée est situé vers le haut avec la partie vestibulaire au niveau des points de flèche blanche inférieure à la fenêtre ovale. (C) Le labyrinthe de l'arrière osseuseretrait er du cartilage externe de la cochlée. Une broche a été placé par le système vestibulaire. (D) à gauche, même vue que la C après le retrait de la membrane de Reissner et la membrane de Corti. Droite, canal cochléaire isolée prêt à être monté. Micrographie électronique (E) de balayage de, une spirale cochléaire exposée intacte exposer la surface du conduit cochléaire, y compris l'épithélium sensoriel. La barre d'échelle est de 100 um. . (A - D) adapté de mai-Simera et al, 2012 25 S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 2. Morphologie et immunofluorescence dans le contrôle cochlée (A - C). Microscope électronique à balayage de la tur basalen en embryonnaire ('a 18,5) de type sauvage cochlée. Une rangée de cellules ciliées internes (en bas) et trois rangées de cellules ciliées externes (en haut) sont séparés et intercalé par des cellules de soutien. stéréocils faisceaux en forme de chevron orienter uniformément vers le bord latéral de chaque cellule de cheveux (de bord supérieure de l'image). À'a 18,5 microvillosités supplémentaires portent sur les surfaces apicales des cellules ciliées, au-dessous des faisceaux stéréocils, et des cellules de soutien intercalées (B). (C) en fonction des microtubules kinétocil unique (flèche blanche), est situé au sommet du faisceau, représenté ici par rapport au bord latéral. (D - G) La coloration par immunofluorescence du tour basal après jour natal 1 (P1) de type sauvage cochlée. Phalloïdine étiquettes actine filamenteuse dans stéréocils et l'actine corticale à la périphérie de la cellule (D, E, G). Myosine 7a est un marqueur de cellules ciliées internes et externes (E). Zo_1 étiquettes des jonctions serrées entre-deux cellules, ce qui en fait un excellent marqueur pour distinguer Bounda cellulaireRies (F). Acétylée α-tubuline est utilisée comme marqueur pour la kinétocil au sommet du faisceau (F, G flèche blanche). Microtubules internes sont également marquées par acétyle α-tubuline, qui sont particulièrement abondants dans les cellules des piliers (G astérisque blanc). Échelle barres A: 10 pm, B: 5 pm, C: 1 pm, DG:. 5 pm S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
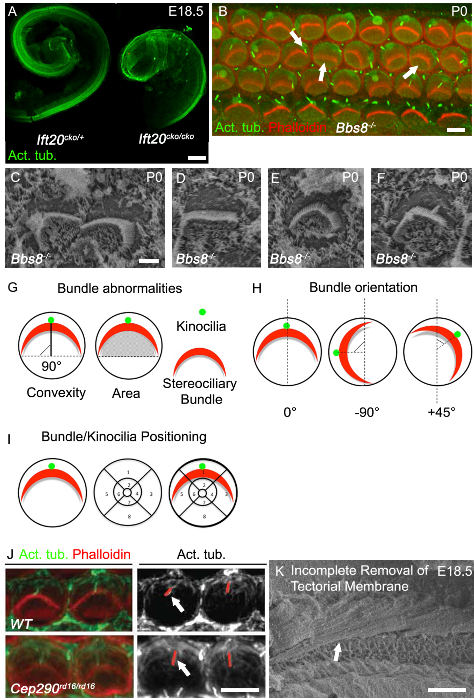
Figure 3. Cochlear phénotype dans les cils Mutants. (A) raccourcissement marqué de Ift20 cko / cko conduits cochléaires par rapport au témoin. cochléaire à canaux disséqués'a 18,5 colorées avec de la tubuline acétylée. (B ) Le total des images de montage de tour cochléaire basale dans Bbs8 - / - mutant (P0). Phalloïdine marquée actine filamenteuse, stéréocils (rouge), la tubuline acétylée, kinocilia (vert). Faisceaux stéréocils dans Bbs8 - / - cochlée sont variablement rotation (flèche droite), aplaties et / ou mislocalized (flèche du milieu). Kinocilia sont mislocalized ou axonèmes sont manquantes (flèche vers la gauche). (C - F) grossissement supérieur SEM de faisceaux et kinocilia stéréocils dans Bbs8 - / - CCEs. En C, rotation des faisceaux, en D, aplaties faisceau, dans E, faisceaux circulaires et F kinocilia mislocalized. (G - I) des représentations schématiques des bundle anomalie quantification. (G) Gauche, bundle convexité (hauteur); la plus courte distance entre le sommet de la botte et la ligne qui traverse les deux extrémités du faisceau «bras». comme depicted par la ligne noire continue. À droite, l'aire sous la botte; la zone. (H) des représentations schématiques des critères utilisés pour quantifier l'orientation des faisceaux stéréocils. L'angle de rotation de l'ensemble est calculée par rapport à une ligne perpendiculaire à la ligne de cellules de pilier. (I) Représentation schématique des critères pour l'analyse de position de kinocilia et faisceaux stéréocils. Une grille segmentée est prévue sur la périphérie de la pile de cheveux et la position notée. (J) de l'image supérieur grossissement de faisceaux de phalloïdine marquée stéréocils (rouge) et kinocilia acétylés de tubuline marqué (vert) de cellules ciliées externes dans P0 cochlée. Dans le panneau monochrome adjacent, lignes rouges identifient les kinocilia, qui sont plus en mutants Cep29 RD16 / de la RD16 par rapport au témoin (flèches blanches). (K) MEB de cochlée embryonnaire avec une élimination incomplète de membrane de Corti. Échellebarres A: 100 um, B: 5 pm, C - F: 2,5 um, I: 5 um, J: 50 pm. (A - F)... Modifiée à partir de mai-Simera et al 2015 8, J Réimpression avec la permission de Rachel et al, 2012 27 S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Discussion
Lors de la préparation des tissus cochléaire pour l'analyse, il y a quelques points clés à garder à l'esprit. Tout d'abord, les différences de fond génétique peuvent modifier le phénotype cochléaire, ce qui rend nécessaire d'analyser et de comparer les seuls contrôles même portée. Deuxièmement, l'élimination complète de la membrane de Corti est nécessaire pour obtenir les meilleures images avec immunohistochimie et est essentielle pour SEM. La membrane de Corti est une structure opaque et peut obscurcir les cellules de l'épithélium sensoriel directement en dessous, ce qui rend plus difficile l'imagerie. De temps en temps au cours du traitement, la membrane tectoriale peut reculer, en découvrant les cellules ciliées. Même dans ces cas, un déplacement est fortement conseillé. Cette étape exige de la patience et de la pratique. Troisièmement, l'immunohistochimie en utilisant des anticorps dirigés contre les protéines ciliaires, en particulier ceux qui se localisent sur le corps de base très compact, peut être difficile et nécessite l'optimisation. Envisager d'effectuer la récupération de l'antigène, l'intensification de la permeabilsation étapes, ou la diminution de la concentration ou de la fixation. Enfin, lors de l'imagerie de la kinocil (le cil primaire trouvé sur les cellules ciliées de la cochlée) garder à l'esprit qu'il commence à se rétracter de P0 - P1 partir dans un gradient de base-sommet. Par conséquent, lorsque l'on mesure la longueur de la kinétocil il est important de comparer les cellules ciliées de la même région de la cochlée et dans les animaux public identifié. Les cellules de soutien intercalaires ont aussi cils primaires, qui ne se rétracte pas. Il faut prendre soin de faire la distinction entre les franges de support cellulaire et kinocilia des cellules ciliées.
Comme les souris arrivent à maturité, il devient de plus en plus difficile d'isoler proprement l'épithélium sensoriel cochléaire, en raison de la calcification des os temporaux et labyrinthes osseux. Décalcification des tissus est nécessaire, ce qui est pas toujours compatible avec d'autres techniques de immunolocalisation mais ne permet pour l'examen du phénotype brut et est également compatible avec la préparation SEM. str de la souris consanguineains présentent souvent des défauts auditifs tels que la perte des cellules ciliées ou les réponses auditives du tronc cérébral élevées (RBZ), due à des mutations dans des gènes connus ou auditives gènes modificateurs. Par conséquent, il est essentiel de comparer âge témoins appariés de même portée ou reproduire sur un fond génétique alternative.
Une des limites de cette analyse est que, chez la souris, l'kinocil commence à se rétracter après la naissance et est plus présent sur les cellules ciliées adultes. Pour cette raison, les mesures de kinocilia ne peut se faire dans le développement de tissus. En outre, il est nécessaire de choisir soigneusement les contrôles appariés selon l'âge pour les comparaisons entre les échantillons de mutants et de contrôle. Une autre limitation est que les souris ciliaires mutant analysés à ce jour ne pas afficher dysfonction auditive sévère (ie., Les réponses du tronc cérébral, ABRs ou émissions oto-acoustiques, EOA) même lorsque le développement cochléaire est altérée. Conformément à cela, les défauts d'audition ne sont pas un phénotype commun de ciliopathie humaine. Exceptionnellement, la perte de hearing est l'une des principales caractéristiques du syndrome Alström, causées par des mutations dans la base de protéines du corps ALMS1 28,29. Cela suggère que des stéréocils faisceau morphologie est pas nécessairement liée à un dysfonctionnement auditif chez les mutants de cils, probablement en raison de la réorientation de correction de faisceaux tard dans le développement comme cela a été rapporté pour les mutants Vangl2 CKO 30. Si le spectre de ciliopathie est élargie pour inclure le syndrome de Usher, la cause congénitale la plus courante de surdicécité, puis dysfonction auditive devient très pertinente. Des données récentes ont montré que plusieurs protéines apparentées à Usher syndrome localisent également le cil et sont impliqués dans les processus liés ciliaires-31, mais si ces protéines ont trait à la signalisation PCP n'a pas encore été examiné.
Jusqu'à présent, la plupart des mutants ciliaire de souris analysées pour les défauts de PCP cochléaires ont seulement été vaguement examiné. Les techniques décrites dans ce manuscrit permettent une vaste détaillant de laphénotype cochléaire, qui va sans doute conduire à une compréhension plus précise de la participation ciliaire dans l'établissement de la signalisation PCP vertébrés. Malgré le grand nombre de modèles de souris ciliopathie disponibles, étonnamment peu ont été analysés en termes de défauts de PCP cochléaires. Un écueil commun associé à ces modèles est létalité embryonnaire. Cependant, depuis le développement de la cochlée peut être examinée en germe le rôle des cils dans le PCP dans l'oreille en développement peuvent être encore être étudiée. En outre, très tôt létalité embryonnaire peut être contourné en utilisant KO conditionnelles. FOXG1 Cre 32 souris, disponibles à partir JacksonLaboratories, sont couramment utilisés pour inactivategenes d'intérêt dans thedeveloping oreille interne de la date E8.To, les efforts ont porté principalement sur l'examen des gènes de ciliopathie pathogènes mais l'exploration d'autres protéines cils liées et comment elles affectent la signalisation PCP au cours du développement peut fournir un meilleur aperçu des cilia biologie et de la fonction.
Si un phénotype auditive est suspectée dans les modèles de souris en cours d'analyse, d'éventuelles nouvelles analyses comprennent des tests audiométriques ABRs 33 ou 34 EOA. Analyses d'extension d'expiant cochléaire (tels que décrits mai-Simera et al., 2012 25), peuvent également être effectuées et permettent l'identification de défauts convergents d'extension à des points de temps de développement antérieurs. Mise en culture des explants de la cochlée permet également un traitement avec divers activateurs ou des inhibiteurs de signalisation, qui peuvent modifier l'extension d'expiant, contribuant ainsi à la compréhension des mécanismes de développement des processus impliqués. Bien qu'il soit connu que le kinétocil rétracte après la naissance 11,13,14, ce retrait n'a pas été entièrement traitée dans le contexte de mutants ciliaires. Il serait intéressant de prendre des mesures de délais précis de kinocilia émergence et la rétraction dans les cils mutants.Considering qu'un rôle de premier plan pour ciliaire proprotéines est le mouvement des marchandises le long des microtubules, il est fort probable que ces protéines peuvent également réglementer les aspects de trafic intracellulaire long du cytosquelette 35-37. Un sous-ensemble de protéines de cils se sont révélés affecter le trafic et de la localisation asymétrique des molécules d'PCP 8. Localisation par immunohistochimie de molécules de PCP, particulièrement des protéines associées à la membrane tels que Vangl2, Frz3 et Dsh, est donc recommandé d'établir si les molécules de PCP sont mislocalized. Établissement de la polarité semble être une affaire à multiples facettes, et il existe des preuves de montage pour une voie autonome de cellule supplémentaire, qui est également nécessaire pour PCP correcte dans les cellules ciliées sensorielles 38. Une étude récente a montré que la signalisation de la protéine G dépendante contrôle la migration du cil de manière autonome 39 cellules. En accord avec un rôle pour les protéines ciliaires dans la localisation des molécules de polarité, la protéine G hétérotrimériques alpha-i 3 sous-unité (Gai3) localization est perturbé en Bbs8 et BBS6 KO cochlée 8,39.
Distinguer le rôle des composants ciliaires et de leurs effets distincts sur la signalisation PCP nous donnera une plus grande perspicacité dans le rôle du cil dans l'établissement de la polarité. Il est particulièrement important de faire la distinction entre les protéines ciliaires fonctionnant dans un contexte ciliaire, par rapport aux fonctions non-ciliaires de protéines ciliaires traditionnellement considérées, telles que leur rôle dans la régulation de non-ciliaire liés trafic intracellulaire. Le haut degré de régularité dans de nombreux aspects de la structure cochléaire, y compris les motifs cellulaire et l'orientation faisceau stéréocils, permet de détecter les changements subtils dans le développement de la PCP en réponse soit perturbations génétiques ou moléculaires dans les protéines de cils liés. Considérant qu'il existe des modèles de nombreux ciliaire de souris disponibles, et que la cochlée de souris en développement est l'un des meilleurs endroits pour examiner PCPla signalisation, il est d'un grand intérêt de savoir dans quelle mesure les différents mutations de protéines perturbent le développement de la cochlée.
Déclarations de divulgation
The author declares no competing financial interests.
Remerciements
L'auteur tient à remercier Matthew Kelley, Tiziana Cogliati, Jessica Gumerson, Uwe Wolfrum, Rivka Levron, Viola Kretschmer et Zoe Mann et pour leur évaluation critique du manuscrit. Ce travail a été financé par le Prix Sofja Kovalevskaya (Fondation Humbodlt) et de l'Université Johannes-Gutenberg, Mainz, Allemagne.
matériels
| Name | Company | Catalog Number | Comments |
| Tools/Equipment | |||
| Silicone elastomere - Sylgard 184 | Sigma-Aldrich | 761028-5EA | See Note 2 |
| Micro dissecting scissors-straight blade | Various | ||
| Fine forceps (no. 5 and 55) and blunt forceps | Various | ||
| Dissecting microscope. | Various | ||
| Uncoated glass microscope slides | Various | ||
| Microscope cover slips (22 mm × 40 mm × 0.15 mm) | Various | ||
| Transfer pipettes | Various | ||
| Minutien pins | Fine Science Tools | 26002-10 | |
| SEM sample holder | tousimis | 8762 | |
| Scanning electron microscopy studs | TED PELLA | 16111 | |
| PELCO Tabs: Carbon adhesive | TED PELLA | 16084-3 | |
| Fluorescent Microscope | Various | ||
| Critical Point Dryer | Various | ||
| Scanning Electron Microscope | Various | ||
| Glass microscope slides | Various | ||
| Glass coverslips | Various | ||
| Kimwipe Tissue | Various | ||
| Fine Paint Brush | |||
| Reagents | |||
| 1× Phosphate buffered saline (PBS) | Gibco/Life Technologies | 10010023 | |
| Paraformaldehyde (PFA) (EM Grade Required for EM) | Various | Prepare a 4% solution in 1× PBS made fresh each time. EM Grade Required for EM. | |
| 2.5% Glutaraldehyde Grade1 | Sigma-Aldrich | G5882 | |
| Tris-HCl (pH 7.5) | Various | ||
| NaCl | Various | ||
| CaCl 2 | Various | ||
| Triton X-100 | Various | ||
| Normal Goat Serum | Various | ||
| AffiniPure Fab Fragment Donkey Anti-Mouse IgG (H+L) | Jackson ImmunoResearch | 715-007-003 | |
| Fluoromount-G Mounting media | SouthernBiotech | 0100-01 | |
| 10× Hanks’ Balanced Salt Solution (HBSS) | Gibco/Life Technologies | 14065 | |
| Hepes | Gibco/Life Technologies | 15630-080 | |
| Osmium tetroxide (OsO4 ) | Sigma-Aldrich/Fluka Analytical | 75632 | |
| Tannic acid | Sigma-Aldrich | 403040 | |
| Ethanol 200 proof | Various | ||
| Antibodies | |||
| anti Arl13b | Protein Tech | 17711-1-AP | Suggested concentration 1:1,000 |
| anti acetylated tubulin (611-B1) | Sigma-Aldrich | T6793 | Suggested concentration 1:800 |
| anti gamma tubulin (GTU-88) | Sigma-Aldrich | T6557 | Suggested concentration 1:200 |
| anti Zo_1 | Invitrogen | 40-2300 | Suggested concentration 1:500 |
| Myosin VI | Proteus Biosciences | 25-6791 | Suggested concentration 1:1000 |
| Myosin VIIa | Proteus Biosciences | 25-6790 | Suggested concentration 1:1,000 |
| anti Vangl2 | Merk Millipore | ABN373 | Suggested concentration 1:250 |
| anti Gαi3 | Sigma-Aldrich | G4040 | Suggested concentration 1:250 |
| Alexa Fluor® 488 Phalloidin | Invitrogen/Life Technologies | A12379 | Suggested concentration 1:300 - 1,000 |
| Alexa Fluor® 568 Phalloidin | Invitrogen/Life Technologies | A12380 | Suggested concentration 1:300 - 1,000 |
Références
- Waters, A. M., Beales, P. L. Ciliopathies: an expanding disease spectrum. Pediatr Nephrol. 26, 1039-1056 (2011).
- May-Simera, H. L., Kelley, M. W. Cilia, Wnt signaling, and the cytoskeleton. Cilia. 1, 7 (2012).
- Ross, A. J., et al. Disruption of Bardet-Biedl syndrome ciliary proteins perturbs planar cell polarity in vertebrates. Nat Genet. 37, 1135-1140 (2005).
- Ezan, J., Montcouquiol, M. Revisiting planar cell polarity in the inner ear. Seminars in cell & developmental biology. 24, 499-506 (2013).
- Semenov, M. V., Habas, R., Macdonald, B. T., He, X. SnapShot: Noncanonical Wnt Signaling Pathways. Cell. 131, 1378 (2007).
- Wang, J., et al. Regulation of polarized extension and planar cell polarity in the cochlea by the vertebrate PCP pathway. Nat Genet. 37, 980-985 (2005).
- Montcouquiol, M., et al. Identification of Vangl2 and Scrb1 as planar polarity genes in mammals. Nature. 423, 173-177 (2003).
- May-Simera, H. L., et al. Ciliary proteins Bbs8 and Ift20 promote planar cell polarity in the cochlea. Development. 142, 555-566 (2015).
- Jones, C., et al. Ciliary proteins link basal body polarization to planar cell polarity regulation. Nat Genet. 40, 69-77 (2008).
- Lim, D. J. Functional structure of the organ of Corti: a review. Hearing research. 22, 117-146 (1986).
- Nayak, G. D., Ratnayaka, H. S., Goodyear, R. J., Richardson, G. P. Development of the hair bundle and mechanotransduction. The International journal of developmental biology. 51, 597-608 (2007).
- Denman-Johnson, K., Forge, A. Establishment of hair bundle polarity and orientation in the deveoping vestibular system of the mouse. J. Neurocytol. , 821-835 (1999).
- Sobkowicz, H. M., Slapnick, S. M., August, B. K. The kinocilium of auditory hair cells and evidence for its morphogenetic role during the regeneration of stereocilia and cuticular plates. Journal of neurocytology. 24, 633-653 (1995).
- Denman-Johnson, K., Forge, A. Establishment of hair bundle polarity and orientation in the developing vestibular system of the mouse. Journal of neurocytology. 28, 821-835 (1999).
- van Dam, T. J., et al. The SYSCILIA gold standard (SCGSv1) of known ciliary components and its applications within a systems biology consortium. Cilia. 2, 7 (2013).
- Blacque, O. E., Sanders, A. A. Compartments within a compartment: what C. elegans can tell us about ciliary subdomain composition, biogenesis, function, and disease. Organogenesis. 10, 126-137 (2014).
- Wallingford, J. B., Mitchell, B. Strange as it may seem: the many links between Wnt signaling, planar cell polarity, and cilia. Genes & development. 25, 201-213 (2011).
- Borovina, A., Ciruna, B. IFT88 plays a cilia- and PCP-independent role in controlling oriented cell divisions during vertebrate embryonic development. Cell reports. 5, 37-43 (2013).
- Huang, P., Schier, A. F. Dampened Hedgehog signaling but normal Wnt signaling in zebrafish without cilia. Development. 136, 3089-3098 (2009).
- Ocbina, P. J., Tuson, M., Anderson, K. V. Primary cilia are not required for normal canonical Wnt signaling in the mouse embryo. PloS one. 4, e6839 (2009).
- Jones, C. G. Scanning electron microscopy: preparation and imaging for SEM. Methods Mol Biol. 915, 1-20 (2012).
- Curtin, J. A., et al. Mutation of Celsr1 disrupts planar polarity of inner ear hair cells and causes severe neural tube defects in the mouse. Current biology : CB. 13, 1129-1133 (2003).
- Wang, Y., Guo, N., Nathans, J. The role of Frizzled3 and Frizzled6 in neural tube closure and in the planar polarity of inner-ear sensory hair cells. The Journal of neuroscience : the official journal of the Society for Neuroscience. 26, 2147-2156 (2006).
- Montcouquiol, M., Jones, J. M., Sans, N. Detection of planar polarity proteins in mammalian cochlea. Methods Mol Biol. 468, 207-219 (2008).
- May-Simera, H., Kelley, M. W. Examining planar cell polarity in the mammalian cochlea. Methods Mol Biol. 839, 157-171 (2012).
- Yin, H., Copley, C. O., Goodrich, L. V., Deans, M. R. Comparison of phenotypes between different vangl2 mutants demonstrates dominant effects of the Looptail mutation during hair cell development. PloS one. 7, e31988 (2012).
- Rachel, R. A., et al. Combining Cep290 and Mkks ciliopathy alleles in mice rescues sensory defects and restores ciliogenesis. J Clin Invest. 122, 1233-1245 (2012).
- Jagger, D., et al. Alstrom Syndrome protein ALMS1 localizes to basal bodies of cochlear hair cells and regulates cilium-dependent planar cell polarity. Human molecular genetics. 20, 466-481 (2011).
- Collin, G. B., et al. The Alstrom Syndrome Protein, ALMS1, Interacts with alpha-Actinin and Components of the Endosome Recycling Pathway. PloS one. 7, e37925 (2012).
- Copley, C. O., Duncan, J. S., Liu, C., Cheng, H., Deans, M. R. Postnatal refinement of auditory hair cell planar polarity deficits occurs in the absence of Vangl2. The Journal of neuroscience : the official journal of the Society for Neuroscience. 33, 14001-14016 (2013).
- Sorusch, N., Wunderlich, K., Bauss, K., Nagel-Wolfrum, K., Wolfrum, U. Usher syndrome protein network functions in the retina and their relation to other retinal ciliopathies. Advances in experimental medicine and biology. 801, 527-533 (2014).
- Hebert, J. M., McConnell, S. K. Targeting of cre to the Foxg1 (BF-1) locus mediates loxP recombination in the telencephalon and other developing head structures. Dev Biol. 222, 296-306 (2000).
- Willott, J. F. Chapter 8, Measurement of the auditory brainstem response (ABR) to study auditory sensitivity in mice. Current protocols in neuroscience. , Unit8 21B (2006).
- Martin, G. K., Stagner, B. B., Lonsbury-Martin, B. L., et al. Chapter 8, Assessment of cochlear function in mice: distortion-product otoacoustic emissions. Current protocols in neuroscience. , Unit8 21C (2006).
- Finetti, F., et al. Intraflagellar transport is required for polarized recycling of the TCR/CD3 complex to the immune synapse. Nature cell biology. 11, 1332-1339 (2009).
- Sedmak, T., Wolfrum, U. Intraflagellar transport molecules in ciliary and nonciliary cells of the retina. J Cell Biol. 189, 171-186 (2010).
- Yuan, S., Sun, Z. Expanding horizons: ciliary proteins reach beyond cilia. Annual review of genetics. 47, 353-376 (2013).
- Tarchini, B., Jolicoeur, C., Cayouette, M. A molecular blueprint at the apical surface establishes planar asymmetry in cochlear hair cells. Developmental cell. 27, 88-102 (2013).
- Ezan, J., et al. Primary cilium migration depends on G-protein signalling control of subapical cytoskeleton. Nature cell biology. 15, 1107-1115 (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon