Method Article
Valutazione della Planar-Cell-polarità fenotipi in Ciliopathy mouse Mutant Coclea
In questo articolo
Riepilogo
Primary cilia influence various signaling pathways. The mammalian cochlea is ideal for examining planar cell polarity (PCP) signaling. Cilia dysfunction affects cochlear outgrowth, cellular patterning and hair cell orientation, readouts of PCP. Our goal is to analyze PCP signaling in mouse cochlea via phenotypic analysis, immunohistochemistry and scanning electron microscopy.
Abstract
In recent years, primary cilia have emerged as key regulators in development and disease by influencing numerous signaling pathways. One of the earliest signaling pathways shown to be associated with ciliary function was the non-canonical Wnt signaling pathway, also referred to as planar cell polarity (PCP) signaling. One of the best places in which to study the effects of planar cell polarity (PCP) signaling during vertebrate development is the mammalian cochlea. PCP signaling disruption in the mouse cochlea disrupts cochlear outgrowth, cellular patterning and hair cell orientation, all of which are affected by cilia dysfunction. The goal of this protocol is to describe the analysis of PCP signaling in the developing mammalian cochlea via phenotypic analysis, immunohistochemistry and scanning electron microscopy. Defects in convergence and extension are manifested as a shortening of the cochlear duct and/or changes in cellular patterning, which can be quantified following dissection from developing mouse mutants. Changes in stereociliary bundle orientation and kinocilia length or positioning can be observed and quantitated using either immunofluorescence or scanning electron microscopy (SEM). A deeper insight into the role of ciliary proteins in cellular signaling pathways and other biological phenomena is crucial for our understanding of cellular and developmental biology, as well as for the development of targeted treatment strategies.
Introduzione
cilia primarie sono lunghe appendici microtubuli-based che si estendono dalla superficie della maggior parte delle cellule di mammifero. cilia primaria sono spesso confusi con cilia motilità, di cui ci sono sempre di più per cella, e il cui scopo è quello di spostare il fluido attraverso le superfici della membrana. cilia primaria, in contrasto, adottare ruoli sensoriali e sono quindi anche denominato cilia come sensoriale. Una volta lungo dimenticato, questo organello stato recentemente 'riscoperto' a causa della sua associazione con una moltitudine di malattie genetiche umane 1. Idealmente posizionato come un organello segnalazione, il ciglio primario è stato dimostrato che regolano numerose vie di segnalazione, molti dei quali sono importanti non solo nella omeostasi tissutale e la malattia, ma anche durante lo sviluppo 2.
Una delle prime vie di segnalazione dimostrato di essere associato con una disfunzione delle ciglia è stata la via di segnalazione Wnt non canonico, conosciuta anche come la polarità planare delle cellule (PCP) percorso > 3. Questa cascata di segnali inizialmente identificata in Drosophila, è fondamentale per l'embriogenesi; in particolare per processi di convergenza ed estensione e per il corretto orientamento delle cellule nel piano di epiteli 4. La segnalazione sequenziale di un nucleo insieme di proteine regolatrici traduce indicazioni direzionali che in definitiva portano a riarrangiamenti del citoscheletro e determinano la polarizzazione coordinata di cellule epiteliali in un piano 5. Il processo di convergenza ed estensione è assolutamente necessaria per il condotto cocleare per allungare e per una corretta patterning cellulare 6. Dato che questo è regolato attraverso l'attivazione del pathway PCP, uno dei fenotipi più suggestivi della coclea mutanti PCP è un condotto cocleare accorciato con disorganizzato epiteli sensoriali 7. Allo stesso modo, i mutanti di topo, che mancano di cilia, mostrano anche una tale convergenza ed estensione fenotipo 8,9, anche se con precisione come questo è regolata ancora da chiarire.
ve_content "> Poiché i processi di convergenza ed estensione sono fondamentali per la conseguenza del condotto cocleare, e patterning cellulare del epiteli sensoriali all'interno del condotto cocleare, la coclea in via di sviluppo è un organo ideale in cui esaminare la segnalazione PCP durante lo sviluppo dei vertebrati. L'organo di Corti, il termine dato al dell'epitelio sensoriale specializzato che le linee del condotto cocleare, è composto di cellule di supporto non-sensoriali e cellule ciliate meccanosensoriali che devono essere orientati in modo uniforme per la coclea di funzionare 10. le cellule ciliate meccanosensoriali sono così chiamati a causa della fasci stereociliary che si estendono dalla piastra cuticolare (superficie apicale) di ciascuna cella capelli sensoriale 11. Questi agiscono come trasduttori primari di mechanosensation e nonostante loro nomenclatura come stereocilia, sono in realtà costituiti da actina modificato microvilli filamento-based. da ogni capelli a forma di chevron fascio, tre file di stereocilia sono organizzati in un pa altamente ordinata e regolaresag o ma in un modo simile-scalinata. Reale cilia microtubuli base, kinocilia chiamati, sono necessari per lo sviluppo e l'orientamento dei fasci stereociliary 12. Su ogni cella di capelli, una singola kinocilium è fisicamente collegato al fascio stereocilia, in posizione centrale adiacente alla più alta fila di stereocilia. La funzione precisa della kinocilium non è chiara, e uno ipotesi è che la kinocilium 'tira' stereocilia in forma man mano che maturano da microvilli 12. Nei vertebrati, kinocilia nella coclea sono presenti solo transitoriamente e si ritraggono dalle cellule ciliate nei topi prima della comparsa di sentire 11,13,14.Completa perdita delle ciglia nello sviluppo risultati coclea in condotti cocleari severamente accorciati, mis-formato e mis-orientato bundle stereociliary, così come corpi basali mis-posizionati 8,9. Un cilium funzionale non è solo composto dal axoneme ciliare. Molte proteine associate con ciliafunzione di verifica in complessi localizzate a sottodomini cilia-correlate, quali il corpo basale, zona di transizione, o ciliare axoneme 15. Il corpo basale, derivato dalla centriolo madre del centrosoma, è anche un centro microtubuli organizzando per microtubuli che si estendono lontano dal ciglio nel corpo cellulare e può regolare il traffico intracellulare e il traffico ciliare. La zona ciliare transizione è un'altra regione in cui la funzione ciliare è regolata in termini di organizzazione importazione ed esportazione di composti ciliari 16.
Diversi studi hanno identificato un legame tra ciglia e Wnt non canonica (segnalazione PCP), anche se il meccanismo preciso non è chiaro 17. Ridondanza di ciliari e PCP geni e la sensibilità della polarità delle cellule di anomalie cellulari generalizzate, rendono difficile per collegare direttamente una mutazione a deficit specifici PCP. Uno dei outs di lettura di segnalazione PCP è il posizionamento del corpo basale e primary cilium, quindi segregare il primario dai difetti secondari è impegnativo. Alcuni studi in zebrafish e topo mutanti hanno suggerito alcuna connessione tra le ciglia e Wnt segnalazione 18-20. Le discrepanze nei dati possono riflettere specie, tessuto, o le differenze temporali-dipendente dei contributi ciliari verso segnalazione Wnt. Inoltre, normale risposta Wnt potrebbe essere mantenuta se i corpi basali rimangono funzionale. Uno sguardo più in profondità il ruolo delle proteine ciliari nei percorsi di segnalazione cellulare e altri fenomeni biologici è fondamentale per la nostra comprensione della biologia cellulare e dello sviluppo, nonché per lo sviluppo di strategie terapeutiche mirate.
Protocollo
Uso e l'eutanasia tutti gli animali in conformità con le linee guida e le normative istituzionali e governative, più comunemente tramite CO 2 inalazione e dislocazione cervicale.
1. Preparazione dei reagenti
NOTA: Prima di iniziare, preparare tutti i reagenti che utilizzano prodotti chimici puri per analisi. Fare soluzioni utilizzando grado molecolare distillata e acqua deionizzata, se non diversamente specificato.
- Tampone fosfato (PBS 1x): fare 1 L di PBS 1x sciogliendo 8g NaCl, 0,2 g KCl, 1.44g Na 2 HPO 4 e 0.24g KH 2 PO 4 in 1 L di H 2 O. Regolare il pH a 7,4 con HCl. PBS non deve essere sterile e può essere conservata a temperatura ambiente. Si noti che questo buffer è fatta senza CaCl 2 o MgCl 2.
- Paraformaldeide (4% PFA): Preparare una soluzione al 4% di PFA in 1x PBS in una cappa aspirante ventilato. Aggiungere 40 g di polvere di paraformaldeide al 1 L di PBS 1x. Per sciogliere, mescolare e riscaldare a circa 60 ° C,e aggiungere lentamente NaOH goccia a goccia per aumentare il pH. Una volta che la polvere si è sciolta, regolare il pH a 7,4 con HCl. Filtrare attraverso un filtro da 0,45 micron e congelare aliquote. Scongelare una nuova aliquota per ogni esperimento.
- Triton buffer: Preparare un 0,1 M Tris-HCl (pH 7,5), 0,15 M di NaCl, 0,1% Triton X-100 soluzione sciogliendo 8.77 g di NaCl in 1 L di 0,1 M Tris-HCl (pH 7,5). Aggiungere 1 ml di Triton X-100. Mescolare per sciogliere. Conservare tampone Triton a RT.
- blocco Triton: Preparare 10% di siero di capra in tampone Triton con l'aggiunta di 1 ml di siero di capra a 9 ml di tampone Triton. Conservare a 4 ° C. Se si utilizza anticorpi primari sollevate nel topo, aggiungere capra anti topo-IgG Fab frammenti a una diluizione di 1 a 200 al blocco del Tritone per la fase di blocco.
NOTA: Se si intende utilizzare i campioni per la microscopia elettronica a scansione (SEM), preparare i reagenti aggiuntive, come indicato di seguito. - Soluzione salina bilanciata Hanks '(HBSS), con calcio e magnesio: ottenere una soluzione 1X di HBSS diluendo da una soluzione madrein distillata sterile H 2 O. Come tampone HBSS è complicato da fare e ci sono rischi, si consiglia di ordinare un premade 10x soluzione madre. La concentrazione finale di HBBS del buffer comunemente impiegati è la seguente: 1.26 mM CaCl 2, 0.49 mM MgCl 2 -6H2O, 0,41 mm MgSO 4 -7H2O, 5,33 mM KCl, 0,44 mM KH 2 PO 4, 4.17 mM NaHCO 3, 137.93 mM NaCl , 0,34 mm Na 2 HPO 4, 5,56 millimetri destrosio.
- Hepes buffer: Preparare una soluzione 0,1 M Hepes a 1x HBSS, sciogliendo 23,8 g HEPES in 1 tampone L 1x HBSS.
- Scansione microscopia elettronica fissativo (SEM Fix): Preparare fissativo per SEM diluendo microscopia elettronica grade glutaraldeide (2,5%) e paraformaldeide (4%) in tampone Hepes. Aggiungere CaCl 2 ad una concentrazione finale di 10 mM.
- 1% tetrossido di osmio (OSO 4) in tampone Hepes; 1% tetrossido di osmio in acqua: Diluire una soluzione madre di tetrossido di osmio in tampone Hepes, e separately in sterile distillata H 2 O, ad una concentrazione finale di 1%. Tetrossido di osmio è altamente tossico ed è più comunemente venduto come una soluzione al 4%.
- 1% (w / v) di acido tannico: Sciogliere 0.5 g di acido tannico in 50 ml sterile distillata H 2 O. Filtro sterilizzare filtrando attraverso un filtro con pori 0,45.
- Graded etanolo serie soluzione: Diluire 200 etanolo prova con sterili H 2 O distillata per rendere le soluzioni di 30, 50, 70, 90 e 95% di etanolo. Per i risciacqui etanolo finali, è necessario il 100% di etanolo 200 prove. Utilizzare una bottiglia appena aperta di 200 etanolo prova per i risciacqui finali.
2. Scelta del tessuto
- Idealmente, esaminare gli embrioni o giovani cuccioli di età compresa tra giorno embrionale 16,5 (E16.5) e il giorno postnatale 3 (P3) tra.
NOTA: ossificazione del labirinto osseo e ossa temporali rende la dissezione progressivamente più impegnativo come topi maturano. Inoltre kinocilia, l'unico vero ciglio microtubuli-based trovati su cellule ciliate cocleari,ritrae durante lo sviluppo e non è più presente in topi adulti. - Dopo la fissazione, Decalcificare coclee adulti. Posto sezionato (vedi sezione 3) labirinti ossee, in 2 ml di EDTA (4,13% in PBS), pH 7,3, in una provetta per 3 - 4 giorni con la rotazione. Ricostituire EDTA quotidiano. Dopo che i tessuti sono ammorbidite, sciacquare in 1,5 ml o più PBS 3 volte per 5 minuti su un nutator con una maggiore agitazione.
3. Coclea Dissection
- Euthanization messaggio tramite dislocazione cervicale o di CO 2 inalazione (100% CO 2), togliere la testa. Utilizzare una lama di bisturi o piccolo paio di forbici, a seconda della dimensione dell'animale, per sezionare la testa lungo la linea mediana sagittale cominciando dal naso e si estende caudalmente. Rimuovere il cervello da ogni metà del cranio con un paio di pinze. Identificare le ossa temporali, che contengono i labirinti in via di sviluppo ossee dell'orecchio interno (vedi freccia nella Figura 1A).
- Utilizzare un paio di perCEPS per isolare con cura i labirinti ossei dal cranio (ossa temporali). Fare questo sotto un microscopio da dissezione. Prise via il tessuto osseo dal cranio eseguendo la pinza delicatamente sotto i labirinti ossee. Negli animali fino a P4 i labirinti ossee sono ancora cartilagineo e possono essere facilmente rimossi senza rompersi.
- A seguito di dissezione, utilizzare la punta delle dissettore per cancellare l'ovale e finestre rotonde e fare un piccolo foro nel vertice della spirale cocleare. Fissare i labirinti ossee prima di ulteriori dissezione del dotto cocleare. Per consentire una facile rimozione della membrana tectorial (vedi 3.7), fissare i labirinti ossee in 1,5 ml 4% PFA per 5 minuti in ghiaccio.
NOTA: Se non è richiesta la rimozione della membrana tectorial, si consiglia di fissaggio più lungo (vedi 4,1-4,3). Breve fissaggio delle ossa temporali precedenti dissezione del condotto cocleare aiuta il processo di dissezione e rimozione della membrana tectorial. dissezione Post e l'esposizione dell'organo del Corti, furtè richiesta la sua fissazione. - Ulteriori sezionare i labirinti ossee per esporre l'epitelio sensoriale cocleare come segue. Posizionare i labirinti ossee in un elastomero rivestite piatto dissezione silicone nero contenente PBS per facilitare la dissezione. Utilizzare perni minutien per immobilizzare il tessuto, se necessario. Per utilizzare perni minutien, metterli attraverso la porzione vestibolare dei labirinti ossee con la faccia ventrale della spirale cocleare rivolta verso l'alto.
NOTA: Nero silicone elastomero piatto: Mescolare componente di base elastomero siliconico con polvere di carbone per ottenere un colore nero opaco. Aggiungere l'agente indurente e versare in una o più piastre di Petri (vetro o plastica). Secco sotto vuoto per eliminare le bolle d'aria intrappolate. piatti asciugare completamente prima dell'uso. - Utilizzare una pinza sottile (# 5) per rimuovere la cartilagine esterna esponendo il dotto cocleare. Inizia la finestra ovale; inserire la punta inferiore della pinza nella finestra ovale e sollevare delicatamente aprire la cartilagine, si muove lentamente verso l'alto verso laapice.
- Dopo l'esposizione del condotto cocleare, rimuovere la superficie ventrale membrana della Reissner. Utilizzare un bel paio di pinze per pizzicare membrana della Reissner alla base del condotto cocleare e sfilarlo in un movimento ascendente. Visualizza la faccia dorsale del condotto cocleare, compreso l'epitelio sensoriale.
- Rimuovere la membrana tectorial come descritto di seguito (opzionale). Per SEM o immunoistochimica della kinocilium o fasci stereociliary rimuovere la membrana tectorial.
- Utilizzare un bellissimo paio di pinze (# 55 o più fine) per pizzicare la membrana tectorial alla base della coclea e la buccia verso l'alto verso l'apice.
NOTA: La membrana tectorial è otticamente trasparente che rende difficile l'identificazione. Più spesso la membrana si stacca in un unico pezzo e anche se non è facilmente visualizzato, si può sentire la resistenza mentre viene tirato fuori dall'organo esposta di Corti. - Dopo aver esposto l'organo del Corti, fissare ulteriormente il tessuto come described sotto. Conservare la regione vestibolare per facilitare le operazioni di preparazione dei tessuti.
4. Fissazione
- Per l'immunoistochimica regolare risolvere i labirinti ossee sezionati in 1,5 ml 4% PFA a 4 ° C su un nutator per 2 ore.
NOTA: A causa della sensibilità dei diversi anticorpi e antigeni, variazioni nella lunghezza e la composizione di determinazione può essere richiesto e dovrebbe essere ottimizzato per ciascun anticorpo. - Dopo la fissazione, lavare i campioni con il risciacquo in 1,5 ml o più PBS 3 volte per 5 minuti su un nutator con una maggiore agitazione. I campioni possono essere conservati in PBS a 4 ° C per diverse settimane prima di elaborare.
- Se la preparazione dei campioni per SEM, fissare sezionato ossa temporali in SEM correzione (vedi 1.7) per 2 ore a temperatura ambiente. Lavare sciacquando in 1,5 ml o più Hepes tampone 3 volte per 5 minuti su un nutator con una maggiore agitazione. Conservare in tampone Hepes a 4 ° C fino ad ulteriore lavorazione. Bagagli per più di un paio di settimanes non è raccomandato.
5. immunoistochimica
- Eseguire immunoistochimica su campioni sezionati in un pozzetto di una piastra da 96 pozzetti a fondo piatto. In alternativa, utilizzare una PCR o provetta. Si consiglia di conservare la porzione vestibolare del labirinto osseo per facilitare l'elaborazione.
- Permeabilize tessuto incubando in 1,5 ml di tampone Triton per 1 ora a RT su un nutator con agitazione.
- Bloccare il tessuto incubando in 0,5 ml blocco Triton per almeno 1 ora a RT. Se si utilizza anticorpi primari sollevate nel topo, aggiungere frammenti anti-topo IgG Fab al blocco a una diluizione di 1 a 200 (vedi paragrafo 1.4). Questo diminuisce notevolmente legame di IgG anti-topo al tessuto topo non specifico.
- Incubare il tessuto con anticorpi primari diluiti in Triton blocco O / N a 4 ° C con agitazione. diluizione degli anticorpi dipende anticorpi in uso (vedere paragrafo 6.1). In alternativa incubare antibodie primarias per 2 ore a temperatura ambiente. Idealmente utilizzare un volume minimo di 0,5 ml di diluizione anticorpo primario. Se anticorpo è limitata, utilizzare il più piccolo volume di diluizione anticorpo che avvolge completamente il tessuto.
- Lavare il tessuto con il risciacquo in 1,5 ml o più tampone Triton, un minimo di 3 volte per 15 minuti, su un nutator con una maggiore agitazione.
- Incubare il tessuto con anticorpi secondari fluorescenti colorante coniugato diluiti ai produttori concentrazione negativa (tipicamente 1: 200-1: 1000) nel blocco Triton per 1 ora a RT su un nutator. Utilizzare un volume minimo di 0,5 ml di diluizione anticorpo secondario.
- Centrifugare l'anticorpo secondario diluito a 13.000 xg per 3 minuti prima dell'uso per ridurre al minimo legame non specifico degli aggregati anticorpo secondario. Proteggere il tessuto dalla luce da questo punto in poi per evitare photobleaching dei coloranti fluorescenti.
- Come nella fase 5.5, lavare il tessuto da risciacquo in 1,5 ml o più Triton tampone, un minimo di 3 volte per 15 minuti, su unnutator con una maggiore agitazione. Conservare i campioni in PBS a 4 ° C fino al momento di montare.
6. Selezione Anticorpo
NOTA: La fonte di anticorpi raccomandati e le loro diluizioni sono elencati nella tabella dei materiali e attrezzature specifiche. Eseguire le incubazioni anticorpi come descritto nella sezione 5.
- Per visualizzare il kinocilium microtubuli-based, utilizzare un ciliare axoneme marcatore come anti-Arl13b (1: 1.000) o anti-acetilata-α-tubulina (1: 800). Visualizzare corpo basale utilizzando un anticorpo contro γ-tubulina (1: 200) o qualsiasi altro marcatore centrosomica.
- Per visualizzare i actina ricco di filamenti fasci stereociliary, aggiungere falloidina (1: 300 - 1.000) coniugata con uno dei diversi fluorofori diversi per l'incubazione anticorpo secondario. Falloidina etichette anche altre strutture filamentose di actina, tra cui i filamenti di actina corticale che circondano la periferia di ogni cella capelli epiteliale. Questo è utile per determinareil contorno di ciascuna cella capelli. Utilizzare un marcatore membrane alternative come anti-Zo-1 (1: 500), se necessario.
- Etichetta cellule ciliate cocleari utilizzando anticorpi contro la miosina VI (1: 1.000) o miosina VIIa (1: 1.000). Questi possono essere usati se valutare lunghezza coclea.
NOTA: L'uso appropriato fluorescenti anticorpi secondari colorante coniugato ottimizzati per le esigenze microscopio.
7. Montaggio e Imaging
- Trasferire il campione in un nero piatto elastomero siliconico contenente PBS. Utilizzando una pinza sottile, rimuovere la regione vestibolare dalla spirale cocleare.
- Molto rimuovere con attenzione la cartilagine sottostante e mesenchima dalla spirale cocleare. La spirale cocleare rimanente contiene il solco interno, organo del Corti e solco esterno.
- Trasferire la spirale cocleare in una goccia di PBS posto su un vetrino da microscopio. Se lo si desidera, separare la spirale cocleare in pezzi equivalenti a un giro. Questo passaggio non è necessario tuttavia, e può portare a loss del tessuto. La superficie apicale (lato stereociglia) delle cellule ciliate cocleari deve essere rivolto verso l'alto verso il vetrino.
- Wick via la PBS con un tessuto assorbente o un pezzo di carta da filtro e delicatamente riposizionare la spirale cocleare se gli epiteli è spostato e si sovrappone su se stesso.
- Aggiungere una goccia di mezzi di montaggio direttamente sul campione coclea e delicatamente mettere un coprioggetto sulla parte superiore, avendo cura di evitare bolle d'aria. Non sono necessari distanziatori; posizionare il coprioggetto direttamente sul campione. Si raccomanda una, non fluorescente solubile in acqua, mezzo di montaggio semipermanente che non richiede ulteriori misure per contenere il vetrino in posizione. supporti di montaggio e spessore coprioggetto dovrebbero essere abbinati al microscopio specifiche.
- Utilizzare un microscopio epifluorescente o confocale a scansione laser dotato di alto ingrandimento (63 - 100X), ad alta apertura numerica (1,2-1,4) obiettivi per catturare le immagini della superficie apicale della cellula capelli cocleare. Utilizza loobiettivi wer (5 - 20X) per prendere immagini sovrapposte della spirale cocleare per quantificare la lunghezza del condotto cocleare. laser di eccitazione partita e filtri di emissione di fluorofori utilizzati per gli anticorpi secondari.
8. Scanning Electron Microscopy
- Continuare dal paragrafo 4.3. Dopo aver lavato i campioni SEM fisse in tampone Hepes, effettuare le seguenti operazioni sotto ventilazione. Il seguente protocollo funziona bene per il tessuto coclea ed evita l'uso del rivestimento a polverizzazione con un metallo conduttivo.
- Post-fix in 1% OsO 4 in Hepes tampone per 1 ora, seguito da 3 lavaggi con 1 ml di acqua distillata per 5 minuti ciascuna. Il più piccolo volume di OsO 4 che avvolge completamente il tessuto deve essere usato per ridurre rifiuti tossici. Non è richiesta alcuna agitazione.
- Incubare campioni a RT in ciascuna delle seguenti soluzioni per 1 ora con 3 lavaggi con 1 ml di acqua distillata per 5 minuti ciascuna tra fasi: Acido tannico 1% preparata in acqua e filtrato prima dell'uso; 1% OsO 4 in acqua, acido tannico 1% in acqua, 1% OsO 4 in acqua.
- Disidratare campioni attraverso una serie graduata di etanolo mediante incubazione per 10 min in ciascuna delle seguenti diluizioni: 30, 50, 70, 90 e 95%. Non è richiesta alcuna agitazione.
- campioni di trasferimento attraverso tre cambi, 5 minuti ciascuno, su 100% di etanolo (da una bottiglia di recente apertura di 200 etanolo prova).
- Eseguire i campioni anche se un punto secco critica seguenti istruzioni del produttore.
- Montare i campioni utilizzando adesivo carbonio conduttivo sopra un stub SEM prima di imaging su un microscopio elettronico. Sotto uno stereomicroscopio, utilizzare un paio di pinze sottili e un pennello per posizionare delicatamente il campione con gli epiteli cocleari rivolto verso l'alto. Utilizzare la porzione vestibolare del campione 'anchor' il tessuto allo stub. Conservare i campioni in un essiccatore fino a quando l'imaging. Eseguire l'imaging SEM come descritto in Jones (2012) 21.
9.quantificazione
- Dopo la preparazione immunoistochimica, di acquisire le immagini utilizzando un epifluorescente o confocale a scansione laser microscopio. Dopo la preparazione per SEM, utilizzare un microscopio elettronico a scansione di immagine esemplari. Immagine superficie apicale dell'organo di Corti con le cellule ciliate cocleari a vista e le cellule di supporto intercalate.
- Definire posizioni specifiche lungo il condotto cocleare, come ad esempio 25, 50, e 75% dalla base e utilizzare questi per confrontare regioni coclea tra i campioni mutanti e di controllo. Analizzare e confrontare i mutanti ciglia con i loro controlli littermate, come le differenze di background genetico possono modificare il fenotipo cocleare.
NOTA: L'organo di Corti sviluppa in un gradiente che si estende dalla metà di base sia verso l'apice e la base. Nel topo, sviluppo non è completa fino P14, quindi è importante confrontare regioni a stadi di sviluppo simili e posizioni. - Scattare foto utilizzando il software che accompagna il microscopio che permesso fumarew per la quantificazione della particolare fenotipo come richiesto (vedi sotto). Utilizzare un'immagine software di analisi come J immagine o software che accompagna il microscopio per misurare lunghezze, contare le cellule e determinare la localizzazione delle proteine come descritto di seguito. Grafico questi dati come un grafico a barre, grafico a dispersione, scatola macchia o istogramma, confrontando il controllo contro mutante.
- La lunghezza totale del condotto cocleare (Figura 3A):
- Utilizzando un marker delle cellule dei capelli o falloidina, (che segna i fasci stereociliary), determinare e misurare in cui l'epitelio sensoriale inizia e finisce. La lunghezza del condotto cocleare è spesso abbreviato in mutanti ciglia.
- Anomalie fascio Stereociliary (Figura 3B, D, E, G):
- Misura convessità fascio (altezza) come la distanza più breve tra il vertice del fascio e la linea che si estende attraverso entrambe le estremità 'bracci' il fascio come mostrato in figura 3G, partita. In alternativa, quantificare la zonaoggetto degli braccia di esterno cella capelli fascio stereociliary come mostrato in figura 3G, destra. Se le cellule dei capelli con fasci stereociliary circolari possono essere identificati contano questi come percentuale di cellule totale dei capelli.
NOTA: In molti mutanti ciliari anomalie bundle può essere osservato indipendentemente dall'orientamento fascio. E 'difficile quantificare con precisione anomalie fascio stereociliary.
- Misura convessità fascio (altezza) come la distanza più breve tra il vertice del fascio e la linea che si estende attraverso entrambe le estremità 'bracci' il fascio come mostrato in figura 3G, partita. In alternativa, quantificare la zonaoggetto degli braccia di esterno cella capelli fascio stereociliary come mostrato in figura 3G, destra. Se le cellule dei capelli con fasci stereociliary circolari possono essere identificati contano questi come percentuale di cellule totale dei capelli.
- Orientamento dei fasci stereociliary (Figura 3B, C, G):
- Valutare l'orientamento di ogni singolo fascio rispetto ad una linea che si estende perpendicolare alla fila di celle pilastro che separa le cellule ciliate interne ed esterne. Cellule con un orientamento normale sono allineati lungo questo asse perpendicolare e quindi hanno una rotazione di 0 °. Determinare angoli di rotazione utilizzando una notazione 360 ° o scostamenti assoluti da 0 °.
- Posizionamento Kinocilia o posizionamento fascio stereociliary (Figura3B, F, H):
- Conta la percentuale di cellule in cui kinocilia mancano. Misurare la distanza dal kinocilium al 'vertice' o il centro del fascio. Il 'vertice' del fascio può non essere facile definire se fasci sono anormali, e quindi il centro del fascio possono essere utilizzati.
- Quantificare la posizione di kinocilia e fasci stereociliary sulla superficie cellulare apicale capelli, sovrapponendo una griglia posizionale su ciascuna cella capelli e segna la posizione di una base del kinocilium o vertice / centro del fascio stereociliary. Visualizzare i dati come percentuale di ciascuna categoria che si trova all'interno di una regione specifica della griglia, e sovrapponendo le posizioni di ciascuna marcatura su una griglia posizionale.
NOTA: Nei tessuti di controllo, kinocilia sono sempre collegato al vertice del fascio stereociliary. In mutanti ciglia, kinocilia sono spesso mancano, ma mislocalized ancora attaccato, o addirittura completamente distaccato dalle sfascio tereociliary. - Lunghezza Kinocilia (Figura 3I):
- Misurare la lunghezza del kinocilium etichettando con un pennarello ciliare axoneme. Unica misura kinocilia che rimangono piatte in un piano confocale a 1,5 micron. Verificare che le ciglia sono distesi osservando una vista in sezione trasversale del tessuto scansionato. Confronto campioni misti invecchiati dalla stessa regione della coclea poiché la kinocilium ritrae durante lo sviluppo.
- Mislocalization di proteine di polarità:
- A seguito di immunoistochimica utilizzando anticorpi contro le proteine di polarità, come Vangl2 e Gαi3, determinare la localizzazione tramite imaging.
NOTA: In alcuni mutanti ciglia, la localizzazione delle proteine di polarità è perturbato. Questi includono Vangl2 e Gαi3, che hanno dimostrato di essere interrotta in Ift20, Bbs8 e Bbs6 coclea mutante.
NOTA: Ulteriori esempi di come quantificare e Polarit cellule capelli visualizzazioney si possono trovare nei seguenti documenti. Curtin, et al. (2003) Current Biology 22, Montcouquiol, et al. (2003) Natura 7, Wang, et al (2006) The Journal of Neuroscience 23, Montcouquiol, et al. (2008) Methods in Molecular Biology 24, maggio-Simera, et al. (2012) Methods in Molecular Biology 25, Yin et al (2012) PLoS One 26.
Risultati
Coclea dissezione e Preparazione del tessuto
Dopo la rimozione del cervello, dopo mezzeria dissezione sagittale di una testa P0 mouse, labirinto osseo, visto da dietro, può essere visualizzato (Figura 1A, freccia bianca) e rimosso. Figura 1B mostra i labirinti ossee isolate con i capelli cocleare rivolto verso l'alto, ventrale, (a sinistra) e da dietro, dorsale (a destra). La freccia bianca alla finestra ovale da cui si può iniziare a rimuovere la cartilagine esterna. Una volta che la cartilagine esterno è stato completamente rimosso, il condotto cocleare esposto, ancora intatto, si può osservare (Figura 1C). è mostrato posizionamento di un perno attraverso la regione vestibolare per aiutare dissezione. Due perni, disposti ad angoli diversi possono anche essere utilizzati per ancorare il tessuto. Figura 1D mostra il dotto cocleare dopo la rimozione della Reissner '; S membrana e la membrana tectorial (sinistra) e l'isolato cocleare spirale epiteliale una volta che è stato isolato dalla regione vestibolare in preparazione montaggio per immunoistochimica (destra). Per dare un'idea generale di ciò capelli cocleare esposto sembra, una preparazione SEM intatto è mostrato nella Figura 1E.
Morfologia e immunofluorescenza nel controllo Coclea
Dopo la preparazione del tessuto cocleare, la superficie dorsale del condotto cocleare contenente l'organo del Corti è esposta e può stato visualizzato tramite SEM o colorazione immunofluorescenza. Visto come preparazione tutto il montaggio, le quattro file di cellule cigliate meccanosensoriali (una fila di villi interni e tre file di cellule cigliate esterne) possono essere distinti. La Figura 2A mostra una vista basso ingrandimento del giro basale da una coclea embrionali di topo , preparata fo SEM. Notare l'orientamento uniforme e allineamento dei fasci stereociliary actina-based. Inoltre la morfologia dei fasci stereociliary è coerente, ogni fascio ha la forma classica ")" (su cellule ciliate interne) o "W" (su cellule ciliate esterne). A ben ingrandimento a questa età microvilli aggiuntivi possono essere visti non solo sulla superficie apicale delle cellule capellute, ma anche in-tra le cellule ciliate sulle cellule di sostegno (Figura 2B). Questi recedere lasciando solo tre file di fasci stereociliary sulle cellule ciliate esterne e due sulle cellule ciliate interne negli adulti. Come si vede nella Figura 2C (freccia bianca), un singolo kinocilium microtubuli base (un vero cilium primario) si trova adiacente alla più alta fila di stereocilia al vertice di ogni fascio stereociliary. Questi sono allegati al fascio tramite link kinocilia.
etichettatura fluorescente con falloidina, che labEls actina, mette in evidenza l'orientamento uniforme e la forma dei fasci di tessuto di controllo (Figura 2D). actina corticale è anche indicata, che è utile per determinare la circonferenza apicale di ogni cella singolo pelo. Co-etichettatura con falloidina e un anticorpo contro miosina 7a (Figura 2E), un marker delle cellule dei capelli, aiuta anche a distinguere tra le cellule dei capelli e le cellule di supporto. Miosina 7a è anche un indicatore utile per misurare l'estensione dotto cocleare (vedi Figura 3A). Un anticorpo contro acetilata-α-tubulina è comunemente utilizzato per identificare il kinocilium microtubuli base (Figura 2F). Come le cellule di supporto ospitano anche cilia primaria, è importante distinguere tra cilia provenienti da cellule ciliate vs. intercalanti cellule di supporto. Un marcatore di membrana addizionale come anticorpi contro ZO-1 (Zona occludere 1), che delinea chiaramente il patterning mosaico della membrana apicale del condotto cocleare, è quindi disponibile ( Figura 2F). Di ulteriore considerazione è che gli anticorpi contro acetilata-α-tubulina etichetta anche microtubuli interne e quindi la cura dovrebbe essere presa quando l'imaging a concentrarsi sulla superficie apicale delle cellule dei capelli. I microtubuli nelle cellule pilastro sono particolarmente densi (Figura 2G, asterisco bianco). Una combinazione di falloidina ed etichettatura anti-acetilata-α-tubulina è spesso usato per identificare contemporaneamente fasci stereociliary e kinocilia vicini (Figura 2G, freccia bianca).
Fenotipo Cochlear in Cilia Mutants
Allungamento del condotto cocleare è uno dei migliori outs lettura di difetti di convergenza ed estensione, e condotti cocleari accorciati sono comunemente osservata nei mutanti PCP classici. La coclea in mutanti ciliari spesso hanno accorciato dotti cocleari e un rilevante ampliamento della epitelio sensorialelia al vertice, come si è visto in Ift20 CKO / CKO topi (Figura 3a). Un altro difetto PCP classica è perturbazioni l'orientamento uniforme delle cellule ciliate cocleari, come si può vedere nelle Bbs8 - / - topi sia con immunoistochimica (Figura 3B, freccia destra) e con SEM (Figura 3C). Oltre a fasci mis-oriented, appiattite e fasci deformi sono anche comunemente osservati (Figura 3B, freccia centrale, la figura 3D). Spesso circolari fasci, come può stato visto in Figura 3E, sono presenti, soprattutto nelle cellule cigliate completamente prive di kinocilia. Mis-localizzazione del kinocilium è anche comune.
Il kinocilium mis-localizzato può o non può essere attaccato al fascio stereociliary (Figura 3B, freccia a sinistra, la figura 3F). Esempi di come quantificare buorientamento e kinocilia ndle o posizionamento fascio sono mostrati in figura 3G e 3H. L'orientamento di ogni singolo fascio può essere valutata determinando la rotazione della relativa del fascio ad una linea che si estende perpendicolare alla fila di celle pilastro che separa le cellule ciliate interne ed esterne. Le cellule con un orientamento normale sono allineati lungo questo asse perpendicolare e così avere una rotazione di 0 ° (Figura 3G). La posizione del kinocilium, o al centro del fascio stereociliary, può essere tracciata sovrapponendo una griglia posizionale sulla superficie luminale delle cellule capellute e quindi determinare la posizione dei kinocilia o bundle all'interno della griglia (Figura 3I). Le mutazioni nei geni ciglia spesso influenzano la lunghezza delle ciglia, e così la lunghezza della kinocilium possono essere valutati. In CEP290 mutanti rd16 / rd16, kinocilia sono più lunghi rispetto ai controlli (Figura 3J). Come le ritrae Ciglio,è fondamentale avere compagni di figliata di età abbinato e di prendere le misure dalla stessa regione della coclea. Per ottenere buone immagini per l'analisi e la quantificazione, sia per immunoistochimica e SEM, è fondamentale per rimuovere la membrana tettoria. La figura 3F mostra una microfotografia SEM in cui la membrana tectorial non è stato completamente rimosso.
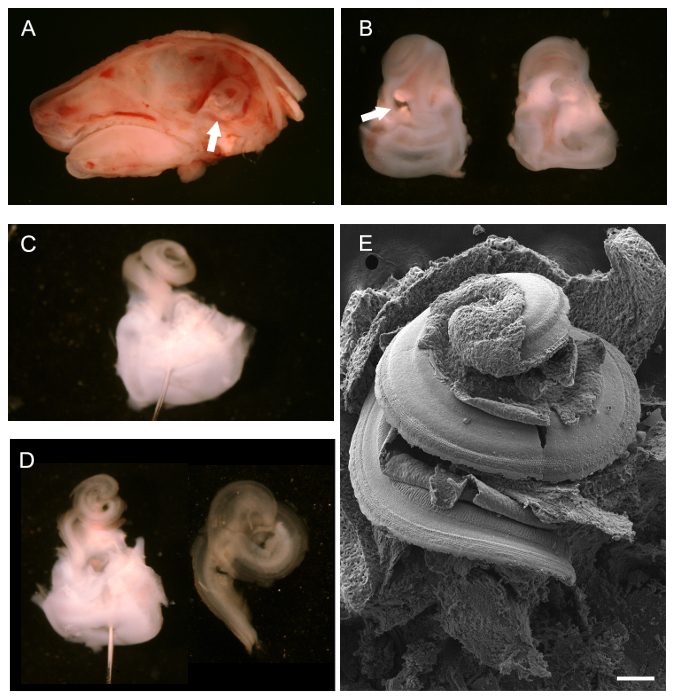
Figura 1. La dissezione di un mouse Coclea in via di sviluppo (P0). (A) Mid-line dissezione sagittale della testa P0 del mouse con il cervello rimosso. La freccia bianca alla posizione del labirinto osseo. (B) ventrale (a sinistra) e dorsale (a destra) vista labirinti ossee sezionati. La coclea è situato verso la parte superiore con la porzione vestibolare nei punti freccia bianca fondo alla finestra ovale. (C) Il labirinto osseo popparimozione er della cartilagine esterna della coclea. Un perno è inserito attraverso il sistema vestibolare. (D) sinistra, analoga alla C dopo la rimozione della membrana di Reissner e tectorial. A destra, isolato dotto cocleare pronto per il montaggio. Microscopio elettronico (E) Scansione di intatto, spirale cocleare esposto esponendo il pavimento del condotto cocleare, compreso l'epitelio sensoriale. barra della scala è di 100 micron. . (A - D) adattato da maggio-Simera et al 2012 25 Si prega di cliccare qui per vedere una versione più grande di questa figura.

Figura 2. Morfologia e immunofluorescenza a controllo coclea (A - C). Microscopio elettronico a scansione del tur basalen in embrionali (E18.5) Tipo di coclee selvaggio. Una fila di cellule interne di capelli (in basso) e tre file di cellule ciliate esterne (in alto) sono separati e intercalate da cellule di sostegno. a forma di Chevron fasci stereociliary orientano uniformemente verso il bordo laterale di ciascuna cella di capelli (bordo superiore dell'immagine). A E18.5 microvilli supplementari coprono le superfici apicali delle cellule cigliate, sotto i fasci stereociliary, e cellule di sostegno intercalate (B). (C) Un kinocilium singolo microtubuli base (freccia bianca), si trova al vertice del fascio, mostrata qui dal bordo laterale. (D - G) immunofluorescente colorazione basale dopo turno natale giorno 1 (P1) wild type coclee. Falloidina etichette actina filamentosa in stereocilia e actina corticale alla periferia delle cellule (D, E, G). Miosina 7a è un marcatore per cellule ciliate interne ed esterne (E). Zo_1 etichette le giunzioni strette in-tra le cellule, il che rende un grande indicatore per distinguere Bounda cellulareRies (F). Acetilato α-tubulina è utilizzato come marcatore della kinocilium al vertice del fascio (F, G freccia bianca). Microtubuli interni sono anche etichettati da acetilata α-tubulina, che sono soprattutto abbondante nelle cellule pilastro (G asterisco bianco). Scala barre A: 10 micron, B: 5 micron, C: 1 micron, DG:. 5 micron Clicca qui per vedere una versione più grande di questa figura.
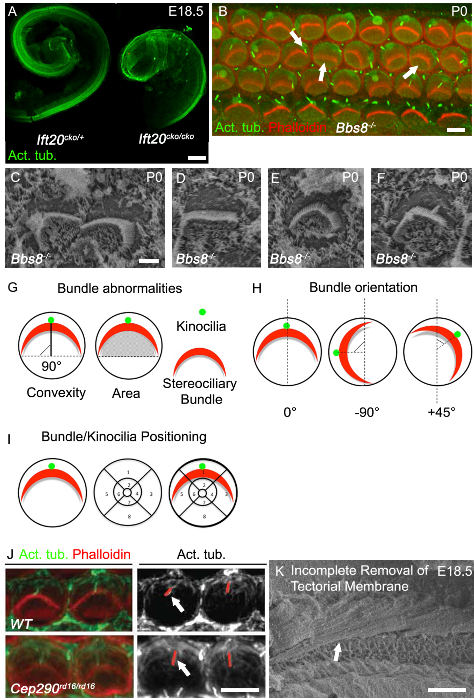
Figura 3. Cochlear fenotipo in Cilia Mutants. (A) accorciamento marcata di Ift20 CKO / CKO dotti cocleari rispetto al controllo. Sezionato condotti cocleari a E18.5 macchiati di tubulina acetilato. (B ) intere immagini di montaggio delle sua volta cocleare basale in Bbs8 - / - mutante (P0). Phalloidin marcato actina filamentosa, stereocilia (rosso), tubulina acetilato, kinocilia (verde). Fasci Stereociliary in Bbs8 - / - coclee sono ruotati variabile (freccia a destra), appiattite e / o mislocalized (freccia al centro). Kinocilia sono mislocalized o assonemi mancano (freccia a sinistra). (C - F) superiore ingrandimento SEM di fasci stereociliary e kinocilia in Bbs8 - / - OHC. In C, ruotare fasci, in D, appiattite fascio, in E, fasci circolari e in F mislocalized kinocilia. (G - I) rappresentazioni schematiche del fascio quantificazione anomalia. (G) a sinistra, Fascio convessità (altezza); la distanza più breve tra il vertice del fascio e la linea che si estende attraverso entrambe le estremità delle 'braccia' fascio. come depicted dalla linea nera solida. A destra, l'area sotto il fascio; l'area. (H) rappresentazioni schematiche dei criteri utilizzati per quantificare l'orientamento di fasci stereociliary. L'angolo di rotazione del fascio è calcolata rispetto ad una linea che si estende perpendicolare alla fila di celle pilastro. (I) Rappresentazione schematica dei criteri per l'analisi posizionale di kinocilia e fasci stereociliary. Una griglia segmentata è posta sulla circonferenza della cella capelli e la posizione osservato. (J) immagine Superiore ingrandimento di fasci phalloidin marcato stereocilia (rosso) e kinocilia tubulina marcato acetilati (verde) di cellule ciliate esterne in P0 coclea. Nel pannello monocromatica adiacente, linee rosse identificano le kinocilia, che sono più in Cep29 mutanti rd16 / rd16 rispetto al controllo (frecce bianche). (K) Micrografia SEM della coclea embrionale con rimozione incompleta tectorial. Scalabar A: 100 micron, B: 5 micron, C - F: 2,5 micron, I: 5 micron, J: 50 micron. (A - F)... Modificato da maggio-Simera et al 2015 8, J Ristampa con il permesso di Rachel et al 2012 27 Si prega di cliccare qui per vedere una versione più grande di questa figura.
Discussione
Quando si prepara il tessuto cocleare per l'analisi, ci sono alcuni punti chiave da tenere a mente. In primo luogo, le differenze di background genetico possono modificare il fenotipo cocleare, rendendo necessario analizzare e confrontare solo i controlli littermate. In secondo luogo, la rimozione completa della membrana tectorial è necessaria per ottenere le migliori immagini con immunoistochimica ed è essenziale per SEM. La membrana tectorial è una struttura opaca e può oscurare le cellule dell'epitelio sensoriale direttamente sotto di essa, rendendo l'imaging più impegnativo. Di tanto in tanto durante la lavorazione, la membrana tectorial può ridursi indietro, scoprendo le cellule ciliate. Anche in questi casi la rimozione è fortemente consigliato. Questo passaggio richiede pazienza e pratica. In terzo luogo, immunoistochimica utilizzando anticorpi contro le proteine ciliari, in particolare quelli che localizzano al corpo basale altamente compatto, può essere impegnativo e richiedono l'ottimizzazione. Considerare l'esecuzione di recupero dell'antigene, intensificando il permeabilzione passi, o diminuendo la concentrazione o il tempo di fissazione. Infine, quando l'imaging la kinocilium (il ciglio primario trovato sulle cellule ciliate cocleari) tenere a mente che comincia a ritrarre da P0 - P1 in poi in un gradiente di base-a-apice. Pertanto, quando si misura la lunghezza del kinocilium è importante confrontare cellule ciliate dalla stessa regione della coclea e negli animali di età corrispondente. Le cellule di supporto intercalate hanno anche cilia primaria, che non si ritrae. Bisogna fare attenzione a distinguere tra il sostegno cilia delle cellule e kinocilia cellule dei capelli.
Come topi maturo, diventa sempre più difficile isolare nettamente gli epiteli sensoriali cocleare, causa la calcificazione delle ossa temporali e labirinti ossee. è necessaria la decalcificazione del tessuto, che non sempre è compatibile con ulteriori tecniche immunolocalizzazione ma non consentono di esame del fenotipo lordo ed è anche compatibile con preparazione SEM. str Inbred del mouseAINS spesso mostrano difetti uditivi come la perdita di cellule dei capelli o elevate risposte uditiva del tronco encefalico (ABR), a causa di mutazioni in geni noti o uditive geni modificatori. Pertanto, è essenziale per confrontare età corrispondenza controlli littermate o razza su un background genetico alternativo.
Uno dei limiti di questa analisi è che, nei topi, la kinocilium inizia a chiudersi dopo la nascita e non è più presente sulle cellule adulte capelli. Per questo motivo le misure kinocilia può essere fatto solo in via di sviluppo del tessuto. Inoltre è necessario selezionare con cura i controlli appaiati per età per i confronti tra i campioni mutanti e di controllo. Un'altra limitazione è che i topi mutanti ciliari analizzati finora non visualizzano grave disfunzione uditiva (es., Le risposte uditiva del tronco encefalico, ABRs o emissioni otoacustiche, OAE) anche quando lo sviluppo cocleare è compromessa. Coerentemente con questo, difetti acustici non sono un fenotipo comune ciliopathy umana. Eccezionalmente, la perdita di hearing è una delle caratteristiche principali della sindrome di Alström, causate da mutazioni nel basale proteina corpo ALMS1 28,29. Ciò suggerisce che la morfologia stereociliary pacchetto non è necessariamente legata alla disfunzione uditiva in mutanti ciglia, probabilmente a causa del riorientamento correttiva dei fasci successivamente in fase di sviluppo, come è stato riportato per Vangl2 CKO mutanti 30. Se lo spettro ciliopathy si allarga per includere Sindrome di Usher, la causa congenita più comune di sordo-cecità, quindi disfunzione uditiva diventa molto rilevante. Dati recenti hanno dimostrato che diverse proteine correlate alla sindrome di Usher localizzare anche al ciglio e sono coinvolti nei processi ciliari legati 31, ma se queste proteine si riferiscono alla segnalazione PCP non è ancora stato esaminato.
Fino ad oggi la maggior parte dei mutanti di topo ciliare analizzati per difetti PCP cocleari sono stati solo vagamente esaminati. Le tecniche descritte in questo manoscritto consentono un'ampia dettaglio dellafenotipo cocleare, che sicuramente porterà ad una più precisa comprensione del coinvolgimento ciliare nello stabilire vertebrati segnalazione PCP. Nonostante il gran numero di modelli di topo ciliopathy disponibili, sorprendentemente pochi sono stati analizzati in termini di difetti PCP cocleari. Un errore comune associato a questi modelli è letalità embrionale. Tuttavia, poiché la coclea di sviluppo può essere esaminata embrionalmente il ruolo delle ciglia in PCP nell'orecchio sviluppo può ancora essere esaminati. Inoltre, molto presto letalità embrionale può essere aggirato utilizzando ko condizionali. Foxg1 Cre 32 topi, disponibili da JacksonLaboratories, sono comunemente utilizzati per inactivategenes di interesse in thedeveloping nell'orecchio interno a partire dalla data E8.To, gli sforzi si sono concentrati principalmente sull'esame geni ciliopathy che provocano la malattia , tuttavia l'esplorazione di altre proteine correlate ciglia e come queste influenzano la segnalazione PCP durante lo sviluppo può fornire una maggiore comprensione cilbiologia ia e funzione.
Se un fenotipo uditivo si sospetta nei modelli di topo in fase di analisi, possibili ulteriori analisi includono test audiometrici di ABRs 33 o 34 OAE. Saggi di Cochlear estensione espianto (come descritto in maggio-Simera et al. 2012 25), possono essere eseguite anche e consentono l'identificazione di difetti di estensione convergenti in precedenti momenti di sviluppo. Coltura di espianti coclea consente anche per il trattamento di vari attivatori o inibitori di segnalazione, che può modificare l'estensione espianto, contribuendo così alla comprensione meccanicistica dei processi di sviluppo coinvolti. Anche se è noto che la kinocilium ritrae dopo la nascita 11,13,14, questo distacco, non sono stati affrontati nel contesto di mutanti ciliari. Sarebbe di interesse per prendere le misure specifiche in tempo di kinocilia comparsa e svincolo in cilia mutants.Considering che un ruolo primario per ciliare proproteine è il movimento di merci lungo i microtubuli, è molto probabile che queste proteine possono anche regolare gli aspetti del traffico intracellulare lungo il citoscheletro 35-37. Un sottoinsieme di proteine ciglia hanno mostrato di influenzare il traffico e localizzazione asimmetrica di molecole PCP 8. La localizzazione mediante immunoistochimica delle molecole PCP, proteine particolarmente associata alla membrana, come Vangl2, Frz3 e Dsh, si raccomanda quindi di stabilire se le molecole PCP sono mislocalized. Istituzione di polarità sembra essere un affare multiforme, e ci sono prove di montaggio per un ulteriore percorso di autonomia delle cellule, che è anche necessario per il corretto PCP in cellule ciliate sensorie 38. Uno studio recente ha dimostrato che G segnalazione proteina-dipendente controlla la migrazione del cilium in maniera cellula-autonomo 39. Coerentemente con un ruolo per le proteine ciliari nella localizzazione di molecole di polarità, eterotrimerico G-proteina alfa-i subunità 3 (Gαi3) localization è interrotto in Bbs8 e Bbs6 knockout coclea 8,39.
Distinguere il ruolo dei singoli componenti ciliari ei loro effetti distinti sulla segnalazione PCP ci darà una maggiore comprensione del ruolo del ciglio nello stabilire la corretta polarità. Di particolare importanza è quello di distinguere tra proteine ciliari che funzionano in un contesto ciliare, contro funzioni non ciliari delle proteine ciliari tradizionalmente considerati, come ad esempio il loro ruolo nella regolazione non ciliare relative traffico intracellulare. L'elevato grado di regolarità in molti aspetti della struttura cocleare, tra cui patterning cellulare e l'orientamento fascio stereociliary, permette di rilevare sottili cambiamenti nello sviluppo della PCP, in risposta a uno perturbazioni genetiche o molecolari di proteine correlate ciglia. Considerando che ci sono molti modelli di topo ciliare disponibili, e che in via di sviluppo coclea del mouse è uno dei posti migliori per esaminare PCPsegnalazione, è di grande interesse per imparare in quale misura le singole mutazioni di proteine interrompono lo sviluppo coclea.
Divulgazioni
The author declares no competing financial interests.
Riconoscimenti
L'autore ringrazia Matthew Kelley, Tiziana Cogliati, Jessica Gumerson, Uwe Wolfrum, Rivka Levron, Viola Kretschmer e Zoe Mann e per la loro valutazione critica del manoscritto. Questo lavoro è stato finanziato dalla Sofja Kovalevskaya Award (Humbodlt Foundation) e l'Università Johannes Gutenberg-, Mainz, Germania.
Materiali
| Name | Company | Catalog Number | Comments |
| Tools/Equipment | |||
| Silicone elastomere - Sylgard 184 | Sigma-Aldrich | 761028-5EA | See Note 2 |
| Micro dissecting scissors-straight blade | Various | ||
| Fine forceps (no. 5 and 55) and blunt forceps | Various | ||
| Dissecting microscope. | Various | ||
| Uncoated glass microscope slides | Various | ||
| Microscope cover slips (22 mm × 40 mm × 0.15 mm) | Various | ||
| Transfer pipettes | Various | ||
| Minutien pins | Fine Science Tools | 26002-10 | |
| SEM sample holder | tousimis | 8762 | |
| Scanning electron microscopy studs | TED PELLA | 16111 | |
| PELCO Tabs: Carbon adhesive | TED PELLA | 16084-3 | |
| Fluorescent Microscope | Various | ||
| Critical Point Dryer | Various | ||
| Scanning Electron Microscope | Various | ||
| Glass microscope slides | Various | ||
| Glass coverslips | Various | ||
| Kimwipe Tissue | Various | ||
| Fine Paint Brush | |||
| Reagents | |||
| 1× Phosphate buffered saline (PBS) | Gibco/Life Technologies | 10010023 | |
| Paraformaldehyde (PFA) (EM Grade Required for EM) | Various | Prepare a 4% solution in 1× PBS made fresh each time. EM Grade Required for EM. | |
| 2.5% Glutaraldehyde Grade1 | Sigma-Aldrich | G5882 | |
| Tris-HCl (pH 7.5) | Various | ||
| NaCl | Various | ||
| CaCl 2 | Various | ||
| Triton X-100 | Various | ||
| Normal Goat Serum | Various | ||
| AffiniPure Fab Fragment Donkey Anti-Mouse IgG (H+L) | Jackson ImmunoResearch | 715-007-003 | |
| Fluoromount-G Mounting media | SouthernBiotech | 0100-01 | |
| 10× Hanks’ Balanced Salt Solution (HBSS) | Gibco/Life Technologies | 14065 | |
| Hepes | Gibco/Life Technologies | 15630-080 | |
| Osmium tetroxide (OsO4 ) | Sigma-Aldrich/Fluka Analytical | 75632 | |
| Tannic acid | Sigma-Aldrich | 403040 | |
| Ethanol 200 proof | Various | ||
| Antibodies | |||
| anti Arl13b | Protein Tech | 17711-1-AP | Suggested concentration 1:1,000 |
| anti acetylated tubulin (611-B1) | Sigma-Aldrich | T6793 | Suggested concentration 1:800 |
| anti gamma tubulin (GTU-88) | Sigma-Aldrich | T6557 | Suggested concentration 1:200 |
| anti Zo_1 | Invitrogen | 40-2300 | Suggested concentration 1:500 |
| Myosin VI | Proteus Biosciences | 25-6791 | Suggested concentration 1:1000 |
| Myosin VIIa | Proteus Biosciences | 25-6790 | Suggested concentration 1:1,000 |
| anti Vangl2 | Merk Millipore | ABN373 | Suggested concentration 1:250 |
| anti Gαi3 | Sigma-Aldrich | G4040 | Suggested concentration 1:250 |
| Alexa Fluor® 488 Phalloidin | Invitrogen/Life Technologies | A12379 | Suggested concentration 1:300 - 1,000 |
| Alexa Fluor® 568 Phalloidin | Invitrogen/Life Technologies | A12380 | Suggested concentration 1:300 - 1,000 |
Riferimenti
- Waters, A. M., Beales, P. L. Ciliopathies: an expanding disease spectrum. Pediatr Nephrol. 26, 1039-1056 (2011).
- May-Simera, H. L., Kelley, M. W. Cilia, Wnt signaling, and the cytoskeleton. Cilia. 1, 7 (2012).
- Ross, A. J., et al. Disruption of Bardet-Biedl syndrome ciliary proteins perturbs planar cell polarity in vertebrates. Nat Genet. 37, 1135-1140 (2005).
- Ezan, J., Montcouquiol, M. Revisiting planar cell polarity in the inner ear. Seminars in cell & developmental biology. 24, 499-506 (2013).
- Semenov, M. V., Habas, R., Macdonald, B. T., He, X. SnapShot: Noncanonical Wnt Signaling Pathways. Cell. 131, 1378 (2007).
- Wang, J., et al. Regulation of polarized extension and planar cell polarity in the cochlea by the vertebrate PCP pathway. Nat Genet. 37, 980-985 (2005).
- Montcouquiol, M., et al. Identification of Vangl2 and Scrb1 as planar polarity genes in mammals. Nature. 423, 173-177 (2003).
- May-Simera, H. L., et al. Ciliary proteins Bbs8 and Ift20 promote planar cell polarity in the cochlea. Development. 142, 555-566 (2015).
- Jones, C., et al. Ciliary proteins link basal body polarization to planar cell polarity regulation. Nat Genet. 40, 69-77 (2008).
- Lim, D. J. Functional structure of the organ of Corti: a review. Hearing research. 22, 117-146 (1986).
- Nayak, G. D., Ratnayaka, H. S., Goodyear, R. J., Richardson, G. P. Development of the hair bundle and mechanotransduction. The International journal of developmental biology. 51, 597-608 (2007).
- Denman-Johnson, K., Forge, A. Establishment of hair bundle polarity and orientation in the deveoping vestibular system of the mouse. J. Neurocytol. , 821-835 (1999).
- Sobkowicz, H. M., Slapnick, S. M., August, B. K. The kinocilium of auditory hair cells and evidence for its morphogenetic role during the regeneration of stereocilia and cuticular plates. Journal of neurocytology. 24, 633-653 (1995).
- Denman-Johnson, K., Forge, A. Establishment of hair bundle polarity and orientation in the developing vestibular system of the mouse. Journal of neurocytology. 28, 821-835 (1999).
- van Dam, T. J., et al. The SYSCILIA gold standard (SCGSv1) of known ciliary components and its applications within a systems biology consortium. Cilia. 2, 7 (2013).
- Blacque, O. E., Sanders, A. A. Compartments within a compartment: what C. elegans can tell us about ciliary subdomain composition, biogenesis, function, and disease. Organogenesis. 10, 126-137 (2014).
- Wallingford, J. B., Mitchell, B. Strange as it may seem: the many links between Wnt signaling, planar cell polarity, and cilia. Genes & development. 25, 201-213 (2011).
- Borovina, A., Ciruna, B. IFT88 plays a cilia- and PCP-independent role in controlling oriented cell divisions during vertebrate embryonic development. Cell reports. 5, 37-43 (2013).
- Huang, P., Schier, A. F. Dampened Hedgehog signaling but normal Wnt signaling in zebrafish without cilia. Development. 136, 3089-3098 (2009).
- Ocbina, P. J., Tuson, M., Anderson, K. V. Primary cilia are not required for normal canonical Wnt signaling in the mouse embryo. PloS one. 4, e6839 (2009).
- Jones, C. G. Scanning electron microscopy: preparation and imaging for SEM. Methods Mol Biol. 915, 1-20 (2012).
- Curtin, J. A., et al. Mutation of Celsr1 disrupts planar polarity of inner ear hair cells and causes severe neural tube defects in the mouse. Current biology : CB. 13, 1129-1133 (2003).
- Wang, Y., Guo, N., Nathans, J. The role of Frizzled3 and Frizzled6 in neural tube closure and in the planar polarity of inner-ear sensory hair cells. The Journal of neuroscience : the official journal of the Society for Neuroscience. 26, 2147-2156 (2006).
- Montcouquiol, M., Jones, J. M., Sans, N. Detection of planar polarity proteins in mammalian cochlea. Methods Mol Biol. 468, 207-219 (2008).
- May-Simera, H., Kelley, M. W. Examining planar cell polarity in the mammalian cochlea. Methods Mol Biol. 839, 157-171 (2012).
- Yin, H., Copley, C. O., Goodrich, L. V., Deans, M. R. Comparison of phenotypes between different vangl2 mutants demonstrates dominant effects of the Looptail mutation during hair cell development. PloS one. 7, e31988 (2012).
- Rachel, R. A., et al. Combining Cep290 and Mkks ciliopathy alleles in mice rescues sensory defects and restores ciliogenesis. J Clin Invest. 122, 1233-1245 (2012).
- Jagger, D., et al. Alstrom Syndrome protein ALMS1 localizes to basal bodies of cochlear hair cells and regulates cilium-dependent planar cell polarity. Human molecular genetics. 20, 466-481 (2011).
- Collin, G. B., et al. The Alstrom Syndrome Protein, ALMS1, Interacts with alpha-Actinin and Components of the Endosome Recycling Pathway. PloS one. 7, e37925 (2012).
- Copley, C. O., Duncan, J. S., Liu, C., Cheng, H., Deans, M. R. Postnatal refinement of auditory hair cell planar polarity deficits occurs in the absence of Vangl2. The Journal of neuroscience : the official journal of the Society for Neuroscience. 33, 14001-14016 (2013).
- Sorusch, N., Wunderlich, K., Bauss, K., Nagel-Wolfrum, K., Wolfrum, U. Usher syndrome protein network functions in the retina and their relation to other retinal ciliopathies. Advances in experimental medicine and biology. 801, 527-533 (2014).
- Hebert, J. M., McConnell, S. K. Targeting of cre to the Foxg1 (BF-1) locus mediates loxP recombination in the telencephalon and other developing head structures. Dev Biol. 222, 296-306 (2000).
- Willott, J. F. Chapter 8, Measurement of the auditory brainstem response (ABR) to study auditory sensitivity in mice. Current protocols in neuroscience. , Unit8 21B (2006).
- Martin, G. K., Stagner, B. B., Lonsbury-Martin, B. L., et al. Chapter 8, Assessment of cochlear function in mice: distortion-product otoacoustic emissions. Current protocols in neuroscience. , Unit8 21C (2006).
- Finetti, F., et al. Intraflagellar transport is required for polarized recycling of the TCR/CD3 complex to the immune synapse. Nature cell biology. 11, 1332-1339 (2009).
- Sedmak, T., Wolfrum, U. Intraflagellar transport molecules in ciliary and nonciliary cells of the retina. J Cell Biol. 189, 171-186 (2010).
- Yuan, S., Sun, Z. Expanding horizons: ciliary proteins reach beyond cilia. Annual review of genetics. 47, 353-376 (2013).
- Tarchini, B., Jolicoeur, C., Cayouette, M. A molecular blueprint at the apical surface establishes planar asymmetry in cochlear hair cells. Developmental cell. 27, 88-102 (2013).
- Ezan, J., et al. Primary cilium migration depends on G-protein signalling control of subapical cytoskeleton. Nature cell biology. 15, 1107-1115 (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon