Method Article
Bewertung der Planar-Cell-Polarity Phänotypen in Ziliopathie Maus-Mutanten-Cochlea
In diesem Artikel
Zusammenfassung
Primary cilia influence various signaling pathways. The mammalian cochlea is ideal for examining planar cell polarity (PCP) signaling. Cilia dysfunction affects cochlear outgrowth, cellular patterning and hair cell orientation, readouts of PCP. Our goal is to analyze PCP signaling in mouse cochlea via phenotypic analysis, immunohistochemistry and scanning electron microscopy.
Zusammenfassung
In recent years, primary cilia have emerged as key regulators in development and disease by influencing numerous signaling pathways. One of the earliest signaling pathways shown to be associated with ciliary function was the non-canonical Wnt signaling pathway, also referred to as planar cell polarity (PCP) signaling. One of the best places in which to study the effects of planar cell polarity (PCP) signaling during vertebrate development is the mammalian cochlea. PCP signaling disruption in the mouse cochlea disrupts cochlear outgrowth, cellular patterning and hair cell orientation, all of which are affected by cilia dysfunction. The goal of this protocol is to describe the analysis of PCP signaling in the developing mammalian cochlea via phenotypic analysis, immunohistochemistry and scanning electron microscopy. Defects in convergence and extension are manifested as a shortening of the cochlear duct and/or changes in cellular patterning, which can be quantified following dissection from developing mouse mutants. Changes in stereociliary bundle orientation and kinocilia length or positioning can be observed and quantitated using either immunofluorescence or scanning electron microscopy (SEM). A deeper insight into the role of ciliary proteins in cellular signaling pathways and other biological phenomena is crucial for our understanding of cellular and developmental biology, as well as for the development of targeted treatment strategies.
Einleitung
Primäre Zilien sind lang Mikrotubuli-basierte Fortsätze, die von der Oberfläche der meisten Säugerzellen erstrecken. Primäre Zilien sind oft mit motile Zilien, von denen verwechselt gibt es immer mehrere pro Zelle, und deren Zweck es ist Fluids über Membranoberflächen zu bewegen. Primäre Zilien, dagegen annehmen sensorischen Rollen und sind somit auch als Sinneshärchen bezeichnet. Nachdem lange vergessen hat diese Organellen vor kurzem als Ergebnis seiner Verbindung mit einer Vielzahl von menschlichen genetischen Erkrankungen ein "wiederentdeckt" worden. Idealerweise als Signalorganelle angeordnet ist, hat der primäre cilium wurden zahlreiche Signalwege gezeigt zu regeln, von denen viele nicht nur wichtig in Gewebshomöostase und Krankheit, sondern auch während der Entwicklung 2.
Einer der ersten Signalwege gezeigt mit Zilien Dysfunktion assoziiert zu sein war der nicht-kanonischen Wnt-Signalwegs, auch bekannt als die planare Zellpolarität (PCP) Weg > 3. Diese Signalkaskade zunächst in Drosophila identifiziert, ist entscheidend für die Embryogenese; insbesondere zur Konvergenz und Ausdehnung Prozesse und für die korrekte Ausrichtung der Zellen in der Ebene der Epithelien 4. Die sequentielle Signalisierung einer Kernsatz von regulatorischen Proteinen übersetzt Richtungshinweise, die letztlich zu Zytoskelett-Umlagerungen führen und 5 in die koordinierte Polarisation von Epithelzellen in einer Ebene zur Folge haben. Der Prozess der Annäherung und Erweiterung ist absolut für den Schneckengang erforderlich zu verlängern und für die korrekte zelluläre Muster 6. Da dies über die Aktivierung des PCP Wegs reguliert wird, eines der markantesten Phänotypen der Mutanten Cochlea PCP ist eine verkürzte Schneckengang mit desorganisiert Sinnesepithelien 7. Ebenso Mausmutanten, die Wimpern fehlen, zeigen auch eine solche Konvergenz und Erweiterung Phänotyp 8,9, obwohl genau, wie dies geregelt ist noch nicht geklärt werden.
ve_content "> Da Prozesse Konvergenz und Erweiterung entscheidend sind für das Auswachsen der Schneckengang und Mobil Strukturierung der Sinnesepithelien im Schneckengang, die Entwicklung von Cochlea ist eine ideale Organ, in dem PCP-Signalisierung während der Wirbeltierentwicklung zu untersuchen. Die Orgel von Corti, der Begriff der Fach Sinnesepithel gegeben, die Linien der Schneckengang, der nicht-Sinnesstützzellen und mechanosensorischen Haarzellen besteht, die einheitlich für die Schnecke ausgerichtet sein muss 10 zu funktionieren. die mechanosensorischen Haarzellen sind so, weil die angerufene stereociliary Bündel, die von der Kutikula Platte (Spitzenfläche) jedes Haarsinneszelle 11. Diese dienen als Primärwandler Mechanosensation und trotz ihrer Nomenklatur als Stereozilien verlängern, sind tatsächlich von modifizierten Aktin-Filament-basierte Mikrovilli umfasste. Innerhalb jeder winkelförmige Haar Bündel, drei Reihen von Stereozilien sind in einem hoch geordneten und regelmäßigen pa organisiertttern in einem Treppenhaus artig. Echt Mikrotubuli-basierte Zilien, bezeichnet Kinozilien, werden für die Entwicklung und die Ausrichtung der stereociliary Bündel 12 erforderlich. Bei jeder Haarzelle wird eine Einzel Kinozilium physisch an den Stereozilien Bündel befestigt, befindet sich auf dem höchsten Reihe von Stereozilien zentral nebeneinander. Die genaue Funktion des Kinozilium ist unklar, und eine Hypothese ist, dass die Kinozilium die Stereozilien in Form "zieht", wie sie von Mikrovilli 12 reifen. Bei Wirbeltieren sind Kinozilien in der Cochlea vorhanden nur vorübergehend und von den Haarzellen in Mäusen zurückzuziehen vor dem Einsetzen 11,13,14 hören.Vollständiger Verlust von Zilien in den Entwicklungs Cochlea führt zu stark verkürzt Cochlea Kanäle, mis geformt und mis orientierten stereociliary Bündel sowie Fehl positioniert Basalkörpern 8,9. Eine funktionelle Cilium ist nicht nur der Ciliar- Axonem umfasste. Viele Proteine mit Zilien verbundenFunktion kommen in Komplexen lokalisiert Zilien bezogene Sub-Domains wie beispielsweise die Basaltemperatur, Übergangszone oder Ciliar- Axonem 15. Der Grundkörper, von der Mutter centriole der Zentrosom abgeleitet, ist auch ein Mikrotubuli-Organisationszentrum für Mikrotubuli aus dem Flimmer in dem Zellkörper weg erstreckt und intrazellulären Transport sowie Ciliar- Handel regulieren. Die Ciliar- Übergangszone ist ein weiterer Bereich, in dem Ziliarfunktion in Bezug auf 16 der Organisation von Import und Export von Ciliar- Verbindungen reguliert wird.
Mehrere Studien haben einen Zusammenhang zwischen Wimpern und nicht-kanonische Wnt (PCP-Signalisierung) identifiziert, obwohl der genaue Mechanismus 17 ist unklar. Redundanz von Ciliar- und PCP-Gene und die Empfindlichkeit der Zellpolarität zu verallgemeinern Zellanomalien, machen es schwierig, direkt eine Mutation an PCP spezifische Defizite zu verknüpfen. Einer der Lese outs von PCP-Signalisierung ist die Positionierung der Basaltemperatur und primary Flimmer, damit die primären von den sekundären Defekte Trennung ist eine Herausforderung. Einige Studien im Zebrafisch und Maus-Mutanten haben keinen Zusammenhang zwischen Wimpern und Wnt-Signal 18-20 vorgeschlagen. Abweichungen in den Daten zurückgelegt werden Spezies, Gewebe oder zeitliche abhängige Unterschiede in Ciliar- Beiträge an Wnt-Signal. Darüber hinaus könnten normale Wnt Reaktionsfähigkeit beibehalten werden, wenn Basalkörpern funktionsfähig bleiben. Ein tiefer Einblick in die Rolle von Ciliar- Proteinen in zellulären Signalwegen und andere biologische Phänomene ist von entscheidender Bedeutung für das Verständnis der zellulären und Entwicklungsbiologie, sowie für die Entwicklung von zielgerichteten Behandlungsstrategien.
Protokoll
Verwenden und einschläfern alle Tiere in Einklang mit den institutionellen und staatlichen Richtlinien und Vorschriften, am häufigsten über CO 2 Inhalation und Genickbruch.
1. Vorbereitung der Reagenzien
HINWEIS: Vor Beginn, bereiten alle Reagenzien Analysequalität Chemikalien. Make-Lösungen unter Verwendung von molekularen Grad destilliert und VE-Wasser, sofern nicht anders angegeben.
- Phosphatgepufferte Kochsalzlösung (1x PBS): Stellen 1 l 1x PBS durch 8g NaCl aufzulösen, 0,2 g KCl, 1,44 g Na 2 HPO 4 und 0,24 g KH 2 PO 4 in 1 l H 2 O. Den pH-Wert auf 7,4 mit HCl. PBS muss nicht steril sein und kann bei Raumtemperatur gelagert werden. Beachten Sie, dass dieser Puffer ohne CaCl 2 oder MgCl 2 besteht.
- Paraformaldehyd (4% PFA): Bereiten Sie eine 4% ige Lösung von PFA in 1x PBS in einem belüfteten Abzugshaube. In 40 g Paraformaldehyd Pulver zu 1 l 1x PBS. Zu lösen, umrühren und Hitze auf etwa 60 ° C,und langsam fügen NaOH weise fallen den pH-Wert zu erhöhen. Sobald das Pulver aufgelöst hat, stellen Sie den pH-Wert auf 7,4 mit HCl. Man filtriert durch ein 0,45 um-Filter und gefrier Aliquots. Tauen Sie ein frisches Aliquot für jedes Experiment.
- Triton-Puffer: Vorbereiten eines 0,1 M Tris-HCl (pH 7,5), 0,15 M NaCl, 0,1% Triton X-100-Lösung durch Lösen von 8,77 g NaCl in 1 l 0,1 M Tris-HCl (pH 7,5). 1 ml Triton X-100. Rühren Sie zu lösen. Store Triton-Puffer bei RT.
- Triton Block: Vorbereiten 10% Ziegenserum in Triton-Puffer durch Zugabe von 1 ml Ziegenserum zu 9 ml Triton-Puffer. Lagerung bei 4 ° C. Bei Verwendung von primären in Maus Antikörpern, fügen Ziege-anti-Maus-IgG Fab bei einer Verdünnung von 1 in 200 in die Triton-Satz auf den Blockierungsschritt Fragmenten.
HINWEIS: Bei der Planung Proben für die Rasterelektronenmikroskopie (SEM) zu bedienen, bereiten zusätzliche Reagenzien wie unten aufgeführt. - Hanks 'Balanced Salt Solution (HBSS) mit Calcium und Magnesium: Machen Sie eine 1x Lösung HBSS durch aus einer Stammlösung verdünntin sterilem destilliertem H 2 O. Wie HBSS-Puffer ist kompliziert zu Beteiligten machen und es gibt Risiken, ist es ratsam, einen vorgefertigten 10x Stammlösung zu bestellen. Die Endkonzentration von HBBS routinemäßig verwendeten Puffer ist der folgende: 1,26 mM CaCl 2, 0,49 mM MgCl 2 -6H2O, 0,41 mM MgSO 4 -7H2O, 5,33 mM KCl, 0,44 mM KH 2 PO 4, 4,17 mM NaHCO 3, 137,93 mM NaCl , 0,34 mM Na 2 HPO 4, 5,56 mM Dextrose.
- Hepes-Puffer: Bereiten Sie eine 0,1 M Hepes-Lösung in 1x HBSS, die durch Lösen von 23,8 g HEPES in 1 l 1x HBSS-Puffer.
- Rasterelektronenmikroskopie Fixierungsmittel (SEM Fix): Vorbereiten Fixiermittel für SEM durch Verdünnen Elektronenmikroskopie Grad Glutaraldehyd (2,5%) und Paraformaldehyd (4%) in Hepes-Puffer. Hinzufügen CaCl 2 auf eine Endkonzentration von 10 mM.
- 1% Osmiumtetroxid (OsO 4) in Hepes-Puffer; 1% Osmiumtetroxid in Wasser: Verdünnen einer Stammlösung von Osmiumtetroxid in Hepes-Puffer, und separately in sterilem destilliertem H 2 O, bis zu einer Endkonzentration von 1%. Osmiumtetroxid ist hochgiftig und wird am häufigsten als eine 4% ige Lösung verkauft.
- 1% (w / v) Gerbsäure: Man löst 0,5 g Gerbsäure in 50 ml sterilem destilliertem H 2 O. Filter sterilisieren durch Filtrieren durch einen 0,45 Porengröße Filter.
- Abgestuften Ethanollösung Serie: Verdünnen 200 Proof Ethanol mit sterilem destilliertem H 2 O bis 30 machen, 50, 70, 90 und 95% Ethanollösungen. Für die endgültige Ethanolspülungen, 100% Ethanol 200 Nachweis ist erforderlich. Verwenden Sie ein frisch geöffneten Flasche 200 Proof Ethanol für die abschließenden Spülungen.
2. Wahl des Tissue
- Im Idealfall untersuchen Embryonen oder junge Welpen im Alter zwischen embryonalen Tag 16,5 (E16.5) und postnatalen Tag 3 (P3).
HINWEIS: Die Verknöcherung des knöchernen Labyrinth und Schläfenbeine macht Dissektion zunehmend schwieriger, da Mäuse reifen. Auch Kinozilien, die einzig wahre Mikrotubuli-basierte Cilium gefunden auf Haarzellen der Cochlea,während der Entwicklung zurückzieht und nicht mehr vorhanden in erwachsenen Mäusen. - Nach der Fixierung entkalken erwachsenen Cochlea. Verlagsort seziert knöchernen Labyrinthe, in 2 ml EDTA (4,13% in PBS), pH 7,3, in einem Mikrozentrifugenröhrchen für 3 (siehe Abschnitt 3) - 4 Tage mit Rotation. Tanken täglich EDTA. Nachdem das Gewebe aufgeweicht haben gründlich in 1,5 ml oder mehr PBS 3 mal für 5 Minuten auf einem Kolbenpendel mit erhöhter Erregung.
3. Cochlea Dissection
- Beitrag Euthanasie durch Genickbruch oder CO 2 Inhalation (100% CO 2), entfernen Sie den Kopf. Verwenden Sie ein Skalpell oder kleine Schere, abhängig von der Größe des Tieres, den Kopf entlang der sagittalen Mittellinie an der Nase beginnt zu zerlegen und sich kaudal. Entfernen Sie das Gehirn aus jeder Hälfte des Schädels mit einer Pinzette. Identifizieren Sie die Schläfenbeine, die die Entwicklung von knöchernen Labyrinthe des Innenohrs enthalten (siehe Pfeil in 1A).
- Verwenden Sie ein Paar fürSteinpilze, die knöchernen Labyrinthe aus dem Schädel (Os temporale) sorgfältig zu isolieren. Tun Sie dies unter einem Binokular. Ausrasten und Knochengewebe aus dem Schädel entfernt von der Pinzette vorsichtig unter den knöchernen Labyrinthe laufen. Bei Tieren P4 bis zur knöchernen Labyrinthe sind noch knorpeligen und kann leicht, ohne zu brechen entfernt werden.
- Nach Präparation mit der Spitze der Pinzette die ovale und runde Fenster zu löschen und ein kleines Loch in der Spitze des Cochlea-Spirale machen. Befestigen Sie die knöchernen Labyrinthe vor der weiteren Zerlegung des Schneckengang. Damit für die einfache Entfernung des Deckmembran (siehe 3.7), fixieren die knöchernen Labyrinthe in 1,5 ml 4% PFA für 5 Minuten auf Eis.
HINWEIS: Wenn die Entfernung der Deckmembran nicht erforderlich ist, wird länger Fixierung empfohlen (siehe 4,1-4,3). Kurze Fixierung der Schläfenbeine vor der Präparation der Schneckengang unterstützt die Dissektion Prozess und das Entfernen der Deckmembran. Beitrag Präparation und Freilegung des Corti-Organ, furtihre Fixierung erforderlich ist. - sezieren weiter die knöchernen Labyrinthe des Cochlea Sinnesepithel freizulegen, wie folgt. Legen Sie die knöchernen Labyrinthe in einem schwarzen Silikon-Elastomer beschichtet Sezieren Gericht PBS, die Präparation zu erleichtern. Verwenden minutien Stifte um das Gewebe zu immobilisieren, wenn erforderlich. Um minutien Stifte verwenden, legen Sie sie durch die vestibulären Teil der knöchernen Labyrinthe mit dem ventralen Aspekt der Cochlea-Spirale nach oben.
HINWEIS: Die schwarze Silikon-Elastomer-Schale: Silikon-Elastomer-Basiskomponente mit Kohlenpulver mischen eine undurchsichtige schwarze Farbe zu erhalten. Fügen Sie den Härter vermischen und in eine oder mehrere Petrischalen (Glas oder Kunststoff). Trockene unter Vakuum eingefangene Luftblasen zu entfernen. Trockengerichte vollständig vor der Verwendung. - Verwenden feinen Pinzette (# 5) die äußere Knorpel zu entfernen Sie den Schneckengang auszusetzen. Beginnen Sie an das ovale Fenster; Legen Sie die untere Spitze der Zange in das ovale Fenster und hebeln vorsichtig den Knorpel zu öffnen, langsam nach oben in Richtung der sich bewegendenApex.
- Nach der Belichtung der Schneckengang, entfernen Sie die Bauchseite, der Membran Reissner. Einen feinen Pinzette die Reissner-Membran an der Basis der Schneckengang zu kneifen und ziehen es in einer Aufwärtsbewegung ab. Visualisieren Sie die dorsalen Aspekt der Schneckengang, einschließlich der Sinnesepithel.
- Entfernen Sie die Deckmembran, wie unten (optional) beschrieben. Für SEM oder Immunhistochemie des Kinozilium oder stereociliary Bündel entfernen Sie die Deckmembran.
- Verwenden Sie einen sehr feinen Pinzette (# 55 oder feiner) die Deckmembran an der Basis der Cochlea zu klemmen und nach oben in Richtung der Spitze schälen.
HINWEIS: Die Deckmembran ist optisch klar was es schwierig macht zu identifizieren. Nicht selten kommt die Membran in einem Stück aus, und obwohl es nicht leicht sichtbar ist, kann man den Widerstand spüren, wie sie von der freiliegenden Corti-Organ abgezogen wird. - Nach Aussetzen des Corti-Organ, fix weiter das Gewebe wie dunter escribed. Bewahren Sie die vestibulären Region weitere Vorbereitung der Gewebe zu unterstützen.
4. Fixation
- Für die regelmäßige Immunhistochemie fixieren die seziert knöchernen Labyrinthe in 1,5 ml 4% PFA bei 4 ° C auf einem Kolbenpendel für 2 Std.
Hinweis: Wegen der Empfindlichkeit von Antikörpern und Antigenen, Abweichungen in der Länge und Zusammensetzung der unterschiedlichen Fixierung erforderlich sein und sollte für jeden Antikörper optimiert werden. - Nach der Fixierung, waschen Sie die Proben durch in 1,5 ml oder mehr PBS 3 mal für 5 Minuten auf einem Kolbenpendel mit erhöhter Erregung spülen. Proben können in PBS bei 4 ° C über mehrere Wochen vor der Verarbeitung gelagert werden.
- Wenn Proben für die REM-Vorbereitung, Fix Schläfenbeine in SEM-Fix (siehe 1.7) für 2 h bei RT seziert. Waschen von in 1,5 ml oder mehr Hepes-Puffer 3 mal für 5 Minuten auf einem Kolbenpendel mit erhöhter Erregung spülen. Speicher in Hepes-Puffer bei 4 ° C bis zur Weiterverarbeitung. Lagerung für länger als ein paar Wochens wird nicht empfohlen.
5. Immunhistochemie
- Führen Sie die Immunhistochemie auf seziert Proben in eine Vertiefung einer Flachboden-96-Well-Platte. Alternativ können Sie eine PCR oder Mikrozentrifugenröhrchen verwenden. Es ist ratsam, die vestibulären Teil des knöchernen Labyrinth zu behalten die Verarbeitung zu erleichtern.
- Permeabilisieren das Gewebe durch eine Kolbenpendel unter leichtem Schütteln in 1,5 ml Triton-Puffer für 1 Stunde bei RT inkubiert.
- Blockieren die Gewebe für mindestens 1 h bei RT in 0,5 ml Triton Block inkubiert. Wenn primären Antikörpern in der Maus angehoben, fügen anti-Maus-IgG-Fab-Fragmente auf den Block in einer Verdünnung von 1: 200 (siehe Abschnitt 1.4). Dies verringert stark unspezifische Bindung von Anti-Maus-IgG an Maus-Gewebe.
- Inkubieren des Gewebes mit primären Antikörpern, verdünnt in Triton Block O / N bei 4 ° C unter leichtem Schütteln. Antikörper Verdünnung hängt von Antikörpern verwendet wird (siehe Abschnitt 6.1). inkubieren Alternativ Primär antibodies für 2 h bei RT. Im Idealfall ein Mindestvolumen von 0,5 ml primärer Antikörper Verdünnung verwenden. Wenn Antikörper beschränkt ist, verwenden Sie das kleinste Volumen von Antikörperverdünnung, die vollständig in das Gewebe umhüllt.
- Waschen Sie das Gewebe in 1,5 ml oder mehr Triton-Puffer gespült, mindestens 3 mal für 15 min, auf einer Kolbenpendel mit erhöhter Agitation.
- das Gewebe mit fluoreszierenden Farbstoff-konjugierten sekundären Antikörpern inkubieren an den Hersteller empfohlene Konzentration verdünnt (typischerweise 1: 200-1: 1000) in Triton Block für 1 h bei RT auf einem Kolbenpendel. Verwenden Sie ein Mindestvolumen von 0,5 ml sekundären Antikörperverdünnung.
- Zentrifugieren des verdünnten sekundären Antikörpers bei 13.000 × g für 3 min vor der Verwendung nicht-spezifische Bindung des sekundären Antikörperaggregaten zu minimieren. Schirmen Sie das Gewebe von Licht, das von diesem Schritt vorwärts zu vermeiden, dass die Fluoreszenzfarbstoffe Photobleaching.
- Wie in Schritt 5.5, waschen das Gewebe durch in 1,5 ml oder mehr Triton-Puffer gespült, mindestens 3 mal für 15 min, auf eineNutator mit erhöhter Erregung. Lagern Sie die Proben in PBS bei 4 ° C bis zur einbaufertig.
6. Antikörperselektion
HINWEIS: Die Quelle der empfohlenen Antikörper und deren Verdünnungen sind in der Tabelle der spezifischen Materialien und Geräte aufgeführt. Führen Antikörperinkubationen, wie in Abschnitt 5 beschrieben.
- Zur Visualisierung der Mikrotubuli-basierte Kinozilium, verwenden Sie ein Ciliar- Axonem Marker wie Anti-Arl13b (1: 1000) oder anti-acetylierten-α-Tubulin (1: 800). Visualisieren Sie die Basaltemperatur einen Antikörper gegen γ-Tubulin (1: 200) oder jede andere zentrosomalen Marker.
- Um die Aktin-Filament-reiche stereociliary Bündel visualisieren, fügen Phalloidin (1: 300 - 1000), konjugiert an eine von mehreren verschiedenen Fluorophore an den sekundären Antikörper Inkubation. Phalloidin Etiketten auch andere filamentöse Aktin Strukturen einschließlich der kortikalen Aktinfilamente dem Umfang jeder epithelialen Haarzelle umgibt. Dies ist hilfreich bei der Bestimmungder Umriß eines jeden Haarzelle. Verwenden eine alternative Membranmarker wie anti-ZO-1 (1: 500), falls erforderlich.
- Beschriften Haarzellen der Cochlea Antikörper gegen Myosin VI (1: 1000) mit oder Myosin VIIa (1: 1000). Diese können, wenn die Beurteilung Cochlea Länge verwendet werden.
HINWEIS: Verwenden Sie geeignete Fluoreszenzfarbstoff-konjugierten sekundären auf die Mikroskop Anforderungen optimierte Antikörper.
7. Montage und Imaging
- Die Probe wird in einem schwarzen Silikon-Elastomer-Schale mit PBS. Mit einer feinen Pinzette, entfernen Sie die vestibulären Bereich von der Cochlea-Spirale.
- Sehr sorgfältig die zugrunde liegende Knorpel und Mesenchym aus dem Cochlea-Spirale entfernen. Die restlichen Cochlea-Spirale enthält den inneren Sulcus, Corti-Organ und Außen Sulcus.
- Übertragen der Cochlea-Spirale in einem Tropfen PBS auf einem Objektträger platziert. Falls gewünscht, trennen die Cochlea-Spirale in Stücke entspricht eine Umdrehung. Dieser Schritt ist jedoch nicht notwendig und kann zu führen lOSS des Gewebes. Der apikalen Oberfläche (Stereozilien Seite) der Cochlea-Haarzellen sollten nach oben in Richtung der Deck weisen.
- Wick die PBS mit einem Adsorptionsmittel Gewebe oder ein Stück Filterpapier entfernt und vorsichtig auf die Cochlea Spiral positionieren, wenn die Epithelien und Überlappungen auf sich selbst verschoben hat.
- Fügen Sie einen Tropfen Eindeckmittel der Cochlea Probe direkt auf und legen Sie vorsichtig mit einem Deckglas auf, darauf zu achten, um Luftblasen zu vermeiden. Keine Abstandshalter sind erforderlich; Stellen Sie das Deckglas direkt auf die Probe. Ein wasserlösliches, nicht-fluoreszierende, semi-permanenten Montage Medium, das nicht zusätzliche Schritte erfordert das Deckglas in Position zu halten wird empfohlen. Eindeckmedium und Deckglas Dicke von Spezifikationen bestimmt Mikroskop abgestimmt werden.
- Verwenden Sie ein epifluoreszenten oder Laser-Scanning-konfokalen Mikroskop mit hoher Vergrößerung ausgestattet (63 - 100X), hoher numerischer Apertur (1,2 bis 1,4) Ziele Bilder der Spitzenfläche des Cochlea Haarzellen zu erfassen. Verwenden loWer Ziele (5 - 20-fach) zu nehmen Bilder des Cochlea-Spirale überlappen die Länge des Schneckengang zu quantifizieren. Spiel Anregungslaser und Emissionsfiltern zu Fluorophore für Sekundärantikörper verwendet.
8. Rasterelektronenmikroskopie
- Fahren Sie mit dem Abschnitt 4.3. SEM fixierten Proben in Hepes-Puffer Nach dem Waschen, führen Sie die folgenden Schritte unter Belüftung. Das folgende Protokoll funktioniert gut für Cochlea Gewebe und vermeidet die Verwendung von Sputter-Beschichtung mit einem leitfähigen Metall.
- Post-fix in 1% OsO 4 in Hepes-Puffer für 1 h, gefolgt von 3 Waschungen mit 1 ml destilliertem Wasser für jeweils 5 Minuten. Das kleinste Volumen von OsO 4, die vollständig um das Gewebe umhüllt sollte giftige Abfälle zu minimieren. Kein Rühren erforderlich.
- Inkubieren Proben bei RT in jeder der folgenden Lösungen 1 h lang mit 3 Waschschritten mit 1 ml destilliertem Wasser für jeweils 5 Minuten in zwischen den Schritten: 1% Gerbsäure frisch hergestellt in Wasser und filtered vor der Verwendung; 1% OsO 4 in Wasser, 1% Gerbsäure in Wasser, 1% OsO 4 in Wasser.
- Dehydratisierung Proben durch eine abgestufte Ethanolreihe durch Inkubation für 10 min in jedem der folgenden Verdünnungen: 30, 50, 70, 90 und 95%. Kein Rühren erforderlich.
- Transfer Proben durch drei Änderungen, jeweils 5 Minuten, 100% Ethanol (aus einer frisch geöffneten Flasche 200 proof Ethanol).
- Führen Sie die Proben allerdings einen kritischen Punkt trockener folgenden Anweisungen des Herstellers.
- Montieren Sie die Proben unter Verwendung von leitfähigem Kohlenstoff Klebstoff auf der Oberseite eines SEM Stummel vor auf einem Elektronenmikroskop auf Bildgebung. Unter einem Stereomikroskop, mit einem Paar von feinen Pinzette und einem Pinsel vorsichtig auf die Probe zu positionieren mit den Cochlea-Epithel nach oben zeigt. Verwenden Sie die vestibulären Teil der Probe zu "Anker" das Gewebe an den Stummel. Lagern Sie die Proben in einem Exsikkator bis Bildgebung. Führen REM-Aufnahmen wie in Jones (2012) 21 beschrieben.
9.Quantifizierung
- Nach Immunhistochemie Vorbereitung, Bilder aufzunehmen, eine epifluoreszenten oder Laser-Scanning-konfokalen Mikroskop. Nach der Vorbereitung für SEM, ein Rasterelektronenmikroskop zu Bild verwenden, um die Proben. Bild der Spitzenfläche des Corti-Organ mit den freiliegenden Haarzellen der Cochlea und eingelagerten Stützzellen.
- Definieren spezifischen Positionen entlang der Schneckengang, wie beispielsweise 25, 50, und 75% von der Basis und verwenden diese Cochlea Bereichen zwischen Mutante und Kontrollproben zu vergleichen. Analysieren und Zilien Mutanten mit ihren Wurfgeschwister-Kontrollen vergleichen, da Unterschiede in der genetischen Hintergrund des Cochlea-Phänotyp modifizieren können.
HINWEIS: Das Corti-Organ entwickelt sich in einer Steigung, die in Richtung der Mitte der Basis erstreckt sowohl der Spitze und der Basis. Bei der Maus ist die Entwicklung bis P14 nicht abgeschlossen ist, so ist es wichtig, Regionen in ähnlichen Entwicklungsstadien und Positionen zu vergleichen. - Nehmen Sie Bilder mit der Software das Mikroskop begleitet, die allow für die Quantifizierung der bestimmten Phänotyp wie erforderlich (siehe unten). Verwenden Bildanalyse-Software wie beispielsweise Bild J oder Software das Mikroskop begleitenden Längen zu messen, zählen Zellen und Proteinlokalisierung bestimmen, wie unten beschrieben. Graph diese Daten als Balkendiagramm, Punktdiagramm, Box-Blot oder Histogramm, mutierte vs. Kontrolle zu vergleichen.
- Gesamtlänge des Schneckengang (3A):
- Mit Hilfe einer Haarzelle Marker oder Phalloidin, (die die stereociliary Bündel markiert), bestimmen und zu messen, wo die Sinnesepithel beginnt und endet. Die Länge des Schneckengang wird häufig in Cilien Mutanten verkürzt.
- Stereociliary Bündel Anomalien (3B, D, E, G):
- Messen Bündel Konvexität (Höhe) als der kürzeste Abstand zwischen dem Scheitelpunkt des Bündels und der Strecke, wie durch die beiden Enden des Bündels "Arme" in Figur 3G dargestellt erstreckt, links. Alternativ quantifizieren den Bereichvon den Armen der äußeren Haarzellen stereociliary Bündel umfasst, wie in Abbildung 3G gezeigt, richtig. Wenn Haarzellen mit kreisförmigen stereociliary Bündel identifiziert werden können diese als Prozentsatz der gesamten Haarzellen zählen.
HINWEIS: In vielen Ciliar- Mutanten Bündel Anomalien unabhängig von Bündelorientierung beobachtet werden. Es ist schwierig, genau stereociliary Bündel Anomalien quantifizieren.
- Messen Bündel Konvexität (Höhe) als der kürzeste Abstand zwischen dem Scheitelpunkt des Bündels und der Strecke, wie durch die beiden Enden des Bündels "Arme" in Figur 3G dargestellt erstreckt, links. Alternativ quantifizieren den Bereichvon den Armen der äußeren Haarzellen stereociliary Bündel umfasst, wie in Abbildung 3G gezeigt, richtig. Wenn Haarzellen mit kreisförmigen stereociliary Bündel identifiziert werden können diese als Prozentsatz der gesamten Haarzellen zählen.
- Orientierung der stereociliary Bündel (3B, C, G):
- Beurteilung der Ausrichtung jedes einzelnen Bündels relativ zu einer Linie senkrecht zu der Reihe von Säulen Zellen erstreckt, die die inneren und äußeren Haarzellen trennt. Zellen mit einer normalen Ausrichtung entlang dieser senkrechten Achse ausgerichtet sind und so eine Drehung von 0 ° aufweisen. Bestimmen Drehwinkel entweder eine 360 ° Notation oder als absoluten Abweichungen von 0 ° verwendet wird.
- Kinozilien Positionierung oder stereociliary Bündel Positionierung (Abbildung3B, F, H):
- Graf den Prozentsatz der Zellen, in denen Kinozilien fehlen. Messen Sie den Abstand von der Kinozilium dem "Scheitel" oder Mitte des Bündels. Die "Vertex" des Bündels kann nicht einfach sein, zu definieren, wenn Pakete sind abnormal, so dass die Mitte des Bündels kann stattdessen verwendet werden.
- Quantifizierung der Position Kinozilien und stereociliary Bündel auf der apikalen Haarzelloberfläche, durch eine Positions Gitter auf jeder Haarzelle überlagert und die Kennzeichnung die Position von entweder der Basis des Kinozilium oder dem Scheitelpunkt / Mittelpunkt der stereociliary Bündel. Anzeigen der Daten als Prozentsatz jeder Kategorie, die in einer bestimmten Region des Gitters liegt, und durch Überlagerung der Positionen der einzelnen Markierung auf einer Positionsraster.
HINWEIS: In Kontrollgeweben, Kinozilien werden immer an der Spitze des stereociliary Bündel angebracht. In Zilien Mutanten fehlen Kinozilien oft, mislocalized dennoch angebracht, oder sogar vollständig von den s abgelösttereociliary Bündel. - Kinozilien Länge (Abbildung 3I):
- Messen Sie die Länge des Kinozilium indem sie mit einem Ciliar- Axonem Marker Beschriftung. Nur Kinozilien messen, die innerhalb eines 1,5 um Konfokalebene flach liegen. Bestätigen Sie, dass Zilien flach liegen durch eine Querschnittsansicht des gescannten Gewebe zu beobachten. Vergleichen Alter abgestimmte Proben aus dem gleichen Bereich der Cochlea, da die Kinozilium während der Entwicklung zurückzieht.
- Fehllokalisation von Polarität Proteinen:
- Im Anschluss an die Immunhistochemie Antikörper gegen Polarität Proteine wie Vangl2 und Gαi3, bestimmen die Lokalisierung via Bildgebung.
HINWEIS: In einigen Zilien Mutanten, Lokalisierung von Polarität Proteinen gestört wird. Dazu gehören Vangl2 und Gαi3, die gezeigt haben, in Ift20, BBS8 und Bbs6 Mutante Cochlea gestört zu werden.
HINWEIS: Weitere Beispiele dafür, wie Polarit zu quantifizieren und Zell Haar Anzeigey in den folgenden Veröffentlichungen gefunden werden. Curtin, et al. (2003) Current Biology 22, Montcouquiol, et al. (2003) Nature 7, Wang, et al (2006) The Journal of Neuroscience 23, Montcouquiol, et al. (2008) Methods in Molecular Biology 24, Mai-Simera, et al. (2012) Methods in Molecular Biology 25, Yin et al (2012) PLoS ONE 26.
Ergebnisse
Cochlea Dissection und Gewebepräparation
Nach der Entfernung des Gehirns, eine Anzeige Mittellinie sagittale Sektion eines P0 Mauskopf, der knöchernen Labyrinth, von hinten gesehen, kann sichtbar gemacht werden (Abbildung 1A, weißer Pfeil) und entfernt. 1B zeigt die isolierten knöchernen Labyrinthe mit dem Cochlea-Haar nach oben, Bauch, (links) und von hinten, Rücken (rechts). Die weißen Pfeil auf das ovale Fenster, von dem kann man damit beginnen, die äußeren Knorpel entfernen. Sobald die äußere Knorpel vollständig entfernt worden ist, die freiliegende Schneckengang, intakte noch kann, beobachtet (1C) werden. Positionierung eines Stiftes durch die vestibulären Region Dissektion zu unterstützen gezeigt. Zwei Stifte, in unterschiedlichen Winkeln gesetzt können auch in das Gewebe zu verankern, verwendet werden. 1D zeigt den Schneckengang nach dem Entfernen der Reissner '; S Membran und die Deckmembran (links) und die isolierte Cochlea Spiral epithelialen einmal (rechts) für die Montage für die Immunhistochemie von vestibulär in Vorbereitung isoliert wurde es. Um eine allgemeine Vorstellung von dem, was die freiliegende Cochlea Haar sieht aus wie eine intakte SEM Zubereitung ist in 1E gezeigt.
Morphologie und Immunfluoreszenz in der Systemsteuerung Cochlea
Nach der Vorbereitung des Cochlea-Gewebe, die Rückenfläche der Schneckengang das Corti-Organ enthält, wird freigelegt und kann über SEM oder Immunfluoreszenzfärbung angesehen. Insgesamt gesehen Montage Vorbereitung, die vier Reihen von mechanosensorischen Haarzellen (eine Reihe von inneren Haarzellen und drei Reihen von äußeren Haarzellen) unterschieden werden. 2A eine geringe Vergrößerung Ansicht der basalen Windung aus einer embryonalen Maus Cochlea zeigt , vorbereitet foder SEM. Man beachte die einheitliche Orientierung und Ausrichtung der Aktin-basierte stereociliary Bündel. Zusätzlich wird die Morphologie der stereociliary Bündel entspricht, wobei jedes Bündel den klassischen ")" (am inneren Haarzellen) oder "W" (auf äußeren Haarzellen) Form. Bei näherer Vergrößerung in diesem Alter können zusätzliche Mikrovilli zu sehen ist nicht nur auf der apikalen Oberfläche der Haarzellen, sondern auch zwischen den Haarzellen auf den Stützzellen (2B). Dies wird zurücktreten nur drei Reihen von stereociliary Bündel an den äußeren Haarzellen und zwei auf der inneren Haarzellen bei Erwachsenen zu verlassen. Wie in 2C (weißer Pfeil), eine einzelne Mikrotubuli-basierte Kinozilium (a wahren Primär cilium) zu sehen ist, an der Spitze jedes stereociliary Bündel zum höchsten Reihe der Stereozilien angrenzend angeordnet. Diese werden an dem Bündel über Kinozilien Verbindungen befestigt.
Fluoreszenzmarkierung mit Phalloidin, das LaborAktin els, unterstreicht die einheitliche Orientierung und Form der Bündel in Kontrollgewebe (2D). Kortikalen Aktin ist ebenfalls markiert, was nützlich ist, der apikalen Umfang jeder einzelnen Haarzelle zu bestimmen. Co-Kennzeichnung mit Phalloidin und ein Antikörper gegen Myosin 7a (2E), eine Haarzellmarker, hilft auch zwischen Haarzellen und Stützzellen zu differenzieren. Myosin 7a ist auch ein nützlicher Marker für Cochlea-Kanal Erweiterung Messung (siehe Abbildung 3A). Ein Antikörper gegen acetyliertes-α-Tubulin wird häufig verwendet, die Mikrotubuli-basierte Kinozilium (2F) zu identifizieren. Als Unterstützung auch Zellen primäre Zilien Hafen, ist es wichtig, zwischen Zilien von Haarzellen ausgehenden zu unterscheiden vs. Stützzellen Einlagern. Ein zusätzlicher Membranmarker wie Antikörper gegen ZO-1 (Zona-Occludens-1), der deutlich die Mosaik Strukturierung der apikalen Membran der Schneckengang beschreibt, ist daher nützlich ( 2F). Weitere Überlegung ist, dass Antikörper gegen acetyliertes-α-Tubulin auch interne Mikrotubuli kennzeichnen und so ist Vorsicht geboten, wenn sie auf der Haarzelle apikalen Oberfläche zu fokussieren Bildgebung. Die Mikrotubuli in die Säulenzellen sind besonders dichte (2G, weiß Sternchen). Eine Kombination von Phalloidin und anti-acetylierten-α-Tubulin-Kennzeichnung wird häufig verwendet, gleichzeitig stereociliary Bündel und Nachbar Kinozilien (2G, weißer Pfeil) zu identifizieren.
Cochlear Phänotyp in Cilia Mutants
Verlängerung der Schneckengang ist einer der besten Lese outs der Konvergenz und Ausdehnung Defekte und verkürzt Cochlea Kanäle werden üblicherweise in klassischen PCP Mutanten beobachtet. Die Cochlea in Ciliar- Mutanten haben oft Cochlea-Kanäle verkürzt und zeigen eine deutliche Verbreiterung der sensorischen epithelia an der Spitze, wie in Ift20 CKO gesehen / CKO-Mäuse (3A). Eine weitere klassische PCP Defekt Störung der gleichmäßigen Ausrichtung der Haarzellen der Cochlea, wie in den BBS8 gesehen werden - / - Mäusen sowohl mit Immunhistochemie (3B, Pfeil nach rechts) und mit SEM (3C). Neben fehlorientierten Bündel, abgeflacht und unförmige Bündel werden ebenfalls häufig beobachtet (3B, Mitte Pfeil, 3D). Oft Kreisbündel, wie in 3E gezeigt hat, sind vorhanden, vor allem in Haarzellen völlig frei von Kinozilien. Mis-Lokalisation des Kinozilium ist ebenfalls üblich.
Das MIS-lokalisierten Kinozilium kann oder kann nicht auf die stereociliary Bündel (3B, Pfeil nach links; 3F) befestigt werden. Beispiele dafür, wie bu zu quantifizierenndle Orientierung und Kinozilien oder Bündel Positionierung sind in Abbildung 3G und 3H gezeigt. Die Ausrichtung der einzelnen Bündel kann dann durch Bestimmen der Drehung des Bündels von relativ zu einer senkrecht zu der Reihe von Zellen Säule erstreckenden Linie beurteilt werden, die die inneren und äußeren Haarzellen trennt. Zellen mit einer normalen Ausrichtung entlang dieser senkrechten Achse ausgerichtet sind und so eine Drehung von 0 ° (Figur 3G) haben. Die Position des Kinozilium oder Zentrum der stereociliary Bündel kann durch Überlagern einer Positions Gitter auf der Lumenoberfläche der Haarzellen und dann die Position der Kinozilien oder innerhalb des Gitters (Abbildung 3I) bündeln Bestimmung aufgetragen werden. Mutationen in Cilien Gene beeinflussen oft Zilien Länge und so die Länge des Kinozilium beurteilt werden kann. In CEP290 RD16 / RD16 Mutanten, Kinozilien sind länger als in der Kontrollgruppe (3J). Da die Zilien zurückzieht,ist es entscheidend, Alter abgestimmt Wurfgeschwister zu haben und Messungen aus der gleichen Region der Cochlea zu nehmen. Um gute Bilder für die Analyse und Quantifizierung erhalten, sowohl für die Immunhistochemie und SEM ist es entscheidend, die Deckmembran zu entfernen. 3F zeigt eine REM-Aufnahme, in der die Deckmembran nicht vollständig entfernt worden ist.
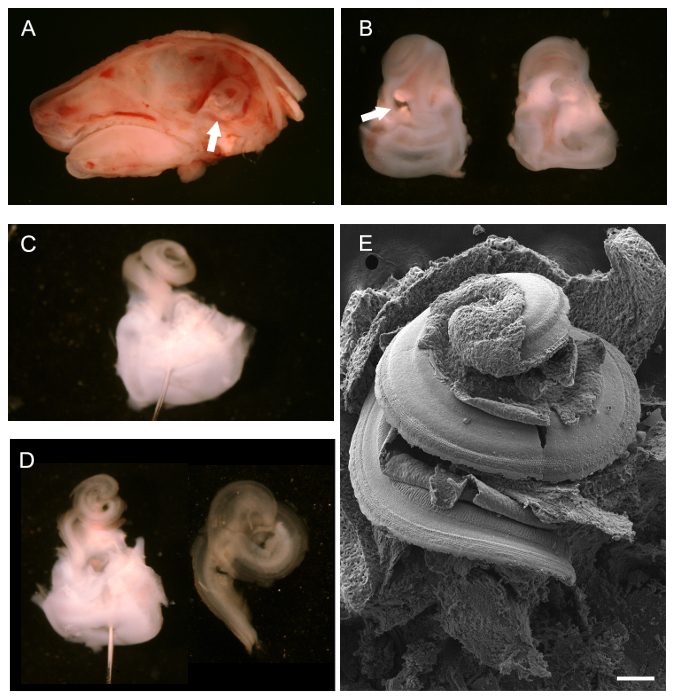
Abbildung 1. Dissection eines Entwicklungs Maus Cochlea (P0). (A) Mid-Linie sagittale Sektion von P0 Maus Kopf mit Gehirn entfernt. Der weiße Pfeil zeigt auf die Position der knöchernen Labyrinth. (B) ventrale (links) und Rücken (rechts) Blick auf seziert knöchernen Labyrinthe. Die Schnecke ist nach oben hin befindet sich mit der vestibulären Teil an den unteren Weiß Pfeil zeigt auf das ovale Fenster. (C) Das knöcherne Labyrinth achterner Entfernen der äußeren Knorpel der Cochlea. Ein Stift wurde durch das Gleichgewichtssystem platziert. (D) links, gleiche Ansicht wie in C nach dem Entfernen der Membran der Reissner und Tektorialmembran. Richtig, isoliert Schneckengang bereit für die Montage. (E) Rasterelektronenmikroskopische Aufnahme einer intakten, ausgesetzt Cochlea-Spirale auf den Boden des Schneckengang ausgesetzt, einschließlich der Sinnesepithel. Maßstabsbalken ist 100 um. . (A - D) angepasst von Mai-Simera et al, 2012 25 Bitte hier klicken, um eine größere Version dieser Figur zu sehen.

Abbildung 2. Morphologie und Immunfluoreszenz in der Systemsteuerung Cochlea (A - C). Rasterelektronenmikroskopische Aufnahmen der basalen turn in der embryonalen (E18.5) Wildtyp cochleae. Eine Reihe von inneren Haarzellen (unten) und drei Reihen von äußeren Haarzellen (oben) werden getrennt und eingelagert von Stützzellen. Chevron-förmigen stereociliary Bündeln orientieren gleichmäßig in Richtung der Seitenkante jeder Haarzelle (oberer Bildrand). Bei E18.5 decken zusätzliche Mikrovilli die Scheitelflächen der Haarzellen, unter den stereociliary Bundles und eingelagerten Stützzellen (B). (C) Eine einzelne Mikrotubuli-basierte Kinozilium (weißer Pfeil), wird an der Spitze des Bündels befinden, hier von der Seitenkante gezeigt. (D - G) Immunfluoreszenzfärbung von Basalwindung postnatalen Tag 1 (P1) Wildtyp cochleae. Phalloidin Etiketten filamentösen Aktin in Stereozilien und kortikalen Aktin an der Zellperipherie (D, E, G). Myosin 7a ist ein Marker für inneren und äußeren Haarzellen (E). Zo_1 beschriftet die Tight Junctions in-zwischen den Zellen, ist es eine große Schnittmuster-Herstellungszelle Bounda zu unterscheidenRies (F). Acetyliertes α-Tubulin ist als Marker für die Kinozilium am Scheitel des Bündels (F, G weißer Pfeil) eingesetzt. Interne Mikrotubuli sind auch durch acetyliertes α-Tubulin markiert, die reichlich in Säule Zellen (G weißen Stern) insbesondere sind. Maßstabsbalken A: 10 & mgr; m, B: 5 um, C: 1 & mgr; m, DG. 5 & mgr; m Bitte klicken Sie hier eine größere Version dieser Figur zu sehen.
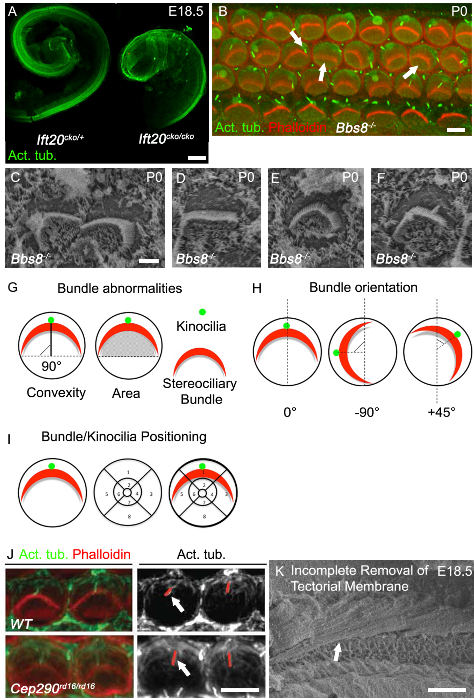
Abbildung 3. Cochlear Phänotyp in Cilia Mutanten. (A) starke Verkürzung der Ift20 CKO / CKO Cochlea-Kanäle im Vergleich zur Kontrolle. Seziert Cochlea-Kanäle mit acetylierten Tubulin bei E18,5 gefärbt. (B ) insgesamt Halterung Bilder der basalen Cochlea wiederum in BBS8 - / - Mutante (P0). Phalloidin-markierten Aktinfilamenten, Stereozilien (rot), acetyliertes Tubulin Kinozilien (grün). Stereociliary Bündel in BBS8 - / - Cochlea variabel gedreht (Pfeil nach rechts), abgeflacht und / oder mislocalized (Mitte Pfeil). Kinozilien sind mislocalized oder axonemes fehlen (Pfeil links). (C - F) Höhere Vergrößerung SEM stereociliary Bündel und Kinozilien in BBS8 - / - OHC. In C gedreht Bündel, in D, Bündel abgeflacht, in E, kreisförmige Bündel und in F mislocalized Kinozilien. (G - I) Schematische Darstellung des Bündels Anomalie Quantifizierung. (G) links, bündeln Konvexität (Höhe); der kürzeste Abstand zwischen dem Scheitelpunkt des Bündels und der Linie, die durch beide Enden des Bündels "Arme" erstreckt. als ddurch die durchgezogene schwarze Linie epicted. Richtig, die Fläche unter der Bündel; das Gebiet. (H) Schematische Darstellungen der Kriterien für die Ausrichtung der stereociliary Bündel zu quantifizieren. Der Drehwinkel des Bündels relativ senkrecht zu der Reihe von Zellen erstreckt Säule zu einer Linie berechnet. (I) Schematische Darstellung der Kriterien für die Positionsanalyse Kinozilien und stereociliary Bündel. Eine segmentierte Gitter wird über den Umfang des Haarzelle gelegt und die Position festgestellt. (J) mit höherer Vergrößerung Bild von Phalloidin-markierten stereocilia Bündel (rot) und acetylierte Tubulin-markierten Kinozilien (grün) der äußeren Haarzellen in P0 Cochlea. In der benachbarten monochromatischen Tafel identifizieren roten Linien die Kinozilien, die in Cep29 länger RD16 / RD16 Mutanten im Vergleich zur Kontrolle (weiße Pfeile). (K) REM-Aufnahme von embryonalen Cochlea mit unvollständige Entfernung von Deckmembran. RahmenBarren A: 100 & mgr; m, B: 5 um, C - F: 2,5 um, I: 5 um, J: 50 & mgr; m. (A - F)... Modifiziert nach May-Simera et al, 2015 8, J Nachdruck mit freundlicher Genehmigung von Rachel et al, 2012 27 Bitte hier klicken, um eine größere Version dieser Figur zu sehen.
Diskussion
Bei Cochlea-Gewebe für die Analyse vorzubereiten, gibt es ein paar wichtige Punkte zu beachten. Zum einen Hintergrund in der genetischen Unterschiede können die Cochlea-Phänotyp zu ändern, ist es notwendig zu analysieren und zu vergleichen, nur littermate Kontrollen machen. Zweitens vollständige Entfernung des Deckmembran ist erforderlich, um die besten Bilder mit Immunhistochemie zu erhalten, und ist wesentlich für SEM. Die Deckmembran ist eine undurchsichtige Struktur und kann die Zellen der Sinnesepithel direkt darunter verdeckt, so dass Abbildungs schwieriger. Gelegentlich während der Verarbeitung kann der Deckmembran zurückschrecken, die Haarzellen aufzudecken. Auch in diesen Fällen ist die Entfernung dringend empfohlen. Dieser Schritt erfordert Geduld und Übung. Drittens Immunhistochemie Antikörper gegen Ciliar- Proteine, insbesondere diejenigen, die mit dem hochverdichteten Basaltemperatur lokalisieren, kann eine Herausforderung und Optimierung erfordern werden. Betrachten Antigen-Retrieval durchführen, die Intensivierung der permeabilsierung Schritte oder die Konzentration oder die Zeit der Fixierung verringert. Schließlich, wenn die Kinozilium Imaging (der primäre Zilien auf den Haarzellen der Cochlea gefunden) im Hinterkopf behalten, dass es von P0 zurückzuziehen beginnt - P1 vorwärts in einem Basis-Spitze Steigung. Wenn daher die Länge des Kinozilium Messung ist es wichtig, Haarzellen aus der gleichen Region der Cochlea und im Alter abgestimmt Tieren zu vergleichen. Die eingelagerten Stützzellen haben auch primären Zilien, die einfahren nicht. Es muss zwischen tragenden Zelle Wimpern und Haarzelle Kinozilien sehr sorgfältig vorgenommen werden.
Da Mäuse reifen, wird es immer schwieriger zu sauber das Cochlea Sinnesepithelien isolieren, aufgrund der Verkalkung der zeitlichen Knochen und Knochen Labyrinthe. Entkalkung des Gewebes erforderlich ist, die mit weiteren Immuntechniken nicht immer kompatibel ist, aber die Prüfung des Brutto Phänotyp erlaubt und ist auch mit SEM Zubereitung kompatibel. Inzucht-Maus strAINS zeigen oft Gehör Mängel wie Haarzellenverlust oder erhöhtem Hirnstamm-Antworten (ABRs), aufgrund von Mutationen in bekannten Gehör Gene oder Gene modifier. Deshalb ist es wichtig Alter abgestimmt Wurfgeschwister-Kontrollen oder züchten auf einer alternativen genetischen Hintergrund zu vergleichen.
Eine der Einschränkungen dieser Analyse ist, dass bei Mäusen, die Kinozilium beginnt Post Geburt zurückziehen und ist nicht mehr auf adulten Haarzellen. Aus diesem Grund Kinozilien Messungen können nur bei der Entwicklung von Gewebe durchgeführt werden. Auch ist es notwendig, sorgfältig zu altersgleichen Kontrollen für Vergleiche zwischen Mutante und Kontrollproben auszuwählen. Eine weitere Einschränkung ist, dass Ciliar- mutierten Mäusen bisher analysiert nicht schweren Hörstörungen anzuzeigen (dh., Hirnstamm Antworten, FAEP oder otoakustischen Emission, OAE), auch wenn Cochlea Entwicklung beeinträchtigt wird. In Übereinstimmung damit Hörschäden sind nicht eine gemeinsame menschliche Ziliopathie Phänotyp. In Ausnahmefällen, Verlust von hearing ist eine der wichtigsten Funktionen von Alström Syndrom, die durch Mutationen in der basalen Körperprotein verursacht ALMS1 28,29. Dies legt nahe, dass stereociliary Bündelmorphologie ist nicht notwendigerweise auf Hörstörungen in Cilien Mutanten verbunden sind, wahrscheinlich, weil der Korrektur Neuorientierung Bündel später in der Entwicklung, wie es für Vangl2 CKO Mutanten 30 berichtet. Wenn die Ziliopathie Spektrum verbreitert wird Usher-Syndrom, die häufigste angeborene Ursache von Taubblindheit zu schließen, dann Hörstörungen wird sehr relevant. Die jüngsten Daten haben gezeigt, dass mehrere Proteine im Zusammenhang auch mit dem Flimmer lokalisieren Usher-Syndrom und sind in Ciliar- bezogenen Prozessen beteiligten 31, aber ob diese Proteine zu PCP-Signalisierung beziehen ist noch nicht untersucht worden.
Bisher haben für Cochlea-PCP Mängel analysiert meisten Ciliar- Mausmutanten nur vage untersucht worden. Die Techniken in diesem Manuskript beschrieben erlauben eine umfangreiche Detaillierung derCochlea-Phänotyp, die zweifellos zu einer genaueren Verständnis der Ciliar- Beteiligung bei der Festlegung wirbel PCP Signalisierung führen wird. Trotz der großen Zahl von Ziliopathie Mausmodelle zur Verfügung, überraschend wenige wurden im Hinblick auf die Cochlea-PCP Defekte untersucht. Ein häufiger Fehler im Zusammenhang mit diesen Modellen ist embryonalen Letalität. Da jedoch die Entwicklung von Cochlea embryonal die Rolle der Flimmerhärchen in PCP in den Entwicklungs Ohr untersucht werden können noch untersucht werden wird. Darüber hinaus kann sehr frühen embryonalen Letalität mit bedingten Knockouts umgangen werden. FOXG1 Cre 32 Mäuse, erhältlich von JacksonLaboratories, sind gemeinsam mit inactivategenes von Interesse verwendet in thedeveloping Innenohr von E8.To Bisher wurden Bemühungen in erster Linie auf die Prüfung krankheitsverursachenden Gene Ziliopathie jedoch Erforschung anderer Zilien verwandte Proteine und deren Auswirkungen auf PCP-Signalisierung während der Entwicklung einen besseren Einblick in cil vorsehenia Biologie und Funktion.
Wenn ein Gehör Phänotyp in den Mausmodellen vermutet wird analysiert werden, können weitere Analysen umfassen audiometrische Untersuchungen von FAEP 33 oder OAE 34. Cochlear Explantat Verlängerungsassays (wie in der May-Simera et al., 2012, 25), können auch zur Identifizierung von konvergenten Erweiterung Mängel bei früheren Entwicklungszeitpunkten durchgeführt und erlauben werden. Die Züchtung von Cochlea Explantate ermöglicht auch die Behandlung mit verschiedenen Signalaktivatoren oder Inhibitoren, die Explantation Erweiterung ändern können, was zu einer mechanistischen Verständnis der Entwicklungsprozesse beteiligt beitragen. Obwohl bekannt ist, dass die nach der Geburt Kinozilium fährt 11,13,14 ist diese Zurückziehen nicht in Zusammenhang mit ciliary Mutanten gründlich angesprochen. Es wäre von Interesse sein, zeitspezifische Messungen von Kinozilien Entstehung und das Zurückziehen in Zilien nehmen mutants.Considering dass eine primäre Rolle für Ciliar- ProProteine ist die Bewegung der Fracht entlang von Mikrotubuli, es sehr wahrscheinlich ist, dass diese Proteine auch Aspekte der intrazellulären Transport entlang des Zytoskeletts 35-37 regeln kann. Eine Untergruppe von Zilien Proteine wurden 8 gezeigt Handel und asymmetrischen Lokalisierung von PCP-Moleküle beeinflussen. Lokalisierung durch Immunhistochemie von PCP-Moleküle, insbesondere membranassoziierten Proteine wie Vangl2, Frz3 und Dsh, wird deshalb empfohlen, festzustellen, ob PCP-Moleküle mislocalized werden. Etablierung von Polaritäten scheint ein vielseitiges Angelegenheit, und es gibt Anzeichen dafür, für eine zusätzliche Zelle autonomen Weg zu sein, die auch für die korrekte PCP in Haarsinneszellen 38 erforderlich ist. Eine aktuelle Papier zeigte, dass G-Protein-abhängige Signal die Migration der Flimmer-Steuerelemente in einem zellautonome Weise 39. In Übereinstimmung mit einer Rolle für ciliary Proteine in der Lokalisierung der Moleküle Polarität, heterotrimeren G-Protein-alpha-Untereinheit i 3 (Gαi3) localization in BBS8 und Bbs6 Knockout Cochlea 8,39 gestört.
Die Unterscheidung, die Rolle der einzelnen Ciliar- Komponenten und deren unterschiedliche Auswirkungen auf die PCP-Signalisierung wird uns einen besseren Einblick in die Rolle der Zilien in der richtigen Polarität zu etablieren. Von besonderer Bedeutung ist zwischen ciliary Proteine funktionieren in einem ciliary Zusammenhang vs. nicht-ciliary Funktionen traditionell als ciliary Proteine, wie ihre Rolle bei der Regulierung nicht ciliary bezogen intrazellulären Transport zu unterscheiden. Der hohe Grad an Regelmäßigkeit in vielen Aspekten der Cochlea-Struktur, einschließlich eines Mobil Strukturieren und stereociliary Bündelorientierung, ist es möglich, feine Veränderungen in der Entwicklung von PCP in Reaktion auf entweder genetische oder molekularen Störungen in Cilien verwandte Proteine zu detektieren. In Anbetracht, dass es viele Ciliar- Mausmodelle zur Verfügung stehen, und dass die Entwicklung der Maus Cochlea ist einer der besten Orte, PCP zu untersuchenSignalisierung, ist es von großem Interesse zu erfahren, inwieweit einzelne Protein Mutationen Cochlea Entwicklung stören.
Offenlegungen
The author declares no competing financial interests.
Danksagungen
Der Autor möchte Matthew Kelley, Tiziana Cogliati, Jessica Gumerson, Uwe Wolfrum, Rivka Levron, Viola Kretschmer und Zoe Mann und für die kritische Bewertung des Manuskriptes. Diese Arbeit wurde durch den Sofja Kovalevskaja-Preis (Humbodlt Foundation) und der Johannes-Gutenberg-Universität, Mainz, Deutschland finanziert.
Materialien
| Name | Company | Catalog Number | Comments |
| Tools/Equipment | |||
| Silicone elastomere - Sylgard 184 | Sigma-Aldrich | 761028-5EA | See Note 2 |
| Micro dissecting scissors-straight blade | Various | ||
| Fine forceps (no. 5 and 55) and blunt forceps | Various | ||
| Dissecting microscope. | Various | ||
| Uncoated glass microscope slides | Various | ||
| Microscope cover slips (22 mm × 40 mm × 0.15 mm) | Various | ||
| Transfer pipettes | Various | ||
| Minutien pins | Fine Science Tools | 26002-10 | |
| SEM sample holder | tousimis | 8762 | |
| Scanning electron microscopy studs | TED PELLA | 16111 | |
| PELCO Tabs: Carbon adhesive | TED PELLA | 16084-3 | |
| Fluorescent Microscope | Various | ||
| Critical Point Dryer | Various | ||
| Scanning Electron Microscope | Various | ||
| Glass microscope slides | Various | ||
| Glass coverslips | Various | ||
| Kimwipe Tissue | Various | ||
| Fine Paint Brush | |||
| Reagents | |||
| 1× Phosphate buffered saline (PBS) | Gibco/Life Technologies | 10010023 | |
| Paraformaldehyde (PFA) (EM Grade Required for EM) | Various | Prepare a 4% solution in 1× PBS made fresh each time. EM Grade Required for EM. | |
| 2.5% Glutaraldehyde Grade1 | Sigma-Aldrich | G5882 | |
| Tris-HCl (pH 7.5) | Various | ||
| NaCl | Various | ||
| CaCl 2 | Various | ||
| Triton X-100 | Various | ||
| Normal Goat Serum | Various | ||
| AffiniPure Fab Fragment Donkey Anti-Mouse IgG (H+L) | Jackson ImmunoResearch | 715-007-003 | |
| Fluoromount-G Mounting media | SouthernBiotech | 0100-01 | |
| 10× Hanks’ Balanced Salt Solution (HBSS) | Gibco/Life Technologies | 14065 | |
| Hepes | Gibco/Life Technologies | 15630-080 | |
| Osmium tetroxide (OsO4 ) | Sigma-Aldrich/Fluka Analytical | 75632 | |
| Tannic acid | Sigma-Aldrich | 403040 | |
| Ethanol 200 proof | Various | ||
| Antibodies | |||
| anti Arl13b | Protein Tech | 17711-1-AP | Suggested concentration 1:1000 |
| anti acetylated tubulin (611-B1) | Sigma-Aldrich | T6793 | Suggested concentration 1:800 |
| anti gamma tubulin (GTU-88) | Sigma-Aldrich | T6557 | Suggested concentration 1:200 |
| anti Zo_1 | Invitrogen | 40-2300 | Suggested concentration 1:500 |
| Myosin VI | Proteus Biosciences | 25-6791 | Suggested concentration 1:1000 |
| Myosin VIIa | Proteus Biosciences | 25-6790 | Suggested concentration 1:1000 |
| anti Vangl2 | Merk Millipore | ABN373 | Suggested concentration 1:250 |
| anti Gαi3 | Sigma-Aldrich | G4040 | Suggested concentration 1:250 |
| Alexa Fluor® 488 Phalloidin | Invitrogen/Life Technologies | A12379 | Suggested concentration 1:300-1000 |
| Alexa Fluor® 568 Phalloidin | Invitrogen/Life Technologies | A12380 | Suggested concentration 1:300-1000 |
Referenzen
- Waters, A. M., Beales, P. L. Ciliopathies: an expanding disease spectrum. Pediatr Nephrol. 26, 1039-1056 (2011).
- May-Simera, H. L., Kelley, M. W. Cilia, Wnt signaling, and the cytoskeleton. Cilia. 1, 7 (2012).
- Ross, A. J., et al. Disruption of Bardet-Biedl syndrome ciliary proteins perturbs planar cell polarity in vertebrates. Nat Genet. 37, 1135-1140 (2005).
- Ezan, J., Montcouquiol, M. Revisiting planar cell polarity in the inner ear. Seminars in cell & developmental biology. 24, 499-506 (2013).
- Semenov, M. V., Habas, R., Macdonald, B. T., He, X. SnapShot: Noncanonical Wnt Signaling Pathways. Cell. 131, 1378 (2007).
- Wang, J., et al. Regulation of polarized extension and planar cell polarity in the cochlea by the vertebrate PCP pathway. Nat Genet. 37, 980-985 (2005).
- Montcouquiol, M., et al. Identification of Vangl2 and Scrb1 as planar polarity genes in mammals. Nature. 423, 173-177 (2003).
- May-Simera, H. L., et al. Ciliary proteins Bbs8 and Ift20 promote planar cell polarity in the cochlea. Development. 142, 555-566 (2015).
- Jones, C., et al. Ciliary proteins link basal body polarization to planar cell polarity regulation. Nat Genet. 40, 69-77 (2008).
- Lim, D. J. Functional structure of the organ of Corti: a review. Hearing research. 22, 117-146 (1986).
- Nayak, G. D., Ratnayaka, H. S., Goodyear, R. J., Richardson, G. P. Development of the hair bundle and mechanotransduction. The International journal of developmental biology. 51, 597-608 (2007).
- Denman-Johnson, K., Forge, A. Establishment of hair bundle polarity and orientation in the deveoping vestibular system of the mouse. J. Neurocytol. , 821-835 (1999).
- Sobkowicz, H. M., Slapnick, S. M., August, B. K. The kinocilium of auditory hair cells and evidence for its morphogenetic role during the regeneration of stereocilia and cuticular plates. Journal of neurocytology. 24, 633-653 (1995).
- Denman-Johnson, K., Forge, A. Establishment of hair bundle polarity and orientation in the developing vestibular system of the mouse. Journal of neurocytology. 28, 821-835 (1999).
- van Dam, T. J., et al. The SYSCILIA gold standard (SCGSv1) of known ciliary components and its applications within a systems biology consortium. Cilia. 2, 7 (2013).
- Blacque, O. E., Sanders, A. A. Compartments within a compartment: what C. elegans can tell us about ciliary subdomain composition, biogenesis, function, and disease. Organogenesis. 10, 126-137 (2014).
- Wallingford, J. B., Mitchell, B. Strange as it may seem: the many links between Wnt signaling, planar cell polarity, and cilia. Genes & development. 25, 201-213 (2011).
- Borovina, A., Ciruna, B. IFT88 plays a cilia- and PCP-independent role in controlling oriented cell divisions during vertebrate embryonic development. Cell reports. 5, 37-43 (2013).
- Huang, P., Schier, A. F. Dampened Hedgehog signaling but normal Wnt signaling in zebrafish without cilia. Development. 136, 3089-3098 (2009).
- Ocbina, P. J., Tuson, M., Anderson, K. V. Primary cilia are not required for normal canonical Wnt signaling in the mouse embryo. PloS one. 4, e6839 (2009).
- Jones, C. G. Scanning electron microscopy: preparation and imaging for SEM. Methods Mol Biol. 915, 1-20 (2012).
- Curtin, J. A., et al. Mutation of Celsr1 disrupts planar polarity of inner ear hair cells and causes severe neural tube defects in the mouse. Current biology : CB. 13, 1129-1133 (2003).
- Wang, Y., Guo, N., Nathans, J. The role of Frizzled3 and Frizzled6 in neural tube closure and in the planar polarity of inner-ear sensory hair cells. The Journal of neuroscience : the official journal of the Society for Neuroscience. 26, 2147-2156 (2006).
- Montcouquiol, M., Jones, J. M., Sans, N. Detection of planar polarity proteins in mammalian cochlea. Methods Mol Biol. 468, 207-219 (2008).
- May-Simera, H., Kelley, M. W. Examining planar cell polarity in the mammalian cochlea. Methods Mol Biol. 839, 157-171 (2012).
- Yin, H., Copley, C. O., Goodrich, L. V., Deans, M. R. Comparison of phenotypes between different vangl2 mutants demonstrates dominant effects of the Looptail mutation during hair cell development. PloS one. 7, e31988 (2012).
- Rachel, R. A., et al. Combining Cep290 and Mkks ciliopathy alleles in mice rescues sensory defects and restores ciliogenesis. J Clin Invest. 122, 1233-1245 (2012).
- Jagger, D., et al. Alstrom Syndrome protein ALMS1 localizes to basal bodies of cochlear hair cells and regulates cilium-dependent planar cell polarity. Human molecular genetics. 20, 466-481 (2011).
- Collin, G. B., et al. The Alstrom Syndrome Protein, ALMS1, Interacts with alpha-Actinin and Components of the Endosome Recycling Pathway. PloS one. 7, e37925 (2012).
- Copley, C. O., Duncan, J. S., Liu, C., Cheng, H., Deans, M. R. Postnatal refinement of auditory hair cell planar polarity deficits occurs in the absence of Vangl2. The Journal of neuroscience : the official journal of the Society for Neuroscience. 33, 14001-14016 (2013).
- Sorusch, N., Wunderlich, K., Bauss, K., Nagel-Wolfrum, K., Wolfrum, U. Usher syndrome protein network functions in the retina and their relation to other retinal ciliopathies. Advances in experimental medicine and biology. 801, 527-533 (2014).
- Hebert, J. M., McConnell, S. K. Targeting of cre to the Foxg1 (BF-1) locus mediates loxP recombination in the telencephalon and other developing head structures. Dev Biol. 222, 296-306 (2000).
- Willott, J. F. Chapter 8, Measurement of the auditory brainstem response (ABR) to study auditory sensitivity in mice. Current protocols in neuroscience. , Unit8 21B (2006).
- Martin, G. K., Stagner, B. B., Lonsbury-Martin, B. L., et al. Chapter 8, Assessment of cochlear function in mice: distortion-product otoacoustic emissions. Current protocols in neuroscience. , Unit8 21C (2006).
- Finetti, F., et al. Intraflagellar transport is required for polarized recycling of the TCR/CD3 complex to the immune synapse. Nature cell biology. 11, 1332-1339 (2009).
- Sedmak, T., Wolfrum, U. Intraflagellar transport molecules in ciliary and nonciliary cells of the retina. J Cell Biol. 189, 171-186 (2010).
- Yuan, S., Sun, Z. Expanding horizons: ciliary proteins reach beyond cilia. Annual review of genetics. 47, 353-376 (2013).
- Tarchini, B., Jolicoeur, C., Cayouette, M. A molecular blueprint at the apical surface establishes planar asymmetry in cochlear hair cells. Developmental cell. 27, 88-102 (2013).
- Ezan, J., et al. Primary cilium migration depends on G-protein signalling control of subapical cytoskeleton. Nature cell biology. 15, 1107-1115 (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten