Method Article
在Ciliopathy鼠标突变耳蜗平面 - 细胞极性表型的评价
摘要
Primary cilia influence various signaling pathways. The mammalian cochlea is ideal for examining planar cell polarity (PCP) signaling. Cilia dysfunction affects cochlear outgrowth, cellular patterning and hair cell orientation, readouts of PCP. Our goal is to analyze PCP signaling in mouse cochlea via phenotypic analysis, immunohistochemistry and scanning electron microscopy.
摘要
In recent years, primary cilia have emerged as key regulators in development and disease by influencing numerous signaling pathways. One of the earliest signaling pathways shown to be associated with ciliary function was the non-canonical Wnt signaling pathway, also referred to as planar cell polarity (PCP) signaling. One of the best places in which to study the effects of planar cell polarity (PCP) signaling during vertebrate development is the mammalian cochlea. PCP signaling disruption in the mouse cochlea disrupts cochlear outgrowth, cellular patterning and hair cell orientation, all of which are affected by cilia dysfunction. The goal of this protocol is to describe the analysis of PCP signaling in the developing mammalian cochlea via phenotypic analysis, immunohistochemistry and scanning electron microscopy. Defects in convergence and extension are manifested as a shortening of the cochlear duct and/or changes in cellular patterning, which can be quantified following dissection from developing mouse mutants. Changes in stereociliary bundle orientation and kinocilia length or positioning can be observed and quantitated using either immunofluorescence or scanning electron microscopy (SEM). A deeper insight into the role of ciliary proteins in cellular signaling pathways and other biological phenomena is crucial for our understanding of cellular and developmental biology, as well as for the development of targeted treatment strategies.
引言
初级纤毛是长基于微管附属物,从大多数哺乳动物细胞的表面上延伸。初级纤毛经常被混淆与运动纤毛,其中总有每个细胞多,而其目的是在整个膜表面移动的液体。初级纤毛,与此相反,采用感觉角色并因此也被称为感觉纤毛。一旦早已被人遗忘,这种细胞器最近被"重新发现"它与人类遗传病1的众多协会的结果。理想的位置作为信号的细胞器,初级纤毛已显示调节众多信号通路,其中有许多是不仅在组织稳态和疾病重要的,但也发展2中。
示出一个将与纤毛功能障碍相关联的第一信号通路是非典型Wnt信号传导途径,也被称为平面细胞极性(PCP)途径 > 3。在果蝇中初步确定这信号级联反应,是胚胎发育的关键;特别是用于会聚和扩展过程和细胞在上皮4的平面中的正确方向。设置调节蛋白的核心的顺序信令转换方向提示这最终导致细胞骨架重排,并导致上皮细胞在平面5的协调极化。衔接和延伸的过程是绝对必需的蜗管伸长和正确的蜂窝图案6。由于这是通过PCP途径的激活调节,耳蜗PCP突变体的最显着的表型中的一个是一个缩短的蜗管与紊乱感觉上皮7。同样,小鼠突变,缺乏纤毛,也表现出这样的融合和扩展型8,9,但恰恰这是如何调控仍有待澄清。
ve_content">由于收敛和扩展步骤是耳蜗管的生长,以及蜗管内的感觉上皮细胞图案化临界,显影耳蜗是其中脊椎动物发育过程中检查PCP信令理想器官。的器官尔蒂,给予该线耳蜗管,是由必须被均匀地取向为耳蜗的功能10非感官支持细胞和mechanosensory毛细胞的专门感觉上皮的术语。本mechanosensory毛细胞是所谓的由于从表皮板延伸纤毛束每个感觉毛细胞11(顶面)。这些充当机械感觉的,尽管其命名为纤毛主要传感器,实际上是由改性肌动蛋白基于灯丝的微绒毛。在每个字形的头发束,三排纤毛的以高度有序的和常规巴被组织ttern在楼梯状的方式。真实基于微管纤毛,称为kinocilia,需要用于该纤毛束 12的发展和方向。在每次毛细胞,一个单一的kinocilium被物理连接到纤毛束,位于中央相邻纤毛的最高行。该kinocilium的确切功能尚不清楚,一个假设是,因为他们从微绒毛12成熟kinocilium'拉'的纤毛成形。在脊椎动物中,在耳蜗kinocilia仅存在瞬时和从头发细胞之前听到11,13,14的发作缩回小鼠。在严重缩短耳蜗管显影耳蜗结果纤毛的完全丧失,错形成及误取向纤毛束,以及错误置位的基体8,9。一个功能纤毛不只是由纤毛轴丝的。纤毛相关的许多蛋白质功能发生在本地化的纤毛相关的子域复合物,如基体,过渡区,或纤毛轴丝15。基础体温,从中心体的中心粒母亲衍生,也是从纤毛向外延伸进入细胞体内微管微管组织中心并能调节细胞内贩卖和走私纤毛。睫状肌的过渡区是纤毛功能被组织纤毛化合物16的进口和出口方面管制的另一个区域。
多个研究已经确定纤毛和非经典Wnt(PCP信令)之间的连接,虽然确切机制尚不清楚17。睫状和PCP基因冗余和细胞极性的广义细胞异常的敏感性,使得难以突变直接链接到特定的PCP-赤字。一个PCP信令的读出出局的是基体和PRIMAR的定位Ÿ纤毛,因此分离主要由二次缺陷是具有挑战性的。在斑马鱼和小鼠突变一些研究表明信号18-20纤毛和Wnt之间没有联系。在数据差异可能反映物种,组织,或在朝向Wnt信号睫状捐款颞依赖性差异。此外,如果基体保持工作正常Wnt信号的响应可能会被保留。一个更深入的了解纤毛蛋白在细胞信号通路及其它生物现象的作用,是对我们的细胞和发育生物学的理解,以及为有针对性的治疗策略的发展至关重要。
研究方案
使用和实施安乐死的动物都按照制度和政府的指导方针和规定,通过CO 2吸入和颈椎脱位最常见。
1.试剂的制备
注:在开始时,准备使用分析纯化学药品所有试剂。使用蒸馏水分子级和去离子水,除非另有说明的解决方案。
- 磷酸盐缓冲盐水(1×PBS)中:通过在1升的H 2 O中溶解8克氯化钠,0.2克氯化钾,1.44克的 Na 2 HPO 4和0.24克KH 2 PO 4使1升1×PBS中的将pH调节至7.4,用HCl。 PBS不需要是无菌的并且可以储存在室温。请注意,此缓冲器被无CaCl 2或MgCl 2的制作。
- 多聚甲醛(4%PFA):在通风橱准备PFA的4%溶液在1×PBS中。添加多聚甲醛粉40克,以1升1X PBS的。溶解,搅拌并加热至约60℃,慢慢地添加氢氧化钠逐滴提高pH值。一旦粉末溶解,调整pH到7.4,用HCl。通过0.45微米过滤器过滤,并冷冻等分试样。除霜每个实验新鲜等分试样。
- 三硝基甲苯缓冲液:准备的0.1M的Tris-HCl(pH值7.5),0.15 M氯化钠,0.1%的Triton X-100溶液在1升0.1M的Tris-HCl(pH7.5)中溶解8.77克NaCl。加入1 ml的Triton X-100。搅拌使之溶解。商店的Triton缓冲在室温。
- TRITON模块:加入1 ml山羊血清到9毫升三硝基甲苯缓冲准备10%山羊血清中的Triton缓冲。保存在4℃。如果使用在小鼠升高初级抗体,以1比200稀释到的Triton块的分块步骤添加山羊抗小鼠IgG Fab片段。
注意:如果计划使用扫描电子显微镜(SEM)的样品,下面列出制备另外的试剂。 - 的Hanks'平衡盐溶液(HBSS)与钙和镁:通过从原液稀释制作的HBSS 1倍溶液在无菌蒸馏水H 2 O作为HBSS缓冲液是复杂的制造和有风险,最好是订购预制10X储液。 HBBS缓冲常规使用的最终浓度如下:1.26毫米氯化钙2,0.49毫MgCl 2的-6H2O,0.41毫硫酸镁 -7H2O,5.33毫米氯化钾,0.44毫KH 2 PO 4,4.17毫碳酸氢钠 ,137.93毫摩尔NaCl ,0.34毫的 Na 2 HPO 4,5.56毫摩尔葡萄糖。
- Hepes缓冲液:准备在1×HBSS的0.1M HEPES溶液中,通过在1升1×HBSS缓冲液中溶解23.8克HEPES。
- 扫描电子显微镜的固定剂(SEM修复):通过在Hepes缓冲液稀释电子显微镜级戊二醛(2.5%)和多聚甲醛(4%)准备固定剂用于SEM。添加氯化钙 2至10mM的终浓度。
- 1%四氧化锇(OSO 4)在Hepes缓冲液; 1%四氧化锇在水中的稀释:四氧化锇在Hepes缓冲液的储备液,并separatel中的Y无菌蒸馏水2 O,以1%的终浓度。四氧化锇是剧毒,是最常见的为4%的溶液出售。
- 1%(重量/体积)单宁酸:将0.5克鞣酸在50ml无菌蒸馏水H 2 O过滤器通过一个0.45孔径过滤器过滤消毒。
- 梯度乙醇溶液系列稀释:用无菌蒸馏水2 O 200标准乙醇在30,50,70,90和95%的乙醇溶液。对于最后的乙醇漂洗,需要100%的乙醇200证明。使用的200度乙醇刚刚打开一瓶最后冲洗。
2.组织的选择
- 理想情况下,检查胚胎16.5天(E16.5)和产后第3天(P3)的年龄介于胚胎或年轻的幼崽。
注:骨迷路和颞骨骨化使小鼠成熟清扫越来越复杂。此外kinocilia,唯一真正基于微管纤毛对耳蜗毛细胞中发现,在开发过程中缩回,并且不再存在于成年小鼠。 - 固定后,脱钙成人耳蜗。地点解剖(见第3)骨迷宫,于2ml EDTA(在PBS中4.13%),pH值7.3,在微量离心管3 - 4天的旋转。每天补充EDTA。组织有软化后,冲洗1.5毫升以上PBS 3次,每次5分钟就增加一搅拌章动器。
3.耳蜗解剖
- 通过颈椎脱位或CO 2吸入安乐死后(100% 的 CO 2),除去头。用剪子的手术刀刀片或小对,根据动物的大小,沿着矢状中线解剖头在鼻子开始和尾端延伸。一双镊子上卸下从头骨的每一半大脑。识别颞骨,其含有内耳的显影骨迷宫(参见图 1A中的箭头)。
- 使用一对用于牛肝菌仔细分离从头骨(颞骨)骨迷宫。这样做解剖显微镜下。轻轻运行镊子骨迷宫下方PRISE远离颅骨骨组织。在动物实验中达到P4骨迷宫仍然软骨,可以不破坏很容易地删除。
- 剥离之后,使用镊子解剖的尖端清除椭圆形和圆形的窗户,让一个小口子耳蜗螺旋的顶点。前蜗管的进一步解剖修复骨迷宫。为了能够容易去除盖膜(见3.7),修复骨迷宫在1.5ml 4%PFA在冰上5分钟。
注意:如果不需要去除盖膜,不再固定是建议(见4.1 - 4.3)。耳蜗管解剖前颞骨的简要固定有助于解剖过程和拆除盖膜。邮政解剖和Corti器的曝光,furt她的固定是必要的。 - 进一步剖析骨迷宫揭露耳蜗感觉上皮如下。将骨迷宫中含有PBS便于清扫一个黑色硅胶elastomere涂层解剖盘。使用minutien销如果需要以固定的组织。使用minutien销,将它们通过骨迷宫朝上耳蜗螺旋的腹侧前庭部。
注意:黑色硅胶elastomere菜:混合硅elastomere基本组件用木炭粉,以获得不透明黑色。添加固化剂并倾入一个或更多个培养皿(玻璃或塑料)。真空干燥去除残留气泡。干菜肴使用之前完全。 - 用细镊子(#5)删除外软骨暴露蜗管。开始在卵圆窗;插入镊子尖底到卵圆窗,轻轻地撬开软骨,慢慢向上对移动顶尖。
- 耳蜗管曝光后,取出腹面,在赖斯纳的膜。用细对镊子在蜗管的底部夹住Reissner变的膜和在向上运动剥开。形象化的蜗管的背侧,包括感觉上皮。
- 下面(选购)的说明卸下盖膜。对于SEM或kinocilium的免疫组化或纤毛束取出盖膜。
- 使用非常精细的钳子(#55或更细),在耳蜗的基础掐盖膜,向上剥离走向顶点。
注:盖膜是光学透明的,这使得它难以辨认。往往不是该膜在一块脱落,虽然它不容易显现,因为它是从科尔蒂的暴露器官被拉断人可以感觉到的阻力。 - 暴露柯蒂氏器后,进一步固定组织为d下面旁切。保留前庭区,以帮助组织进一步的准备。
4.固定
- 对于常规免疫组织化学固定在1.5ml 4%PFA的解剖骨迷宫在4℃下于2小时一章动器。
注意:由于不同的抗体和抗原,变型中的长度和固定的组合物的敏感性,可能需要并应该为每个抗体进行优化。 - 固定后,通过对具有增加的搅动一章动器在1.5ml以上PBS中的3次漂洗5分钟洗涤样品。样品可以处理之前被存储在PBS在4℃几周。
- 如果制备样品的SEM,在SEM中修复弄不好解剖颞骨(参见1.7)中于室温2小时。由1.5毫升以上Hepes缓冲上增加一个搅拌5章动器分3次冲洗清洗。商店在Hepes缓冲液,在4℃直至进一步处理。存储的时间超过几个星期的不推荐秒。
5.免疫组化
- 对解剖的样品在平底96孔板中的一个孔进行免疫组化分析。或者,使用PCR或离心管中。明智的做法是保留骨迷路的前庭部分,以方便处理。
- 通过在RT上缓慢搅拌一章动器在1.5ml的Triton缓冲孵育1小时透化组织。
- 由0.5毫升三硝基甲苯块孵育在室温下至少1小时的块组织。如果使用鼠标中提出的主要抗体,以1比200稀释(见1.4)添加抗鼠IgG Fab片段,以块。这大大降低了非特异性小鼠组织的抗小鼠IgG的结合。
- 孵育在曲通块O / N轻轻搅拌稀释于4℃初级抗体的组织。抗体稀释取决于所用抗体(参见6.1节)。另外孵化初级antibodieS表示在RT 2小时。理想的情况下使用0.5毫升初级抗体稀释液的最小体积。如果抗体是有限的,使用的抗体稀释度完全包住的组织的最小的体积。
- 通过漂洗1.5毫升以上的Triton缓冲液,15分钟的最小的3倍,在具有增加的搅动一章动器洗净组织。
- 在的Triton块在RT上的章动器1小时孵育在厂家稀释的荧光染料缀合的二级抗体的组织建议的浓度(1000通常为1:200-1)。使用0.5毫升次级抗体稀释液的最小体积。
- 离心稀释的第二抗体以13,000×g离心以使用3分钟前,以尽量减少二级抗体聚集体的非特异性结合。这一步免受光组织起以避免漂白的荧光染料。
- 如在步骤5.5中,由于1.5ml以上的Triton缓冲,最小的3次漂洗洗涤组织15分钟,在一个章动器增加搅拌。在PBS样品储存在4°C,直到准备安装。
6.抗体选择
注:推荐抗体及其稀释液的来源列于具体材料和设备的表中。在第5节进行抗体孵化。
- 可视化的基于微管kinocilium,使用一个纤毛轴丝标记诸如抗Arl13b(1:1000)或抗乙酰-α微管蛋白(1:800)。可视化使用抗体抗γ微管蛋白的基体(1:200),或任何其他中心体标志物。
- 以可视化的肌动蛋白纤维丰富,纤毛束,加毒伞素(1:300 - 1000)偶联到几个不同的荧光团到二级抗体孵育之一。鬼笔环肽还标签其它丝状肌动蛋白的结构包括围绕每个上皮毛细胞的周围的皮质肌动蛋白丝。这是有助于确定各毛细胞的轮廓。使用另一种膜标记物,如抗ZO-1(1:500),如果需要的话。
- 标签使用抗肌球蛋白VI(1:1000)耳蜗毛细胞或肌球蛋白Ⅶa因子(1:1000)。这些名称可能会评估耳蜗长度使用。
注:优化显微镜要求使用合适的荧光染料标记的二抗。
7.安装和影像
- 将含有PBS一个黑色硅胶elastomere菜样本。用细镊子,从耳蜗螺旋删除前庭区。
- 非常小心地取出从耳蜗螺旋底层的软骨和间质。其余耳蜗螺旋包含在内沟,科蒂和外沟的器官。
- 转移耳蜗螺旋入放置在显微镜载玻片上的PBS下降。如果需要的话,在耳蜗螺旋分离成碎片相当于一匝。这个步骤是不必要然而,并可导致步骤l组织的OSS。耳蜗毛细胞的顶端表面(纤毛侧)应朝上朝向盖玻片。
- 吸走的PBS用滤纸的吸附剂组织或片,轻轻地重新定位耳蜗螺旋如果上皮细胞已经转移和重叠到自身。
- 添加安装媒体的直接下降到耳蜗样品,轻轻地在上面放置盖玻片,照顾,以避免气泡。无间隔是必需的;直接放置在盖玻片样品上。一种水溶性的,非荧光的,半永久性的安装平台,它不需要额外的步骤来保持在适当位置的盖玻片建议。安装媒体和盖玻片厚度应匹配显微镜规格。
- 使用配备有高倍率(63 - 100X)啶或激光扫描共聚焦显微镜,高数值孔径(1.2 - 1.4)的目标捕捉耳蜗毛细胞的顶端表面的图像。使用LOWER目标(5 - 20X)取重叠耳蜗螺旋的图像,以量化所述蜗管的长度。匹配激发激光器和发射滤波器来用于第二抗体的荧光基团。
8.扫描电子显微镜
- 从第4.3节继续。在Hepes缓冲液洗涤SEM固定的样品后,执行下通风以下步骤。以下方案可以很好地用于耳蜗组织并避免了与导电金属的使用溅射镀膜的。
- 后修复程序中的1%OSO 4在Hepes缓冲液1小时,随后洗涤3次用1毫升,每次5分钟,蒸馏水。 OSO 4的最小体积完全包住的组织应该被用来减少有毒废物。没有搅拌是必需的。
- 孵育在RT样品中的每个下面的解决方案,为1小时,以3次洗涤用1毫升蒸馏水,每次5分钟,在步骤之间:1%鞣酸水和FIL新鲜的使用前羊羔; 1%OSO 4在水中,在水中1%单宁酸,1%OSO 4中的水。
- 30,50,70,90,和95%的:通过温育梯度乙醇系列中的每个下面的稀释液10分钟,脱水样品。没有搅拌是必需的。
- 通过三个变化,每次5分钟,100%乙醇的转移样品(从200标准乙醇的新开瓶)。
- 运行虽然临界点干燥器下列制造商的说明将样品。
- 安装上使用于成像在一个电子显微镜之前的SEM存根的顶部导电性碳粘合剂样品。在立体显微镜,用一双细镊子和画笔轻轻样品与耳蜗上皮朝上的位置。使用示例的前庭部为"锚"的组织的残余部分。样品储存在干燥器中,直到成像。在琼斯(2012)21中描述进行SEM成像。
9。量化
- 免疫组化准备后,获取使用啶或激光扫描共聚焦显微镜图像。用于SEM制备后,使用扫描型电子显微镜图像的标本。图像尔蒂与暴露的耳蜗毛细胞和闰支持细胞的器官的顶端表面。
- 定义特定位置沿耳蜗管,如25,50,以及从基部75%,并利用这些突变体和对照样品之间耳蜗区域进行比较。分析并与他们同窝对照比较纤毛的突变体,如遗传背景的差异可以修改耳蜗的表型。
注:Corti器的开发中,从朝向顶点和基部两者中间基座延伸的梯度。在小鼠,发育不完全,直到P14,所以在相似的发展阶段和立场进行比较的区域是非常重要的。 - 使用附带的软件的异体显微镜拍照w表示该特定表型的量化的要求(见下文)。使用图像分析软件,如图像J或软件附带的显微镜测量长度,细胞计数和确定,如下所述蛋白定位。这些图形数据为条形图,散点图,箱印迹或直方图,比较突变体与控制。
- 耳蜗管(图3A)的总长度:
- 使用毛细胞标志物或鬼笔环肽,(这标志着纤毛束),确定并测量其中感觉上皮开始和结束。耳蜗管的长度通常短于纤毛突变体。
- 纤毛束异常( 图3B,D,E,G):
- 测量束凸(高度)作为该包的顶点,并且通过如在图3G中所示的束"臂"的两端延伸的线之间的最短距离,离开。另外,量化区如图3G,向右外毛细胞纤毛束的武器包围。如果毛细胞具有圆形纤毛束可以被识别计为总毛细胞的百分比。
注:在许多纤毛束的突变体的异常可以观察到,不论束方向。它难以准确地量化纤毛束异常。
- 测量束凸(高度)作为该包的顶点,并且通过如在图3G中所示的束"臂"的两端延伸的线之间的最短距离,离开。另外,量化区如图3G,向右外毛细胞纤毛束的武器包围。如果毛细胞具有圆形纤毛束可以被识别计为总毛细胞的百分比。
- 在纤毛束(图3B,C,G)的 方向:
- 评估各个相对束的方向,以垂直延伸,以分隔所述内和外毛细胞支柱细胞的行的线。与正常的取向单元沿此垂直轴对准,因此有0°的旋转。使用一个360°的符号或绝对偏离0°判断旋转角度。
- Kinocilia定位或纤毛束定位( 图3B,F,H):
- 伯爵在kinocilia缺少细胞的百分比。测量到该包的"顶点"或中心,距离kinocilium的距离。的束的"顶点"可能不容易确定,如果包是异常,所以束的中心,可以替代使用。
- 量化kinocilia和纤毛束的位置根尖毛细胞表面上,通过覆盖的位置的网格上的每个毛细胞和标记kinocilium任碱或纤毛束的顶点/中心的位置。将数据显示为每个类别的百分比位于网格的一个特定区域内,并通过叠置每个标记的位置到一个位置的网格。
注:在控制组织,kinocilia总是附着在纤毛束的顶点。在纤毛突变体,kinocilia经常丢失,错误定位但仍附着,或甚至完全从S脱离tereociliary捆绑。 - Kinocilia长度(图3I):
- 通过用纤毛轴丝标记标记测量kinocilium的长度。唯一的衡量标准,一个1.5微米的激光共聚焦平面内躺平kinocilia。确认纤毛通过观察扫描的组织的剖视图平躺。从耳蜗的相同区域相比较老化匹配样本由于kinocilium开发期间缩回。
- 极性蛋白的错误定位:
- 以下使用抗极性蛋白质,如Vangl2和Gαi3免疫组化,确定通过影像定位。
注:在某些纤毛突变,极性蛋白的本地化被打乱。这些包括Vangl2和Gαi3,这已被证明在Ift20,Bbs8和BBS6突变耳蜗被打乱。
注:如何量化和显示毛细胞POLARIT进一步的例子y可能在下面的文章中找到。 Curtin的,等。 (2003)当代生物学22,Montcouquiol,等。 (2003)自然7,王等人(2006)神经科学杂志23,Montcouquiol,等。 (2008)分子生物学24,5月Simera等方法。 (2012)分子生物学方法25,尹等人(2012)公共科学图书馆·26之一。
结果
耳蜗解剖和组织准备
去除大脑后,P0老鼠头,骨迷路,从后面看,可以看到( 图1A,白色箭头),并取消后中线矢状解剖图1B显示了耳蜗毛孤立骨迷宫朝上,腹,(左)和从后面,背(右)。白色箭头指向卵圆窗从中可以开始除去外软骨。一旦外软骨已经完全除去,暴露的耳蜗管,仍完好,可以观察到(图1C)。通过前庭区,协助解剖针的定位显示。两个销,设置在不同的角度,也可用于锚定组织。 图1D示出除去期Reissner'的后耳蜗管氏膜和盖膜(左)和分离的耳蜗上皮螺旋一旦已经从前庭区域分离,以准备安装用于免疫组织化学(右)。为了让什么样的暴露耳蜗毛的样子,一个完整的SEM准备如图所示1E的总体思路。
形态和免疫荧光控制耳蜗
制备耳蜗组织后,将含有柯蒂氏器耳蜗管的背表面被暴露,并且可以通过SEM或免疫荧光染色被查看。看作是一个整个安装制备,mechanosensory毛细胞(内毛细胞的一行和外毛细胞的三排)的四行可以区分。 图2A示出的底转的低倍率视图从胚胎小鼠耳蜗,准备˚F或SEM。注意基于肌动蛋白纤毛束均匀方向和对齐方式。此外,该纤毛束的形态是一致的,每束具有古典")"(上内毛细胞)或"W"(上外毛细胞)的形状。一旦在这个年龄接近倍率附加微绒毛可以看出,不仅在毛发细胞的顶面,而且在中间的支持细胞(图2B)的毛细胞。这些会退去的外毛细胞,两个在成人内毛细胞只留下三行纤毛束。 如在图2C中 (白色箭头)可以看出,单个基于微管kinocilium(真实初级纤毛)毗邻纤毛的最高行每个纤毛束的顶点。这些都是通过kinocilia链路连接到包。
荧光标记鬼笔带,其中实验室ELS肌动蛋白,强调了控制组织(图2D)的束的统一方向和形状。皮质肌动蛋白也标记,这是为了确定每个单独的毛细胞的顶圆周有用。共标识与鬼笔环肽和抗肌球蛋白7a中(图2E)抗体,毛细胞标记物,也有助于毛细胞和支持细胞之间进行区分。肌球蛋白7a是也用于测定耳蜗管延伸部分( 见图 3A)的有用标志物。抗乙酰化-α微管蛋白的抗体通常用于识别基于微管kinocilium(图2F)。作为支持细胞也怀有初级纤毛,从毛细胞发出与嵌入支持纤毛细胞来区分是很重要的。一个附加的膜标记物,如抗ZO-1(卵Occludens 1),这清楚地概述了耳蜗管的顶膜的镶嵌图案形成抗体,因此有益的(图2F)。进一步考虑的是,抗乙酰化-α微管蛋白抗体也标记内部微管等关心成像聚焦毛细胞顶端表面上时,应采取。在支柱细胞中的微管是特别致密(图2G,白星号)。鬼笔环肽和抗乙酰-α微管蛋白的标签的组合通常被用来同时识别纤毛束和相邻kinocilia(图2G,白色箭头)。
纤毛突变表型人工耳蜗
耳蜗管的伸长率收敛性和扩展缺陷的最佳读出出局之一,并缩短了耳蜗管在古典PCP突变体中观察到。在睫状突变耳蜗往往缩短了耳蜗管,并显示感觉上皮的显着变宽利亚在顶点,如在Ift20 CKO /被看见CKO小鼠( 图3A)。另一个古典PCP缺陷是中断耳蜗毛细胞的均一取向,如可以在Bbs8可见- / -小鼠两者与免疫组织化学( 图3B中,向右的箭头),并用扫描电镜(图3C)。除了 面向误束,扁平和畸形束通常也观察到( 图3B中,中间的箭头; 图3D)。很多时候圆形束, 如在图3E被看见,都存在,尤其是在毛细胞完全没有kinocilia的。在kinocilium的误定位也很常见。
误局部kinocilium可以或可以不被连接到纤毛束( 图3B中,左箭头;图3F)。如何量化蒲式耳例子ndle取向和kinocilia或束定位显示在图3G和 3H。每个单独的束的方向可以通过测定的相对束的转动在垂直于分隔的内和外毛细胞柱细胞的行延伸的线进行评估。与正常的取向单元沿此垂直轴对准,因此有0°(图3G)的旋转。的kinocilium或纤毛束的中心的位置,可通过毛细胞的腔表面上重叠的位置网格,然后确定kinocilia的位置或束栅格(图3I)内被绘制。在纤毛基因的突变往往影响纤毛长度,因此kinocilium的长度可以进行评估。在CEP290 RD16 / RD16突变体,kinocilia比对照组( 图3J)长。随着纤毛缩回,关键是要具有年龄匹配的同窝和进行测量从耳蜗的相同区域。以获得用于分析和量化良好的图象,为免疫组织化学和SEM,这是至关重要的,除去盖膜。 图3F示出的SEM显微照片,其中盖膜未被完全除去。
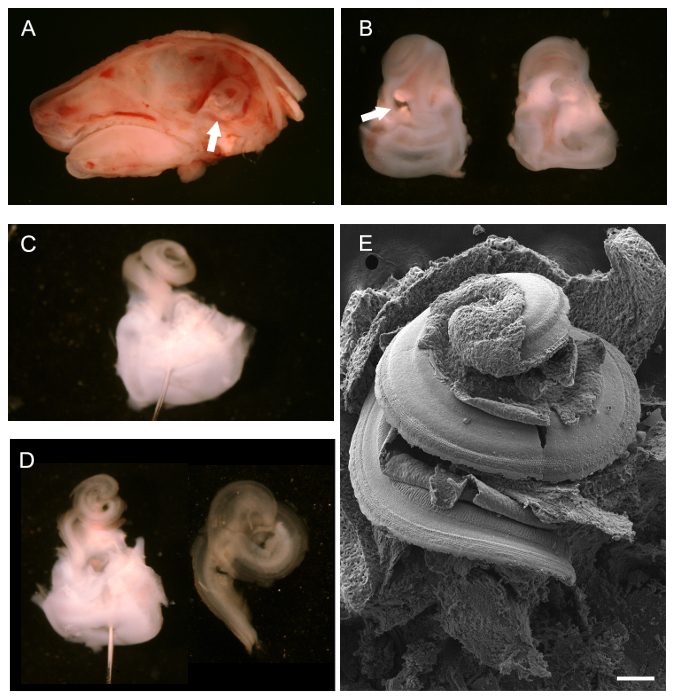
图1. 解剖一个发展中鼠标耳蜗(P0)的。(A)P0鼠标头部的中线矢状切除脑取出。白色箭头指向骨迷路的位置。 (B)腹(左)和背侧(右)的意见解剖骨迷宫。耳蜗位于朝向在底部白色箭头指向卵圆窗前庭部的顶部。 (三)骨迷路船尾器除去耳蜗的外软骨。销已放在通过前庭系统。 (D)左,去除赖斯纳的膜和盖膜后同样的观点在C。右的,孤立的蜗管准备安装。一个完整的,暴露的耳蜗螺旋露出蜗管的底板,包括感觉上皮(E)的扫描电子显微照片。比例尺为100微米。 (A - D)改编自五月-Simera 等人 ,2012 25 请点击此处查看该图的放大版本。

图2. 形态和免疫荧光控制耳蜗 (A - C)。基础TUR的扫描电子显微照片n的胚胎(E18.5)野生型耳蜗。内毛细胞(底部)和外毛细胞(顶部)的三排的一排被分离并通过支持细胞插。字形纤毛束均匀地定向朝向各个毛细胞(图像的上缘)的横向边缘。在E18.5额外的微绒毛覆盖毛细胞的顶表面,所述纤毛束的下方,插支持细胞 (B)。 (C)基于单个微管kinocilium(白色箭头),位于所述束的顶点,从横向边缘处所示。 (D - G)底转产后第1天(P1)野生型耳蜗的免疫荧光染色。鬼笔标签在小区外围(D,E,G)中的纤毛和皮质丝状肌动蛋白肌动蛋白。肌球蛋白7A是内,外毛细胞(E)的标志。 Zo_1标签紧密连接在中间细胞,使其成为一个伟大标志来区分细胞bounda里斯(F)。乙酰化α微管蛋白被用作标记用于kinocilium在束(F,G白色箭头)的顶点。内部微管也被乙酰化α微管蛋白,这是特别丰富的支柱中的单元格(G白星号)标记。比例尺答:10微米,B:5微米,C:1微米,DG:5微米请点击此处查看该图的放大版本。
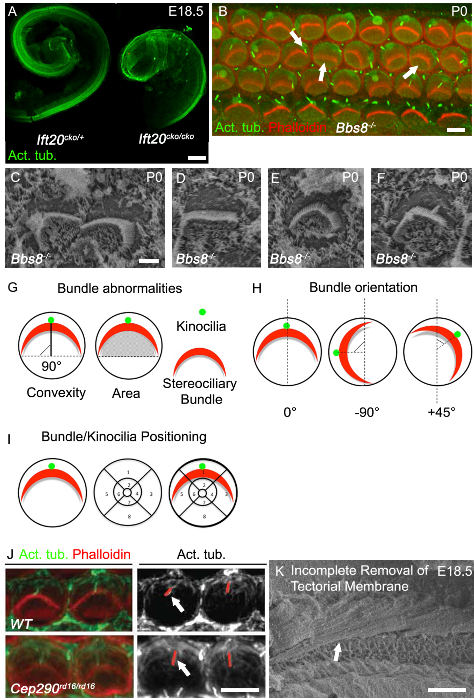
与对照相比, 图3耳蜗表型纤毛突变体。(A)Ift20 CKO /应注明缩短CKO耳蜗管道。在E18.5解剖耳蜗管道沾上乙酰化微管蛋白。 (B Bbs8耳蜗基底转强>)整装图像 - / -突变体(P0)。毒伞素标记的丝状肌动蛋白,纤毛(红色),乙酰化微管蛋白,kinocilia(绿色)。 / - -在Bbs8纤毛束耳蜗可变地旋转(右箭头),扁平和/或错误定位(中箭头)。 Kinocilia被错误定位或轴突缺失(左箭头)。 (C - F)纤毛束和kinocilia的高倍SEM在Bbs8 - / -耳蜗外毛细胞。在C,旋转束,在D,扁平捆绑,在E,圆捆在 F中错误定位kinocilia。 (G - I)捆绑异常量化的示意图。 (G)左,捆绑凸(高度);束的顶点,并且通过束"臂"的两端延伸的线之间的最短距离。为D由黑色实线epicted。右,区包下;的区域。 (H)的用于定量纤毛束的方向的标准示意图。束的旋转角度相对于垂直于柱细胞的行延伸的线来计算。 (I)的对kinocilia和纤毛束的位置分析的标准示意图。分段的网格铺设在毛细胞的圆周和位置指出。 (J)的鬼笔环肽标记的纤毛束(红色)和在P0耳蜗外毛细胞的乙酰化微管蛋白标记kinocilia(绿色)的更高放大倍率的图像。在相邻的单色面板,红色线识别kinocilia,这是在Cep29 RD16 / RD16突变体不再与对照相比(白色箭头)。胚胎耳蜗(K)SEM照片不完全去除盖膜。规模酒吧 :100微米,B:5微米,C - F:2.5微米,I:5微米,J:50微米。 。(A - F)。从五月-Simera 等人 2015年8,J重印修改许可雷切尔等,2012 27 请点击此处查看该图的放大版本。
讨论
当准备耳蜗组织进行分析,有要记住几个关键点。首先,在遗传背景的差异可以修改耳蜗的表型,因此有必要进行分析和比较只同窝对照。其次,需要彻底清除盖膜获得具有免疫最好的图像,是SEM至关重要。盖膜是不透明结构,并且可以直接模糊感觉上皮的细胞其下方,使得成像更具挑战性。偶尔在加工过程中,盖膜可能会退缩,露出毛细胞。即使在这些情况下,除去强烈建议。这一步需要耐心和实践。第三,使用针对纤毛蛋白质,特别是定位于高致密基体的那些,免疫抗体可以是具有挑战性的,需要优化。考虑执行抗原修复,加剧了permeabil化步骤,或降低浓度或固定的时间。最后,成像kinocilium(在耳蜗毛细胞中发现的主要纤毛)时,请记住,它开始从P0收起 - 起开始在基地到顶点梯度P1。因此,测量kinocilium的长度时,它以毛细胞从耳蜗的相同区域,并在年龄匹配的动物比较是很重要的。闰支持细胞也具有初级纤毛,不回缩。必须小心支持细胞纤毛和毛细胞kinocilia之间进行区分。
小鼠的成熟,它变得越来越难以干净地分离耳蜗感觉上皮,由于颞骨和骨迷宫的钙化。组织的脱钙是必需的,这并不总是与另外的免疫定位技术相容,但允许对毛表型的检查和也用SEM制剂兼容。近交系小鼠海峡AINS通常表现出听觉缺陷如毛细胞损失或升高的听性脑干反应(ABR上),由于在已知的听觉基因或修饰基因的突变。因此,它以比较年龄匹配的同窝对照或繁殖到另一个遗传背景是重要的。
一个这种分析的局限性在于,在小鼠中,kinocilium开始缩回后出生,不再存在于成人毛细胞。为此kinocilia测量只能在显影组织来完成。也有必要仔细地选择用于突变体和对照样品之间的比较年龄匹配的对照。另一个限制是,睫状突变小鼠分析迄今不显示严重的听觉功能障碍( 即 ,听性脑干反应,ABR上或耳声发射,耳声)即使当耳蜗发展受损。与此相一致,听力缺陷不是人类共同的ciliopathy表型。在特殊情况下,赫林的损失g为阿尔斯特伦症候群的主要特征,所引起的基体蛋白ALMS1 28,29突变之一。这表明,纤毛束形态不一定与听觉功能障碍的纤毛突变,可能是因为重新定位的纠正捆在发展以后作为被举报Vangl2 CKO突变体30。如果ciliopathy频谱扩大到包括Usher综合征,聋哑失明的最常见的先天性的原因,然后听觉功能障碍变得高度相关。最近的数据表明,向Usher综合征相关的几种蛋白也定位于纤毛和参与睫状相关的过程31,但这些蛋白是否与PCP信令尚未审查。
直到耳蜗PCP缺陷分析,现在大部分纤毛小鼠突变只被模糊地检查。在这个手稿中描述的技术允许一个广泛的,详细的耳蜗的表型,这无疑将导致纤毛参与的更精确的了解,建立脊椎动物PCP信号。尽管有大量可用ciliopathy小鼠模型的,令人吃惊的少已在耳蜗PCP缺陷来分析。这些模型相关联的常见缺陷是胚胎致死。然而,由于在显影耳蜗可以在显影耳朵embryonically审查PCP纤毛的作用仍然可以进行调查。此外,非常早期胚胎致死性可以使用条件敲除来规避。Foxg1 Cre的 32只小鼠,购自JacksonLaboratories,通常用于感兴趣inactivategenes 从 E8.To日期thedeveloping内耳,努力主要集中于研究致病ciliopathy基因但是其他的纤毛相关蛋白,以及如何探索这些影响发展可能提供更深入地了解CIL期间PCP信号IA生物学和功能。
如果一个听觉型涉嫌在小鼠模型中所分析,可能的进一步分析包括区域边界路由器33或耳声34听力测试。耳蜗植延伸测定(如在5 - Simera 等人所述 ,2011 25),也可以执行,并允许在早期发育时间点收敛延伸的缺陷的识别。耳蜗植体培养也允许与各种信令激活剂或抑制剂,其可以修改外植体延长治疗,从而促进所涉及的发育过程的机械理解。尽管已知该kinocilium出生11,13,14后缩回,这个缩回尚未彻底睫状突变体的情况下解决。这将是感兴趣的采取kinocilia出苗和退回的具体时间测量中纤毛mutants.Considering对于睫状亲主要作用teins是货物沿微管的运动,这是非常可能的是这些蛋白质也可以调节细胞内运输的方面沿着细胞骨架35-37。纤毛蛋白的一个子集已被证明影响贩运和PCP分子8的不对称定位。由PCP分子免疫定位,特别是膜相关蛋白如Vangl2,Frz3和DSH,因此,建议建立如果PCP分子错误定位。极性的建立似乎是一个多方面的事,并且有一个附加的细胞中自主通路,这也需要在感觉毛细胞38正确的PCP越来越多的证据。最近的一篇论文显示,使得G蛋白依赖的信号控制的细 胞自主的方式39纤毛的迁移。与纤毛蛋白的极性分子的定位作用一致,异G-蛋白α-I亚基3(Gαi3)●ocalization在Bbs8和BBS6打乱淘汰赛耳蜗8.39。
分别区分纤毛组件以及它们对PCP信号不同效果的作用,会给我们更深入地了解纤毛在建立正确的极性作用。特别重要的是睫状蛋白在纤毛中不起作用,与传统上认为睫状蛋白质的非纤毛功能,例如其在调节相关细胞内运输的非纤毛作用之间进行区分。高度在耳蜗结构中,包括蜂窝构图和纤毛束取向的许多方面的规律性,使得它能够检测响应于纤毛相关蛋白或遗传或分子扰动的PCP的发展微妙的变化。考虑到有许多纤毛的鼠标型号,以及发育中的小鼠耳蜗是考察PCP的最好的地方之一信号,这是极大的兴趣,要学到什么程度个别蛋白突变破坏耳蜗的发展。
披露声明
The author declares no competing financial interests.
致谢
笔者要感谢马修·凯利,蒂齐阿纳Cogliati,杰西卡Gumerson,乌韦·沃尔夫鲁姆,Rivka Levron,中提琴克雷奇默尔和Zoe曼和手稿其关键的评价。这项工作是由Sofja Kovalevskaya奖(与洪堡基金会)和约翰内斯 - 古腾堡大学,美因茨,德国资助。
材料
| Name | Company | Catalog Number | Comments |
| Tools/Equipment | |||
| Silicone elastomere - Sylgard 184 | Sigma-Aldrich | 761028-5EA | See Note 2 |
| Micro dissecting scissors-straight blade | Various | ||
| Fine forceps (no. 5 and 55) and blunt forceps | Various | ||
| Dissecting microscope. | Various | ||
| Uncoated glass microscope slides | Various | ||
| Microscope cover slips (22 mm × 40 mm × 0.15 mm) | Various | ||
| Transfer pipettes | Various | ||
| Minutien pins | Fine Science Tools | 26002-10 | |
| SEM sample holder | tousimis | 8762 | |
| Scanning electron microscopy studs | TED PELLA | 16111 | |
| PELCO Tabs: Carbon adhesive | TED PELLA | 16084-3 | |
| Fluorescent Microscope | Various | ||
| Critical Point Dryer | Various | ||
| Scanning Electron Microscope | Various | ||
| Glass microscope slides | Various | ||
| Glass coverslips | Various | ||
| Kimwipe Tissue | Various | ||
| Fine Paint Brush | |||
| Reagents | |||
| 1× Phosphate buffered saline (PBS) | Gibco/Life Technologies | 10010023 | |
| Paraformaldehyde (PFA) (EM Grade Required for EM) | Various | Prepare a 4% solution in 1× PBS made fresh each time. EM Grade Required for EM. | |
| 2.5% Glutaraldehyde Grade1 | Sigma-Aldrich | G5882 | |
| Tris-HCl (pH 7.5) | Various | ||
| NaCl | Various | ||
| CaCl 2 | Various | ||
| Triton X-100 | Various | ||
| Normal Goat Serum | Various | ||
| AffiniPure Fab Fragment Donkey Anti-Mouse IgG (H+L) | Jackson ImmunoResearch | 715-007-003 | |
| Fluoromount-G Mounting media | SouthernBiotech | 0100-01 | |
| 10× Hanks’ Balanced Salt Solution (HBSS) | Gibco/Life Technologies | 14065 | |
| Hepes | Gibco/Life Technologies | 15630-080 | |
| Osmium tetroxide (OsO4 ) | Sigma-Aldrich/Fluka Analytical | 75632 | |
| Tannic acid | Sigma-Aldrich | 403040 | |
| Ethanol 200 proof | Various | ||
| Antibodies | |||
| anti Arl13b | Protein Tech | 17711-1-AP | Suggested concentration 1:1,000 |
| anti acetylated tubulin (611-B1) | Sigma-Aldrich | T6793 | Suggested concentration 1:800 |
| anti gamma tubulin (GTU-88) | Sigma-Aldrich | T6557 | Suggested concentration 1:200 |
| anti Zo_1 | Invitrogen | 40-2300 | Suggested concentration 1:500 |
| Myosin VI | Proteus Biosciences | 25-6791 | Suggested concentration 1:1000 |
| Myosin VIIa | Proteus Biosciences | 25-6790 | Suggested concentration 1:1,000 |
| anti Vangl2 | Merk Millipore | ABN373 | Suggested concentration 1:250 |
| anti Gαi3 | Sigma-Aldrich | G4040 | Suggested concentration 1:250 |
| Alexa Fluor® 488 Phalloidin | Invitrogen/Life Technologies | A12379 | Suggested concentration 1:300 - 1,000 |
| Alexa Fluor® 568 Phalloidin | Invitrogen/Life Technologies | A12380 | Suggested concentration 1:300 - 1,000 |
参考文献
- Waters, A. M., Beales, P. L. Ciliopathies: an expanding disease spectrum. Pediatr Nephrol. 26, 1039-1056 (2011).
- May-Simera, H. L., Kelley, M. W. Cilia, Wnt signaling, and the cytoskeleton. Cilia. 1, 7 (2012).
- Ross, A. J., et al. Disruption of Bardet-Biedl syndrome ciliary proteins perturbs planar cell polarity in vertebrates. Nat Genet. 37, 1135-1140 (2005).
- Ezan, J., Montcouquiol, M. Revisiting planar cell polarity in the inner ear. Seminars in cell & developmental biology. 24, 499-506 (2013).
- Semenov, M. V., Habas, R., Macdonald, B. T., He, X. SnapShot: Noncanonical Wnt Signaling Pathways. Cell. 131, 1378 (2007).
- Wang, J., et al. Regulation of polarized extension and planar cell polarity in the cochlea by the vertebrate PCP pathway. Nat Genet. 37, 980-985 (2005).
- Montcouquiol, M., et al. Identification of Vangl2 and Scrb1 as planar polarity genes in mammals. Nature. 423, 173-177 (2003).
- May-Simera, H. L., et al. Ciliary proteins Bbs8 and Ift20 promote planar cell polarity in the cochlea. Development. 142, 555-566 (2015).
- Jones, C., et al. Ciliary proteins link basal body polarization to planar cell polarity regulation. Nat Genet. 40, 69-77 (2008).
- Lim, D. J. Functional structure of the organ of Corti: a review. Hearing research. 22, 117-146 (1986).
- Nayak, G. D., Ratnayaka, H. S., Goodyear, R. J., Richardson, G. P. Development of the hair bundle and mechanotransduction. The International journal of developmental biology. 51, 597-608 (2007).
- Denman-Johnson, K., Forge, A. Establishment of hair bundle polarity and orientation in the deveoping vestibular system of the mouse. J. Neurocytol. , 821-835 (1999).
- Sobkowicz, H. M., Slapnick, S. M., August, B. K. The kinocilium of auditory hair cells and evidence for its morphogenetic role during the regeneration of stereocilia and cuticular plates. Journal of neurocytology. 24, 633-653 (1995).
- Denman-Johnson, K., Forge, A. Establishment of hair bundle polarity and orientation in the developing vestibular system of the mouse. Journal of neurocytology. 28, 821-835 (1999).
- van Dam, T. J., et al. The SYSCILIA gold standard (SCGSv1) of known ciliary components and its applications within a systems biology consortium. Cilia. 2, 7 (2013).
- Blacque, O. E., Sanders, A. A. Compartments within a compartment: what C. elegans can tell us about ciliary subdomain composition, biogenesis, function, and disease. Organogenesis. 10, 126-137 (2014).
- Wallingford, J. B., Mitchell, B. Strange as it may seem: the many links between Wnt signaling, planar cell polarity, and cilia. Genes & development. 25, 201-213 (2011).
- Borovina, A., Ciruna, B. IFT88 plays a cilia- and PCP-independent role in controlling oriented cell divisions during vertebrate embryonic development. Cell reports. 5, 37-43 (2013).
- Huang, P., Schier, A. F. Dampened Hedgehog signaling but normal Wnt signaling in zebrafish without cilia. Development. 136, 3089-3098 (2009).
- Ocbina, P. J., Tuson, M., Anderson, K. V. Primary cilia are not required for normal canonical Wnt signaling in the mouse embryo. PloS one. 4, e6839 (2009).
- Jones, C. G. Scanning electron microscopy: preparation and imaging for SEM. Methods Mol Biol. 915, 1-20 (2012).
- Curtin, J. A., et al. Mutation of Celsr1 disrupts planar polarity of inner ear hair cells and causes severe neural tube defects in the mouse. Current biology : CB. 13, 1129-1133 (2003).
- Wang, Y., Guo, N., Nathans, J. The role of Frizzled3 and Frizzled6 in neural tube closure and in the planar polarity of inner-ear sensory hair cells. The Journal of neuroscience : the official journal of the Society for Neuroscience. 26, 2147-2156 (2006).
- Montcouquiol, M., Jones, J. M., Sans, N. Detection of planar polarity proteins in mammalian cochlea. Methods Mol Biol. 468, 207-219 (2008).
- May-Simera, H., Kelley, M. W. Examining planar cell polarity in the mammalian cochlea. Methods Mol Biol. 839, 157-171 (2012).
- Yin, H., Copley, C. O., Goodrich, L. V., Deans, M. R. Comparison of phenotypes between different vangl2 mutants demonstrates dominant effects of the Looptail mutation during hair cell development. PloS one. 7, e31988 (2012).
- Rachel, R. A., et al. Combining Cep290 and Mkks ciliopathy alleles in mice rescues sensory defects and restores ciliogenesis. J Clin Invest. 122, 1233-1245 (2012).
- Jagger, D., et al. Alstrom Syndrome protein ALMS1 localizes to basal bodies of cochlear hair cells and regulates cilium-dependent planar cell polarity. Human molecular genetics. 20, 466-481 (2011).
- Collin, G. B., et al. The Alstrom Syndrome Protein, ALMS1, Interacts with alpha-Actinin and Components of the Endosome Recycling Pathway. PloS one. 7, e37925 (2012).
- Copley, C. O., Duncan, J. S., Liu, C., Cheng, H., Deans, M. R. Postnatal refinement of auditory hair cell planar polarity deficits occurs in the absence of Vangl2. The Journal of neuroscience : the official journal of the Society for Neuroscience. 33, 14001-14016 (2013).
- Sorusch, N., Wunderlich, K., Bauss, K., Nagel-Wolfrum, K., Wolfrum, U. Usher syndrome protein network functions in the retina and their relation to other retinal ciliopathies. Advances in experimental medicine and biology. 801, 527-533 (2014).
- Hebert, J. M., McConnell, S. K. Targeting of cre to the Foxg1 (BF-1) locus mediates loxP recombination in the telencephalon and other developing head structures. Dev Biol. 222, 296-306 (2000).
- Willott, J. F. Chapter 8, Measurement of the auditory brainstem response (ABR) to study auditory sensitivity in mice. Current protocols in neuroscience. , Unit8 21B (2006).
- Martin, G. K., Stagner, B. B., Lonsbury-Martin, B. L., et al. Chapter 8, Assessment of cochlear function in mice: distortion-product otoacoustic emissions. Current protocols in neuroscience. , Unit8 21C (2006).
- Finetti, F., et al. Intraflagellar transport is required for polarized recycling of the TCR/CD3 complex to the immune synapse. Nature cell biology. 11, 1332-1339 (2009).
- Sedmak, T., Wolfrum, U. Intraflagellar transport molecules in ciliary and nonciliary cells of the retina. J Cell Biol. 189, 171-186 (2010).
- Yuan, S., Sun, Z. Expanding horizons: ciliary proteins reach beyond cilia. Annual review of genetics. 47, 353-376 (2013).
- Tarchini, B., Jolicoeur, C., Cayouette, M. A molecular blueprint at the apical surface establishes planar asymmetry in cochlear hair cells. Developmental cell. 27, 88-102 (2013).
- Ezan, J., et al. Primary cilium migration depends on G-protein signalling control of subapical cytoskeleton. Nature cell biology. 15, 1107-1115 (2013).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。