Method Article
Elektroporasyon tarafından Embriyonik Fare Koklear Eksplantlarından Kültür ve Gen Transferi
Bu Makalede
Özet
We present a method that describes isolation and culture of cochlear explants from embryonic mouse inner ear. We also demonstrate a method for gene transfer into cochlear explants via square-wave electroporation. The in vitro explant culture coupled with gene transfer technique enables researchers to study the effects of altering gene expression during development.
Özet
Auditory hair cells located within the mouse organ of Corti detect and transmit sound information to the central nervous system. The mechanosensory hair cells are aligned in one row of inner hair cells and three rows of outer hair cells that extend along the basal to apical axis of the cochlea. The explant culture technique described here provides an efficient method to isolate and maintain cochlear explants from the embryonic mouse inner ear. Also, the morphology and molecular characteristics of sensory hair cells and nonsensory supporting cells within the cochlear explant cultures resemble those observed in vivo and can be studied within its intrinsic cellular environment. The cochlear explants can serve as important experimental tools for the identification and characterization of molecular and genetic pathways that are involved in cellular specification and patterning. Although transgenic mouse models provide an effective approach for gene expression studies, a considerable number of mouse mutants die during embryonic development thereby hindering the analysis and interpretation of developmental phenotypes. The organ of Corti from mutant mice that die before birth can be cultured so that their in vitro development and responses to different factors can be analyzed. Additionally, we describe a technique for electroporating embryonic cochlear explants ex vivo which can be used to downregulate or overexpress specific gene(s) and analyze their potential endogenous function and test whether specific gene product is necessary or sufficient in a given context to influence mammalian cochlear development1-8.
Giriş
The mammalian organ of Corti is comprised of a mosaic of specialized cell types, including two types of mechanosensory hair cells as well as at least four types of nonsensory supporting cells making it an ideal model system to study normal cellular processes like proliferation, fate specification, differentiation and patterning. In addition, the normal development of these different cell types is essential for normal hearing function. Hence, it is crucial to understand the factors, both molecular and cellular, that regulate their development. However, the small size of the mouse cochlea as well as its inaccessibility poses a particular challenge for gene expression studies. Moreover, most of the cell fate specification and patterning events occur during embryonic time periods and are mostly completed before birth. Therefore, identification and characterization of signaling events during embryonic time periods is essential to gain insight into the molecular basis of cochlear morphogenesis.
Here, we demonstrate a method to culture intact cochlea in vitro from embryonic mouse inner ears. The rationale behind the use of this technique is that cultured cochleae maintain their molecular and morphological characteristics thereby providing a valuable model for investigating potential candidate genes and exploring the mechanisms involved in cochlear morphogenesis. Although transgenic mice can be used for gene expression studies, an in vitro system is often needed for monitoring specific gene functions. Moreover, cochlear cultures can be established from transgenic mouse embryos so that their in vitro development and response to various soluble factors and antagonists can be studied. Although embryos at day 13 (E13) are used in this protocol, cultures from E12 or E14 to early postnatal inner ears can give similar results.
We also present a gene transfer technique in cultured embryonic cochlear explants using square wave electroporation. Following the isolation of the cochlear explants, electroporation can be used to express DNA plasmids of gene(s) of interest in individual cells within the cochlear duct. This technique serves as a complementary approach to studies utilizing transgenic mice to gain insight into the molecular pathways underlying cellular phenotype. Using this method of gene transfer, a variety of epithelial cell types within the embryonic cochlea are transfected, thereby enabling loss-and gain-of-function analyses at the single-cell level. In addition, electrophysiological studies can also be performed in cochlear explant cultures8. This method of in vitro electroporation is relatively simple and straightforward, combined with minimal damage to the tissue, has resulted in a rapid expansion of this technique.
Protokol
NOT: canlı hayvanlar kullanarak tüm protokolleri gözden ve Kurumsal Hayvan Bakım ve Kullanım Komitesi (IACUC) tarafından onaylanmış ve resmi laboratuvar hayvanlarının bakımı ve kullanımı için yöntemler onaylı takip gerekir gerekir. Bütün tahlil temiz bir laminer akış tezgahı üzerinde, steril tekniği kullanılarak yapılmalıdır. Eldiven ve maske, istenirse, bu işlem sırasında giyilmelidir.
Embriyonik Fare İç Kulak 1. Diseksiyon
- Corti eksplant kültürlerin organ için ayarlama:
- Yaklaşık 30 dakika, UV ışık yakarak laminer akış doku kültürü kapağı sterilize ve kullanımdan önce% 70 etanol ile bir yüzeyin dezenfekte edilmesi. Buna ek olarak, ince diseksiyon araçları ve otoklav yoluyla embriyo diseksiyon veya kullanımdan önce en az 20 dakika süreyle% 70 etanol iliklerine Sylgard kaplı yemekleri dahil olmak üzere tüm diseksiyon aletleri sterilize. Temiz bir laminer akış clea hava kurumaya yemekleri ve araçlar% 70 etanol dökün ve izinn tezgah kullanmadan önce.
- Hazırlama steril Hank Dengeli Tuz Çözeltisi (HBSS) / (4- (2-hidroksietil) -1-piperazinetansülfonik asit), HEPES 10x HBSS ve% 0.5% 10 eklenmesi ve yaklaşık pH'ı 7.2'ye ayarlayın ve filtre sterilizasyonu ile (HEPES) karışımı 4 ° C'de, nihai çözelti saklayın. Daha iyi prosedür boyunca doku korumak için soğutulmuş HBSS / hepes çözeltisi içinde tüm diseksiyonları uygulayın.
- 15 ml'lik steril bir polipropilen tüp içinde taban membran matrisi bir 300 ul'lik bölüntü, steril (4 ° C) soğuk Dulbecco Modifiye Edilmiş Eagle Ortamı (DMEM) 5 ml ilave etmek suretiyle taban membran matrisi ile kaplayın cam alt yemekler. Içeriğini vorteks ile karıştırın ve kasesinin ortasına kadar mevcut tüm kültür kapsar, böylece her bir kültür kabı merkezine bazal membran matris DMEM karışımından 150 ul ilave edin. Kullanımdan önce en az 45 dakika süre ile 37 ° C inkübatör yemekleri ve mağaza örtün.
- Th içine HBSS soğutulmuş 4-5 ml dökünSteril polistiren petri kapları REE ve kaput kapalı bırakın.
- DMEM 9 ml N2 takviyeleri 100 ul, 10 ug / ml Cipro ve FBS, 1 ml ilave edilerek steril bir 15 ml'lik polipropilen bir tüp içinde kültür ortamı hazırlanır.
- Embriyoların izole edilmesi:
NOT: embriyonik farelerden alınan koklear eksplantlarm Bu prosedürde, hasat iç kulaklar embriyonik gün (E) den gübreleme gün sonra 13 temporal kemik E1 9 olarak kabul ediliyor. protokol de E12 dan E18 başlayan embriyonik fare iç kulakları ile kullanılabilir.- CO 2 ile zamanlanmış gebe fare Euthanize ve servikal dislokasyon veya uygun onaylanmış protokoller ile hayvan kurban. Doku kültürü odasında sterilite korumak için uzak laminer akış doku kültürü kaputu gelen euthanization yürütmek.
- Yukarı bakacak şekilde karın kağıt havlu üzerine ötenazi fare koyun ve% 70 etanol ile karın dezenfekte edin.
- Cildi kapma karın boşluğu açınBaşka bir el kullanılarak makas ile orta hat boyunca kavisli bir eliyle forseps ve kesme epidermis ve kas ile. Her iki tarafta iki dik kesim yapmak ve forseps ile bilateral uterin boynuz kaldırarak dikkatle rahim çekin ve bağ dokusu kullanılarak makas altından ayırmak.
- Laminer akışlı temiz bir tezgah soğutulmuş diseksiyon çözeltisi (HBSS / hepes karışımı) ve transfer ihtiva eden bir petri tabağına embriyonik zinciri yerleştirin.
- Plasenta dikkatlice embriyolar çıkarın ve diseksiyon çözeltisi içeren steril Petri kapları birine yerleştirin. Çözüm kanlı dönerse, yeni bir Petri kabı taşıyabilirsiniz.
NOT: Bu noktada, embriyolar, bir Theiler evreleme kılavuzunu kullanarak sahnelenecek edilebilir. - Temiz forseps veya makasla ile boyun bölgesinde kısma embriyolar başını kesmek ve soğutulmuş diseksiyon çözeltisi içeren taze Petri kabındaki başkanları yerleştirin.
- İç kulak Diseksiyon:
- Yeri oSoğuk diseksiyon içeren bir steril sylgard çanak ne embriyo baş
- Çözelti. ~ 1.6x bir büyütmede bir mikroskop altında çalışarak, göz bölgesi (Şekil 1A) etrafında ya da daha yakın Minutien işaretçilerini yerleştirerek embriyo baş hareketsiz.
- Steril forseps iki çift kullanarak dikkatli bir şekilde cilt kaldırmak ve orta hat (Şekil 1B) boyunca sırt tarafında kafatasını açmak. Kranial kavite ve temporal kemiklerin içinde yer alan iç kulaklar, bu aşamada (Şekil 1C, D) tespit edilebilir beyni çıkarın. Genellikle, iç kulak çevresine mevcut kan damarı, astar, bu aşamada (Şekil 1D), iç kulak belirlemek için bir işaret olarak kullanılabilir.
- Dokuda altına forseps yerleştirerek ve soğuk diseksiyon çözüm içeren yeni bir çanak kafatası ve transfer tabanından iç kulak izole ederek zamansal kemiklerden iç kulak incelemek (Şekil 1E, F).
Corti Eksplant Kültürler Organ 2. Nesil
NOT: Bu gelişme aşamasında, doku kıkırdak ve kolayca forseps kullanılarak disseke edilebilir.
- Orient ventral yüzü (Şekil 2A) yukarı bakacak ve yavaşça iç kulak (Şekil 2B) vestibüler bölümü ile Minutien pim keskin ucunu takarak iç kulak stabilize böylece iç kulak.
- Kullanımı ultra ince forseps koklea (Şekil 2C) kıkırdak kaldırmak dikkatlice oval pencereye yakın forseps bir ucunu kullanarak ve bir kesi yaparak örten kıkırdak kesip.
NOT: Bu örten kıkırdak bazen altına kazıma ile altta yatan koklear kanal gelen kıkırdak serbest bırakmak için kapalı forseps kullanmak yararlı olduğu durumda koklear kanal ile kaynaşmış olarak forseps kıkırdak içine çok derin takılı olmadığından emin olmak için önemlidir sKıkırdak, sert bir yere. Bu gelişme aşamasında, koklear spiral uzunluğu bir dönüş sadece dörtte üçü olduğunu. - Sonraki baz ya da çok apeks de ya koklear kanal tercih edilen bölgede forseps koyarak duyusal epitel maruz ve yavaşça koklea (Şekil 2B) çatısı çekerek.
NOT: Kokleanın çatı o analizini engelleyen duyusal epitel maske gibi tamamen kaldırılmalıdır.
NOT: duyusal epitel gözyaşı kolay olduğu gibi bu işlem nazikçe yapılmalıdır. - Koklear eksplant tabanı eşit düz böylece son adım olarak, dikkatle maruz duyusal epitel yatan bağ doku kaldırmak.
- Forseps kullanarak iç kulak vestibüler kısmından disseke koklea izole edin. Bu, daha önce ya da aşama 2.4 (Şekil 2E) sonra gerçekleştirilebilir.
- Bir bodrum membra içine disseke koklear duyusal epitel aktarınne matris kaplı kültür de bir 1,5 mm steril scooper (Şekil 2F) kullanılarak.
- Orient epitel lümenal yüzeyi ile koklear eksplant yukarı bakacak ve dikkatle doku dümdüz ve hafifçe çanak ekleyerek taze kültür ortamı 150 ul ile değiştirmek için bazal membran matris-DMEM çözüm aspire. Bakım, her eksplant kaplamalı cam lamel iyi yapışır ve kültür ortamı içinde yüzen olmadığından emin olmak için alınmalıdır. Koklear eksplant zarar vermemek için cam kuyuya yapıştırılması sırasında forseps ucu kadar sivri olduğundan emin olun.
- Yavaşça İstenilen bir zaman, in vitro olarak, genellikle 3-6 gün (DIV),% 5 CO2 ile 37 ° C 'de, bir doku kültürü kuluçka makinesi içinde bir steril 150 mm kültür çanağı ve yerine kültür kaplarına transfer. 1 DIV sonra, koklear eksplant kültürü çanak iyi yapışmış emin olmak için bir mikroskop altında kültürleri incelemek.
- Sonrasıistenen zaman uzunlukları için in vitro cubation, kültürler imünohistokimya için işlenir.
Not: eksplant kültürleri genellikle gelişim aşamasına, P0 eşdeğerdir 6 DIV için inkübe edilir. In vitro inkübasyondan sonra, kültürler, immünohistokimya gibi, daha aşağıda uygulama (Şekil 3B) için işlenebilir, RT-PCR, in situ hibridizasyon ve / veya Western blot.
3. Elektroporasyon aracılı gen transferi
- Elektroporasyon için ayarlama:
- Otoklavda veya yaklaşık 20 dakika boyunca% 70 etanol içinde ıslatılarak bir 100 mm Sylgard kaplı cam tabak sterilize ve kullanımdan önce temiz bir tezgah içinde kurumaya bırakın.
- Uygun maksi veya Midi-prep kitleri kullanılarak seçim bir ifade vektörü DNA hazırlayın. Bu protokolde kullanılan ifade vektörleri pIRES2-Atoh1.EGFP ve pCLIG-NeuroD1.EGFP vardır. DNA nihai konsantrasyon steril DNA, en az 1 ug / ul olmalıdır /RNAse içermeyen su.
- Embriyonik koklear eksplantlarından içine DNA electroporating:
- Taze 100 mm Sylgard kaplı çanak plazmid DNA çözeltisinin 10 ul ekle ve DNA çözeltisi (adım 2.5 de elde edilmiş), tam kesilmiş koklear eksplant aktarın.
- Çanak düzlemine dikey olacak şekilde yukarı bakacak şekilde epitelyum lümenal yüzeyi ile hafifçe koklea yatırın.
- Duyusal epiteli ve koklea tabanına bitişik bulunan pozitif raket (anot) doğru negatif kürek (katot) ile koklea iki tarafında elektrot kürekler yerleştirin.
Not: DNA, negatif yüklü olduğu için, pozitif elektrot ve duyu epitel bitişik sonda katot ucuna yerleştirilerek negatiften göç; DNA, çoğunlukla duyusal epitel yüzeyine geçer. - Elektro-kullanma, 24 mV 9-10 darbeler teslim, t ayak pedalı ile 30 msn darbe süresiO Electroporator ve ardından Electroporated cochlea'ya sıcak kültür ortamı 100 ul ekleyin.
- Tekrar tüm koklear eksplant ve ilgi tüm genlerin DNA için 3.2.1-4 adımları ve (adım 2.7) kaplama için bazal membran matris kaplı çanak içine electroporated cochleae aktarın. Daha sonra, bağışıklık kimyası için işlenecektir arzu edilen bir zaman uzunlukları için 37 ° C,% 5 CO2 ile nemlendirilmiş inkübatörde kültür Electroporated cochleae.
NOT: CD1 fare (yaklaşık 8-12 yavru) bütün bir çöp gelen koklea, izole microdissected, Electroporated ve <4 saat içinde kaplama olabilir.
4. Analiz Koklear Eksplantın Kültürlerin
Not: kültürleri genellikle gelişim aşamasına, P0 eşdeğerdir 6 DIV için inkübe edilir. In vitro inkübasyondan sonra, kültürler sabitlenmiş ve immünolojik hücre kimyası için işlendi.
- Inc istenilen uzunlukta sonraubation, kültür ortamı çıkarın ve hızlı bir şekilde fosfat-tamponlu salin (PBS) 'de koklear eksplant yıkayın ve oda sıcaklığında 15 dakika boyunca (PBS içerisinde hazırlanmıştır)% 4 paraformaldehid içinde inkübe edilir.
- 15 dakika boyunca üç kez ekleyerek PBS ile fiksatif yıkayın ve PBS içinde durulayın.
- % 10 keçi serumu içeren PBS-T ile bloke önce 30 dakika için PBS-T (PBS +% 0.5 Tween) ile geçirgenliği.
- 4 ° C de bir gece boyunca,% 1 keçi serumu ile PBS-T ile primer antikor ihtiva eden birincil antikor çözelti içinde inkübe edilir.
- Uygun Alexa-konjuge sekonder antikor ilave edilmeden önce PBS-T her biri 15 dakika kullanılarak oda sıcaklığında koklea üç kez yıkayın.
- Koklear eksplant cam lamel kültüre olduğundan, çanak lamel izole ve bir slayt monte edilerek tek tek ele alınabilir. Bu, oda sıcaklığında en az 1 saat için çözücü, OS30 kültür çanağı ıslatılmasıyla elde edilebilir. Steril jilet kullanarak, d lamel ayırmakish ve bir slayt monte ve bir floresan mikroskop altında görselleştirmek.
Sonuçlar
We describe a method to isolate cochlea from embryonic inner ears and micro-dissect to expose the sensory epithelium. Once dissected, it may be plated and cultured as an intact cochlear duct (Figure 3) and analyzed by immunohistochemistry. The cultured cochlear explants provide a useful assay to examine the effect of variety of soluble factors and pharmacological drugs on cochlear development. Following dissection of cochlear explants, electroporation technique can be used to misexpress genes of interest and examine their effect on cochlear morphogenesis. The results presented here demonstrate that forced expression of basic helix-loop-helix (bHLH) transcription factor, Atoh1 into cultured cochlear explants established from E13 inner ears leads to ectopic hair cell formation. In contrast, forced expression of another bHLH transcription factor, NeuroD1 in prosensory cells and nonsensory epithelial cells within GER leads to the formation of ectopic neurons.
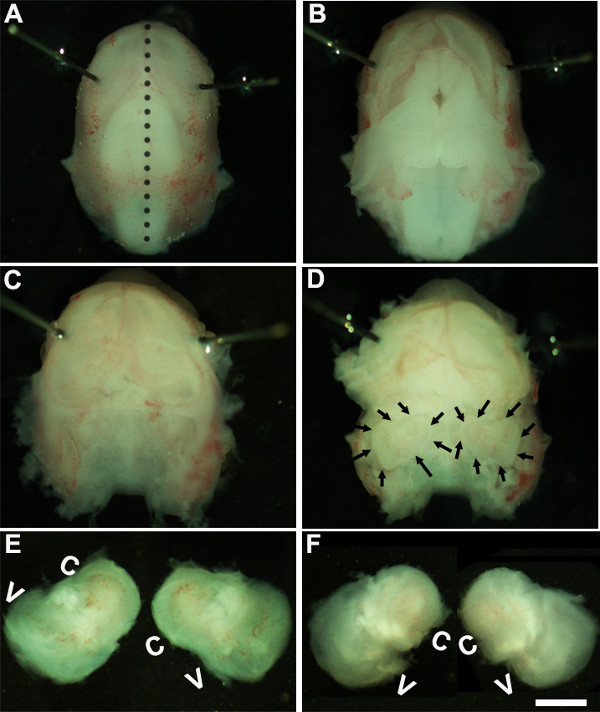
Figure 1: Dissection of the embryonic cochlea. Dissection steps involved in isolating developing cochleae from E13 mouse head as discussed in Part 1. Dotted line in (A) indicates dorsal midline and the borders of inner ears are indicated by arrows in (D). In (E), C indicates cochlea and V, vestibule. Scale bar: 1.0 mm.
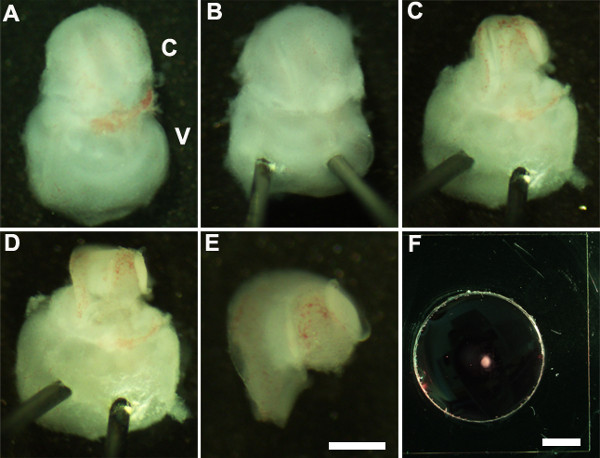
Figure 2: Generation of embryonic cochlear explant cultures. Panels (A-F) illustrate key steps in the dissection of the cochlea down to the sensory epithelium as described in Part 2. C, cochlea; V, vestibule. Scale bar: A-E, 100 m; F, 10 mm.
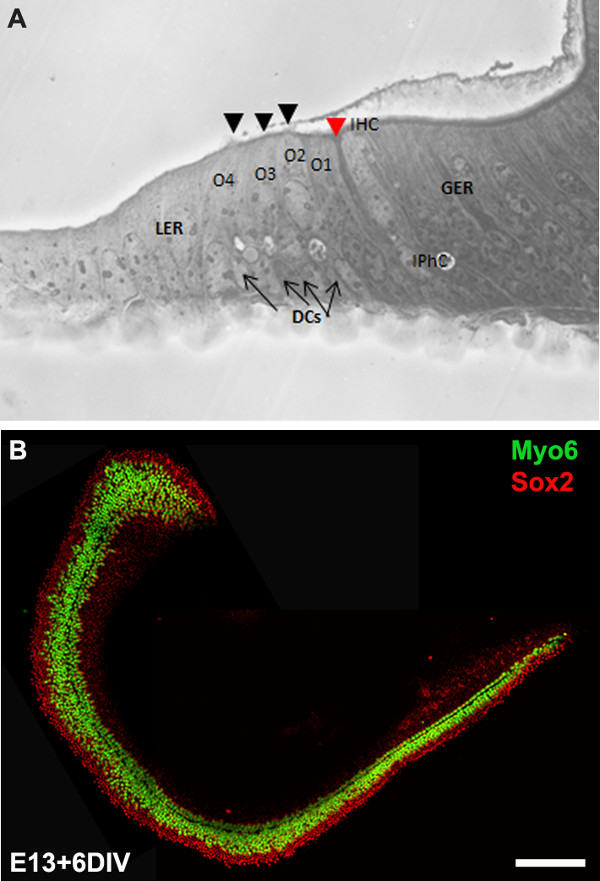
Figure 3: The development of the organ of Corti in cochlear cultures. The formation of hair cells and supporting cells occurs normally in cultured explants. Cross-sectional view of E13 cochlear explant incubated for 6 DIV (equivalent to P0) (B) and top-down view of a whole-mount cochlear explant immuno-stained with Myo7a in green and Sox2 in red demonstrates the presence of one inner and 3-4 rows of outer hair cells and surrounding support cells. Arrows point to Deiters’ cells and black arrowheads indicate the presence of stereociliary bundles within the cochlear explant. Arrowhead in red indicates the depression formed by the prominent pillar cell projection. IHC, inner hair cell; O1,2,3, three outer hair cells, DCs, Deiters’ cells; IPhC, inner phalangeal cell; GER, greater epithelial ridge which includes nonsensory epithelial cells present on the modiolar side of the epithelium; LER, lesser epithelial ridge, includes nonsensory epithelial cells present on strial edge of the sensory epithelium. Scale bar: B, 100 µm.

Figure 4: Electroporation of Atoh1.EGFP (A-C) and NeuroD1 into the organ of Corti explant culture. Embryonic (E) day 13 cochlear explants were established from WT CD1 mouse pups and electroporated with Atoh1.EGFP (A-C), NeuroD1-EGFP (D-F) reporter constructs as described and immunolabeled with hair cell-specific marker anti-Myo7a or neuronal marker, TuJ1 (β-tubulin III) in red. Electroporated cells which can be visualized by EGFP expression are seen throughout the GER, LER and sensory epithelium (SE) cells. The NeuroD1 transfected cochlear epithelial cells after 5 DIV acquire neuronal phenotype with dendritic processes, most of which are positive for TuJ1 while Atoh1 transfected cells are positive for Myo7a expression. SE, sensory epithelium; GER, greater epithelial ridge. Scale bar: A-C, 20 µm; D-F, 50 µm. Please click here to view a larger version of this figure.
Tartışmalar
Dahil olmak üzere, bir fare, iç kulağın membranöz labirent içindeki tüm hücreler duyusal duyunun ve spiral gangliyon nöronlarının her E8 10-14 civarında, ektodermin Beyin bitişiğinde yer otocyst placodally türevi elde edilir. E11 içinde otocyst ventral bölgesi koklear kanal oluşturmak üzere uzanır ve geliştirme devam ederken haline koklea içindeki epitel hücreleri yanı sıra otocyst diğer bölgelerinde bir grup, daha sonra ortaya çıkaracaktır prosensory yamalar olarak belirtilen mechanosensory saç hücreleri ve duyunun destekleyici hücrelerin farklı. Gelişmekte olan koklea, iç saç hücreleri bir satır ve dış saç hücrelerinin üç sıra E15.5 etrafında ve E17 ile tespit edilebilir, desenlendirme iç saç hücreleri, ayağı hücreleri ve dış saç hücrelerinin üç satır tek satır ile esasen tamamlandı . Koklear kanal ilk olarak E17 ile dif tüm dışarı büyümeye başlar E11 dan yayılan bir süre içindeferent hücre kaderi kararları ve desenlendirme saç hücreleri ve destek hücreleri normal bir tamamlayıcısı olan bir çarpıcı hücresel desen oluşturmak için gelişmekte olan epitel içinde ortaya çıkar. Saç hücreleri ve / veya destek hücrelerinin kaybı işitme önde gelen nedenidir. Bu hücre tipleri yalnızca embriyonik gelişim sırasında oldukça kompakt bir dönemde üretilen bu yana, rejeneratif stratejileri içine önemli fikir gitmelidir bu hücre tiplerinin her belirtmek moleküler ve genetik yollar anlamak önemlidir.
Koklear kültürleme ve elektroporasyon teknikleri gelişen farenin içinde gen ekspresyonunu değiştirmek için geliştirilmiştir. Bu videoda, birincil eksplantlar ve Corti kültürlü embriyonik fare organ haline gen aktarımı için bir elektroporasyon tekniği üretilmesi için teknikleri kültürleme göstermiştir. Bu şekilde hazırlanan primer eksplantlan, in vitro olarak 7-10 gün boyunca muhafaza edilebilir. Koklear eksplantlar can böyle kaderi şartname, bağlılık, farklılaşma ve desenlendirme gibi gelişimsel süreçleri düzenleyen mekanizmaları anlamak için bize sağlayacak farmakolojik yaklaşımlarla gen ifadesini işlemek için kullanılır. Ayrıca, bu yöntem E12 geçmiş hayatta olmayan mutant embriyonik farelerin gelişim fenotip analizi kolaylaştırır.
Kare dalga elektroporasyon aracılı gen transferi prosedürü kendi kaderini ex vivo olarak görselleştirmek için duyusal saç hücreleri, destek hücreleri ve GER ve LER bölgeleri içindeki hücrelerde gen ifadesinin işlemek için bir mekanizma sağlar. Bu prosedürü kullanarak, azaltan veya ektopik bir başka doğal tipte arka prosensory hücreler, saç hücreleri ve / veya destek hücrelerin spesifik genleri ifade ve kaderi özellikleri ve farklılaşması üzerinde spesifik etkileri analiz edilebilir. Bu gelişmekte olan koklea içinde belirli gen fonksiyonlarını anlamak için bize sağlayacaktır. Örneğin, gösterildiği gibi, Şekil 4, GER veya ler içinde hücrelerde Atoh1 2,4 veya NeuroD1 8 zorla ifade sırasıyla dış saç hücreleri ve nöron oluşmasına yol açar. Ayrıca, bu teknik birden aday genler 6,7 electroporate ve duyusal saç hücresi ve destekleyici hücre oluşumu, farklılaşması ve örgüt üzerindeki etkisini incelemek için izin verir. adenoviral vektörler içeren gen transferi tekniği geniş ifadeyi sunar ve başarılı iç kulak 15,16 kullanılmıştır. Ancak, bu teknik üretmek ve çoğu zaman alıcıdır virüsleri arındırmak için beceri bağlıdır.
Cochear kültürleri gibi erken E12, E12.5 daha küçük koklear eksplant elektroporasyon gibi tespit edilebilir, ancak / E13 analizi için hantal hale dokuya hasar görmesine neden olur. Buna ek olarak, ifade vektörünün hızlandırıcı hücre tipleri koklear du içinde transfekte olduğunu tespit kullanılanct. Örneğin ekspresyon vektörleri içeren insan sitomegalovirüs promoteri, Kollikers 'organı sağlam transfeksiyon elde edilir ise duyu epitel içinde hücreler içinde transfeksiyonuyla yüksek etkinlik CMV erken güçlendirici / tavuk beta aktin promotörü sonuçlanır. Embriyonik koklear eksplant elektroporasyon sırasında karşılaşılan ortak sorunlar, aşırı hücre ölümü ve / veya doku ve zayıf transfeksiyon verimliliği hasar vardır. Elektrotlar ve DNA konsantrasyonu uygun boşluklar en az hasar ve daha yüksek transfeksiyon verimi elde edilmesinde önemli bir rol oynar. Özetle, bu teknikler kazanç veya fonksiyon stratejileri ve farmakolojik manipülasyonlar kaybı yoluyla gen ifadesini işlemek ve büyük ölçüde desenleme ve hücre kaderi kararlarını etkileyen sinyaller diseksiyon yardımcı yeteneğimizi geliştirir.
Açıklamalar
No conflicts of interest declared.
Teşekkürler
We would like to acknowledge Dr. Bradley Schulte for comments on this protocol. This work was supported by National Institutes of Health grant R00 (5R00DC010220). This project was performed in a renovated laboratory space supported by Grant C06RR014516.
Malzemeler
| Name | Company | Catalog Number | Comments |
| HBSS | Gibco | 14065-056 | |
| HEPES | Gibco | 15630-080 | |
| Dulbecco’s Modified Medium | Gibco | 12430-054 | |
| Fetal bovine serum | Gibco | 10082 | |
| N-2 Supplement (100x) | Gibco | 17502-048 | |
| Ciprofloxacin hydrochloride | Cellgro | 61-277-RF | |
| Glass Dish 60 mm | Kimble Chase | 23062-6015/23064-6015 | |
| Glass Dish 100 mm | Kimble Chase | 23064-10015/23062-10015 | |
| Minutien pins | Fine Science Tools | 26002-15 | |
| Dumont #5 forceps | Fine Science Tools | 11251-10 | |
| Pulse generator | Protech International Inc | CUY21Vivo-SQ | |
| Glass bottom culture dishes | MatTek | P35G-0-10-C | |
| Matrigel matrix | BD Biosciences | 356237 | |
| Culture dish, 60 x 15 mm | Becton Dickinson | 353037 | |
| Tissue culture dishes | Greiner Bio-one | 639160 | |
| Phosphate buffered saline | Gibco | 10010-023 | |
| OS-30 | Dow Corning | 4021768 | |
| Fluoromount | Southern Biotech | 0100-01 | |
| Conical tubes, 15 ml | Greiner Bio-one | 188261 | |
| Myosin 6 | Proteus Biosciences Inc | 25-6791 | |
| Myosin 7a | Proteus Biosciences Inc | 25-6790 | |
| TuJ1 | Sigma | T2200 |
Referanslar
- Sobkowicz, H. M., Bereman, B., Rose, J. E. Organotypic development of the organ of Corti in culture. J Neurocytol. 4 (5), 543-572 (1975).
- Zheng, J. L., Gao, W. Q. Overexpression of Math1 induces robust production of extra hair cells in postnatal rat inner ears. Nat Neurosci. 3 (6), 580-586 (2000).
- Zheng, J. L., Shou, J., Guillemot, F., Kageyama, R., Gao, W. Q. Hes1 is a negative regulator of inner ear hair cell differentiation. Development. 127 (21), 4551-4560 (2000).
- Woods, C., Montcouquiol, M., Kelley, M. W. Math1 regulates development of the sensory epithelium in the mammalian cochlea. Nat Neurosci. 7 (12), 1310-1318 (2004).
- Jones, J. M., Montcouquiol, M., Dabdoub, A., Woods, C., Kelley, M. W. Inhibitors of differentiation and DNA binding (Ids) regulate Math1 and hair cell formation during the development of the organ of Corti. J Neurosci. 26 (2), 550-558 (2006).
- Dabdoub, A., et al. Sox2 signaling in prosensory domain specification and subsequent hair cell differentiation in the developing cochlea. Proc. Natl. Acad. Sci. U.S.A. 105 (47), 18396-18401 (2008).
- Doetzlhofer, A., Basch, M. L., Ohyama, T., Gessler, M., Groves, A. K., Segil, N. Hey2 regulation by FGF provides a Notch-independent mechanism of maintaining pillar cell fate in the organ of Corti. Dev Cell. 16 (1), 58-69 (2009).
- Puligilla, C., Dabdoub, A., Brenowitz, S. D., Kelley, M. W. Sox2 induces neuronal formation in the developing cochlea. J Neurosci. 20 (2), 714-722 (2010).
- Kaufman, M. H. . The Atlas of Mouse Development. , (1995).
- Sher, A. E. The embryonic and postnatal development of the inner ear of the mouse. Acta Otolaryngol Suppl. 285, 1-77 (1971).
- Torres, M., Giraldez, F. The development of the vertebrate inner ear. Mech Dev. 71 (1-2), 5-21 (1998).
- Brown, S. T., Martin, K., Groves, A. K. Molecular basis of inner ear induction. Curr Top Dev Biol. 57, 115-119 (2003).
- Puligilla, C., Kelley, M. W. Building the world’s best hearing aid; regulation of cell fate in the cochlea. Curr Opin Genet Dev. 19 (4), 368-373 (2009).
- Wu, D. K., Kelley, M. W. Molecular mechanisms of inner ear development. Cold Spring Harb Perspect Biol. 4 (8), a008409 (2012).
- Holt, J. R. Viral-mediated gene transfer to study the molecular physiology of the mammalian inner ear. Audiol Neurootol. 7 (3), 157-160 (2002).
- Stone, I. M., Lurie, D. I., Kelley, M. W., Poulsen, D. J. Adeno-associated virus-mediated gene transfer to hair cells and support cells of the murine cochlea. Mol Ther. 11 (6), 843-848 (2005).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır